En la actualidad se considera que el consumo de carne y productos cárnicos es excesivo y predisponente hacia las patologías más prevalentes Por ello, la obtención de cárnicos con una composición más “saludable” e incluso conteniendo ingredientes bioactivos que los conviertan en funcionales, adquiere relevancia en la salud. Se revisan aspectos generales sobre concepto, métodos de obtención y significación en la salud de los alimentos funcionales. El diseño de un producto cárnico funcional permite modificar la composición nutricional de los cárnicos convencionales y asegurarles una mayor vida útil y estabilidad oxidativa, así como contribuir en los consumidores a mejorar una o varias funciones corporales y reducir el riego de enfermedades degenerativas. Se discuten las publicaciones sobre cárnicos funcionales del grupo AFUSAN y de otros investigadores obtenidos a partir de la incorporación a las matrices cárnicas de alimentos completos como nueces o algas, así como de ingredientes de los que existe evidencia científica sobre su papel en la salud: glucomananos, espirulina, hidroxitirosol, aceite de chia, silicio, triglicéridos de diseño con alta proporción de ácidos grasos poliinsaturados ω-3, polifenoles procedentes de la pulpa de algarrobo. Los estudios se han realizados en humanos con riesgo cardiovascular elevado (p. ej. sobrepeso/obesidad, dislipemia, hipertensión, consumo de tabaco) y en modelos murinos (ratas Wistar o Zucker fa/fa) en los que se indujo hipercolesterolemia, hígado graso no alcohólico, obesidad, o Diabetes Mellitus tipo 2. Aunque cada ingrediente funcional parece inducir cambios específicos, puede señalarse que en muchos casos estos alimentos funcionales respecto a los convencionales son capaces de ejercer en modelos murinos efectos pleitrópicos, mejorando el perfil lipoproteico, reduciendo, entre otros aspectos, el estrés oxidativo y la inflamación. En humanos es de destacar resultados relevantes sobre la lipemia, trombogénesis y el estrés oxidativo. La utilización de un extracto de algarrobo como ingrediente funcional de reestructurados cárnicos ejerce efectos plurales en modelos de Diabetes tipo 2 en diferentes estadios de la enfermedad, particularmente en hígado y colon, mejorando en este último órgano, el estatus antioxidante, la integridad de la barrera intestinal y la pluralidad de la microbiota. Estos resultados sugieren los beneficios de sustituir carne y preparados cárnicos convencionales por productos funcionales, que permitan asegurar el aporte de algunos nutrientes de la matriz cárnica y eliminar aquellos que impliquen riesgo para la salud. El trabajo se última planteando líneas futuras de actuación en el marco de una dieta plural, funcional y de precisión.
Palabras clave: cárnicos funcionales; vida útil; modificaciones oxidativa; efectos funcionales; humanos; modelos experimentales; obesidad; hígado graso no alcohólico; diabetes tipo 2
ABSTRACT:
At present, it is considered that the consumption of meat and meat products is excessive and predisposes towards the most prevalent pathologies. Therefore, obtaining meat products with a “healthier” composition and even containing bioactive ingredients that make them functional, acquires relevance in health. General aspects about concept, obtaining methods and current significance in health of functional foods are given. The design of a functional meat product makes it possible to modify the nutritional composition of conventional meat products and ensure a longer shelf life and oxidative stability, as well as helping consumers to improve one or more bodily functions and/or to decrease the risk of suffering degenerative diseases. The publications on functional meat from the AFUSAN group and from other researchers related to the incorporation of whole foods such as nuts or algae into meat matrices, as well as different ingredients for which there is scientific evidence on their role. in health: glucomannans, spirulina, hydroxytyrosol, chia oil, silicon, designer triglycerides enriched in ω-3 polyunsaturated fatty acids, polyphenols from carob pulp. Studies have been conducted in humans with high cardiovascular risk (e.g. overweight/obesity, dyslipidemia, hypertension, tobacco use) and in murine models (Wistar or Zucker fa/fa rats) in which hypercholesterolemia, fatty liver, obesity, or Type 2 Diabetes Mellitus was induced. Although each functional ingredient seems to induce specific changes, it can be pointed out that in many cases these functional foods, compared to conventional ones, are capable of exerting pleiotropic effects in murine models, improving the lipoprotein profile, reducing, among other aspects, oxidative stress and inflammation. In humans, relevant results on lipemia, thrombogenesis and oxidative stress should be highlighted. The use of a carob extract as a functional ingredient of restructured meat exerts multiple effects in models of Type 2 Diabetes at different stages of the disease, particularly in liver and colon, improving in this last organ, the antioxidant status, the integrity of the intestinal barrier and the microbiota plurality. These results suggest the benefits of consuming meat and conventional meat preparations for functional products, which ensure the supply of some nutrients via the meat matrix and eliminate those that imply health risks. The work ends by proposing future lines of action within the framework of a plural, functional and precision diet.
Keywords: functional meats; meat shelf life; oxidative modifications functional effects; human; experimental models; obesity; non-alcohlic fatty liver disease; type 2 Diabetes
1. INTRODUCCIÓN
En las últimas décadas ha tenido lugar en el mundo, y en particular en aquellos países con culturas gastronómicas bien establecidas y culturalmente aceptadas, la pérdida de hábitos culinarios y alimentarios tradicionales. Esta transición nutricional se ha acompañado de una transición epidemiológica con aumento marcado de enfermedades crónicas no transmisibles entre las que destacan la aparición en la población de un incremento significativo de sobrepeso y obesidad y de enfermedades relacionadas, con las implicaciones que conllevan sobre la Salud Pública (1-4). Especial importancia presenta este aspecto en el campo de la obesidad infantil entre los que destacan México, en el Continente de América del Norte, y España, entre los países mediterráneos (1, 3).
Este cambio ha estado muy influenciado por la globalización creciente a nivel mundial, que ha inducido fuertes modificaciones en los hábitos de consumo de la población, con un importante incremento del número de comidas realizadas fuera de casa, la incorporación de la mujer al trabajo, la reducción del tiempo disponible y empleado para cocinar y, en particular, para elaborar platos “de cuchara” tan tradicionales de nuestra cultura culinaria. Por último, hay que señalar que también ha tenido lugar un importante aumento del consumo de productos industriales, de embutidos en las cenas, y de alimentos típicos y específicos consumidos en los fines de semana (2). Esta transición nutricional también ha estado marcada por la facilidad de incorporar a productos industriales, grasas culinarias de baratas y de baja calidad; sin olvidar que la grasa, junto con la sal y el azúcar son los tres componentes dietéticos que más incrementan la palatabilidad y, por tanto, la aceptabilidad y consumo de los alimentos (2).
Es por ello por lo que, en la actualidad, los Organismos y Sociedades Científicas se esfuerzan en recuperar aspectos perdidos de los hábitos nutricionales, insistiendo particularmente en la recuperación de la dieta tradicional y el incremento de la actividad física (1-5). No obstante, los cambios ocurridos en la forma de comer y la oferta de sistemas que incitan a la inactividad se han hecho casi permanentes, por lo que se requieren otras medidas que ayuden a paliar la reducción producida en ciertos compuestos clave de nuestra dieta y que garanticen una alimentación balanceada y más individualizada y optimizada con la finalidad de frenar, la tendencia creciente observada en la incidencia y prevalencia de enfermedades degenerativas y en particular de obesidad y sus comorbilidades relacionadas. La OMS (5) mostró su enorme preocupación al respecto creando el Plan de acción mundial para la prevención y el control de las enfermedades no transmisibles 2013-2020, que se planteaba la reducción relativa del 25% en la mortalidad prematura a causa de dichas enfermedades para 2025 y una detención del aumento de la obesidad mundial para coincidir con las tasas de 2010.
Desafortunadamente, y aunque ha sido una situación transitoria, es destacable que en España y en otros países se ha producido, debido al confinamiento por la pandemia COVID-19, incrementos en el peso de la población debidos a cambios en las pautas de consumo y en la actividad física. Así, particularmente durante la primera “ola”, se produjeron cambios en el consumo de alimentos en los hogares con incremento de la cantidad de todos los grupos de alimentos, pero en especial de bebidas alcohólicas, huevos, aceites y grasas, legumbres, azúcar y dulces (6,7), que ha supuesto un incremento medio de consumo de energía durante el periodo de marzo a mayo de 545 kcal/persona/día respecto a los mismos meses del año 2019 (6).
2. CONCEPTO DE ALIMENTOS FUNCIONALES
En las culturas orientales, principalmente en la china y japonesa, existe una larga tradición de atribuir propiedades curativas y terapéuticas a los alimentos (8). Los términos “alimento medicinal” y “alimento especial” fueron frecuentemente utilizados en las prácticas médicas de la dinastía Este Han (siglo I y II a. C.) y de la dinastía Song (circa año 1000 d. C.). Hipócrates, en el Siglo V a.C., ya recomendaba que “el alimento sea tu medicina y la medicina tu alimento” iniciando los primeros pasos de una nueva filosofía relacionada con la alimentación y los hábitos de vida. De hecho, la medicina tradicional considera que promover la salud y evitar las enfermedades a través de prácticas dietéticas adecuadas, es más importante que tratar al propio enfermo (9).
Desde hace menos de una centuria, la nutrición ha ido evolucionado hasta la actualidad, pasando por diferentes etapas en las que se ha ido garantizando una Nutrición clásica que pretendía la reducción de las enfermedades producidas por carencias nutricionales mediante el establecimiento de las ingestas recomendadas o RDA, pasando por una Nutrición segura y preventiva, con la aparición de listas de aditivos permitidos y los Codex Alimentarios. Posteriormente, se planteó la conveniencia de una Nutrición óptima, dado el incremento en la prevalencia de enfermedades degenerativas, basada en las DRI (del inglés, dietary recommended intakes) o ingestas dietéticas de referencia, que abarca a su vez la implementación de ingestas adecuadas, ingestas máximas tolerables, guías nutricionales y objetivos nutricionales. En la actualidad, la nutrición se ha convertido en Nutrición funcional, intentando explotar al máximo el potencial positivo-preventivo de los alimentos, en el marco de una nutrición balanceada, completa y preventiva en la que lejos de prohibir ciertos alimentos, se induzca la mejora en su producción y la incorporación de ingredientes que aporten funcionalidad y ayuden a reducir el riesgo de sufrir enfermedades crónico-degenerativas. Esta optimización de la dieta pasa por respetar, en la medida de lo posible, la individualización y la optimización de la misma, considerando la posibilidad de una alimentación funcional y las peculiaridades individuales de la genética, epigenética, y metagenética. Esto nos lleva en último lugar al concepto actual de la Nutrición de Precisión (10) (Figura 1).
Figura 1. Evolución de la Ciencia de la Nutrición en las últimas décadas. Modificado de Celada y Sánchez-Muniz (10).
El interés actual por los alimentos funcionales se inició en Japón, entre otras causas por el incremento de alergias a los alimentos, la incidencia de cáncer de colon en la población nipona y el rápido aumento de los costos del sistema de salud que tuvieron lugar después de la II Guerra Mundial. En 1984, bajo los auspicios del Ministerio Japonés de Educación, Ciencia y Cultura, surge el primer Programa Nacional sobre Alimentos Funcionales. En 1990, como resultado de un informe del Comité de Estudios de los Alimentos Funcionales, el ministerio Japonés de Salud y Bienestar emitió un decreto por el cual se aprobaron los “Alimentos de Uso Específico para la Salud”. A partir de ahí surgió una nueva gama de alimentos que se acogieron bajo la denominación de FOSHU (Foods for Specific Health Use) (9,10).
Los FOSHU o Alimentos de Uso Específico para la Salud, en español, son “alimentos que tienen un impacto positivo en la salud, el rendimiento físico, o el estado de ánimo, además de su propio valor nutritivo”. Una vez autorizados podrán incluir en el etiquetado una alegación o declaración que exponga que de su ingesta se puede esperar un beneficio sobre su salud. Las autoridades japonesas añaden que los alimentos FOSHU deben cumplir tres condiciones: a) Contener ingredientes de origen natural y en ningún caso se presentarán bajo una forma farmacéutica (comprimidos, cápsulas o polvos); b) Ser consumidos como parte de la dieta diaria y c) Su ingesta implica una mejora o regularización de un proceso o mecanismo biológico concreto para así prevenir o controlar una enfermedad específica (9).
El interés por los alimentos funcionales en Europa y Estados Unidos es algo más reciente que en Japón. A partir del incremento de evidencia científica sobre los componentes minoritarios de los alimentos y el aumento de la prevalencia de enfermedades degenerativas, tuvo lugar el inicio de la obtención y comercialización de de los alimentos funcionales. No obstante, no es hasta 1994 cuando la American Dietetic Association (ADA) apoya por primera vez el estudio y existencia de alimentos funcionales. En 1995 se celebró la Primera Conferencia Internacional sobre perspectivas Oriente-Occidente de los alimentos funcionales, cuya misión fue recoger la información disponible y unificar perspectivas del mundo Occidental y Oriental sobre este tema (8). Posteriormente, organismos como el Parlamento Europeo, mostraron una amplia preocupación sobre el asesoramiento científico en términos de seguridad y la necesidad de una mayor interacción entre este asesoramiento y el interés de los consumidores. En el año 1998 se elaboró un documento de consenso sobre conceptos científicos en relación con los alimentos funcionales. En él participó el Comité de Expertos de la Functional Food Science Europe (FUFOSE) con la asesoría del International Life Science Institute Europe (ILSI Europe). En ese documento se define a un alimento funcional como “El alimento que contiene uno o más componentes, nutrientes o no nutrientes, con efecto selectivo sobre una o varias funciones del organismo, con efecto fisiológico por encima de su valor nutricional, y cuyos efectos positivos justifican que pueda reivindicarse su carácter funcional o incluso saludable” (11). En la actualidad, desde el 20 de diciembre de 2006, existe en la Europa Comunitaria una reglamentación en la que se recogen las normas y criterios que deben seguir y reunir un alimento para conseguir la denominación de Funcional y poder incluir en su etiquetado declaraciones de salud (12).
Actualmente en los Estados Unidos de Norteamérica no existe una definición universalmente aceptada para Alimentos Funcionales. No obstante, un alimento funcional es definido comúnmente como un alimento que provee beneficios más allá de la nutrición básica proporcionada por dicho alimento, ejerciendo el Bureau Federal Americano (FDA) como autoridad indiscutible para la aceptación legal de este tipo de alimentos (13).
3. TIPOS DE ALIMENTOS FUNCIONALES
Un alimento funcional debe ser similar en apariencia a un alimento convencional y sus efectos fisiológicos beneficiosos sobre la salud han de estar demostrados. Por tanto, un alimento funcional puede ser natural o transformado mediante tecnología o biotecnología, pero siempre deben existir evidencias científicas que avalen su efecto funcional sobre sujetos con unas determinadas características patológicas o previas que les predispongan a padecer una enfermedad. Es importante insistir en que la constatación científica de dichos efectos beneficiosos no solo ha de basarse en resultados estadísticamente significativos, sino que ha de poseer relevancia desde el punto de vista clínico.
Bajo ese punto de vista los alimentos funcionales se clasifican en:
Funcionales “per natura” (p.ej. agua, aceite de oliva virgen o virgen extra, pescado graso, nueces). Funcionales para adaptar a alimentación especial. En ellos se encuentran:
- b1) Alimentos para alimentación enteral y parenteral
- b2) Alimentos para alergias e intolerancias
- b3) Por modificación de la textura (p.ej. beikost).
Por modificaciones mayores: composición, funcionalidad. En ellos se encuentran:
- c1) Alimentos modificados y “mejorados”
- c2) Complementos nutricionales
- c3) Dietéticos
- c4) “Novel Foods”.
La gran mayoría de alimentos funcionales se encuentra dentro del apartado “c1” de la clasificación anterior; no obstante, la información muchas veces es dispar y no muy específica a la hora de incluir como alimentos funcionales a los nutracéuticos, complementos y suplementos o a ciertos alimentos “nuevos” (p. ej. alimentos transgénicos, alimentos basados en alimentos no convencionales).
En los Estados Unidos de Norteamérica, los alimentos funcionales se pueden clasificar en dos amplias categorías. La primera consiste en alimentos funcionales que naturalmente contienen un componente que ofrece beneficios adicionales al consumidor; la segunda en alimentos procesados en el que el componente se añade al alimento para darle beneficios adicionales (13).
También los alimentos funcionales pueden clasificarse atendiendo a sus efectos:
- Mejorar una o varias funciones corporales
- Reducir el riesgo de padecer enfermedades degenerativas
- Ambas cosas.
Una tercera clasificación surge al catalogarlos dependiendo de las funciones específicas y/o generales para las que se diseñan, las cuales se resumen en siete grandes grupos de alimentos funcionales definidos por FUFOSE y comentados por Aranceta Bartrina (14).
Con efectos sobre funciones conductuales y psicológicas; b) Que pueden mejorar las funciones gastrointestinales; c) Que optimizan el crecimiento, el desarrollo y la maduración; d) Que regulan el metabolismo de los macronutrientes y la homeostasis corporal; e) Que pueden actuar mejorando la defensa contra el estrés oxidativo; f) Que pueden actuar disminuyendo el riesgo de enfermedades cardio- y cerebro-vasculares; g) Que mejoran el rendimiento y el buen estado físico.
No obstante, debemos señalar que existen claros solapamientos entre algunas funciones clasificadas en grupos diferentes (p. ej. propiedades cardiovasculares, regulación del metabolismo, defensa contra el estrés oxidativo), por lo que en algunos casos puede decirse que algunos alimentos funcionales, o los ingredientes que incorporan, pueden tener multifunción y ser válidos para mejorar o normalizar diferentes aspectos de nuestra economía corporal.
4. OBTENCIÓN DE ALIMENTOS FUNCIONALES
Entre los procesos más habituales parara elaborar alimentos funcionales se encuentran: a) Selección genética para obtención de animales o vegetales con una composición potencialmente más adecuada para la salud (p.ej. reducción del contenido de grasa en la carne de consumo procedente de diferentes animales, modificación de una ruta metabólica para asegurar la presencia elevada o disminuida de uno o varios compuestos, b) alimentación animal con dieta con un contenido mejorado de alimentos que aseguren salud y bienestar animal y (p.ej. con aporte en su dieta de un contenido óptimo de vitaminas, que asegura mayor retención de vitaminas por los tejidos animales, alimentos OVN (de Optimum vitamin nutrition); y c) reformulación de alimentos (9,10,15)
La industria actual trabaja de forma incansable para poder enfrentarse al reto de poder ofrecer alimentos más saludables mediante la reformulación. Esta estrategia es mucho más rápida que la intervención en la producción animal e incide directamente en el alimento que va a ser consumido. La reformulación de alimentos consiste en alterar la composición de los mismos optimizando el contenido de los componentes de los que existe evidencia científica de sus beneficios para la salud y/o limitando el de aquellos que puedan tener una influencia negativa para la misma. De una manera esquemática (Figura 2) se podría resumir que la obtención de un alimento funcional (10,15) parte de un alimento tradicional que es modificado mediante los siguientes posibles procedimientos:
- Eliminar algún componente al que se atribuyen efectos fisiológicos adversos
- Aumentar la cantidad de un componente con efectos fisiológicos beneficiosos
- Adicionar un componente con efectos fisiológicos positivos
- Sustituir parcialmente un ingrediente con efectos adversos por otro con efectos beneficiosos
- Aumentar la biodisponibilidad de uno o más de sus componentes para mejorar la asimilación de un componente beneficioso
- Mezcla de algunos de los puntos anteriores.
A estas posibilidades derivadas de la modificación o reformulación de los alimentos, hay que añadir las ya discutidas en los apartados anteriores, en las que se incrementan o reducen algunos componentes de su composición, gracias a condiciones especiales de cultivo, crianza o procedimientos biotecnológicos.
Figura 2. Fases o pasos mediante los cuales puede obtenerse un alimento funcional a partir de una alimento tradicional o convencional. Modificado de Celada y Sánchez-Muniz (10).
Se ha de tener en cuenta que un alimento funcional no es siempre un producto nuevo. Es necesario, también, diferenciar entre un alimento enriquecido y un alimento funcional. En España, la categoría de los suplementos alimentarios o dietéticos se considera más próxima a la farmacología que a la nutrición y no se incluye dentro de los alimentos funcionales. Sin embargo, hay que considerar que estos productos se venden en muchas ocasiones fuera de las farmacias, con lo que adquieren una categoría intermedia, no siendo reconocidos como medicamentos.
5. CONSUMO ACTUAL DE CARNE Y DERIVADOS. RELACIÓN CON LA MORTALIDAD TOTAL Y ATRIBUIBLE A ENFERMEDADES CRÓNICAS NO TRANSMISIBLES
Los patrones globales de hábitos alimentarios revelan que tanto la producción como el consumo promedio per cápita de carne a nivel mundial están aumentando notablemente (58% mayor consumo en 2020 que en 1970), siendo más elevado en los países industrializados (16), y que permiten establecer una relación positiva entre el nivel de ingresos y el consumo de proteína animal (16-18). Utilizando datos promedio del consumo de carne a nivel mundial, se estima que cada persona consume alrededor de 120 g /día (19), de los cuales un tercio es carne de cerdo y aves de corral, un quinto es carne de res y el resto procede de otras fuentes, como carne de oveja o cabra (19). Este incremento viene dado en su mayoría por el mayor consumo observado en países con ingresos medios, especialmente en China y Asia Oriental; aunque simultáneamente parece existir una estabilización o incluso una ligera disminución del consumo en los países de con altos ingresos (16,19).
En España el consumo total es aproximadamente de 147 g/por cabeza y día, correspondiendo 107,2 g al de carnes frescas, 35,4 g al de transformadas y 3,2 g al de congeladas, con un consumo dispar entre comunidades autónomas en lo referente at tipo y procedencia de la carne y sus productos (20).
Se define por carne la parte comestible de los músculos de bóvidos, óvidos, suidos, cápridos, équidos y camélidos, sanos, sacrificados en condiciones higiénicas. Por extensión se incluyen también animales de corral, cazas de pelo y pluma y mamíferos marinos. Dentro del apartado carne se han de considerar los despojos que según el Reglamento del Parlamento Europeo de 2004 son las partes comestibles que se extraen de los animales y que no están consideradas dentro del término canal (21).
La carne está constituida mayoritariamente por agua (60-80%), proteínas (16-25%) (aproximadamente el 40% de sus aminoácidos son esenciales) y grasas (1-30%). Su contenido en hidratos de carbono es casi inexistente, debido a que el glucógeno de los músculos desaparece casi por completo durante el proceso de maduración. En la carne se encuentran pequeñas cantidades de sustancias nitrogenadas no proteicas (aminoácidos libres, péptidos, creatina, nucleótidos, etc.) y ácido láctico. También hay cantidades relativamente elevadas de algunas vitaminas (tiamina, niacina, retinol y B6 y B12) y pequeñas cantidades de vitamina D. Entre los minerales destacan el contenido de hierro hemo y de zinc de alta biodisponibilidad, los niveles de fósforo, selenio, sodio, potasio y cobalto (15,18,22). La composición de la carne varía en función del tipo de alimentación del animal, edad, zona de la canal, etc., de ahí que cualquier generalización puede ser errónea (20). Respecto a los productos cárnicos, la composición difiere dependiendo del tipo de producto, de los componentes que la integran y de las materias primas utilizadas en su elaboración. En general contienen más grasa y menos proteínas que la carne de consumo directo y su contenido mineral aumenta al adicionarle sales para su conservación y elaboración. La riqueza en ácido linoleico depende de la presencia de tocino de cerdo y, si se utilizan como ingrediente vísceras y despojos de bajo precio, se reduce el aporte de aminoácidos esenciales. El contenido vitamínico es dependiente de las materias primas utilizadas y del proceso de elaboración, reduciéndose por lixiviación en las salazones y en los productos cocidos. Los embutidos de carne de cerdo son más ricos en tiamina, mientras que las pastas de hígado lo son en retinol y vitamina A (22).
Con el nombre genérico de derivados cárnicos se designa a los productos alimenticios preparados total o parcialmente con carnes o despojos de las especies autorizadas (en España por el Código Alimentario) (21). La mezcla de estos ingredientes, elaborados mediante salazón, deshidratación, cocción o sus combinaciones da lugar a la aparición de nuevos productos más agradables a la vista y al paladar. Se clasifican en a) salazones, ahumados, adobados; b) tocinos; c) embutidos, charcutería y fiambres; d) extractos y caldos de carne, y e) tripas. La palabra embutido se aplica a todo producto preparado a base de carne y grasa picadas, en general de cerdo, mezcladas con condimentos y especias, cuya masa se introduce en tripas, naturales o artificiales (tubos extruidos de colágeno regenerados, materiales celulósicos o películas plásticas). En España se denominan “cocidos” cuando reciben tratamiento térmico, en oposición a todos los demás que se designan como “crudos” “frescos” o “curados”, según el tiempo de maduración–desecación que han recibido. Al margen de un posible tratamiento en secadero, en la mayoría de los países de la UE, se califica al producto cárnico curado al que ha recibido la acción de nitritos (19) (23).
La carne y los productos cárnicos, a pesar de ser una buena fuente de nutrientes, presentan ciertos componentes que en exceso se consideran perjudiciales para la salud, como los ácidos grasos saturados (AGS) y el colesterol y también el contenido de nitratos, nitritos, y nitrosaminas (22,24,25). De hecho, varias revisiones recientes han establecido una relación entre el consumo de carne roja y procesada y un mayor riesgo de ciertas enfermedades crónicas, principalmente enfermedades cardiovasculares (ECV), cáncer y diabetes mellitus tipo 2 (DMT2) (22,24-27). En particular y respecto al cáncer, entre los compuestos o componentes considerados como candidatos por haberse encontrado alguna posible relación epidemiológica con el cáncer, se encuentran los nitratos, los nitritos, las aminas heterocíclicas, los hidrocarburos policíclicos aromáticos, el contenido de hierro hemo y la insaturación. También se ha señalado, a la presencia o formación de ácido siálico de bacterias, a la formación de trimetilaminas por fermentación por la microbiota, y a la interacción con los ácidos biliares a nivel digestivo (15,22,24,28). No obstante, hay que tener presente que los estudios transversales que se realizan en un determinado momento no pueden relacionar causa y efecto por sí solos. Es decir, que haya correlación entre mortalidad y consumo de un alimento, no implica causalidad, ya que otros muchos factores de estilo de vida diferentes al consumo de carne roja pueden contribuir a este resultado (29).
Este hecho fue postulado por Hill hace 50 años, enumerando nueve tipos distintos de evidencias que podrían ayudar a reafirmar los resultados de los estudios observacionales; estos postulados siguen gozando de buena consideración. Los nueve tipos de evidencias incluyen: fuerza, que Hill creía que era, con mucho, la más importante, consistencia, especificidad, temporalidad, gradiente biológico, verosimilitud, coherencia, experimentación y analogía (30). Los postulados de Hill son aceptados y considerados tanto por aquellos que están a favor como por los que están en contra de utilizar solo los estudios observacionales para obtener conclusiones sobre la causalidad.
También se ha señalado que algunos componentes, como los oxisteroles y los nonenales, pueden originarse durante el almacenamiento y la cocción, así como durante la digestión y el metabolismo (28,31,32). Tras una comida a base de productos cárnicos ricos en lípidos y proteínas, se ha encontrado un aumento de la susceptibilidad al daño oxidativo corporal (24,27,31,33). Además, hay consenso que, tras el consumo de alimentos oxidados, tanto por animales como en humanos, se produce aumento de los compuestos de oxidación en el plasma [p.ej. malondialdehído (MDA), productos finales de glicosilación avanzada, 4-hidroxi-nonenal (4-HNE), oxisteroles o carbonilos proteicos] (28). También se ha definido que el estómago actúa como biorreactor a pH bajo y en presencia de oxígeno, aumentando la oxidación de lípidos y proteínas, con mayor formación de MDA e hidroperóxidos (28,32,33), junto con la oxidación de otros componentes como la vitamina E y los b-carotenos (34). Por otra parte, en el estómago, la mioglobina se desnaturaliza e hidroliza, liberando hierro que puede actuar como pro-oxidante (31). Tras la digestión, los lípidos oxidados son absorbidos, incluidos y transportados por los quilomicrones, aumentando el estrés oxidativo en diferentes tejidos y activando la respuesta inflamatoria (35). Por todo ello, se ha planteado la hipótesis de que las especies reactivas del oxígeno (ROS) y los lípidos oxidados generados durante la digestión también pueden contribuir a la oxidación de las proteínas de la carne y a sus efectos potencialmente negativos (31).
6. PRODUCTOS CÁRNICOS SALUDABLES Y FUNCIONALES. DISEÑO Y DESARROLLO
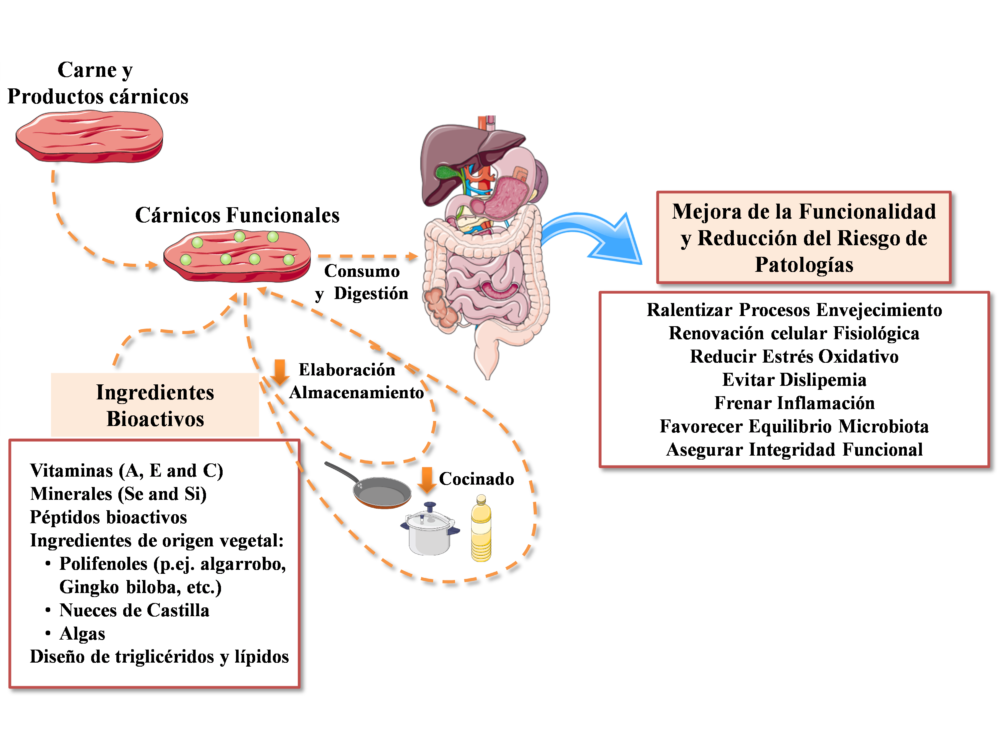
Como hemos comentado en el apartado “Obtención de Alimentos Funcionales” la reformulación de alimentos o productos cárnicos funcionales, es la forma más utilizada para eliminar, reducir, aumentar, agregar y/o reemplazar diferentes componentes bioactivos (9,15,18) (Figura 2). Por tanto, la amplia aceptación de los productos cárnicos por los consumidores y su “plasticidad tecnológica” como matriz para incorporar y vehiculizar componentes bioactivos, los convierte en una clara opción para el desarrollo de alimentos funcionales.
Teniendo en cuenta estas premisas, parece plausible diseñar carnes funcionales que puedan minimizar los procesos oxidativos en todas las fases posibles (Figura 3), desde su producción hasta las fases finales del metabolismo de sus ingredientes, así como influenciar positivamente sobre otros aspectos de la salud y contribuir a frenar el desarrollo de enfermedades degenerativas.
Figura 3. Esquema de integración. La carne y los productos cárnicos aparecen como matriz adecuada para incorporar ingredientes bioactivos o funcionales. Los ingredientes funcionales contribuyen a minimizar las alteraciones de los alimentos (organolépticas, oxidativas, lixiviación) durante su elaboración, almacenamiento, cocinado y digestión. Estos ingredientes, interaccionando o no con los de la matriz, ejercerían sus efectos nutricionales y de mejora de la funcionalidad reduciendo el riesgo de enfermedades degenerativas, cuya base es eminentemente oxidativa y relacionada con el envejecimiento. Modificada de Macho-González y col. (15).
No obstante debemos señalar que para su desarrollo, es necesario que se cumplan los siguientes aspectos esenciales: la selección y caracterización de componentes bioactivos, el diseño tecnológico, el desarrollo del alimento y la evaluación de factores que modifican su contenido/biodisponibilidad; y por último, y más importante, la evaluación del efecto funcional utilizando modelos in vitro e in vivo que proporcionen información sobre los mecanismos de acción, relación dosis-respuesta y efectos agudos y crónicos sobre diferentes aspectos fisiológicos que interviene en la salud (11,13-15,18).
7. PAPEL DE LOS CÁRNICOS FUNCIONALES PARA EJERCER EFECTOS SALUDABLES Y REDUCIR EL RIESGO DE SUFIR DE ENFERMEDADES CRÓNICAS EN LOS CONSUMIDORES
Desde un punto de vista práctico, las enfermedades se clasifican normalmente según su localización o por la presencia de mecanismos fisiológicos específicos alterados. Así pues, los alimentos funcionales o sus ingredientes también podrían clasificarse según sus mecanismos de acción y sus efectos específicos y/o sistémicos demostrados en estudios clínicos o preclínicos (15,36,37). La mayoría de las enfermedades crónicas no transmisibles prevalentes tienen un origen común basado en factores prooxidantes/inflamatorios (28, 37); sin embargo, hasta la fecha, la evidencia científica sobre los efectos antioxidantes y de otra índole inducidos por los productos cárnicos funcionales en modelos animales, es relativamente escasa, limitándose la información disponible a hígado y plasma, disponiéndose de mucha menos información sobre sus efectos a nivel del páncreas, cerebro, riñones, bazo, corazón, músculo esquelético, etc. Asimismo, en los seres humanos la evidencia sobre los efectos de los productos cárnicos funcionales se reduce al plasma, orina y heces, en los que se analizaron la mayoría de las veces marcadores rutinarios (colesterol, lipoproteínas, índice redox, actividades de enzimas antioxidantes en plasma, interleucinas) (15).
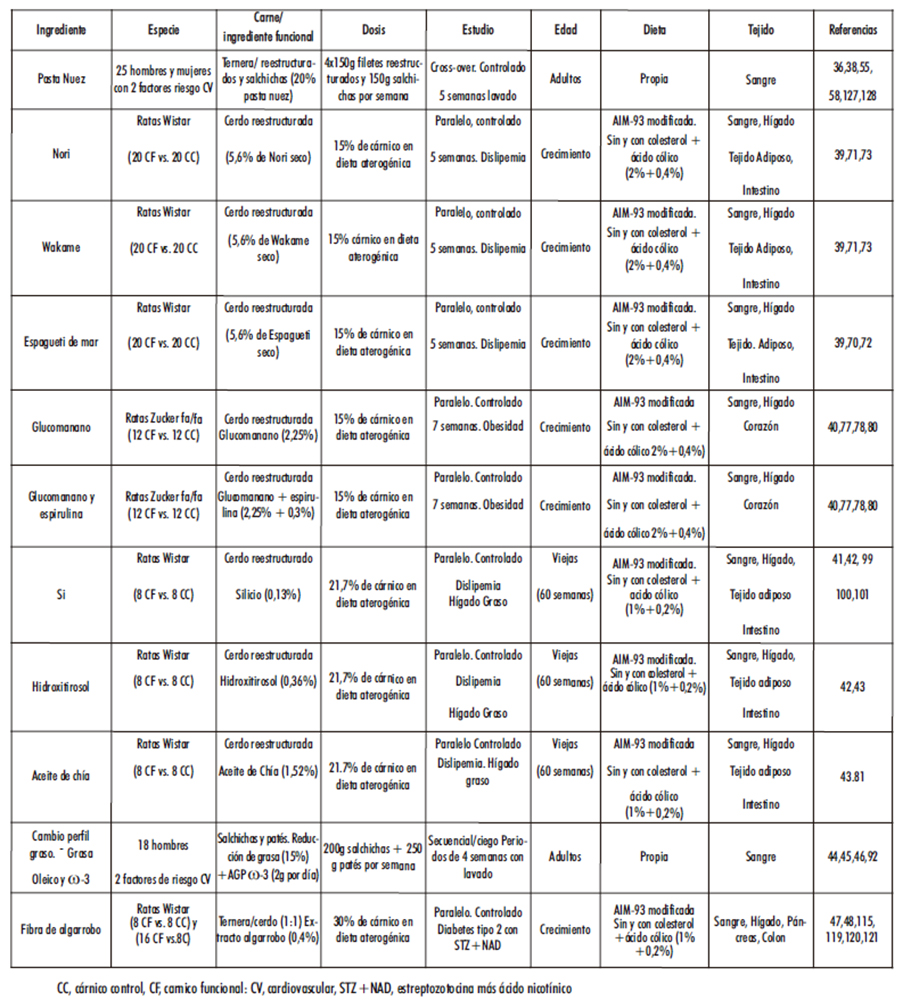
Nuestro grupo de investigación Nutrición y Salud Cardiovascular de la UCM, referencia #920536 que responde al acrónimo de AFUSAN, (de Alimentación, FUncional, SAlud y Nutrición), en colaboración con el Instituto de Ciencia y Tecnología de los Alimentos y Nutrición (ICTAN) del Consejo Superior de Investigaciones Científicas (CSIC) de España ha diseñado cárnicos funcionales a los que se han incorporado diferentes ingredientes funcionales como: nueces, algas, glucomanano, espirulina, silicio, hidroxitirosol, y aceite de chia (15,18,36,38-43). Más recientemente el grupo AFUSAN ha investigado en la incorporación a productos cárnicos de triglicéridos de diseño enriquecidos en ácido oleico y ácidos grasos poliinsaturados (AGP) ω-3 (44-46), así como de extractos de algarroba, rico en fibra insoluble y proantocianidinas y sus efectos sobre la salud (15,47,48) (Tabla 1).
Como puede observarse en la Tabla 1 los estudios se realizaron tanto en humanos con varios factores de riesgo cardiovascular (edad, sobrepeso/obesidad, colesterol, hipertensión, tabaquismo) como en animales de experimentación en los que se provocó hipercolesterolemia experimental, hígado graso no alcohólico o DMT2 en ratas Wistar en crecimiento o envejecidas o en modelos genéticamente predispuestos (ratas Zucker fa-fa) en las que se inducía obesidad y resistencia elevada a la insulina. En las siguientes secciones se expondrá de forma detallada los resultados más relevantes obtenidos por el grupo AFUSAN con diferentes tipos de cárnicos funcionales.
Tabla 1. Resumen del diseño, población objeto de estudio, tipo de cárnico, dosis edad, dieta y tejidos estudiados por el grupo AFUSAN.
7.1. Productos cárnicos conteniendo pasta de nuez
Las nueces (Juglans regia, L.), presentan algunas características diferenciales en su composición respecto a otros frutos secos. Así, son ricas en arginina (38,49,50) un aminoácido precursor del óxido nítrico con efecto vasodilatador antiinflamatorio endógeno e inhibidor de la agregación plaquetaria, lo que explica, al menos parcialmente, los efectos cardiovasculares protectores del consumo de este fruto seco (49-51). También las nueces contienen minerales antioxidantes como el magnesio, el selenio, el cobre y el zinc (38,50,51), cantidades notables de vitaminas antioxidantes (p. ej.,γ-tocoferol), polifenoles (p. ej., quercetina) y esteroles vegetales (p. ej. β-sitosterol) (38,51). Además, su contenido en ácido a-linolénico (AGP ω-3) es muy superior al de otros frutos secos. Este aspecto es importante, ya que los AGP ω-3 inducen una menor expresión y actividad de ciclooxigenasa-2 (COX-2) que sus homólogos los AGP ω-6, e incluso producen resolución de la inflamación a través de compuestos como las maresinas, resolvinas y neuroprotectinas (52).
A pesar de sus propiedades, el consumo de nueces en el mundo es reducido y casi se restringe su uso a repostería. Por tanto, para promover su consumo, y aprovechar sus propiedades saludables, las nueces podrían utilizarse como ingrediente funcional en alimentos de alto consumo (p. ej. la carne/los productos cárnicos). Esta adición convertiría a los productos cárnicos en más saludables (15,18,38). Debido a las diferencias específicas con respecto a otros frutos secos (50,51), las nueces se seleccionaron por el grupo AFUSAN para ser incluidas en la carne de ternera. Este enfoque permitió que sujetos con elevado riesgo cardiovascular consumieran, por un lado, algunos nutrientes o nutrimentos de los cárnicos como aminoácidos esenciales, hierro y zinc, junto con otros componentes y por otro, nutrientes aportados por las nueces como la fibra dietética, la arginina, los ácidos α-linolénico, γ-linolénico, y vitaminas como el ácido fólico (38,51). Además, como cualquier alimento funcional, los productos cárnicos que contienen pasta de nuez deben mantener las propiedades saludables del ingrediente incorporado después de su cocción o cocinado. A este respecto, señalaremos que al menos el 80% del ácido α-linolénico, y de los AGP totales permaneció en la carne enriquecida con pasta de nuez después de la fritura superficial con aceite de oliva (53). También los resultados con otros métodos culinarios señalan la estabilidad y viabilidad de este tipo de cárnicos (54).
Como se resume en la Tabla 1, se realizó un estudio cruzado aleatorizado y controlado con placebo, de cinco semanas de duración en hombres y mujeres con alto riesgo de ECV, para evaluar los efectos funcionales del consumo semanal de filetes reestructurados (4×150g) y salchichas (150g) que contenían un 20% de pasta de nuez. Los niveles de oxidación de las lipoproteínas de baja densidad (LDL), así como el colesterol transportado por las LDL (LDLcolesterol) disminuyeron tras el consumo de cárnicos con nuez respecto al de cárnicos convencionales, sugiriendo una reducción del riesgo cardiovascular (38). Además de los resultados obtenidos en las LDL, se observaron efectos interesantes sobre otros marcadores antioxidantes e inflamatorios, y sobre la concentración de tromboxanos y prostaciclinas. Así, la mejora de los niveles de estos eicosanoides (55) sugiere una reducción de la actividad de la COX, una enzima que durante su acción produce (ROS) (56). La ingesta de estos productos cárnicos cinco veces por semana aumentó las concentraciones de los enzimas antioxidantes catalasa (CAT), superóxido dismutasa (SOD), glutatión reducido (GSH) e índice redox dado por el cociente glutatión reducido/glutatión oxidado (GSH/GSSG), y redujo la concentración de lipoperóxidos (LPO) en comparación con la ingesta de los productos cárnicos de contenido graso reducido (36). Estos resultados son similares a los obtenidos por otros autores que demostraron que las nueces pueden reducir la oxidación sistémica (56) y el estrés oxidativo cerebral (57). Nuestros resultados también denotaron disminución en los marcadores de inflamación y quimiotaxis como leucotrienos de la serie 4, moléculas de adhesión vascular e intercelular (sVCAM e sICAM, respectivamente) (58). Esta intervención dietética de carne enriquecida con nueces aumentó la actividad de la enzima paraoxonasa (PON1) sin modificar los niveles de colesterol en las lipoproteínas de alta densidad (HDLcolesterol) (36). Todos estos resultados sugieren ampliamente que la mejora del estado antioxidante en los participantes se debió al consumo de carne enriquecida con nueces.
7.2. Productos cárnicos funcionales conteniendo macroalgas y microalgas
En la actualidad existe abundante evidencia de que diferentes componentes bioactivos de las algas, tales como la fibra dietética, las proteínas, los macro y microminerales (p. ej. sodio, calcio, potasio, hierro, magnesio, selenio y manganeso), las vitaminas (C y del grupo B), los AGP ω-3, los polifenoles, los carotenoides o los tocoferoles pueden ayudar a conseguir mayor estabilidad y a mejorar ciertas propiedades organolépticas de los productos cárnicos (39). También estos componentes ejercen propiedades funcionales en los consumidores (39,59). Sin embargo, debe evitarse cualquier generalización sobre las propiedades de las algas, ya que su composición difiere de unas algas a otras y depende, entre otros factores, de la especie, el hábitat y el estado de maduración (60-62). Además, las algas pueden contener elevadas cantidades de elementos traza tóxicos (p. ej. arsénico) que bloquean parcialmente las propiedades antioxidantes definidas en las algas, al actuar negativamente sobre el sistema del glutatión (63). También es importante diferenciar entre algas enteras frescas, desecadas, y sus extractos, ya que el proceso de extracción de algunos compuestos bioactivos puede determinar la posterior actividad antioxidante, explicando, al menos en parte, la falta de reproducibilidad de resultados entre los estudios (39,64). Nuestro grupo AFUSAN en colaboración con el ICTAN del CSIC de España, ha elaborado diferentes tipos de carne enriquecida con “espagueti de mar” (Himanthalia elongata), “wakame” (Undaria pinnatifida) o “nori” (Porphyra umbilicalis) mediante un sistema de gel/emulsión (39,65). Las publicaciones fruto de esta colaboración señalan que la incorporación de algas a derivados cárnicos (p. ej. salchichas tipo Frankfurt) permite reducir la adición de cloruro sódico e incluso la demanda de antioxidantes (39,66). También las salchichas, hamburguesas y filetes reestructurados contenían mayores cantidades de polifenoles solubles procedentes de las algas, responsables de la elevada estabilidad y actividad antioxidante durante el procesamiento y el almacenamiento (66,67). Estos resultados coinciden con otro estudio en el que los investigadores incluyeron dos carotenos procedentes de algas como la fucoxantina o astaxantina (68) y con otro, en el que la adición de extractos de algas mejoró la estabilidad del color y disminuyó la producción de LPO tras el almacenamiento y la cocción (69).
En relación con la funcionalidad, se han realizado estudios en animales de investigación para evaluar el efecto del consumo de carne enriquecida con algas sobre el estatus antioxidante (70-73). Así, durante un total de cinco semanas, diferentes grupos de ratas Wistar en crecimiento recibieron dietas (con o sin adición de factores hipercolesterolemiantes) cuya base era carne reestructurada de cerdo que contenía un 5% en peso de nori, wakame o espagueti de mar. Curiosamente, los efectos hipocolesterolemiantes de los cárnicos con algas respecto a los del cárnico control se tradujeron en una disminución de los niveles de antioxidantes. Así pues, el cárnico con wakame mostró mayor efecto antioxidante, pero poca acción hipocolesterolemiante. Por su parte, el “espagueti de mar” se comportó como potente hipocolesterolemiante, pero sus efectos antioxidantes potenciales se constataron solo parcialmente en nuestras condiciones experimentales. Estos resultados se explican, al menos parcialmente, porque la transformación de colesterol en ácido cólico requiere de la acción de la hemoenzima CYP7A1, la cual origina en presencia de hierro elevados niveles de ROS, lo que requiriere de niveles elevados de antioxidantes, a fin de evitar el daño oxidativo y el bloqueo de la acción de esta enzima. Esta hipótesis se comprobó netamente en las ratas que consumieron el restructurado de carne de cerdo con nori, ya que, respecto al cárnico control, tanto los efectos reductores de la colesterolemia, como los efectos antioxidantes fueron moderados. No obstante, y como resumen, debemos señalar que la acción hipocolesterolemiante en las dietas que contenían algas fue significativa en el caso de incluir en los cárnicos nori o espagueti de mar, pero no wakame, lo que sugiere además que la acción reductora del colesterol plasmática, que se atribuye el arrastre de las sales biliares por la fibra de las algas, dependió claramente de la composición química de las mismas (60,62). Respecto a los efectos antioxidantes, aunque se observaron diferencias entre las tres cárnicos con algas, puede afirmarse, al menos parcialmente, que la carne enriquecida con algas ejerció efectos amortiguadores frente a la oxidación, ya que indujo una expresión moderada de enzimas antioxidantes [CAT, Mn-SOD, Zn-SOD y glutatión peroxidasa (GPx] en ratas (70,72,73). Todas las algas analizadas contenían una cantidad considerable de xantófilas y compuestos polifenólicos, cuya actividad antioxidante puede ayudar a eliminar las ROS producidos en la activación de la hemoenzima CYP7A1, haciendo innecesario aumentar la expresión de los mecanismos antioxidantes en el organismo (74). Asimismo, algunos péptidos bioactivos de las algas llamados ficobiliproteínas (complejos de proteínas y pigmentos) tienen actividades antioxidantes que pueden ser beneficiosas para reducir los efectos negativos de las enfermedades asociadas al estrés oxidativo y a la inflamación (75).
Nuestro grupo ha revisado recientemente la importancia del consumo de algas en la prevención y tratamiento de la DMT2, incidiendo sobre los efectos de los diferentes polifenoles en la homeostasis de la glucosa (76). Resultados no publicados del grupo AFUSAN muestran que algunos extractos de algas comestibles (Sea spaghetti, Wakame, y Nori) presentaban un elevado efecto secretagogo GLP-1 in vitro en células STC1. Estos efectos difirieron dependiendo del alga y del tipo de extracto (acuoso, etanólico o clorofórmico). Por tanto, la inclusión en cárnicos de estos extractos, preferiblemente etanólicos y clorofórmicos del alga Nori, podría tener importancia clínica para pacientes con DMT2.
Respecto a la inclusión de microalgas, señalar que el grupo AFUSAN ha testado los efectos hipolipemiantes, antioxidantes, antiinflamatorios y antiobesidad de una carne funcional formulada con una mezcla de glucomanano más espirulina (Spirulina platensis o Arthrospira maxima) respecto a los de una carne funcional con glucomanano o de una carne control en ratas fa/fa alimentadas con dieta aterogénica (40,77) (Tabla 1). No obstante, debe señalarse que se trata de una cianobacteria, y no de un alga propiamente dicha, como sigue considerándose en ciertos círculos. En estas ratas genéticamente condicionadas, la inclusión de la dieta aterogénica indujo obesidad severa y elevó la colesterolemia a niveles muy críticos (próximos a 1000 mg/dL), con presencia de enormes concentraciones de lipoproteínas aterogénicas: lipoproteínas de muy baja densidad enriquecidas en colesterol o beta (b-VLDL), lipoproteínas de densidad intermedia (IDL) y LDL. La inclusión de glucomanano redujo la colesterolemia a valores del orden de 420 mg/dL con menor presencia de lipoproteínas aterogénicas, efecto que se potenció mucho más por la inclusión de glucomanano+espirulina, reduciéndose los valores de colesterol a niveles próximos a 240 mg/dL (77). La acción conjunta del glucomanano y espirulina redujo marcadamente la producción de ROS vinculada a la eliminación activa del colesterol en las ratas (78). Otros efectos notables fueron la reducción de los niveles de colesterol en hígado y plasma debido al incremento de la expresión génica de la enzima CYP7A1c y las modificaciones beneficiosas en la actividad de la enzima AE (78). A pesar de los efectos positivos de la espirulina en la actividad antioxidante y de la estabilidad que proporciona su incorporación a la carne, se necesitan más estudios para evaluar sus propiedades funcionales tanto en modelos animales como en humanos.
Debe insistirse que los efectos de las algas sobre la salud dependen en gran medida de su composición. También es importante señalar que los efectos de las algas utilizadas como ingrediente en alimentos potencialmente funcionales dependen de la matriz alimenticia en la que se incluyen. AFUSAN ha comparado tales efectos en matrices cárnicas y en matrices de concentrados de proteína de calamar sobre la colesterolemia, homeostasis de la glucosa y marcadores de inflamación en ratas Zucker fa/fa alimentadas con una dieta aterogénica (79,80). La inclusión de estos ingredientes funcionales en un producto de pescado hecho con proteína redujo los niveles en sangre de colesterol, glucosa, leptina y adiponectina; sin embargo, cuando se incluyó glucomanano más espirulina en una matriz de carne, no se observaron cambios en la glucemia.
Esta pérdida de efecto sobre la glucemia podría deberse al mayor contenido calórico de las dietas pertenecientes al estudio con carnes funcionales, pero también, entre otros aspectos, a la composición en ácidos grasos de las matrices alimentarias utilizadas.
7.3. Productos cárnicos funcionales con modificación del perfil de ácidos grasos. Enriquecimiento con ácidos grasos omega-3
Como ya comentábamos al inicio de este trabajo, en la población occidental se ha elevado el consumo de AGS y reducido el de AGP ω-3 (2). Podemos señalar que en España, aproximadamente, alrededor del 25% de los lípidos consumidos deriva de carne y productos cárnicos (9,20). Por ello la modificación en los productos cárnicos del perfil de ácidos grasos puede ser una estrategia tecnológica correcta para reducir el consumo de AGS. Se basa en la sustitución parcial, total o casi total de la grasa cárnica, rica en AGS, por AGP y/o AGP ω-3, para favorecer perfiles grasos en la dieta acordes a los objetivos nutricionales (2,9,18). Por ello, teniendo en cuenta los beneficios para la salud de los AGPω-3 (2,45), la industria alimentaria ha desarrollado estrategias para aumentar su concentración en los productos cárnicos mediante: a) la introducción de un aceite o alimento rico AGP ω-3 (p. ej. aceite de lino, aceite de chia; nueces) (38,43,75,81) y b) la inclusión de acilgliceroles en cuyos restos acilos se incluyan AGP ω-3 [ácidos αω-linolénico, dihomo-gamma-linolénico, eicosapentaenoico (EPA) y/o docosahexaenoico (DHA)] (44-46).
Teniendo en cuenta que la composición lipídica de la carne depende en gran medida de la composición grasa de los piensos consumidos por los animales destinados a producción y consumo, principalmente en los animales monogástricos, una de las estrategias más utilizadas es la incorporación de fuentes ricas en AGP ω-3 (p. ej. aceites de pescado, colza o lino, chía, algas) en la alimentación animal. Este método es eficaz en la producción de carne de cerdo o de aves de corral (82, 83); sin embargo, los resultados son contradictorios en el caso de la carne de vacuno o de cordero, debido a que los AGP de la dieta están sujetos a la biohidrogenación ruminal (84).
Aun así, aumentar la concentración de AGP en la carne podría ser una estrategia algo arriesgada, ya que estos ácidos grasos son los principales sustratos de los LPO (28). No obstante, el aumento de la oxidación por el enriquecimiento con AGP puede reducirse si los animales pastan, porque aumenta sus niveles de vitamina E (85). Además, la adición de AGP es especialmente problemática para los productos cárnicos, ya que las condiciones de procesamiento, como la molienda, la cocción y el secado, implican la exposición a temperaturas relativamente altas, la descomposición de los antioxidantes o el aumento de la oxidación del sustrato (86-89). Por ello, muchos estudios incluyen junto con AGP w-3 compuestos antioxidantes para garantizar su estabilidad desde su producción hasta el consumo (90,91).
El grupo AFUSAN ha comprobado en voluntarios con un riesgo elevado de ECV mediante un estudio secuencial, no aleatorizado y controlado de cinco meses de duración, el efecto del consumo de productos cárnicos (patés y salchichas) con un contenido reducido en grasa total, pero enriquecidos AGP w-3 (a-linolénico, EPA y DHA) frente a productos cárnicos con bajo contenido graso y frente a productos cárnicos convencionales. Los voluntarios pasaron por tres periodos de un mes donde debieron consumir 200g/semana de salchichas y 250g/semana de patés de los tres tipos ya comentados. Entre los periodos de estudio estuvieron separado por “lavados” de un mes de duración (Tabla 1). Los efectos de la ingesta de los productos con bajo contenido total graso, pero elevado perfil de AGP ω-3 frente a los productos cárnicos control se evaluaron mediante marcadores antropométricos y hormonales y mediante biomarcadores de ECV (37-39,44,45,84,92,93). Los resultados revelaron, entre otros aspectos, cambios en los niveles de LDLcolesterol (44), aumento de la actividad arilesterasa (AE) y una menor relación AE/oxLDL, lo que sugiere una mejora del estado antioxidante de las lipoproteínas tras el consumo de los productos cárnicos funcionales modificados conteniendo poca grasa total, pero con alta proporción en AGP ω-3 (45). Quizás los efectos más relevantes se refieren a la reducción aproximadamente de un 70% de los niveles de tromboxano B2 en los voluntarios que tomaron los productos cárnicos enriquecidos en AGP w-3 respecto a los cárnicos convencionales (46).
El aceite de chia, obtenido de la semilla de la chía (Salvia hispánica, L.), es uno de los aceites con mayor contenido de ácido a-linolénico (81). El grupo AFUSAN ha estudiado en ratas Wistar envejecidas el efecto de dietas aterogénicas (ricas en colesterol y grasa saturada) en la que se incluyeron cárnicos reestructurados elaborados adicionando aceite de chía. Los efectos se compararon frente a los de un grupo alimentado con la misma dieta aterogénica, pero con un cárnico enriquecido en hidroxitirosol o un cárnico control. Se determinó el perfil lipoproteico, la expresión de receptor para LDL, la composición de las lipoproteínas en colesterol triglicéridos, fosfolípidos y proteínas, el índice hepatosomático, el factor de transcripción nuclear E2 (Nrf2), y marcadores antioxidantes y de inflamación (Tabla 1). Los animales que recibieron el cárnico con aceite de chia presentaron niveles de colesterol en plasma e índice redox similares a los del grupo control que recibió una dieta rica en AGS, pero sin colesterol. El consumo del cárnico con chía redujo especialmente la presencia de b-VLDL (enriquecidas en colesterol y muy aterogénicas para la rata). Este efecto estuvo parcialmente relacionado con la expresión génica del factor de transcripción SREBP-1c que modula a su vez la actividad y expresión del receptor de LDL (43). A pesar del alto contenido de AGP ω-3, el cárnico con aceite de chía redujo los niveles de sustancias reactivas al ácido tiobarbitúrico (TBARS) y demandó menos expresión de SOD, aunque la actividad de esta enzima antioxidante se mantuvo (81). El aceite de chía activó el Nrf2 para detener la respuesta prooxidante inducida por la eliminación de colesterol vía ácido cólico y por el propio envejecimiento.
El sistema de la óxido nítrico-sintasa endotelial (eNOS) fue menor en el grupo que ingirió cárnico con hidroxitirosol que en el que recibió el cárnico formulado con aceite de chía, lo que sugiere su actividad antiaterogénica y el efecto protector relacionado contra la ingesta elevada de AGP. El aumento del factor de necrosis tumoral alfa (TNFα) fue bloqueado parcialmente en el grupo que ingirió cárnico con aceite de chía (81). Los resultados indican que este aceite tiene la capacidad de prevenir el daño oxidativo y modificar la respuesta inflamatoria, lo que apunta una regulación adecuada del sistema antioxidante y subraya la importancia de incorporar AGP w-3 en la dieta y particularmente cuando se trate de dieta con alto contenido de AGS y colesterol (43,81).
A pesar de los resultados prometedores asociados al consumo de AGP w-3, existen pocos productos cárnicos industriales enriquecidos con dichos ácidos grasos. La dificultad tecnológica para garantizar su estabilidad puede ser una de las causas, lo que representa una interesante línea de investigación y desarrollo de productos para mejorar la salud de los consumidores (15).
7.4. Productos cárnicos funcionales con inclusión de silicio en derivados cárnicos
El silicio es un oligoelemento esencial para el crecimiento y la función biológica de varios microorganismos, plantas y animales (93,94). Aunque se han publicado resultados que sugieren beneficios del silicio en la salud (95,96), hasta la fecha no se han definido las ingestas dietéticas de referencia de este mineral. Los estudios in vitro han demostrado que el silicio eleva la actividad antioxidante en diferentes tipos de células (97).
La inclusión de silicio en la carne reestructurada aseguraría, por un lado, la ingesta adecuada de este micronutriente esencial y, por otra, permitiría beneficiarse de sus propiedades nutricionales y funcionales al consumirla como ingrediente de los cárnicos, reduciendo los posibles efectos negativos atribuidos al alto consumo de estos alimentos (98). Aunque no existen datos publicados sobre la estabilidad oxidativa de los cárnicos enriquecidos con silicio durante el almacenamiento, la cocción y la digestión, datos preliminares de AFUSAN, utilizando un modelo in vitro de sistema digestivo, sugieren que la carne de cerdo enriquecida con silicio sufre menos oxidación que su control sin silicio.
En cuanto a sus propiedades funcionales y de salud, hay que señalar que la administración de silicio, mediante gavage esofágico a ratas Wistar jóvenes sanas, fue capaz de reducir la digestión y absorción de glucosa y aceite de oliva. Los efectos sobre las curvas postprandiales de glucemia y trigliceridemia fueron observables desde las primeras dosis, pero particularmente relevantes después de una semana de administrar diariamente silicio (99).
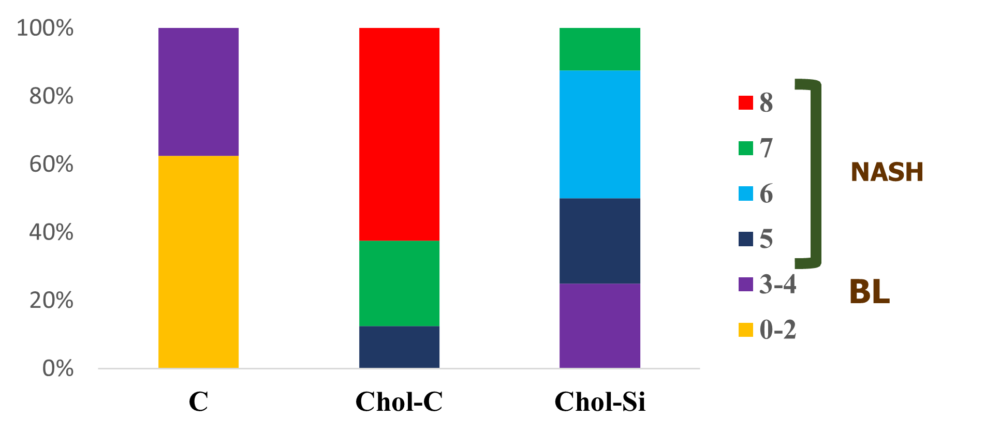
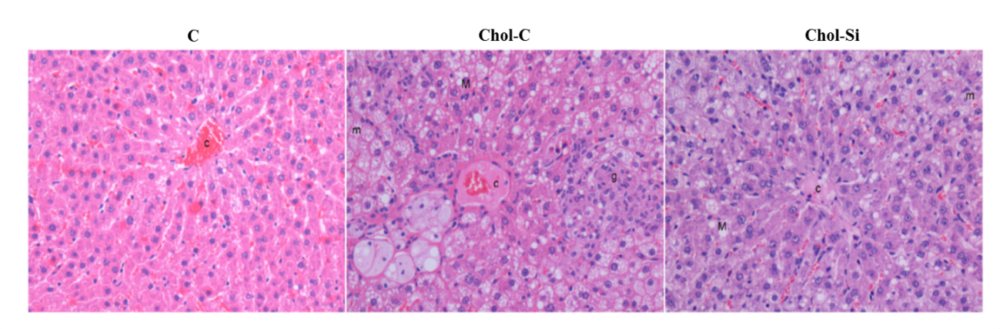
Considerando estas premisas se plantearon una serie de estudios en los que se evaluó la funcionalidad de cárnicos a los que se incorporó silicio inorgánico. Estos estudios se hicieron en ratas de 60 semanas de forma similar a lo comentado para el aceite de chia e hidroxitirosol (Tabla 1). Los resultados señalan una excreción fecal total y de grasa elevada en los animales que recibieron cárnico enriquecido en silicio respecto al cárnico control. Se observó una reducción de la expresión del transportador para glucosa SLGT1 tanto en duodeno como en yeyuno. A nivel de lipoproteínas se observaron mejoras significativas en los animales alimentados con carne enriquecida con silicio en el marco de una dieta aterogénica (41) ya que redujo la colesterterolemia, la trigliceridemia, la concentración de b-VLDL, la peroxidación de las VLDL e incrementó la cantidad de receptor hepático para LDL (41). Uno de los resultados más espectaculares fue la reducción de la esteatosis hepática, así como de la inflamación periportal que originó la dieta rica en AGS y colesterol (100) (Figura 4).
Figura 4. A) Cambios a nivel histológico hepático de ratas Wistar de 60 semanas que recibieron reestructurados cárnicos en la dieta. C, grupo control que recibió dieta rica en ácidos grasos saturados (AGS); Chol-C, grupo control hipercolesterolemiante que recibió una dieta aterogénica rica en AGS y colesterol y el cárnico control; Chol-Si, grupo hipercolesterolemiante–silicio, que recibió una dieta aterogénica rica en AGS y colesterol y el cárnico enriquecido en silicio. Obsérvese la balonización y esteatosis e infiltración leucocitaria en el grupo Chol-C. Tales alteraciones fueron mucho menos evidentes en el grupo Chol-Si. Tinción Hematoxilina-Eosina. B) Esteatosis no alcohólica (NAFLD) y esteatohepatitis no alcohólica (NASH) en las ratas de los tres grupos estudiados, considerando la puntuación NAS. Ninguna rata del grupo C, fue diagnosticada de (NASH), mientras que el 100% de las ratas del grupo C mostró NASH. En las ratas del grupo Chol-Si, la prevalencia de NASH fue del 75%. Adaptado de Garcimartín y col. (100).
Asimismo, se observó una mejora en los niveles de los antioxidantes hepáticos, especialmente para la SOD, a través de la activación del factor Nrf2 en ratas que desarrollaron la enfermedad del hígado graso no alcohólico (NAFLD) y que estuvieron alimentadas con carne enriquecida con silicio. También se observó reducción de la apoptosis (del factor inductor de apoptosis y de factores proapoptóticos vs antiapoptóticos), así como de la presencia de células inflamatorias a nivel hepático (100).
Estos datos indican que el consumo de la carne funcional con silicio respecto a la carne convencional en el marco de una dieta aterogénica enriquecida en colesterol, bloquea el paso NAFLD a esteatohepatitis no alcohólica (NASH), ya que logra reducir significativamente el porcentaje de ratas diagnosticadas de NASH definitivo. La mejora en el estado antioxidante parece ser parcialmente responsable de la reducción de la apoptosis hepática encontrada en estos animales, lo que sugiere el papel hepatoprotector inducido por el silicio incorporado en un modelo animal de NAFLD (100).
Muy recientemente el grupo AFUSAN ha estudiado la influencia de la incorporación de cárnicos enriquecidos en silicio a dietas aterogénicas ricas en AGS y colesterol a animales a los que se había inducido un estado avanzado de DMT2 mediante la inyección de estreptozotocina + NAD en la absorción de colesterol y los mecanismos fisiológicos subyacentes (101). Los resultados a nivel duodenal son relevantes y novedosos, ya que existen muy poca evidencia científica en modelos de DMT2 y sugieren que el consumo una matriz cárnica enriquecida en silicio frente a una matriz cárnica control mejora la colesterolemia y los niveles de lipoproteínas aterogénicas a través de 1) reducir la absorción incrementada de colesterol en las ratas diabéticas que consumen el cárnico control por disminuir el área de absorción y los niveles de ACAT2 y 2) incrementar la excreción de colesterol por inducción de LXR y los transportadores ABCG5/G8.
7.5. Productos cárnicos con adición de fibra dietética, asociada a extractos vegetales o a proantocianidinas de la pulpa de algarroba
Como es evidente, la carne carece de fibra dietética (102, 103). Su incorporación en la formulación de carnes funcionales ha sido ampliamente estudiada, ya que le aporta notables propiedades tecnológicas (retención de agua, lubricación, capacidad de disminuir las pérdidas por cocción, estabilización del producto, modificación de la textura y sabor neutro) y nutricionales (fuente de alto contenido en fibra y componentes asociados como polifenoles, diversificación de la microbiota intestinal y efectos hipocolesterolemiantes, antioxidantes y/o saciantes) (104). Además, muchos compuestos antioxidantes, como los polifenoles y los carotenoides, se consideran asociados y en cierto modo inseparables de la fibra dietética (103, 105, 106). Aunque existen muchos tipos de biofenoles, su estructura fenólica los convierte en eficaces donantes de electrones o hidrógeno para neutralizar los ROS y las especies reactivas del nitrógeno (RNS) (15,103,107). Se ha informado que los polifenoles presentan diferentes propiedades al respecto: (a) interrumpen la etapa de propagación de las reacciones en cadena de autooxidación de los lípidos al ser eficaces captadores de “radicales libres” (108); (b) actúan como quelantes de metales oxidantes con la consiguiente disminución de los -OH reactivos causados por la reacción de Fenton (108); y (c) activan, en forma libre o glicosilada, la vía antioxidante promoviendo la translocación de Nrf2 al núcleo, activando el elemento de respuesta antioxidante (109). Estas propiedades sugieren la conveniencia de diseñar productos cárnicos enriquecidos con compuestos antioxidantes asociados a la fibra.
Otro aspecto importante se refiere a mantener las condiciones óptimas y la estabilidad de la carne durante el almacenamiento y la cocción (28,103,110). El enriquecimiento de los productos cárnicos con diferentes extractos de frutas reduce su alteración oxidativa durante la cocción y posterior refrigeración (111) (figura 3). Además, la disminución de la producción de carbonilos en la carne se relaciona con una alta concentración de flavonoides, que bloquea la oxidación de las cadenas laterales de los residuos de lisina, prolina, arginina e histidina (15) (figura 3).
La adición de concentrados de fibra y proantocianidinas a sistemas cárnicos, equivalentes a los que se utilizan en la preparación de salchichas, alargó de forma significativa la vida útil de estos productos en refrigeración y congelación cuantificada por la presencia de productos de oxidación como TBARS y de compuestos de alteración lipídica, en particular en el caso de añadir un producto enriquecido en taninos condensados no extraíbles (112).
Varios estudios in vivo han evaluado los efectos de los extractos vegetales añadidos a los productos cárnicos enriquecidos, teniendo en cuenta tanto sus propiedades tecnológicas como su estabilidad oxidativa (15). Entre los resultados merecen destacarse los obtenidos en un modelo animal de cáncer colorrectal en el que se testó el consumo de carne de cerdo curada enriquecida con vino tinto (2%), granada (0,6%) y a-tocoferol (0,045%) y se observó una reducción tanto del contenido de LPO en heces como la formación de ácido mercaptúrico 1,4-dihidroxinonano en orina (el principal metabolito urinario del 4HNE y un indicador de la LPO) (113). También hay que señalar que en otro estudio se evaluó el efecto protector de las antocianinas frente al cáncer colorrectal.
Así, el consumo de salchichas enriquecidas con antocianinas (0,11%) aumentó la actividad antioxidante total del plasma y redujo la abundancia de bacterias proinflamatorias (114).
Desde tiempo inmemorial, la pulpa de la vaina del algarrobo (Ceratonia siliqua, L.) de la familia de las Fabaceas, se ha utilizado con diferentes fines gastronómicos, en particular para repostería.
Esta pulpa tiene un alto contenido en azúcar, fibra, minerales y polifenoles (fundamentalmente proantocianidinas), mientras que las semillas son más ricas en grasas y pobres en azúcares que la pulpa y de ellas se obtiene un producto muy apreciado el “garrofín” que se emplea de forma asidua por la industria alimentaria y farmacéutica (115). A partir de la pulpa se han obtenido diferentes extractos, mostrándose la composición de dos de ellos en la figura 5.
Figura 5. Composición de dos extractos de pulpa de algarrobo, Exxenterol y Liposterina. Se diferencian fundamentalmente en su concentración en taninos, integrados por la unión de moléculas de proantocianidinas. Para facilitar su identificación, la proporción de los taninos constituyentes de ambas fracciones se han coloreado en diferentes gamas del color rojo. TC, taninos condensados. Adaptado de Bastida y col. (112).
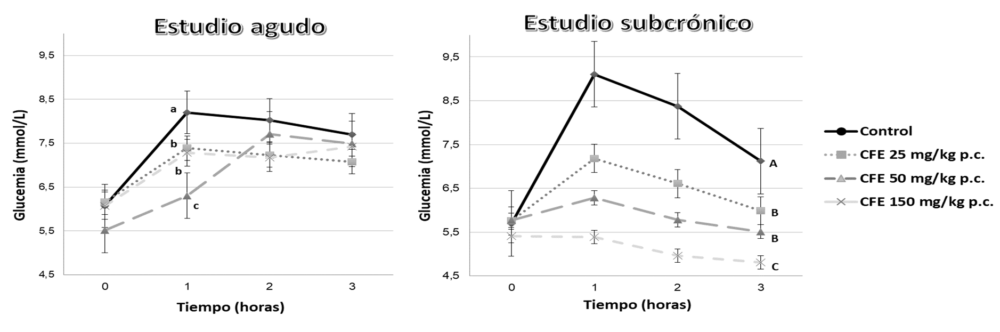
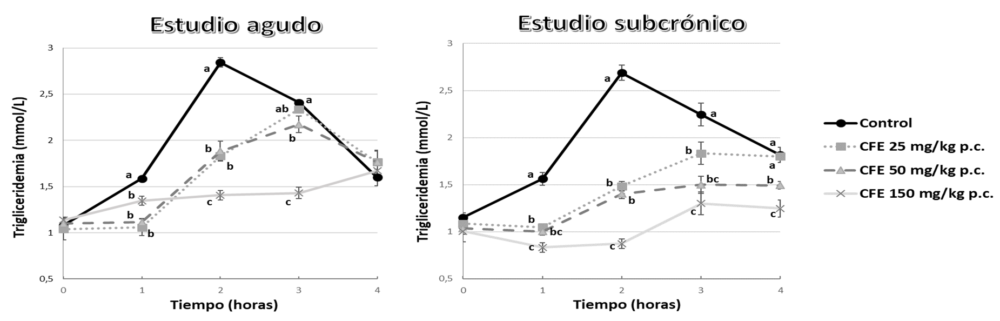
El grupo AFUSAN, antes de analizar las propiedades funcionales de los extractos de algarrobo y su aplicación en patologías clínicas, comprobó que estos extractos eran capaces de reducir de forma dosis-dependiente la curva postprandial de glucemia y la de triglicéridos en ratas jóvenes, lo que le convertía en un candidato para estudiar estos efectos en un modelo de DMT2 en roedores (116, 117) (Figura 6).
Figura 6. Cambios postprandiales de la glucemia y trigliceridemia en ratas sanas jóvenes tras el aporte agudo (primer día) o subcrónico (al quinto día) de aceite de oliva y glucosa y cantidades crecientes de extracto de algarrobo rico en proantocianidinas CFE. Adaptado de Macho y col. (116, 117).
Posteriormente el grupo AFUSAN ha evaluado el efecto de una carne enriquecida con extracto de algarroba (0,4g/100g de carne) durante ocho semanas en dos modelos animales de DMT2 (Tabla 1). En la fase inicial de la DMT2, el consumo de carne funcional redujo la hiperinsulinemia y corrigió parcialmente la dislipemia, afectando parcialmente a la concentración de las VLDL, y por tanto a la trigliceridemia, como consecuencia de una mejora en la señalización de la insulina a nivel hepático con incremento de los niveles de PI3K, pAKT y mejora del transportador de glucosa GLUT2 (47). También debe resaltarse que la carne con el extracto de algarrobo aumentó la actividad de la AE, una de las tres actividades de la enzima PON1 en el hígado, pero redujo la actividad en el plasma (47). La PON1 se define como una enzima suicida, que ejerce efectos antioxidantes pleiotrópicos y protege, en condiciones de alto estrés oxidativo con ausencia de antioxidantes, de la oxidación a muchas macromoléculas (p. ej. lipoproteínas plasmáticas) (118). Además, resultados aún no publicados señalan que la carne con el extracto de algarrobo moduló parcialmente en la fase inicial de la DMT2 la composición de la microbiota intestinal, manteniendo unos niveles más elevados de bacterias del grupo Clostridium leptum y de la especie Faecalibacterium prausnitzii, al mismo tiempo que redujo los niveles de bacterias potencialmente menos beneficiosas como Enterobacteriaceae. Todo ello, resultó en un incremento en el contenido de butirato en heces y a reforzar la barrera colónica (48). De hecho, las proantocianidinas son metabolizadas por la microbiota, liberando grandes cantidades de metabolitos antioxidantes en el plasma (119). Esto sugiere que la carne enriquecida con extracto rico en proantocianidinas puede reducir el estrés oxidativo en la fase inicial de la DMT2, ya que no se requiere una actividad plasmática adicional de AE (47).
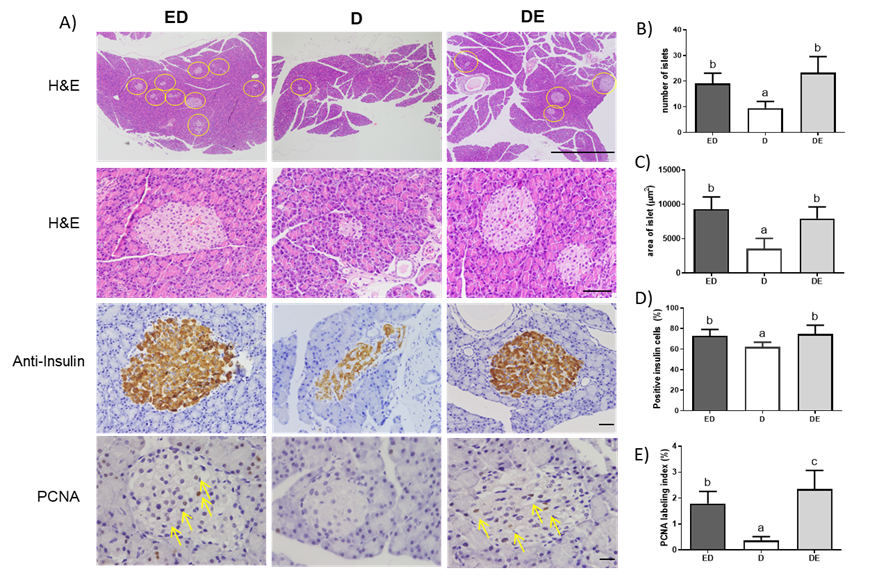
Para el estudio de las acciones de este extracto en la fase tardía de la DMT2, se indujo la lesión pancreática mediante inyección de estreptozotozina más ácido nicotínico (STZ+NAD). El NAD, actuó como protector evitando que las células beta-pancreáticas perdieran totalmente la capacidad de producir insulina. Junto al grupo que recibió una dieta aterogénica incluyendo carne control, se incluyeron dos grupos en los que se ensayó la carne enriquecida en extracto de algarrobo. Uno de ellos se utilizó como grupo de prevención, el cual recibió el cárnico enriquecido en extracto de algarrobo desde el inicio del estudio, y el otro como grupo de tratamiento, en el que se incluyó el cárnico funcional una vez establecida la DMT2 por la inyección de STZ+NAD (Tabla 1). Al igual que en el modelo inicial, tanto el grupo de prevención como de tratamiento, corrigieron parcialmente la dislipemia diabética con disminuciones en la oxidación de las VLDL, lipoproteína mayoritaria en la rata (120) y mejoraron notablemente la señalización de insulina a nivel hepático, incrementando los niveles y expresión de las principales proteínas implicadas en la transducción de señales (ruta InsR/PI3K/AKT/GSK3) (121). Además, en ambos casos se observó una mejoría relevante y significativa en la glucemia, una mejor salud pancreática, con presencia de islotes de Langerhäns regulares (área de células-b productoras de insulina), mayor concentración de insulina y una mayor proliferación celular en comparación con el grupo control (121) (Figura 7).
Figura 7. Cambios a nivel pancreático de ratas Wistar diagnosticadas de DMT2 en estadio tardío, acorde a sus niveles de glucosa e insulina, que recibieron reestructurados cárnicos en la dieta conteniendo o no extracto de algarrobo. D, grupo control diabético que recibió dieta rica en AGS más colesterol, más cárnico control e inducción de diabetes con streptozotocina + NAD; ED, grupo de prevención que consumó dieta rica en AGS más colesterol más cárnico enriquecido en el extracto de algarrobo durante todo el estudio (desde antes de la inducción de diabetes con streptozotocina + NAD); DE grupo de tratamiento que consumó dieta rica en AGS más colesterol más cárnico enriquecido en el extracto de algarrobo a partir de la inducción de diabetes con streptozotocina + NAD). Se observa en los grupos ED y DE mejoría de la funcionalidad insular atendiendo a los incrementos tanto del número, como del tamaño de los islotes, de la producción de insulina y del antígeno nuclear de células en proliferación (PCNA). AGS, ácidos grasos saturados; NAD, nicotinamida. Adaptado de Macho-González (121).
También se procedió a evaluar el efecto del consumo del cárnico enriquecido en el extracto de algarrobo sobre la NAFLD, principal manifestación hepática de la DMT2. De forma muy similar a lo anteriormente comentado, tanto la prevención como el tratamiento con el extracto de algarrobo, redujeron la acumulación de lípidos hepáticos, aspecto que principalmente se relacionó con una menor absorción de los lípidos de la dieta, una mejora de la señalización de la insulina y una reducción de los factores de transcripción lipogénicos (121).
Por último, estudiamos el efecto de este cárnico funcional conteniendo el extracto de algarroba rico en proantocianidinas sobre la microbiota intestinal y la salud colónica. De forma preventiva bloqueó parcialmente la disbiosis de la microbiota intestinal inducida por una dieta alta en grasas saturadas y colesterol, observándose niveles superiores en el grupo de prevención que en el control diabético de Bacteroides spp., Bifidobacterium spp., Faecalibacterium prausnitzii, Lactobacillus spp., especies claramente beneficiosas. Este equilibrio de la microbiota intestinal, mantuvo una producción adecuada de ácidos grasos de cadena corta, especialmente de acetato, propionato y butirato, lo que redujo parcialmente las alteraciones colónicas inducidas por la dieta rica en AGS y colesterol, consiguiendo una adecuada estructura de las células del intestino grueso y, por tanto, una mejor salud colónica. No obstante, cuando el cárnico funcional enriquecido con el extracto de la pulpa de algarrobo se introdujo una vez instaurada la patología diabética, no consiguió revertir la microbiota intestinal en su totalidad, pero reforzó notablemente la barrera intestinal, mostrando niveles más elevados de ocludina y reducidos de zonulina-1 (48) (Tabla 1).
Estos estudios confirman que la inclusión del extracto rico en proantocianidinas como ingrediente funcional en un reestructurado cárnico parece ser una estrategia nutricional adecuada para pacientes con prediabetes y DMT2 con el objetivo de mejorar o ralentizar la evolución de dicha patología.
En la actualidad, AFUSAN está testado en modelos murinos de DMT2 los posibles beneficios de la sustitución en la dieta de un cárnico control por otro enriquecido en extracto de pulpa de algarrobo sobre la señalización de insulina y protección antioxidante a nivel cerebral, siendo los resultados preliminares obtenidos muy prometedores.
8. CÁRNICOS FUNCIONALES Y DIETA DE PRECISIÓN
El efecto de cualquier alimento funcional debe considerarse en función de las características fenotípicas del consumidor en el que su genoma y el entorno están en continuo diálogo (122-124). Por ello, parece necesario, a fin de incrementar la eficacia de la dietoterapia, el diseño de una nutrición de precisión que determine con exactitud el efecto de la dieta global, de nutrientes y compuestos bioactivos en la expresión de los genes y sus consecuencias sobre la síntesis proteica (proteómica), el metabolismo (metabolómica) y la diversidad génica de la microbiota (metagenómica) (125).
La nutrigenómica se definió inicialmente como el estudio de los efectos de los nutrientes/alimentos en la expresión génica de un individuo. Posteriormente, este concepto se ha ampliado para abarcar los factores nutricionales que protegen el genoma de posibles daños (126). Además, los alimentos y sus componentes pueden provocar modificaciones epigenéticas en la transcripción del ADN y la traducción del ARNm, contribuyendo a mejorar o empeorar los aspectos fisiopatológícos de una enfermedad, lo que refuerza la importancia de realizar estudios de intervención nutricional adecuados (122,124,125). Sin embargo, las interacciones entre dieta y genes son complejas y difíciles de predecir, lo que ha dado lugar a un gran número de estudios basados en estudios de asociación del genoma completo (GWAS), aplicaciones de puntuaciones (scores) de riesgo genético (GRS) y técnicas de secuenciación de nueva generación (NGS) (122-124). Asimismo, los análisis de secuenciación del ARNm, la transcriptómica, la proteómica, la metabolómica, la lipidómica y los estudios de asociación de todo el epigenoma (EWAS) también contribuirán a conseguir que se realice una nutrición de precisión (122,124-126).
Nuestro grupo ha informado de que las respuestas antioxidantes en voluntarios con alto riesgo de ECV que consumen carne enriquecida con pasta de nuez varían según dos formas polimórficas principales de las variantes Q192R (rs662) y L55M (rs854560) del gen PON1 (127, 128). Aunque el tamaño muestral era limitado, los resultados obtenidos sugieren que los cambios en los marcadores del estado antioxidante de los voluntarios tras el consumo de carne enriquecida con nueces tras un periodo de cinco semanas fueron mayores en los portadores de PON1 QQ que en los de PON1 QR+RR. Además, el polimorfismo PON1 Q192R estaba más relacionado con el estado antioxidante que el PON1 L55M (127). También comprobamos los efectos de cárnicos enriquecidos en pasta de nuez en individuos con riesgo cardiovascular elevado que eran portadores del Alelos PON-1 y ApoA4 360 sobre la concentración de moléculas de adhesión sICAM y sVCAM y de leucotrieno B4 (LTB4) (58). Los resultados sugieren la necesidad de genotipar a la población dada la diferente respuesta observada en unos portadores respecto a otros.
Por otra parte, los nutrientes y los compuestos bioactivos ejercen sus efectos sobre la salud a través de mecanismos nutrigenómicos y epigenómicos (122-125). En las secciones anteriores hemos comentado cómo el consumo de extractos de plantas, algas, silicio, etc., afecta a las expresiones génicas de las enzimas antioxidantes, modificando así el estado antioxidante de los consumidores.
La importancia de la transcriptómica y de otras tecnologías “ómicas” en la nutrición de precisión parece evidente, ya que varios polimorfismos de genes implicados en vías metabólicas se han relacionado con enfermedades degenerativas (129). Los efectos negativos del alto consumo de carne en la celularidad del colon parecen estar estrechamente relacionados con la naturaleza y la presencia de un microbioma rico en bacterias proteolíticas. No obstante, el consumo conjunto de carne y de hidratos de carbono digeribles permite amortiguar estos efectos negativos (130), ya que una dieta rica en hidratos de carbono hace que predominen las bacterias sacarolíticas del colon. Todos estos resultados ponen de manifiesto la importancia de consumir una dieta plural o incluir algunos compuestos vegetales fermentables cuando se consuman con frecuencia alimentos ricos en proteínas de origen animal como la carne.
A pesar de estos retos, los productos cárnicos funcionales formulados con ingredientes antioxidantes no sólo deberían reducir la formación de ROS y otros compuestos de oxidación, sino también potenciar las vías antioxidantes mediante la modulación de los niveles de varios factores de transcripción [p. ej. Nfr2, NF-kB, el receptor X de retinoides (RXR) y el receptor de vitamina D (VDR)]. Estos efectos parecen estar mediados por cambios epigenéticos asociados a su consumo, lo que indica que son un arma nutricional potencial para ayudar a mejorar las patologías crónicas, y más teniendo en cuenta la posible adición a los cárnicos de algunas vitaminas liposolubles (p.ej., vitamina D) debido a sus efectos antioxidantes y antitumorales (131).
9. CONCLUSIONES Y TRABAJOS FUTUROS
El grupo AFUSAN en colaboración con investigadores del ICTAN ha diseñado y desarrollado una gran cantidad de posibles alimentos funcionales con base de carne para cubrir dos objetivos principales: mejorar la composición y la vida útil de los productos cárnicos y mejorar el estado de salud de los consumidores mejorando una o más funciones corporales y/o reduciendo el riesgo de desarrollo de enfermedades degenerativas.
Los productos cárnicos modificados garantizan atributos de calidad aceptables en términos de propiedades fisicoquímicas y sensoriales, así como de estabilidad.
La alimentación animal y la formulación de alimentos son las dos formas más habituales de obtener alimentos saludables y funcionales.
La carne y los productos cárnicos se han convertido en matrices alimentarias ideales para suministrar compuestos bioactivos (p. ej. fibra, AGP ω-3 y péptidos bioactivos) o alimentos completos (p. ej. nueces y algas) sin cambiar los hábitos alimentarios, lo que contribuye a mejorar la calidad y la adecuación nutricional de la dieta.
La información sobre la protección contra la oxidación de la carne con ingredientes funcionales es amplia, pero son pocos los estudios que han evaluado los efectos saludables y protectores in vivo de la carne funcional tras su consumo.
El consumo habitual de productos cárnicos adecuadamente formulados garantiza una mejora del perfil lipoproteico y por tanto del riesgo cardio y cerebrovascular y del estado antioxidante, ya que reduce los niveles de algunos marcadores específicos de oxidación (TBARS, MDA) y mejora el sistema de glutatión, reduciendo sus consecuencias metabólicas negativas (alteración del ADN, producción de interleucinas, apoptosis celular, etc.).
Dada la escasez de estudios y resultados, es urgente investigar de qué forma los distintos sistemas de cocinado (cocción, calentamiento, hervido, fritura, etc.) afectan a la biodisponibilidad del ingrediente funcional y a su funcionalidad.
Se necesitan trabajos futuros no sólo para evaluar los efectos sobre la salud mediados por los productos cárnicos funcionales, sino también para orientar a las personas que se ven más afectadas por su consumo.
Deben estudiarse los efectos plurales o “multitarjet” (antioxidantes, antiinflamatorios, antiapoptóticos, etc.) del consumo de cárnicos funcionales en órganos mitóticos y no-mitóticos de animales jóvenes y viejos, machos y hembras, en el marco de diferentes dietas y estados fisiológicos y nutricionales.
Es urgente la realización de estudios controlados a largo plazo para comprender cómo los efectos de las carnes funcionales se ven afectados por las mediciones “ómicas”.
Agradecimientos
Este trabajo fue parcialmente subvencionado los Proyectos PID2019-103872RB-100. PID2019-103872RB-I00 y /AEI/10.13039/501 100 011 033. Rocío Redondo-Castillejo es recipiendaria de una beca FPU20/0 2920 del Ministerio de Universidades y Adrián Macho-González recipiendario de una beca postdoctoral Margarita Salas en el Albert Einstein College of Medicine de Nueva York.
Abreviaturas
ABCG, tranportador ATP binding casette tipo G; ACAT, transferasa de restos acilos al colesterol en hígado; ADA, American Dietetic Association; ARN, ácido ribonucleico; AE, arilesterasa; AFUSAN, Alimentación Funcional, Salud y Nutrición; AGP, ácidos grasos poliinsaturados; AGS, ácidos grasos saturados; pAKT, proteína cinasa B fosforilada; ARN, ácido ribonucleico; CAT, catalasa; COX, ciclooxigenasa; CSIC, Consejo Superior de Investigaciones Científicas; CYP7A1, isoforma 7A1 del citocromo P450; DHA, ácido docosahexaenoico; DMT2, diabetes mellitus tipo 2; ECV, enfermedades cardiovasculares; eNOS, óxido nítrico-sintasa endotelial; EPA, ácido eicosapentaenoico; EWAS, estudios de asociación de todo el epigenoma; FDA, Federal Drug Administration; FOSHU, Foods for Specific Health Use o alimento de uso específico para la salud; FUFOSE, Functional Food Science Europe; GLP-1, péptido similar al glucagón tipo 1; GLUT2, transportador 2 de glucosa; GPx, glutatión peroxidasa; GR, glutatión reductasa; GRS, puntuación o score de riesgo genético; GSH, glutatión reducido; GSSG, glutatión oxidado; GWAS, estudios de asociación del genoma completo; HDL, lipoproteínas de alta densidad; HNE, hidroxinonenal; ILSI, International Life Science Institute; ICTAN, Instituto de Ciencia y Tecnología de los Alimentos y Nutrición; IDL, lipoproteínas de densidad intermedia; LDL, lipoproteínas de baja densidad; LPO, lipoperóxidos; LTB, leucotrieno de la serie B; LXR, factor de transcripción receptor hepático; MDA, malondialdéhido; NAD, Nicotinamida; NAFLD, enfermedad del hígado graso no alcohólico; NASH, esteatohepatitis no alcohólica; NGS, técnicas de secuenciación de nueva generación; Nrf2, factor de transcripción nuclear E2; NF-kB, factor nuclear potenciador de las cadenas ligeras kappa de las células β activadas; OMS, Organización Mundial de la Salud; OVN, Optimum Vitamin Nutrition o Nutrición Óptima de Vitaminas; PI3K, Fosfatidilinositol kinasa; PON, paraoxonasa; RDA, recommended dietary allowances o ingestas dietéticas recomendadas; ROS, especies reactivas del oxígeno; RNS, especies reactivas de nitrógeno; RXR, receptor X de retinoides; sICAM, molécula soluble de adhesión intercelular; SOD, superóxido dismutasa; SREBP, sterol regulatory element-binding protein o proteína de unión al elemento receptor de esteroles; STZ, estreptozotocina; sVCAM, molécula soluble de adhesión vascular; TBARS, sustancias reactivas al ácido tiobarbitúrico; TNFα, factor de necrosis tumoral alfa; UCM, Universidad Complutense de Madrid; VDR, receptor de vitamina D; VLDL, lipoproteínas de muy baja densidad.
10. REFERENCIAS
1. Sánchez-Muniz FJ. Obesidad un componente clave del síndrome metabólico. En: Sánchez-Muniz FJ. (Ed. y director) y Bastida Codina S, Gesteiro Alejos E, Garcimartín Álvarez A (Coed.). IV y V Cursos Avanzados sobre Obesidad y Síndrome Metabólico. Monografía XLVI. Madrid: Instituto de España. Real Academia Nacional de Farmacia. 2018; pp.17-44.
2. Sánchez-Muniz FJ, Bastida S. Lípidos. En: Varela G. (coord.). Libro Blanco de la Nutrición en España. Madrid: Agencia Española de Seguridad Alimentaria y Nutrición (AESAN) y Fundación Española de la Nutrición (FEN) 2013; pp. 113-24.
3. Palmeros Exsome C. Hurtado Capetillo JM, Torres Flores B. La obesidad en México. Programas en marcha. An Real Acad Farm 2016; 82(Special Issue): 55-63.
4. Escobar Toledo D, Calonge Pascual S, González-Gross M. Gasto energético: algo más que balance. En: Sánchez-Muniz FJ. (Ed. y director) y Bastida Codina S, Gesteiro Alejos E, Garcimartín Álvarez A (Coed.). IV y V Cursos Avanzados sobre Obesidad y Síndrome Metabólico. Monografía XLVI. Madrid: Instituto de España. Real Academia Nacional de Farmacia. 2018, pp. 65-86.
5. OMS https://www.who.int/es/news-room/fact-sheets/detail/obesity-and-overweight
6. Del Pozo de la Calle S, Alonso Ledesma I , Nuñez O, Castelló Pastor A, Lope Carvajal V, Fernández de Larrea Baz N, Pérez-Gómez B, Pollán M, Ruiz Moreno E. Composition and nutritional quality of the diet in Spanish households during the first wave of the COVID-19 pandemic. Nutrients 2021; 13: 1443.
7. Ruiz-Roso MB, Knott-Torcal C, Matilla-Escalante DC, Garcimartín A, Sampedro-Nuñez MA, Dávalos A, Marazuela M. COVID-19 lockdown and changes of the dietary pattern and physical activity habits in a cohort of patients with type 2 Diabetes Mellitus. Nutrients 2020; 12: 2327.
8. Weng W, Chen J. The Eastern perspective of functional foods based on traditional Chinese Medicine Nutr Rev. 1996; 54: S11-6.
9. Sánchez-Muniz FJ. La carne y productos cárnicos como alimentos funcionales. En: Jiménez-Colmenero F, Sánchez-Muniz FJ, Olmedilla-Alonso B (eds.). La carne y produtos cárnicos como alimentos funcionales. Madri: Fundación Española de la Nutrición (FEN), 2004; pp. 39-58.
10. Celada-Rodríguez P, Sánchez-Muniz FJ. Alimentos funcionales, rendimiento físico y deporte. En: González-Gross M. (directora). Aparicio-Ugarriza R, Fuentes Jimenez F, Mielgo-Ayuso JF (codir.). Nutrición deportiva. Desde la fisiología a la práctica. Buenos Aires: Ed. Panamericana 2020; pp. 381-404.
11. Diplock AT, Aggett PJ, Ashwell M, Bornet F, Fern EB, Roberfroid MB. Scientific concepts of functional food in Europe: Consensus document. Br J Nutr. 1999; 81 (Suppl. 1): S1-27.
12. Reglamento (CE) nº 1924/2006 del Parlamento Europeo y del Consejo, de 20 de diciembre de 2006, relativo a las declaraciones nutricionales y de propiedades saludables en los alimentos. Diario Oficial de la Unión Europea 18.1.2007; L 12/3.
13. FDA FSHN12-17/FS210 Functional Foods. Publicaciones del Departamento de Ciencia de los Alimentos y Nutrición Humana, Servicio de Extensión Cooperativa de la Florida, Instituto de Alimentos y Ciencias Agrícolas, Universidad de la Florida (UF/IFAS). Fecha de primera publicación: December 2012. Revisado July 2016 and March 2020. https://edis.ifas.ufl.edu
14. Aranceta Bartrina J. ¿Es necesario incluir alimentos funcionales en nuestra alimentación? Revista de Nutrición Práctica 1999; 3: 49-58.
15. Macho-González A, Bastida S, Garcimartín A, López-Oliva ME, González P, Benedi J, González-Muñoz MJ, Sánchez-Muniz FJ. Functional meat-products as oxidative stress modulators: a review. Adv Nutr 2021; 12(4): 1514-39.
16. https://thefoodtech.com/tendencias-de-consumo/consumo-carnico-a-nivel-mundial/#
17. Godfray HCJ, Aveyard P, Garnett T, Hall JW, Key TJ, Lorimer J, Pierrehumbertr RT, Scarborough P, Springmann M, Jebb SA. Meat consumption, health, and the environment. Science 2018; 361(6399): 5324.
18. Olmedilla-Alonso B, Jiménez-Colmenero F, Sánchez-Muniz FJ. Development and assessment of healthy properties of meat and meat products designed as functional foods. Meat Sci; 2013; 95: 919-30.
19. FAO F. a. A. O. o. t. U. N. FAOSTAT. 2016. Retrieved from http://www.fao.org/faostat/en/#data/FBS
20. Sánchez-Muniz FJ en representación del grupo AFUSAN. Nuevas recomendaciones sobre el consumo de carne. XIII Congreso Internacional sobre Dieta Mediterránea. Fundación Mediterránea. Barcelona 6-7 de abril, 2022.
21. Comisión Europea. Reglamento (CE) nº 853/2004 del Parlamento Europeo y del Consejo, de 29 de abril de 2004, por el que se establecen normas específicas de higiene de los alimentos de origen animal. Diario Oficial de la Unión Europea 2006; 139:55
22. Celada P, Sánchez-Muniz FJ. Are meat and meat product consumptions harmful? Their relationship with the risk of colorectal cancer and other degenerative diseases. An Real Acad Farm 2016; 82(1): 68-90.
23. Bello Gutiérrez J. Carne y derivados. En: Astiasarán I, Martínez JA (Direc.). Alimentos. Composición y propiedades. Madrid: McGraw-Hill Interamericana 2000, pp. 11-28.
24. Celada P, Bastida S, Sánchez-Muniz FJ. To eat or not to eat meat. That is the question. Nutr Hosp 2016; 33(1): 177-81.
25. Song P, Wu L, Guan W. Dietary nitrates, nitrites, and nitrosamines intake and the risk of gastric cancer: A Meta-analysis. Nutrients. 2015; 7(12): 9872-95.
26. Aune D. Plant Foods, antioxidant biomarkers, and the risk of cardiovascular disease, cancer, and mortality: a review of the evidence. Adv Nutr 2019; 10(Suppl. 4): s404-21.
27. Liguori I, Russo G, Curcio F, Bulli G, Aran L, Della-Morte D, Gargiulo G, Testa G, Cacciatore F, Bonaduce D, et al. Oxidative stress, aging, and diseases. Clin Interv Aging 2018; 13: 757-72.
28. Macho-González A, Garcimartín A, López-Oliva ME, Benedí J, Bastida S, Ros G, Nieto G, Sánchez-Muniz FJ. Can meat and meat-products induce oxidative stress? Antioxidants 2020; 9(7): E638.
29. Corpet DE. Red meat and colon cancer: should we become vegetarians, or can we make meat safer? Meat Science 2011; 89: 310-6.
30. Hill AB. The environment and disease, Association: or causation? Proceedings of the Royal Society of Medicine 1965; 58: 295-300.
31. Papuc C, Goran GV, Predescu CN, Nicorescu V. Mechanisms of oxidative processes in meat and toxicity induced by postprandial degradation products: a review. Compr Rev Food Sci Food Saf 2017; 16(1): 96-123.
32. Olivero David R, Sánchez-Muniz FJ, Bastida S, Benedi J, González-Muñoz MJ. Gastric emptying and short-term digestibility of thermally oxidized sunflower oil used for frying in fasted and nonfasted rats. J Agric Food Chem 2010; 58(16): 9242-8.
33. Kanner J, Gorelik S, Roman S, Kohen R. Protection by polyphenols of postprandial human plasma and low-density lipoprotein modification: the stomach as a bioreactor. J Agric Food Chem 2012; 60(36): 8790-6.
34. Gorelik S, Lapidot T, Shaham I, Granit R, Ligumsky M, Kohen R, Kanner J. Lipid peroxidation and coupled vitamin oxidation in simulated and human gastric fluid inhibited by dietary polyphenols: health implications. J Agric Food Chem 2005; 53(9): 3397-3402.
35. Garcimartín A, Macho-González A, Caso G, Benedí J, Bastida S, Sánchez-Muniz FJ. Frying a cultural way of cooking in the Mediterranean diet and how to obtain improved fried foods. En: Preedy V, Watson R. (eds.). The Mediterranean Diet. London, UK: Academic Press, 2020; pp. 191-207.
36. Canales A, Benedí J, Nus M, Librelotto J, Sánchez-Montero JM, Sánchez-Muniz FJ. Effect of walnut-enriched restructured meat in the antioxidant status of overweight/obese senior subjects with at least one extra CHD-risk factor. J Am Coll Nutr 2007; 26(3): 225-232.
37. Zeng Y, Pu X, Du J, Yang X, Li X, Mandal MSN, Yang T, Yang J. Molecular mechanism of functional ingredients in barley to combat human chronic diseases. Oxid Med Cell Longev 2020; 2020: 3836172.
38. Jiménez-Colmenero F, Sánchez-Muniz FJ, Olmedilla-Alonso B, Collaborators: Ayo J, Carballo J, Cofrades S, Ruiz-Capillas C, Serrano A, Bastida S, Benedí J, Canales A, Librelotto J, Nus M, Blanco-Navarro I, Blázquez-García S, Granado-Lorencio F, Herrero-Barbudo C. Design and development of meat-based functional foods with walnut: Technological, nutritional and health impact. Food Chem 2010; 123(4): 959-67.
39. Cofrades S, Benedí J, Garcimartín A, Sánchez-Muniz FJ, Jiménez-Colmenero F. A comprehensive approach to formulation of seaweed-enriched meat products: From technological development to assessment of healthy properties. Food Res Intern 2017; 99: 1084-94.
40. González-Torres L, Matos C, Vázquez-Velasco M, Santos-López JA, Sánchez-Martínez I, García-Fernández C, Bastida S, Benedí J, Sánchez-Muniz FJ. Glucomannan- and glucomannan plus spirulina-enriched pork affect liver fatty acid profile, LDL receptor expression and antioxidant status in Zucker fa/fa rats fed atherogenic diets. Food Nutr Res 2016; 61(1): 1264710.
41. Garcimartín A, Santos-López JA, Bastida S, Benedí J, Sánchez-Muniz FJ. Silicon-enriched restructured pork affects the lipoprotein profile, VLDL Oxidation, and LDL receptor gene expression in aged rats fed an atherogenic diet. J Nutr 2015;145(9): 2039-45.
42. Santos-López JA, Garcimartín A, Merino P, López-Oliva ME, Bastida S, Benedí J, Sánchez-Muniz FJ. Effects of silicon vs. hydroxytyrosol-enriched restructured pork on liver oxidation status of aged rats fed high-saturated/high-cholesterol diets. PloS one 2016; 11(1): e0147469.
43. Santos-López A, Garcimartín A, Bastida S, Bautista-Ávila M, González-Muñoz MJ, Benedí J, Sánchez-Muniz FJ. Lipoprotein profile in aged rats fed chia oil-or hydroxytyrosol-enriched pork in high cholesterol/high saturated fat diets. Nutrients 2018; 10(12): 1830.
44. Delgado-Pando G, Celada P, Sánchez-Muniz FJ, Jiménez-Colmenero F, Olmedilla-Alonso B. Effects of improved fat content of frankfurters and pâtés on lipid and lipoprotein profile of volunteers at increased cardiovascular risk: a placebo-controlled study. Eur J Nutr 2014; 53(1): 83-93.
45. Celada P, Sánchez-Muniz FJ, Delgado-Pando G, Bastida S, Rodilla ME, Jiménez-Colmenero F, Olmedilla-Alonso B. Effects of improved fat meat products consumption on emergent cardiovascular disease markers of male volunteers at cardiovascular risk. J Physiol Biochem 2016; 72(4): 669-78.
46. Celada P,·Olmedilla-Alonso B, Delgado-Pando G,·Raposo R, Jiménez-Colmenero F, Garcimartin A, Sánchez-Muniz FJ. Coagulation, thrombogenesis, and insulin resistance markers in increased cardiovascular risk subjects consuming improved fat meat products. J Am Coll Nutr 2019; 38(4): 334-41.
47. Macho-González A, Garcimartín A, López-Oliva ME, Celada P, Bastida S, Benedí J, Sánchez-Muniz FJ. Carob-fruit-extract-enriched meat modulates lipoprotein metabolism and insulin signaling in diabetic rats induced by high-saturated-fat diet. J Funct Foods 2020; 64:103600.
48. Macho-González A, Garcimartín A, Redondo N, Cofrades S, Bastida S, Nova E, Benedí J, Sánchez-Muniz, FJ, Marcos A, López-Oliva ME. Carob fruit extract-enriched meat, as preventive and curative treatments, improves gut microbiota and colonic barrier integrity in a late-stage T2DM model. Food Res Int. 2021; 141: 110124.
49. Badimon L, Vilahur G, Padro T. Lipoproteins, platelets and atherothrombosis. Rev Esp Cardio 2009; 62(10): 1161-78.
50. Ros E. Nuts and CVD. Br J Nutr 2015; 113 Suppl 2: S111-20.
51. Nus, Ruperto M, Sánchez-Muniz FJ. Frutos secos y riesgo cardio y cerebrovascular. Una perspectiva española. Arch Latinoam Nutr 2004; 54: 137-48.
52. Calder PC. Omega-3 fatty acids and inflammatory processes: from molecules to man. Biochem Soc Trans 2017; 45(5): 1105-15.
53. Librelotto J, Bastida S, Serrano A, Cofrades S, Jiménez-Colmenero F, Sánchez-Muniz FJ. Changes in fatty acids and polar material of restructured low-fat or walnut-added steaks pan-fried in olive oil. Meat Sci 2008; 80(2): 431-41.
54. Serrano A, Librelotto J, Cofrades S, Sánchez-Muniz F, Jiménez-Colmenero F. Composition and physicochemical beef steaks containing walnuts as characteristics of restructured affected by cooking method. Meat Sci 2007; 77(3): 304-13.
55. Canales A, Bastida S, Librelotto J, Nus M, Benedí J, Sánchez-Muniz FJ. Platelet aggregation, eicosanoid production and thrombogenic ratio in individuals at high risk consuming walnut-enriched meat. A cross-over, placebo-controlled study. Br J Nutr 2009; 102: 134-41.
56. Berryman CE, Grieger JA, West SG, Chen CYO, Blumberg JB, Rothblat GH, Sankaranarayanan S, Kris-Etherton PM. Acute consumption of walnuts and walnut components differentially affect postprandial lipemia, endothelial function, oxidative stress, and cholesterol efflux in humans with mild hypercholesterolemia. J Nutr 2013; 143(6): 788-94.
57. Chen BB, Han Y, Pan XT, Yan JH, Liu WJ, Li YF, Lin X, Xu SH, Peng XE. Association between nut intake and non-alcoholic fatty liver disease risk: a retrospective case-control study in a sample of Chinese Han adults. BMJ Open 2019; 9(9): e028961.
58. Canales A, Sánchez-Muniz FJ, Bastida S, Librelotto J, Nus M, Corella D, Guillén M, Benedí J. Effect of walnut-enriched meat on the relationship between VCAM, ICAM, and LTB4 levels and PON-1 activity in ApoA4 360 and PON-1 allele carriers at increased cardiovascular risk. Eur J Clin Nutr 2011; 65(6): 703-10.
59. Gómez-Zavaglia A, Lage MAP, Jiménez-López C, Mejuto JC, Simal-Gandara J. The potential of seaweeds as a source of functional ingredients of prebiotic and antioxidant value. Antioxidants 2019; 8(9): 406.
60. Jiménez-Escrig A, Sánchez-Muniz FJ. Dietary fibre from edible seaweeds: Chemical structure, physicochemical properties and effects on cholesterol metabolism. Nutr Res 2000; 20: 585-98.
61. Rodenas de la Rocha S, Sánchez-Muniz FJ, Gómez-Juaristi M, Larrea-Marín MT. Trace elements determination in edible seaweeds by an optimized and validated ICP-MS method. J Food Compos Anal 2009; 22: 330–6.
62. Larrea-Marín MT, Pomares-Alfonso MS, Gómez-Juaristi M, Sánchez-Muniz FJ, de la Rocha SR. Validation of an ICP-OES method for macro and trace element determination in Laminaria and Porphyra seaweeds from four different countries. J Food Compos Anal 2010; 23(8): 814-20.
63. Bocanegra A, Benedí J, Sánchez-Muniz FJ. Differential effects of konbu and nori seaweed dietary supplementation on liver glutathione status in normo- and hypercholesterolaemic growing rats. Br J Nutr 2006; 95(4): 696-702.
64. Wells ML, Potin P, Craigie JS, Raven JA, Merchant SS, Helliwell KE, Smith AG, Camire ME, Brawley SH. Algae as nutritional and functional food sources: revisiting our understanding. J App Phycol 2017; 29(2): 949-82.
65. Cofrades S, Lopez-Lopez I, Ruiz-Capillas C, Triki M, Jiménez-Colmenero F. Quality characteristics of low-salt restructured poultry with microbial transglutaminase and seaweed. Meat Sci 2011; 87(4): 373-80.
66. López-López I, Bastida S, Ruiz-Capillas C, Bravo L, Larrea MT, Sánchez-Muniz F, Cofrades S, Jiménez-Colmenero F. Composition and antioxidant capacity of low-salt meat emulsion model systems containing edible seaweeds. Meat Sci 2009; 83(3): 492-8.
67. López-López I, Cofrades S, Ruíz-Capillas C, Jiménez-Colmenero F. Design and nutritional properties of potential functional frankfurters based on lipid formulation, added seaweed and low salt content. Meat Sci 2009; 83(2): 255-62.
68. Pogorzelska E, Godziszewska J, Brodowska M, Wierzbicka A. Antioxidant potential of Haematococcus pluvialis extract rich in astaxanthin on colour and oxidative stability of raw ground pork meat during refrigerated storage. Meat Sci 2018; 135: 54-61.
69. Roohinejad S, Koubaa M, Barba FJ, Saljoughian S, Amid M, Greiner R. Application of seaweeds to develop new food products with enhanced shelf-life, quality and health-related beneficial properties. Food Res Int 2017; 99: 1066-83.
70. Schultz-Moreira AR, Benedi J, González Torres L, Olivero-David R, Bastida S, Sánchez-Reus M, González-Muñoz M, Sánchez-Muniz FJ. Effects of diet enriched with restructured meats, containing Himanthalia elongata, on hypercholesterolaemic induction, CYP7A1 expression and antioxidant enzyme activity and expression in growing rats. Food Chem 2011; 129(4): 1623-30.
71. Olivero-David R, Schultz-Moreira A, Vázquez-Velasco M, González-Torres L, Bastida S, Benedi J, Sánchez-Reus MI, González-Muñoz MJ, Sánchez-Muniz FJ. Effects of nori- and wakame-enriched meats with or without supplementary cholesterol on arylesterase activity, lipaemia and lipoproteinaemia in growing Wistar rats. Br J Nutr 2011; 106(10): 1476-86.
72. Schultz-Moreira A, Olivero-David R, Vázquez-Velasco M, González-Torres L, Benedí J, Bastida S, Sánchez-Muniz FJ. Protective effects of sea spaghetti-enriched restructured pork against dietary cholesterol: effects on arylesterase and lipoprotein profile and composition of growing rats. J Med Foo 2014; 17(8): 921-8.
73. Schultz-Moreira A, González-Torres L, Olivero-David R, Bastida S, Benedí J, Sánchez-Muniz FJ. Wakame and nori in restructured meats included in cholesterol-enriched diets affect the antioxidant enzyme gene expressions and activities in Wistar rats. Plant Foods Human Nutr 2010; 65(3): 290-8.
74. Fernández-Segovia I, Lerma-García MJ, Fuentes A, Barat JM. Characterization of Spanish powdered seaweeds: composition, antioxidant capacity and technological properties. Food Res Int 2018; 111: 212-9.
75. Lordan S, Ross RP, Stanton C. Marine bioactives as functional food ingredients: potential to reduce the incidence of chronic diseases. Mar Drugs 2011; 9(6): 1056-1100.
76. Bocanegra A, Macho-González A, Garcimartín A, Benedí J, Sánchez-Muniz FJ. Whole alga, algal extracts, and compounds as ingredients of functional foods: Composition and action mechanism relationships in the prevention and treatment of Type-2 Diabetes mellitus. Int J Mol Sci. 2021; 22(8): 3816.
77. González-Torres L, Vázquez-Velasco M, Olivero-David R, Bastida S, Benedí J, Raposo González R., González-Muñoz MJ, Sánchez-Muniz FJ. Glucomannan and glucomannan plus spirulina added to pork significantly block dietary cholesterol effects on lipoproteinaemia, arylesterase activity and CYP7A1 expression in Zucker fa/fa rats. J Physiol Biochem 2015; 71(4): 773-84.
78. González Torres L. Efectos sobre el metabolismo lipoproteico y estrés oxidativo en ratas Zucker fa/fa de cárnicos enriquecidos con glucomanano y espirulina. Tesis doctoral. Facultad de Farmacia. Universidad Complutense de Madrid, 2016.
79. Vázquez-Velasco M. Efectos del surimi de calamar enriquecido con glucomano y/o espirulina sobre marcadores del síndrome metabólico en ratas Zucker fa/fa. Tesis Doctoral Europea. Madrid: Facultad de Farmacia, Universidad Complutense de Madrid. 2015.
80. Santos López JA. Efectos del consumo de matrices cárnicas modificadas sobre marcadores del metabolismo lipídico y oxidación hepática. Facultad de Farmacia. Universidad Complutense de Madrid
Madrid. 2017.
81. Santos-López JA, Garcimartín A, López-Oliva ME, Bautista-Ávila M, González-Muñoz MJ, Bastida S, Benedí J, Sánchez-Muniz FJ. Chia oil-enriched restructured pork effects on oxidative and inflammatory status of aged rats fed high cholesterol/high fat diets. J Med Food 2017; 20(5): 526-34.
82. Konieczka P, Czauderna M, Smulikowska S. The enrichment of chicken meat with omega-3 fatty acids by dietary fish oil or its mixture with rapeseed or flaxseed-effect of feeding duration dietary fish oil, flaxseed, and rapeseed and n-3 enriched broiler meat. Anim Feed Sci Technol 2017; 223: 42-52.
83. Alagawany M, Elnesr SS, Farag MR, Abd El-Hack ME, Khafaga AF, Taha AE, Tiwari R, Yatoo MI, Bhatt P, Khurana SK, et al. Omega-3 and omega-6 fatty acids in poultry nutrition: effect on production performance and health. Animals 2019; 9(8):573.
84. Dannenberger D, Nuernberg K, Herdmann A, Nuernberg G, Hagemann E, Kienast W. Dietary PUFA intervention affects fatty acid- and micronutrient profiles of beef and related beef products. Foods 2013; 2(3): 295-309.
85. Wood JD, Richardson RI, Nute GR, Fisher AV, Campo MM, Kasapidou E, Sheard PR, Enser M. Effects of fatty acids on meat quality: a review. Meat Sci 2004; 66(1): 21-32.
86. Gómez-Estaca J, Pintado T, Jiménez-Colmenero F, Cofrades S. The effect of household storage and cooking practices on quality attributes of pork burgers formulated with PUFA- and curcumin-loaded oleogels as healthy fat substitutes. LWT Food Sci Technol 2020; 119: 108909.
87. Freire M, Cofrades S, Serrano-Casas V, Pintado T, Jimenez MJ, Jiménez-Colmenero F. Gelled double emulsions as delivery systems for hydroxytyrosol and n-3 fatty acids in healthy pork patties. J Food Sci Technol 2017; 54(12): 3959-68.
88. Sánchez-Muniz FJ, Olivero-David R, Triki M, Salcedo L, González-Muñoz MJ, Cofrades S, Ruiz-Capillas C, Jiménez-Colmenero F, Benedí J. Antioxidant activity of Hypericum perforatum L. extract in enriched n-3 PUFA pork meat systems during chilled storage. Food Res Int 2012; 48(2): 909-15.
89. Pintado T, Cofrades S. Quality characteristics of healthy dry fermented sausages formulated with a mixture of olive and chia oil structured in oleogel or emulsion gel as animal fat replacer. Foods 2020; 9(6): 830.
90. Bermejo LM, López-Plaza B, Weber TK, Palma-Milla S, Iglesias C, Reglero G, Gómez-Candela C. Impact of cooked functional meat enriched with omega-3 fatty acids and rosemary extract on inflammatory and oxidative status; a randomised, double-blind, crossover study. Nutr Hosp 2014; 30(5): 1084-91.
91. Kumar F, Tyagi PK, Mir NA, Dev K, Begum J, Biswas A, Sheikh SA, Tyagi PK, Sharma D, Sahu B, et al. Dietary flaxseed and turmeric is a novel strategy to enrich chicken meat with long chain omega-3 polyunsaturated fatty acids with better oxidative stability and functional properties. Food Chem 2020; 305: 125458.
92. Celada P, Delgado-Pando G, Olmedilla-Alonso B, Jiménez-Colmenero F, Ruperto M, Sánchez-Muniz FJ. Impact of improved fat-meat products consumption on anthropometric markers and nutrient intakes of male volunteers at increased cardiovascular risk. Nutr Hosp 2015; 32(2): 710-21.
93. Sánchez-Muniz FJ, Macho-González A, Garcimartín A, Santos-López JA, Benedí J, Bastida S, González-Muñoz MJ. The nutritional components of beer and its relationship with neurodegeneration and Alzheimer’s disease. Nutrients 2019; 11(7): 1558.
94. Sánchez-Muniz FJ, González-Muñoz MJ, Macho-González A, Benedí J, Garcimartín A, López-Oliva E, Santos-López JA, Bastida S, AFUSAN Research Group. Cuando el silicio transmuta en oro. JONNPR 2020; 5(2): 202-11.
95. Jurkic LM, Cepanec I, Pavelic SK, Pavelic K. Biological and therapeutic effects of ortho-silicic acid and some ortho-silicic acid-releasing compounds: new perspectives for therapy. Nutr Metabol 2013; 10: 2.
96. González-Muñoz MJ, Garcimartín A, Meseguer I, Mateos-Vega CJ, Orellana JM, Peña-Fernández A, Benedí J, Sánchez-Muniz FJ. Silicic acid and beer consumption reverses the metal imbalance and the prooxidant status induced by aluminum nitrate in mouse brain. J Alzheimers Dis 2017; 56(3): 917-27.
97. Garcimartín A, Merino JJ, Santos-López JA, López-Oliva ME, González MP, Sánchez-Muniz FJ, Benedí J. Silicon as neuroprotector or neurotoxic in the human neuroblastoma SH-SY5Y cell line. Chemosphere 2015; 135: 217-24.
98. Cofrades S, Bou R, Gómez-Nieto B, Procopio JR, Errabi A, Jiménez-Colmenero F. Physicochemical properties and encapsulation of silicon in double emulsions for healthier food applications. J Food Sci Technol 2016; 53(11): 3884-93.
99. Garcimartín A, López-Oliva ME, Macho-González A, Bastida S, Benedí J, Sánchez-Muniz FJ. Hypoglycaemic and hypotriglyceridaemic postprandial properties of organic silicon. J Funct Foods 2017; 29: 290-4.
100. Garcimartín A, López-Oliva ME, Santos-López JA, García-Fernández RA, Macho-González A, Bastida S, Benedí J, Sánchez-Muniz FJ. Silicon alleviates nonalcoholic steatohepatitis by reducing apoptosis in aged Wistar rats fed a high-saturated fat, high-cholesterol diet. J Nutr 2017; 147(6): 1104-12.
101. Hernández-Martín M, Bocanegra A, Redondo-Castillejo R, Macho-González A, Sánchez-Muniz FJ, Benedi J, Bastida S, García-Fernández R, Garcimartín A, López-Oliva ME. Could duodenal molecular mechanisms be involved in the hypocholesterolemic effect of silicon used as functional ingredient in late-stage type 2 Diabetes Mellitus? Mol Nutr Food Res. 2022; e2200104.
102. Mehta N, Ahlawat SS, Sharma DP, Dabur RS. Novel trends in development of dietary fiber rich meat products-a critical review. J Food Sci Technol 2015; 52(2): 633-47.
103. Saldaña P, Bastida S, Macho-González A, Sánchez-Muniz FJ. Functional foods as an alternative to increase the consumption of dietary fiber and proanthocyanidins. Possible effects on the gut microbiota. JONNPR 2020; 5(12): 1575-98.
104. Verma AK, Banerjee R. Dietary fibre as functional ingredient in meat products: a novel approach for healthy living – a review. J Food Sci Technol 2010; 47(3): 247-57.
105. Saura-Calixto F. Dietary fiber as a carrier of dietary antioxidants: an essential physiological function. J Agric Food Chem 2011; 59(1): 43-9.
106. Palafox-Carlos H, Ayala-Zavala JF, González-Aguilar GA. The Role of dietary fiber in the bioaccessibility and bioavailability of fruit and vegetable antioxidants. J Food Sci 2011; 76(1): R6-15.
107. Zhang H, Tsao R. Dietary polyphenols, oxidative stress and antioxidant and anti-inflammatory effects. Curr Opin Food Sci 2016; 8: 33-42.
108. Belščak-Cvitanović A, Durgo K, Huđek A, Bačun-Družina V, Komes D. 1 – Overview of polyphenols and their properties. En: Galanakis CM (Ed.). Polyphenols: Properties, recovery, and applications. Oxford: Woodhead Publishing, 2018; pp. 3-44.
109. Martínez-Huélamo M, Rodríguez-Morató J, Boronat A, de la Torre R. Modulation of Nrf2 by olive oil and wine polyphenols and neuroprotection. Antioxidants 2017; 6(4): 73.
110. Jiménez-Colmenero F, Cofrades S, Herrero AM, Ruíz-Capillas C. Implications of domestic food practices for the presence of bioactive components in meats with special reference to meat-based functional foods. Crit Rev Food Sci Nutr 2018; 58(14): 2334-45.
111. Shah MA, Bosco SJD, Mir SA. Plant extracts as natural antioxidants in meat and meat products. Meat Sci 2014; 98(1): 21-33.
112. Bastida S, Sánchez-Muniz FJ, Olivero R, Pérez-Olleros L, Ruíz-Roso B, Jiménez-Colmenero F. Antioxidant activity of carob fruit extracts in cooked pork meat systems during chilled and frozen storage. Food Chem 2009; 116(3): 748-54.
113. Bastide NM, Naud N, Nassy G, Vendeuvre JL, Tache S, Gueraud F, Hobbs DA, Kuhnle GG, Corpet DE, Pierre FHF. Red wine and pomegranate extracts suppress cured meat promotion of colonic mucin-depleted foci in carcinogen-induced rats. Nutr Cancer 2017; 69(2): 289-98.
114. Fernández J, García L, Monte J, Villar CJ, Lombo F. Functional anthocyanin-rich sausages diminish colorectal cancer in an animal model and reduce pro-inflammatory bacteria in the intestinal microbiota. Genes 2018; 9(3):133.
115. Macho-González A. Cárnicos funcionales enriquecidos en extracto de algarroba (Ceratonia siliqua, L.) en la prevención y tratamiento de la Diabetes Mellitus tipo 2. Tesis Doctoral Internacional. Madrid: Facultad de Farmacia. Universidad Complutense de Madrid 2021.
116. Macho-González A, Garcimartín A, López-Oliva ME, Bertocco G, Naes F, Bastida S, Sánchez-Muniz FJ, Benedí J. Fiber purified extract of carob fruit decrease carbohydrate absorption. Food and Function 2017; 8(6): 2258-65.
117. Macho-González A, Garcimartín A, Naes F, López-Oliva ME, Amores-Arrojo Á, Gonzales-Muñoz MJ, Bastida S, Benedi J, Sánchez-Muniz FJ. Effects of fiber purified extract of carob fruit on fat digestion and postprandial lipemia in healthy rats. J Agric Food Chem 2018; 66(26): 6734-41.
118. Vázquez-Velasco M, Esperanza Díaz L, Lucas R, Gómez-Martínez S, Bastida S, Marcos A, Sánchez-Muniz FJ. Effects of hydroxytyrosol-enriched sunflower oil consumption on CVD risk factors. Br J Nutr 2011; 105(10): 1448-52. Corrigendum in Br J Nutr 2011; 105(11): 1712.
119. Macho-González A, Garcimartín A, López-Oliva E, Benedí J, Bastida S, Sánchez-Muniz FJ. Papel de las proantocianidinas sobre la microbiota, permeabilidad intestinal e inflamación. En: Marcos A. Gómez-Martínez S (Eds.). Inmunonutrición. Estilo de vida. 2nd edición. Buenos Aires: Panamericana 2020. pp. 245-66.
120. Macho-González A, Garcimartín A, López-Oliva ME, Ruiz-Roso B, Martín de la Torre I; Bastida S, Benedí J, Sánchez-Muniz FJ. Can Carob-fruit-extract-enriched meat improve the lipoprotein profile, VLDL-oxidation, and LDL receptor levels induced by an atherogenic diet in STZ-NAD-diabetic rats? Nutrients. 2019; 11(2): pii:E332.
121. Macho-González A, López-Oliva ME, Merino JJ, García-Fernández RA, Redondo-Castillejo R, Bastida S, Sánchez-Muniz FJ, Benedí J. Carob fruit extract-enriched meat improves pancreatic beta-cell dysfunction, hepatic insulin signaling and lipogenesis in late-stage type 2 diabetes mellitus model. J Nutr Biochem 2020; 84: 10846.
122. Corella D, Coltell O, Portoles O, Sotos-Prieto M, Fernández-Carrión R, Ramírez-Sabio JB, Zanon-Moreno V, Mattei J, Sorli JV, Ordovas JM. A guide to applying the sex-gender perspective to nutritional genomics. Nutrients 2019; 11(1): 4.
123. Lai CQ, Smith CE, Parnell LD, Lee YC, Corella D, Hopkins P, Hidalgo BA, Aslibekyan S, Province MA, Absher D, et al. Epigenomics and metabolomics reveal the mechanism of the APOA2-saturated fat intake interaction affecting obesity. Am J Clin Nutr 2018; 108(1): 188-200.
124. Ferguson JF, Allayee H, Gerszten RE, Ideraabdullah F, Kris-Etherton PM, Ordovás JM, Rimm EB, Wang TJ, Bennett BJ. Nutrigenomics, the microbiome, and gene-environment interactions: new directions in cardiovascular disease research, prevention, and treatment: a scientific statement from the American Heart Association. Circ Cardiovasc Genet 2016; 9(3): 291-313.
125. Ferguson LR, De Caterina R, Görman U, Allayee H, Kohlmeier M, Prasad C, Choi MS, Curi R, de Luis DA, Gil Á, et al. Guide and position of the international society of nutrigenetics/nutrigenomics on personalised nutrition: Part 1 – Fields of precision nutrition. J Nutrigenet Nutrigenomics 2016; 9(1): 12-27.
126. Sales NMR, Pelegrini PB, Goersch MC. Nutrigenomics: Definitions and advances of this new science. J Nutr Metab 2014; 2014: 202759.
127. Sánchez-Muniz FJ, Canales A, Nus M, Bastida S, Guillen M, Corella D, Olmedilla-Alonso B, Granado-Lorencio F, Benedi J. The antioxidant status response to low-fat and walnut paste-enriched meat differs in volunteers at high cardiovascular Risk carrying different PON-1 polymorphisms. J Am Coll Nutr 2012; 31(3): 194-205.
128. Nus M, Frances F, Librelotto J, Canales A, Corella D, Sánchez-Montero JM, Sánchez-Muniz FJ. Arylesterase activity and antioxidant status depend on PON1-Q192R and PON1-L55M polymorphisms in subjects with increased risk of cardiovascular disease consuming walnut-enriched meat. J Nutr 2007; 137(7): 1783-8.
129. Aguirre-Portolés C, Fernández LP, Ramírez de Molina A. Precision nutrition for targeting lipid metabolism in colorectal cancer. Nutrients 2017; 9(10): 1076.
130. Ma N, Tian Y, Wu Y, Ma X. Contributions of the interaction between dietary protein and gut microbiota to intestinal health. Curr Protein Pept Sci 2017; 18(8): 795-808.
131. Jeon S-M, Shin E-A. Exploring vitamin D metabolism and function in cancer. Exp Biol Med 2018; 50(4): 20.