Soñar entre las rocas, por colinas y ríos, adentrase en silencio por regiones boscosas, donde está cuanto escapa al dominio del hombre, ¡donde huellas mortales tal vez nunca han llegado! Escalar por montañas invisibles, sin rastro, como animal salvaje; y a solas, embebido, contemplar las cascadas, los barrancos más altos; eso no es soledad: es más bien comulgar. Sumergirse en la magia de la naturaleza (Byron, 1906; tomado de El Diario de Edith Holden) (1).
1. INTRODUCCIÓN
El descubrimiento de la Insulina hace ya más de 100 años y su posterior utilización en humanos es probablemente uno de los acontecimientos científicos en el campo de la Medicina de mayor importancia y trascendencia del siglo XX. De hecho, a comienzos del siglo pasado la esperanza de vida de un individuo diagnosticado de diabetes no superaba el año de vida desde el diagnóstico.
El curso de la enfermedad era corto e irreversible, finalizando en cetoacidosis, coma y muerte. Los que sobrevivían cierto tiempo acababan muriendo por las complicaciones asociadas a esta patología; lesiones vasculares, enfermedad renal terminal, ceguera, amputación de extremidades inferiores etc. La única forma de evitar la rápida progresión de la enfermedad era a base de restricciones dietéticas, facilitando así la aparición de desnutrición en esa población. A este respecto el Dr. Frederick Allen reportaba en 1919 que tanto la glucosuria como la cetosis podían curarse siempre que se aplicara una dieta de fuerte restricción calórica al inicio de la enfermedad (2). También era típico la supresión total de los hidratos de carbono de la dieta, con elevadísimas cantidades de grasa que incidían muy negativamente sobre la salud cardiovascular de los pacientes.
Releyendo el “Epílogo” del III Curso Avanzado sobre Obesidad publicado en 2016 en un número especial de Anales de la Real Academia de Farmacia (3), podemos afirmar sin temor a equivocarnos, parafraseando a Joseph Conrad tal como lo describe Reverte (4), que en aquellos días de las dos primeras décadas del siglo XX los mapas de la Diabetes mostraban muchos terrenos ignotos alrededor de la insulina, y que para sus descubridores la visita a esos territorios, para ir “nombrando” y poniendo existencia a tales lugares, debía ser particularmente atractiva.
Es difícil conocer de forma precisa que fue lo que orientó a Banting, Best, McLeod, Collip y a otros por allá en los años previos al descubrimiento de la insulina, para que fuera posible la puesta en marcha de un engranaje complejo, que permitiera aislar, purificar, sintetizar, y tener décadas después, al alcance de la mano, una variedad enorme de insulinas para cada tipo y peculiaridad de enfermos con diabetes que precisan del aporte exógeno de esta hormona.
2. BREVE NOTA HISTÓRICA SOBRE DEL NOBEL CON EL QUE SE ORTOGÓ EL DESCUBRIMIENTO DE LA INSULINA
Alfred Nobel, posibilitó con su fortuna, la creación de un fondo para poder premiar a aquellas personas que sobresalieran de forma determinante en los campos de la Paz, Literatura, Fisiología o Medicina, Física y Química y muy posteriormente en Economía (5). Nobel, fue ingeniero e inventor, del que se conocen 350 inventos, sobresaliendo por razones evidentes, el de la dinamita, por su enorme importancia en el desarrollo de las vías de comunicación, pero también por su papel negativo y decisivo originado muchas muertes en las guerras pasadas.
Los Premios Nobel, instituidos por el químico e inventor Alfred Nobel en su testamento, y organizados y administrados desde hace más de un siglo por la Fundación Nobel, es uno de los galardones más prestigiosos del mundo y se concede tal como figura en la página oficial “For the greatest benefits to humankind” (traducción libre al castellano “Para mayor beneficio de la humanidad”).
Este premio, rodeado de anécdotas, de pequeñas o grandes errores, injusticias o anacronismos, es cada año un soplo de esperanza para muchos. No obstante, es paradójico, como nos dice Flexner (6), que en un mundo saturado de odios irracionales que amenazan a la propia civilización, algunos hombres y mujeres se alejen de esta tormenta venenosa y se entreguen a la extensión del conocimiento, al alivio de los que sufren, a la cura de las enfermedades. Queremos insistir de nuevo que muchos descubrimientos centrales en Medicina, por ejemplo el descubrimiento por Banting de la insulina, el de Minot y Whipple de la bondad del extracto de hígado en el tratamiento de la anemia perniciosa, tuvieron su origen en multitud de conocimientos teóricamente “inútiles” que habían acumulado muchos estudios de científicos “puros” realizados solo por el placer de probar, y que por suerte los escogidos (no sin esfuerzo) pensaron que había llegado el momento de plantear su utilidad (6).
Recordemos que la elección es realizada por el Comité del Nobel de Fisiología o Medicina que está integrado por un conjunto de científicos cualificados y profesores de prestigio, junto con personalidades a las que se ha otorgado el Premio Nobel de esa especialidad, donde el error humano es posible o donde el azar pueda desempeñar. Así, como señalan las bases de los Premios Nobel, los investigadores deben ser premiados en vida y puede ocurrir que, por el infortunio de la muerte, una vez otorgado el premio y nominados los galardonados, el Comité del Nobel tenga que replantearse y “olvidar” a personas que aportaron conocimientos centrales en los avances científicos que llevaron a dicho galardón (7). Así respecto al Premio Nobel de 1923, en el que se premió a los descubridores de la insulina, no deja de ser curioso a) la rapidez con la que se otorgó el premio (solo un año después de su descubrimiento) y b) a quién se concedió por la fundación del Nobel el preciado galardón en 1923 (8).
Es de todos conocido que el premio Nobel en Fisiología o Medicina de 1923 fue otorgado a Frederick G, Banting y John J. R. Macleod por el descubrimiento de la insulina; no obstante, la elección de los dos como laureados ha sido tema de debate desde su concesión. De hecho, fue muy inusual que se concediera el mismo año el premio Nobel a científicos que habían sido nominados por primera vez. Sin embargo, tal como puede observarse en el material archivado por el instituto Karolinska que concedió el premio, fue verdad para Banting y Macleod. Ellos publicaron su trabajo del descubrimiento de la insulina en 1922 y fueron nominados por primera vez en 1923.
Así según comentan De Leiva y col. (8) (sic) “El 25 de octubre de 1923, los 19 profesores del Karolinska Institutet decidieron en voto secreto la concesión del Premio Nobel de Fisiología y Medicina a Frederick Grant Banting y John James Richard Macleod, del Departamento de Fisiología de la Universidad de Toronto, por el descubrimiento de la insulina, publicado en 1922. Banting fue nominado por GW Crile (Cleveland), FG Benedict (Boston), y August Krogh; Macleod fue propuesto por GN Stuart (Cleveland) y también por August Krogh”.
Esta decisión generó reclamaciones, formuladas por el alemán Georg Ludwig Zuelzer, los norteamericanos Ernest Lyman Scott y John Raymond Murlin, y el rumano Nicolae Constatin Paulescu. Años después, Charles Herbert Best, colaborador de Macleod y Banting, también reclamaría para sí mismo la primacía en el descubrimiento.
Así la Fundación Nobel reconocía que en la documentación que sirvió como base para la concesión del premio no se había tenido en cuenta el primer trabajo publicado por Banting y Best en 1922 (9). En este mismo informe se puntualizaba que Best y Collip habían sido considerados como ayudantes y, por tanto, no eran primeros candidatos al galardón.
En cualquier caso, como apuntaba el historiador Michael Bliss, los cuatro investigadores, Banting, Best, Mcleod y Collip, fueron esenciales para el descubrimiento de la insulina (10).
Es muy interesante el material archivado por el instituto Karolinska en relación con el Premio Nobel otorgado a los descubridores de la insulina (9). Recogemos el informe de August Krong, según se cita por De Leiva y col. (8) (sic) «With the information which I personally have obtained in Toronto, and which also, although less clearly so, emerges from the published works, one may conclude that the credit for the idea behind the work which led to the discovery, undoubtedly goes to Banting, who is a young and apparently very talented man. However, he would definitely not have been able to carry out the investigations, which from the start and during all stages, have been supervised by Professor Macleod».
Otros integrantes de la comisión, como Jacobeous, encontraron más difícil la decisión. Exponemos textualmente las palabra de Jacobeous según se citan en el artículo de De Leiva y col. (8) (sic): «Dr. Banting, who undoubtedly was the first to have the idea and who has carried out the investigations, should be the one who in the first place is awarded the prize. On the other hand, it is difficult to evaluate Macleod’s contribution. It is not apparent from the literature. Macleod, who is the head of the department in Toronto, has previously carried out investigations on blood sugar. Banting came to Macleod with his idea and purified insulin under the direction of Macleod. I have been told that it is very likely, that the discovery would never have been made if Macleod had not guided him, at least not as early as it turned out. It has even been declared that Banting planned experiments that would not have been successful unless corrected by Macleod. On the basis of what has been said I am most inclined that Banting and Macleod jointly receive the Nobel Prize.”
El flujo de correspondencia no fue escaso por aquellos días respecto a la nominación y el propio August Krong en enero de 1923 mandaba en una misiva dirigida a Göran Liljestrand lo siguiente (sic) “As you understand from my discourse it is my opinion that the discovery of insulin is of extraordinary both theoretical and practical importance and it will hardly surprise you that I intend to submit a nomination that the Nobel Prize be awarded to Dr. Banting and Professor Macleod.”
Un año más tarde, en febrero de 1924 August Krong dirigía a Göran Liljestrand la siguiente misiva (sic): “I understand that the prize to Banting and Macleod ignoring other coworkers has not been met with absolute consent on the other side of the Atlantic Ocean and that especially Banting is offended by the fact that Best was not included. However, I am convinced that the correct choice was made.”
Por razones de espacio y contenido de este artículo no comentaremos más “in extenso” la fuerte controversia que surgió en aquellos días, pero hace pensar que el camino del Nobel de 1923 no fue un camino de rosas y que detrás de uno de los descubrimientos más importantes de la medicina, hubo varios científicos enemistados que se enfrentaron.
El propio Banting, en contestación a si investigadores como Paulescu, Zuelzer y otros, como el científico de Rockefeller, Israel Kleiner, merecían algún crédito por el descubrimiento de la insulina, dijo estas palabras (traducción libre del inglés) “Ninguno de ellos convenció al mundo de lo que tenían… Esto es lo más importante en cualquier descubrimiento. Tienes que convencer al mundo científico. Y nosotros lo hicimos”.
También, no deja de ser curiosa la reacción del propio Banting al conocer que había sido galardonado con el Nobel (11). Se cuenta que cuando el teléfono de Frederick Banting sonó una mañana de octubre de 1923, al otro lado de la línea, un amigo emocionado le preguntó si había visto los periódicos de la mañana. Cuando Banting respondió que no, su amigo le dio la noticia: “Acabas de recibir el premio Nobel por tu descubrimiento de la insulina”. Banting le dijo a su amigo que “se fuera al infierno” y colgó el auricular. Luego salió de casa y compró el periódico de la mañana. En los titulares, vio en blanco y negro que sus peores temores se habían hecho realidad. Era cierto que había recibido el Nobel, pero también se lo habían dado a su jefe, John Macleod, profesor de fisiología en la Universidad de Toronto.
3. BREVE RESEÑA DEL DESCUBRIMIENTO DE LA INSULINA
El trabajo realizado en la Universidad de Toronto (Canadá) en 1921-22, es para algunos autores (12-15) el evento más “dramático” de la historia del tratamiento de una enfermedad, hoy conocida como Diabetes Mellitus tipo I, hasta aquellos tiempos inevitablemente mortal, siendo pues el impacto de sus resultados increíblemente sensacional. En las siguientes líneas hacemos una somera referencia de los aspectos más importantes que coincidieron en aquel evento.

Figura 1. Frederick Banting y John Macleod. Fisher Insulin Collection, Rare Book Library, University of Toronto.
El Dr. Frederick Grant Banting era un médico canadiense, que estudio en la Universidad de Toronto. Durante la primera guerra mundial fue médico militar. Al finalizar esta, regresa a Canadá en 1919, para completar su formación como cirujano ortopedista, inicia una residencia en cirugía general en un hospital pediátrico en Toronto, posteriormente decide trabajar en medicina privada donde ejerció como médico poco tiempo en Londres Ontario, un pueblo a 200 kilómetros de Ontario. Para ayudarse económicamente acepta trabajar como asistente de profesor en la escuela de medicina de la Universidad del Occidente de Ontario, donde le encargan preparar una clase sobre fisiología y metabolismo de los hidratos de carbono, materia que no le era muy familiar. El domingo 30 de octubre de 1920 estuvo estudiando y preparando su clase hasta altas horas de la noche y leyó un artículo de Moses Barron sobre la relación de los islotes de Langerhäns y la diabetes, en especial con la litiasis pancreática. En la madrugada del lunes 31 despertó súbitamente a las dos de la madrugada pensado en diseñar un protocolo de investigación para aislar la insulina. Consistía en ligar el conducto pancreático de un perro, mantenerlo vivo, esperando la degeneración de los acinis glandulares de la secreción externa pancreática, liberando las células de Langerhäns. A la mañana siguiente viajó a Toronto para solicitar una entrevista con el Dr. Miller quién a pesar de no convencerle el proyecto de Banting, le sugirió ir a la Universidad de Toronto a solicitar una entrevista con el Profesor John James Rickard Macleod, reconocido científico escocés, considerado una autoridad en el metabolismo de los carbohidratos en la Escuela de Medicina de la Universidad de Toronto. Banting fue a Toronto para proponerle su proyecto y solicitarle asesoría. Posiblemente el entusiasmo, pasión y confianza del joven médico ayudaron a convencer al profesor quien, le proporcionó un equipado laboratorio y un asistente el Dr. Best.
Figura 2. Charles Best (izq) y Frederick Banting (der) con uno de los perros del laboratorio en la Universidad de Toronto. Agosto de 1921. Thomas Fisher Rare Book Library, University of Toronto. https://www.bbc.com/mundo/noticias-59937796#:~:text=Frederick%20Banting%20gan%C3%B3%20en%201923,su%20descubrimiento%20de%20la%20insulina
Desde los tres primeros meses del proyecto contó con la colaboración de Charles Best, estudiante graduado que en ese momento rotaba por el hospital. Fue el profesor Mcleod quien sugirió la idea de utilizar a un experto bioquímico para purificar y refinar el extracto de hormona conseguida a la que llamaron “isletina”. A tal efecto convenció al Dr. James Collip, joven profesor de bioquímica de la Universidad de Alberta Canadá, para que se uniera a su grupo de trabajo y continuar con las investigaciones.
Banting y Best iniciaron su proyecto de investigación el 17 de mayo de 1921, bajo la supervisión de Macleod. Los experimentos iniciaron en mayo de 1921 bajo la supervisión del Dr. Collip, el inicio tuvo sus dificultades, ya que los primeros perros operados murieron por importante pérdida de sangre y severas infecciones. Pronto mejoraron su técnica quirúrgica y continuaron buscando la acción de la hipotética secreción endocrina hipoglucemiante en el páncreas canino. El 3 de agosto de 1921 en un perro pancreatectomizado diabético llamado Marjorie encontraron el befecto hipoglucemiante buscado en uno de sus extractos.
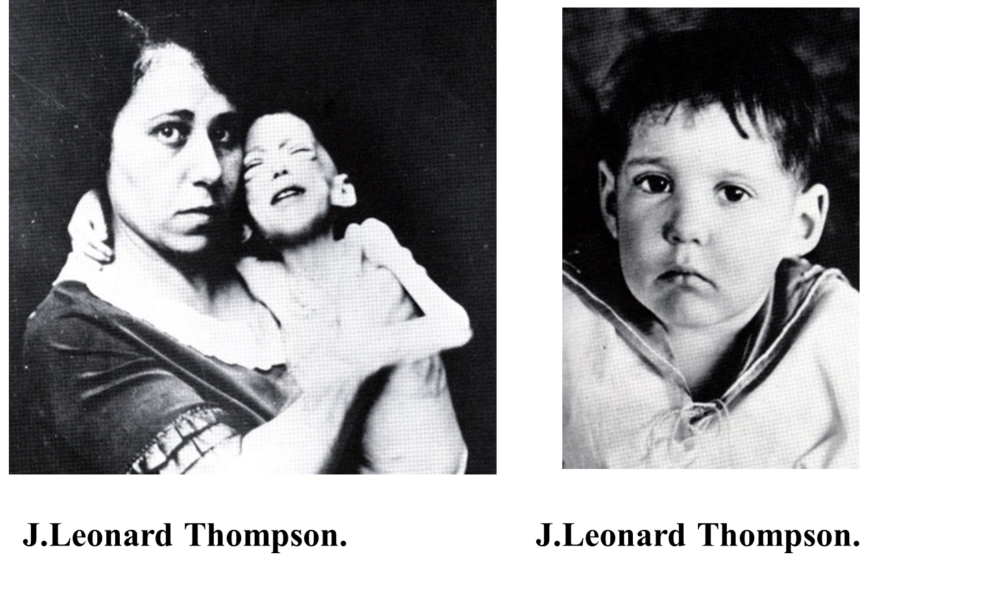
El 11 de enero de 1922, menos de 6 meses después de los experimentos en perros, un niño diabético de 14 años con un peso aproximado de 29,5 kg llamado Leonard Thompson (Figura 3) fue la primera persona en el mundo en recibir la insulina.
Figura 3. Paciente Leonard Thompson antes y después de recibir tratamiento con insulina (McCormick). Fotos cortesía de Elli Lilly.
Aunque los efectos en el descenso de la glucosa fueron mínimos, afortunadamente no presentó severos efectos colaterales. El 23 de enero recibió un segundo extracto, con algunas modificaciones realizadas por el Dr. Collip buscando una mayor pureza, donde se encontró una rápida respuesta en el descenso de la glucemia. Vivió 13 años con el tratamiento y murió de una neumonía a la edad de 27 años.
La segunda persona en recibir la insulina fue una niña llamada Elizabeth Evans Hughes quien padeció diabetes desde los 11 años y pesaba solo 34 kilogramos. Elizabeth era hija del Gobernador del Estado de Nueva York, Evans Hughes, lo que facilitó, que la madre de Elizabeth contactara con el Dr. Banting, quién aceptó tratarla. Vivió hasta los 74 años. Se menciona que cuando murió había recibido aproximadamente 42.000 inyecciones de insulina.
4. BREVE RECUERDO HISTÓRICO DE LA RELACIÓN DE LA DIABETES Y LA INSULINA
La diabetes mellitus es una de las enfermedades más prevalentes en el mundo siendo la cuarta o quinta causa de muerte en los países industrializados y con perspectivas de aumentar dramáticamente las cifras de afectados, especialmente en países de medio o bajo perfil económico. En el año 2019 había 463 millones de personas con Diabetes Mellitus y las previsiones apuntan a que se alcancen los 700 millones en el año 2045. Efectivamente, la Diabetes Mellitus está considerada como uno de los retos sanitarios más importantes a combatir en el siglo XXI (IDF, 2019) (16). Desde un punto de vista estrictamente económico la “International Diabetes Federation” (IDF) ha informado de que los costes de la Diabetes Mellitus a nivel mundial se elevaron en 2014, al menos, a 612.000 millones de dólares siendo el gasto sanitario “per cápita” de dos a tres veces mayor en los sujetos con Diabetes que sin ella, lo que equivale, según las mismas fuentes, al 11% del gasto sanitario total. Se incluyen en esta partida los gastos derivados del cuidado de las complicaciones agudas (hipoglucemias y cetoacidosis) y crónicas (enfermedades coronarias, nefropatía, etc.) causadas por la enfermedad.
La evidencia escrita más antigua sobre la descripción de los síntomas de la Diabetes Mellitus la encontramos en el papiro de Ebers que data unos 1550 años antes de Cristo (aC) donde se definen aspectos de la poliuria de Imhotep, sacerdote y ministro del faraón Zosser en el año 3.000 aC. Posteriormente, Arateus de Capadocia introdujo la palabra diabetes para denominar la “licuefacción de la carne y los huesos en orina”. Definiendo la diabetes en el siglo I (17) de la siguiente forma: “La diabetes es una maravillosa afección no muy frecuente entre los hombres, caracterizada por la fusión de la carne y los miembros en orina. Su curso es de naturaleza fría y húmeda como un edema afectando por regla general a riñones y vejiga; los pacientes orinan continuamente y el flujo es incesante. Como si se abriera un acueducto. La naturaleza de la enfermedad es crónica tardando un largo periodo en formarse, pero una vez establecida la enfermedad, el paciente tiene una corta esperanza de vida ya que la fusión es rápida y la muerte veloz”.
La diabetes deriva su nombre del griego “fluir”, como referencia a uno de sus síntomas más comunes y por el cual el médico inglés del siglo XVII Thomas Willis (1625-1675) le dio el nombre mucho más memorable de “mal de mear” (18).
Distintas interpretaciones del sabor dulce de la orina, más o menos pintorescas, surgen desde el siglo I hasta que en 1859 Claude Bernard descubre que tal sabor se debe a la glucosa sanguínea derivada de una secreción glucogénica del hígado, adjudicando a este órgano un papel central en el desarrollo de la Diabetes Mellitus.
Pero quizás los primeros antecedentes de este gran descubrimiento inician en 1778 con la publicación del Dr. Thomas Cowley en Inglaterra quien describe el caso de un hombre de 33 años que muere seis meses después con el diagnóstico de diabetes, a quien en los hallazgos de la autopsia le encuentran lesiones atróficas en el páncreas, con la presencia de un cálculo que obstruyó el conducto de las secreciones pancreáticas exocrinas que desemboca en el duodeno (12).
Es importante mencionar al estudiante alemán Paul Langerhäns, discípulo del Dr, Rudolf Virchow que ya en 1869 describió en su tesis doctoral a un grupo de células pancreáticas diferentes al resto de las que conformaban el tejido pancrático. Más tarde, Gustave Laguese, reconocía que ese grupo de células podría desempeñar otra función distinta a la secreción del jugo pancreático y los denominó islotes de Langerhäns (19).
Posteriormente Bouchardat y Lancereaux se convirtieron en los más fervientes defensores del páncreas como órgano fundamental en la etiología de la Diabetes Mellitus. Aquél, ya distinguía, al menos, dos tipos diferentes de Diabetes Mellitus: una grave que se presentaba en jóvenes y que no respondía satisfactoriamente a terapia con dieta y otra en adultos obesos en los que el tratamiento a base de diferentes dietas y ejercicio producía unos resultados excelentes. El comportamiento clínico y los descubrimientos “post mortem” llevaron a asegurar a Bouchardat que la forma más grave tenía un origen pancreático. Lancereaux y su equipo por su parte, llegaron a la misma conclusión sobre la etiología de la enfermedad e introdujeron dos términos para definir ambos tipos: la diabetes de los delgados y la diabetes de la grasa (20).
En 1889 Joseph Von Mering mientras investigaba sobre la función del páncreas en la digestión y absorción de grasa y basándose fundamentalmente en los trabajos de Claude Bernard, comprendió que para un animal era prácticamente imposible sobrevivir tras una pancreatectomía. Consultó con Óscar Minkowski, científico que trabajaba con Albert Naunyn prestigioso clínico de la época experto en Diabetes Mellitus, con objeto de llevar a cabo experimentos en perros y comprobar la certeza de su teoría. Sin desanimarse por trabajos anteriores, operaron a dos perros y observaron cómo ambos animales sobrevivían sin páncreas y, sorprendentemente, presentaban al día siguiente un cuadro de frecuentes y abundantes micciones. Ante esta nueva situación Minkowski se encargó de estudiar detalladamente la Diabetes Mellitus y sus desviaciones metabólicas y, tras dos años de experimentos, llegó a demostrar que el páncreas era una glándula de secreción interna y que una pequeña parte de ella, cuando se implantaba subcutáneamente a un perro desprovisto de páncreas, prevenía la aparición de hiperglucemia hasta que se eliminaba el implante o bien hasta que degeneraba espontáneamente (21). Posteriores desarrollos permitieron la medida de la glucemia estableciéndose como un dato seguro y fiable para el diagnóstico de la enfermedad.
Entre 1895 y 1921 los experimentos en esta área se centraron en dos aspectos: por un lado, el estudio histológico de los islotes de Langerhäns que desembocaron en la identificación de distintos tipos de células capaces de secretar varias hormonas y enzimas además de la insulina, y por otro, el estudio de la propia molécula de insulina con intención de utilizarla como recurso terapéutico.
Así, en los inicios del siglo XX, Georg Zuelzer en Alemania y D.A. Scott en los Estados Unidos de Norteamérica intentaron la administración de extractos pancreáticos en humanos pero no lograron resultados reproducibles, posiblemente debidos a lo crudo de sus extractos y a la falta de pureza de la secreción interna por su contaminación con otras proteínas provenientes de las enzimas proteolíticas y la amilasa de los jugos pancreáticos de la secreción externa, con la presencia severos efectos colaterales, además del anhelado efecto hipoglucemiante.
En este sentido los requerimientos para su uso eran muy exigentes. Así, el preparado resultante debía tener la suficiente potencia, tenía que revertir las anormalidades metabólicas producidas en un animal desprovisto de páncreas, los signos, síntomas y anormalidades químicas de la diabetes humana y, por último, carecer de efectos secundarios.
El inicio de la primera Guerra Mundial que, entre muchos otros inconvenientes, tales como hambruna, inseguridad, angustia de la sociedad e importantes daños al medio ambiente, paralizó la investigación a nivel mundial, dejando en espera el buscado asilamiento y purificación de la misteriosa secreción interna del páncreas, que para esos tiempos ya contaba con el nombre de Insulina propuesto en 1909 por el investigador de Bélgica J. de Meyer y en Inglaterra en 1916 por E.A. Schafer.
Finalmente, y como hemos indicado en la sesión anterior, en el verano del 1921 comenzaron los experimentos que conducirían a la extracción comercial de la insulina en la universidad de Toronto.
John J.R. Macleod, profesor de fisiología facilitó su laboratorio para que se realizara un proyecto experimental consistente en ligar el ductus pancreático en perros. Frederick Banting, cirujano, y Charles Best estudiante de cuarto año de fisiología, empezaron a trabajar en ello bajo la supervisión de Macleod.
Tras algunas discusiones sobre el procedimiento a seguir Banting y Best lograron obtener extractos de material pancreático que descendían los niveles de glucosa en sangre en animales de experimentación con y sin diabetes (22). Macleod, sin embargo, pensaba que era necesaria experiencia en el campo de la bioquímica y para ello contó con James Collip, un joven profesor de esta disciplina que estaba pasando un año sabático en el departamento, logró finalmente incorporarse al equipo. Collip empezó a preparar extractos alcohólicos de páncreas fresco mediante técnica de evaporación al vacío; uno de los extractos de vaca fue empleado para tratar al primer paciente que recibía insulina en la historia, Leonard Thompson de 14 años. El muchacho, aunque experimentó un modesto descenso de la glucemia presentó un absceso en el lugar de la inyección, lo que se interpretó como que el preparado todavía presentaba un grado de impureza que desaconsejaba su utilización en tratamientos prolongados así que se procedió a interrumpir el tratamiento recién establecido. Mientras tanto, Collip desarrolló una técnica para separar el principio activo del extracto pancreático de vaca mediante precipitación a una concentración del alcohol diferente a de la de otras proteínas contaminantes. El nuevo tratamiento aplicado a Leonard Thompson con el extracto así conseguido fue todo un éxito ya que no solo bajaba la glucemia, sino que lo hacía sin efectos secundarios relevantes (23).
En la tabla 1 se resumen muchos hitos relacionados con la insulina y su obtención y comercialización desde 1923 (utilización de técnicas
Figura 4. Envases originales de las primeras insulinas comercializadas por Eli Lilly & Company, Indianapolis – USA. Walter Cicchetti / Alamy Stock Photo
con punto isoeléctrico, definición de la unidad internacional de insulina, insulina protamina, adición de zinc, insulina globina, insulina NPH, insulinas U100, insulinas de un solo pico, introducción clínica de las bombas de insulina, disponibilidad de insulinas recombinantes, descubrimientos de análogos).
Tabla 1. Hitos más importantes en el descubrimiento, obtención y comercialización de la insulina y sus análogos
En la década de los años 1930-1940, la retinopatía y la nefropatía fueron reconocidas como complicaciones específicas no sólo de los pacientes diabéticos que habían recibido insulina durante muchos años, sino de aquellos con grados más ligeros de hiperglucemia y que no habían seguido tratamiento insulínico. En muchos de esos trabajos, de manera implícita, ya se hablaba de enfermedades macrovasculares concomitantes (26, 27). Más tarde, el Dr. Bell en su monumental estudio sobre arterioesclerosis puso de manifiesto la alta incidencia de enfermedades coronarias en pacientes diabéticos (28).
Allá por 1960 ya se distinguían claramente dos tipos de Diabetes Mellitus una primaria, hereditaria y asociada a un déficit de insulina que representaba la enfermedad clásica conocida y otra secundaria a otras causas (enfermedades pancreáticas, endocrinopatías, etc.). En 1961 Conn y Fajans definieron una historia natural de la Diabetes Mellitus primaria que constaba de las siguientes fases: prediabetes, diabetes subclínica, diabetes latente y diabetes clínica o manifiesta (29). Cuando el recorrido por estas fases era rápido los autores aseguraban que la Diabetes Mellitus aparecería de forma aguda y sería de comienzo juvenil, mientras que si el agotamiento de la célula b era más lento pasaría por todas las fases y la presentación de la enfermedad se daría en el adulto. Toda esta historia natural representaría el progresivo agotamiento de la célula b dañada por el trastorno genético previo y sería un proceso dinámico con progresiones y eventuales regresiones, en donde las complicaciones asociadas a la Diabetes Mellitus podrían presentarse en cualquier fase. El cuadro clínico completo se reflejaría en dos tipos de pacientes: Diabetes Mellitus infanto-juvenil y Diabetes Mellitus de la madurez, siendo la edad la única diferencia entre ambas y, por tanto, serían diferentes grados y peculiaridades de un mismo trastorno. Todos estos conceptos estuvieron vigentes durante muchos años, pero la aplicación de métodos más precisos sobre la base genética de la enfermedad y la mejor interpretación de los factores ambientales y sociales, demostraron que la aparente uniformidad de este esquema no se correspondía con la realidad.
La introducción de las técnicas de radioinmunoanálisis permitió comprobar que muchos pacientes diabéticos presentaban niveles de insulina en sangre tanto normales como, en algunos casos, elevados. Estas observaciones pusieron de manifiesto que la Diabetes Mellitus no era debida solamente a la ausencia de insulina, como se pensó durante mucho tiempo, sino que podría ser también el resultado de un problema en la acción de la insulina o, simplemente, un defecto de la propia molécula. Este hallazgo contribuyó a proporcionar una heterogeneidad patogénica muy considerable a la Diabetes Mellitus. A la luz de estos y otros descubrimientos la clasificación y el diagnóstico fueron evolucionando con el tiempo hasta llegar al año 1979, cuando un comité de expertos revisó la clasificación y los criterios diagnósticos y publicó un informe. Posteriormente en 1997 y 1999, tal informe fue actualizado, para introducir cambios en el diagnóstico de la diabetes mellitus gestacional (30).
Históricamente la insulina se extrajo de material pancreático obtenido de diferentes especies animales entre ellas las ovejas, vacas, cerdos, ballenas etc., aunque con la que se inició la terapia en pacientes con diabetes mellitus eran de cerdo y vaca, probablemente por la similitud de la secuencia de aminoácidos con la insulina humana y por la gran disponibilidad de estos animales en los mataderos. No obstante, a pesar de la semejanza, y por razones inmunológicas se empezó a aislar insulina humana (31) de páncreas humanos en los años 1960, pero las cantidades así conseguidas eran muy limitadas, sin olvidar los problemas éticos que se plantearon. Por ello, y a raíz del conocimiento cada vez más detallado del ADN y de la posibilidad de su manipulación y a través de procesos de fermentación en ciertos microorganismos se logró obtener una insulina con idéntica secuencia de aminoácidos que la humana (insulina recombinante) en cantidades lo suficientemente grandes para abastecer la demanda de los canales de suministro del todo el mundo (32). En septiembre de 1978, un equipo de científicos del Hospital City of Hope en el sur de California y la empresa de biotecnología Genentech en San Francisco anunciaron que ya los pacientes con diabetes tipo I no tenían que tratarse inyectándose insulina recuperada de los tejidos de vacas o cerdos como subproducto de la industria cárnica, sino que podían, por primera vez, inyectarse insulina humana. En la mañana del 14 de octubre de 1980, los corredores de bolsa se sumergieron en un frenesí para comprar las acciones de la recién lanzada Genentech, que hizo multimillonarios a sus fundadores, el capitalista de riesgo Bob Swanson y el científico Herb Boyer (32).
La compañía Eli Lilly utilizó Escherichia coli como elemento huésped mientas que Novo Nordisk optó por el Saccharomyces cerevisiae para la producción de insulina humana (Tabla 1).
Así, como quiera que la insulina tiende a formar hexámeros durante su almacenamiento, la disociación en monómeros activos en el lugar de la inyección se vuelve lenta de forma que la tasa de absorción es pequeña y, por tanto, la entrada a la circulación sanguínea resulta menor de lo esperado. Los análogos de insulina rápida se crearon con la intención de solucionar el problema. Pequeñas modificaciones en la estructura de la molécula mantendrían la insulina en forma de monómeros aumentando la velocidad de absorción y de difusión, eso sí reteniendo la afinidad por su receptor. Así al análogo “Lyspro”, comercializado por Lilly en su momento, consiste en sustituir la Prolina y la Lisina de las posiciones B28 y B29 por Lisina y Prolina respectivamente consiguiendo así el efecto deseado. Novo Nordisk, por su parte, decidió cambiar la posición B28 por ácido aspártico. La presencia de un ácido en el grupo carboxilo terminal impide la formación de hexámeros por su carga negativa. Ambas moléculas logran una mayor rapidez de acción controlando mejor las excursiones de glucosa tras la ingesta.
Otro aspecto que debe resaltarse es la importancia de reducir la glucemia en ayuno, lo que dio lugar a la aparición de los análogos de acción retardada. El primer análogo de insulina retardada aprobada para su uso clínico fue la glargina de la compañía Aventis. “Glargina” contiene dos modificaciones estructurales de la molécula de la insulina humana; primero se añaden dos Argininas en la región carboxilo terminal de la cadena B (B31 arg y B32 arg, posiciones no presentes en la insulina humana) de esta forma se cambia el punto isoeléctrico de la proteína desde pH 5,4 a pH 6,7, lo que provoca un cambio en la solubilidad, así se vuelve más soluble a pH ácido, pero menos a pH neutro. Como el análogo se conserva en pH ácido es necesario otra modificación para evitar la desaminación de la Asparagina en posición 21. Se logra sustituyendo la Asparagina por glicina en la posición A21. Al ser menos soluble a pH fisiológico subcutáneo, una vez inyectado el análogo se formará un microprecipitado que se va absorbiendo lentamente. En teoría, tras su inyección se consigue un perfil plano sin picos que ayuda a mantener la glucemia basal estabilizada durante su tiempo de acción, de 20 a 24 horas. “Detemir” es un análogo de insulina de acción prolongada obtenido mediante la adición de ácido mirístico (un ácido graso de 14 carbonos) en posición B29 así como la eliminación de la Treonina en la B30. Esta modificación, permite establecer una unión reversible con la albúmina sérica, incrementando la vida media del análogo. También presenta una duración de acción cercana a las 24 horas lo que le otorga un perfil adecuado para ser utilizado de forma basal.
Recientemente se han comercializado nuevos análogos que dependiendo de su mecanismo de acción se pueden dividir en “ultra-rápidos” y “de acción prolongada”. En realidad, desde que se descubrió la insulina todos los esfuerzos para encontrar una terapia eficaz se han encaminado a reproducir el modo de actuación de la insulina en el organismo. La insulina se almacena en gránulos secretores de las células b pancreáticas y no son liberadas al torrente sanguíneo hasta que se produzca una señal específica que estimule la exocitosis (33). La presencia de glucosa en sangre, pero particularmente el cambio de concentración de la glucemia actúa como el estímulo principal para la liberación de insulina, siguiendo un patrón determinado, ya que si nivel de glucosa se eleva lentamente la secreción de insulina será igualmente lenta. Si por el contrario existe una subida abrupta de la glucosa, la secreción de insulina sigue un patrón bifásico; a un “pico” inicial como respuesta le sigue una secreción más lenta. Esta rápida respuesta es esencial para el mantenimiento de una homeostasis óptima de la glucosa. La pérdida de esta característica se ha considerado como un signo precoz de disfunción de la célula b (34). Con los nuevos análogos Insulina “Aspart”, “Glulisina de acción ultra-rápida” (comienzo de acción a los 15 minutos) o la “insulina Degludec” con acción prolongada (libera insulina hasta 42 horas tras la administración) se pretende satisfacer las necesidades terapéuticas para un mejor control de la glucosa en sangre.
En el caso de “Degludec” la molécula ha sido obtenida por omisión de la Treonina en la posición B30 sustituyéndola por una cadena compuesta por ácido glutámico y un ácido graso de 16 carbonos. “Aspart” es un análogo obtenido sustituyendo la prolina de la posición B38 por una molécula de ácido aspártico y la “Glulisina” se obtiene reemplazando la asparagina de la posición B3 por lisina y la lisina de la posición B29 por ácido glutámico.
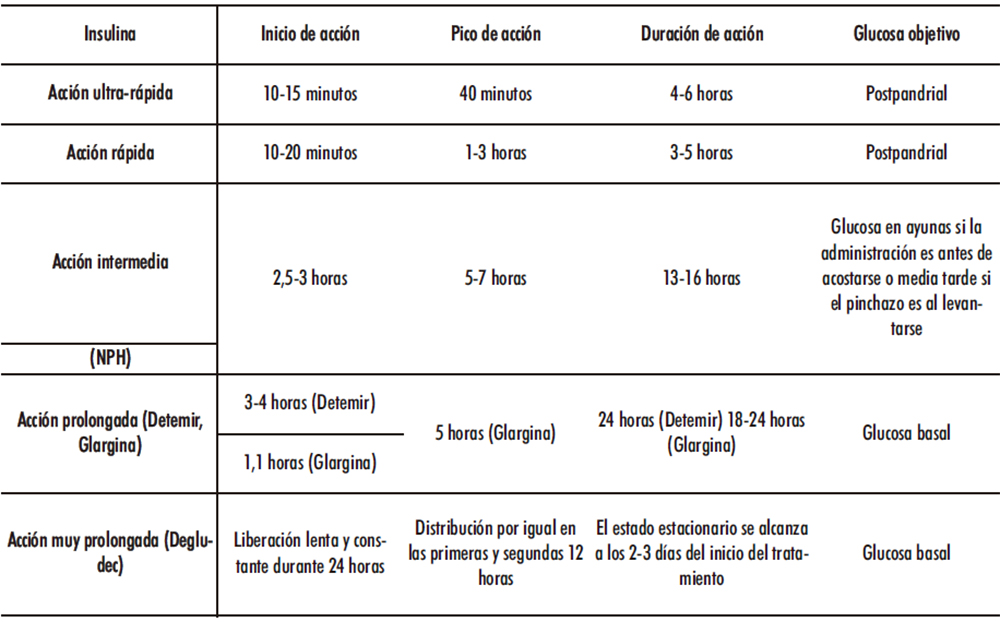
En las Tablas 2 a 4 se presentan un resumen de los diferentes tipos de insulina y sus aplicaciones terapéuticas dependiendo de su mecanismo de acción, de su estructura química y de su acción farmacocinética.
Tabla 2. Tipos de insulina atendiendo a su mecanismo de acción.
Tabla 3. Tipos de insulina atendiendo a su estructura química
Tabla 4. Tipos de insulina atendiendo a sus características farmacocinéticas tras inyección subcutánea
Dadas las características de este artículo no insistiremos más en los diferentes tipos de insulinas actualmente existentes, pero se recomienda la visita a la Web de la Real Academia Nacional de Farmacia y en particular al VI Curso Avanzado sobre Obesidad y Síndrome Metabólico, en particular a la ponencia del Dr. Mario García Gil (35) titulada “El mundo de las insulinas en la diabetes tipo 2 y el síndrome metabólico”. Según este mismo autor, las variaciones de los niveles de glucosa en sangre van a generar o condicionar variaciones en la producción y secreción de insulina. Por ello, existirá una secreción basal de insulina y una secreción prandial, por lo que en situaciones de diabetes tipo 2 se deberán medir tanto los niveles de glucosa basal en ayunas como los prandiales para establecer la pauta posológica de insulina (35).
Muy interesante y de utilidad práctica para el manejo de la diabetes tipo 2 es la utilización de algoritmos terapéuticos acuñados por sociedades científicas nacionales e internacionales que establecen los escalones terapéuticos según los niveles de hemoglobina glicosilada y condicionantes clínicos, siendo las insulinas un escalón tardío a utilizar o en situaciones clínicas concretas. Hoy día, existe una amplia gama de insulinas en el mercado siendo las recombinantes, fabricadas mediante biotecnología, las más usadas tanto en su uso en forma de bolos por picos prandiales, como las de acción prolongada para controles de niveles basales (35). En este último caso, se han desarrollado insulinas que, mediante formulación galénica han ralentizado su absorción, con el objeto de evitar las pautas posológicas cada 12 horas, permitiendo su administración cada 24 horas, con el objetivo de mejorar la calidad de vida del paciente y su cumplimento terapéutico, tal como hemos resumido en las tablas 2 a 4.
Un avance excepcional ha sido las llamadas bombas de insulina, consideradas un esbozo del páncreas artificial, utilizadas por primera vez en humanos en 1978 (Tabla 1). La bomba de insulina ha ido modificando su tamaño y sus características desde su primer diseño, siendo hoy día un pequeño dispositivo (del tamaño de un teléfono móvil) que administra insulina de forma continuada (36). Consta fundamentalmente de dos partes: el infusor de insulina y el catéter de conexión. El infusor es una microcomputadora integrada por una pantalla, una batería, unos botones y un reservorio de insulina, que ha sido programada previamente para infundir insulina de manera continua las 24 horas del día. Mediante un sensor de glucosa, una bomba de insulina y una fórmula matemática se encarga por sí solo de mantener a raya las cifras de glucosa en sangre, idealmente en cualquier situación (estado postprandial, ejercicio, estado interprandial). El catéter de conexión es un fino tubo de plástico que conecta la bomba con el tejido subcutáneo. Este catéter termina en una cánula de plástico que está localizada debajo de la piel. Allí será donde se deposite la insulina administrada por la bomba. La cantidad de insulina que se va a infundir está programada previamente por el equipo diabetológico, el paciente y/o su familia basándose en los controles de glucemia, pudiendo modificarse la tasa basal de insulina a inyectar hasta cada 30 minutos. Utiliza análogos de insulina de acción rápida.
En la actualidad ya se manejan bombas o sistemas híbridos que conlleva el empleo conjunto de dos aproximaciones tecnológicas de diferente base, pero complementarias entre sí: 1) mantener un nivel de glucemia determinado sin que intervenga el paciente; 2) contar con la participación del paciente en dos situaciones muy concretas: las comidas y la actividad física. En el caso de las comidas, el paciente tiene que introducir la cantidad estimada de carbohidratos que va a ingerir en las comidas y darle la orden táctil al dispositivo para que administre la insulina calculada en forma de bolus. En el caso del ejercicio físico, de manera anticipada el paciente antes de iniciar la actividad debe indicar al sistema tipo de actividad y duración y programar un objetivo de glucemia algo elevada para evitar la hipoglucemia. Los nuevos sistemas son capaces de administrar automáticamente bolus de insulina para corregir en todo momento una cifra de glucosa fuera de objetivos. No obstante, a pesar del enorme avance, el equipo en cierto modo es aún “rudimentario”, ya que supone la intervención frecuente del paciente, y problemas relacionados con la función del sensor, las calibraciones y la repetición de molestas alarmas (36).
5. BREVE MENCIÓN DE LA ESTRUCTURA, SÍNTESIS, SECRECIÓN Y PAPEL DE LA INSULINA
La insulina (del latín insula, “isla”) es una hormona polipeptídica formada por 51 aminoácidos, producida y secretada por las células beta de los islotes pancreáticos. Aunque la insulina fue reconocida rápidamente como una proteína tras su descubrimiento, la confirmación de su estructura primaria no ocurrió hasta el año 1955 cuando Sanger desarrolló una metodología nueva para determinar la secuencia primaria de las proteínas, la primera de las cuales fue, precisamente, la insulina (36). Esta consta de dos cadenas polipeptídicas unidas entre sí por puentes disulfuros.
Ambas cadenas, A y B, están formadas por 21 y 30 aminoácidos respectivamente y están unidas por enlaces covalentes entre las posiciones CysA7 y CysB7 y entre las posiciones CysA20 y CysB19.
Existe, además, un enlace intracatenario adicional en la cadena A que conecta las posiciones Cys6 y Cys11. Esta estructura se ha mantenido a lo largo de la evolución de los vertebrados siendo las zonas críticas las que comprenden los puentes disulfuros y los terminales amino y carboxilo de la cadena A y los grupos terminales carboxilos y los residuos hidrofóbicos de la cadena B.
Probablemente sean partes esenciales para crear y mantener la estructura tridimensional necesaria para que sea reconocida por sus receptores (37). La naturaleza peptídica de la insulina tiene importantes implicaciones para el tratamiento sustitutivo con insulina exógena ya que no se puede administrar por vía oral al ser destruida por los enzimas digestivos.
En 1967 Steiner y Oyer (38) mostraron la primera evidencia de la existencia de un precursor, la proinsulina. En la actualidad sabemos que también existe un precursor de la proinsulina, la pre-proinsulina con sus primeros 24 aminoácidos formando un péptido señal que permite la entrada de la molécula al retículo-endoplásmico perdiéndose en el proceso para dar lugar a la proinsulina.
Una vez allí, sufre un plegamiento para facilitar la formación de los dos puentes disulfuro que unen las cadenas A y B. Posteriormente, mediante un proceso adenosín trifosfato (ATP)-dependiente, la molécula de proinsulina es trasladada al aparato de Golgi y almacenada en gránulos secretores. La conversión de proinsulina a insulina tiene lugar en dichos gránulos gracias a reacciones mediadas por la acción de endoproteasas (39) y allí queda almacenada hasta que lleguen los estímulos secretores (Figura 5).
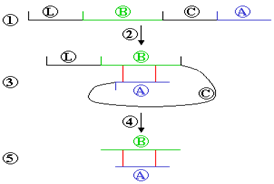
Figura 5. Esquema de la formación de la insulina a partir de la preproinsulina. 1. Preproinsulina (Lguía + cadena B + cadena C + cadena A); proinsulina consiste en las cadenas B + C + A, sin la L guía; 2. Plegamiento espontáneo; 3. Las cadenas A y B son unidas por puentes sulfuros; 4. La cadena Guía y la cadena C son cortadas; 5. Insulina (https://es.wikipedia.org/wiki/Insulina, acceso libre)
La preproinsulina, precursora de la insulina, es codificada por el gen INS (40), localizado en el cromosoma 11p15.5. Se han identificado una variedad de alelos mutantes en la región que codifica al gen. También se han descrito varias secuencias reguladoras a nivel de la región promotora del gen de la insulina humana sobre la cual se unen los factores de transcripción. En general, se sabe que las cajas A se unen a factores Pdx1, que las cajas E se unen a NeuroD, las cajas C sobre MafA y que las secuencias denominadas elementos de respuesta al cAMP se unen sobre los factores de transcripción CREB. En la actualidad se conoce que la glucosa participa en el control de la expresión del gen de la insulina a través de los tres factores de transcripción ya comentados (Pdx1, Neuro D y MafA). Estos tres factores activan la expresión de la insulina de forma coordinada y sinérgica en respuesta al aumento de los niveles de glucosa. La cantidad de proinsulina sintetizada está controlada por numerosos factores como algunos nutrientes, en particular la glucosa, neurotransmisores y hormonas. Efectivamente, el metabolismo de la glucosa es necesario para generar la señal intracelular que estimula la biosíntesis de insulina tanto a nivel de traslación como de transcripción génica (41).
Cambios en las concentraciones de glucosa modulan la función de estos factores de transcripción e a distintos niveles: cambios en los niveles de expresión, localización subcelular (p.ej. translocación), fosforilación, unión al ADN, capacidad de unirse a otras proteínas. Se han descubierto también varios silenciadores genéticos que inhiben la transcripción de la insulina, como desacetilasas de histonas HDCA1 y HDCA2 (41).
Existen otras sustancias capaces de estimular también la biosíntesis de insulina, pero generalmente son menos eficaces que la glucosa. Ciertas hormonas también estimulan específicamente la síntesis de insulina, como la hormona de crecimiento, el glucagón y el “Péptido similar al glucagón 1” (GLP1). El glucagón y el GLP1 lo consiguen a través de la vía del adenosín monofosfato cíclico (AMPc). Por otro lado, la somatostatina se comporta como un potente inhibidor de la secreción de insulina, pero no tiene efecto sobre la síntesis, mientras que el interferón inhibe la síntesis, pero a concentraciones muy altas. Caso curioso es el de la interleuquina interleucina1, que es capaz de estimular o inhibir la síntesis dependiendo de las concentraciones utilizadas (42). Hay, además, una serie de situaciones fisiológicas en las que la biosíntesis de proinsulina está aumentada como en el caso del embarazo o la obesidad, pero asociadas a un aumento de la masa celular e hiperplasia de los islotes. En otras situaciones como la edad avanzada, periodos de ayuno o en algunos modelos de diabetes mellitus tipo 2 en animales se observa una disminución de la biosíntesis, quizá respondiendo a una pérdida de masa de células b (43).
Otros nutrientes distintos a los hidratos de carbono. Los aminoácidos han mostrado sus propiedades como estimulantes de la secreción de insulina, en especial leucina, arginina y lisina. Su efecto es independiente de la presencia de glucosa, pero ésta potencia su acción. Los lípidos y sus metabolitos no parecen ejercer el mismo control, aunque la resistencia a la insulina producida por una exposición aguda, durante 90 minutos, a los ácidos grasos libres se ve compensada por un incremento en la secreción de insulina. Si la exposición persiste, se verían afectados el normal funcionamiento de la biosíntesis y la secreción de insulina (43). Los islotes de Langerhäns están inervados por terminaciones nerviosas colinérgicas y adrenérgicas. El sistema parasimpático estimula la secreción de insulina a través de varios neurotransmisores como la acetilcolina, el péptido intestinal vasoactivo (VIP) y el “pituitary adenylate cyclase-activating polypeptide” (PACAP, por sus siglas en inglés). Todos ellos actúan incrementando los niveles de AMPc y otros actuando por otras vías. Por otro lado, el sistema simpático disminuye los niveles de insulina en plasma, efecto atribuido a la liberación de noradrenalina y catecolaminas como resultado de la estimulación de la médula adrenal. Como quiera que este sistema también sea capaz de estimular la secreción de glucagón, podemos concluir que ejerce una función de mantenimiento o aumento de la glucemia en condiciones de estrés como neuroglucopenia, hipovolemia o ejercicio físico (44).
Funciones de la Insulina. La insulina es el mayor regulador hormonal del metabolismo de la glucosa; de hecho, la función fisiológica y la relevancia clínica de la insulina se observan en asociación con el papel de esta hormona en el mantenimiento de la homeostasis de la glucosa (45).
En mamíferos la expresión del gen de la insulina y la biosíntesis de esta hormona están localizados en las células b del páncreas endocrino con la posible excepción del hígado fetal (46, 47). La función primordial de las células b consiste en la producción, almacenamiento y regulación de la secreción de insulina de manera que, en circunstancias normales, siempre existe una reserva de insulina para ser secretada en respuesta a un estímulo, como el incremento de la glucemia. Cualquier aumento de la liberación de insulina se compensa, en proceso dinámico y fuertemente regulado, por el correspondiente incremento en la biosíntesis de la hormona de manera que la reserva se mantiene constante. Sin embargo, la insulina es una hormona anabólica que estimula un gran número de respuestas celulares (45).
La señalización de insulina a través del receptor de insulina involucra varias vías y da como resultado un estado anabólico del metabolismo (Figura 6). La vía canónica a través de las fosfocinasas PI3K y AKT/PKB promueve la captación de glucosa y la síntesis de glucógeno y lípidos, mientras que en los adipocitos se inhibe la lipólisis, así como la gluconeogénesis hepática. Además, las quinasas AKT activan mTORC1, que respalda la lipogénesis de novo y la síntesis de proteínas. La vía de señalización de la insulina a través de SHC y las MAP quinasas MEK y ERK promueve la proliferación celular y la síntesis de proteínas. Otra vía de señalización de la insulina involucra a NOX4 y la inhibición de PTEN, un inhibidor de la vía PI3K-AKT.
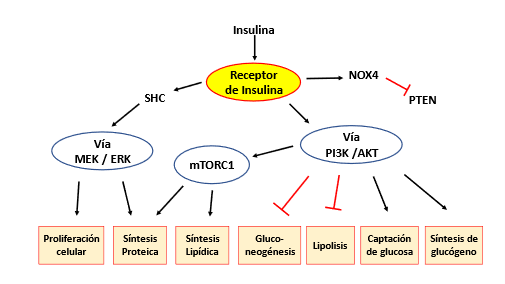
Figura 6. Vías anabólicas mediadas por la insulina. Flechas en negro activación, fecha cortada en rojo inactivación. Modificada de Kolb y col. (45)
No solo las concentraciones de insulina demasiado bajas, sino también las excesivas, son perjudiciales para el equilibrio fisiológico. Aunque la actividad glucorreguladora de la insulina se mitiga durante la hiperinsulinemia al disminuir la eficiencia de la señalización de la insulina, este no es el caso para la mayoría de las otras acciones hormonales de la insulina, incluida la promoción de la síntesis de proteínas, la lipogénesis de novo y la recuperación celular, la proliferación, la inhibición de la lipólisis, el recambio celular dependiente de la autofagia y la acción antioxidante dependiente del factor 2 relacionado con el factor nuclear E2 (Nrf2); y otros mecanismos de defensa. Por lo tanto, no hay resistencia general a la insulina, sino un deterioro selectivo de la señalización de la insulina en muchos órganos que provoca una menor captación de glucosa de la sangre y una activación reducida de la NO sintasa endotelial (eNOS) (Figura 7).
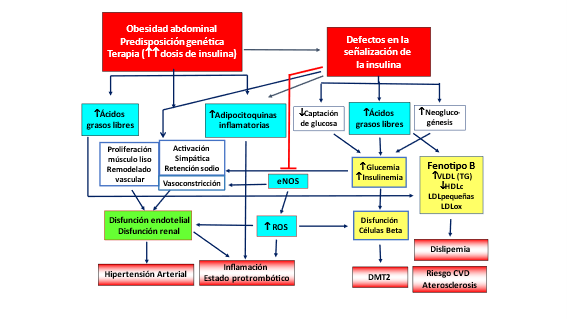
Figura 7. Mecanismos que relacionan la alteración de la señalización de la insulina con la obesidad y con una terapia inadecuada con elevadas dosis de insulina con los componentes del síndrome metabólico (clásicos) y emergentes (inflamación y estado protrombótico y oxidativo). Nótese el papel preponderante del incremento de los ácidos grasos libres en ambas vías. DMT2, Diabetes Mellitus Tipo 2; ROS, Radicales libres; eNOS, sintasa de óxido nítrico endotelial. Modificada de Sánchez-Muniz (48).
Como se observa en la Figura 7, ante la presencia de alteraciones en la señalización de la insulina, la célula-β pancreática incrementa su producción de insulina, originándose un hiperinsulinismo inicial con normoglucemia, pero a lo largo de la evolución de la patología se acompaña de glucemia basal alterada, intolerancia a la glucosa y finalmente Diabetes Mellitus tipo 2, situación en la que las células-β no responden a la demanda de insulina requerida. A su vez la resistencia a la insulina disminuye de forma marcada la captación de glucosa muscular, lo que induce además incremento de la glucosa hepática por aumento de la glucogenolisis y síntesis de novo de glucosa. También cuando los niveles de insulina disminuyen, se produce la liberación aumentada de glicerol y AGL al plasma. Todo esto promueve síndrome metabólico, en el cual co-existen obesidad, resistencia a la insulina (RI), hiperglucemia, hipertrigliceridemia, descenso de los niveles de colesterol transportado por las lipoproteínas de alta densidad (HDLcolesterol), e hipertensión arterial (48).
Debido a la señalización de insulina en gran medida sin restricciones, la hiperinsulinemia en respuesta a la resistencia a la insulina aumenta el riesgo de obesidad, diabetes tipo 2 y enfermedades cardiovasculares y disminuye la duración de la salud y la esperanza de vida.
Los resultados de estudios epidemiológicos sugieren que la terapia con dosis erróneas elevadas se asocia con un mayor riesgo de enfermedad cardiovascular. Los ensayos controlados aleatorios del tratamiento con insulina no observaron ningún efecto sobre el riesgo de enfermedad, pero estos ensayos solo estudiaron dosis bajas de insulina de hasta 40 UI/día (45). Aunque controvertido, la prueba de un vínculo causal entre los niveles elevados o muy elevados de insulina y el riesgo tras el tratamiento erróneo con insulina proviene de los estudios de aleatorización mendeliana que comparan individuos con una producción de insulina alta o baja controlada genéticamente.
6. EPÍLOGO
A pesar de que la insulina y sus análogos han salvado y salvarán muchas vidas, lamentablemente no es accesible para todos los que la necesitan, de hecho, a nivel mundial se estima que solo una de cada dos personas tienen acceso a la insulina que requieren (49). Las dificultades que impiden a las personas ser tratadas con insulina son complejos y ocurren tanto a nivel mundial como en España, por lo que aún se requieren cambios y estrategias a nivel social y político para superar estas barreras y lograr el acceso al tratamiento con insulinas de manera universal.
Cabe destacar, que la dificultad al acceso a la insulina no solo es por cuestiones socioeconómicas y políticas, sino también por una creciente ola de mitos que la rodean, haciendo más difícil su implementación. Entre los mitos populares se encuentran que “la insulina provoca ceguera, amputaciones, daños en el riñón y diversas complicaciones”, o “si te recetan insulina es porque ya estás en las últimas”. Por tanto, la educación y la desmitificación de la diabetes son esenciales, explicando y demostrando que el ser humano necesita insulina para vivir sea o no diabético.
Además, debe señalarse que un diabético no produce suficiente insulina o los mecanismos de señalización y utilización de esta por las células no es correcta, apareciendo complicaciones relacionadas con la hiperglucemia durante prolongados periodos de tiempo. Desgraciadamente, es común que el control de la Diabetes sea deficiente y tal deficiencia se prolongue durante años.
Por ello el diagnóstico precoz, y el tratamiento de precisión adecuado, considerando el tipo de insulina y su dosificación, deben iniciarse de manera oportuna para evitar desenlaces catastróficos, como ha sido ampliamente demostrado en la práctica clínica y referenciado en la bibliografía relacionada.
En conclusión, los avances en estos 100 años en la terapia con insulina han logrado que la Diabetes haya pasado de ser una enfermedad fatal a una condición crónica manejable. Estos 100 años, han sido un viaje sensacional, que han permitido la aparición de diferentes tipos de insulina y sus análogos cada vez más adecuados para el tratamiento preciso de los diferentes tipos de pacientes.
No obstante, el camino a recorrer sigue siendo largo, ya que muchas personas en todo el mundo aún no tienen acceso a un diagnóstico de la patología y a una atención básica, incluida la administración regular y confiable de la insulina. Por ello no solo son importantes los avances tecnológicos, sino el poder garantizar un acceso responsable equitativo con educación y mejor atención en el cuidado de la diabetes.
7. REFERENCIAS
- Holde E. The Country diary of an Edwardian Lady. Edición Española Observaciones sobre la naturaleza. En: La Felicidad de vivir con la naturaleza. El diario de Edith Holden. Barcelona: Editorial Blume1979; or Wrebb & BowerLtd. Exeter. Inglaterra.1977.
- Allen F, Stillman E, Fitz R. Total dietary regulation in the treatment of diabetes. New York: 1919.
- Sánchez-Muniz FJ. Epílogo. An Real Acad Farm 2016; 82 ( Special Issue); 277-8.
- Reverte J. Prólogo. En: Reverte J, Puig-Samper MJ, Moreno Martín JM, Vallespín F. (eds.). Expedición Malaespina. Un viaje científico-político alrededor del mundo 1789-1794. Ministerio de Defensa de España, TURNER, 2010, pp. 17-8.
- Sánchez-Muniz FJ, Culebras J, Vicente Vacas L. En el mes de la concesión de los Premios Nobel, rendimos homenaje a Alfred Nobel y a los galardonados con el Premio de Fisiología y Medicina de 2021. JONNPR 2021; 7(N): nnn-nn. DOI: 10.19230/jonnpr.4650
- Flexner A. La utilidad de los conocimientos útiles. En: La utilidad de lo inútil. Manifiesto. Ordina N (ed.): Acantilado: Barcelona, 2013; pp.153-71.
- Rincón del vago https://www.rincondelvago.com/informacion/premios-nobel/
- De Leiva A, Brugués E, de Leiva-Pérez A. The discovery of insulin: Continued controversies after ninety years. Endocrinol Nutr (Edición en inglés) 2011; 58 (9): 449-56. (traducción al castellano en https://www.elsevier.es/es-revista-endocrinologia-nutricion-12-articulo-el-descubrimiento-insulina-continuan-controversias-S1575092211003172).
- Nobel Foundation. Nobel, the man and his prizes. Oklahoma: University of Oklahoma press. 1951. pp: 221-3.
- Bliss M. The discovery of insulin. Chicago: University of Chicago Press. 1982.
- https://www.bbc.com/mundo/noticias-9937796#:~:text=Fre derick%20Banting%20gan%C3%B3%20en%201923,su%20descubimiento%20de%20la%20insulina.
- Blis M. The history of Insulin. Diabetes Care 1993;16(Suplemeto 3):4-7
- Lewis GF, Brubaker PL. The Discovery of insulin revisited: lessons for the modern era. J Clin Invest 2021; 131 (1): 1-9.
- Molina CE. 100 years of Insulin: Celebrating the past, present and future of diabetes therapy. Nat Med 2021; 7:1154-64.
- Hegele RA. Insulin’s Century. The birth of an idea. Lancet Diabetes Endocrinol 2020; 12: 971-7.
- IDF diabetes atlas 9th edition. 2019
- Barnett, A.H. Preventing renal complications in diabetic patients: the Diabetics Exposed to Telmisartan and Enalapril (DETAIL) study. Acta Diabetol 2005; 42 (Suppl 1): s42–9.
- https://www.bbc.com/mundo/noticias59937796#:~:textxt= Frederick%20Banting%20gan%C3%B3%20en%201923,su%20descubrimiento%20de%20la%20insulina
- Biedl A. The internal secretory organs: Their physiology and pathology. London: 1913.
- Lancereaux E. La diabète maigre: ses simptômes, son évolution, son pronostic et son traitement; ses rapprts avec les alterations du pancréas. Union Med (Paris). 1880; 29: 161-8.
- Minkowski O. Historical development of the theory of pancreatic diabetes (introduction and translation by R. Levine). Diabetes 1989; 38: 1-6.
- Banting F, Best C, Collip J, Campbell W, Fletcher A. Pancreactic extracts in the treatment of diabetes mellitus. Preliminary report. Can Med Assoc J. (1922);12: 141-6.
- Banting F, Best C, Collip J, Macleod J. The preparation of pancreatic extracts containing insulin. Trans Roy Soc Can. 1922;5
- Kahn CR, Weir GC, King GL, Moses AC, Smith RJ, Jacobson AM. Joslin’s Diabetes Mellitus.14 ed. Filadelfia: Lippincott Williams & Wilkins (LWW), 2007.
- Owens DR, Monier L, Ceriello A, Bolli GB. Insulin Centennial: Milestones influencing the development of insulin preparations since 1922. Diabetes Obes Metab 2022; 24(suppl 1): 27-42.
- Wait JH, Beetham WP. The visual mechanism in diabetes mellitus: a comparative study of 2002 diabetics and 457 non-diabetics for control. N Engl J Med 1935; 212: 429-43.
- Kimmelstiel P, Wilson C. Intercapillary lesions in the glomeruli of the kindney. Am J Pathol 1936; 12: 83-97.
- Bell ET. A postmortem study of vascular disease in diabetics. Arch Pathol 1952; 53: 444-55.
- Conn JW, Fajans SS. The prediabetic state. A concept of dynamic resistance to a genetic diabetogenic influence. Amer J Med 1961; 31: 839-43.
- Gavin JR, III; Alberti KGMM, Davidson MB; DeFronzo RA, et al. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care; 1997; 20(7): 1183-97.
- Fineberg S, Galloway J, Fineberg N, Rathbun M. Immunological improvement resulting from the transfer of animal insulin-treated diabetic subjects to human insulin (Recombinant DNA). Diabetes Care 1982; 5(Suppl 2): 107-13.
- Hall K. Insulin – the Crooked timber: A history from thick Brown Muck to Wall Street Gold. Oxford (UK): Oxford University Press. 2022. www.kerstenhall.com
- Rhodes CJ, Halban PA. Newley-synthesized proinsulin/insulin and stored insulin are released from pancreatic beta cells via a regulated, rather than a constitutive, pathway. J Cell Biol 1987;105: 145-53.
- Campbell JE, Newgard CB. Mechanisms controlling pancreatic islet cell function in insulin secretion. Nature reviews. Mol Cell Biol 2021;22(Suppl2): 142-58.
- García Gil M. El mundo de las insulinas en la diabetes tipo 2 y el síndrome metabólico. En: Sánchez Muniz FJ (director), Martínez Sesmero JM y Marcos Sánchez A. (coordinadores). VI Curso avanzado sobre Obesidad y Síndrome metabólico. Aspectos cardiometabólicos. Cátedra Novo Nordisk-RANF. Madrid: RANF. 2021. pp.55-6.
Conget I, Giménez M. Investigadores del Cibeerdem. De las bombas de insulina al páncreas artificial: el camino para el control de la diabetes tipo 1. 2021. https://cuidateplus.marca.com/bienestar/2021/11/14/bombas-insulina-pancreas-artificial-camino-control-diabetes-tipo-1-179284.html - Sanger F. Chemistry of insulin: determination of the structure of insulin opens the way to greater understanding of life processes. Science 1959; 129:1340-4.
- Gammeltoft S. Insulin receptors: binding kinetics and structure-function relationship of insulin. Physiol Rev 1984; 64: 1321-68.
- Steiner DF, Oyer PE. The biosynthesis of insulin and probable precursor of insulin by a human islet cell adenoma. Proc Nat Acad Sci USA 1967: 57: 473-80.
- Rhodes CJ, Shoelson S, Halban PA. Insulin biosynthesis, processing and chemistry. In: Kahn CR, Weir GC, King GL, Jacobson AM, Moses AC, Smith RJ. (eds). Joslin’s Diabetes Mellitus. Boston Diabetes Center, 2005;pp. 65-82.
- Bell GI, Pictet RL, Rutter WJ, Cordell B, Tischer E, Goodman HM. Sequence of the human insulin gene. Nature 1980; 284 (5751): 26-32.
- Gil Hernández A, Aguilera García C, Gómez Llorente C. Nutrigenómica. En: Gil A (ed.). Tratado de Nutrición. Vol 1. Capítulo 31, Buenos Aires: Panamericana. 2010; Pp 762-764.
- Guest PG, Rhodes CJ, Hutton JC. Regulation of the biosynthesis of insulin secretory granule proteins: coordinate translational control is exerted on some, but not all, granules matrix constituents. Biochem J 1989; 257: 431-7.
- García-Quismondo Fernández A. Proteína C reactiva, índice de conicidad y factores de riesgo cardiovascular en pacientes con Diabetes tipo 2. Tesis Doctoral. Facultad de Farmacia. Universidad Complutense de Madrid. 2016
- Gilon P, Henquin JC. Mechanisms and physiological significance of the cholinergic control of pancreatic β-cell function. Endocrine Rev 2001; 22(5): 565-604.
- Kolb H, Kempf K, Röhling M, Martin S. Insulin: too much of a good thing is bad. BMC Med 2020; 18(1): 224.
- Orci L. The insulin factory: a tour of the plant surroundings and a visit to the assembly line. Diabetologia 1985; 28: 528-46.
- Giddings SJ, Carnaghi LR. Selective expression and developmental regulation of the ancestral rat insulin II gen in fetal liver. Mol Endocrinol 1990; 4: 1363-9.
- Sánchez-Muniz FJ. Obesidad central un componente clave del síndrome metabólico. nuevos conceptos. En: Sánchez Muniz FJ (director), Martínez Sesmero JM y Marcos Sánchez A. (coordinadores). VI Curso avanzado sobre Obesidad y Síndrome metabólico. Aspectos cardiometabólicos. Cátedra Novo Nordisk-RANF. Madrid: RANF. 2021. Pp. 9-10.
- Madrigal Sanroman JR. 100 años de la insulina. https://www.tierraadentro.cultura.gob.mx/100-anos-de-la-insulina/