RESUMEN:
La fritura repetida de alimentos produce termooxidación y polimerización, potencialmente negativas para la salud. Se desconoce cómo reacciona el sistema gastrointestinal frente a estos compuestos. Las proantocianidinas poseen propiedades antioxidantes e hipolipemiantes. Hipotetizamos que un extracto de algarrobo rico en proantocianidinas (CFE) mejora la defensa del intestino frente a la agresión termooxidativa. Se estudió, en el aceite de girasol, la termooxidación producida por la fritura repetida de pescado y, en ratas Wistar, el efecto de administrar conjuntamente aceite de fritura y CFE sobre: la digestión de los compuestos termooxidados, la lipemia postprandial, las proteínas implicadas en la absorción de lípidos, y la actividad y expresión antioxidante y de hemo-oxigenasa-1 en intestino delgado. Doce ratas Wistar, macho, de 200-250 g fueron canuladas durante una semana con la mezcla del aceite termooxidado-CFE o con aceite termooxidado. Se cuantificó la alteración termooxidativa en el aceite de fritura y en la grasa post-prandial del lumen gastrointestinal, la lipemia postprandial, las proteínas NPC1L1, ACAT-2 y MTP, y el estado antioxidante en duodeno, yeyuno e íleon. Se encontraron niveles elevados de compuestos de polimerización y triglicéridos oxidados en el aceite de girasol y en la grasa del lumen gastrointestinal. La administración de aceite de girasol termooxidado-CFE disminuye la digestibilidad del aceite y de los compuestos poliméricos/termooxidados, aminora la lipemia postprandial, eleva NPC1L1, ACAT-2 y MTP, y mejora el estado antioxidante intestinal y la excreción de polímeros fecales. El empleo de CFE reduce la lipemia postprandial y garantiza un estado antioxidante intestinal adecuado frente a lípidos termooxidados.
Palabras Clave:aceite de girasol; algarrobo; alteración termooxidativa; fibra; proantocianidinas; fritura; lipemia post-prandial; enzimas antioxidantes
ABSTRACT:
The repeated frying of food in sunflower oil produces thermo-oxidation and polymerization, potentially negative for health. The reaction of the gastrointestinal system to these compounds is unknown. Proanthocyanidins have antioxidant and lipid-lowering properties. We hypothesize that a carob-fruit extract rich in proanthocyanidins (CFE) improves the defense of the intestine against thermo-oxidative aggression. In sunflower oil, the thermo-oxidation produced by repeated frying of fish was studied while, in Wistar rats, the effect of jointly administering altered sunflower oil and CFE on: the digestion of thermo-oxidized compounds, postprandial lipaemia, proteins involved in lipid absorption, antioxidant and hemoxygenase-1 activity and expression in the small intestine. Twelve male Wistar rats, 200-250 g were cannulated for one week with the mixture of the thermo-oxidized oil-CFE or the thermo-oxidized oil. Thermo-oxidation was determined in sunflower oil and in the postprandial-fat of the gastrointestinal lumen, postprandial lipaemia, the proteins NPC1L1, ACAT-2 and MTP, and the antioxidant status in the duodenum, jejunum and ileum. High thermo-oxidation and polymerization levels were found on sunflower oil and fat in the gastrointestinal lumen. The administration of thermo-oxidized sunflower oil-CFE decreases the digestibility of the oil and the polymeric/thermo-oxidized compounds, reduces postprandial lipaemia, increases NPC1L1, ACAT-2, and MTP, and improves the intestinal antioxidant status and excretion of fecal polymers. The use of CFE reduces postprandial lipaemia and guarantees an adequate intestinal antioxidant status against thermo-oxidized lipids.
Keywords: sunflower oil; carob-fruit; fatty thermal-oxidative alteration; fiber; proanthocyanidins; frying; post-prandial lipaemia; antioxidant enzyme
1. INTRODUCCIÓN
La fritura es uno de los métodos de cocinado más empleado en el mundo, entre otros aspectos por incrementar la palatabilidad y mejorar las características organolépticas de los alimentos que se fríen, haciéndolos crujientes y aportándoles una textura y odor característicos. Esto explica la amplia oferta que existe en el mercado de productos fritos y pre-fritos (1). El proceso de fritura se diferencia netamente del simple calentamiento del aceite a temperaturas de fritura, ya que la presencia de alimento en el aceite calentado junto con aire hace la situación definitivamente más compleja (2). El proceso de fritura puede resumirse en tres vías de alteración: hidrolítica, termooxidativa y de polimerización (3–5).
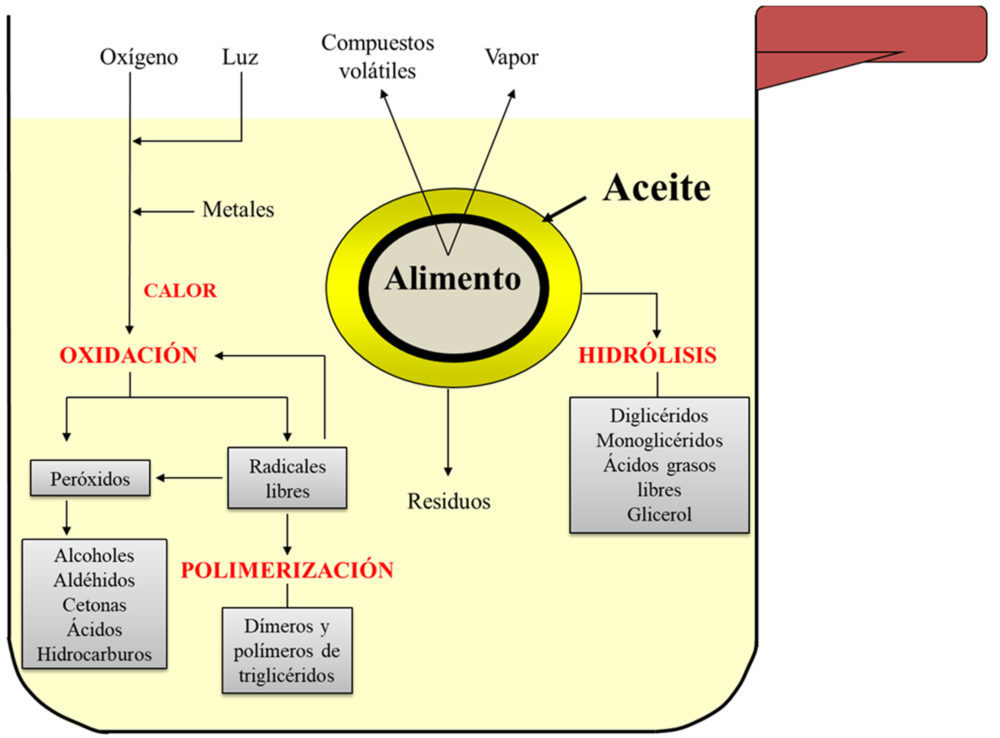
Figura 1. Proceso de fritura. Representación esquemática de los procesos de hidrólisis, oxidación y polimerización. Adaptada de Sánchez-Muniz, et al. 2007 (6).
Así, el agua de los alimentos induce alteración hidrolítica en el aceite de fritura, originándose diglicéridos (DG), ácidos grasos libres (AGL) y, en mucha menor cantidad, monoglicéridos (MG) (7). La presencia de oxígeno y temperaturas relativamente elevadas induce termooxidación, con formación de hidroperóxidos y de componentes secundarios relacionados. Cuando el proceso se origina a temperaturas próximas a 200 ºC, la formación de compuestos poliméricos y cíclicos se acelera enormemente. No obstante, la intensidad depende en gran medida del contenido de agua del alimento, la temperatura del proceso, la insaturación del aceite y la presencia de otros componentes en el alimento como minerales, vitaminas y antioxidantes (1). En España, en restauración, industria culinaria y en menor proporción en los hogares, el aceite de girasol (AG) se utiliza ampliamente en el procesado y cocinado de los alimentos (e.g. fritura). El alto contenido en ácidos grasos insaturados (aproximadamente ≥50 % de ácido linoleico) hace a este aceite mucho más propenso a la alteración termooxidativa que otros aceites de uso común como el aceite de oliva (8).
De todo lo comentado se deduce la dificultad de evaluar todos los cambios que acontecen en la fritura. Sin embargo, en las últimas tres décadas se han desarrollado nuevas técnicas cromatográficas que permiten conocer la naturaleza y concentración de los TG y ácidos grasos alterados en los aceites utilizados en fritura. La concentración máxima de compuestos de alteración hidrolítica, termooxidativa y de polimerización en los aceites y grasas comestibles -también llamados compuestos polares (CP) por tener mayor polaridad que los TG no alterados- no debe superar, según la legislación vigente en distintos países europeos, el 20-25 % (9). En España, este contenido máximo de CP se fija en el 25 % (10). Junto con los CP, son relevantes otros marcadores como el contenido de polímeros de triglicéridos (PTG) y el de lípidos termooxidados (11). Respecto a los PTG existe, en general, consenso de que la alteración no supere el valor de 10-12% de compuestos poliméricos (7–9). Simultáneo a la aparición de alteraciones termooxidativas se produce el intercambio de calor y masa entre el aceite y los alimentos, aceptándose que al final del proceso la composición grasa de los alimentos fritos es similar a la del aceite en la que se han cocinado (4,8). Por todo ello, es importante considerar tanto la estabilidad del aceite empleado como la calidad del alimento frito, ya que redundan en la salud de la población (1,5,7,11).
El proceso de digestión de los aceites alterados es relativamente similar al de los aceites no alterados, ya que se requieren las mismas enzimas, co-enzimas y productos de emulsificación (12). En la absorción de las grasas están implicados, entre otros, el transportador Niemann-Pick C1-like 1 (NPC1L1), que capta esteroles en sus formas libres (colesterol y fitoesteroles) y está presente en la membrana apical de los enterocitos (13–16); la enzima acetil-CoA acetiltransferasa 2 (ACAT-2) que se localiza en la membrana del retículo endoplásmico y cataliza específicamente la conversión del colesterol libre a ésteres de colesterol (15); y finalmente, la proteína de transferencia de triglicéridos microsomales (MTP) que interviene en el ensamblaje de los quilomicrones nacientes (14,15). No obstante, con el consumo de aceites alterados se modifican ciertos aspectos digestivos con importancia fisiológica como el vaciamiento gástrico, la respuesta colecistoquinética y la capacidad de hidrólisis de los triglicéridos oxidados (TGox) y PTG por la lipasa pancreática (17).
También es importante considerar que, en su digestión, los alimentos fritos liberan sus componentes lipídicos que dependiendo de sus características fisicoquímicas y el grado de alteración pueden afectar a la integridad y fisiología del sistema gastrointestinal (18). Sin embargo, resulta paradójico que la mayoría de los estudios se hayan realizado con aceites calentados a altas temperaturas (250 ºC) y durante tiempo prolongado (30-50 h) e incluso con burbujeo de oxígeno, en vez de con aceites utilizados en fritura o extraídos de alimentos fritos (8). Además, las dosis de compuestos alterados testados son normalmente excesivas y se alejan de lo que puede encontrarse en aceites usados en frituras y en las dietas (19). No obstante, los estudios en animales de experimentación han demostrado que el consumo de PTG oxidados y no oxidados puede inducir efectos deletéreos (2,8). También se ha comprobado en diferentes estudios tanto in vitro (2) como in vivo (2,8,20) que, a pesar de la mayor dificultad de reconocimiento por la lipasa pancreática, los TGox y los PTG son parcialmente hidrolizados por las enzimas intestinales lo que facilita la absorción de sus componentes (2,8). Debido a su polaridad, los dímeros de triglicéridos (DTG) y los TGox presentan mayor absorción, por lo que pueden suponer gran relevancia toxicológica en el desarrollo de alteraciones digestivas y metabólicas (2). Sin embargo, no se conocen de forma detallada los procesos mediante los cuales el sistema digestivo absorbe, controla y elimina estos compuestos de oxidación (7,18).
Aunque la barrera intestinal pueda limitar el acceso de grasa oxidada y polimerizada al interior del organismo y proteger contra el daño de especies reactivas de oxígeno (ROS), resulta difícil de entender que exista un número bastante reducido de estudios, la gran mayoría de ellos realizados con aceites calentados durante largos periodos, pero muy pocos con aceites utilizados en fritura de alimentos (18). Además, en estos estudios, la disminución en la abundancia y actividad de las enzimas antioxidantes fue menor de lo esperado (18,21). Por otro lado, el intestino delgado puede adaptar su capacidad de absorción de lípidos al contenido y características de la grasa consumida, pudiendo verse así afectados los niveles postprandiales de TG y colesterol (12).
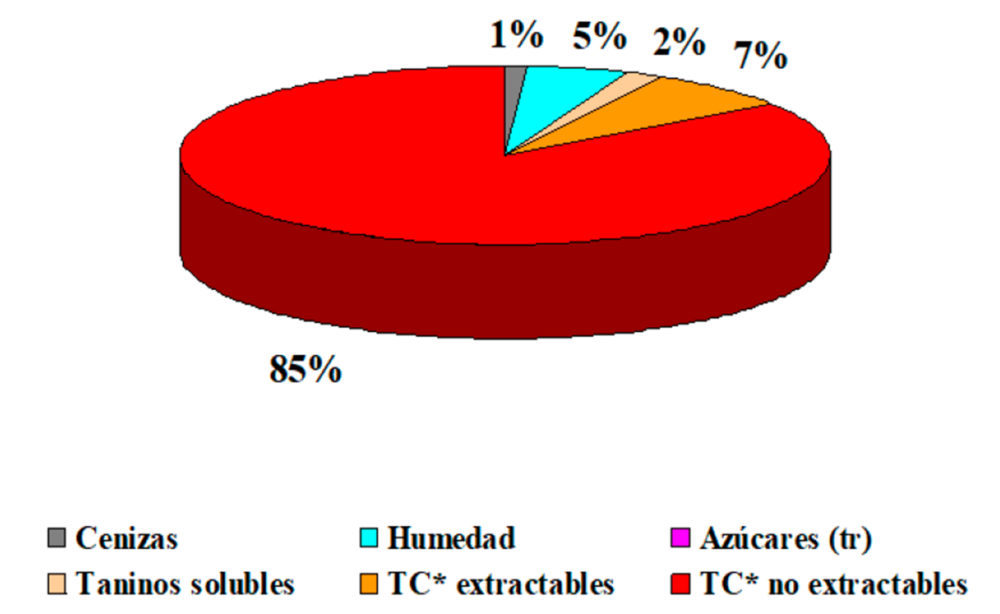
La fibra dietética es uno de los componentes de la dieta que ha despertado mayor interés. Entre sus propiedades resaltan los efectos beneficiosos intestinales tanto relacionados con la eliminación fecal como aquellos que implican regulación de la microbiota y de la integridad colónica, reduciendo los efectos pro-oxidantes e inflamatorios (22,23). Así, se ha descrito la capacidad de la fibra dietética de atrapar en su matriz compuestos oxidados, contribuyendo con ello a disminuir su absorción y a evitar la transferencia de ROS a las lipoproteínas de membrana del sistema gastrointestinal. Las proantocianidinas (taninos condensados) son compuestos naturales de origen vegetal que han demostrado ampliamente su capacidad para promover la salud intestinal (24,25). Entre sus propiedades beneficiosas se encuentran la actividad antioxidante, antiinflamatoria e inmunomoduladora, el refuerzo de la integridad de la pared intestinal, la capacidad hipolipemiante, etc. También se ha definido el papel de las proantocianidinas inhibiendo la actividad de la lipasa pancreática (26). Por todo ello, pensamos que pueden ser potencialmente útiles para disminuir las alteraciones que el consumo de aceites de fritura provoca en el sistema gastrointestinal. En nuestro caso, empleamos un extracto de la pulpa de las vainas del algarrobo (Ceratonia siliqua, L.), árbol de la familia de las fabáceas, que es rico en proantocianidinas (más de un 65 %) (Figura 2). Su degradación con ácidos tioglicólico o hidroclórico indica que las proantocianidinas están compuestas por polímeros de subunidades de flavan-3-ol y flavan-3,4-diol (27).
En este estudio se hipotetiza que la administración conjunta de AG utilizado en fritura repetida junto a un extracto de algarrobo rico en proantocianidinas reduce los efectos negativos del aceite alterado sobre la integridad y funcionalidad de la mucosa digestiva.
EXTRACTO RICO EN PROANTOCIANIDINAS
Figura 2. Composición porcentual del extracto de algarrobo rico en proantocianidinas.
2. Material y métodos
2.1. Animales de experimentación
Se adquirieron 12 ratas Wistar macho (Harlan S.L., Barcelona, España) de 2 meses de edad y de 200-250 g de peso, que se mantuvieron durante 1 semana con acceso libre a la dieta de mantenimiento (Panlab, Barcelona, España) y agua del grifo. Los animales se alojaron en parejas en condiciones ambientales estándar (20 °C y 12 h de ciclo luz-oscuridad). El estudio fue aprobado por el Comité Consultivo Español de Ciencia y Tecnología y por la Universidad de Alcalá. Todos los experimentos se realizaron de conformidad con la Directiva 2010/63/UE, de 22 de septiembre de 2010, para la protección de los animales utilizados para la experimentación.
2.2. Aceite de girasol y extracto de frutos de algarrobo
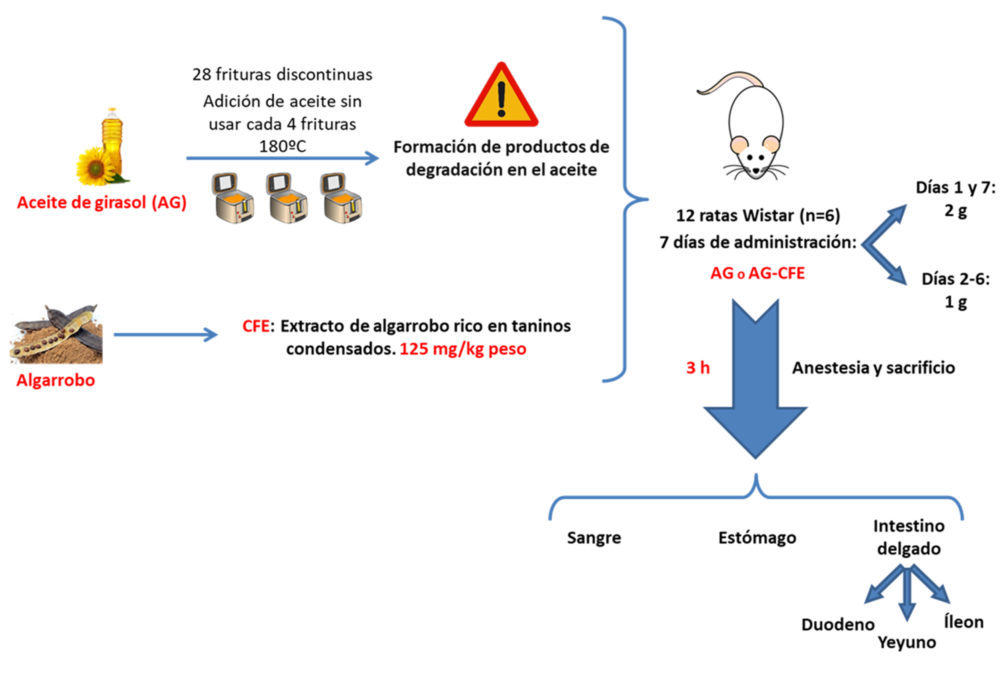
El AG empleado fue un aceite comercial obtenido de las semillas de la planta de girasol (Helianthus annuus, L.). Este aceite se utilizó previamente en 28 frituras discontinuas de pescado (filetes empanados y palitos de merluza). Para ello se utilizaron tres freidoras domésticas (Taurus®) de un litro de capacidad. Se fijó la temperatura del termostato a 180 ºC y se añadieron, en cada fritura, 130 g de palitos de merluza o de filetes de merluza (Pescanova®). Cada 4 frituras se añadió AG sin usar para compensar el aceite absorbido por los palitos o los filetes de pescado y así mantener uniforme la relación aceite/alimento durante las 28 frituras estudiadas. La duración de cada fritura fue de 5 minutos, pudiendo calcularse el total de minutos de calentamiento del aceite en 140 minutos.
La fibra insoluble rica en taninos condensados o proantocianidinas- se obtuvo de los frutos de algarrobo (Ceratonia siliqua, L.) según el procedimiento descrito en la patente WO/2004/014150 (27). Tras la retirada de las semillas, la pulpa se lavó 3 veces durante 45 minutos con agua a 45 °C y agitación constante, descartando el líquido de lavado. La pulpa húmeda resultante se homogeneizó con agua en una proporción de 1:2 (p/p) y se agitó vigorosamente durante 3 horas a 80 ºC. Seguidamente, y tras filtrar la pulpa, el líquido obtenido se dejó enfriar y se sometió a un proceso de decantación a temperatura ambiente durante seis horas. Finalmente, la muestra decantada se centrifugó a 2500 g y se eliminó el sobrenadante. El residuo resultante se secó a 85 °C y 0,2 atmósferas de presión durante 12 horas en una estufa. Una vez enfriado, el residuo se molturó y se tamizó hasta obtener un tamaño de partícula inferior a 180 µm.
2.3. Diseño experimental
Durante siete días, sin mantener a los animales en situación de ayuno nocturno, se inoculó por sonda esofágica el AG alterado (grupo AG) o la mezcla extemporánea del AG alterado con CFE (grupo AG-CFE), este último añadido en la cantidad de 125 mg/kg de peso del animal. Se emplearon 2 g del aceite o la mezcla los días 1 y 7, y 1 g los días 2-6 del estudio. El séptimo día de tratamiento, el AG alterado o la mezcla AG-CFE fueron administrados en estado de ayuno. A las tres horas de la administración los animales fueron anestesiados y sacrificados mediante extracción de sangre de la aorta descendente con una jeringa heparinizada. A continuación, se aislaron el estómago y el intestino delgado (separando duodeno, yeyuno e íleon).
Figura 3. Esquema del diseño experimental. AG: aceite de girasol usado en fritura; AG-CFE: aceite de girasol usado en fritura y extracto del fruto del algarrobo.
2.4. Preparación de las muestras
La sangre obtenida en el sacrificio se centrifugó a 2500 rpm (1500 g) durante 20 min, obteniendo así el plasma para determinar los TG y el colesterol, así como los TG en quilomicrones.
El contenido luminal del estómago y del intestino delgado se recogió por arrastre perfundiendo lentamente con 10 mL de solución salina el estómago y con 50 mL el intestino. Posteriormente se cuantificó y analizó la cantidad total y los componentes de alteración de la grasa remanente en estas regiones. Cada porción del intestino delgado se dividió en dos partes equivalentes. Una se homogeneizó y se prepararon extractos para determinar la actividad y los niveles de proteína (abundancia) de las enzimas superóxido dismutasa (SOD), catalasa (CAT), glutatión reductasa (GR), glutatión peroxidasa (GPx) y hemo-oxigenasa-1 (HO1). La otra parte se almacenó en formol (4%) para su fijación y posterior montaje en parafina para la detección y localización de las proteínas estudiadas in situ en el tejido. Se estudió la inmunorreactividad de las siguientes proteínas: el transportador NPC1L1, ACAT-2 y MTP.
2.5. Técnicas de laboratorio
2.5.a Cuantificación de la grasa
La determinación y cuantificación de grasa en el estómago e intestino se llevó a cabo de acuerdo a la metodología propuesta por Bligh y Dyer con cloroformo/metanol (28).
2.5.b Determinación de la alteración termooxidativa en el aceite utilizado en fritura y en el lumen gástrico e intestinal
La cuantificación de la alteración total en forma de CP en el AG y en la grasa obtenida por perfusión del lumen gástrico e intestinal se realizó siguiendo la técnica cromatográfica en columna de gel de sílice de Dobarganes et al. (29). Se eluyó 1 g de aceite, primero con hexano:éter dietílico 90:10 para separar los TG no alterados o componente apolar y, posteriormente, con éter dietílico para la elución de los compuestos de alteración hidrolítica y termooxidativa de mayor polaridad que los TG no alterados. Las dos fracciones se evaporaron en rotavapor y se cuantificaron mediante gravimetría. Posteriormente se procedió a la identificación de los compuestos que integraban la fracción de compuestos hidrolíticos (DG, MG y AGL) y la fracción de compuestos termooxidados (PTG y DTG oxidados o no oxidados y TGox) por cromatografía de alta eficacia por separación de masa molecular (HPSEC de las siglas en inglés de High-performance size-exclusion chromatography) mediante la utilización de dos columnas de poliestireno-divinilbenceno (PL-gel) acopladas en serie y conectadas a un refractómetro (Agilent, Barcelona). La identificación de los compuestos se efectuó atendiendo a sus tiempos de retención, previamente comprobados por el uso de patrones de AGL, MG, DG y TG, y de aceites alterados conocidos para los DTG y PTG. La cuantificación de los compuestos se realizó mediante refractometría, aceptando una respuesta similar para todos los compuestos hidrolíticos y termooxidados.
2.5.c Separación de quilomicrones. Cuantificación de colesterol y triglicéridos
Los quilomicrones plasmáticos se separaron por gradientes salinos de densidad, a partir de 2 mL de plasma, mediante ultracentrifugación a 30.000 rpm (153.000 g) a 4 ºC en una ultracentrífuga Beckman L8-70M, rotor SW-40.1 (Palo Alto, CA, EE.UU.) siguiendo lo señalado por Bocanegra et al. (30). La concentración de colesterol plasmático se determinó utilizando el kit enzimático colorimétrico de CHOD-POD (Spinreact, Barcelona), mientras que la de TG en plasma y en quilomicrones se cuantificó con el de GPO-POD (Spinreact, Barcelona).
2.5.d Determinaciones enzimáticas en el intestino delgado
Se determinó la actividad de las enzimas antioxidantes en homogenados de las muestras de duodeno, yeyuno e íleon en tampón fosfato (50 mM, pH 7,4). Para medir la actividad SOD se empleó el método Nitroblue Tetrazolium (NBT) adaptado por Santos-López et al. (31). Este método se basa en la producción del radical superóxido por autooxidación de hidrocloruro de hidroxilamina que reduce el NBT a nitrito. La reacción entre nitrito y EDTA da lugar a complejos colorimétricos que se midieron a 560 nm. La actividad enzimática resultante se expresó como UI/mg proteína. La actividad CAT se determinó como describe Aebi (32), midiendo a 240 nm la descomposición de H2O2; la actividad se expresó como UI/mg de proteína a 25 °C. La actividad GR se evaluó empleando el método descrito por Mannervik (33), que considera la reducción de disulfuro de glutatión por NADPH, y se expresó como nanomol de NADPH oxidado a NADP+ por minuto y por miligramo de proteína. La actividad GPx se analizó siguiendo el método de Agarkov et al. (34), en el que se cuantifica la oxidación de NADPH cuando el glutatión oxidado se reduce por GR con H2O2 como sustrato. La actividad GPx se expresó como nanomol de NADPH oxidado a NADP+ por minuto y por miligramo de proteína.
Dado que la absorción de lípidos acontece fundamentalmente en el yeyuno (35), se determinaron, en este segmento intestinal, los niveles proteicos (abundancia) de las cuatro enzimas antioxidantes (SOD, CAT, GR y GPx) y HO1 por Western Blot, siguiendo el protocolo descrito en Macho-González et al. (36). Las muestras se homogeneizaron con tampón de lisis que contiene Tris-HCl 10 mM (pH 7,4), SDS al 1 %, vanadato de sodio 1 mM y 0,01% cóctel inhibidor de proteasa (todos de Sigma-Aldrich). La proteína intestinal se midió utilizando el método de Lowry (37). Se separaron cantidades iguales de proteína (30 µg) a 150 V en gel de poliacrilamida (SDS-PAGE) al 8 % (v/v) y, después de la migración, se transfirió a una membrana de fluoruro de polivinilideno (PVDF) (GE Healthcare, Madrid, España) con Trans-Blot Turbo (Bio-Rad, Madrid, España) durante 20 min y 2,5 mA. Las membranas se bloquearon con albúmina sérica bovina (BSA) al 5 % durante 1 hora y se incubaron con el anticuerpo primario [SOD: sc-11407; CAT: sc-271803; GR: sc-32886; GPx: sc-133160; HO1: sc-136960 (Santa Cruz Biotechnology, Quimigen, Madrid, España)] durante toda la noche a 4 ºC. El anticuerpo secundario conjugado con peroxidasa (Santa Cruz Biotechnology, Quimigen, Madrid, España) se incubó durante 1 hora a temperatura ambiente. La señal de quimioluminiscencia se detectó empleando el ECL Select-kit (GE Healthcare, Madrid, España) y se leyó en un ImageQuant LAS 500 (GE Healthcare, Madrid, España). La densidad de banda se cuantificó empleando el programa Quantity One v.4.2.6 y se cuantificó en referencia a la β-actina como control de carga.
La cuantificación inmunohistoquímica se realizó según la técnica descrita por Garcimartín et al. (38). Las muestras se incubaron con los correspondientes anticuerpos específicos policlonales primarios y secundarios biotinilados (Santa Cruz Biotechnology, Quimigen, Madrid). El sistema de detección se realizó usando peroxidasa conjugada con estreptavidina (Sigma Aldrich. Madrid) y se reveló por incubación con 3,3′-diaminobenzidina (DAB) (Sigma Aldrich, Madrid). La inmunorreactividad se determinó por análisis de imagen usando un microscopio óptico Leica DM LB2 acoplado a una cámara digital Leica DFC 320 (Leica. Madrid. España). Para medir la inmunorreactividad de NPC1L1, ACAT2 y MTP, las preparaciones fueron estudiadas asignando una puntuación a cada una de ellas basándonos en la intensidad de tinción (de 1 a 4) o el porcentaje de células teñidas en cada muestra.
2.6. Análisis estadístico
Los resultados fueron expresados como media y desviación estándar. Se realizó la prueba de Levene para ratificar o descartar la igualdad de las varianzas entre los grupos comparados. Las diferencias fueron analizadas mediante pruebas no pareadas de la t de Student, aceptando diferencias significativas para p<0,05. El análisis estadístico se realizó con el software IBM SPSS versión 25.0 (SPSS Inc., Chicago, IL, EEUU).
3. Resultados
3.1. Cuantificación de la alteración termooxidativa en el aceite de girasol y en la grasa remanente en el lúmen gástrico e intestinal
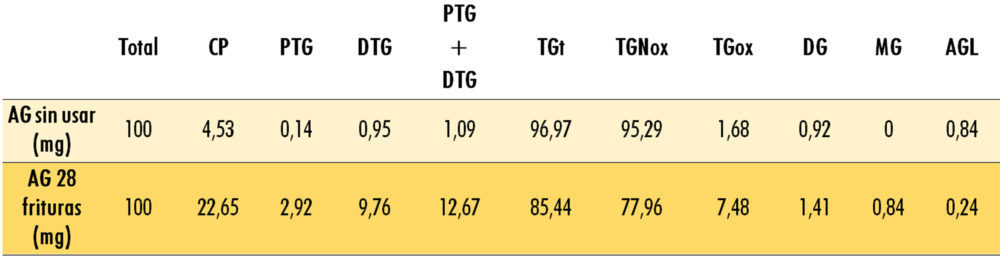
Las 28 frituras de productos de merluza elevaron el contenido de CP y de compuestos termooxidados en el aceite, afectando en menor cantidad a los compuestos hidrolíticos. Así, el contenido de CP y PTG + DTG y TGox (datos en mg/100 mg aceite) se elevó de 4,53, 1,09 y 1,68 en el aceite sin usar, a 22,65, 12,67 y 7,48 en el aceite usado, respectivamente (Tabla 1).
Tabla 1. Compuestos de alteración termooxidativa e hidrolítica en el aceite de girasol sin usar y tras 28 frituras de pescado.
Los datos corresponden a los valores medios de tres determinaciones. AG: aceite de girasol; CP: Compuestos polares; PTG: polímeros de triglicéridos; DTG: dímeros de triglicéridos; TGt: triglicéridos totales; TGNox: triglicéridos no oxidados; TGox: triglicéridos oxidados; DG: diglicéridos; MG: monoglicéridos; AGL: ácidos grasos libres.
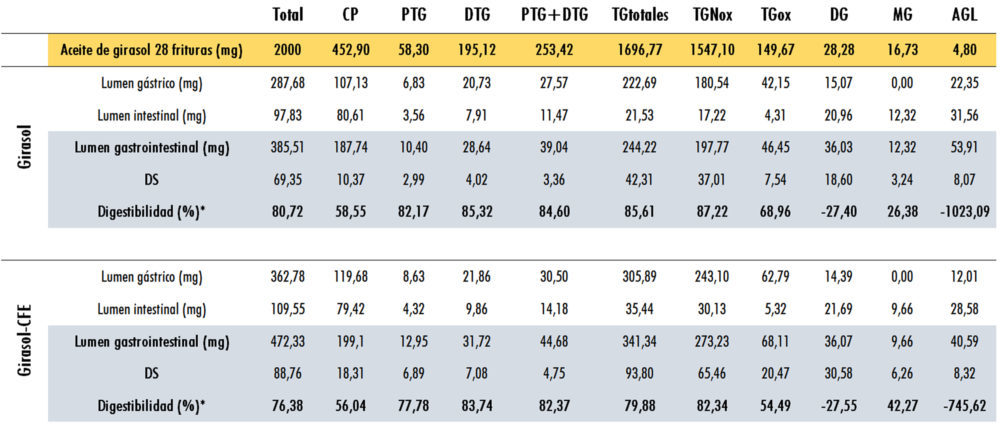
La Tabla 2 representa el perfil de los compuestos polares presentes en el AG tras las 28 frituras y en las grasas remanentes extraídas del lumen gástrico e intestinal. El contenido en los 2000 mg de AG procedente de las 28 frituras administrados fue 253,42 mg de PTG+DTG; 1547,10 mg de TG no oxidados (TGNox); 149,67 mg de TGox; 28,28 mg de DG; 16,73 mg de MG y 4,80 mg de AGL. Esta cantidad de aceite, aunque pueda parecer relativamente elevada, no produjo diarrea o esteatorrea en ninguna rata, coincidiendo con los resultados de Olivero-David (7).
Tabla 2. Alteración termooxidativa e hidrolítica en el aceite de girasol tras 28 frituras de productos de pescado y en el contenido del lumen gástrico e intestinal para los grupos AG y AG-CFE tras 3 horas de su administración in vivo.
*Digestibilidad (%) = 100 x (cantidad administrada – remanente gastrointestinal) / cantidad administrada
Los datos corresponden a los valores medios de las determinaciones. DTG: dímeros de triglicéridos; PTG: polímeros de triglicéridos; TGtotales: triglicéridos totales; TGNox: triglicéridos no oxidados; TGox: triglicéridos oxidados; DG: diglicéridos; MG: monoglicéridos; AGL: ácidos grasos libres; DS: desviación estándar; CFE: extracto del fruto del algarrobo.
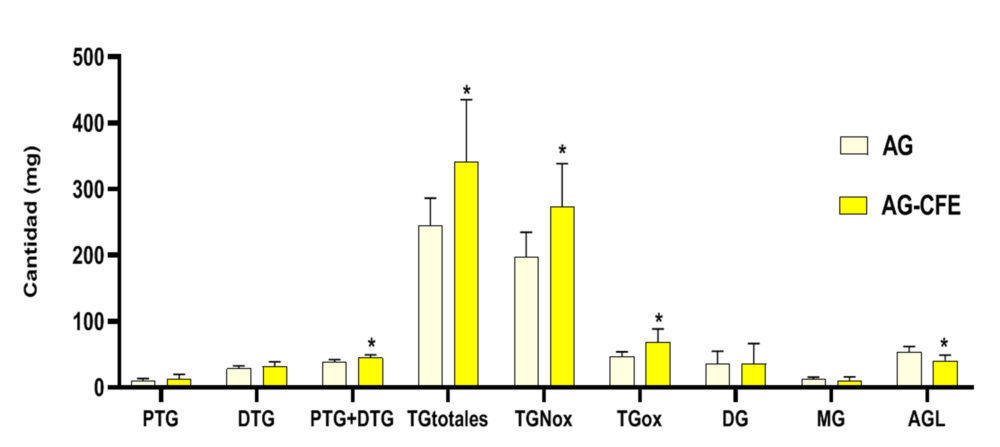
En la Figura 4 se expone el perfil de los componentes tanto alterados como no alterados presentes en el remanente gastrointestinal a las 3 horas de la administración de 2000 mg de AG y AG-CFE. El contenido gastrointestinal de grasa luminal presentó mayor cantidad de PTG+DTG, TG totales, TGNox, TGox y menor cantidad de AGL en el grupo AG-CFE (p<0,05).
Figura 4. Compuestos lipídicos en el lumen gastrointestinal. DTG: dímeros de triglicéridos; PTG: polímeros de triglicéridos; TGtotales: triglicéridos totales; TGNox: triglicéridos no oxidados; TGox: triglicéridos oxidados; DG: diglicéridos; MG: monoglicéridos; AGL: ácidos grasos libres; DS: desviación estándar; AG: aceite de girasol; AG-CFE: aceite de girasol y extracto del fruto del algarrobo.
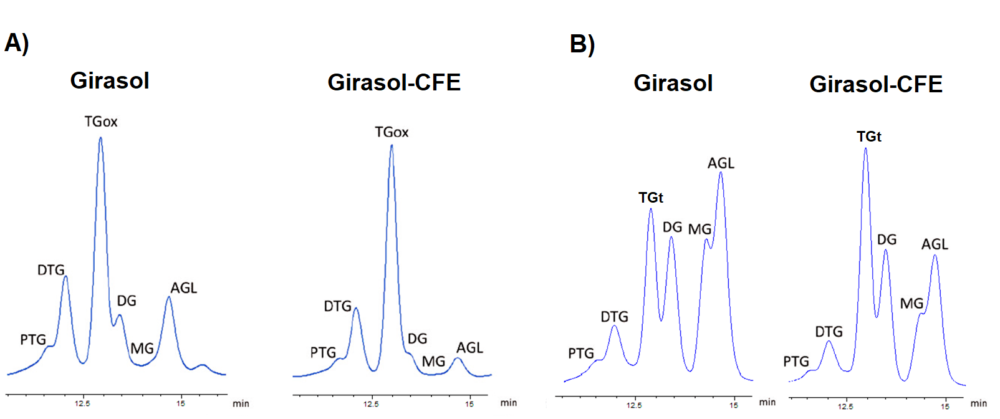
En la Figura 5A se muestran dos cromatogramas que corresponden, respectivamente, a la fracción polar de la grasa remanente en el estómago de las ratas que recibieron AG y AG-CFE. En la Figura 5B se muestran dos cromatogramas que corresponden, respectivamente, al total de la grasa remanente en el intestino de las ratas que recibieron AG y AG-CFE.
Las diferencias fundamentales en los cromatogramas corresponden al mayor porcentaje de compuestos hidrolíticos (DG, MG y AGL) en el caso del intestino.
Respecto a la comparación entre grupos, en la grasa remanente en el estómago se observaron menos compuestos hidrolíticos en AG-CFE vs. AG. En la grasa remanente en el intestino se encontraron más TG totales y menos compuestos hidrolíticos en AG-CFE vs. AG.
Figura 5: Cromatogramas HPSEC de: (A) fracción polar de la grasa remanente en el lumen gástrico de los animales que recibieron AG y AG-CFE; (B) grasa sin fraccionar remanente en el lumen intestinal de los animales que recibieron AG y AG-CFE.
3.2. Cuantificación de la alteración termooxidativa en el aceite de girasol y en el lumen gástrico e intestinal
Las concentraciones postprandiales plasmáticas de TG y colesterol se muestran en la Tabla 3. Asimismo, se muestran las concentraciones de TG en los quilomicrones.
Tabla 3. Concentración postprandial de colesterol y triglicéridos en plasma y triglicéridos en quilomicrones en las ratas de los grupos AG y AG-CFE.
Se observa un efecto hipolipemiante en el grupo que recibió CFE (AG-CFE) respecto al grupo AG. Así, las concentraciones de colesterol y TG plasmáticas fueron significativamente menores (p<0,001) en el grupo AG-CFE vs. AG. Asimismo, la concentración de TG en los quilomicrones fue significativamente menor (p<0,05) en el grupo AG-CFE vs. su control AG.
Tabla 3. Concentración postprandial de colesterol y triglicéridos en plasma y triglicéridos en quilomicrones en las ratas de los grupos AG y AG-CFE.
Valores expresados como media ± desviación estándar (DE). Los asteriscos señalan diferencias significativas entre los grupos AG y AG-CFE. (*p<0,05; ***p<0,001). AG: aceite de girasol; AG-CFE: aceite de girasol y extracto del fruto del algarrobo.
3.3. Capacidad de absorción lipídica
3.3.a Inmunolocalización y cuantificación de la inmunorreactividad del transportador NPC1L1
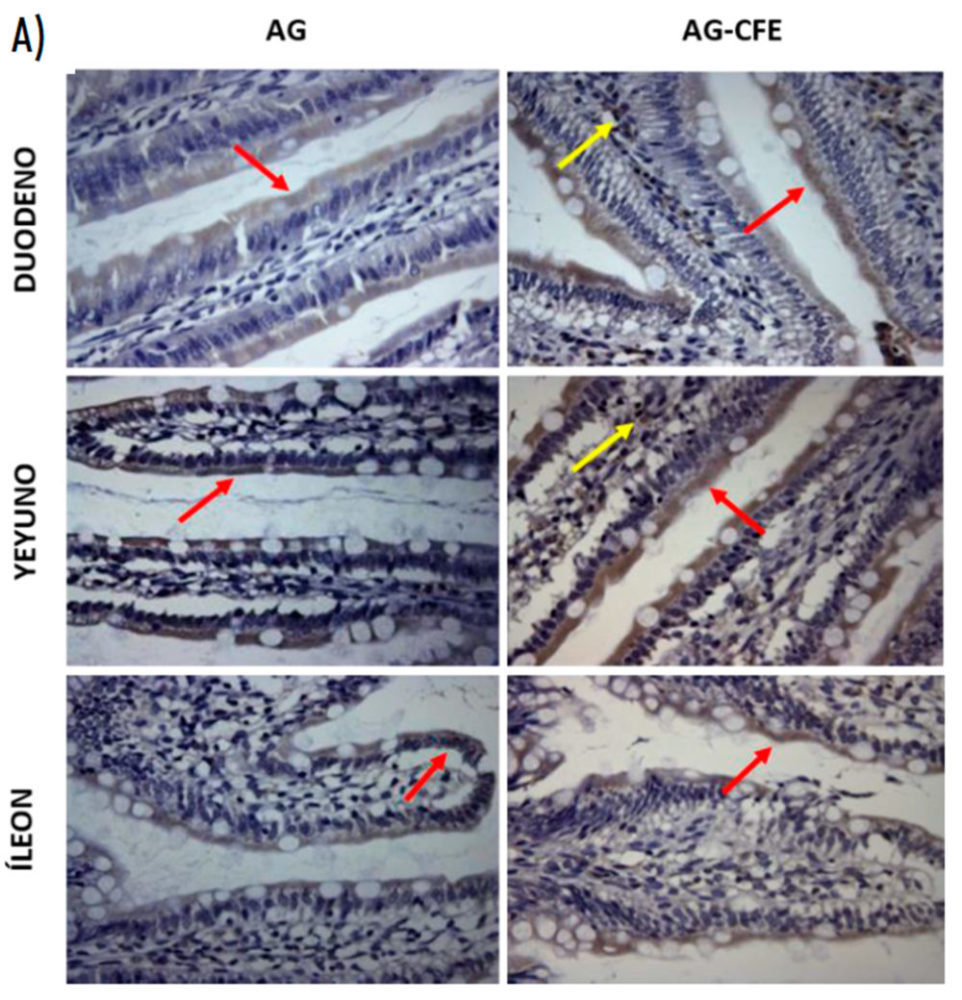
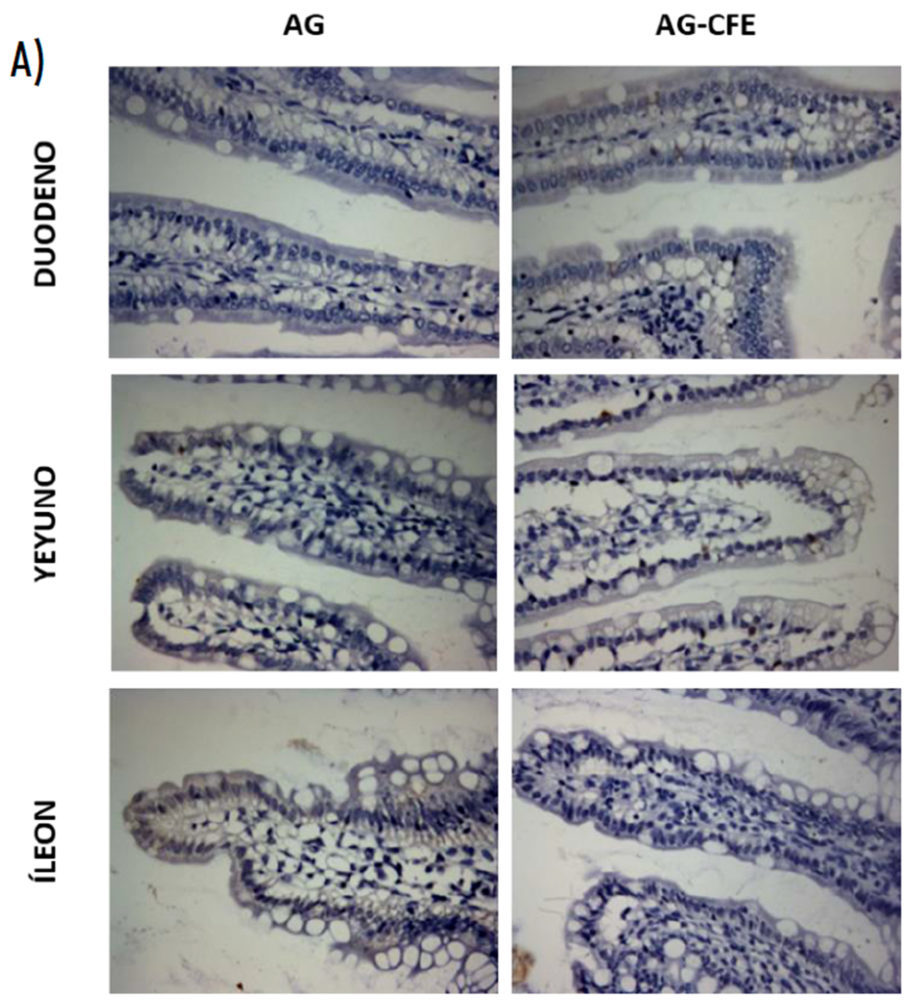
La Figura 6A muestra la inmunolocalización de NPC1L1 en duodeno, yeyuno e íleon. Observamos que los enterocitos expresaron la proteína NPC1L1 en su dominio apical para asegurar la captación de esteroles en el intestino. Además, detectamos la presencia de NPC1L1 en células del interior de la lámina propia de las vellosidades y en la parte basal de las criptas.
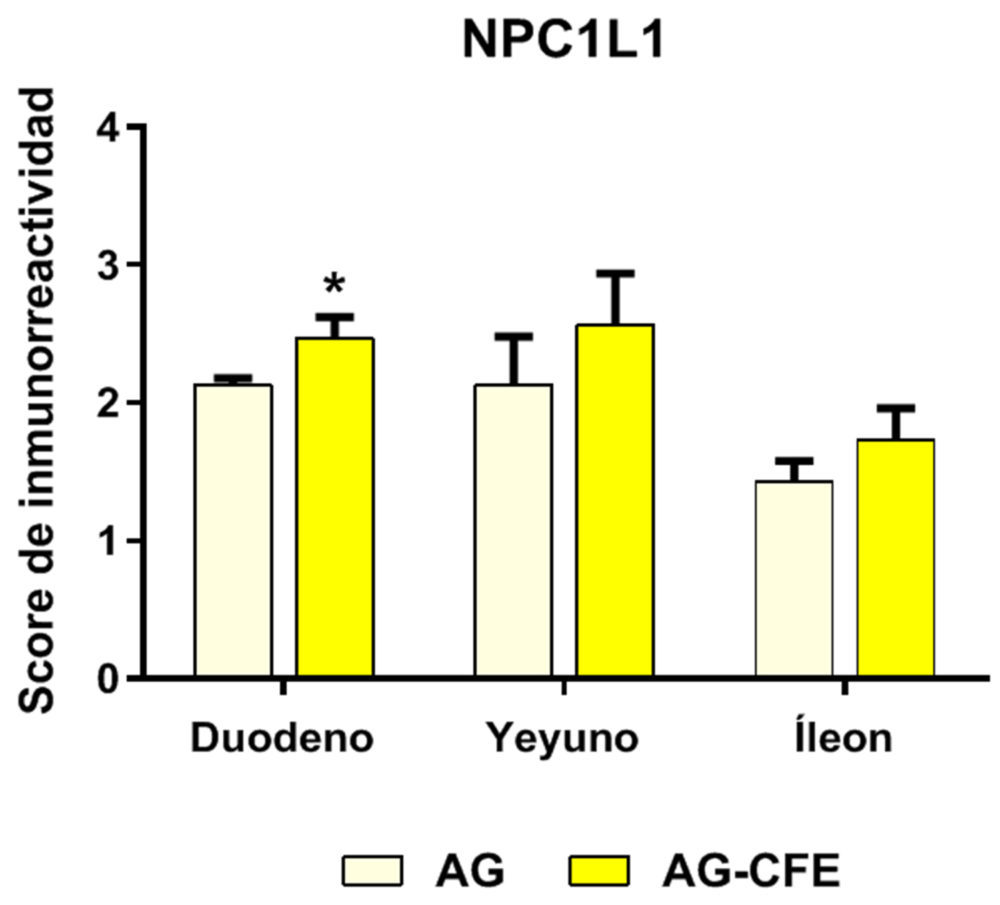
La Figura 6B representa la cuantificación de la inmunorreactividad de NPC1L1 en los tres segmentos del intestino delgado. La incorporación del CFE en el AG tiende a regular al alza el marcaje de NPC1L1 duodeno, yeyuno e íleon, detectando diferencia significativa (p<0,05) en duodeno.
Según el patrón de distribución del transportador a lo largo del intestino, se observa que ambos grupos de animales presentaron niveles más bajos del transportador NPC1L1 en íleon. Los mayores niveles de NPC1L1 se detectaron en el yeyuno del grupo AG-CFE, localización en la que sucede principalmente la captación y absorción de esteroles (tanto de origen animal como vegetal) (35).
Figura 6. Inmunolocalización del transportador NPC1L1 (A) y cuantificación de la inmunorreactividad (B) en las ratas que recibieron AG o AG-CFE. Las flechas rojas señalan la inmunoexpresión de NPC1L1 en los enterocitos. Las flechas amarillas indican la inmunoexpresión de NPC1L1 en células de la lámina propia. Las barras con asteriscos (media + desviación estándar) señalan diferencias significativas debidas al CFE (AG vs. AG-CFE) (*p<0,05). NPC1L1: transportador Niemann-Pick C1-like 1; AG: aceite de girasol; AG-CFE: aceite de girasol y extracto del fruto del algarrobo.
3.3.b Inmunolocalización y cuantificación de la inmunorreactividad de la proteína intestinal ACAT-2
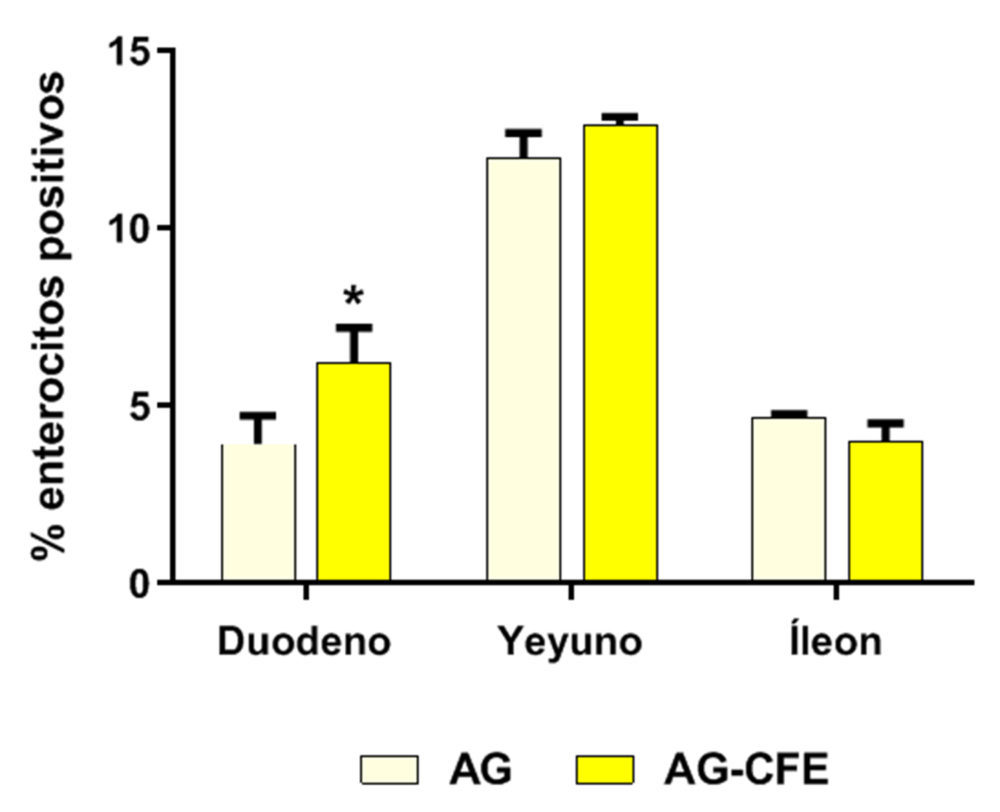
Los resultados de la inmunohistoquímica de ACAT-2 en los tres segmentos se muestran en la Figura 7A. El marcaje de ACAT-2 se localizó en el citoplasma de los enterocitos, fundamentalmente en la región apical de la vellosidad. La Figura 7B representa los resultados relativos al marcaje de ACAT-2 en los tres segmentos intestinales, expresando como porcentaje de enterocitos positivos.
El yeyuno fue el segmento intestinal con mayor expresión de ACAT-2. La administración de CFE provocó cambios en el marcaje de ACAT-2 en el duodeno, donde el grupo AG-CFE mostró una mayor expresión respecto a AG (p<0,05).
Figura 7. Inmunolocalización de la proteína ACAT-2 (A) y cuantificación de la inmunorreactividad (B) en las ratas que recibieron AG o AG-CFE. Las barras con asteriscos (media + desviación estándar) señalan diferencias significativas debidas al CFE (AG vs. AG-CFE) (*p<0,05). ACAT-2: Acetil-CoA acetiltransferasa 2; AG: aceite de girasol; AG-CFE: aceite de girasol y extracto del fruto del algarrobo.
3.3.c Inmunolocalización y cuantificación de la inmunorreactividad del transportador MTP
La Figura 8A muestra la inmunolocalización del transportador MTP en los tres segmentos del intestino delgado. La intensidad del marcaje de MTP disminuyó desde las regiones proximales a las distales del intestino. El marcaje para MTP se localizó específicamente en el citoplasma de los enterocitos, asociado a la región apical de las vellosidades intestinales. No se observó inmunorreactividad para MTP en las células de la lámina propia, en las células globosas, en las criptas de Lieberkühn de la mucosa, ni tampoco en otras capas de la pared intestinal, demostrando la especificidad del enterocito para expresar MTP.
En la Figura 8B se presentan los resultados de la cuantificación de la inmunorreactividad de MTP en el intestino delgado. El duodeno y el yeyuno de los grupos AG y AG-CFE presentaron un patrón similar de expresión del transportador. El CFE moduló la inmunorreactividad de MTP en el íleon. Así, el grupo AG-CFE respecto a AG mostró valores de MTP significativamente mayores en el íleon (p<0,05).
Figura 8. Inmunolocalización del transportador MTP (A) y cuantificación de la inmunorreactividad (B) en las ratas que recibieron AG o AG-CFE. Las barras con asteriscos (media + desviación estándar) señalan diferencias significativas debidas al CFE (AG vs. AG-CFE) (*p<0,05). MTP: proteína de transferencia de triglicéridos microsomales; AG: aceite de girasol; AG-CFE: aceite de girasol y extracto del fruto del algarrobo.
3.3.d Evaluación del estado antioxidante intestinal
La Figura 9 muestra las actividades de las enzimas SOD, CAT, GR y GPx en los tres segmentos del intestino delgado. En términos generales, las actividades SOD, GR y GPx fueron más elevadas en yeyuno; sin embargo, la actividad CAT resultó mayor en íleon.
Figura 9. Actividades antioxidantes en los tres segmentos intestinales de las ratas que recibieron AG o AG-CFE. Las barras con asteriscos (media + desviación estándar) señalan diferencias significativas para las comparaciones entre AG vs. AG-CFE (*p<0,05; ***p<0,001). SOD: superóxido dismutasa; CAT: catalasa; GR: glutatión reductasa; GPx: glutatión peroxidasa; AG: aceite de girasol; AG-CFE: aceite de girasol y extracto del fruto del algarrobo.
En los animales a los que se administró AG-CFE se encontraron actividades significativamente menores de SOD en yeyuno (p<0,05) en comparación con su respectivo control AG. El grupo AG-CFE mostró una mayor actividad de CAT en el duodeno y menor en el íleon frente al grupo AG (p<0,001 y p<0,05, respectivamente). La actividad de GR fue significativamente menor en la fracción yeyunal de las ratas AG-CFE vs. AG (p<0,05). La actividad GPx fue significativamente menor en la fracción yeyunal de los animales AG-CFE con respecto a su control AG (p<0,001).
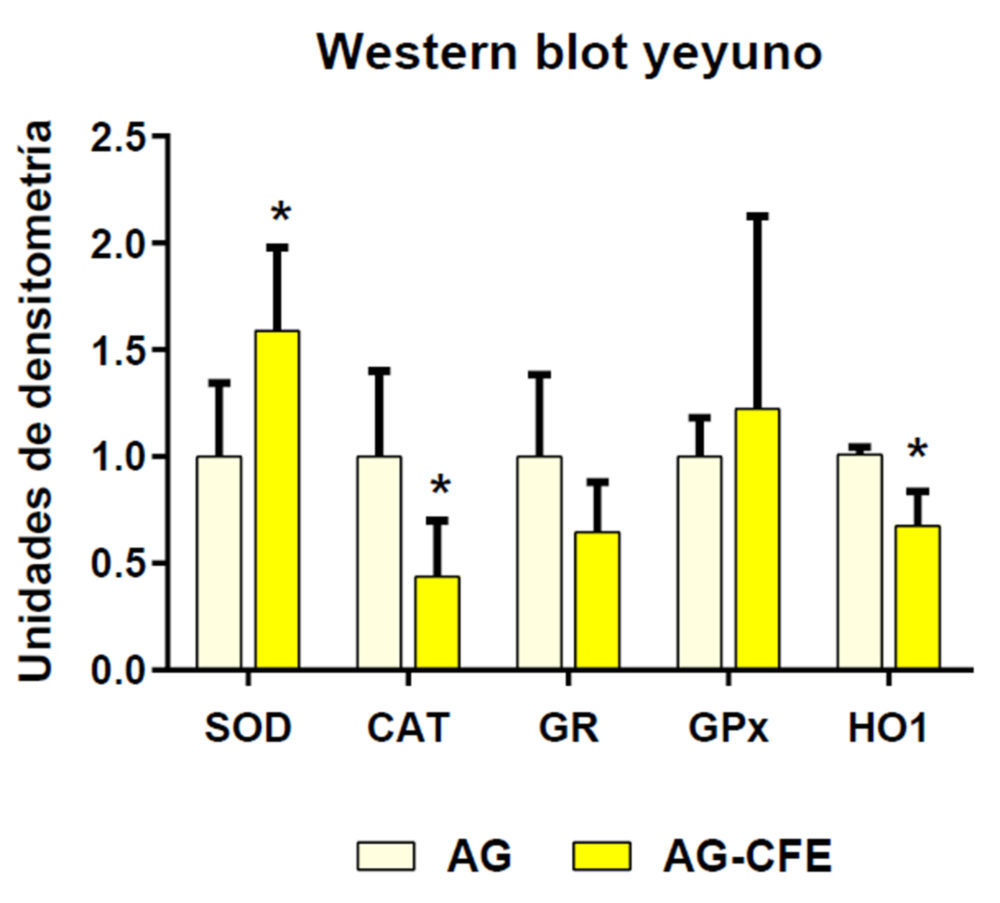
La Figura 10 muestra los niveles proteicos de las cuatro enzimas antioxidantes (SOD, CAT, GR y GPx) y HO1 en el yeyuno. Se seleccionó solo la fracción yeyunal atendiendo a los cambios observados en las actividades enzimáticas y por ser el segmento intestinal en el que tiene lugar la mayor absorción de grasa (35). Se estudiaron las posibles diferencias en los niveles de estas proteínas en función del producto administrado (AG o AG-CFE).
Figura 10. Niveles de proteínas antioxidantes intestinales (SOD, CAT, GR y GPx) y hemoxigenasa 1 determinados por Western Blot en el yeyuno de las ratas que recibieron AG o AG-CFE. Las barras con asteriscos (*p<0,05; **p<0,01) señalan diferencias significativas entre el grupo AG-CFE y AG. SOD: superóxido dismutasa; CAT: catalasa; GR: glutatión reductasa; GPx: glutatión peroxidasa; HO1: hemoxigenasa 1. AG: aceite de girasol; AG-CFE: aceite de girasol y extracto del fruto del algarrobo.
La administración conjunta del aceite con CFE incrementó significativamente (p<0,05) los niveles proteicos de SOD vs. el grupo AG, a la vez que redujo significativamente los niveles de CAT y HO1 (p<0,05) en AG-CFE vs. AG.
4. Discusión
La concentración de CP en el AG sin usar señala que se trataba de un aceite de buena calidad según Lumley (39). La fritura repetida de palitos y filetes de merluza a 180 ºC en AG, con adición de aceite cada 4 frituras, incrementó la alteración termooxidativa de este aceite. El nivel de CP + DTG superó ligeramente el valor de 20 mg/100 mg de aceite, por lo que este aceite era aún válido para su consumo en humanos atendiendo a la legislación vigente en España (10). Sin embargo, su contenido en PTG superó el 10-12 %, por lo que, según la Sociedad Alemana para la Investigación de las Grasas (9), este aceite debería ser rechazado para el consumo humano. La falta de equivalencia entre CP y PTG ha sido ya indicada (8), particularmente en aceites con alto contenido de ácidos grasos poliinsaturados (40).
Considerando las cantidades medias de grasa en el lumen gastrointestinal, la digestibilidad de los aceites testados a las tres horas fue del 80,72 % en el grupo AG y del 76,38 % en el grupo AG-CFE. Igualmente, del aceite administrado el 4,89 % en el grupo AG y el 5,48 % en el grupo AG-CFE se encuentra en el lumen intestinal aún sin absorberse, lo que muestra el efecto inhibidor de la digestión al añadir CFE. Stanley et al. (41), Oliveira et al. (42), Macho-González et al. (26) y Gonçalves et al. (43) han señalado el efecto inhibitorio de las proantocianidinas sobre la lipasa pancreática, lo que explicaría el efecto inhibidor de la digestión encontrado.
La digestibilidad gastrointestinal de los compuestos de polimerización (PTG+DTG) y oxidación (TGox) fue menor en el grupo AG- CFE vs. AG (82,37 % vs. 84,60 % y 54,49 vs. 68,96 %, respectivamente) (Tabla 2). Estos resultados recuerdan a los de Olivero-David (7) y Márquez-Ruiz (2), quienes señalan que la presencia de compuestos poliméricos reduce la acción de la lipasa pancreática. Además, apoyan la idea de que en el estómago hay una elevada producción de ROS, en este caso de TGox (7). En el lumen gastrointestinal, se encontró mayor cantidad de PTG+DTG y TGox en AG-CFE (Figura 4), a pesar del efecto teóricamente antioxidante del CFE.
En el lumen intestinal la cantidad de grasa no absorbida tendió a ser más elevada en el grupo AG-CFE, aunque no se encontraron diferencias significativas. La digestión a nivel intestinal se relaciona fundamentalmente con la presencia de la lipasa pancreática y la naturaleza adsorbente y gelificante del CFE. No obstante, puede sugerirse que la presencia de mayores niveles de CFE y TGox provocan un atrapamiento de la lipasa y, por tanto, un menor efecto de esta enzima sobre los TGox y TGNox. Estudios previos señalan que la presencia de PTG, DTG y de TG condiciona la hidrólisis de los TGNox, mientras que la disminución de TGNox reduce la eficacia de la hidrolisis de los TGox y de PTG (2, 7, 17). El aumento de la grasa remanente y, en parte, la reducción de la lipemia postprandial se deben a la ralentización de la digestión de la grasa por la presencia de fibra insoluble (celulosa y hemicelulosa) aportada por el CFE. Esta fibra provocaría el retraso en el vaciamiento gástrico y, por ende, en la digestión y absorción de los lípidos (26). Datos preliminares no mostrados en este trabajo señalan que el contenido de polímeros en las heces recogidas durante los 3 últimos días del estudio es mayor en el grupo AG-CFE vs. AG (un 6 % más excretado). Por lo tanto, a pesar de que se observe mayor cantidad de polímeros en el lumen gastrointestinal, el potencial daño que pudieran causar es contrabalanceado por la capacidad de excreción de estos compuestos.
Los resultados de este estudio demuestran los beneficios del consumo de CFE simultáneo a la ingesta de AG alterado por la fritura repetida de pescado empanado. Para ello hemos analizado las concentraciones plasmáticas de colesterol y TG y las de TG en quilomicrones, la inmunorreactividad de las proteínas NPC1L1, ACAT-2 y MTP, y la actividad y abundancia de las enzimas anti oxidantes intestinales.
Estudios previos con CFE sugieren una reducción de la lipemia postprandial en ratas (26) e incluso en ensayos clínicos en los que se empleó el CFE como ingrediente funcional incluido o no en una matriz láctea (44, 45). Por ello, se evaluó si el CFE puede reducir la lipemia postprandial promovida por el consumo de AG térmicamente alterado y oxidado. Se observó que el grupo AG-CFE presentó menor cantidad de colesterol y TG plasmáticos y de TG en quilomicrones (Tabla 3). Adicional a la acción inhibitoria de la lipasa pancreática comentada con anterioridad, cabe señalar que el CFE impide la acción de las sales biliares sobre las gotículas de grasa (22, 23).
La información sobre cómo afecta el consumo de aceites termooxidados a la distribución y niveles de los principales transportadores y enzimas implicados en la absorción de lípidos a nivel intestinal es bastante limitada. La absorción de los TG y el colesterol ingeridos se produce en el borde en cepillo de los enterocitos. En su absorción están implicados, entre otros, el transportador de colesterol NPC1L1, la enzima ACAT-2 que esterifica el colesterol, y la proteína MTP que es imprescindible en el ensamblaje de los quilomicrones en el intestino (14,15) (Figura 11). Los cambios en la expresión de estas proteínas pueden conllevar una modificación de la absorción de grasa y una extensa regulación de todos los sistemas implicados en el mantenimiento de los niveles de grasa corporal (13–15). Por ello, la repercusión que pueda tener la ingestión de fibra insoluble rica en taninos condensados junto con un aceite alterado sobre la localización y expresión de estas proteínas puede ser relevante para caracterizar sus efectos sobre la lipemia.
Figura 11. Resumen de los procesos relacionados con la absorción de lípidos y formación de quilomicrones. Se resumen los mecanismos que relacionan el consumo de colesterol y TG, la presencia de colesterol biliar y dietético en el lumen intestinal con la formación de los quilomicrones plasmáticos. LPL: lipofosfolípidos; NPC1L1: transportador Niemann-Pick C1-like 1; SR-BI: receptor eliminador de clase B tipo I; IAP: fosfatasa alcalina intestinal; ACAT- 2: acetil-CoA acetiltransferasa 2; MTP: proteína de transferencia de triglicéridos microsomales.
La expresión de las proteínas NPC1L1, ACAT-2 y MTP se analizó por inmunohistoquímica. ACAT-2 y MTP se inmunolocalizaron exclusivamente en el citoplasma de los enterocitos (46) mientras que NPC1L1 se inmunolocalizó en la región apical de estas células, en la parte basal de las criptas y también en las células del interior de la lámina propia (Figura 12). Este hecho contrasta con los resultados de Chang et al. (46), que detectaron la inmunoexpresión de NPC1L1 exclusivamente en los enterocitos y en las criptas. Desconocemos el porqué de las diferencias, pero pueden deberse a la técnica utilizada para detectar la inmunoexpresión de NPC1L1.
Figura 12. Inmunolocalización del transportador NPC1L1 en las células del interior de la lámina propia. Estudio inmunohistoquímico con hematoxilina como colorante de contraste. Las puntas de las flechas señalan células positivas para el marcaje de NPC1L1. NPC1L1: transportador Niemann-Pick C1-like 1.
El CFE reduce la concentración de lípidos postprandiales a pesar de la mayor inmunorreactividad de NPC1L1 y ACAT-2 en el duodeno y de MTP en el íleon del grupo AG-CFE con respecto a sus controles. La regulación de la expresión de estas proteínas es compleja y no se encuentra completamente dilucidada. El aumento de la inmunorreactividad de NPC1L1 hallada en duodeno puede explicarse debido a un efecto estimulante del CFE sobre su expresión ya que este extracto, aunque rico en proantocianidinas, contiene otros componentes como esteroles vegetales que también utilizan para su absorción al transportador NPC1L1 (35). Los esteroles vegetales reducen los niveles de colesterol a través de diferentes mecanismos (47) entre los que se encuentra la modificación del flujo de colesterol. Por ello, pensamos que el aumento del flujo hacia el lumen intestinal promovido por los esteroles vegetales del CFE podría estar regulando al alza la expresión de NPC1L1.
Complementariamente, hay que tener en cuenta el efecto de secuestro propio de la fibra, capaz de embeber al colesterol dietético y biliar. Este hecho podría disminuir el contacto del colesterol con la mucosa intestinal, evitar su absorción y estimular la regulación al alza de la expresión de NPC1L1 (15,48). Resultados similares fueron publicados por Huff et al. (16) que observaron un aumento de la expresión de NPC1L1 en la mucosa intestinal de los animales alimentados con una dieta escasa en colesterol, mientras que disminuyó la expresión de NPC1L1 en los animales alimentados con una dieta hipercolesterolemiante. La mucosa intestinal está directamente expuesta a ácidos grasos oxidados de origen dietético y este tejido experimenta fácilmente desequilibrios redox y estrés oxidativo después de la ingestión de grandes cantidades de grasa oxidada (49). En cuanto a la mayor inmunorreactividad de ACAT-2 en duodeno, pensamos que puede deberse al aumento de TGox presentes en el intestino. Wang et al. (50) determinaron que la enzima ACAT-2 es altamente sensible al estrés oxidativo intestinal y puede aumentar su expresión por la presencia de una mayor cantidad de ROS en el intestino. El aumento en el número de frituras genera ROS que pueden oxidar el residuo de ubiquitinación de ACAT-2, estabilizando así la proteína y evitando su degradación. La estabilización de ACAT-2 tiene un efecto claramente beneficioso, pues disminuye la lipotoxicidad y está relacionada con menor susceptibilidad de resistencia a la insulina (50).
Iqbal et al. (48) señalan que la regulación de MTP no depende de la expresión ni de la actividad de ACAT-2, lo que explicaría que aun encontrándose modificada la inmunorreactividad ACAT-2 no se encuentren cambios en la expresión de MTP en la fracción duodenal. Sin embargo, sí que se detecta mayor inmunorreactividad de MTP en el íleon de las ratas administradas con AG-CFE vs.
AG. Como hemos comentado, el CFE es capaz de inhibir parcialmente la lipasa pancreática (26), reduciendo la hidrólisis de los TG en AGL y MG que puedan difundir al enterocito. Adicionalmente, los AGL y MG pueden ser embebidos en la matriz de la fibra insoluble, impidiendo también la difusión al interior del enterocito. De esta forma se explica el aumento de la inmunorreactividad de MTP, ya que esta enzima podría aumentar su expresión cuando existen niveles reducidos de AGL. A su vez, las menores tasas de AGL explicarían los niveles más bajos de TG en quilomicrones y en plasma en el grupo AG-CFE vs. AG. Todos estos hechos sugieren que el CFE impide la captación de TG y colesterol. Sin embargo, serían necesarios más estudios que evalúen los mecanismos por los que se produce tal efecto sobre los lípidos en el intestino. No obstante, pueden existir otros mecanismos tales como: la reducción de la capacidad de micelización, la disminución de la actividad (pero no de la expresión) de las proteínas implicadas, la mayor actividad de los transportadores ABCG5/G8, etc. (51).
La menor lipemia y quilomicronemia postprandial observada en el grupo AG-CFE puede considerarse un factor positivo, dada la relación entre lipemia postprandial elevada y el riesgo cardiovascular (52, 53). Por otro lado, las ROS que continuamente se forman en nuestro organismo, presentan en general una gran agresividad oxidativa celular y parecen estar relacionadas con distintos procesos patológicos. Las proantocianidinas presentes en el CFE muestran una gran capacidad antioxidante, siendo capaces de incrementar la expresión del sistema antioxidante intestinal.
El papel protector del intestino delgado frente agresiones prooxidantes relacionadas con la dieta es aún poco conocido. Nuestros resultados señalan cómo la abundancia y actividad de las principales enzimas antioxidantes intestinales (SOD, CAT, GR y GPX) y HO1 se modifican al ingerir CFE junto con AG termooxidado. La mayor reducción en la actividad enzimática se produjo en el yeyuno, donde el CFE disminuyó la actividad SOD, GR y GPx. Sin embargo, aumentó la actividad CAT en duodeno al tiempo que disminuyó en íleon (Figura 9). La abundancia de las enzimas antioxidantes (Figura 10) fue mayor para SOD y menor para CAT y HO1 en los yeyunos de las ratas AG-CFE que en las ratas AG. La mayor actividad de catalasa en duodeno en el grupo AG-CFE no es fácil de explicar, dado que es el yeyuno el segmento que contribuye de manera más importante a la digestión y absorción de grasa. No obstante, debe recordarse que a nivel intestinal se encontraron cantidades más elevadas de TGox en el grupo AG-CFE que, aunque permanecen menos accesibles a la lipasa pancreática, sí pueden transferir radicales oxidantes a las lipoproteínas de membrana de los enterocitos duodenales, demandando mayor actividad antioxidante para su eliminación. Aunque la acción de la catalasa se ha definido claramente como enzima eliminadora de H2O2, Yokozawa et al. (54) han señalado que, en algunos tejidos, a concentraciones menores de 100 mol de peróxidos y en presencia de proantocianidinas, es la catalasa el enzima que contribuye preferentemente a eliminar los peróxidos, siendo mucho menos relevante la acción de la GPx (Figura 13). No obstante, otros posibles mecanismos indican que se encuentran gran cantidad de peroxisomas en la región apical de los enterocitos maduros que se descaman, y que la administración de aceites oxidados en ratas Wistar regula al alza la expresión génica de las enzimas acil-CoA oxidasa y citocromo p450 4A1c y activa PPARa (55), reduciendo significativamente el ARNm y las actividades de enzimas lipogénicos (56). Debe recordarse que tanto la acción de HO1 (isoformas del citocromo p450) como PPARa inducen producción peroxisomal y microsomal de radicales de oxígeno requiriendo mayor activación de la catalasa (57).
Teniendo en cuenta la abundancia y la actividad enzimática, la menor activación del sistema antioxidante intestinal sugiere que se demandan menos recursos endógenos para neutralizar el poder prooxidante del AG termooxidado. Es bien sabido que las proantocianidinas actúan como poderosos captadores de radicales libres (15,24,25), por lo que se requeriría menor actividad SOD para neutralizar el anión superóxido (Figura 13).
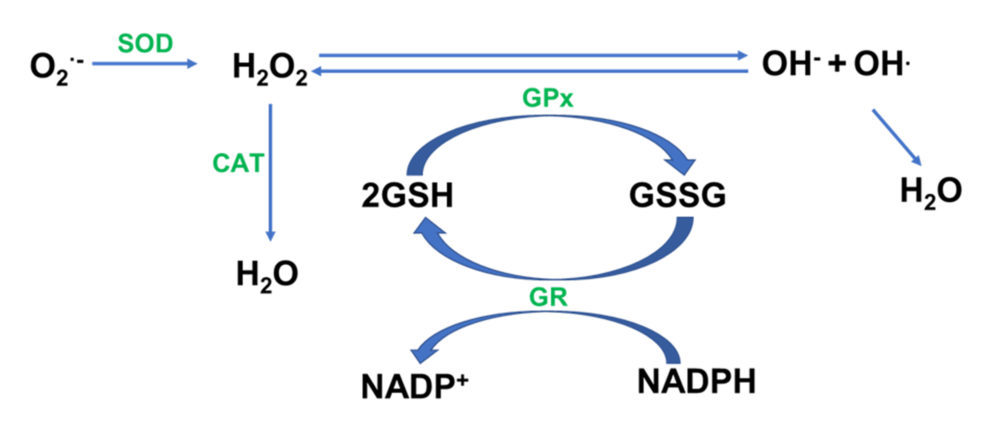
Figura 13. Esquema general del sistema del glutatión implicado en la eliminación del anión superóxido y del peróxido de hidrógeno y recuperación de los niveles de glutatión reducido. SOD, superóxido dismutasa; CAT, catalasa; GR, glutatión reductasa, GPx, glutatión peroxidasa; GSH, glutatión reducido; GSSG; glutatión peroxidado.
Rtibi et al. (58) sugirieron que un suplemento dietético conteniendo algarrobo podría usarse para prevenir enfermedades relacionadas con el exceso de radicales libres. De igual modo, la infraactivación del sistema glutatión puede deberse a la menor presencia de especies oxidantes en el grupo AG-CFE vs. AG. Estas enzimas tienen un papel fundamental en la eliminación de peróxidos (de hidrógeno, lipídicos y orgánicos). Yang et al. (59) señalan que las proantocianidinas disminuyen la peroxidación lipídica. Este hecho sugiere que el CFE permite asegurar la actividad del sistema glutatión, mejorando la respuesta del intestino a un posible estrés oxidativo y protegiendo a la mucosa intestinal. Sin embargo, debemos señalar que algunas actividades y abundancias de enzimas antioxidantes intestinales permanecen similares en ambos grupos de ratas, debido probablemente al alto contenido en antioxidantes de la dieta de mantenimiento que consumen.
La HO1 es un enzima inducible cuya expresión aumenta por una variedad enorme de agentes (60). En condiciones de estrés, la HO1 se transloca al núcleo donde regula su propia expresión. La localización nuclear de HO1 se ha relacionado con la protección contra el estrés oxidativo y las agresiones proinflamatorias mediante la regulación positiva de los genes antioxidantes y la regulación del sistema inmune. Sin embargo, en su función de proteger las células, también se ha observado que aumenta la supervivencia y suprime las vías apoptóticas, por lo que puede llegarse a producir una proliferación incontrolada y progresión hacia la carcinogénesis. Los menores niveles de proteína de HO1 podrían estar asociados con la disminución de los TGox ya discutida.
A pesar de los resultados positivos obtenidos, este estudio presenta algunas limitaciones, entre las que podemos destacar: (1) el número de animales de experimentación empleado fue reducido, (2) el estudio se realizó solo en ratas macho, (3) solo se testó una dosis de CFE, (4) la dieta de mantenimiento contenía componentes antioxidantes y (5) la duración del estudio fue únicamente de una semana.
5. CONCLUSIONES
La fritura repetida de palitos de merluza eleva los productos de hidrólisis, termooxidación y de polimerización en el aceite que recomendaría su descarte según la Sociedad Alemana para la Investigación de las Grasas (9), aunque según la legislación española este aceite podría ser aún consumido. La administración de este aceite termooxidado provoca la presencia de compuestos de polimerización y de TGox y TGNox en el lumen gástrico e intestinal. La administración conjunta de AG y CFE reduce la digestión y absorción de la grasa y la lipemia postprandial, ayuda a mantener el estado antioxidante intestinal y favorece la eliminación de los compuestos polimerizados a través de las heces.
Lista de Abreviaturas
ACAT-2, acetil-CoA acetiltransferasa 2; AG, Aceite de girasol; AGL, ácidos grasos libres; CAT, catalasa; CFE, extracto de algarrobo; CP, compuestos polares; DG, diglicéridos o diacilgliceroles; DTG, dímeros de triglicéridos; GPx, glutatión peroxidasa; GR, glutatión reductasa; HO1, hemo-oxigenasa-1; MG, monoglicéridos o monoacilgliceroles; MTP, proteína de transferencia de triglicéridos microsomales; NPC1L1, transportador Niemann-Pick C1-like 1; PTG, polímeros de triglicéridos; ROS, especies reactivas de oxígeno; SOD, superóxido dismutasa; TG, triglicéridos o triacilgliceroles; TGNox, triglicéridos no oxidados; TGox, triglicéridos oxidados.
Conflicto de intereses
Los autores declaran la ausencia de conflicto de intereses.
Agradecmientos
Los autores agradecen la colaboración y asesoramiento a Mª José González Muñoz, Giulia Caso, Ángela Amores Arrojo e Isabel Martín de la Torre. Rocío Redondo-Castillejo recibió una ayuda FPU20/02920 del Ministerio de Universidades. Agradecimiento al Proyecto PID2019-103872RB-I00, financiado por el Ministerio de Ciencia, Innovación y Universidades, y al Consejo Oleícola Internacional (COI) por su financiación como apoyo a la investigación mediante un artículo 83 COI-UCM.
6. REFERENCIAS
1. Garcimartín A, Macho-González A, Caso G, Benedí J, Bastida S, Sánchez-Muniz FJ. Frying a cultural way of cooking in the Mediterranean diet. How to obtain improved fried foods. En: Preedy V, Watson R, editores. Mediterranean diet. 2a ed. Amsterdam: Elsevier; 2020. p. 191–207.
2. Márquez-Ruiz G, Dobarganes MC. Nutritional and physiological effects of used frying fats. En: Perkins E, Erickson M, editores. Deep frying: chemistry, nutrition and practical applications. Champaign, IL.: AOCS Press; 1996. p. 160–82.
3. Brühl L. Fatty acid alterations in oils and fats during heating and frying. Eur J Lipid Sci Technol. 2014; 116(6):707–15.
4. Sánchez-Muniz FJ. Oils and fats: Changes due to culinary and industrial processes. Int J Vitam Nutr Res. 2006; 76(4):230–7.
5. Dobarganes C, Márquez-Ruiz G. Possible adverse effects of frying with vegetable oils. Br J Nutr. 2015; 113(S2):S49–57.
6. Sánchez-Muniz FJ, Bastida S, Márquez-Ruiz G, Dobarganes C. Effect of heating and frying on oil and food fatty acids. En: Chow CK, editor. Fatty acids in foods and their health implications. 3a ed; CRC Press 2007. p. 511-43.
7. Olivero-David RJ. Digestibilidad de los compuestos termooxidados y su influencia sobre la defensa antioxidante intestinal en ratas. Efectos del ayuno y grado de alteración del aceite de fritura. [Tesis doctoral]. Facultad de Farmacia. Universidad de Alcalá; 2011.
8. Sánchez-Muniz FJ, Bastida S, Márquez-Ruiz G, Dobarganes MC. Effects of heating and frying on oil and food fatty acids. En: Cho CK, editor. Fatty acids in foods and their health implications. Boca Raton, FL, USA: CRC Press, Taylor and Francis Book.; 2008. p. 511–43.
9. German Society for Fat Research (DGF). Proceedings of the 3rd international symposium of deep-fat frying. Final recommendations. Eur J Lipid Sci Technol. 2000; 103–594.
10. Orden de 26 de enero de 1989 por la que se aprueba la Norma de calidad para los aceites y grasas calentados. [Internet]. «BOE» núm. 26, de 31/01/1989 [Consultado 13 Oct 2020]. Disponible en: https://www.boe.es/eli/es/o/1989/01/26/(1)/con
11. Li X, Wu G, Yang F, Meng L, Huang J, Zhang H, et al. Influence of fried food and oil type on the distribution of polar compounds in discarded oil during restaurant deep frying. Food Chem 2019; 272:12–7.
12. Sánchez-Muniz FJ, Sánchez-Montero JM. Enzymatic methods for the study of thermoxidized oils and fats. En: Boskou D, Elmadfa I, editores. Frying of food oxidation, nutrient and non-nutrient antioxidants, biologically active compounds and high temperatures. Pensilvania, USA: Technomic Publishing Co, Inc. Lancaster; 1999. p. 105–41.
13. Davis HR, Basso F, Hoos LM, Tetzloff G, Lally SM, Altmann SW. Cholesterol homeostasis by the intestine: Lessons from Niemann-Pick C1 Like 1 (NPC1L1). Atheroscler Suppl. 2008; 9(2):77–81.
14. Alphonse PAS, Jones PJH. Revisiting human cholesterol synthesis and absorption: The reciprocity paradigm and its key regulators. Lipids. 2016; 51(5):519–36.
15. Iqbal J, Hussain MM. Intestinal lipid absorption. Am J Physiol Endocrinol Metab. 2009; 296(6):1183–94.
16. Huff MW, Pollex RL, Hegele RA. NPC1L1: Evolution from pharmacological target to physiological sterol transporter. Arterioscler Thromb Vasc Biol. 2006; 26(11):2433–8.
17. González-Muñoz MJ, Bastida S, Sánchez-Muniz FJ. Short-term in vivo digestibility assessment of a highly oxidized and polymerized sunflower oil. J Sci Food Agric. 2003; 83(5):413–8.
18. Olivero-David R, Bastida S, Schultz A, González-Torres L, González MJ, Sánchez-Muniz FJ, et al. Fasting status and thermally oxidized sunflower oil ingestion affect the intestinal antioxidant enzyme activity and gene expression of male Wistar rats. J Agric Food Chem. 2010; 58:2498–504.
19. Billeck G. Heated fats in the diet. En: Padley FB, Podmore J, editores. The role of fats in human nutrition. Chichester, UK.: Ellis Horwood Ltd; 1985. p. 163–71.
20. Frankel EN. Review. Recent advances in lipid oxidation. J Sci Food Agric. 1991; 54(4):495–511.
21. Thomas S, Prabhu R, Balasubramanian KA. Surgical manipulation of the intestine and distant organ damage – Protection by oral glutamine supplementation. Surgery. 2005; 137(1):48–55.
22. Gálvez Peralta J, Rodríguez Cabezas M, Camuesco Pérez D. Fibra dietética. En: Gil A, editor. Tratado de nutrición. Barcelona: Editorial Médica Panamericana; 2017. p. 87–110.
23. Fuller S, Beck E, Salman H, Tapsell L. New horizons for the study of dietary fiber and health: a review. Plant Foods Hum Nutr. 2016; 71(1):1–12.
24. González-Quilen C, Rodríguez-Gallego E, Beltrán-Debón R, Pinent M, Ardévol A, Blay MT, et al. Health-promoting properties of proanthocyanidins for intestinal dysfunction. Nutrients. 2020;12(1).
25. Macho-González A, Garcimartín A, López-Oliva E, Benedí J, Bastida S, Sánchez-Muniz FJ. Papel de las proantocianidinas sobre la microbiota, permeabilidad intestinal e inflamación. En: Marcos A, editor. Inmunonutrición. Estilo de vida. 2a. Ed. Editorial Panamericana; 2020. p. 245–66.
26. Macho-González A, Garcimartín A, Naes F, López-Oliva ME, Amores-Arrojo A, González-Muñoz MJ, et al. Effects of fiber purified extract of carob fruit on fat digestion and postprandial lipemia in healthy rats. J Agric Food Chem. 2018; 66(26):6734–41.
27. Ruiz-Roso B, Requejo AM, Pérez-Olleros L, Martín-Casero M, Haber B. Denatured Carob Flour (DCF) with a low content of soluble tannins and sugars, meant for human consumption and process to obtain it. WO/2004/014150, 2004.
28. Bligh EG, Dyer WJ. A rapid method of total lipid extraction and purification. Can J Biochem Physiol. 1959; 37(8):911–7.
29. Dobarganes MC, Velasco J, Dieffenbacher A. Determination of polar compounds, polymerized and oxidized triacylglycerols, and diacylglycerols in oils and fats: Results of collaborative studies and the standardized method (Technical report). Pure Appl Chem. 2000; 72(8):1563–75.
30. Bocanegra A, Bastida S, Benedí J, Nus M, Sánchez-Montero JM, Sánchez-Muniz FJ. Effect of seaweed and cholesterol-enriched diets on postprandial lipoproteinaemia in rats. Br J Nutr. 2009; 102(12):1728–39.
31. Santos-López JA, Garcimartín A, Merino P, López-Oliva ME, Bastida S, Benedí J, et al. Effects of silicon vs. hydroxytyrosol-enriched restructured pork on liver oxidation status of aged rats fed high-saturated/high-cholesterol diets. PLoS One. 2016; 11(1):e0147469).
32. Aebi H. Catalase in vitro. Methods Enzymol. 1984; 105(C):121–6.
33. Mannervik B. Measurement of glutathione reductase activity. Curr Protoc Toxicol. 2001; 00(1):7.2.1-7.2.4.
34. Agarkov AA, Popova TN, Verevkin AN, Matasova L V. Activity of the glutathione antioxidant system and NADPH-generating enzymes in blood serum of rats with type 2 diabetes mellitus after administration of melatonin-correcting drugs. Bull Exp Biol Med. 2014; 157(2):198–201.
35. Altmann SW, Davis HR, Zhu LJ, Yao X, Hoos LM, Tetzloff G, et al. Niemann-Pick C1 Like 1 protein is critical for intestinal cholesterol absorption. Science. 2004; 303(5661):1201–4.
36. Macho-González A, Garcimartín A, López-Oliva ME, Ruiz-Roso B, De la Torre IM, Bastida S, et al. Can carob-fruit-extract-enriched meat improve the lipoprotein profile, VLDL-oxidation, and LDL receptor levels induced by an atherogenic diet in STZ-NAD-diabetic rats? Nutrients. 2019;11(2).
37. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem. 1951; 193(1):265–75.
38. Garcimartín A, López-Oliva ME, Sántos-López JA, García-Fernández RA, Macho-González A, Bastida S, et al. Silicon alleviates nonalcoholic steatohepatitis by reducing apoptosis in aged Wistar rats fed a high–saturated fat, high-cholesterol diet. J Nutr. 2017; 147(6):1104–12.
39. Lumley I. Polar compounds in heated oils. En: Varela G, Bender A, ID. M, editores. Frying of foods principles, changes, new approaches. Chichester, UK.: Ellis Horwood Ltd; 1988. p. 166–73.
40. Bastida S, Sánchez-Muniz FJ. Polar content vs. TAG oligomer content in the frying-life assessment of monounsaturated and polyunsaturated oils used in deep-frying. J Amer Oil Chem Soc. 2002; 79(5):447–51.
41. Stanley TH, Van Buiten CB, Baker SA, Elias RJ, Anantheswaran RC, Lambert JD. Impact of roasting on the flavan-3-ol composition, sensory-related chemistry, and in vitro pancreatic lipase inhibitory activity of cocoa beans. Food Chem. 2018; 255:414–20.
42. Oliveira RF, Gonçalves GA, Inácio FD, Koehnlein EA, de Souza CGM, Bracht A, et al. Inhibition of pancreatic lipase and triacylglycerol intestinal absorption by a Pinhão coat (Araucaria angustifolia) extract rich in condensed tannin. Nutrients. 2015; 7(7):5601–14.
43. Gonçalves R, Mateus N, de Freitas V. Study of the interaction of pancreatic lipase with procyanidins by optical and enzymatic methods. J Agric Food Chem. 2010; 58(22):11901–6.
44. Ruiz-Roso B, Quintela JC, de la Fuente E, Haya J, Pérez-Olleros L. Insoluble carob fiber rich in polyphenols lowers total and ldl cholesterol in hypercholesterolemic subjects. Plant Foods Hum Nutr. 2010; 65(1):50–6.
45. Martínez-Rodríguez R, Navarro-Alarcón M, Rodríguez-Martínez C, Fonollá-Joya J. Efectos sobre el perfil lipídico en humanos de un extracto de algarroba (Ceratonia siliqua L.) rico en polifenoles, incluido en un lácteo como alimento funcional; estudio piloto. Nutr Hosp. 2013; 28(6):2017–114.
46. Xie C, Zhou Z Sen, Li N, Bian Y, Wang YJ, Wang LJ, et al. Ezetimibe blocks the internalization of NPC1L1 and cholesterol in mouse small intestine. J Lipid Res. 2012; 53(10):2092–101.
47. Nakano T, Inoue I, Murakoshi T. A newly integrated model for intestinal cholesterol absorption and efflux reappraises how plant sterol intake reduces circulating cholesterol levels. Nutrients. 2019; 11(2).
48. Iqbal J, Boutjdir M, Rudel LL, Hussain MM. Intestine-specific MTP and global ACAT2 deficiency lowers acute cholesterol absorption with chylomicrons and HDLs. J Lipid Res. 2014; 55(11):2261–75.
49. Wijeratne SSK, Cuppett SL. Soy isoflavones protect the intestine from lipid hydroperoxide mediated oxidative damage. J Agric Food Chem. 2007; 55(24):9811–6.
50. Wang YJ, Bian Y, Luo J, Lu M, Xiong Y, Guo SY, et al. Cholesterol and fatty acids regulate cysteine ubiquitylation of ACAT2 through competitive oxidation. Nat Cell Biol. 2017; 19(7):808–19.
51. Li R, Liu Y, Shi J, Yu Y, Lu H, Yu L, et al. Diosgenin regulates cholesterol metabolism in hypercholesterolemic rats by inhibiting NPC1L1 and enhancing ABCG5 and ABCG8. Biochim Biophys Acta Mol Cell Biol Lipids. 2019; 1864(8):1124–33.
52. Miller M, Stone NJ, Ballantyne C, Bittner V, Criqui MH, Ginsberg HN, et al. Triglycerides and cardiovascular disease: A scientific statement from the American Heart Association. Circulation. 2011; 123(20):2292–333.
53. Puri R, Nissen SE, Shao M, Elshazly MB, Kataoka Y, Kapadia SR, et al. Non-HDL Cholesterol and triglycerides: Implications for coronary atheroma progression and clinical events. Arterioscler Thromb Vasc Biol. 2016; 36(11):2220–8.
54. Yokozawa T, Satoh A, Kim YJ. Modulation of oxidative stress by proanthocyanidin in H2O2-exposed human diploid fibroblast cells. Biosci Biotechnol Biochem. 2013; 77(10):2056–60.
55. Chao PM, Chao CY, Lin FJ, Huang CJ. Oxidized frying oil up-regulates hepatic acyl-CoA oxidase and cytochrome P450-4-A1 genes in rats and activates PPARα. J Nutr. 2001; 131(12):3166–74.
56. Eder K, Suelzle A, Skufca P, Brandsch C, Hirche F. Effects of dietary thermoxidized fats on expression and activities of hepatic lipogenic enzymes in rats. Lipids. 2003; 38(1):31–8.
57. Aguilera C, Rupérez A, Ruiz F. Regulación de la expresión génica mediada por lípidos. En: Gil A, editor. Tratado de nutrición bases moleculares de la nutrición. Buenos Aires: Panamericana; 2017. p. 261–80.
58. Rtibi K, Jabri MA, Selmi S, Souli A, Sebai H, El-Benna J, et al. Carob pods (Ceratonia siliqua L.) inhibit human neutrophils myeloperoxidase and in vitro ROS-scavenging activity. RSC Adv. 2015; 5(102):84207–15.
59. Yang L, Xian D, Xiong X, Lai R, Song J, Zhong J. Proanthocyanidins against oxidative stress: From molecular mechanisms to clinical applications. Biomed Res Int. 2018; 12(2018:8584136).
60. Drummond GS, Baum J, Greenberg M, Lewis D, Abraham NG. HO-1 overexpression and underexpression: Clinical implications. Arch Biochem Biophys. 2019; 673:108073.