RESUMEN:
Las señales de daño molecular atraen a los neutrófilos hasta los lugares donde hay infección o inflamación. El receptor acoplado a la proteína G (GPR43) y el receptor para los compuestos avanzados de glicosilación (RAGE) reconocen a ácidos grasos de cadena corta (propionato y butirato) y AGEs (compuestos avanzados de glicosilación) respectivamente, estando ambos receptores abundantemente expresados en los neutrófilos y las células del epitelio intestinal. El papel funcional que juega la activación de estos receptores en la orquestación in vivo de la respuesta inmune no está claro. Nuestro trabajo examina el efecto de la ingesta de AGEs sobre la respuesta inmune, tanto en ratones sanos como en ratones a los que se les indujo una colitis, utilizando ratones transgénicos deficientes en los receptores GPR43 o RAGE. Uno de los principales hallazgos es que tanto el receptor GPR43 como el RAGE son necesarios para el reclutamiento de los neutrófilos en un modelo de inflamación intestinal por lesión de la barrera mucosa. Así mismo hemos comprobado que los AGEs ingeridos con la dieta promueven la aparición de un desequilibrio en el balance inflamatorio a nivel intestinal, dando lugar a un status proinflamatorio. Igualmente hemos demostrado que la carboximetillisina (CML), un tipo de AGE concreto, es capaz de estimular el receptor GPR43 y actuar como un factor quimioatractor de los neutrófilos. Finalmente, hemos ensayado el tratamiento con sRAGE, proteína capaz de captar AGEs libres. Este procedimiento podría ser una terapia prometedora para el tratamiento de la enfermedad inflamatoria intestinal.
Palabras Clave: Enfermedad inflamatoria intestinal; Reacción de Maillard; Carboximetillisina; Alimentos; Tratamiento térmico; RAGE; GPR43
ABSTRACT:
Molecular damage signals attract neutrophils to sites of infection or inflammation. The G-protein coupled receptor (GPR43) and the receptor for advanced glicosilation compounds (RAGE) recognize short-chain fatty acids (propionate and butyrate) and AGEs (advanced glycosylation compounds) respectively, both receptors being abundantly expressed in neutrophils and intestinal epithelial cells. The functional role that activation of these receptors plays in the in vivo orchestration of the immune response is unclear. Our work examines the effect of the ingestion of AGEs on the immune response, both in healthy mice and in mice that were induced to colitis, using transgenic mice deficient in GPR43 or RAGE receptors. One of the main findings is that both the GPR43 receptor and RAGE are necessary for the recruitment of neutrophils in a model of intestinal inflammation due to mucosal barrier injury. We have also verified that the AGEs ingested with the diet promote the appearance of an imbalance in the inflammatory balance at the intestinal level, giving rise to a pro-inflammatory status. We have also show that carboxymethylisine (CML), a specific type of AGE, is capable of stimulating the GPR43 receptor and acting as a neutrophil chemoattraction factor. Finally, we have tested the treatment with sRAGE, a protein capable of capturing free AGEs. This procedure could be a promising therapy for the treatment of inflammatory bowel disease.
Keywords: Inflammatory bowel disease; Maillard reaction; Carboximethillysine; Food; Thermal treatment; RAGE; GPR43
1. INTRODUCCIÓN
El término enfermedad inflamatoria intestinal (EII) recoge una serie de trastornos multisistémicos de etiología desconocida, caracterizados por la inflamación crónica y recurrente del tracto digestivo y cuyos cuadros clínicos más representativos son la enfermedad de Crohn y la colitis ulcerosa (1). La colitis ulcerosa afecta solo a la mucosa del intestino delgado mientras que el síndrome de Crohn afecta a toda la pared intestinal en su conjunto, tanto del intestino grueso como delgado, dando lugar a la formación de fístulas y abscesos.
La etiología precisa de la EII es desconocida e incluye diversos factores genéticos, medioambientales, nutricionales, microbiológicos e inmunológicos (2). De esta forma una respuesta inflamatoria exacerbada del intestino aparece como consecuencia de la reacción inapropiada a distintos agentes luminales, impulsada posiblemente por la microbiota intestinal (3) que sobrerregula la síntesis y liberación de distintos mediadores proinflamatorios como metabolitos reactivos del oxígeno (ROS) y nitrógeno (NOS), eicosanoides y citoquinas proinflamatorias (4). Todos estos mediadores contribuyen a la cascada patogénica que inicia y perpetúa la respuesta inflamatoria intestinal. El análisis de la flora entérica luminal ha revelado sin embargo diferencias de la composición de esta flora comparada a los controles sanos (5). Las concentraciones de bacteroides, eubacterias, peptostreptococos están incrementadas, mientras que el número de bifidobacterias está significativamente reducido. Una mejora en la integridad de la mucosa intestinal podría contribuir a reducir la inflamación intestinal (6) ya que evitaría la traslocación de endotoxinas y antígenos que sobrerregula la respuesta inmunitaria (7). Debido a esto ello se cree que los ácidos grasos de cadena corta (SCFA) provenientes de la fermentación en el intestino delgado de la fibra dietética podría mejorar la mucosa intestinal, ya que dichos ácidos grasos participan en el mantenimiento de la homeostasis colónica (8). Recientemente se ha descubierto que existe un receptor específico para los SCFA denominado GPR43, que se localiza en la mucosa del íleon (9). La activación de dicho receptor da lugar al reclutamiento de los neutrófilos, que actúan como un factor protector frente a la traslocación bacteriana, pero también como factor perjudicial en la respuesta a una inflamación crónica (10). De esta forma los SCFA actuarían in vivo como el interruptor principal para poder alcanzar el umbral crítico de otros estímulos, que dan lugar finalmente a la migración de los neutrófilos. Por todo ello, los SCFA promoverían la activación del sistema inmune de la mucosa en presencia de una barrera mucosa dañada, contribuyendo al desarrollo de la EII (11).
Diversas evidencias científicas parecen indicar que la dieta es uno de los factores medioambientales que más efecto pueden ejercer sobre el desarrollo de la EII (12) y las posteriores recaídas (13). Respecto a los alimentos individuales, los estudios epidemiológicos (12) indican que un bajo consumo de frutas y vegetales en combinación con un alto consumo de azúcares refinados, y grasa favorecen la aparición de EII. En otros estudios (13) se ha examinado el consumo de margarinas, café y alcohol y las dietas ricas en carnes rojas, obteniendo correlaciones positivas entre las recidivas de la enfermedad y la ingesta de alcohol y carnes rojas, especialmente cuando estas están tratadas térmicamente. En ambos estudios se sugiere la necesidad de realizar más estudios de investigación para aclarar la posible asociación entre la dieta y la EII. En los últimos 25 años la dieta de la población española, especialmente en la población infantil y juvenil, está cambiando el perfil mediterráneo por una alimentación más similar a la estadounidense, rica en grasas saturadas y carnes, con disminución en la ingesta de verduras y legumbres (14) y mayor consumo de snacks y productos de bollería (15). Dichos cambios dietéticos se están produciendo en la misma ventana temporal que el incremento en los casos de EII, lo que podría indicar que el mayor consumo de ciertos alimentos podría predisponer a la aparición de dicha enfermedad. Tanto las carnes como los snacks, bollería y productos precocinados tienen en común que sufren una serie de tratamientos térmicos que favorecen su digestión, conservación y aceptación por parte de los consumidores. Sin embargo, el calentamiento da lugar a la aparición de la reacción de Maillard (RM), que está constituida por una serie de reacciones entre proteínas y carbohidratos. Los productos de Maillard están presentes en cantidades considerables en la dieta diaria, debido fundamentalmente a que la mayor parte de los alimentos contienen proteínas y carbohidratos (16).
Entre los productos avanzados que se forman en la RM destacan los compuestos avanzados de glicosilación (Advanced Glycation End productS; AGEs) que pueden dañar los tejidos de diversas formas (17): Modificando la funcionalidad proteica mediante la glicosilación, formando enlaces cruzados que dan lugar a rigidez proteica y tisular o incluso interaccionando con células a través de la activación de receptores específicos (RAGE) iniciando una disfunción celular por liberación de sustancias proinflamatorias (18). El RAGE (Receptor for Advanvced Glycation End products) es una proteína transmembrana correspondiente a la superfamilia de las inmunoglobulinas y está presente en distintos tipos celulares como células endoteliales, monocitos, microglía e incluso neuronas. La unión AGE-RAGE da lugar a la formación de ROS, los cuales inducen procesos relacionados con la activación celular e inflamación (19). La principal vía proinflamatoria consiste en la expresión del NFkβ , el cual da lugar a la formación de citoquinas inflamatorias como IL-6 o TNFα . A nivel intestinal, se ha comprobado que la unión AGE-RAGE da lugar a un aumento de la permeabilidad de la mucosa (20). Así mismo, diversos autores han encontrado que la unión AGE-RAGE también incrementa el reclutamiento de células inflamatorias como los neutrófilos (21, 22).
Ante las evidencias científicas presentes en la literatura, el presente trabajo ofrece resultados a cerca de la influencia que una ingesta elevada de AGEs tiene sobre la inflamación intestinal, repercutiendo finalmente en el desarrollo de la enfermedad inflamatoria intestinal. En este sentido, se evalúa el efecto que ejerce una proteína glicosilada sobre el epitelio intestinal y la subyacente red inmunitaria, investigando si existe algún tipo de relación entre los receptores RAGE y GPR43.
2. MATERIAL Y MÉTODOS
2.1 Preparación de las muestras
Para obtener una proteína glicosilada rica en carboximetil-lisina (CML), uno de los AGEs que estimula al receptor RAGE, se siguió la técnica descrita por Valencia et al (23). De forma breve, se disuelve albúmina sérica bovina (BSA) en tampón fosfato 150 mM pH 7.4 que contiene ácido glioxílico y NaBH3CN en concentraciones 25 y 75 mM respectivamente. Esta solución se filtra de forma estéril y se incuba a 50 ºC durante 48 horas para dar lugar a la BSA glicosilada (BSA-G). De igual forma, la BSA calentada sin ácido glioxílico ni NaBH3CN se utilizó como muestra control (BSA-C). Tras la incubación, la BSA se dializa frente a agua para eliminar los restos de glucosa que no reaccionaron y las sales del tampón y finalmente se liofiliza. La cuantificación del contenido total de CML en la proteína glicosilada se realizó mediante GC-MS, utilizando 2H8-CML como estándar interno (24). De forma resumida, la muestra se reduce con NaBH4 y posteriormente se hidroliza con ácido clorhídrico. Los aminoácidos se transforman en sus trifluorometilésteres y se analizan por GC-MS en modo SIM.
2.2. Diseño experimental para los ensayos con animales
Los estudios con animales se realizaron de acuerdo con las directivas de la Convención para la protección de los animales vertebrados usados en experimentación y con otros fines científicos establecidas por la Unión Europea (85/ETS123; 86/609/EEC) y fueron aprobados por el comité de bioética de la Universidad de Granada. Se emplearon cuatro grupos de animales que cubrían la expresión de los dos receptores a estudiar: ratones homocigotos control Gpr43+/+ (129SvEvBrd, Deltagen) y RAGE+/+ (C57Bl/6, Lexicon Genetics Inc.) y ratones transgénicos que sufren la delección del gen que codifica dichos receptores, ratones Gpr43-/- (129SvEvBrd, Deltagen) y ratones RAGE-/- C57Bl/6 (Lexicon Genetics Inc.). Los animales se mantuvieron en ciclos de luz-oscuridad de 12:12 horas y tuvieron acceso libre a una dieta standard de laboratorio y agua. El sacrificio se realizó mediante sobredosis con halotano.
En el experimento A, a cuatro grupos de ratones (n = 10) se les indujo una colitis aguda con dextrano sulfato sódico (DSS) tras haber ingerido durante 28 días una dieta enriquecida al 3% con la BSA-G o BSA-C (25). Tras este periodo, a los ratones se les administró el DSS al 4% por medio del agua de bebida durante 7 días y se les monitorizó diariamente el tipo de deposiciones y el sangrado presente en ellas. El día 7 se sacrificaron los animales, se extrajo el colon y se analizó histológicamente siguiendo procedimientos estándar. Como control se utilizaron 3 animales de cada grupo a los que no se les indujo la colitis mediante DSS.
En el experimento B, a los cuatro grupos de ratones (n = 10) se les indujo una colitis crónica con DSS (10) tras haber ingerido durante 28 días una dieta enriquecida al 3% con la BSA-G o BSA-C. Tras este periodo, a los ratones se les administró DSS al 2% (excepto a los grupos control) durante 5 días, seguidos de 5 días donde se les suministraba agua normal. Este ciclo se repitió dos veces más y los animales fueron sacrificados en el día 30. El avance de la colitis se monitorizó de igual forma que en el caso de la colitis aguda. Como control se utilizaron 3 animales de cada grupo a los que no se les indujo la colitis mediante DSS.
En el experimento C se estudió el efecto de la ingesta de AGEs durante un periodo largo (90 días), usando los cuatro grupos de ratones comentados anteriormente y suministrándoles una dieta enriquecida al 3% con BSA-G o BSA-C.
Para evaluar el efecto de un tratamiento anti-AGEs sobre la colitis inducida por DSS, en el experimento B tres animales de cada grupo se trataron durante 7 días con 100 μg/dosis de exRAGE (R&D Systems Inc.) tal y como se detalla en la bibliografía (20). El exRAGE es una proteína quimérica obtenida mediante recombinación del dominio extracelular del RAGE murino (Gln 24-ALA 342, homólogo al sRAGE.
2.3. Ensayos histológicos y bioquímicos
Para evaluar el efecto de la ingesta de los AGEs sobre la orquestación de la respuesta inmune mediada por los receptores GPR43 y RAGE, estudiamos diversos signos clínicos, cambios histológicos y producción de citoquinas.
Signos clínicos: Se midió de forma diaria el peso de los animales, la consistencia de las heces y el contenido de sangre fecal. Las deposiciones de los animales se puntuaron de 0 a 4, siendo 0 las deposiciones normales y 4 las diarreicas. En cuanto al contenido de sangre fecal se analizó mediante el test Hemoccult (Beckman Coulter). El índice de actividad diaria (DAI) se calculó teniendo en cuenta de forma combinada los parámetros anteriormente descritos (26).
Estudios histológicos: El daño en la mucosa colónica se puntuó de la siguiente forma: 0, sin daño; 1, daño en la mucosa solo; 2, daño en la mucosa y en la submucosa; 3, daño transmural. Una sección del colon distal, obtenido tras el sacrificio del animal, se fijó en formaldehído al 4% y se insertó en parafina. Secciones de 5 mm se tiñeron con hematoxilina-eosina, tomando microfotografías con un microscopio equipado con cámara a 600 aumentos. El grado de infiltración de los neutrófilos se obtuvo contando todos los neutrófilos extrabasales por microfotografía. La puntuación obtenida representa la media del contenido de neutrófilos en 4 zonas aleatorias de mucosa y submucosa que proceden de tres secciones diferentes del colon descendente.
Permeabilidad de la mucosa intestinal: Se estudió el incremento de la permeabilidad en la mucosa intestinal de los distintos grupos de animales usando como sonda fluorescente la fluoresceína isotiocianato-dextrano (FD-4). Brevemente, se tomaron muestras de colon de tres animales de cada grupo (n=3), se cerraron mediante sutura y se llenaron con tampón bicarbonato de Krebs-Henseleit (KHBB, pH 7.4). Posteriormente cada saco se suspendió en KHBB que contenía FD-4 y se incubó durante 30 minutos a 37ºC bajo una atmósfera de 02:CO2 (95:5). Finalmente, se tomó una muestra de la solución serosa (donde se suspendió el saco) y mucosa (contenido del saco), se centrifugaron y se midió la intensidad de la fluorescencia. De esta forma, la permeabilidad se expresó como la capacidad de aclaramiento de la FD-4 de la capa mucosa a la serosa (27).
Mieloperoxidasa (MPO): Esta enzima se utiliza como marcador de la infiltración de neutrófilos, aunque no es una enzima estrictamente específica de estos fagocitos. El análisis de la MPO se analizó en tres segmentos colónicos de cada animal (28). Los tejidos se homogeneizaron y centrifugaron, realizando el ensayo de la MPO usando un kit comercial (Hbt. Biotechnology).
Determinaciones de citoquinas: El contenido de TNFα colónico y de IL-6 e IL-10 plasmáticos se realizó mediante ELISA, usando kits comerciales para cuantificar citoquinas murinas (Cytoset kit, Biosource Internacional).
Ensayos quimiotácticos: La quimiotaxis de los neutrófilos se estudió usando cámaras transwell mediante la técnica descrita por Kawohl et al. (29). Los neutrófilos se aislaron a partir de un lavado peritoneal con suero salino estéril de ratones control, Gpr43-/- y RAGE-/- (n = 3) 4 horas tras la administración de una solución de tioglicolato 3%. Los neutrófilos se enumeraron tras tinción de Meyer-Hemalaun. Para evaluar la acción de los AGEs (se utilizó CML como AGE patrón) sobre el receptor GPR43 se utilizó un anticuerpo monoclonal antiRAGE murino (R&D Systems Inc) para bloquear la interacción AGE-RAGE.
2.4. Análisis estadístico
Para realizar el estudio estadístico se utilizó el programa SPSS ver. 15. Las medidas se realizaron al menos en triplicado y la normalidad de los datos se comprobó utilizando el test de Kolmogorov-Smirnov. Los resultados se expresan como media ± desviación estándar. Los valores P se calcularon utilizando un test de ANOVA multifactorial y el test de la t de student. Los valores de P<0,05 se consideraron estadísticamente significativos.
3. RESULTADOS
La regulación de la respuesta inmune a nivel intestinal es muy compleja y dentro de ella juegan un papel importante los receptores RAGE y GPR43. Desde hace 5 años se está estudiando el papel que juega el RAGE sobre la permeabilidad de la mucosa intestinal, así como sobre el reclutamiento de los neutrófilos. De igual forma, recientemente se está evidenciando el papel fundamental que juega el receptor GPR43 para regular el reclutamiento de las células del sistema inmune hasta la mucosa intestinal ante determinados estímulos microbianos. Sin embargo, hasta ahora no se conoce si existe algún tipo de relación entre la actividad de ambos receptores. En este sentido, en el presente trabajo se evalúa cómo se activan dichos receptores mediante la administración de una proteína rica en AGEs y se estudia qué papel juegan en el desarrollo de la inflamación intestinal. Para ello, se utiliza un modelo murino de enfermedad inflamatoria intestinal, ya que se disponen de ratones transgénicos comerciales que carecen de los receptores GPR43 y RAGE donde se puede inducir una colitis aguda o crónica. Así mismo, tras estudiar el efecto de los AGEs ante una situación patológica, es evalúa su efecto durante una ingesta prolongada, evaluando si dicha ingesta puede incrementar el riesgo de desarrollar la enfermedad. Finalmente, para reforzar los hallazgos encontrados se estudian los efectos de una terapia con exRAGE y propionato sobre la inflamación intestinal inducida con DSS.
3.1. Glicosilación de la BSA
Para evaluar el efecto de un consumo elevado de AGEs sobre la inflamación intestinal decidimos utilizar una BSA glicosilada. Mediante el método de glicosilación utilizado por nosotros obtuvimos unos valores de CML de 69 mg/g proteína, que son similares a los encontrados por otros autores (30). Como se adiciona un 3% de BSA a la dieta estándar de los ratones y teniendo en cuenta el consumo de éstos, se estimó la ingesta diaria de CML en 10 mg/día, aunque expresada en peso corporal llegamos 100 mg/Kg/día. La ingesta diaria de CML en humanos ha sido estimada en unos 75 mg/día (31) dando lugar a una ingesta de 1 mg/Kg/día., lo que es 100 inferior a la ingesta que realizaron nuestros ratones. De esta forma, podemos evaluar con certeza el efecto de una ingesta elevada de CML sobre la inflamación intestinal. Otros autores (21) han demostrado que la BSA glicosilada interacciona con el receptor RAGE mediante la CML, lo que refuerza la utilización de esta proteína para realizar el estudio.
3.2. Relación de los receptores RAGE y GPR43 con la ingesta elevada de AGEs en un modelo de colitis aguda
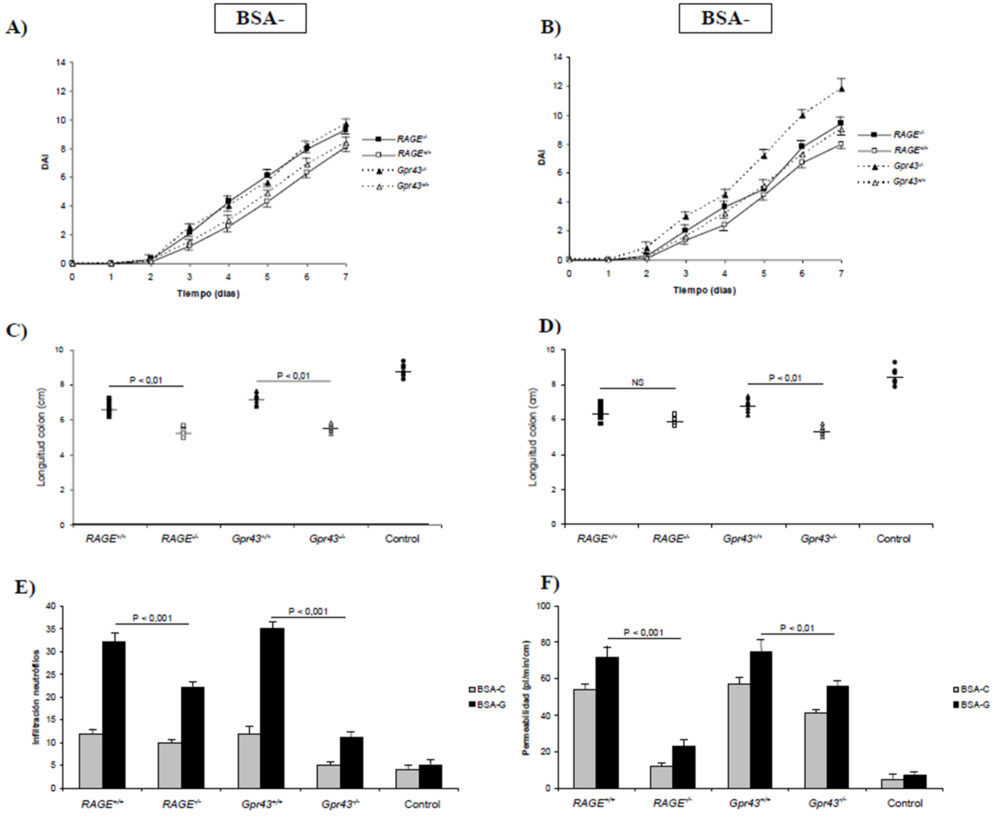
Para estudiar la relevancia de la deficiencia de los receptores RAGE y GPR43 en condiciones de inflamación aguda, así como el efecto de la ingesta elevada de AGEs, indujimos una colitis aguda mediante la administración de DSS al 4% en el agua de bebida de ratones Gpr43+/+, RAGE+/+, Gpr43-/- y RAGE-/-. Hasta el día 2 todos los animales mostraron unos signos clínicos idénticos (peso, consistencia de las heces y sangrado rectal) lo que dio lugar a un índice de actividad diaria (DAI) similar (Figuras 1A y 1B). A partir del tercer día todos los ratones deficientes en los recetores GPR43 y RAGE (Gpr43-/- y RAGE-/-) perdieron peso de forma más significativa que los ratones control (Gpr43+/+ y RAGE+/+) mientras que estos tuvieron menos diarrea y sangrado rectal (P<0,05). De igual forma se puede observar que la utilización de una dieta enriquecida en AGEs (1B) no dio lugar a unos peores signos clínicos en ratones que carecían del receptor RAGE, mientras que el índice de actividad diaria fue superior (P<0,01) en ratones Gpr43-/-. Estos resultados concuerdan con la longitud del colon de los animales alimentados con BSA-C (1A) y BSA-G (1B), mostrando una mayor inflamación en ratones deficientes en los receptores RAGE y GPR43.
Figura 1. Signos clínicos y estudios histológicos obtenidos en animales con colitis aguda inducida. A) Índice de actividad patológica (DAI) en ratones alimentados con BSA control. B) DAI en ratones alimentados con BSA glicosilada. C) Longitud del colon en ratones alimentados con BSA control. D) Longitud del colon en ratones alimentados con BSA glicosilada. E) Infiltración de neutrófilos. F) Permeabilidad intestinal. E y F) Las diferencias para el mismo tipo de ratón alimentados con BSA control o glicosilada son estadísticamente significativas (P<0,001) excepto en los ratones RAGE-/- para permeabilidad intestinal (P<0,05).
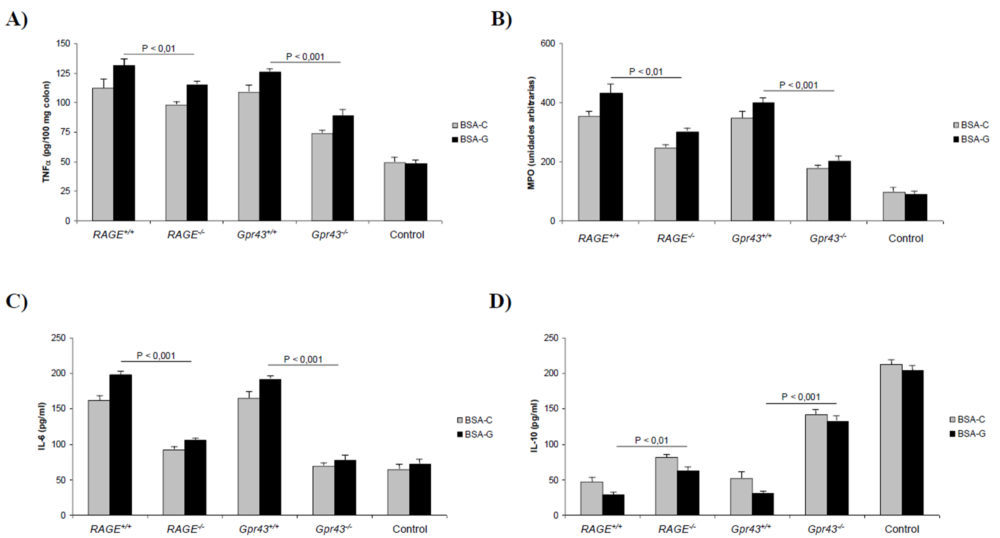
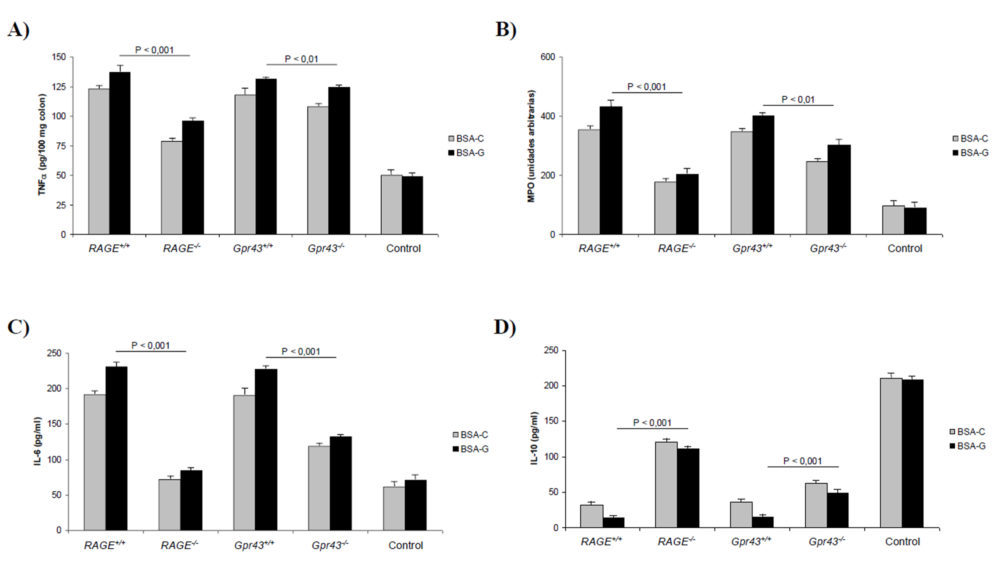
El examen histológico de las muestras obtenidas del colon descendente mostró (Figura 1E) un daño tisular reducido y una menor infiltración de los neutrófilos (P<0,001) en los ratones que carecen de los receptores RAGE y GRP43 y son alimentados con un dieta rica en AGEs. Sin embargo, estas diferencias no son tan apreciables en el caso de los animales alimentados con BSA-C, no significativas en el caso del receptor RAGE y P<0,05 en el caso del GPR43. Para cuantificar la cantidad de neutrófilos, realizamos también un ensayo ELISA para determinar los niveles de MPO en tejido colónico homogeneizado. Como se muestra en la figura 2B, los niveles de MPO estaban significativamente reducidos en los ratones RAGE-/- (P<0,01) y Gpr43-/- (P<0,001). Además, la reducción de los niveles de TNF α colónicos (2A) fue más marcada en los ratones Gpr43-/- (P<0,001) que en los RAGE-/-(P<0,01). Los mismos descensos se encontraron para los niveles de IL-6 plasmática (2C) mientras que los niveles de IL-10 (2D) estaban mas elevados en los ratones Gpr43-/- (P<0,001). Teniendo en cuenta que la IL-10 es una citoquina antiinflamatoria, mientras que la IL-6 y TNF α son proinflamatorias, se puede establecer que la inducción de una colitis aguda con DSS origina un estado proinflamatorio que da lugar a una infiltración de neutrófilos. La utilización de una dieta rica en AGEs promueve el desarrollo de una patología más grave. Dicha infiltración e inflamación resultante es menor en los ratones que carecen del receptor GPR43, lo que indica que dicho receptor es crucial en el desarrollo de una respuesta inflamatoria temprana ante un agente externo. En este sentido, la figura 1E muestra el efecto que dicha inflamación provoca en la permeabilidad al FD4, que se considera un índice de la función barrera que ejerce el epitelio intestinal. Como se puede observar, en incremento en la permeabilidad originada por la colitis no se experimentó en los ratones carentes del receptor GPR43, debido fundamentalmente al desarrollo de una menor inflamación, como se ha comentado anteriormente.
Figura 2. Parámetros bioquímicos obtenidos en animales con colitis aguda inducida. A) Niveles de TNFα colónico. B) MPO. C) Niveles de IL-6 plasmáticos. D) Niveles de IL-10 plasmáticos. A, B, C y D) Las diferencias para el mismo tipo de ratón alimentados con BSA control o glicosilada son estadísticamente significativas (P<0,05) excepto en los ratones Gpr43+/+ para MPO y RAGE-/- para IL-6 (diferencias no significativas).
3.3. Relación entre los receptores RAGE y GPR43 con la ingesta elevada de AGEs en un modelo de colitis crónica
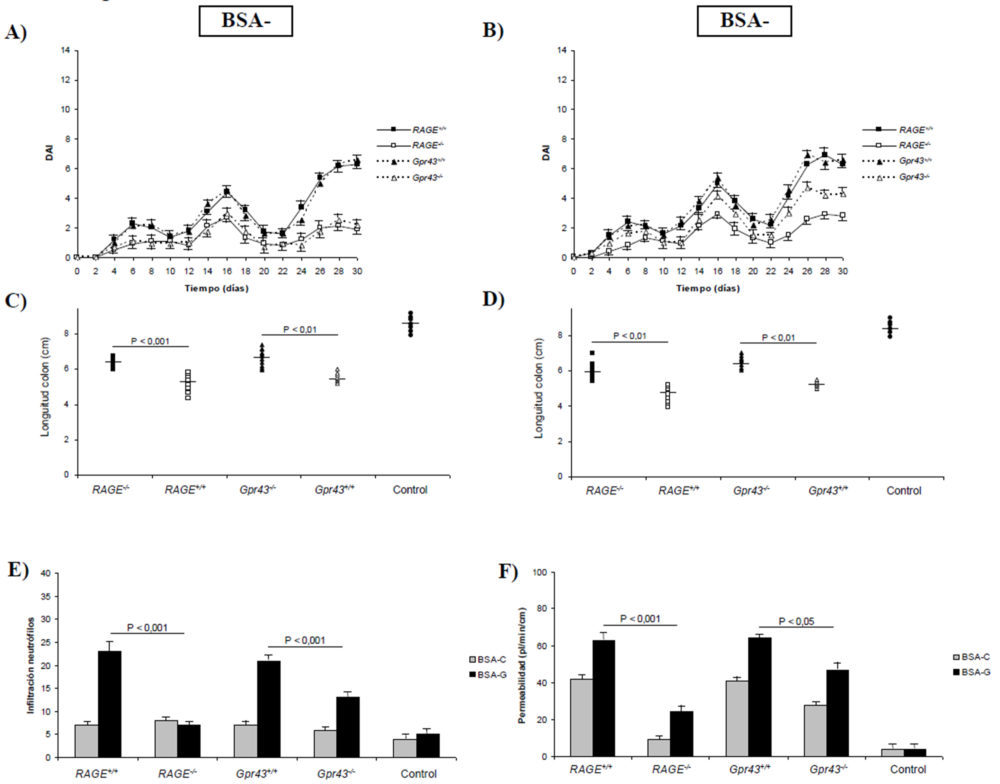
Para profundizar en el efecto de los receptores RAGE y GPR43 y la exposición continuada a concentraciones elevadas de AGEs sobre el proceso inflamatorio a nivel intestinal, realizamos un ensayo en el que administramos DSS al 2% durante 30 días a los distintos grupos de ratones estudiados. Como puede observarse en la figuras 3A y 3B, el índice de actividad diaria mostraba picos que coinciden con el cese de la administración del DSS. Así mismo, es evidente que la ausencia de los receptores RAGE y GPR43 protege frente a la inducción de daño intestinal, resultando en unos DAI menos elevados. Sin embargo, en el caso de la suplementación de la dieta con BSA glicosilada (Figura 3B) mostró que los ratones Gpr43-/- desarrollaban una diarrea, pérdida de peso y sangrado rectales mas parecidos al de los ratones control (que expresaban dicho receptor), lo que sugiere que el receptor RAGE juega un papel fundamental en el desarrollo de la inflamación de tipo crónico. El estudio microscópico de diferentes secciones del colon descendente mostró menos signos de inflamación de la mucosa intestinal en ratones con deficiencia en la expresión de alguno de los receptores (Figura 4). Estos resultados también se apoyan en la mayor longitud colónica en los animales transgénicos (P<0,01) comparados con sus homólogos salvajes (Figuras 3C y 3D).
Figura 3. Signos clínicos y estudios histológicos obtenidos en animales con colitis crónica inducida. A) Índice de actividad patológica (DAI) en ratones alimentados con BSA control. B) DAI en ratones alimentados con BSA glicosilada. C) Longitud del colon en ratones alimentados con BSA control. D) Longitud del colon en ratones alimentados con BSA glicosilada. E) Infiltración de neutrófilos. F) Permeabilidad intestinal. E y F) Las diferencias para el mismo tipo de ratón alimentados con BSA control o glicosilada son estadísticamente significativas (P<0,01) excepto en los ratones RAGE-/- para infiltración de neutrófilos.
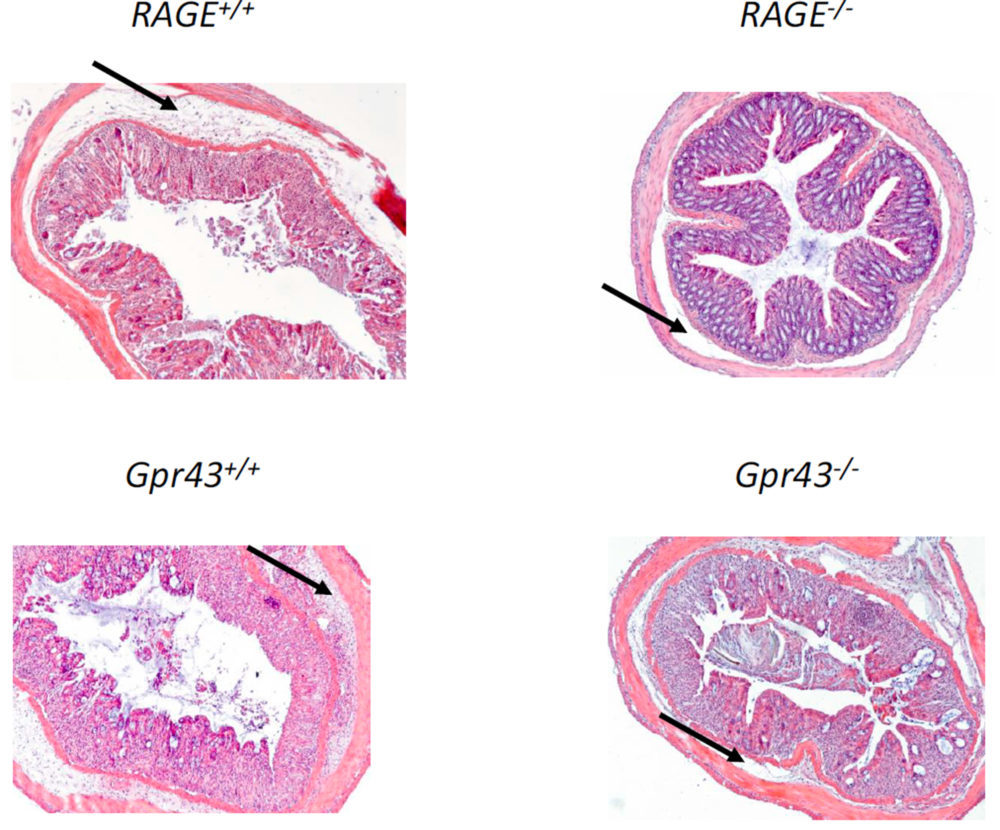
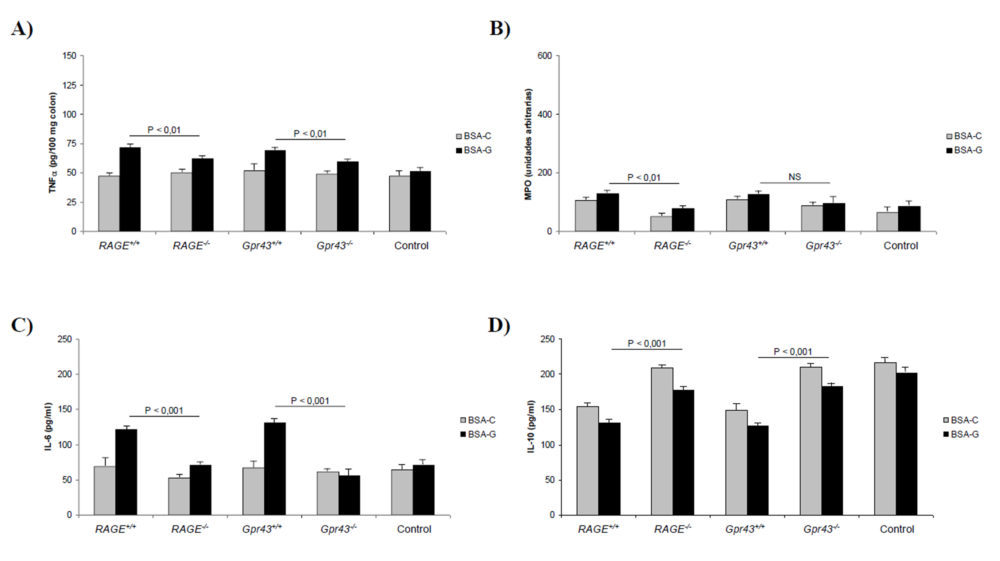
Como se ha comentado previamente, las preparaciones microscópicas revelaron una lesión mucosa menor en ratones Gpr43-/- y RAGE-/- (Figura 4) y especialmente una menor infiltración de neutrófilos (Figura 4E). Este hecho se demostró cuantitativamente por los menores valores de TNFα (5A) y MPO (5B) e IL-6 (5C) así como por un mayor nivel plasmático de IL-10 (5D). De esta forma, la función de barrera epitelial se vio más protegida en dichos ratones (Figura 3E), especialmente en los RAGE-/-. En resumen, estos resultados demuestran que la deficiencia en los receptores GPR43 y RAGE dan lugar a una menor inflamación colónica en el modelo de colitis crónica inducida por DSS, dando un mayor protagonismo al receptor RAGE en el mantenimiento de la inflamación intestinal de tipo crónico. Así mismo, estos resultados apoyan la hipótesis de que los AGEs procedentes de la dieta pueden dar lugar al desarrollo y/o perpetuación de una patología inflamatoria intestinal más severa que cuando se administra una dieta normal.
Figura 4. Microfotografías colónicas obtenidas en animales con colitis crónica inducida. Los ratones RAGE-/- y GPR43-/- presentan una inflamación crónica menos severa. Las flechas indican la presencia de una cantidad diferente de neutrófilos en la zona submucosa.
Figura 5. Parámetros bioquímicos obtenidos en animales con colitis crónica inducida. A) Niveles de TNFα colónico. B) MPO. C) Niveles de IL-6 plasmáticos. D) Niveles de IL-10 plasmáticos. A, B, C y D) Las diferencias para el mismo tipo de ratón alimentados con BSA control o glicosilada son estadísticamente significativas (P<0,05) excepto en los ratones RAGE-/- para MPO e IL-10 (diferencias no significativas).
3.4. Repercusión de la ingesta prolongada de AGEs sobre los receptores RAGE y GPR43
Como se ha comentado en los dos apartados precedentes, el consumo elevado de AGEs origina un cuadro inflamatorio más severo en distintos modelos de inflamación intestinal. De esta forma, nos propusimos evaluar el efecto que tiene una ingesta elevada de AGEs en animales a los que no se les induce ningún tipo de colitis. Como se puede observar en la figura 6, se obtuvo una mayor infiltración de neutrófilos (P<0,001) en todos los ratones que se alimentaron durante tres meses con BSA-G, excepto en el caso de los ratones Gpr43-/- donde no se encontraron diferencias estadísticamente significativas. Este hecho se verificó a partir del contenido colónico de MPO, que mostró una infiltración mayor en ratones alimentados con la proteína glicosilada, exceptuando a los ratones con deficiencia de los receptores RAGE y GPR43 (no significativas). Así mismo, se encontraron mayores niveles (P<0,01) de TNFα colónico e IL-6 plasmática en ratones con dieta enriquecida en BSA-G (Figura 7), siendo los valores de IL-10 plasmática inferiores en estos grupos. Así, estos resultados apuntan a que la ingesta prolongada de cantidades sustanciales de AGEs da lugar a la elevación de marcadores inflamatorios.
Figura 6. Infiltración de los neutrófilos en animales con una ingesta prolongada de AGEs. Las diferencias para el mismo tipo de ratón alimentados con BSA control o glicosilada son estadísticamente significativas (P<0,001) excepto en los ratones Gpr43-/-(NS).
Figura 7. Parámetros bioquímicos obtenidos en animales con colitis aguda inducida. A) Niveles de TNFα colónico. B) MPO. C) Niveles de IL-6 plasmáticos. D) Niveles de IL-10 plasmáticos. A, B, C y D) Las diferencias para el mismo tipo de ratón alimentados con BSA control o glicosilada son estadísticamente significativas (P<0,05) excepto en los ratones RAGE-/- y Gpr43+/+ para MPO y GPR43-/- para IL-6 (diferencias no significativas).
3.5. Efecto del tratamiento con exRAGE sobre los receptores RAGE y GPR43 en un modelo de colitis crónica
Tras evidenciar que los receptores RAGE y GPR43 juegan un papel fundamental en la respuesta inmunológica ante una situación de inflamación sostenida, decidimos estudiar el efecto que puede tener una terapia de secuestro de AGEs mediante la utilización de exRAGE, que es una proteína quimérica homóloga al sRAGE humano y que es capaz de captar AGEs libres en el medio. Para ello, se repitió el experimento de inducción de colitis crónica a ratones suplementados como BSA-G.
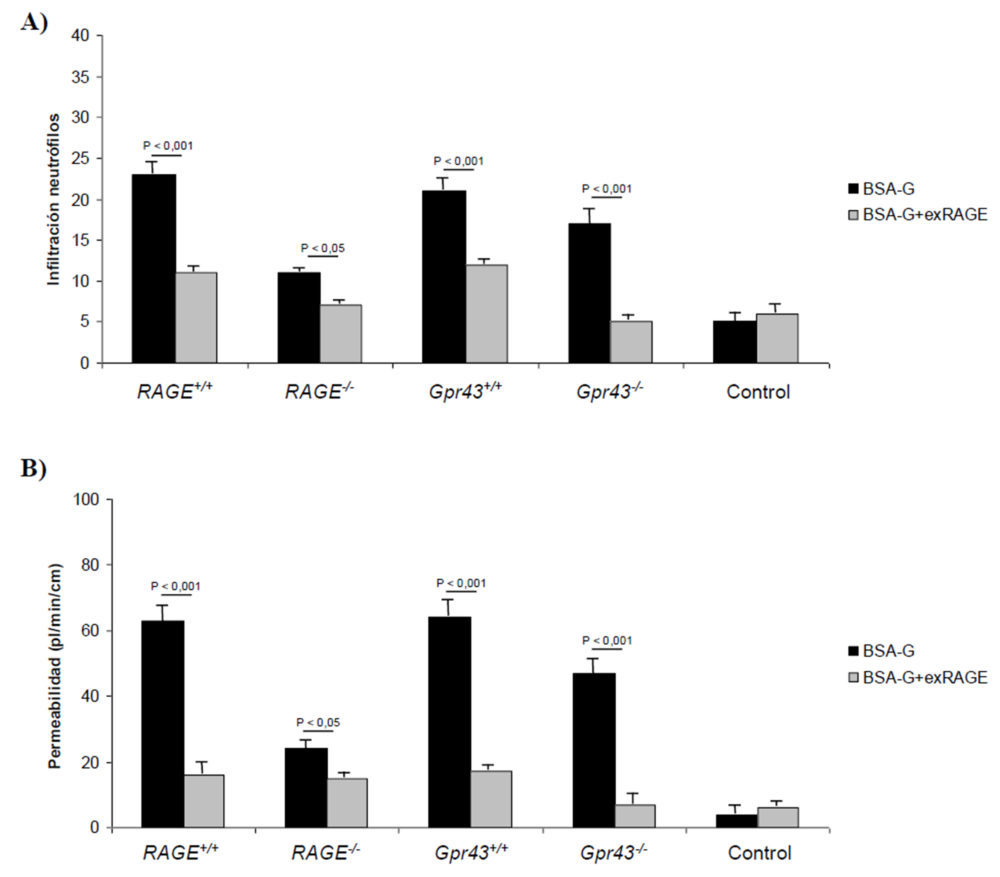
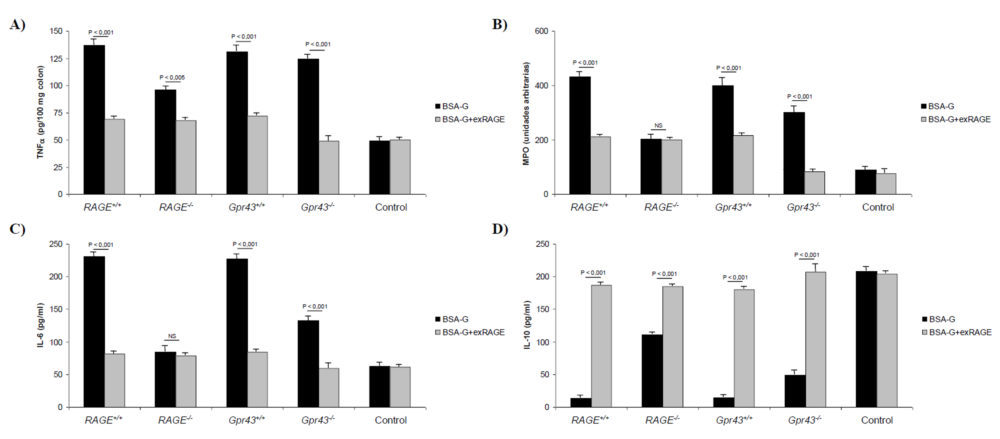
Como se observa en la figura 8A, el grado de infiltración de los neutrófilos en el colon descendió significativamente (P<0,001) cuando se trataron ratones Gpr43+/+, RAGE+/+, Gpr43-/- y RAGE-/-; en este último también se observó un descenso significativo (P<0,05). Teniendo en cuenta que estos ratones carecen del receptor RAGE, el efecto beneficioso derivado de retirar un exceso de AGEs podría indicar que otros receptores como el GPR43, que están implicados en el reclutamiento de los neutrófilos, también se activan por los AGEs. De igual forma, la permeabilidad del epitelio intestinal (Figura 8B) mejoró de forma considerable (P<0,001) con el tratamiento mediante exRAGE. De forma cuantitativa, la infiltración neutrofílica, medida como actividad de la MPO, disminuyó significativamente (P<0,001) mediante el tratamiento con exRAGE en todos los grupos excepto en el RAGE-/- donde no se encontraron diferencias (Figura 9B). En cuanto a los marcadores proinflamatorios, las citoquinas TNFα (9A) e IL-6 (9C) se comportaron de igual forma a los signos histológicos reseñados anteriormente. Finalmente, la concentración de IL-10 plasmática se incrementó de forma significativa (P<0,001) con el tratamiento, indicando que la inflamación subsiguiente a la inducción de la colitis era menor (Figura 9D).
Figura 8. Signos clínicos y estudios histológicos obtenidos en animales con colitis crónica inducida y tratados con exRAGE. Las diferencias para el mismo tipo de ratón alimentados con BSA control o glicosilada son estadísticamente significativas (P<0,001) excepto en los ratones Gpr43-/-.
Figura 9. Parámetros bioquímicos obtenidos en animales con colitis crónica inducida y tratados con exRAGE. A) Niveles de TNFα colónico. B) MPO. C) Niveles de IL-6 plasmáticos. D) Niveles de IL-10 plasmáticos. A, B, C y D) Se trató a los ratones con BSA glicosilada. De igual forma los ratones se trataron con exRAGE para captar los AGEs libres con o sin adición de propionato, para estimular al receptor GPR43.
3.6. Efecto de la CML y propionato sobre la migración de los neutrófilos y su relación con los receptores RAGE y GPR43
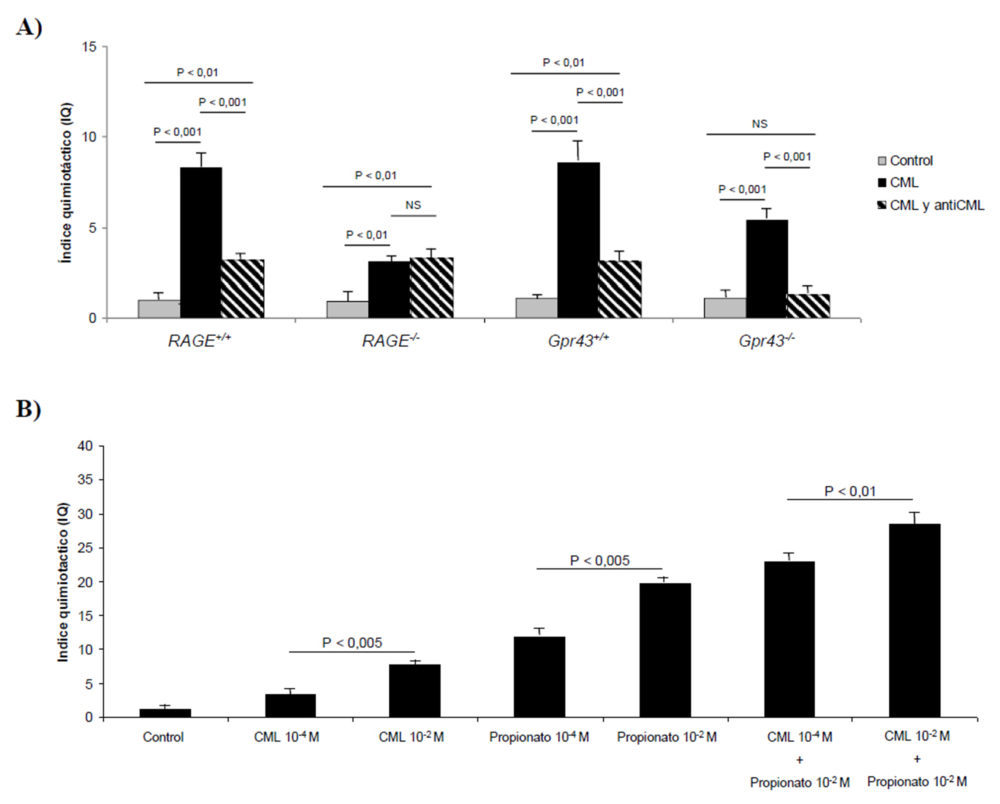
Los resultados obtenidos en los apartados anteriores indican que el receptor GPR43 podría ser estimulado por los AGEs, principalmente la CML, que es el AGE mayoritario formado en la BSA glicosilada. De esta forma, para caracterizar la respuesta quimiotáctica de los neutrófilos ante los AGEs, aislamos neutrófilos a partir del lavado peritoneal de ratones de los cuatro grupos tratados previamente con tioglicolato. Para realizar el experimento utilizamos una solución de CML 10-2 M, ya que ha mostrado previamente su actividad quimiotáctica sobre los neutrófilos en ratones salvajes. Tras 45 minutos de estimulación, se observó un incremento significativo (P<0,001 excepto en RAGE-/-, P<0,01) de la migración quimiotáctica en todos los grupos (Figura 10A). Es de señalar que en el RAGE-/- la migración quimiotáctica debe de estar mediada por otros receptores distintos al RAGE, que no se expresa en esos neutrófilos. Para determinar si el receptor GPR43 podía activarse mediante la estimulación con CML, se utilizó un anticuerpo murino antiRAGE, que es capaz de bloquear la señal AGE-RAGE. Así, se pudo observar que en los ratones RAGE+/+, Gpr43+/+ y Gpr43-/- la migración de los neutrófilos descendió de forma significativa un 60% (P<0,001) mientras que en el grupo RAGE-/- no se encontraron diferencias significativas, ya que estos neutrófilos carecían del receptor RAGE. De igual forma, los valores a los que descendió la migración quimiotáctica fueron significativamente mayores (P<0,01) en los grupos Gpr43+/+, RAGE+/+ y RAGE-/- que la quimiotaxis del grupo control. Sin embargo, en el grupo Gpr43-/- no se encontraron diferencias significativas entre el control y los neutrófilos tratados con CML y antiCML. Habida cuenta de que estos neutrófilos carecen de receptor GPR43, la quimiotaxis debía deberse al receptor RAGE, que resulta bloqueado por su anticuerpo. Así, las diferencias de actividad encontradas con los neutrófilos de los demás grupos cuando se añade CML y antiRAGE indican que en estos grupos la migración quimiotáctica se debía al receptor GPR43.
Para comparar la capacidad migratoria de los neutrófilos debida a los SCFA y la CML, se realizó un ensayo con neutrófilos procedentes de ratones RAGE-/-, donde se ha demostrado previamente que la quimiotaxis se debía exclusivamente a la interacción con el receptor GPR43. Así, se ensayaron dos concentraciones distintas de CML y propionato (10-2 M y 10-4 M) que fue seleccionado como SCFA de referencia por su marcada actividad quimiotáctica (10). Como puede observarse en la figura 10B, el incremento en la concentración de CML o propionato indujo una mayor respuesta quimiotáctica, que fue aproximadamente el doble en el caso del propionato comparado con la CML. Así mismo, la co-estimulación con CML y propionato dio lugar a un incremento cooperativo en la migración de los neutrófilos.
Figura 10. Efectos de CML y propionato sobre la migración de los neutrófilos. A) Efecto de la CML (10-4 M) sobre la migración de los neutrófilos procedentes de ratones RAGE+/+, RAGE-/- GPR43+/+ y GPR43-/-. Se utilizó el anticuerpo monoclonal murino antiRAGE para evaluar del efecto de la CML sobre el receptor GPR43. B) Efecto de la CML y propionato sobre la migración de los neutrófilos aislados de ratones RAGE-/-.
4. DISCUSIÓN
Los resultados obtenidos en el presente trabajo permiten extraer diversas conclusiones. Uno de los principales hallazgos es que tanto el receptor GPR43 como el RAGE son necesarios para el reclutamiento de los neutrófilos en un modelo de inflamación intestinal por lesión de la barrera mucosa. Los datos obtenidos permiten demostrar que la activación de ambos receptores juega un papel contradictorio en la fisiopatología inflamatoria a nivel intestinal: por un lado, la activación de estos receptores ejerce un factor protector frente a la traslocación bacteriana en un modelo agudo de colitis. Sin embargo, dicha activación es perjudicial en el caso de una inflamación de tipo crónico.
Hemos demostrado claramente el papel protector que ejerce la presencia de los receptores GPR43 y RAGE frente las lesiones agudas que se producen tras la exposición a una dosis elevada de DSS. La activación del receptor GPR43 permite el reclutamiento de los neutrófilos, con la consiguiente elevación de la citoquinas proinflamatorias TNFα e IL-6 y la disminución de la IL-10 (citoquina antiinflamatoria). Un comportamiento similar, pero menos potente se ha observado con el receptor RAGE. La ausencia de este receptor da lugar al desarrollo de una patología ligeramente mas severa que en los ratones control, pero la ausencia del receptor GPR43 dio lugar a una evolución clínica peor, lo que está en consonancia con estudios realizados por otros investigadores (10, 25). Esto parece indicar que el receptor RAGE no puede compensar la ausencia del GPR43 y que este es estrictamente necesario para iniciar el proceso inflamatorio. Por un lado, Sina et al. (10) han demostrado que las señales inducidas por los SCFA a través del receptor GPR43 actúan in vivo como el interruptor maestro para poder alcanzar el umbral crítico ante otros estímulos. Así, la ausencia de este receptor retardaría el desarrollo del proceso inflamatorio mediado por otros receptores como el RAGE. Por otro lado, el receptor RAGE podría actuar a más largo plazo, como se demuestra en los problemas a largo plazo derivados de la diabetes (32).
En cuanto al modelo de colitis crónica, hemos podido demostrar claramente el papel protector que juega la deficiencia de los receptores GPR43 y RAGE frente a las lesiones crónicas generadas tras varios ciclos de administración de una dosis baja de DSS. Los ratones transgénicos deficientes en estos receptores exhibieron una inflamación menor de la mucosa, tal y como indicaban los signos clínicos, histología y niveles de citoquinas anti- y proinflamatorias. Estos resultados coinciden con los obtenidos por Sina et al. (10) mientras que otros autores (25) defienden que la presencia del receptor GPR43 protege del desarrollo de una inflamación crónica. Nuestros resultados, junto con los de otros grupos apuntan a que estos receptores juegan un papel perjudicial en la inflamación crónica. La activación de estos receptores provocaría la migración hacia el intestino de cantidades crecientes de neutrófilos. Por un lado, uno de los efectos fundamentales que ejercen los neutrófilos en la inflamación intestinal es la regulación a la baja de las proteínas de unión intercelular en el epitelio intestinal. Así, una infiltración sostenida de los neutrófilos podría contribuir a la disminución de la función barrera de dicho epitelio (33). Por otro lado, diversos autores han encontrado tanto en células Caco-2 (22) como en el colon (20) la permeabilidad de la mucosa se altera por activación del receptor RAGE. Esta hipótesis explicaría porqué aumenta la permeabilidad intestinal en los ratones RAGE+/+ y Gpr43+/+ en el modelo de inflamación crónica, a la vez que aumenta el número de neutrófilos infiltrados en la mucosa intestinal.
Es importante señalar que, si bien la actividad del receptor RAGE no parece ser fundamental en el inicio de la actividad inflamatoria, su papel en el posterior mantenimiento de este status parece ser importante. La unión AGE-RAGE daría lugar a la aparición de diversos efectos mediados por la activación celular (22):
1) Atracción quimiotáctica de los neutrófilos por regulación al alza de receptores de adhesión endotelial y su unión al mismo receptor RAGE, que también actúa como receptor de adhesión.
2) Producción elevada de citoquinas proinflamatorias.
De forma general se especula que los AGEs puedan ser un “factor de riesgo” para la salud humana (34, 35). Estos autores indican que la absorción de los AGEs procedentes de los alimentos es de un 10% y de acuerdo con estudios cinéticos un tercio de los mismos se eliminan por vía renal. Por tanto, una alta proporción es retenida, aunque no esta claro cual de los compuestos de Maillard de la dieta activan la vía proinflamatoria después de su absorción y si los organismos sanos compensan el efecto fisiopatológico. En este sentido, otra de las conclusiones que se derivan del presente trabajo es que los AGEs ingeridos con la dieta promueven la aparición de un desequilibrio en el balance inflamatorio a nivel intestinal, originando un status proinflamatorio que podría dar lugar a la aparición de la enfermedad inflamatoria intestinal en aquellos individuos con susceptibilidad genética o sometidos a otro tipo de estímulos ambientales o microbianos. Por un lado, hemos demostrado que el consumo elevado de AGEs promueve la activación del sistema inmune de la mucosa en presencia de una barrera mucosa dañada, contribuyendo al desarrollo de la EII. Por otro lado, hemos observado que la ingesta elevada de AGEs durante un tiempo prolongado da lugar a una serie de cambios, como infiltración de neutrófilos en la mucosa intestinal o elevación de los niveles de citoquinas proinflamatorias, que podría predisponer al desarrollo de una patología posterior.
Otro descubrimiento importante del presente trabajo es la demostración de que la CML es capaz de estimular el receptor GPR43. De esta forma los AGEs, en concreto la CML, no solo actuarían como quimioatractores de los neutrófilos de una forma indirecta mediante su interacción con el receptor RAGE, sino que podrían actuar de forma directa tal y como los SCFA hacen. Los agonistas naturales del receptor GPR43 son los ácidos grasos de cadena corta como el acetato, propionato o butirato (36), aunque recientemente se han sintetizado diversos compuestos artificiales, fenilacetamidas, con una mayor actividad sobre este receptor (37). En este sentido, mediante la utilización de neutrófilos obtenidos a partir de ratones transgénicos, hemos demostrado por primera vez que la CML es capaz de unirse al receptor GPR43 y activarlo, promoviendo la migración quimiotáctica de los neutrófilos. Los SCFA interactúan con el GPR43 por medio de grupo carboxilato tal y como muestra la figura 11 (39). Este grupo con carga negativa se uniría a los grupos catiónicos de la arginina 5.39 y 7.35 (40). Así, la CML podría unirse al GPR 43 mediante el grupo carboxílico en la posición e, ya que el que está presente en la posición e es el que se utiliza para realizar el enlace peptídico en la proteínas (Figura 11) . Respecto a la potencia de la CML, se observó que es aproximadamente del 30 al 40% de la que ejerce el propionato. En los SCFA la potencia de acción depende de la longitud de la cadena alifática, pero en el caso de la CML no hemos realizado experimentos para determinar si su actividad depende de las cadenas señaladas en la figura 10, aunque posiblemente, debido a la homología estructural con las fenilacetamidas, el grupo Ne y el carboxilo anexo podrían ser los responsables. También es de destacar la actividad cooperativa que existe entre la CML y el propionato, que dieron lugar a un incremento notable en la migración de los neutrófilos. Un comportamiento similar se ha encontrado entre el propionato y el quimioatractante de los queratinocitos (10) y el propionato y las fenilacetamidas (38).
Figura 11. Posible explicación de la afinidad de la CML por el receptor GPR43 teniendo en cuenta las semejanzas en la estructura química con el ácido propiónico.
Finalmente, habida cuenta del papel que juegan los AGEs en crear las condiciones propicias para el desarrollo de un brote agudo de la EII o de la perpetuación de una inflamación crónica, el tratamiento con sRAGE podría ser una terapia prometedora para el tratamiento de esta patología. La administración de sRAGE en el modelo de colitis crónica mejoró tanto los signos clínicos de la enfermedad como los parámetros bioquímicos e histológicos. Unos resultados similares se han obtenido al utilizar sRAGE para prevenir las alteraciones que se producen en la barrera epitelial en experimentos de isquemia-reperfusión (20). Como se ha comentado antes, una ingesta elevada de AGEs produce una patología más grave y podría facilitar el desarrollo de la EII si se ingieren en cantidades elevadas durante un tiempo prolongado. De igual forma hemos comentado la actividad agonista de la CML sobre el receptor GPR43. Así, quelación de los AGEs podría ser una forma prometedora de inhibir la migración de los PMN o la sobreproducción de citoquinas proinflamatorias.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Financiación
Este trabajo se ha llevado a cabo gracias al proyecto europeo Stance4Health (Contracto Nº 816303) financiado por la European Research Commission (Research Executive Agency) cuyo Coordinador es el Dr. José Ángel Rufián Henares.
Abreviaturas
AGEs: Compuestos avanzados de glicosilación
BSA-C: Álbumina sérica bovina control.
BSA-G: Álbumina sérica bovina glicosilada.
BSA: Álbumina sérica bovina.
CML: carboximetillisina
DAI: Índice de actividad diaria.
DSS: dextrano sulfato sódico.
EII: Enfermedad inflamatoria intestinal
GC-MS: Cromatografía gaseosa acoplada a espectrometría de masas.
GPR43: Receptor acoplado a la proteína G43
IL-10: Interleukina 10.
IL-6: Interleukina 6.
MPO: Mieloperoxidasa.
NFkb: Factor nuclear de transcripción kappa-beta.
NOS: Radicales del nitrógeno
RAGE: Receptor para los compuestos avanzados de glicosilación
ROS: Radicales del oxígenos
SCFA: Ácidos grasos de cadena corta
SIM: Single Ion Monitoring.
sRAGE: Fracción soluble del receptor RAGE
TNFa: Factor de necrosis tumoral alfa.
5. REFERENCIAS
1. Royero HA. Enfermedad inflamatoria intestinal. Revista Colombiana de Gastroenterología. 2003, 18(1): 20-6.
2. Fiocchi C. Inflammatory bowel disease: aetiology and pathogenesis. Gastroenterology. 1998, 115: 182–205.
3. Farrell RJ, Peppercorn MA. Ulcerative colitis. The Lancet. 2002, 359: 331–40.
4. Sartor RB. Pathogenesis and immune mechanisms of chronic inflammatory bowel diseases. American Journal of Gastroenterology. 1997, 92: 5S–11S.
5. Mills DJS, Tuohy KM, Booth J, Buck M, Crabbe MJC, Gibson GR, Ames JM. Dietary glycated protein modulates the colonic microbiota towards a more detrimental composition in ulcerative colitis patients and non-ulcerative colitis subjects. Journal of Applied Microbiology. 2008, 105: 706–14.
6. Higa A, McKnight W, Wallace JL. Attenuation of epithelial injury in acute experimental colitis by immunomodulators. European Journal of Pharmacology. 1993, 239: 171–76.
7. MacDermott RP. Alterations of the mucosal immune system in inflammatory bowel disease. Journal of Gastroenterology. 1996, 31: 907–16.
8. Mortensen PB, Clausen MR. Short-chain fatty acids in the human colon: relation to gastrointestinal health and disease. Scandinavian Journal of Gastroenterology. 1996, 31: 132S–48S.
9. Karaki S, Mitsui R, Hayashi H, Kato I, Sugiva H, Iwanaga T, Furnes JB, Kuwahara A. Short-chain fatty acid receptor, GPR43, is expressed by enteroendocrine cells and mucosal mast cells in rat intestine. Cell Tissue Research. 2006, 324: 353–60.
10. Sina C, Gavrilova O, Förster M, Till A, Derer S, Hildebrand F, Raabe B, Chalaris A, Scheller J, Rehmann A, Franke A, Ott S, Häsler R, Nikolau S., Fölsch UR, Rose-John S, Jiang HP, Li J, Schreiber S, Rosenstiel P. G protein-coupled receptor 43 is essential for neutrophil recruitment during intestinal inflammation. Journal of Immunology. 2009, 183: 7514-22.
11. Chadwick VS, Anderson RP. Inflammatory Products of Commensal Bacteria and Gastro-Intestinal Disorders. Digestive Diseases. 1990, 8: 253–68.
12. Reif S, Klein I, Lubin M. Pre-illness dietary factors in inflammatory bowel disease. Gut. 1997, 40: 754-60.
13. Jowett SL, Seal CJ, Pearce MS, Phillips E, Gregory W, Barton JR, Welfare MR. Influence of dietary factors on the clinical course of ulcerative colitis: a prospective cohort study. Gut. 2004, 53:1479–84.
14. Serra-Majem L, Ribas L, Ngo de la Cruz J, Ortega RM. Alimentación, jóvenes y dieta mediterránea en España. Desarrollo del KIDMED, índice de calidad de la dieta mediterránea en la infancia y adolescencia, En: Serra Majem L, Aranceta Bartrina J. (Eds.), Alimentación infantil y juvenil, Estudio Enkid Masson, Barcelona, España, 2002, pp. 51-59.
15. Seiquer I, Mesías M, Muñoz-Hoyos A, Galdó G, Navarro MP. Mediterranean Dietary Style Improves Calcium Utilization in Healthy Male Adolescents. Journal of the American College of Nutrition. 2008, 27: 454-62.
16. Rufián-Henares JA, Morales FJ. Functional properties of melanoidins: In vitro antioxidant, antimicrobial and antihypertensive activities. Food Research International. 2007, 40: 995-1002.
17. Nass N, Bartling B, Navarrete-Santos A, Scheubel R, Börgermann J, Silber RE, Simm A. Advanced glycation end products, diabetes and ageing. Zeitung Gerontology Geriatrics. 2007, 40: 349–56.
18. Yamagishi S, Takeuchi M, Inagaki Y, Nakamura K, Imaizumi T. Role of advanced glycation end products (AGEs) and their receptor (RAGE) in the pathogenesis of diabetic microangiopathy. International Journal of Clinical Pharmacology Research. 2003, 23:129-34.
19. Bierhaus A, Humpert PM, Morcos M, Wendt T, Chavakis T, Arnold B, Stern DM, Nawroth PP. Understanding RAGE, the receptor for advanced glycation end products. Journal of Molecular Medicine. 2005, 83: 876–86.
20. Raman, KG, Sappington PL, Ryan RY, Levy M. Prince JM, Liu S, Watkins SK, Schmidt AM, Billiar TR, Fink MP. The role of RAGE in the pathogenesis of intestinal barrier dysfunction after haemorrhagic shock. American Journal of Physiology and Gastrointestinal Liver Physiology. 2006, 291: G556–65.
21. Collison KS, Parhar RS, Saleh SS, Meyer BF, Kwaasi AA, Hammami MM, Schmidt AM, Stern DM, Al-Mohanna FA. RAGE-mediated neutrophil dysfunction is evoked by advanced glycation end products (AGEs). Journal of Leukocyte Biology. 2002, 71: 433-44.
22. Kislinger T, Fu C, Huber B, Qu W, Taguchi A, Du-Yan S. N(epsilon)-(carboxymethyl)lysine adducts of proteins are ligands for RAGE that activate cell signaling pathways and modulate gene expression. Journal of Biological Chemistry. 1999, 274: 31740–9.
23. Valencia JV, Weldon SC, Quinn D, Kiers GH. Advanced glycation end product ligands for the receptor for advanced glycation end products: biochemical characterization and formation kinetics. Analytical Biochemistry. 2004, 324: 68–78.
24. Charissou A, Ait-Ameur L, Birlouez-Aragon I. Evaluation of a gas chromatography/mass spectrometry method for the quantification of carboxymethyllysine in food samples Journal of Chromatography A. 2007, 1140: 189-94
25. Maslowski KM, Vieira AT, Ng A, Kranich J, Sierro F, Heidi DY, Schilter C, Rolph MS, Mackay F, Artis D, Xavier RJ, Teixeira MM, Mackay CR. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43. Nature. 2009, 461: 1282-87.
26. Siegmund B, Lehr HA, Fantuzzi G, Dinarello CA. IL-1-converting enzyme (caspase-1) in intestinal inflammation. Proceedings of the National Academy of Sciences USA. 2001, 98: 13249–54.
27. Watkins RL, Delude F, Yang R, Gallo DJ, Baust JJ, Uchiyama T. Ethyl pyruvate modulates inflammatory gene expression in mice subjected to haemorrhagic shock. Amercican Journal of Physiology and Gastrointestinal Liver Physiology. 2002, 283: 212-21
28. Vieira AT, Pinho V, Lepsch LB, Scavone C, Ribeiro IM, Tomassini T, Ribeiro-dos-Santos R, Soare M., Teixeira M, Souza DG. Mechanisms of the anti-inflammatory effects of the natural secosteroids physalins in a model of intestinal ischaemia and reperfusion injury. British Journal of Pharmacology. 2005, 146: 244–51.
29. Kawohl G, Szperalski B, Schroder JM, Christophers E. Polymorphonuclear leukocyte chemotaxis in psoriasis: enhancement by self-activated serum. British Journal of Dermatology. 1980, 103: 527–33.
30. Buetler TM, Leclerc E, Baumeyer A, Latado H, Newell J, Adolfsson O, Parisod V, Richoz J, Maurer S, Foata F, Piguet D, Juno S., Heizmann CW, Delatour T. Ne-carboxymethyllysine-modified proteins are unable to bind to RAGE and activate an inflammatory response. Molecular Nutrition and Food Research. 2008, 52: 370–8.
31. Henle T. AGE in foods: do they play a role in uremia? Kidney International. 2003. Suppl 84: S145–S147.
32. Singh R, Barden A, Mori T, Beilin L. Advanced glycation end-products: a review. Diabetologia. 2001, 44: 129–46.
33. Kucharzik T, Walsh SV, Chen J, Parkos CA. Nusrat A. Neutrophil transmigration in inflammatory bowel disease is associated with differential expression of epithelial intercellular junction proteins. American Journal of Pathology. 2001, 159: 2001–9.
34. Koschinsky T, He CJ, Mitsuhashi T, Bucala R, Liu C, Buenting C, Heitmann K, Vlassara H. Orally absorbed reactive glycation products (glycotoxins): an environmental risk factor in diabetic nephropathy. Proceedings of the National Academy of Sciences USA. 1997, 94: 6474–9.
35. He C, Sabol J, Mitsuhashi T, Vlassara H. Dietary glycotoxins: inhibition of reactive products by aminoguanidine facilitates renal clearance and reduces tissue sequestration. Diabetes. 1999, 48: 1308–15.
36. Brown AJ, Goldsworthy SM, Barnes AA, Eilert MM, Tcheang L, Daniels D, Muir AI, Wigglesworth MJ, Kinghorn I, Fraser NJ, Pike NB, Strum JC, Steplewski KM, Murdock PR, Holder JC, Marshall FH, Szekeres PG, Wilson S, Ignar DM, Foord SM, Wise A, Dowell SJ. The orphan G protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids. Journal of Biological Chemistry. 2003, 278: 11312–9.
37. Lee T, Schwandner R, Swaminath G, Weiszmann J, Cardozo M. Greenberg J, Jaeckel P, Ge H, Wang Y, Jiao X, Liu J, Kayser F, Tian H, Li Y. Identification and Functional Characterization of Allosteric Agonists for the G protein-coupled receptor FFA2. Molecular Pharmacology. 2008, 74: 1599-609.
38. Schmitt A, Schmitt J, Münch G, Gasic-Milenkovic J. Characterization of advanced glycation end products for biochemical studies: side chain modifications and fluorescence characteristics. Analytical Biochemistry. 2005, 338: 201–15.
39. Smith NJ, Stoddart LA, Devine NM, Jenkins L, Milligan G. The action and mode of binding of thiazolidinedione ligands at free fatty acid receptor 1. Journal of Biological Chemistry. 2009, 284: 17527–39.
40. Sum CS, Tikhonova IG, Neumann S, Engel S, Raaka BM, Costanzi S. Identification of residues important for agonist recognition and activation in GPR40. Journal of Biological Chemistry. 2007, 282: 29248–55.