1. INTRODUCCIÓN
La investigación clínica tiene por objeto avanzar en el conocimiento biomédico mediante el estudio de las personas humanas en el ámbito de la salud, ya sea a través de la interacción directa o mediante la recolección y análisis de sangre, tejidos u otros datos (1). Para ello, un elemento fundamental – irrenunciable – es la metodología científica, necesaria para generar una imagen de la realidad hasta donde la confluencia del conocimiento teórico con la evidencia empírica permita establecer, pero sin perder de vista que la esencia del método científico es la experimentación y reproducibilidad de los resultados (2). En definitiva, la investigación clínica debe seguir – como cualquier otra forma de estudio científico – un plan o protocolo predefinido, es decir, un método o procedimiento estándar y reproducible que haya sido contrastado previamente, con el fin de evaluar y medir, en su caso, los efectos de algún tipo de intervención (práctica médica, farmacológica, quirúrgica, conductual, dietética, fisioterapéutica, etc.) en los resultados para la salud en seres humanos o, simplemente, observar – registrar – los datos correspondientes a grupos seleccionados.
Al participar en la investigación clínica y siempre que sean adecuadamente informadas y cuyo consentimiento activo haya sido solicitado y positivamente otorgado previamente, las personas participantes no solo pueden sentirse más implicadas en la mejora de su propia atención médica, sino que también tienen la oportunidad de acceder a tratamientos experimentales susceptibles de resolver o paliar condiciones previamente irresolubles y, al mismo tiempo, colaborar en la mejora de las expectativas de otras personas (3).
2. REGULACIÓN LEGAL Y REGISTRO OFICIAL DE LA INVESTIGACIÓN CLÍNICA EN LA UNIÓN EUROPEA
Aunque es frecuente escuchar o leer que ambos términos se emplean de forma indistinta, no es lo mismo un estudio clínico que un ensayo clínico. La diferencia es matizada la norma legal que regula oficialmente la investigación clínica en España, el Real Decreto 1090/2015, de 4 de diciembre, que regula en España los ensayos clínicos con medicamentos, los Comités de Ética de la Investigación con medicamentos y el Registro Español de Estudios Clínicos (4). Según la referencia oficial, un estudio clínico es cualquier investigación relativa a personas destinada a descubrir o comprobar los efectos clínicos, farmacológicos o demás efectos farmacodinámicos de uno o más medicamentos; identificar cualquier reacción adversa a uno o más medicamentos; estudiar la absorción, la distribución, el metabolismo y la excreción de uno o más medicamentos, con el objetivo de determinar la seguridad y/o eficacia de dichos medicamentos. También tienen la consideración de estudios clínicos los estudios observacionales, es decir, toda investigación que implique la recogida de datos individuales relativos a la salud de personas, siempre que no implique ningún tipo de intervención. Por su parte, un ensayo clínico es definido oficialmente como cualquier estudio clínico que cumpla con las siguientes condiciones:
- Se asigna de antemano al sujeto de ensayo a una estrategia terapéutica determinada, que no forma parte de la práctica clínica habitual del Estado miembro implicado.
- La decisión de prescribir los medicamentos en investigación se toma junto con la de incluir al sujeto en el estudio clínico.
- Se aplican procedimientos de diagnóstico o seguimiento a los sujetos de ensayo que van más allá de la práctica clínica habitual.
Junto con ello, se define como ensayo clínico de bajo nivel de intervención a aquel que cumple todas las condiciones siguientes:
- Los medicamentos en investigación, excluidos los placebos, están ya autorizados.
- Según el protocolo del ensayo clínico:
- Los medicamentos en investigación se utilizan de conformidad con los términos de la autorización de comercialización.
- O el uso de los medicamentos en investigación se basa en pruebas y está respaldado por datos científicos publicados sobre la seguridad y eficacia de dichos medicamentos en investigación en alguno de los Estados miembros implicados.
- Los procedimientos complementarios de diagnóstico o seguimiento entrañan un riesgo o carga adicional para la seguridad de los sujetos que es mínimo comparado con el de la práctica clínica habitual en alguno de los Estados miembros implicados.
El Reglamento (UE) n.º 536/2014 del Parlamento Europeo y del Consejo, de 16 de abril de 2014, sobre los ensayos clínicos de medicamentos de uso humano, no solo establece los procedimientos comunes para la autorización de ensayos clínicos en toda Europa, sino que insta a que los Estados miembros cooperen en la evaluación mediante una posición única y común, al margen de los aspectos de carácter intrínsecamente nacional que requieren una evaluación por parte de cada Estado miembro (5). La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) es la autoridad competente para emitir una autorización de cualquier ensayo clínico que se lleve a cabo en España.
La investigación clínica no acaba con la autorización de comercialización de un medicamento, sino que, al contrario, son muchos los que siguen siendo objeto de una extensa e intensiva investigación por parte de sus laboratorios titulares con el fin de extraer el máximo de conocimiento y de resultados sanitarios de unos productos cuyo desarrollo tiene un muy alto coste económico y que requiere amplios y multidisciplinares equipos humanos investigadores. En este sentido, y a título de ejemplo, el Comité de Medicamentos de Uso Humano (Committee for Medicinal Products for Human Use, CHMP) de la Agencia Europea de Medicamentos (European Medicines Agency, EMA) ha hecho 258 recomendaciones positivas de extensión de indicaciones, para un total de 181 medicamentos procedentes de 74 laboratorios, en los tres últimos años, entre enero de 2021 y marzo de 2024 (6).
Actualmente, todos los ensayos clínicos en curso en la UE (y algunos otros países pertenecientes al Espacio Económico Europeo, como Noruega, Islandia y Liechtenstein) deben trasladarse por imperativo legal al Sistema de Información de Ensayos Clínicos (Clinical Trials Information System, CTIS), que comenzó el 31 de enero de 2022, aunque solo fue obligatorio desde el 31 de enero de 2023; el 31 de enero de 2025 marcó el final del período de transición (7). Por su parte, el Registro Español de Estudios Clínicos (REec) es una base de datos pública, de uso libre y gratuito para todo usuario, accesible desde la página web de la AEMPS, cuyo objetivo es servir de fuente de información primaria en materia de estudios clínicos con medicamentos (8).
En Estados Unidos está disponible una base de datos en línea, con un sitio web de acceso libre que está disponible en la National Library of Medicine, conocido como ClinicalTrials.gov, que proporciona información pública a los investigadores y a los profesionales de la salud sobre estudios de investigación clínica (9). No obstante, a diferencia de CTIS (Unión Europea) y REec (España), en Estados Unidos la agencia reguladora oficial de medicamentos FDA (Food & Drug Administration) no revisa ni aprueba la seguridad y los métodos de todos los estudios incluidos en ClinicalTrials.gov, sino que los National Institutes of Health (NIH) y otras agencias oficiales implicadas solo aprueban aquellos estudios que ellas mismas financian. Además, ClinicalTrials.gov no incluye necesariamente a todos los estudios de investigación clínica, ya que son los propios patrocinadores e investigadores los que de forma voluntaria incorporan los registros y la información.
3. PARTICIPACIÓN Y REPRESENTATIVIDAD DE LAS PERSONAS MAYORES EN ENSAYOS CLÍNICOS
Es bien conocido que la edad fisiológica realiza cambios fisiológicos y patológicos de manera progresiva en todos los órganos del cuerpo, lo que obviamente condiciona el uso de los medicamentos indicados en cada caso particular. Este es un motivo primordial para la representación de ancianos en los ensayos clínicos, porque el comportamiento de los fármacos en un cuerpo con cambios tiende a hacerse impredecible (10). En particular, los cambios farmacocinéticos y farmacodinámicos en mayores de 75 años son llamativos, aunque todos los cambios no son igualmente relevantes para todos los medicamentos ni para todos los ancianos, especialmente porque la población anciana no es homogénea. Entre los cambios que se producen, son particularmente significativos aquellos observados en la distribución del volumen, el porcentaje de grasa, así como la masa hepática (muy relevante por los mecanismos de reacciones de fase 1 para enzimas asociadas al citocromo P450). Tales cambios múltiples se traducen —entre otras consecuencias— en una disminución de flujo hepático que provoca la reducción del efecto de primer paso, alterando las formas activas de aquellos medicamentos que son afectados comúnmente por este proceso. Por tanto, los cambios en la farmacocinética y también en la farmacodinamia – por modificación de la respuesta tisular u orgánica — de los medicamentos en las personas mayores pueden determinar importantes alteraciones en sus perfiles de seguridad y eficacia alterados.
Con el objetivo de evaluar la representación de adultos mayores en ensayos clínicos de solicitudes de nuevos fármacos (NDA) y solicitudes de licencias de productos biológicos (BLA), Lau y colaboradores (11) llevaron a cabo un estudio transversal en el que se analizaron los datos de la Food & Drug Administration (FDA) de Estados Unidos para las NDA y BLA aprobadas entre 2010 y 2019. En concreto, la distribución por edad de los participantes de los ensayos clínicos se comparó con la distribución por edad de la población estadounidense con la enfermedad o trastorno (población prevalente). Los datos analizados – desde noviembre de 2020 hasta febrero de 2021 – procedían de adultos inscritos en ensayos clínicos para la depresión, la insuficiencia cardíaca, el insomnio, el cáncer de pulmón de células no pequeñas (CPCNP), la fibrilación auricular no valvular, la prevención de accidentes cerebrovasculares, la osteoporosis y la diabetes tipo 2 o de adultos de la población prevalente en los datos de salud que viven en la comunidad.
La representatividad de las poblaciones de ensayo se evaluó mediante la relación participación-prevalencia, definida como el porcentaje de pacientes por grupo etario entre los participantes del ensayo clínico respecto del porcentaje de pacientes por grupo etario entre la población prevalente. Se analizaron los datos correspondientes a 166 ensayos clínicos (229.558 participantes) para 44 NDA y BLA. El hallazgo más consistente fue la inscripción limitada de los grupos de mayor edad, es decir, los de 75 años o más para la diabetes tipo 2 y el CPCNP, y los de 80 años o más para la prevención del accidente cerebrovascular con fibrilación auricular no valvular, el insomnio, la insuficiencia cardíaca y la osteoporosis; no obstante, los adultos de 60 a 74 años se inscribieron en una proporción igual o mayor que la población prevalente. Todo ello pone en evidencia la subrepresentación de los adultos mayores durante la evaluación de nuevos medicamentos y productos biológicos, aunque estos representan proporciones significativas de la población de tratamiento.
Estudios muy recientes, como el de Hanvey y colaboradores (12), confirman lo que ya la literatura científica ha venido revelando desde hace tiempo: los pacientes de identidades sociales, estatus socioeconómicos (SES) y experiencias médicas marginadas, especialmente los pacientes de color y adultos mayores, están subrepresentados en los ensayos clínicos sobre el cáncer (CCT). La evidencia emergente indica cada vez más una subrepresentación de los CCT entre los pacientes de SES más bajo o de origen rural, minorías sexuales y de género y pacientes con discapacidad comórbida.
Obviamente, esta situación no es exclusiva de determinados países, sino que puede decirse que está generalizada a nivel mundial. Así, Noronha y colaboradores (13) realizaron un análisis retrospectivo de estudios intervencionistas realizados en India entre 2003 y 2023 en pacientes adultos con neoplasias malignas, incluyendo 21.894 pacientes inscritos en 150 ensayos intervencionistas en oncología quirúrgica, médica y radioterápica, anestesia y farmacología clínica, encontrando 5.132 (23,4%) participantes de ≥60 años, 2.678 (12,2%) ≥65 años y 1.045 (4,8%) ≥70 años. Sin embargo, los datos del registro hospitalario revelaron que el 30% de los adultos tenían ≥60 años. Aunque hubo un aumento significativo en la proporción de pacientes mayores inscritos en ensayos clínicos desde 2003 (8%) hasta 2019 (22%) – mientras que el registro hospitalario se mantuvo estable en 28-29% – los autores de este estudio consideran que, aunque se ha reducido con el tiempo, todavía existe una brecha entre la proporción de adultos indios mayores con cáncer en el registro hospitalario y aquellos inscritos en ensayos clínicos intervencionistas.
Anteriormente mencionábamos el hecho de que la población de personas mayores no es homogénea y, por tanto, la agrupación etaria en “mayores de 64 años” refiere una amplia dispersión de características fisiopatológicas, posiblemente mayor que la que puede apreciarse en el grupo etario de “adultos jóvenes” (18-64 años). En este sentido, Tack y colaboradores (14) han estudiado la proporción de pacientes mayores con cáncer “aptos” en relación a los “vulnerables” incluidos en ensayos de registro oncológico de fase II y III, en comparación con las proporciones en un entorno oncológico de la vida real. Para ello, recopilaron retrospectivamente las características de los pacientes y del ensayo de pacientes mayores (≥70 años) tratados en un centro oncológico clínico e incluidos en ensayos clínicos de fase II o III, emparejándolos individualmente con pacientes seleccionados al azar del entorno oncológico general, en función del sexo, la edad, el tipo de tumor, el estadio del tumor y la intención de tratamiento. Los resultados revelaron una diferencia estadísticamente significativa entre los casos y los controles emparejados, con una mayor proporción de pacientes “aptos” incluidos en ensayos en comparación con la proporción en el grupo de control emparejado (70,7 vs. 41,5%), lo que respalda la hipótesis de que los pacientes mayores incluidos en ensayos oncológicos de fase II o III están significativamente en mejor forma física que la población oncológica real, lo que puede ofrecer una imagen sesgada de la efectividad terapéutica real.
Si, en general, las personas mayores están subrepresentadas en los ensayos clínicos oncológicos; aquellas con edades más avanzadas – donde no son infrecuentes los cuadros neoplásicos – pueden estarlo en mucha mayor medida, impidiendo obtener un conocimiento decisivo sobre el valor terapéutico de una intervención. Barrichello y colaboradores (15) han estudiado recientemente la cuestión de la subrepresentación de los pacientes con cáncer de pulmón de células no pequeñas (CPCNP) de ≥80 años en los ensayos clínicos, evaluando si la edad se correlaciona con un inmunofenotipo distinto o afecta los resultados del tratamiento de primera línea con pembrolizumab en pacientes con CPCNP avanzado, puntuación de proporción tumoral (TPS) de PD-L1 de ≥50 % y ≥80 años de edad. Para ello, analizaron retrospectivamente tres cohortes de CPCNP para evaluar el impacto de la edad (<80 años frente a ≥80 años) en la eficacia del pembrolizumab y el microambiente tumoral (EMT), concluyendo que los pacientes ≥80 años con CPNM con PD-L1 alto mostraron un inmunofenotipo distinto en el EMT y, si bien alcanzaron tasas de respuesta similares con pembrolizumab de primera línea en comparación con los pacientes más jóvenes, la supervivencia global fue más corta en los pacientes mayores, que tenían menos probabilidades de recibir terapia de segunda línea.
El cáncer de mama sigue siendo una de las principales causas de mortalidad relacionada con el cáncer en todo el mundo, y los pacientes de edad avanzada (mayores de 65 años) representan una parte sustancial de los afectados. En una reciente revisión, Bonotto y colaboradores (16) han explorado la aplicación de conjugados anticuerpo-fármaco (ADC), como trastuzumab emtansina (T-DM1), trastuzumab deruxtecan (T-DXd) y sacituzumab govitecan (SG), en el tratamiento del cáncer de mama en poblaciones de edad avanzada. La evidencia actual indica que estos ADC son efectivos y tolerables en pacientes de edad avanzada, a pesar de un ligero aumento de los eventos adversos. Sin embargo, los nuevos ADC, incluidos datopotamab deruxtecan y ARX-788, son prometedores, pero carecen de datos extensos específicos para geriatría, por lo que se necesitan más investigaciones para optimizar su uso en pacientes mayores con cáncer de mama.
En general, el campo de la oncología geriátrica ha logrado avances significativos en las últimas décadas, pero como afirman Lichtman y colaboradores (17), aún se pierden oportunidades en importantes áreas de investigación. La escasa representación de los pacientes mayores, especialmente los mayores de 75 años, en los ensayos clínicos ha dado lugar a una falta de datos de alta calidad para la atención de esta población, por lo que las sociedades oncológicas y, en particular, la Sociedad Estadounidense de Oncología Clínica han pedido que se aumente la base de evidencia para los pacientes mayores con cáncer. La segunda oportunidad perdida a la que alude Lichtman es la de recopilar conocimientos importantes de los pacientes mayores que participan en ensayos clínicos, como medicamentos, apoyo social, seguros e información financiera para mejorar la información disponible para los investigadores y los médicos. La tercera oportunidad perdida es la de analizar en profundidad y comunicar de forma consistente los datos, dado que muchos ensayos clínicos solo informan de una mediana de edad y de un rango, lo que es un perjuicio tanto para los participantes como para los futuros pacientes que serán tratados en función de los resultados del estudio. Para avanzar en la investigación sobre oncología geriátrica, es necesario recopilar, analizar y comunicar los datos necesarios mediante una representación adecuada de los pacientes mayores, la recopilación de información esencial y un análisis y comunicación exhaustivos de los resultados. El diseño de los ensayos clínicos debe incluir parámetros basales geriátricos, y el Programa de Evaluación de Terapia del Cáncer (CTEP) ha modificado su plantilla para incluir estos parámetros.
Otro de los campos donde los ensayos clínicos son especialmente relevantes para las personas mayores es la neurología, en la que frecuentemente se encuentran subrepresentados o incluso ausentes. Como indica Muñoz Vendrell, del Grupo de Estudios de Cefaleas (jGECSEN) de la Sociedad Española de Neurología (18), los pacientes con migraña mayores de 65 años han sido excluidos de los ensayos fundamentales de anticuerpos monoclonales anti-CGRP (péptido relacionado con el gen de la calcitonina), de los que hay varios fármacos autorizados en la Unión Europea (erenumab, eptinezumab, galcanezumab, fremanezumab), lo que deja datos limitados en la vida real sobre la eficacia y la seguridad en esta población.
Igualmente, se ha descrito la implicación de las limitaciones de edad en los pacientes mayores susceptibles de ser incorporados a ensayos clínicos en una patología tan típicamente prevalente en ancianos como la enfermedad de Parkinson (EP). Kłosowska y colaboradores (19) han estudiado los criterios de elegibilidad en ensayos clínicos aleatorizados en EP, especialmente aquellos que limitan la inscripción de adultos mayores. De los 420 ensayos que comenzaron entre 2013 y 2022, doscientos treinta y nueve (57%) tenían un límite de edad superior de 85 años o menos. Asimismo, trescientos cincuenta y seis (85%) ensayos tenían otros criterios de elegibilidad que limitaban la inclusión de pacientes mayores, entre ellos el deterioro cognitivo (n=285; 68%), un elemento patológico relativamente común en pacientes con EP.
A pesar de que, en comparación con sus contrapartes más jóvenes, los ancianos tienen una mayor incidencia de morbilidades relacionadas con la enfermedad, toman más medicamentos y son responsables de más eventos adversos relacionados con los medicamentos, sin embargo, a menudo han estado subrepresentados –junto con las mujeres– en los ensayos clínicos aleatorizados que prueban el efecto de los tratamientos sobre las enfermedades cardiovasculares, a pesar de que estas enfermedades los afectan en gran medida a ambos, tal y como han documentado Vitale y colaboradores (20).
Un ejemplo paradigmático de esto último es la escasa investigación clínica para determinar la eficacia y la seguridad de la reducción intensiva de LDL-colesterol en pacientes mayores, lo que ha dado lugar a recomendaciones más débiles en las directrices para pacientes ≥75 años de edad en comparación con los pacientes más jóvenes, como sostiene Al Said y colaboradores (21), debido a que los datos sobre los beneficios a largo plazo de la inhibición de la proproteína convertasa subtilisina/kexina tipo 9 en pacientes mayores son escasos. Por ello, estos investigadores realizaron un estudio con el objetivo de evaluar el beneficio a largo plazo del evolocumab entre pacientes ≥75 años con riesgo elevado, asignando aleatoriamente a 27.564 pacientes de 18 a 85 años con enfermedad cardiovascular aterosclerótica a evolocumab frente a placebo con una mediana de seguimiento de 2,2 años. Los resultados mostraron que el inicio temprano del tratamiento a largo plazo con evolocumab ofrece a los pacientes mayores con enfermedad cardiovascular aterosclerótica beneficios cardiovasculares al menos tan buenos como los observados en pacientes más jóvenes, con un número necesario a tratar más favorable en los pacientes mayores y sin problemas de seguridad significativos.
Es evidente que cada vez es mayor la esperanza de vida entre las personas mayores de 65 años en la mayoría de los países del mundo, y lo es particularmente en España. Como indica el Instituto Nacional de Estadística de España (INE), en los países occidentales, la esperanza de vida ha experimentado notables avances en el último siglo, y se ha conseguido con disminuciones en la probabilidad de morir debido a los avances médicos y tecnológicos, reducción en las tasas de mortalidad infantil, cambios en los hábitos nutricionales y estilos de vida, mejora en los niveles de condiciones materiales de vida y en la educación, así como el acceso de la población a los servicios sanitarios. En las últimas décadas ha aumentado significativamente la esperanza de vida al nacimiento en hombres y mujeres, y la diferencia entre estos ha disminuido en los últimos años. En concreto, según los datos del INE (22), en 2022 la esperanza de vida a los 65 años era de 19,1 años de vida adicionales para los varones (totalizando 84,1 años) y de 23,0 para las mujeres (88,0), mientras que la esperanza de vida a los 85 años es de 6,0 años adicionales para los varones (91) y de 7,4 para las mujeres (92,4); además, se estima que la esperanza de vida a los 65 años sea de 20,5 años adicionales (85,5) para los varones y de 24,1 (89,1) para las mujeres en 2030, valores que alcanzarán previsiblemente en 2050 la cifra de 21,9 años adicionales (86,9) en varones y 25,4 (90,4) en mujeres.
Por todo lo indicado, cada vez será mayor el número y la proporción de personas mayores que utilizarán medicamentos, incluso en etapas muy avanzadas de la vida. Sin embargo, a pesar de que la mayoría de los usuarios de medicamentos tienen 60 años o más, muchos ensayos aún excluyen a las personas mayores. Esto corre el riesgo de que las personas tomen medicamentos que pueden no ser tan efectivos como podrían ser o, peor aún, que provoquen reacciones adversas. Pese a esto, según la Sociedad Española de Geriatría y Gerontología, un 89% de las personas mayores de 65 años consumen algún medicamento, proporción que asciende al 93,4% de los mayores de 75 años, a lo que hay que añadir que el 93% de las personas con enfermedades crónicas están polimedicadas (23).
Es, pues, muy pertinente considerar las consecuencias y los retos de la incorporación de personas mayores a los ensayos clínicos, tal como se recomienda en el informe publicado en 2023 por el International Longevity Centre (ILC), que identifica una serie de barreras para realizar ensayos con pacientes mayores (24).
Para empezar, la inclusión de participantes de mayor edad suele requerir más recursos y flexibilidad por parte de los equipos de investigación clínica, debido – se supone – a que normalmente es más fácil y más barato utilizar cohortes más jóvenes y saludables, que además conllevan un menor riesgo de eventos adversos. Sin embargo, indica el informe del ILC, esta es una suposición sobre los pacientes mayores que requiere confirmarse mediante investigación. Asimismo, posiblemente reclutar cohortes más jóvenes a menudo da como resultado la obtención de conjuntos de datos más “claros” o “limpios” – homogéneos – y menos complejos, ya que la eliminación de los participantes de mayor edad tiende a reducir parte de la complejidad necesaria, incluida las comorbilidades y las medicaciones concomitantes. De hecho, algunos protocolos de ensayo permiten que algunas personas (como las personas mayores) sean excluidas de la participación debido a otros diagnósticos o dudas sobre el cumplimiento terapéutico, aunque de manera desproporcionada y sin una buena razón. Todo ello puede redundar en que cualquier conclusión extraída sobre la eficacia del medicamento sea menos precisa y menos generalizable a poblaciones más grandes y heterogéneas; es decir, aunque los datos “limpios” pueden parecer preferibles, reducen los matices y la diversidad necesarios en un ensayo verdaderamente representativo y no ayudan a los investigadores a entender si los medicamentos son seguros y efectivos para todos los pacientes que pueden tomarlos.
Aunque en las últimas décadas se ha ido observando un paulatino aumento en las iniciativas para mejorar la inclusión de grupos subrepresentados, particularmente en lo que respecta al género y la raza, no ha ocurrido lo mismo en materia de diversidad de edad. Por eso es preciso un cambio estructural y cultural, tal como concluye el informe; para lograr una diversidad de edad significativa en las cohortes de ensayos clínicos, las partes interesadas involucradas en cualquier etapa del proceso deben ir más allá de lo que se requiere actualmente. Esto incluye una participación exhaustiva y constante de los pacientes, una mayor inversión de tiempo y recursos en redes e infraestructura, además de cambios regulatorios para apoyar el diálogo entre reguladores, compañías farmacéuticas y diseñadores de ensayos. Los ensayos clínicos son complejos, costosos y necesarios para la buena salud de poblaciones, que simultáneamente aumentan y envejecen. Por eso este informe defiende que todos deben hacer un esfuerzo adicional para incluir a personas de todas las edades, entendiendo que se trata de una inversión en la futura salud colectiva.
En el diseño experimental de un ensayo clínico que incluya a personas mayores, debe tenerse en cuenta y ajustarse a las previsibles deficiencias y disfunciones asociadas a la edad, tales como hipostesia, hipoacusia, disminución de la agudeza visual e incluso deterioros cognitivos que pueden complicar la participación del adulto mayor en la investigación clínica. Para ello, se hace imprescindible el acompañamiento de asistentes que faciliten la inclusión, aunque ello implique que estas personas se constituyan como un participante del ensayo que es preciso entrenar, además de proceder a cumplimentar las normas éticas y de confidencialidad previstas. Las personas de edad avanzada pueden necesitar más tiempo para ser reclutadas y es posible que se requieran los conocimientos de investigadores con experiencia en la evaluación de personas mayores. En muchos casos, los sujetos necesitan ser acompañados por un cuidador, todo lo cual implica un tiempo adicional para el desarrollo de la investigación, un incremento de costes y una planificación más compleja; asimismo, los pacientes adultos mayores no suelen buscar activamente la participación en ensayos clínicos, mayoritariamente debido al desconocimiento y a la falta de información adecuada al nivel específico de comprensión de cada anciano. Por otro lado, los objetivos a alcanzar deben ser modificados y adaptados a este grupo de edad; por ejemplo, aunque el objetivo de disminuir la mortalidad cardiovascular a largo plazo es evidente en la población adulta joven, sin embargo, puede no ser un parámetro particularmente relevante en la población anciana, en comparación con la mejora de la discapacidad que puede mejorar la calidad de vida y disminuir la carga social de la enfermedad del adulto anciano (25).
Existen actualmente diversas iniciativas internacionales destinadas a mejorar la inclusión de grupos infrarrepresentados en los ensayos clínicos, no solo de las personas mayores, sino también de minorías étnicas, residentes en áreas rurales, invidentes o ciudadanos con bajo nivel sociocultural. Este es el caso de un grupo de estudio denominado READI (Research in Europe and Inclusion of Diversity; Investigación en Europa e Inclusión de la Diversidad), coordinado por el Hospital Universitario La Paz de Madrid, una red conformada por 73 organizaciones de 18 países que involucra a investigadores, pacientes, agencias reguladoras, comités de ética e industria farmacéutica (26).
4. ENSAYOS CLÍNICOS CON PERSONAS MAYORES EN LA UNIÓN EUROPEA
Con el fin de cuantificar la participación de personas mayores en ensayos clínicos, hemos procedido a realizar un análisis estadístico con datos procedentes del CTIS, el Sistema de Información de Ensayos Clínicos (7) de la Unión Europea, empleado también por varios países – Noruega, Liechtenstein e Islandia – del Espacio Económico Europeo.
La extracción de datos se hizo el día 7 de marzo de 2025, centrando la búsqueda en los ensayos clínicos actualmente autorizados o que estén ya en curso (ongoing), excluyendo por tanto a los proyectos de estudios que estén en fase de evaluación, así como a los ensayos temporalmente detenidos, definitivamente suspendidos o ya finalizados: Ensayos clínicos: 7.600
- Autorizados: 2.820. Con proceso de selección o reclutamiento de personas/pacientes.
- No iniciado: 2.128
- Activo: 692
- En curso: 4.780. Con proceso de selección o reclutamiento de personas/pacientes.
- Activo: 3.085
- Finalizado: 1.695
Considerando explícitamente los grupos de edad (etarios), el número de ensayos clínicos autorizados o en marcha que incluyen personas de 0 a 17 años es de 1.087 (14,3% de 7600), el de los que incluyen personas de 18 a 64 años es 6.992 (92,0%) y el de los que incluyen mayores de 64 años es de 5.967 (78,5%). El total de ensayos que incluyen a todas las personas adultas (18 años o más) fue de 7.085, lo que supone que hay 1.188 (16,8%) ensayos clínicos en adultos que no incluyen a personas mayores, mientras que solo 93 (1,3%) son exclusivos para mayores de 64 años.
4.1. Ensayos clínicos que incluyen población mayor (más de 64 años)
Centrándonos en los ensayos clínicos que incluyen a personas mayores (más de 64 años), están autorizados 2137, lo que supone un 75,8% de todos los autorizados (2820) y, específicamente, con procesos de reclutamiento o selección de personas/pacientes no iniciados, son 1600 (75,2% del total de 2128) y con reclutamiento en curso son 537 vs. (77,6% de 692). Los ensayos actualmente en curso son 3830 (80,1% de 4780), de los que 2425 (76,6% de 3085) mantienen abierto el reclutamiento y 1405 (82,9% de 1695) ya lo han finalizado.
Es interesante indicar que dentro del grupo de ensayos clínicos que incluyen mayores de 64 años (5967), el número de ensayos clínicos con medicamentos huérfanos es de 580 (9,7%), mientras que el de ensayos clínicos realizados sobre enfermedades raras es de 1130 (18,9%) y el de ensayos clínicos con bajo nivel de intervención es de 450 (7,5%). Finalmente, los ensayos clínicos que incluyeron a voluntarios sanos (solos o conjuntamente con pacientes) son 207 (3,5%).
Como ya se ha indicado, el número de ensayos clínicos en marcha con procesos de reclutamiento y selección de personas/pacientes ya finalizados es de 1405. En este grupo, 39 (2,8%) tuvieron 1.000 o más participantes, el mayor de los cuales incluye a 130.000 en un estudio pragmático en Dinamarca para determinar el efecto de Abrysvo® (vacuna contra el virus respiratorio sincitial, VRS) para la prevención de hospitalizaciones por VRS. El segundo más grande (N=9.233) es un estudio multinacional en el que se compara milvexian (un inhibidor del factor de coagulación XIa) con apixaban (inhibidor del factor Xa) para la fibrilación auricular, mientras que el tercero mayor (N=6.020) es un ensayo multinacional que estudio el empleo de evolocumab en prevención de eventos cardiovasculares graves en pacientes con riesgo cardiovascular elevado. Con 500 a 999 participantes hay 69 (4,9%), con 200 a 499 hay 305 (21,7%), con 100 a 199 hay 296 (21,1%) y con 50 a 99 hay 283 (20,1%); todo lo cual implica que solo la mitad (50,4%) de los ensayos clínicos con procesos de reclutamiento y selección de personas/pacientes (incluidos mayores de 64 años) ya finalizados (709/1405) incluyen a 100 o más participantes. El número de ensayos clínicos exclusivos para varones es de 56 (4,0%), exactamente igual que el de ensayos exclusivos para mujeres.
4.2. Área terapéutica
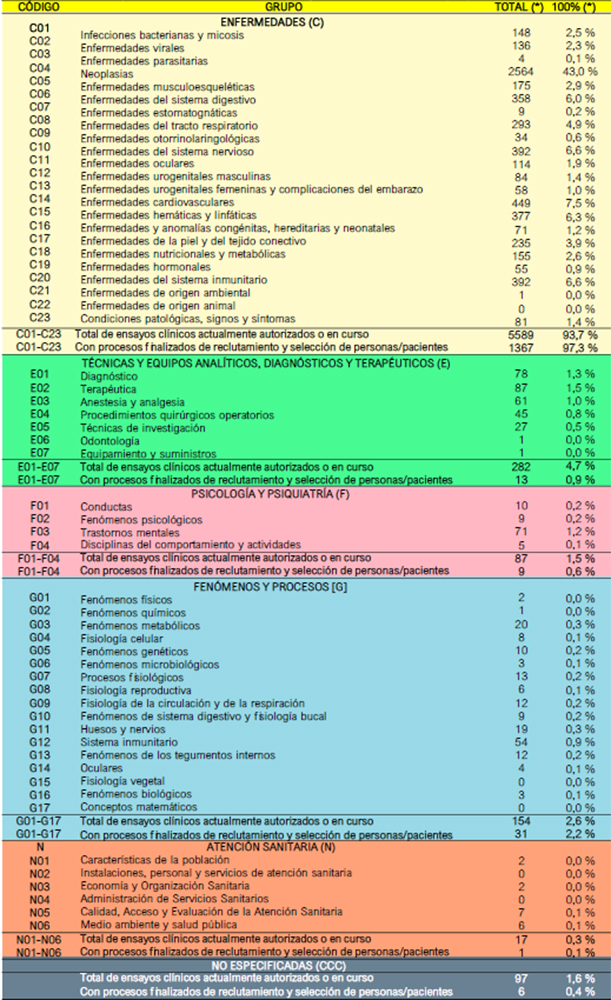
CTIS y REec comparten la misma codificación para las áreas terapéuticas en las que se inscriben los ensayos clínicos registrados. En concreto, se trata de enfermedades [C], equipos y técnicas terapéuticas, analíticas y diagnósticas [E], psiquiatría y psicología [F], procesos fisiológicos [G] y atención a la salud [N]. El sistema de registros permite incluir un mismo ensayo clínico en dos o más categorías y – naturalmente – hay una categoría no especificada [CCC] que, en el periodo estudiado, son 97 (1,6% del total de 5.967 en los que participan personas/pacientes mayores de 64 años) y 6 (0,4% de los 1495 en ensayos con procesos finalizados de reclutamiento y selección de personas/pacientes).
Tal como se puede observar en la Tabla 1, las enfermedades [C] suponen el grueso de las áreas tipo de estudio, con 5589 (incluyendo las opciones múltiples), lo que supone el 93,7% (5589/5967) de los ensayos clínicos actualmente autorizados o en curso, con 1367 de los 1405 (97,3%) ensayos con procesos finalizados de reclutamiento y selección de personas/pacientes. Gran parte (2564; 43,0%) investigan en enfermedades neoplásicas, muy por encima de los restantes grupos: enfermedades cardiovasculares (449; 7,5%), del sistema nervioso (392; 6,6%), del sistema inmunitario (392; 6,6%) y del sistema digestivo (358; 6,0%).
El resto de ámbitos terapéuticos son claramente minoritarios:
Equipos y técnicas terapéuticas, analíticas y diagnósticas [E]: 282 ensayos clínicos actualmente autorizados o en curso ( 4,7 %), con 13 (0,9%) con procesos finalizados de reclutamiento y selección.
Psiquiatría y Psicología [F]: 87 ensayos clínicos actualmente autorizados o en curso (1,5%), con 9 (0,6%) con procesos finalizados de reclutamiento y selección.
Fenómenos y Procesos [G]: 154 ensayos clínicos actualmente autorizados o en curso (2,6%), con 31 (2,2%) con procesos finalizados de reclutamiento y selección.
Atención Sanitaria [N]: 17 ensayos clínicos actualmente autorizados o en curso (0,3%), con 1 (0,1%) con procesos finalizados de reclutamiento y selección.
Tabla 1. Tabla 1. Número de ensayos clínicos autorizados o en marcha actualmente en la Unión Europea (UE) y Noruega, Liechtenstein e Islandia (EEE: Espacio Económico Europeo), según el ÁREA TERAPÉUTICA (I-IV)
Fuente: elaboración propia a partir de datos extraídos de CtIs el 7 de marzo de 2025. (*) la suma de los datos y porcentajes (%) parciales exceden a las cifras que aparecen en las casillas de total, debido a que algunos ensayos clínicos están clasificados en dos o más categorías diferentes. el número de ensayos clínicos total seleccionado en el periodo indicado es de 5.967 y el de aquellos con procesos finalizados de reclutamiento y selección es de 1.405
4.3. Fases de ensayo
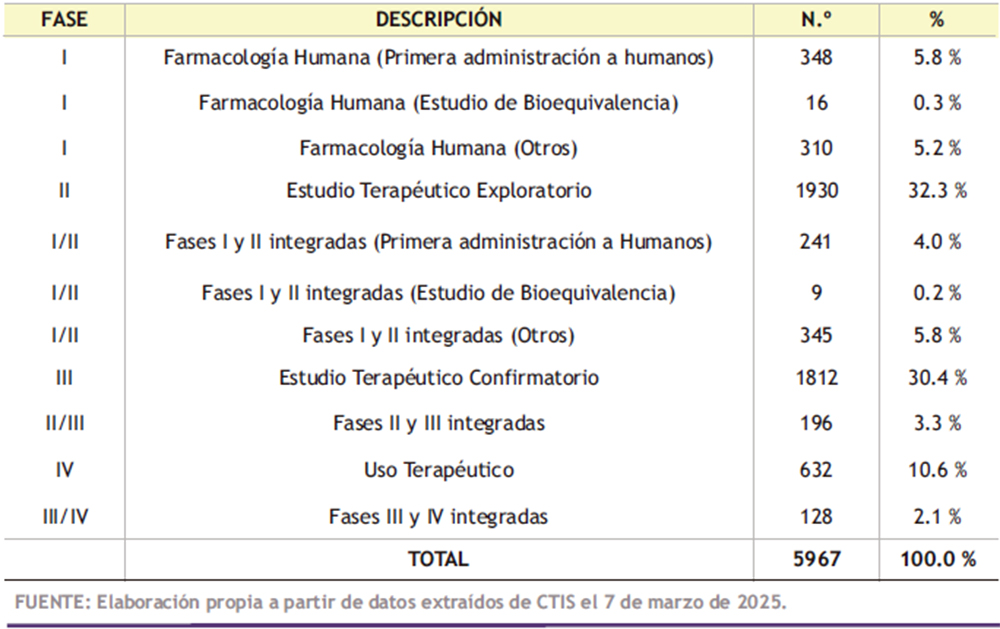
La investigación clínica pasa por varias fases, en las que las poblaciones de estudio van aumentando progresivamente. La distribución de los 5.967 ensayos clínicos autorizados o en marcha actualmente en la Unión Europea (UE) y Noruega, Liechtenstein e Islandia, en los que participan personas/pacientes mayores de 64 años, según la fase del ensayo (I-IV), está descrita en la Tabla 2. Los aspectos más significativos son:
- Fase I: Farmacología humana: Pueden corresponder a la primera administración a seres humanos, estudios de bioequivalencia o de otros tipos. Suelen incluir a pocos participantes (decenas), que pueden ser voluntarios sanos en función de la patología de estudio, para confirmar que la administración del fármaco es segura. Suman un total de 674 (11,3%), distribuidos de la siguiente forma:
- Primera administración a humanos: 348 (5,8%)
- Estudio de bioequivalencia: 16 (0,3%)
- Otros estudios: 310 (5,2%)
- Fase II: Estudios terapéuticos exploratorios: comienzan los análisis de eficacia en una población que puede llegar a las 200-300 personas, siendo la seguridad con las dosis exploradas otro de los objetivos principales. Son un total de 1.930 (32,3%)
- Fase III: Estudios terapéuticos confirmatorios: confirmación de la eficacia del fármaco en miles de participantes con el objetivo de obtener datos para una solicitud de autorización de comercialización. Son 1,812 (30,4%).
- Fase IV: Uso terapéutico: estudios a largo plazo con medicamentos ya autorizados para estudiar posibles reacciones adversas poco frecuentes o conocer posibles beneficios adicionales. Un total de 632 (10,6%).
- Son relativamente comunes los ensayos clínicos que integran dos fases: 919 (15,4%).
- I/II: 595 (10,0%)
- II/III: 196 (3,3%)
- III/IV: 128 (2,1%)
Tabla 2. Número de ensayos clínicos autorizados o en marcha actualmente en la Unión Europea (UE) y Noruega, Liechtenstein e Islandia (EEE: Espacio Económico Europeo), según la fase del ensayo (I-IV).
4.4. Países y promotores de los ensayos clínicos
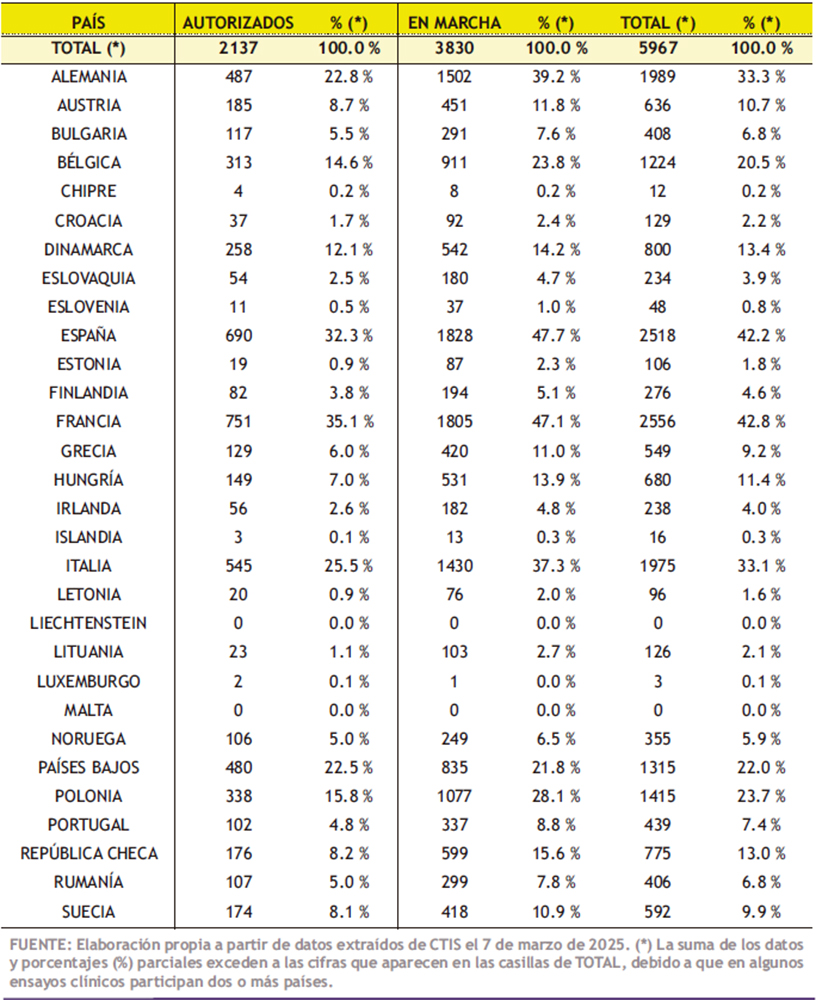
En la Tabla 3 se describe el número de ensayos clínicos autorizados o en marcha actualmente en la Unión Europea (UE) y Noruega, Liechtenstein e Islandia (EEE: Espacio Económico Europeo). Actualmente, muchos de los ensayos clínicos son desarrollados en varios países al mismo tiempo o, en ocasiones, consecutivamente; por ello, la suma de los datos y porcentajes (%) parciales excede a las cifras que aparecen en las casillas de total.
Considerando el conjunto de ensayos clínicos autorizados y en marcha en los que se incluyen personas/pacientes mayores (5,967), en Francia se llevan a cabo el 42,8% del total, seguida a corta distancia por España (42,2%), Alemania (33,3%) e Italia (33,1%). Considerando específicamente aquellos que actualmente están en marcha, es España el país que lidera la lista, con el 47,7% de los 3.830 ensayos, seguida de Francia (47,1%), Alemania (39,2%) e Italia (37,3%).
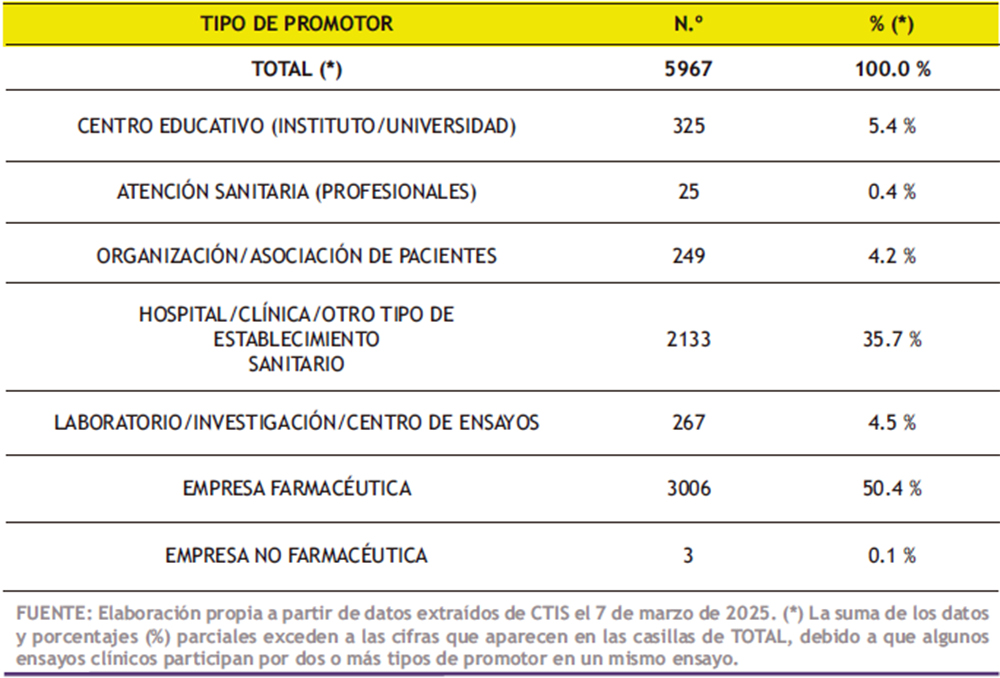
La normativa europea – y, por tanto, la española – denomina promotores a los individuos, empresas, instituciones u organizaciones responsables de iniciar, gestionar y organizar la financiación de un ensayo clínico. Gran parte de ello acabarán siendo las entidades titulares de los medicamentos tras su eventual autorización oficial; es decir, sus dueños a todos los efectos (sociales, comerciales, judiciales, etc.). En la Tabla 4 están registrados siguiendo la codificación empleada por CTIS. En la mitad (50,4%) de los ensayos, el promotor es una empresa farmacéutica, aunque también una parte muy significativa (35,7%) está promovida por hospitales y clínicas.
Tabla 3. Número de ensayos clínicos autorizados o en marcha actualmente en la Unión Europea (UE) y Noruega, Liechtenstein e Islandia (EEE: Espacio Económico Europeo)
Tabla 4. Número de ensayos clínicos autorizados o en marcha actualmente en la Unión Europea (UE) y Noruega, Liechtenstein e Islandia (EEE: Espacio Económico Europeo), según el tipo de ProMotor.
5. CONCLUSIONES
- El envejecimiento provoca cambios fisiológicos y patológicos de manera progresiva en todos los órganos del cuerpo, lo que condiciona el uso de los medicamentos indicados en cada caso particular. Este es un motivo primordial para la representación de ancianos en los ensayos clínicos, porque el comportamiento de los fármacos en un cuerpo con cambios tiende a hacerse impredecible. En particular, los cambios farmacocinéticos y farmacodinámicos en mayores de 75 años son llamativos, aunque todos los cambios no son igualmente relevantes para todos los medicamentos ni para todos los ancianos.
- La evidencia emergente indica una subrepresentación de las personas mayores en los ensayos clínicos aleatorizados, así como de personas con bajos recursos económicos, de origen rural, minorías sexuales y de género y pacientes con discapacidad comórbida. Esta situación no es exclusiva de determinados países, sino que está generalizada a nivel mundial.
- La población de personas mayores no es homogénea, sino que refiere una amplia dispersión de características fisiopatológicas, posiblemente mayor que la que puede apreciarse en el grupo etario de “adultos jóvenes” (18-64 años).
- La escasa representación de los pacientes mayores en los ensayos clínicos da lugar a una falta de datos de alta calidad para la atención de esta población. Para avanzar en la investigación geriátrica, es necesario recopilar, analizar y comunicar los datos necesarios mediante una representación adecuada de los pacientes mayores, la recopilación de información esencial y un análisis y comunicación exhaustivos de los resultados. En comparación con sus contrapartes más jóvenes, los ancianos tienen una mayor incidencia de morbilidades relacionadas con la enfermedad, toman más medicamentos y son responsables de más eventos adversos relacionados con los medicamentos.
- Cada vez es mayor la esperanza de vida entre las personas mayores de 65 años en la mayoría de los países del mundo. En España, se estima que la esperanza de vida a los 65 años será de 20,5 años adicionales (85,5) para los varones y de 24,1 (89,1) para las mujeres en 2030.
- Un 89% de las personas mayores de 65 años consumen algún medicamento, proporción que asciende al 93,4% de los mayores de 75 años.
- En el diseño experimental de un ensayo clínico que incluya a personas mayores, debe tenerse en cuenta y ajustarse a las previsibles deficiencias y disfunciones asociadas a la edad, tales como hipostesia, hipoacusia, disminución de la agudeza visual e incluso deterioros cognitivos que pueden complicar la participación del adulto mayor en la investigación clínica. Para ello, se hace imprescindible el acompañamiento de asistentes que faciliten la inclusión. Los objetivos a alcanzar y las variables de eficacia y seguridad deben ser también adaptados a este grupo de edad.
- Hemos procedido a realizar un análisis con datos procedentes del CTIS, el Sistema de Información de Ensayos Clínicos de la Unión Europea (datos extraídos el 7 de marzo de 2025), correspondiente a los ensayos clínicos que incluyen personas mayores de 64 años y que están autorizados o actualmente en curso (ongoing), sumando 5.967, lo que supone un 78,5% del total para todas las edades (7.600, de 0 a más de 64 años). Hay 1.188 (16,8%) ensayos clínicos en adultos (18 o más años) que no incluyen a personas mayores, mientras que solo 93 (1,3%) son exclusivos para mayores de 64 años.
- El número de ensayos clínicos que incluye a mayores de 64 años con medicamentos huérfanos es de 580 (9,7%), mientras que el de los realizados sobre enfermedades raras es de 1130 (18,9%) y el de aquellos con bajo nivel de intervención es de 450 (7,5%).
- Los ensayos clínicos en marcha con procesos finalizados de reclutamiento y selección son 1405, de los que 39 (2,8%) tuvieron 1.000 o más participantes y solo la mitad (50,4%) incluye a 100 o más participantes. Gran parte (43%) de los estudios investigan en enfermedades neoplásicas, muy por encima de enfermedades cardiovasculares (7,5%), sistema nervioso (6,6%), sistema inmunitario (6,6%) y sistema digestivo (6,0%).
- Considerando la fase del estudio, los más frecuentes son los de fase II (estudios terapéuticos exploratorios: 32,3%) y III (estudios terapéuticos confirmatorios: 30,4%), frente a los de fase I (Farmacología humana: 11,3%) y IV (Uso terapéutico: 10,6%), aunque un porcentaje significativo de ensayos integran dos fases: I/II (10,0%), II/III (3,3%) y III/IV (2,1%).
- Los países de la UE con mayor número de ensayos clínicos actualmente son Francia (35,1% de los autorizados y 47,1% de los que están actualmente en marcha), España (32,3% y 47,7%), Alemania (22,8% y 39,2%) e Italia (25,5% y 37,3%), aunque buena parte de ellos son estudios multinacionales. En la mitad (50,4%) de los ensayos.
6. REFERENCIAS
- National Institutes of Health. Clinical Research. https://www.nichd.nih.gov/health/clinical-research
- Cuéllar Rodríguez S. Medición y ciencia. Panorama Actual Med. 2021; 45(447): 1034-1039. https://www.farmaceuticos.com/pam/revision/medicion-y-ciencia/
- Cuéllar Rodríguez S. La investigación clínica en España (2020-2024): tendencias y perspectivas. Panorama Actual Med. 2024; 48(479): 1338-1350. https://www.farmaceuticos.com/pam/revision/la-investigacion-clinica-en-espana-2020-2024-tendencias-y-perspectivas/
- Ministerio de Sanidad, Servicios Sociales e Igualdad. Real Decreto 1090/2015, de 4 de diciembre, por el que se regulan los ensayos clínicos con medicamentos, los Comités de Ética de la Investigación con medicamentos y el Registro Español de Estudios Clínicos. BOE-A-2015-14082 (texto consolidado). https://www.boe.es/buscar/act.php?id=BOE-A-2015-14082
- Unión Europea. Reglamento (UE) n °536/2014 del Parlamento Europeo y del Consejo, de 16 de abril de 2014, sobre los ensayos clínicos de medicamentos de uso humano, y por el que se deroga la Directiva 2001/20/CE Texto pertinente a efectos del EEE. https://eur-lex.europa.eu/legal-content/ES/TXT/HTML/?uri=CELEX:32014R0536
- Cuéllar Rodríguez S. Reposicionamiento terapéutico: importancia de las nuevas indicaciones terapéuticas autorizadas para antiguos medicamentos. An Real Acad Farm. 2024; 90(2): 239-256. DOI: https://doi.org/10.53519/analesranf.2024.90.02.06
- Unión Europea. Clinical Trials Information System (CTIS). https://euclinicaltrials.eu/
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Registro Español de Estudios Clínicos (REec). https://reec.aemps.es/reec/public/web.html
- National Library of Medicine. ClinicalTrials.gov. https://clinicaltrials.gov/
- Rubio López JM. Representación de pacientes ancianos en ensayos clínicos. Revisión bibliográfica. Med Fam Andal. 2020; 21(3): 175-181. https://www.samfyc.es/wp-content/uploads/2020/12/v21n3_repasandoAP_pacientesAncianos.pdf
- Lau SWJ, Huang Y, Hsieh J, et al. Participation of Older Adults in Clinical Trials for New Drug Applications and Biologics License Applications From 2010 Through 2019. JAMA Netw Open. 2022 Oct 3; 5(10): e2236149. doi:10.1001/jamanetworkopen.2022.36149
- Hanvey GA, Johnson H, Cartagena G, Dede DE, Krieger JL, Ross KM, Pereira DB. The role of social, economic, and medical marginalization in cancer clinical trial participation inequities: A systematic review. J Clin Transl Sci. 2024 Dec 20; 9(1): e25. doi:10.1017/cts.2024.677
- Noronha V, Patil V, Menon N, et al. Under-representation of older Indian persons with cancer in clinical trials. BMJ Oncol. 2024 Aug 12; 3(1):e000445. doi:10.1136/bmjonc-2024-000445
- Tack L, Lefebvre T, Lycke M, et al. Underrepresentation of vulnerable older patients with cancer in phase II and III oncology registration trials: A case-control study. J Geriatr Oncol. 2020 Mar; 11(2): 320-326.doi:10.1016/j.jgo.2019.09.003
- Barrichello APC, Elkrief A, Ricciuti B, et al. Tumor Immunophenotypic Correlates in Patients Aged 80 Years or Older With Non-Small Cell Lung Cancer and Outcomes to First-Line Pembrolizumab in PD-L1 High (≥50%) Patients. Clin Lung Cancer. 2025 Feb 4: S1525-7304(25)00025-7. doi:10.1016/j.cllc.2025.01.014
- Bonotto M, De Pieri G, Esposto R, et al. Antibody-drug conjugates in elderly patients with breast cancer. Breast. 2025 Feb 23; 80: 104428. doi:10.1016/j.breast.2025.104428
- Lichtman SM. Missed Opportunities in Geriatric Oncology Research. Oncologist. 2023 May 8; 28(5): 373-375. DOI:10.1093/oncolo/oyad072
- Muñoz Vendrell A, López Bravo A, Layos Romero A, et al; junior Headache Group of the Spanish Society of Neurology (jGECSEN). Effectiveness and safety of anti-CGRP monoclonal antibodies for migraine in patients over 65 years: a systematic review. Pain Manag. 2025 Mar; 15(3): 161-171. Doi:10.1080/17581869.2025.2470615
- Kłosowska D, Fiszer U, Dulski J, et al. Exclusion of older patients from randomized clinical trials in Parkinson’s disease. Geroscience. 2024 Aug; 46(4): 3819-3830. DOI: 10.1007/s11357-024-01104-4
- Vitale C, Fini M, Spoletini I, et al. Under-representation of elderly and women in clinical trials. Int J Cardiol. 2017 Apr 1; 232: 216-221. doi:10.1016/j.ijcard.2017.01.018
- Al Said S, O’Donoghue ML, Ran X, et al. Long-Term Lipid Lowering With Evolocumab in Older Individuals. J Am Coll Cardiol. 2025 Feb 11; 85(5): 504-512. doi:10.1016/j.jacc.2024.11.019
- Instituto Nacional de Estadística (INE). Esperanza de vida. https://www.ine.es/ss/Satellite?blobcol=urldata&blobheader=Unknown+format&blobheadername1=Content-Disposition&blobheadervalue1=attachment%3B+filename%3DD1T4.xlsx&blobkey=urldata&blobtable=MungoBlobs&blobwhere=538%2F955%2FD1T4.xlsx&ssbinary=true
- Sociedad Española de Geriatría y Gerontología. Guía de buena práctica clínica en geriatría. Farmacología y Envejecimiento. Los medicamentos en las personas mayores. https://www.segg.es/media/descargas/GBPCG_Farmacologia.pdf
- International Longevity Centre. Trial and error. Supporting age diversity in clinical trials. 2023 https://ilcuk.org.uk/wp-content/uploads/2023/04/ILC-Trial-and-Error-Report-Final-Version.pdf
- Fernández Nin AE, García Agustín D, Stable García Y, et al. Retos de los ensayos clínicos en el adulto mayor. Rev. CENIC Cienc. Biol [Internet]. 2023; 54: 37-43. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S2221-24502023000100037&lng=es.
- Comunidad de Madrid. La Comunidad de Madrid lidera un proyecto europeo para mejorar la inclusión de poblaciones infrarrepresentadas en los ensayos clínicos. https://www.comunidad.madrid/noticias/2025/01/16/comunidad-madrid-lidera-proyecto-europeo-mejorar-inclusion-poblaciones-infrarrepresentadas-ensayos-clinicos (16 de enero de 2025). El promotor es una empresa farmacéutica, aunque también una parte muy significativa (35,7%) está promovida por hospitales y clínicas.