El interés farmacológico de los líquenes radica en su capacidad para producir metabolitos secundarios bioactivos, siendo la mayoría de estos metabolitos, compuestos fenólicos con grupos hidroxilo reactivos que les confieren potencial antioxidante a través de diversos mecanismos. El aumento de la incidencia y el impacto de las enfermedades relacionadas con el estrés oxidativo, entre ellas los trastornos neurodegenerativos, ha fomentado la búsqueda de nuevas estrategias farmacológicas que permitan su control. La información recopilada en esta revisión proviene de investigaciones in vitro, sobre sustratos celulares y en modelos animales que permiten afirmar que los líquenes constituyen, en el campo de los productos naturales, una fuente prometedora de compuestos, muchos de ellos fenólicos, con actividad antioxidante.
Palabras clave: líquenes; farmacología; antioxidante; metabolitos secundarios
ABSTRACT:
The pharmacological interest of lichens lies in their ability to produce bioactive secondary metabolites, being most of them phenolic compounds with reactive hydroxyl groups which confer antioxidant potential through multiple mechanisms. The increasing incidence and impact of oxidative stress-related diseases, including neurodegenerative disorders, has promoted the search of new pharmacological strategies for control purposes. The information compiled in this review comes from in vitro research, on cell substrates and animal models, which allows us to affirm that lichens constitute, in the field of natural products, a promising source of compounds, many of them phenolic, with antioxidant activity.
Keywords: lichens; pharmacology; antioxidant; secondary metabolites
1. INTRODUCCIÓN
Los líquenes son organismos compuestos por un hongo y un alga y/o cianobacteria. No se trata de organismos individuales sino de una simbiosis que funciona en la naturaleza como una unidad, y en la que los tejidos del hongo (micobionte) generalmente rodean al alga y/o la cianobacteria fotosintética (fotobiontes). Se acepta como definición de consenso la facilitada por Hawksworth y Honegger (1), según la cual los líquenes son “ecologically obligate, stable mutualism between an exhabitant fungal partner (the mycobiont) and an inhabitant population of extracellularly located unicellular or filamentous algal and/or cyanobacterial cells (the photobiont)”. Existe, sin embargo, una amplia variabilidad en las relaciones que se establecen entre el hongo y el alga (o cianobacteria), ya que pueden existir dos, tres, cuatro o incluso más simbiontes en el mismo organismo; por ello, ha habido intenso debate en torno a la definición de “líquen”. Además, no están considerados como un grupo taxonómico propio, sino que su taxonomía se basa en la clasificación del componente fúngico dominante o micobionte. Por tanto, y a pesar de que pueden incluir individuos de tres reinos distintos, las simbiosis liquénicas pertenecen, desde un punto de vista filogenético, al reino Fungi.
Entre los usos etnomedicinales de las especies liquénicas, cabe destacar el empleo de Lobaria pulmonaria para el tratamiento de enfermedades respiratorias, y también como cicatrizante y antiséptico; Xanthoria parietina, de color amarillo, se utilizaba para tratar la ictericia; Parmelia sulcata en afecciones craneales; distintas especies de Usnea usadas para fortalecer el cabello y evitar su caída; Peltigera aphthosa se recomendaba como vermífugo y para tratar úlceras (en especial, llagas en la mucosa bucal en los niños) y el líquen islándico (Cetraria islandica), uno de los más utilizados en medicina tradicional, al que se le atribuían propiedades beneficiosas en enfermedades pulmonares, de riñón y vejiga, en inflamación de mucosas o incluso para el tratamiento del cáncer (2). Incluso en los últimos años, se ha incluido en la Farmacopea Europea.
En España, la medicina tradicional recoge el empleo de Pseudevernia furfuracea para el tratamiento de enfermedades respiratorias y de Ramalina bourgeana con fines diuréticos.
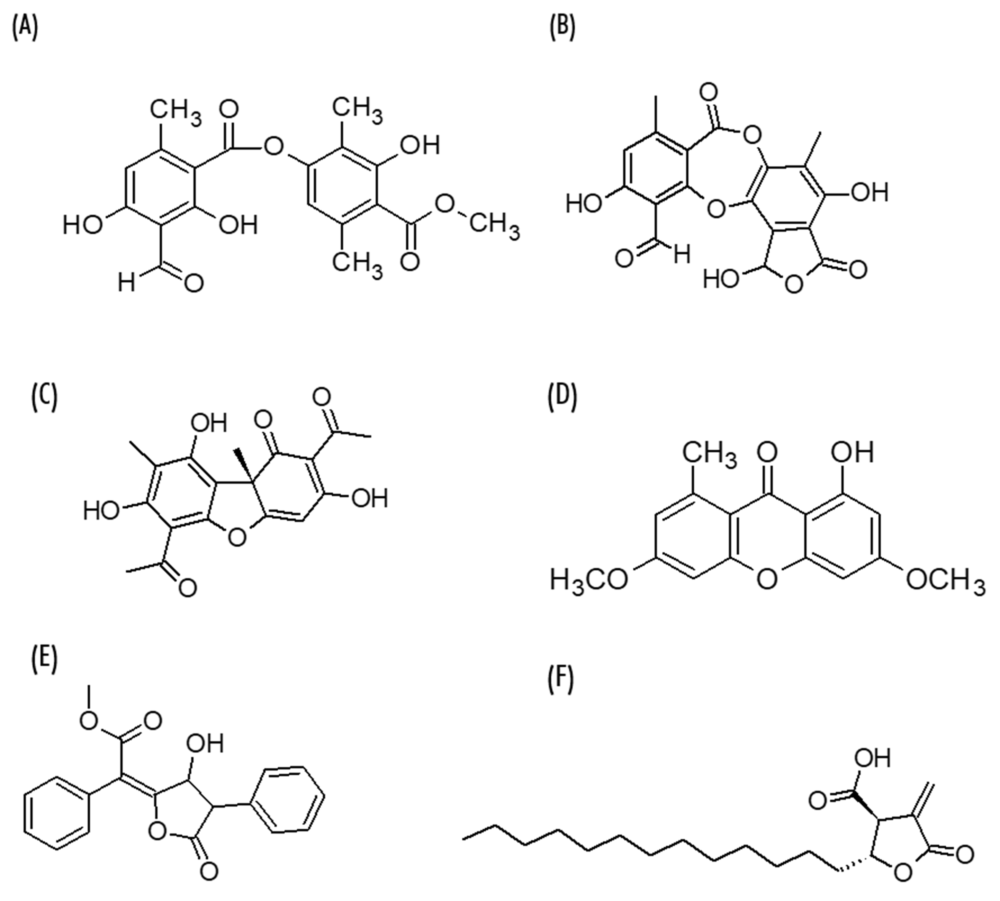
Al tratarse de una asociación de dos organismos diferentes (alga y hongo, ya mencionados), los líquenes presentan una composición química particular y compleja, puesto que ambos organismos en asociación tienen diferentes componentes. Se han identificado más de 1050 compuestos procedentes de líquenes, habiéndose clasificado, de forma general los metabolitos liquénicos en tres grandes grupos: compuestos alifáticos, compuestos aromáticos y carbohidratos o polisacáridos. Más recientemente, se han propuesto clasificaciones basadas en sus estructuras químicas, clasificando así los principales metabolitos secundarios en: Compuestos fenólicos monocíclicos (derivados del orcinol/ácido orselínico y b-orcinol), Depsidas (atranorina, ácido barbático, entre otros), Depsidonas (ácido protocetrárico o ácido salazínico), Dibenzofuranos (ácido úsnico), Quinonas (parietina, liquexantona), Derivados del ácido pulvínico (ácido vulpínico) y Ácidos alifáticos o lactonas, como el ácido protoliquesterínico (Figura 1). Además, se ha detectado la presencia de compuestos como ésteres de escabrosina, derivados de aminoácidos, xantona-glucósidos y algunos carotenoides y terpenoides.
Figura 1. Estructuras de metabolitos secundarios de líquenes: (A) atranorina, (B) ácido salazínico, (C) (+)-ácido úsnico, (D) liquexantona, (E) ácido vulpínico y (F) ácido proto-liquesterínico.
La importancia farmacológica de los líquenes radica en su capacidad para producir estos metabolitos secundarios, muchos de los cuales solo aparecen en estos hongos liquenizados. Entre ellos, los compuestos fenólicos anteriormente citados son los metabolitos secundarios más relevantes, además de ser los metabolitos mejor estudiados. En la Figura 1 se muestran las estructuras químicas de algunos de los compuestos más representativos de los grupos anteriormente mencionados.
Tanto los compuestos liquénicos como los extractos que los contienen, han demostrado un amplio rango de actividades biológicas con interés farmacológico, entre ellas, las más estudiadas incluyen: antibacteriana, antifúngica, antiviral, anti-inflamatoria, analgésica/antipirética, actividad inhibitoria de enzimas y efectos antiproliferativos y citotóxicos (3). El estudio sistemático de las propiedades farmacológicas, tanto de los extractos como de los componentes liquénicos, ha comenzado recientemente, siendo los resultados obtenidos hasta el momento de gran interés, lo que ha hecho aumentar este campo de investigación. Los géneros mejor estudiados desde el punto de vista farmacológico son Parmelia y Usnea. Si nos referimos a especies, las de mayor interés hasta el momento son Cetraria islandica, Hypogymnia physodes, Evernia prunastri y Pseudevernia furfuracea por ser aquellas con las que se han realizado un mayor número de estudios (4) (Figura 2).
Figura 2. Especímenes representativos de las especies Evernia prunastri (A), y Vulpicida canadensis (B).
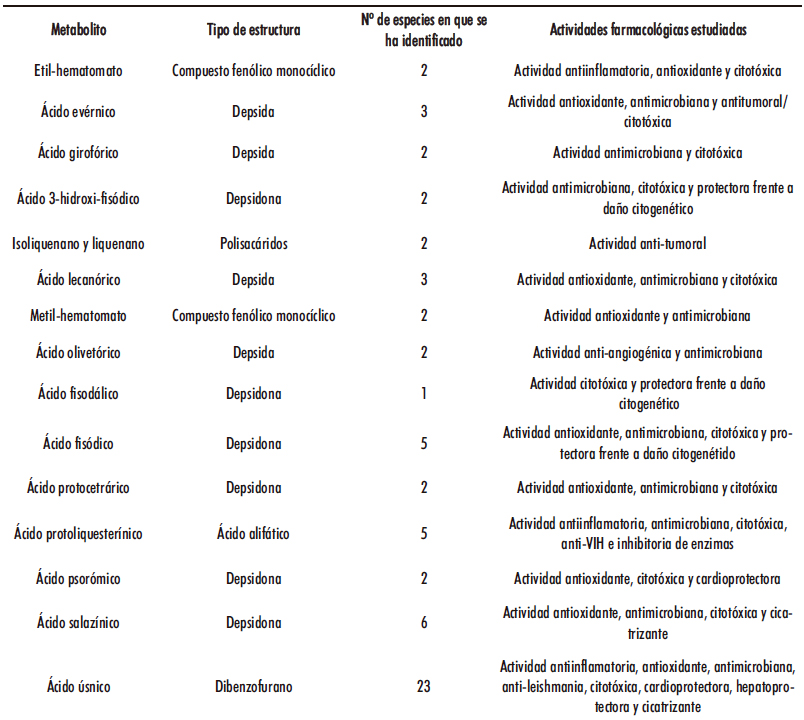
En la Tabla 1 se recogen los principales metabolitos identificados en líquenes parmeliáceos de los que se ha estudiado alguna actividad farmacológica.
En los últimos años, se ha observado un incremento en el interés por la búsqueda de nuevos productos naturales que puedan ser activos en la prevención y el tratamiento de diversas enfermedades, con especial atención a las enfermedades neurodegenerativas y, por lo tanto, en encontrar compuestos con potencial neuroprotector basado en su capacidad para contrarrestar el estrés oxidativo (5). La capacidad antioxidante de los líquenes y sus metabolitos bioactivos es la propiedad que más directamente se relaciona con el potencial neuroprotector de los productos naturales. La naturaleza polifenólica de un gran número de metabolitos secundarios presentes en los líquenes sugiere que pueden ejercer efectos antioxidantes frente a especies reactivas de oxígeno y/o nitrógeno, habiéndose sugerido en diversas revisiones científicas que los líquenes son una fuente interesante de productos naturales con capacidades antioxidantes (6,7).
El objetivo marcado en este artículo de revisión ha sido recopilar la información publicada sobre las propiedades antioxidantes de los líquenes y sus metabolitos secundarios aislados a fin de aportar nuevos conocimientos con el fin de facilitar y orientar futuras investigaciones sobre estos productos naturales.
2. ESTRÉS OXIDATIVO
El término “estrés oxidativo” (EO) hace referencia a un desequilibrio entre la producción de especies reactivas (ER) y las defensas antioxidantes a nivel celular (8). Hace ya casi cuatro décadas, Sies lo definía como una “alteración en el balance pro-oxidante/antioxidante a favor del primero, que lleva a un potencial daño” (9).
Los radicales libres, incluidas las especies reactivas del oxígeno, como el radical hidroxilo, el anión superóxido, el peróxido de hidrógeno y las especies reactivas del nitrógeno, como el óxido nítrico, desempeñan, en condiciones fisiológicas, funciones importantes en muchos procesos celulares; sin embargo, también están asociados con procesos patológicos y de daño celular. El estrés oxidativo se define como un desequilibrio entre los procesos bioquímicos que conducen a la producción de especies reactivas de oxígeno (ROS) y los responsables de su eliminación, los denominados antioxidantes. En la situación de estrés oxidativo, los radicales libres podrán causar daño a los ácidos nucleicos y las proteínas, así como los ácidos grasos insaturados de la membrana celular (10, 11).
En condiciones fisiológicas, las células del organismo se encuentran protegidas frente al daño derivado del estrés oxidativo por los sistemas de defensa, entre los que se incluyen sistemas enzimáticos y no enzimáticos, los cuales actúan a través de diversos mecanismos, como son la capacidad de captación y posterior degradación de las ERO, la prevención de la generación de ERO, la captación de iones metálicos que catalizan reacciones que involucran a las ERO, y capacidad para potenciar la actividad y activar la expresión de enzimas antioxidantes. Así pues, los agentes antioxidantes inhiben y previenen aquellas ROS que pueden causar enfermedades degenerativas. Cabe recordar que muchos antioxidantes sintéticos han generado efectos tóxicos y/o mutagénicos (12,13), por lo que la búsqueda de antioxidantes naturales es un campo de investigación científica de interés. En las últimas décadas, diversos estudios han puesto de manifiesto las capacidades antioxidantes de numerosos compuestos naturales en modelos in vitro e in vivo de patologías relacionadas con el estrés oxidativo, incluyendo las enfermedades neurodegenerativas. Sobresalen, entre ellos, los compuestos polifenólicos, tanto por su diversidad de estructuras existentes como por sus efectos. Entre estos compuestos destacan los flavonoides y otros compuestos fenólicos como los derivados hidroxicinámicos, las catequinas, las teaflavinas, las curcuminas y los terpenoides (14). En su mayoría son compuestos fenólicos que contienen grupos hidroxilo que pueden reaccionar fácilmente, basándose sus propiedades antioxidantes en su capacidad para capturar ROS, quelar iones metálicos como el hierro y el cobre, estabilizar electrones desapareados y modular los sistemas de defensa antioxidantes endógenos enzimáticos y no enzimáticos.
En las últimas décadas, se ha descrito la implicación del estrés oxidativo en numerosas patologías, entre las que se encuentran la diabetes, las enfermedades cardiovasculares y el cáncer.
Actualmente, existe un amplio consenso científico, basado en sólidas investigaciones, sobre la implicación del estrés oxidativo en las enfermedades neurodegenerativas asociadas a la edad como las enfermedades de Alzheimer, Parkinson y Huntington o la esclerosis lateral amiotrófica, entre otras.
En este sentido, la estrategia más común desarrollada hasta la fecha para combatir los elevados niveles de ERO en neuronas ha sido el estudio de compuestos antioxidantes, cuyo aporte exógeno permita combatir el EO por los diversos mecanismos antioxidantes anteriormente mencionados: captación directa de ERO, quelación de iones metálicos, potenciación de la actividad de enzimas antioxidantes e inhibición de enzimas pro-oxidantes como NOS y mieloperoxidasa, entre otros.
Como ya se ha comentado anteriormente, en las últimas décadas, ha cobrado especial relevancia la investigación de los productos naturales con propiedades antioxidantes, motivado en parte por cuestiones de seguridad y toxicidad de los antioxidantes sintéticos., con el objetivo de lograr moléculas que permitan intervenir en la etiología o progresión de la enfermedad a través del uso individual o combinado de moléculas capaces de mejorar los procesos de defensa antioxidante enzimáticos y no enzimáticos endógenos (11). Así pues, resulta de gran interés la investigación del potencial antioxidante de los líquenes, y, más concretamente, de sus metabolitos secundarios como estrategia futura para la prevención o el tratamiento de diversas enfermedades relacionadas con el estrés oxidativo. Los mecanismos y vías detalladas involucrados en la actividad antioxidante de los líquenes se encuentran en investigación y su conocimiento ayudará a comprender la farmacología de estos metabolitos secundarios y sus posibilidades en el tratamiento de los trastornos neurodegenerativos, promoviendo así el desarrollo de productos naturales neuroprotectores.
3. PROPIEDADES ANTIOXIDANTES DE LOS LÍQUENES
Diversos extractos de líquenes y metabolitos secundarios han sido estudiados por sus propiedades antioxidantes debido a su contenido fenólico; por ejemplo, se han demostrado las actividades antioxidantes de algunos depsidos y depsidonas aisladas de varias especies de líquenes (15,16), así como las propiedades in vitro de algunos extractos de líquenes. Además, se han realizado también estudios centrados en la modulación de ROS intracelulares por metabolitos/extractos de liquen y sus efectos in vivo. La tabla 2 recoge la actividad antioxidante observada mediante ensayos in vitro de algunos líquenes parmeliáceos y sus metabolitos aislados.
Tabla 2. Estudios en cultivos celulares in vitro sobre propiedades antioxidantes de líquenes
Respecto a los metabolitos secundarios, son muy recientes las primeras aproximaciones a su potencial efecto neuroprotector a nivel del sistema nervioso central. El estudio realizado por de Paz et al. (15) demostró que ciertos poliquétidos, como los ácidos estíctico, salazínico y úsnico, presentan un interesante efecto antioxidante, aumentando la viabilidad celular. Del mismo modo, la depsida atranorina demostró un efecto citoprotector frente al estrés oxidativo.
Luo y colaboradores (17) abordaron por primera vez la búsqueda en líquenes de metabolitos secundarios con aplicación terapéutica frente a la enfermedad de Alzheimer. Para ello realizaron un screening de bioactividad en 109 extractos liquénicos, identificaron en un extracto de Cladonia macilenta la biruloquinona (previamente aislado en Parmelia birulae, de Parmeliaceae), este compuesto actúa como un potente inhibidor de acetilcolinesterasa y demostró un interesante efecto citoprotector en un modelo neuronal frente a la toxicidad ejercida por el péptido Ab25-35 y frente a estrés oxidativo, sugiriendo actividad como un agente multi-funcional. En esta línea, nuestro grupo ha publicado resultados interesantes para varios líquenes parmeliáceos frente al estrés oxidativo en modelos celulares de SNC (se incluyen Cetraria islandica, Vulpicida canadensis, Cetrelia braunsiana, Parmotrema saccatilobum y Usnea ghattensis), así como la identificación de sus principales compuestos bioactivos. Por último, se ha demostrado el potencial de los metabolitos liquénicos en el SNC, al revelar las propiedades neuroactivas de atranorina, ácido perlatórico y ácido fisódico; estos poliquétidos ejercen propiedades neurotróficas, neurogénicas e inibitorias de acetilcolinesterasa in vitro y ex vivo (18, 19).
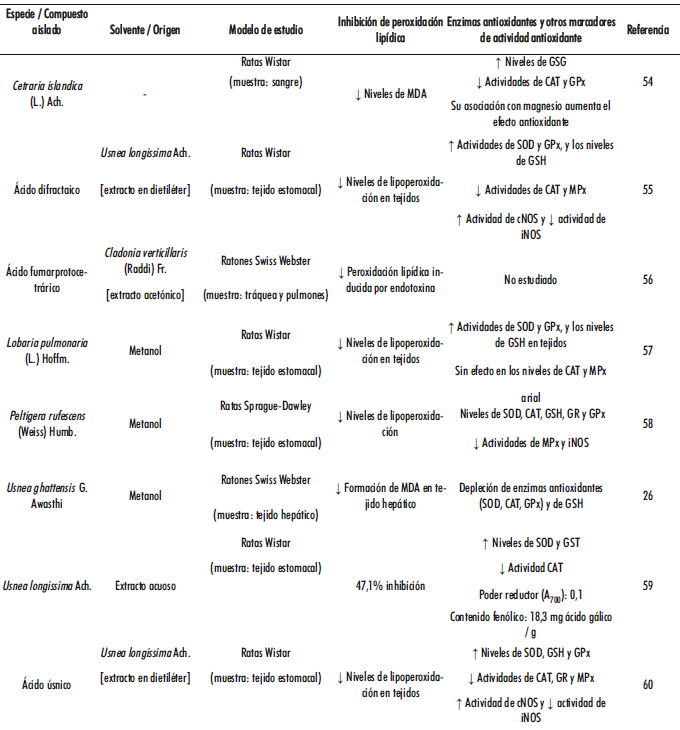
En Tabla 3 se recogen los studios in vivo que evalúan parámetros sobre propiedades antioxidantes de líquenes En general, la actividad antioxidante se ha evaluado principalmente en función de algunos ensayos químicos, como la Inhibición de peroxidación lipídica y la actividad de enzimas antioxidantes y otros marcadores de actividad antioxidante. El metanol resultó ser uno de los solventes más utilizados para la extracción eficiente de los compuestos bioactivos a partir de los líquenes con actividades antioxidantes, por lo que se han realizado muchos ensayos de actividad antioxidante a partir de extractos metanólicos (20, 7).
Tabla 3. Estudios in vivo que evalúan parámetros sobre propiedades antioxidantes de líquenes
Además de todas las especies y ensayos que se muestran en las tablas, algunos autores han medido parámetros similares por otros métodos, como por ejemplo otras propiedades de captación de radicales y también diferentes parámetros relacionados con el potencial antioxidante de los líquenes y compuestos antes mencionados. Con respecto a otras propiedades de captación de radicales, (21) evaluaron la actividad captadora de radicales hidroxilo de los metabolitos de b-orcinol del liquen Hypotrachyna revoluta (Flörke) Hale (Parmeliaceae). La actividad de captación de radicales también se ha medido en Toninia candida (Weber) Th.Fr. (Ramalinaceae) (22), Usnea ghattensis G. Awasthi (Parmeliaceae) (23), y Umbilicaria cylindrica (L.) Delise ex Duby (Umbilicariaceae) (24). La actividad de captación de radicales de óxido nítrico se analizó en Usnea complanata (Müll. Arg.), Motyka (Parmeliaceae) (25), Usnea ghattensis (26), ácidos psorómico y úsnico (25), y en otros 14 metabolitos purificados por líquenes (27). Además, se estudió la capacidad para eliminar el peróxido de hidrógeno en Parmelia saxatilis (28) y la capacidad antioxidante equivalente de Trolox se ha determinado mediante el ensayo de radicales ABTS en varias especies de líquenes polares (29), así como en Usnea ghattensis (23), Laurera benguelensis Zahlbr. (Zahlbr.).
Behera et al. (30, 31) evaluaron la capacidad inhibidora de la xantin oxidasa en especies de la familia Graphidaceae; la actividad quelante de iones hierro se ha investigado en Umbilicaria cylindrica (24) y Toninia candida (22), mientras que la actividad inhibidora de tirosin kinasa ha sido estudiada en algunos líquenes y compuestos aislados (32, 33).
Finalmente, es destacable el trabajo realizado por Lopes et al. (34), en el que se ensayaron las propiedades captadoras de radicales de numerosos derivados semisintéticos del ácido lecanórico obtenido de un espécimen de Parmotrema tinctorum (Delise ex Nyl.) Hale (Parmeliaceae). Se obtuvieron tres compuestos activos en la eliminación del radical DPPH, el ácido orselínico, el orcinol y el resorcinol, mientras que el orsellinato de metilo mostró la actividad más baja.
4. CONCLUSIONES
Los estudios de las actividades antioxidantes de líquenes son de inicio muy reciente. Los ensayos in vitro realizados como primera aproximación han mostrado resultados muy interesantes en muchas de las especies estudiadas. Se recogen también en esta revisión los datos disponibles sobre las actividades antioxidantes in vitro de algunas especies de líquenes y de metabolitos aislados en sustratos celulares e in vivo en modelos animales.
Un mayor conocimiento de este potencial implica una investigación más profunda sobre sus actividades para comprender los mecanismos implicados. En relación con las propiedades antioxidantes, los compuestos más interesantes son los polifenoles. Las propiedades antioxidantes de los polifenoles se deben a la presencia de sus muchos grupos hidroxilo fenólicos, que les confieren una alta capacidad para captar radicales libres (35, 36). Por ejemplo, los compuestos fenólicos pueden donar hidrógeno a los radicales reactivos e inhibir la cadena de las reacciones de oxidación de los lípidos desde su inicio (37).
Así pues, la importante actividad antioxidante mostrada por algunos extractos de líquenes o sus metabolitos aislados, evaluada por diferentes métodos, se puede atribuir a su alto contenido en polifenoles totales (especialmente representados por depsidos, depsidonas y dibenzofuranos, entre otros), habiéndose demostrado una correlación positiva entre la composición fenólica y la capacidad antioxidante para la mayoría de ellos (20, 24); ello sugiere que los constituyentes polifenólicos podrían ser los principales responsables de la actividad antioxidante observada en los líquenes estudiados. No obstante, es necesario destacar que existen otros estudios en los que los resultados no mostraron ninguna correlación positiva entre la actividad antioxidante de algunos líquenes y el contenido fenólico total (38,39). Este hecho implica que no deben ignorarse otros compuestos minoritarios, no fenólicos, presentes en los extractos liquénicos y que la actividad antioxidante también podría atribuirse a la presencia de estos compuestos no fenólicos, a interacciones antagónicas o sinérgicas entre los diversos constituyentes e incluso a las distintas actividades antioxidantes de compuestos fenólicos individuales (40,41).
Como hemos comentado, existe una gran diversidad de líquenes con composiciones químicas más o menos complejas, de forma que el creciente interés por el estudio de sus propiedades farmacológicas está impulsando más estudios filogenéticos en un contexto evolutivo. Basados principalmente en datos moleculares, están conduciendo a una clasificación más compleja de familias y especies de líquenes (42, 43). Además, el análisis filogenético de genes biosintéticos puede facilitar el descubrimiento de nuevos compuestos, nuevos genes y, por lo tanto, productores desconocidos de compuestos con actividad farmacológica relevantes, incluidos los antioxidantes: uno de los mayores desafíos lo constituye el encontrar el gen biosintético de interés en la biosíntesis de los metabolitos activos o asignar una función a cada uno de los genes biosintéticos que se encuentran en el genoma de un liquen (44). Teniendo en cuenta las dificultades que se siguen encontrando para el cultivo in vitro de líquenes debido a la producción de diferentes cantidades y tipos de metabolitos secundarios en función de las características del cultivo (45), el abordaje de un enfoque global de las características metabolómicas de los líquenes es crucial para el desarrollo de procesos biotecnológicos novedosos y viables que permitan la producción de cantidades adecuadas de compuestos antioxidantes únicos aislados de líquenes (46).
Podemos concluir, por tanto, que los líquenes son una fuente potencial de antioxidantes naturales siendo aún necesarias investigaciones más profundas para establecer sus posibilidades y la mejor comprensión de sus mecanismos de acción. Este objetivo se puede lograr mediante el aislamiento y caracterización de los metabolitos purificados y posteriores estudios tanto in vitro como in vivo que nos permitan identificar objetivos moleculares, compuestos activos y establecer las correlaciones estructura-actividad, todo ello con el objetivo final de su empleo en terapéutica.
5. REFERENCIAS
1. Hawksworth DL, Honegger R. (1994). The lichen thallus: A symbiotic phenotype of nutritionally specialized fungi and its response to gall producers. In: Williams MAJ, ed. Plant Galls. Special vol. 49. Oxford: The Systematics Association, 77–98
2. Illana-Esteban C. Lichens used in traditional medicine. Bol. Soc. Micol. Madrid. 2012; 36: 163-174.
3. Gómez-Serranillos MP, Fernández-Moriano C, González-Burgos E, Divakar PK, Crespo A. Parmeliaceae family: phytochemistry, pharmacological potential and phylogenetic features. RSC Adv. 2014; 4: 59017-59047.
4. Sánchez M, Ureña-Vacas I, González-Burgos E, Divakar PK, Gómez-Serranillos MP. The Genus Cetraria s. str.-A Review of Its Botany, Phytochemistry, Traditional Uses and Pharmacology. Molecules. 2022; 27(15):4990.
5. Wang JY, Yang JY, Wang F, et al. Neuroprotective effect of pseudoginsenoside-f11 on a rat model of Parkinson’s disease induced by 6-hydroxydopamine. Evid Based Complement Alternat Med. 2013:152798.
6. Boustie J, Grube M. Lichens: A promising source of bioactive secondary metabolites. Plant Genet Resour. 2005; 3:273–87.
7. Zambare VP, Christopher LP. Biopharmaceutical potential of lichens. Pharm Biol. 2012; 50:778–98.
8. Halliwell B. Oxidative stress and neurodegeneration: where are we now? J Neurochem. 2006; 97(6):1634-58.
9. Cadenas E, Sies H. Oxidative stress: excited oxygen species and enzyme activity. Adv Enzyme Regul. 1985; 23:217-37.
10. Molnár K, Farkas E. Current results on biological activities of lichen secondary metabolites: A review. Z Naturforsch 2010; 65c:157–73.
11. Sayre LM, Perry G, Smith MA. Oxidative stress and neurotoxicity. Chem Ress Toxicol 2008; 21:172–88.
12. Grice HC. Enhanced tumour development by butylated hydroxytoluene (BHT) in the liver, lung and gastro-intestinal tract. Food Chem Toxicol. 1986; 24:1127–30.
13. Wichi, HP. Safety evaluation of butylated hydroxyanisole from the perspective of effects on forestomach and oesophageal squamous epithelium. Food Chem Toxicol. 1988; 26:717–23.
14. Sundararajan R, Ahamad NH, Venkatesan K, et al. Cytisus scoparius link – A natural antioxidant. BMC Complem Altern Med. 2006; 6:8.
15. de Paz G, Raggio J, Gómez-Serranillos MP, Palomino OM, et al. HPLC isolation of antioxidant constituents from Xanthoparmelia spp. J Pharm Biomed Anal. 2010; 53:165–71.
16. Jayaprakasha GK, Rao LJ. Phenolic constituents from the lichen Parmotrema stuppeum (Nyl.) Hale and their antioxidant activity. Z Naturforsch. 2000; 55:1018–22.
17. Luo H, Li C, Kim JC, Liu Y, Jung JS, Koh YJ, Hur JS. Biruloquinone, an acetylcholinesterase inhibitor produced by lichen-forming fungus Cladonia macilenta. J Microbiol Biotechnol. 2013; 23(2):161-6.
18. Fernández-Moriano C, González-Burgos E, Divakar PK, Crespo A, Gómez-Serranillos MP. Evaluation of the Antioxidant Capacities and Cytotoxic Effects of Ten Parmeliaceae Lichen Species. Evid Based Complement Alternat Med. 2016; 2016:3169751.
19. Fernández-Moriano C, Divakar PK, Crespo A, Gómez-Serranillos MP. Protective effects of lichen metabolites evernic and usnic acids against redox impairment-mediated cytotoxicity in central nervous system-like cells. Food Chem Toxicol. 2017; 105:262-277.
20. Kosanić M, Ranković B, Vukojević J. Antioxidant properties of some lichen species. J Food Sci Technol. 2011; 48:584–90.
21. Papadopolou P, Tzakou O, Vagias C, et al. β-Orcinol metabolites from the lichen Hypotrachyna revolute. Molecules. 2007; 12:997–1005.
22. Manojlovic NT, Vasiljevic PJ, Maskovic PZ. Chemical composition and antioxidant activity of lichen Toninia candida. Rev Bras Farmacogn. 2012; 22:291–8.
23. Verma N, Behera BC, Makhija U. Antioxidant and hepatoprotective activity of a lichen Usnea ghattensis in vitro. Appl Biochem Biotechnol. 2008; 151:167–81.
24. Manojlovic NT, Vasiljevic PJ, Maskovic PZ, et al. Chemical composition, antioxidant, and antimicrobial activities of lichen Umbilicaria cylindrica (L.) Delise (Umbilicariaceae). Evid Based Complement Alternat Med. 2012; 2012:452431.
25. Behera BC, Mahadik N, Morey M. Antioxidative and cardiovascular-protective activities of metabolite usnic acid and psoromic acid produced by lichen species Usnea complanata under submerged fermentation. Pharm Biol. 2012; 50:968–79.
26. Verma N, Behera BC, Sonone A, Makhija U. Lipid peroxidation and tyrosinase inhibition by lichen symbionts grown in vitro. African J Biochem Res. 2008; 2:225–31.
27. Thadhani VM, Choudhary MI, Ali S, et al. Antioxidant activity of some lichen metabolites. Nat Prod Res. 2011; 25:1827–37.
28. Özen T, Kinalioglu K. Determination of antioxidant activity of various extracts of Parmelia saxatilis. Biologia. 2008; 63:211–16.
29. Singh SM, Singh P, Ravindra R. Screening of antioxidant potential of Arctic lichens. Polar Biol. 2011; 34:1775–82.
30. Behera BC, Adawadkar B, Makhija U. Inhibitory activity of xanthine oxidase and superoxide-scavenging activity in some taxa of the lichen family Graphidaceae. Phytomedicine. 2003; 10:536–43.
31. Behera BC, Adawadkar B, Makhija U. Tissue-culture of selected species of the Graphis lichen and their biological activities. Fitoterapia. 2006; 77:208–15.
32. Behera BC, Adawadkar B, Makhija U. Tyrosinase-inhibitory activity in some species of the lichen family Graphidaceae. J Herb Pharmacother. 2006; 6:55–69.
33. Paudel B, Bhattarai HD, Koh HY, et al. Ramalin, a novel nontoxic antioxidant compound from the Antarctic lichen Ramalina terebrata. Phytomedicine. 2011; 18:1285–90.
34. Lopes TI, Coelho R, Yoshida N, Honda NK. Radical-scavenging activity of Orsellinates. Chem Pharm Bull. 2008; 56:1551–4.
35. Dai J, Mumper RJ. Plant phenolics: Extraction, analysis and their antioxidant and anticancer properties. Molecules. 2010; 15:7313–52.
36. Sawa T, Nakao M, Akaike T, et al. Alkylperoxyl radical-scavenging activity of various flavonoids and other phenolic compounds: Implications for the anti-tumor-promoter effect of vegetables. J Agric Food Chem. 1999; 47:397–402.
37. Gülçin I, Beydemir S, Alici HA, et al. In vitro antioxidant properties of morphine. Pharmacol Res. 2004; 49:59–66.
38. Odabasoglu F, Aslan A, Cakir A, et al. Comparison of antioxidant activity and phenolic content of three lichen species. Phytother Res. 2004; 18:938–41.
39. Stojanović G, Stojanović I, Stankov-Jovanović V, et al. Reducing power and radical scavenging activity of four Parmeliaceae species. Cent Eur J Biol. 2010; 5:808–13.
40. Fernández-Moriano C, Divakar PK, Crespo A, Gómez-Serranillos MP. Neuroprotective activity and cytotoxic potential of two Parmeliaceae lichens: Identification of active compounds. Phytomedicine. 2015; 22(9):847-55.
41. Ureña-Vacas I, González-Burgos E, Divakar PK, Gómez-Serranillos MP. Lichen Extracts from Cetrarioid Clade Provide Neuroprotection against Hydrogen Peroxide-Induced Oxidative Stress. Molecules. 2022; 27(19):6520.
42. Crespo A, Kauff F, Divakar PK, et al. Phylogenetic generic classification of parmelioid lichens (Parmeliaceae, Ascomycota) based on molecular, morphological and chemical evidence. Taxon. 2010; 59:1735–53.
43. Aoussar N, Laasri FE, Bourhia M, Manoljovic N, Mhand RA, Rhallabi N, Ullah R, Shahat AA, Noman OM, Nasr FA, Almarfadi OM, El Mzibri M, Vasiljević P, Benbacer L, Mellouki F. Phytochemical Analysis, Cytotoxic, Antioxidant, and Antibacterial Activities of Lichens. Evid Based Complement Alternat Med. 2020; 2020:8104538.
44. Schmitt I, Barker FK. Phylogenetic methods in natural product research. Nat Prod Rep. 2009; 26:1585–602.
45. Behera BC, Verma N, Sonone A, Makhija U. Evaluation of antioxidant potential of the cultured mycobiont of a lichen Usnea ghattensis. Phytothet Res. 2005; 19:58–64.
46. Letwin L, Malek L, Suntres Z, Christopher L. Cytotoxic and Antibiotic Potential of Secondary Metabolites from the Lichen Umbilicaria muhlenbergii. Curr Pharm Biotechnol. 2020; 21(14):1516-1527.
47. Adenubi OT, Famuyide IM, McGaw LJ, Eloff JN. Lichens: An update on their ethnopharmacological uses and potential as sources of drug leads. J Ethnopharmacol. 2022; 298:115657.
48 Melo MG, dos Santos JP, Serafini MR, Caregnato FF, Pasquali MA, Rabelo TK, da Rocha RF, Quintans L Jr, Araújo AA, da Silva FA, Moreira JC, Gelain DP. Redox properties and cytoprotective actions of atranorin, a lichen secondary metabolite. Toxicol In Vitro. 2011; 25(2):462-8.
49. Kotan E, Alpsoy L, Anar M, Aslan A, Agar G. Protective role of methanol extract of Cetraria islandica (L.) against oxidative stress and genotoxic effects of AFB₁ in human lymphocytes in vitro. Toxicol Ind Health. 2011; 27(7):599-605.
50. Brisdelli F, Perilli M, Sellitri D, Piovano M, Garbarino JA, Nicoletti M, Bozzi A, Amicosante G, Celenza G. Cytotoxic activity and antioxidant capacity of purified lichen metabolites: an in vitro study. Phytother Res. 2013; 27(3):431-7.
51. Alpsoy L, Orhan F, Nardemir G, et al. Antigenotoxic potencies of a lichen species, Evernia prunastri. Toxicol Ind Health 2015; 31:153–61.
52. Rabelo TK, Zeidán-Chuliá F, Vasques L, et al. Redox characterization of usnic acid and its cytotoxic effect on human neuron-like cells (SH-SY5Y). Toxicol In Vitro. 2012; 26:304–14.
53. Turkez H, Aydin E, Aslan A. Xanthoria elegans (Link) (lichen) extract counteracts DNA damage and oxidative stress of mitomycin C in human lymphocytes. Cytotechnology. 2011; 64:679–86.
54. Cernescu I, Tarţău L, Macavei A, Lupuşoru CE. Cercetări experimentale privind efectele unui extract din Cetraria islandica asupra stresului oxidativ la animale de laborator [Experimental research on the effects of a Cetraria islandica extract on oxidative stress in laboratory animals]. Rev Med Chir Soc Med Nat Iasi. 2011; 115(3):899-904.
55. Bayir Y, Odabasoglu F, Cakir A, Aslan A, Suleyman H, Halici M, Kazaz C. The inhibition of gastric mucosal lesion, oxidative stress and neutrophil-infiltration in rats by the lichen constituent diffractaic acid. Phytomedicine. 2006; 13(8):584-90.
56. de Barros Alves GM, de Sousa Maia MB, de Souza Franco E, Galvão AM, da Silva TG, Gomes RM, Martins MB, da Silva Falcão EP, de Castro CM, da Silva NH. Expectorant and antioxidant activities of purified fumarprotocetraric acid from Cladonia verticillaris lichen in mice. Pulm Pharmacol Ther. 2014; 27(2):139-43.
57. Karakus B, Odabasoglu F, Cakir A, Halici Z, Bayir Y, Halici M, Aslan A, Suleyman H. The effects of methanol extract of Lobaria pulmonaria, a lichen species, on indometacin-induced gastric mucosal damage, oxidative stress and neutrophil infiltration. Phytother Res. 2009; 23(5):635-9.
58. Tanas S, Odabasoglu F, Halici Z, Cakir A, Aygun H, Aslan A, Suleyman H. Evaluation of anti-inflammatory and antioxidant activities of Peltigera rufescens lichen species in acute and chronic inflammation models. J Nat Med. 2010; 64(1):42-9.
59. Halici M, Odabasoglu F, Suleyman H, Cakir A, Aslan A, Bayir Y. Effects of water extract of Usnea longissima on antioxidant enzyme activity and mucosal damage caused by indomethacin in rats. Phytomedicine. 2005; 12(9):656-62.
60. Odabasoglu F, Cakir A, Suleyman H, Aslan A, Bayir Y, Halici M, Kazaz C. Gastroprotective and antioxidant effects of usnic acid on indomethacin-induced gastric ulcer in rats. J Ethnopharmacol. 2006; 103(1):59-65.