Las enfermedades neurodegenerativas son de origen multifactorial, es decir, su etiología comprende una amplia serie de procesos patológicos interconectados. Como consecuencia, la enfermedad continúa su avance cuando se corrige uno solo de estos procesos de forma aislada, como se hace con las terapias actuales. Existen varias aproximaciones terapéuticas que pueden, en principio, ayudar a superar estas limitaciones y la más reciente y prometedora es la estrategia multidiana, en la que se buscan moléculas diseñadas racionalmente para que sean capaces de modular varias dianas terapéuticas asociadas a una enfermedad. En este artículo de revisión se exponen los fundamentos del diseño de agentes multidiana, que se aclararan mediante ejemplos tomados de la investigación que se lleva a cabo en el grupo del autor. Las principales dianas involucradas en este trabajo son diversas proteínas implicadas en la vía de señalización Nrf2-ARE, proteínas transportadoras de calcio y rho-quinasa 2.
Palabras clave: fármacos multidiana; vía Nrf2-ARE; proteínas transportadoras de calcio; rho-quinasa 2
ABSTRACT:
Neurodegenerative diseases are multifactorial in origin, i.e., their etiology involves a large number of interconnected pathological processes. As a consequence, disease progression cannot be efficiently stopped by modulating a single target, as done with current therapies. Several approaches attempt to overcome this limitation, and the most promising one is based on the use of multitarget drugs. This approach seeks molecules that are rationally designed to modulate several therapeutic targets associated to a particular disease. In this review article, the foundations of the design of multitarget drugs are summarized and illustrated through examples taken from work carried out in the group of the author. The main targets studied are proteins involved in the Nrf2-ARE pathway, calcium transport proteins and rho-kinase 2.
Keywords: multitarget drugs; Nrf2-ARE pathway; calcium transport proteins; rho-kinase 2
1. INTRODUCCIÓN
El diseño de fármacos tradicional busca compuestos de elevada potencia, selectivos hacia una única diana terapéutica. Puede considerarse que se inició con el concepto de la “bala mágica” de Paul Ehrlich, desarrollada en paralelo al concepto de receptor por Langley y el propio Ehrlich. Supone un enfoque reduccionista, en el que se asume que un sistema complejo, como los biológicos, puede reducirse a sus partes elementales sin considerar la complejidad asociada a la integración entre éstas. En esta aproximación, la falta de selectividad, es decir la capacidad de interacción con múltiples dianas, se considera una característica indeseada.
La aproximación “un fármaco, una diana” es, en principio, adecuada para el tratamiento de enfermedades asociadas a alteraciones en un solo gen, pero parece dar malos resultados en el caso de las enfermedades más complejas, de origen multifactorial. Entre ellas figuran las enfermedades neurodegenerativas, cuya etiología comprende una amplia serie de procesos patológicos interconectados. Como consecuencia, la enfermedad continúa su avance cuando se actúa únicamente sobre una diana aislada, como se hace con las terapias convencionales disponibles en la actualidad, ya que los sistemas biológicos son a menudo resistentes a alteraciones en un solo nodo de una red de procesos debido a la existencia de funciones redundantes y mecanismos compensatorios.
Para combatir las enfermedades multifactoriales, existe cada vez mayor interés en aproximaciones terapéuticas basadas en la modulación simultánea de varios mecanismos patológicos a través de estrategias de polifarmacología. La más sencilla consiste en la administración de varias moléculas que actúan de forma independiente en distintas dianas biológicas, y se emplea habitualmente en cáncer, VIH y enfermedades cardiovasculares, entre otras. Sin embargo, esta estrategia tiene varias limitaciones, que se resumen más abajo. Puede diferenciarse entre combinación de medicamentos, en la que los principios activos se administran en medicamentos diferentes, y asociación de fármacos, en la que todos los principios activos se administran simultáneamente en la misma forma farmacéutica.
2. LA ESTRATEGIA MULTIDIANA
2.1. Características de los fármacos multidiana
Para mantener la capacidad de modular simultáneamente varios mecanismos moleculares y reducir los riesgos asociados a la asociación de especies activas, están adquiriendo gran importancia los fármacos multidiana(1) que presentan varias ventajas sobre las asociaciones gracias al hecho de emplear una única molécula:
- Se simplifica la farmacocinética, al no ser necesario sincronizar la actividad de varias especies.
- Se simplifican los estudios toxicológicos y de seguridad.
- Se simplifican los ensayos clínicos.
- Desaparece el riesgo de interacciones entre fármacos.
- Mejora el cumplimiento terapéutico (en comparación con las combinaciones de medicamentos).
- Se evitan incompatibilidades en la fase de formulación farmacéutica (en comparación con las asociaciones de fármacos).
- Aparecen nuevas posibilidades de diseño. Por ejemplo, se puede emplear un fragmento de la molécula para ayudar al transporte de otro.
Por otra parte, los fármacos multidiana tienen también algunas limitaciones:
- La etapa de investigación es más complicada, ya que las moléculas deben verificar requisitos estructurales que permitan la interacción con más de una diana.
- Aparecen requisitos de diseño adicionales como la necesidad de un perfil de actividad equilibrado entre las dianas implicadas, indispensable para que todas ellas puedan ser moduladas a la misma dosis.
- Se pierde la posibilidad de extender la vida de la patente de un fármaco antiguo mediante una nueva combinación.
2.2. Criterios para el diseño de fármacos multidiana
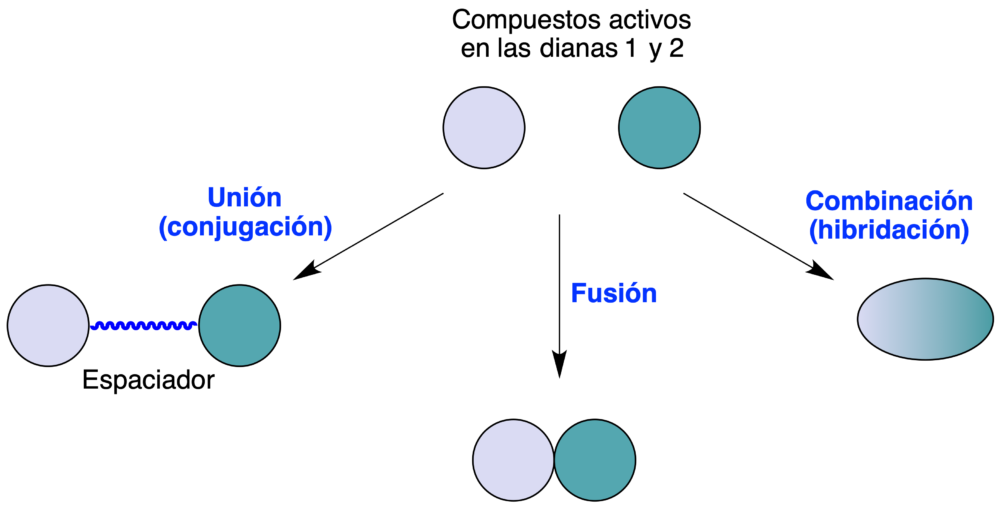
El diseño racional de moléculas multidiana se basa en tres estrategias principales, que se describen como unión (conjugación), fusión y combinación (hibridación), que se esquematizan en la figura 1. La estrategia de unión requiere la presencia de los esqueletos responsables de la interacción con cada diana, así como de grupos funcionales que permitan su conexión por medio de un espaciador. Esta estrategia, en comparación con las otras, ofrece varias ventajas, entre ellas la de hacer más sencillo mantener la funcionalidad de los compuestos originales y por tanto conservar las interacciones con la diana de ambos farmacóforos. Además al no esperarse, en principio, grandes diferencias entre la actividad de los ligandos originales y la del compuesto multidiana, es probable que se necesiten menos ciclos de optimización para llegar al fármaco final. Como aspecto negativo, la unión de farmacóforos mediante un espaciador da lugar generalmente a compuestos de elevado peso molecular, lo que puede afectar negativamente a la biodisponibilidad oral y otras propiedades farmacocinéticas. Las estrategias de combinación y fusión son más adecuadas para mantener el peso molecular dentro de valores más moderados.
Figura 1. Modalidades del diseño de fármacos multidiana
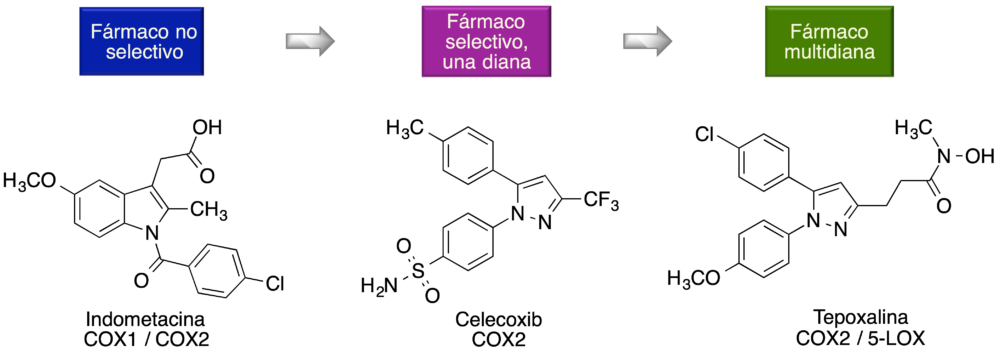
En muchos casos la búsqueda de fármacos multidiana se planifica como una etapa de diseño más avanzada que la búsqueda de selectividad. Puede encontrarse un ejemplo en la figura 2, en la que se muestra la evolución de los inhibidores de ciclooxigenasa desde fármacos no selectivos entre COX1 y COX2, como la indometacina, a fármacos selectivos hacia COX2, como el celecoxib, y desde allí hacia compuestos multidiana, como la tepoxalina, diseñada como un inhibidor selectivo de COX2 capaz, además, de inhibir la lipooxigenasa 5 (2).
Figura 2. Los fármacos multidiana como una etapa de diseño más avanzada respecto a la búsqueda de selectividad
2.3. Criterios para la selección de dianas
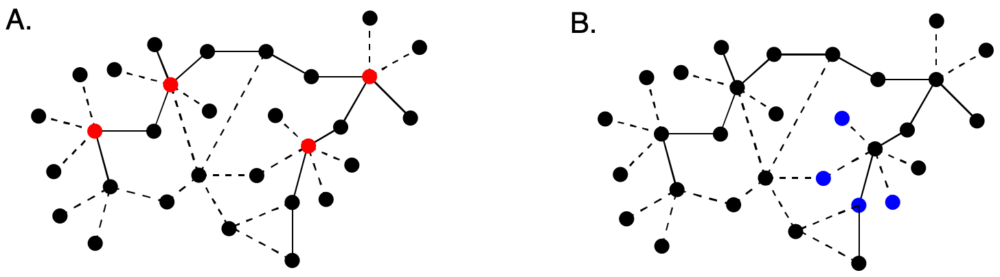
Idealmente, las dianas seleccionadas deben tener la capacidad de modificar la enfermedad, no simplemente sus síntomas. En el caso de los fármacos multidiana, se considera preferible modular proteínas que presenten efectos sinérgicos o aditivos. A la hora de seleccionarlas, debe tenerse presente que el objetivo final no es bloquear o modular proteínas concretas, sino redes de procesos bioquímicos. Algunos de los criterios de selección de dianas con esta finalidad se resumen en la figura 3. Para agentes quimioterápicos, la estrategia adecuada es atacar los nodos de la red (puntos altamente interconectados), debiendo, obviamente, buscarse selectividad entre especies. Para restaurar una red alterada, que es la situación que se encuentra en tratamiento de las enfermedades neurodegenerativas, puede ser mejor estrategia modular varios puntos no cruciales de la red próximos a un nodo, para reducir toxicidad (3).
Figura 3. A. Estrategia multidiana en fármacos quimioterápicos. B. Selección de dianas para restaurar una red alterada de procesos bioquímicos
Algunos de los procesos clave en las enfermedades neurodegenerativas son:
- Estrés oxidativo. Un mecanismo importante en el proceso de neurodegeneración y muerte cerebral está asociado a la generación de especies reactivas derivadas del metabolismo del oxígeno molecular, que es especialmente intenso en el sistema nervioso central. El estrés oxidativo es un factor común conectado a la patogenia de todas las enfermedades neurodegenerativas.
- Neuroinflamación. La microglía constituye el sistema inmune primario del sistema nervioso central y se activa como consecuencia de alteraciones en la homeostasis fisiológica para destruir patógenos y eliminar células dañadas. La neuroinflamación es un estado reactivo de este sistema inmune, mediada por las propias células de glía y también por efectores moleculares solubles procedentes de ellas, como las citoquinas proinflamatorias. La neuroinflamación es crucial en el desarrollo de la enfermedad de Alzheimer (4) y otros procesos neurodegenerativos (5).
- Proteinopatías. Muchas enfermedades neurodegenerativas están asociadas a la formación de agregados de proteínas plegadas anormalmente, que resultan neurotóxicos (6).
- Disfunción mitocondrial. A causa de sus elevados requerimientos energéticos, las neuronas son especialmente vulnerables a daños en sus mitocondrias. De hecho, las principales enfermedades neurodegenerativas están asociadas a disfunciones mitocondriales.
- Alteraciones en ciertas vías de señalización celular.
3. FÁRMACOS MULTIDIANA Y ENFERMEDADES NEURODEGENERATIVAS
3.1. Observaciones generales
El tratamiento de las enfermedades neurodegenerativas es una de las aplicaciones potenciales más interesantes de la estrategia multidiana a causa de su etiología multifactorial, que implica mecanismos moleculares muy complejos. Tomemos como ejemplo la enfermedad de Alzheimer, la enfermedad neurodegenerativa de mayor incidencia y para la que no hay un tratamiento efectivo pese a los enormes esfuerzos realizados hasta la fecha en la investigación en este campo. La gran complejidad de los mecanismos patológicos implicados explica por qué los tratamientos actuales, dirigidos a una única diana, no son capaces de alterar el curso de la enfermedad (7,8). Por este motivo, el interés en el empleo de fármacos multidiana para el tratamiento de la enfermedad de Alzheimer es cada vez mayor y algunos de ellos han alcanzado ya ensayos clínicos (9).
3.2. El carácter multifactorial de las enfermedades neurodegenerativas
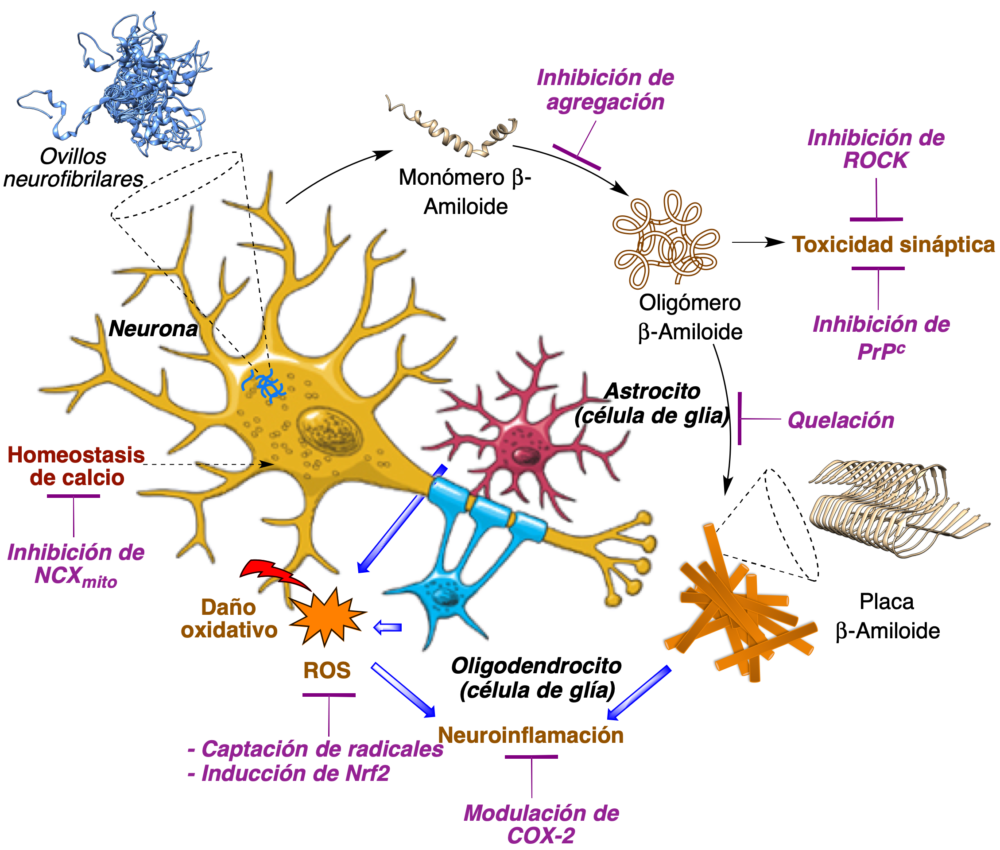
Como ejemplo representativo de la complejidad de la etiología de las enfermedades neurodegenerativas, se resumen en la figura 4 algunas de las dianas terapéuticas potenciales para el tratamiento de la enfermedad de Alzheimer, incluyendo:
- Los procesos de formación de agregados de proteínas, incluyendo los ovillos tau y las placas beta-amiloides (Ab).
- Los mecanismos de toxicidad sináptica.
- Los daños asociados al estrés oxidativo y la neuroinflamación.
- Los procesos de control de la homeostasis del calcio, tantro intraneuronal como intramitocondrial.
Aunque no todas están estudiadas con el mismo nivel de detalle que la enfermedad de Alzheimer, puede afirmarse que las otras enfermedades neurodegenerativas presentan una complejidad etiológica comparable.
Figura 4. Algunas dianas terapéuticas relevantes en la enfermedad de Alzheimer
3.3. La vía Nrf2-ARE como una diana en enfermedades neurodegenerativas
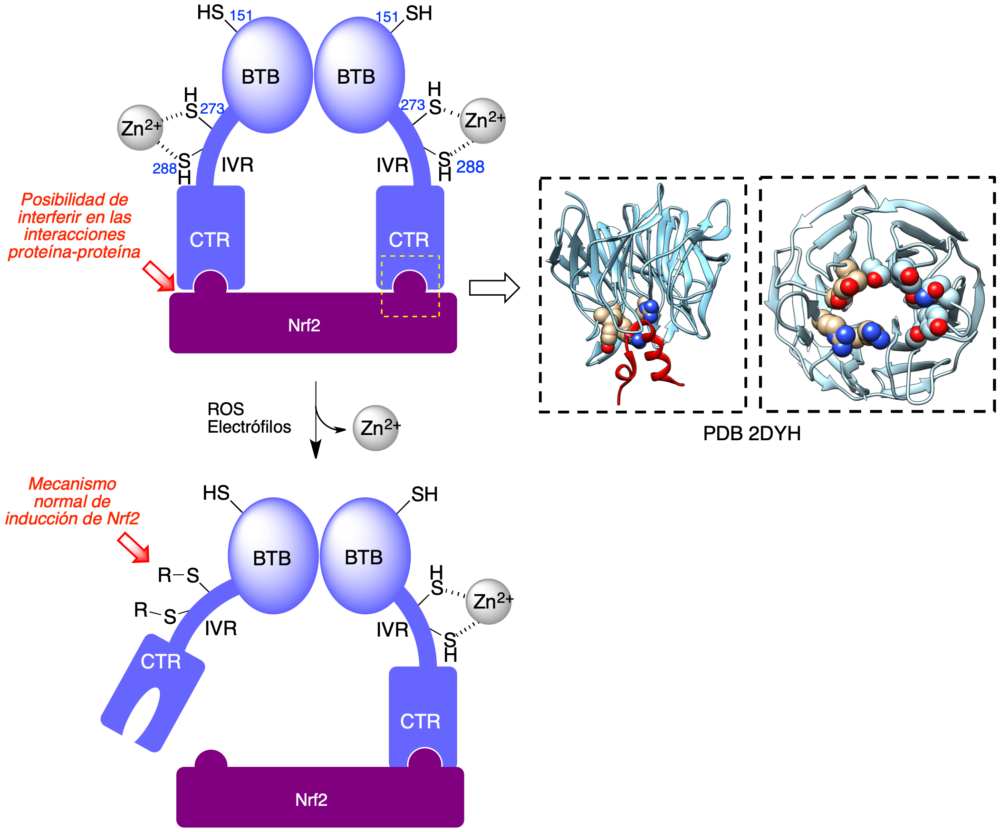
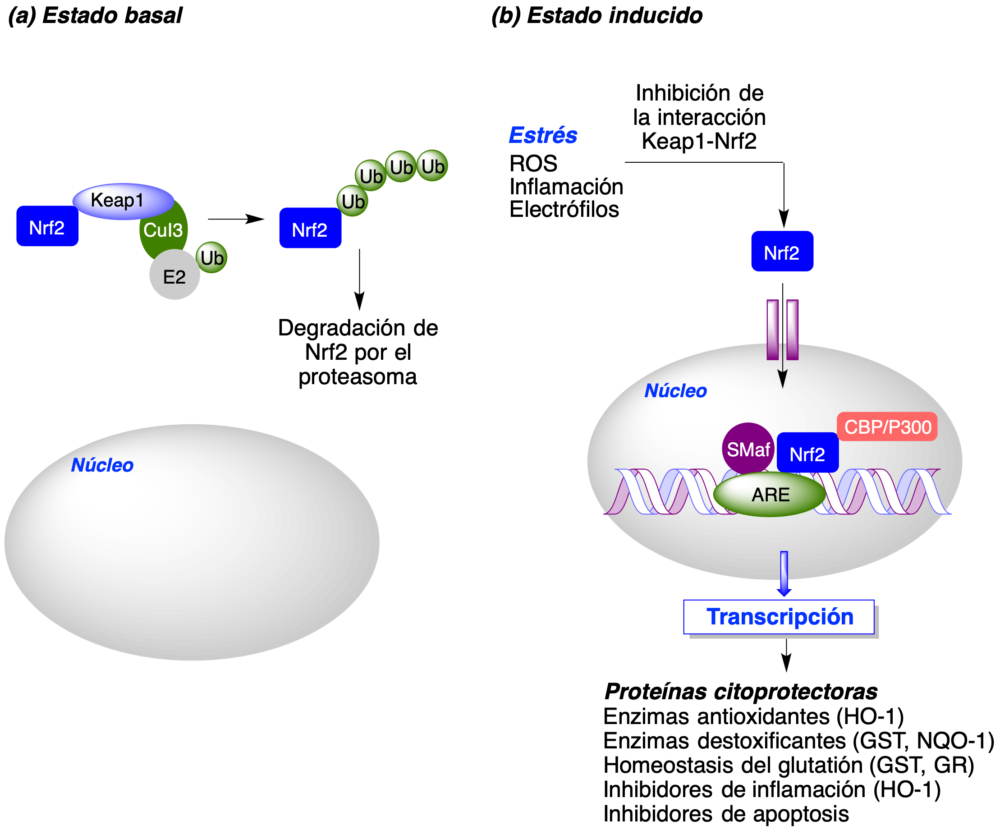
Los antioxidantes pueden actuar por reacción directa con los radicales oxigenados o nitrogenados (captadores de radicales, radical scavengers), pero hay otra posibilidad, que implica la inducción de la vía transcripcional Nrf2-ARE. Esta vía se considera el principal mecanismo de regulación de la respuesta antioxidante a través de la estimulación de la síntesis de enzimas antioxidantes de fase II (10). Nrf2 tiene varios mecanismos de regulación, de los cuales el más conocido es la proteína Keap1, que actúa como su regulador negativo. Keap1 es capaz de secuestrar Nrf2 en el citoplasma, actuando como una ligasa E3 que promueve la ubiquitinación de Nrf2 y por tanto su posterior degradación por el proteosoma. Una forma de lograr la activación de Nrf2 es reducir su afinidad por Keap1, lo cual se puede conseguir por dos mecanismos principales:
- Keap1 contiene una región, compuesta por varios residuos de cisteína, que actúa como sensor de estrés oxidativo o de compuestos potencialmente tóxicos a causa de su electrofilia. Estas cisteínas están normalmente unidas a cationes zinc y se modifican, bien por oxidación a cistina en presencia de especies oxidantes, o bien por alquilación en presencia de electrófilos, lo que produce un cambio conformacional en Keap1 que afecta a la parte de la proteína que se une a Nrf2 y reduce la afinidad de ambas proteínas. Por tanto, puede plantearse lograr la inducción de Nrf2 mediante el empleo de fármacos que contengan un fragmento electrófilo que active este mecanismo de control.
- Alternativamente, puede lograrse el mismo resultado por interferencia directa en la interacción entre Nrf2 y Keap1 (figura 5).
Figura 5. Regulación de Nrf2 por Keap1
Esta disminución de la afinidad entre ambas proteínas implica la posibilidad de que Nrf2 pueda translocarse hasta el núcleo celular donde, previa interacción con ciertas proteínas que actúan como coactivadores, es capaz de reconocer un segmento específico del ADN conocido como elemento de respuesta antioxidante (ARE, antioxidant response element) o elemento de respuesta a eletrófilos (ERE, electrophile response element). Como consecuencia, se induce la expresión de una serie de genes implicados en la respuesta antioxidante a través de la biosíntesis de numerosas proteínas citoprotectoras a través de mecanismos antioxidantes y antiinflamatorios, entre otros (figura 6). Existen mecanismos alternativos de activación de Nrf2, tales como la vía no canónica (11) y mecanismos indirectos basados en la modulación de ciertos receptores de membrana (α7 nicotiníco, melatonina) y la inhibición de la quinasa GSK3β, entre otros.
Figura 6. La vía Nrf2-ARE y su regulación por Keap1
En resumen, la vía Nrf2-ARE es una diana muy prometedora en el tratamiento de las enfermedades neurodegenerativas, aunque está todavía relativamente poco explorada (12).
Sobre estas bases, resumiré a continuación algunos ejemplos de fármacos multidiana orientados al tratamiento de diversas enfermedades neurodegenerativas, representativos de algunos aspectos de la investigación llevada a cabo recientemente en el grupo BIOHET de la Universidad Complutense.
4. COMPUESTOS MULTIDIANA BASADOS EN LA MODULACIÓN DEL CALCIO INTRANEURONAL
Una desregulación de la homeostasis del calcio, asociada a una disfunción mitocondrial, tienen un papel clave en los mecanismos moleculares de la enfermedad de Alzheimer y de otras enfermedades neurodegenerativas (13). Por tanto, compuestos capaces de mantener los niveles de calcio dentro de valores fisiológicos deberían ser efectivos como agentes neuroprotectores.
El control de los niveles de calcio intraneuronales se logra mediante la actuación de una amplia serie de proteínas de transporte cuyo conjunto se ha descrito como calcium signaling toolkit (14,15).
Las mitocondrias desempeñan un papel fundamental en esta regulación, y nosotros fijamos nuestra atención en la inhibición de una proteína conocida como intercambiador mitocondrial sodio/calcio (NCXmito). Aunque esta proteína no se ha estudiado mucho como diana terapéutica, se sabe que su inhibición conduce a efectos neuroprotectores gracias a que se evita el paso de calcio de la mitocondria de las neuronas hacia el citosol, reduciendo por tanto los niveles de calcio en éste. Se conocen pocos inhibidores de NCXmito, principalmente la benzotiazepina CGP-37157 y algunos análogos (16), y se sabe que estos compuestos son neuroprotectores en algunos modelos celulares. Su mecanismo de acción involucra probablemente a otros transportadores de calcio adicionales, como los canales neuronales dependientes de voltaje (17) y el canal conocido como SERCA (Sarcoplasmic Reticulum Calcium ATPase) (18).
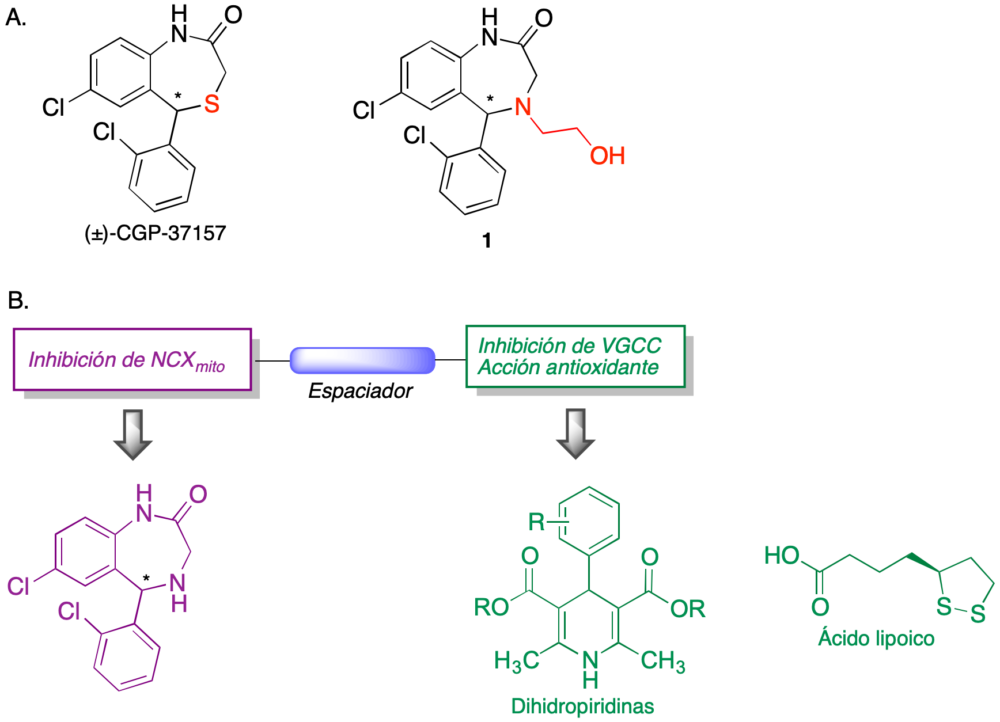
En relación con esta diana, hemos planteado la síntesis y estudio de compuestos multidiana basados en la estructura 1, un isóstero de CGP-37157 que tiene una actividad similar frente a NCXmito y es más adecuado como punto de partida para la obtención de compuestos multidiana ya que la presencia del segundo átomo de nitrógeno permite la fácil incorporación de cadenas espaciadoras (figura 7A). En este contexto, nuestro proyecto implicaba la conexión mediante espaciadores adecuados del aza-análogo de CGP-37157 con otros compuestos de interés como neuroprotectores.
Con esta finalidad, seleccionamos compuestos antioxidantes, como el ácido lipoico, y dihidropiridinas, a causa de su capacidad de inhibir canales de calcio, con el objeto de controlar los niveles de este catión por un segundo mecanismo (figura 7).
Figura 7. Estructuras híbridas diseñadas a partir de CGP-37157
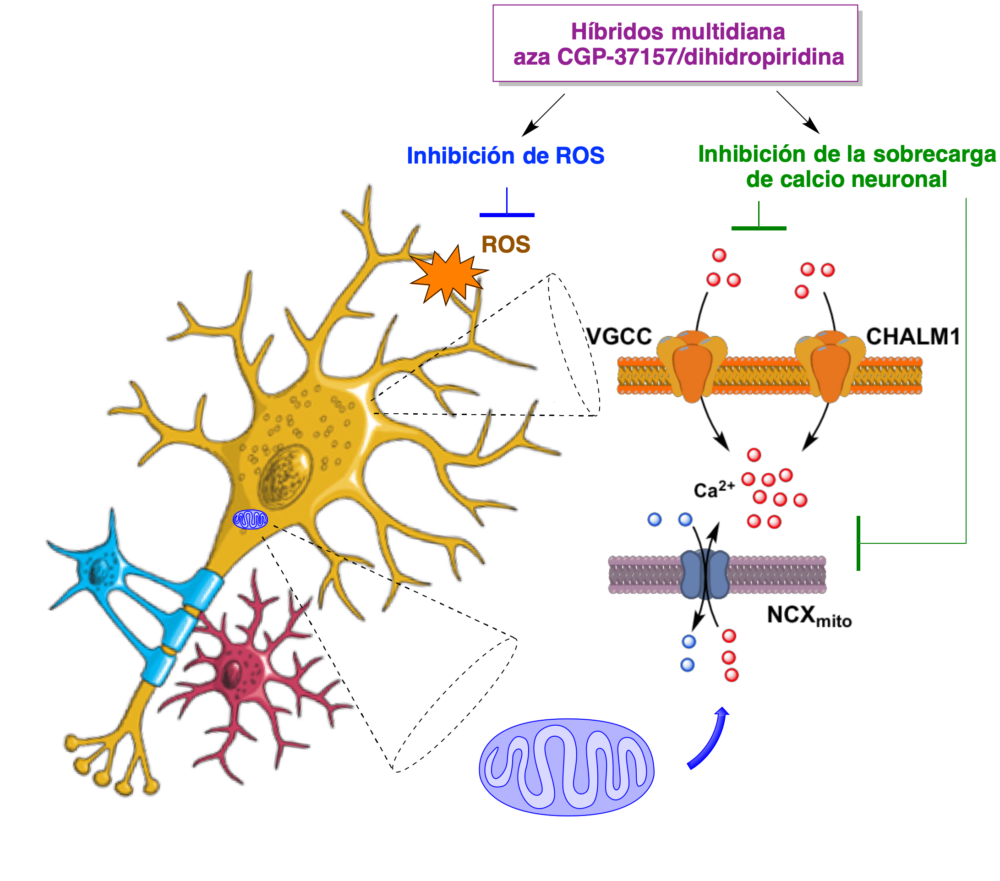
Las dihidropiridinas tradicionales tienen algunos efectos cerebrales beneficiosos, incluyendo la prevención de la pérdida de memoria en ancianos. De hecho, una de ellas, el nilvadipino, ha alcanzado la fase III de ensayos clínicos contra la enfermedad de Alzheimer. El mecanismo de este efecto protector es poco claro, aunque se sabe que estos fármacos son antioxidantes. En nuestro caso, el estudio de las estructuras híbridas derivadas de dihidropiridina se inició con la construcción de una estructura híbrida aza-CGP-37157/nimodipino, para la que se esperaba de entrada el perfil farmacológico multidiana resumido en la figura 8.
Figura 8. Perfil multidiana esperado para los compuestos conjugados aza CGP-37157/nimodipino
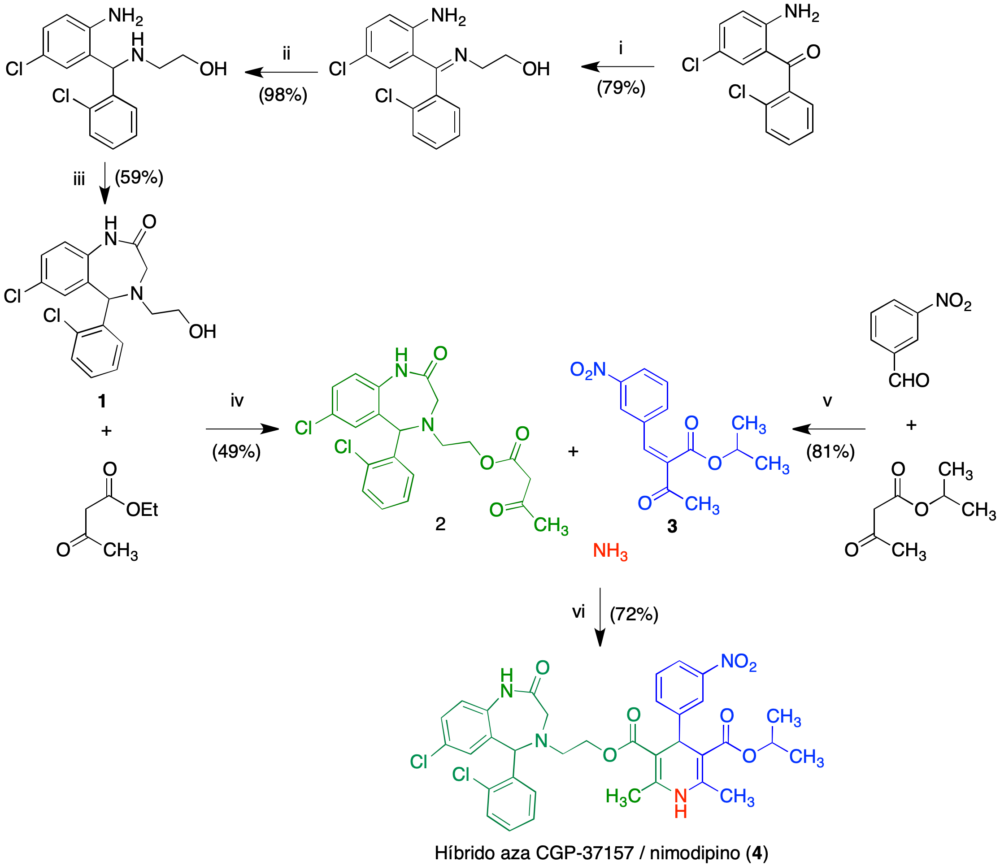
La síntesis del sistema conjugado se resume en la figura 9, y se basa en la construcción inicial del compuesto 1, seguida de su unión al acetilacetato de etilo por transesterificación para dar 2 y una reacción de Hantzsh final entre 2, el compuesto 3, obtenido por condensación de Knoevenagel del 3-nitrobenzaldehído y el acetilacetato de isopropilo, y amoníaco. El compuesto 4 así obtenido es una mezcla de diastereómeros, pero se consideró adecuado para un estudio inicial de prueba de concepto.
Figura 9. Síntesis del compuesto conjugado 4. Reactivos y condiciones: i. 2-Aminoetanol (sin disolvente), 140 °C, 20 h; ii NaBH3CN, MeOH/AcOH, 0 °C a temperatura ambiente, 18 h; iii. (a) bromuro de bromoacetilo, 0 °C a temperatura ambiente, 17 h; (b) DIEA, 50 °C, 5 h; iv KOH acuoso 2 M, MeOH, temperatura ambiente, 2 h. iv. Amberlist-15, tolueno, reflujo, 15 h. (v) Piperidina, AcOH, benceno, reflujo, 16 h; (vi) EtOH, reflujo, 15 h.
El estudio farmacológico del compuesto 4, llevado a cabo en colaboración con varios grupos del Instituto Rafael Hernando de la Universidad Autónoma de Madrid, en especial el del Dr. Rafael León, se centró en su investigación en situaciones de isquemia, que no es en sí una enfermedad neurodegenerativa pero tiene como consecuencia procesos de neurotoxicidad aguda. Este estudio confirmó el perfil multidiana de 4, que mostró las siguientes propiedades:
- Neuroprotección en dos modelos celulares de sobrecarga de calcio: toxicidad inducida por altas concentraciones de K+ en células de neuroblastoma SH-SY5Y y por veratridina en rodajas de hipocampo.
- Neuroprotección en un modelo celular de estrés oxidativo, como es el tratamiento con rotenona-oligomicina en células de neuroblastoma SH-SY5Y.
- Se investigó el mecanismo del efecto antioxidante de 4, encontrándose actividad captadora de especies reactivas de nitrógeno y una capacidad moderada de inducción de la vía Nrf2-ARE.
- Propiedades antiinflamatorias, demostradas por la reducción de la producción de nitritos inducida por lipopolisacárido en cultivos de células de glía.
- Efectos protectores en dos modelos agudos de isquemia cerebral en células de hipocampo: Excitotoxicidad inducida por glutamato y privación de oxígeno y glucosa.
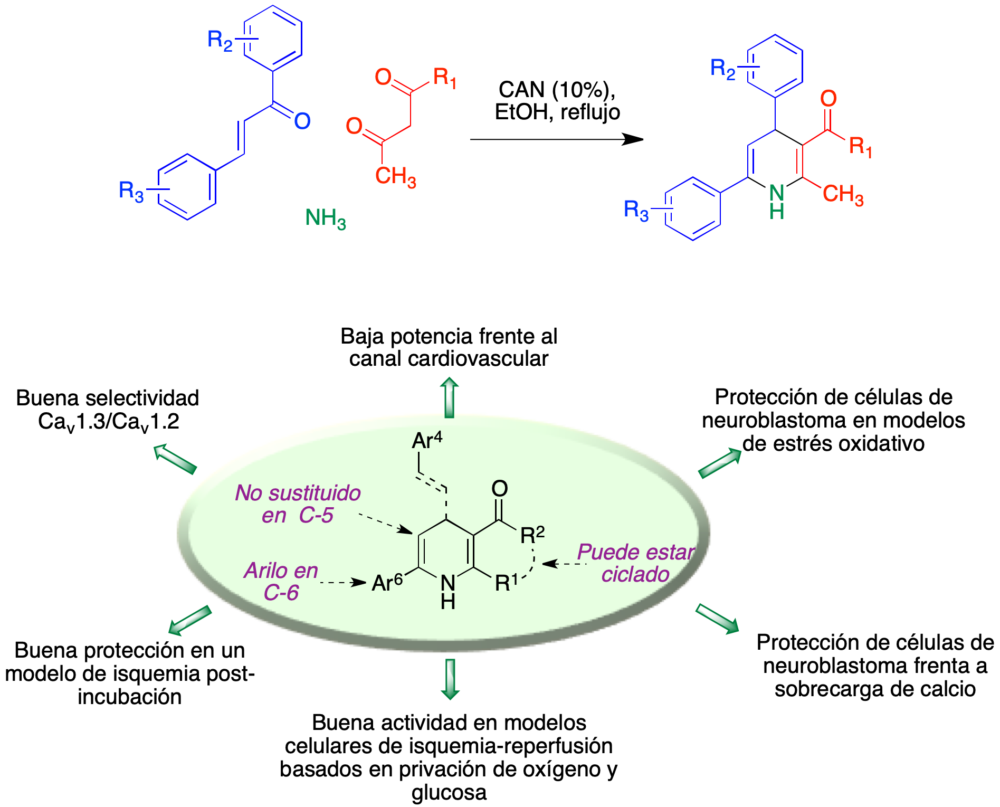
Se pudo concluir, por tanto, que la estrategia de hibridación molecular había conducido a un compuesto con propiedades mejoradas respecto a las moléculas de partida, CGP37157 y nimodipino (19). No obstante, un problema no resuelto en el uso de dihidropiridinas como agentes de neuroprotección es el de disociar estos efectos (asociados al canal VGCC CaV1.3) de los cardiovasculares (asociados al canal VGCC CaV1.2). Nos planteamos, por tanto, diseñar compuestos que no cumplieran la relación estructura-actividad propia de las dihidropiridinas con actividad cardiovascular, bien conocida por la amplia investigación llevada a cabo a lo largo de los años sobre dihidropiridinas vasodilatadoras. Sobre esta base, planteamos la síntesis de una serie de 4,6-diaril-1,4-dihidropiridinas no sustituidas en C-5, que pudo llevarse a cabo por medio de una reacción multicomponente entre chalconas, compuestos β-dicarbonílicos y amoníaco (20). El estudio farmacológico de esta quimioteca demostró unas propiedades de neuroprotección similares a las encontradas previamente en el conjugado de nifedipino, además de una buena selectividad entre los canales VGCC CaV1.3 y CaV1.2 (figura 10) (21,22). La conjugación de estas estructuras al fragmento de aza-CGP37157 está todavía pendiente.
Figura 10. Síntesis de 4,6-diaril-1,4-dihidropiridinas a través de una reacción multicomponente y resumen de su perfil farmacológico.
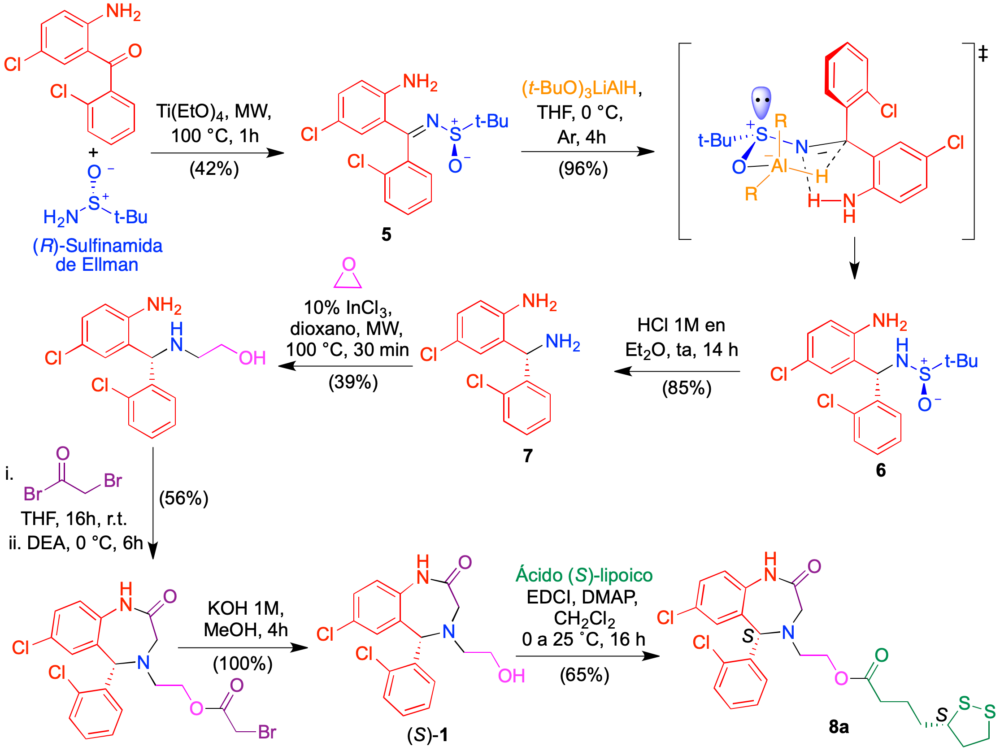
Una complicación adicional de los sistemas conjugados derivados de aza-CGP37157 es la presencia de estereocentros en ambos farmacóforos, que hace que existan cuatro esteroisómeros de cada compuesto, con actividades potencialmente diferentes. Para un análisis detallado de la influencia de este factor en la actividad de nuestros fármacos multidiana, se hizo necesaria la obtención de ambos enantiómeros del esqueleto de aza CGP-37157. Tras varias rutas fallidas, se desarrolló una basada en el empleo como auxiliar quiral de la sulfinamida de Ellman, que puede considerarse un equivalente quiral al amoníaco. La reducción de la imina 5 así obtenida con hidruro de litio y tri-terc-butoxialuminio fue completamente diastereoselectiva, pasando por un estado de transición hexagonal con los grupos más voluminosos en disposición ecuatorial, y proporcionó el compuesto 6, cuya hidrólisis ácida condujo a la amina 7 en forma enantioméricamente pura. Su transformación en el enantiómero (S) del compuesto 1 se consiguió mediante tratamiento sucesivo con óxido de etileno y bromuro de bromoacetilo, seguido de hidrólisis básica. En este caso nos planteamos la obtención de conjugados con el ácido lipoico, ya que está disponible comercialmente en forma de sus dos enantiómeros. Así, la esterificación de (S)–1 con ácido (S)–lipoico proporcionó el compuesto conjugado 8a (Figura 11).
Figura 11. Síntesis enantioselectiva de un conjugado aza-CGP 37157/ ácido lipoico
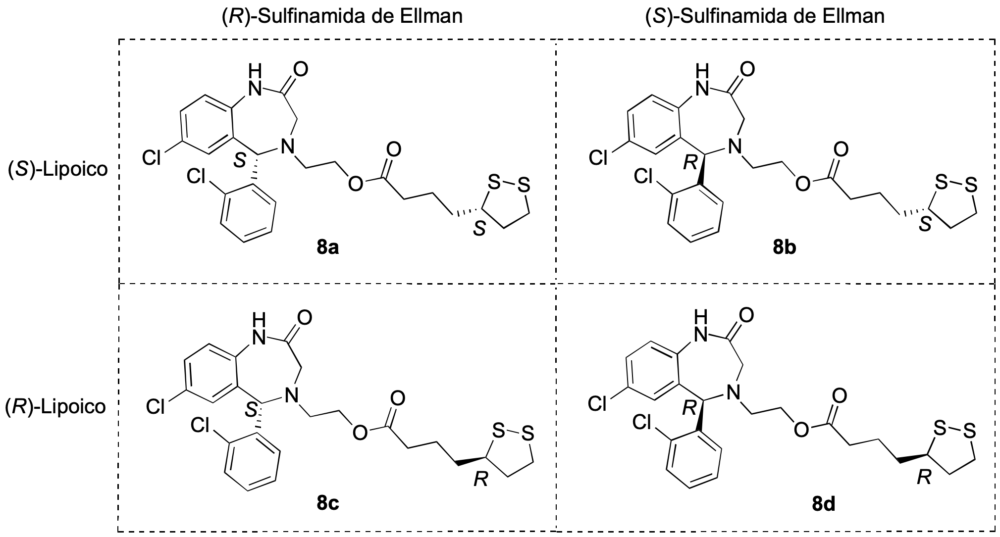
Aplicando un método similar, se logró la síntesis de los cuatro estereoisómeros de la estructura 8, como se indica en la figura 12.
Figura 12. Los cuatro estereoisómeros de la estructura 8
El estudio farmacológico de los compuestos 8 reveló actividad antioxidante y antiinflamatoria, así como capacidad de inducir Nrf2, junto con propiedades neuroprotectoras en modelos celulares de estrés oxidativo (rotenona–oligomicina) y de hiperfosforilación (ácido okadaico). Resultó interesante comprobar que la inducción de Nrf2 era altamente estereoespecífica en cuanto a la configuración de ambos estereocentros. El derivado de configuración S,R (8c) mostró la mejor actividad antiinflamatoria y neuroprotectora y será estudiado con más detalle en el futuro (23,24).
5. Compuestos multidiana basados en la modulación del estrés oxidativo
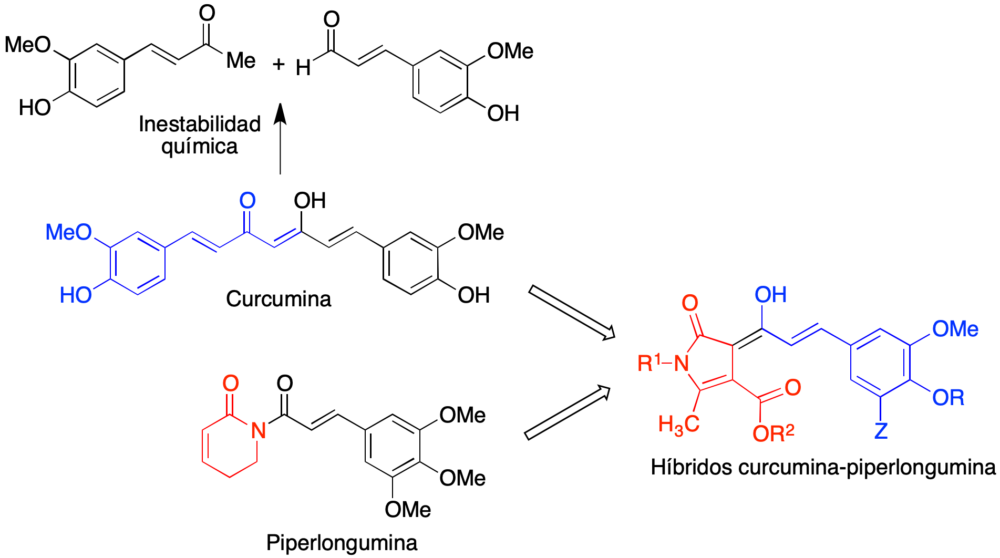
En uno de los proyectos llevados a cabo en el grupo, se planteó la preparación de compuestos híbridos que combinaran las estructuras de dos productos naturales con propiedades neuroprotectoras, la curcumina y la piperlongumina. La curcumina es el componente mayoritario del rizoma de cúrcuma (Curcuma longa) y tiene un amplio espectro de propiedades de interés potencial en la enfermedad de Alzheimer (25), tales como propiedades antioxidantes y antiinflamatorias (26), asociadas a la inducción de Nrf2 (27), y la capacidad de inhibir la agregación de proteínas amiloides (28) y la formación de ovillos tau (29). Sin embargo, la curcumina presenta una baja estabilidad química y metabólica que limita su utilización en terapéutica. Por ello, nos planteamos la preparación de análogos de curcumina de estabilidad mejorada por incorporación de un fragmento heterocíclico, que seleccionamos para que mostrara analogía con la piperlongumina, un alcaloide de Piper longum que inhibe el estrés oxidativo y la neuroinflamación, esta última por modulación de NF-kB (30) (figura 13).
Figura 13. Diseño de los compuestos híbridos curcumina-piperlongumina
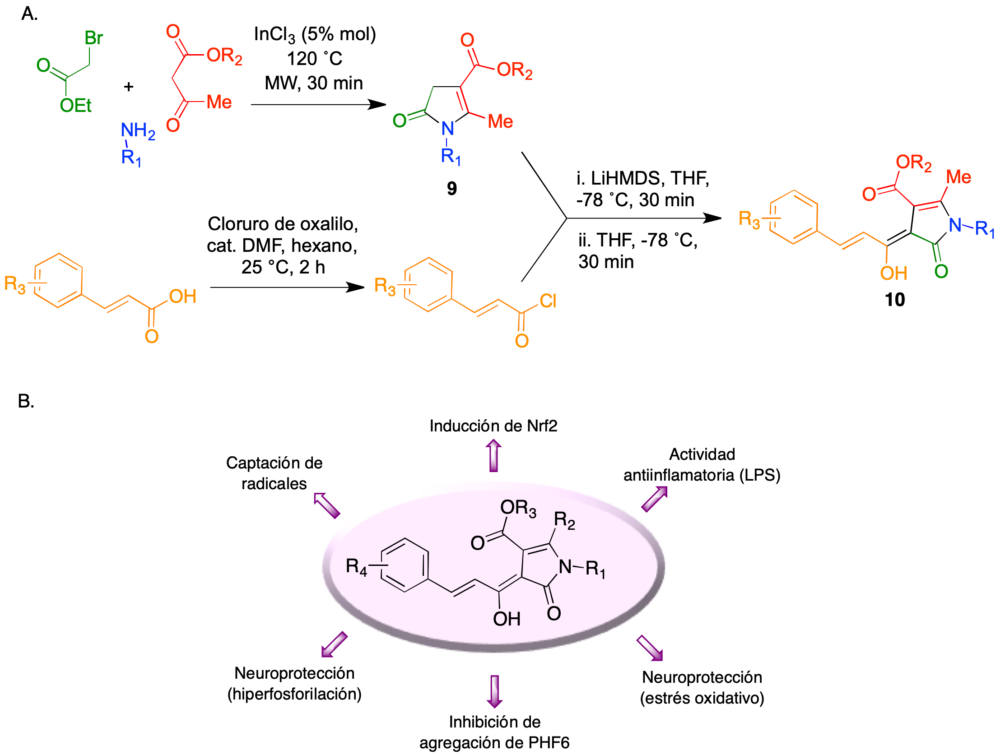
La síntesis de los compuestos híbridos se basó en una reacción multicomponente previamente descrita por el grupo (31), en la que la irradiación con microondas focalizadas de α-halocetonas, aminas primarias y compuestos β-dicarbonílicos en presencia de tricloruro de indio permite la síntesis de derivados de 2-pirrolin-5-ona 9. Su acilación con derivados del cloruro de cinamoílo en medio fuertemente básico proporcionó los compuestos híbridos deseados 10 (figura 14A). Estos compuestos mostraron un perfil multidiana muy prometedor, que se resume en la figura 14B e incluye propiedades antioxidantes por captación de radicales e inducción de Nrf2, actividad antiinflamatoria frente a lipopolisacárido, neuroprotección en modelos de estrés oxidativo e hiperfosforilación, así como la capacidad de inhibir la agregación de un hexapéptido (PHF6) representativo de la proteína tau (32).
Figura 14. Síntesis y perfil farmacológico de los híbridos curcumina-piperlongumina
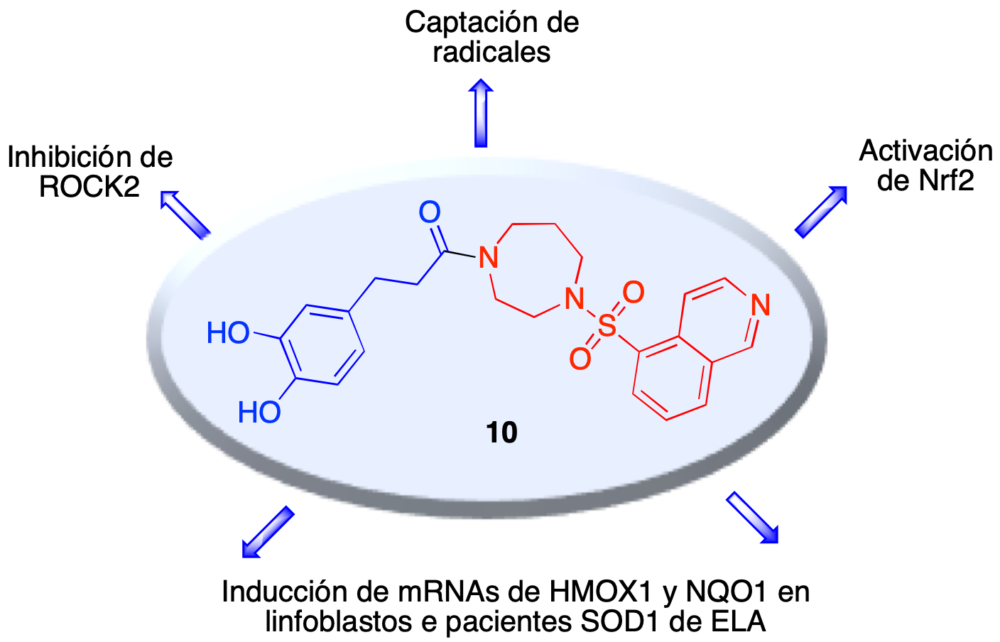
Figura 15. Perfil multidiana de un compuesto fusionado fasudil/ácido dihidrocafeico
Los compuestos 9 se utilizaron también como punto de partida para la obtención de una quimioteca de análogos de las bisavenantramidas, otra familia de productos naturales, que mostraron buenas propiedades antioxidantes y neuroprotección frente al estrés oxidativo (33).
6. COMPUESTOS MULTIDIANA BASADOS EN LA MODULACIÓN DE RHO QUINASA
Las proteínas Rho son proteínas de señalización englobadas en la superfamilia Ras y regulan muchos aspectos de la dinámica de la actina. Sus efectores son las rho-quinasas (ROCK). Estas enzimas modulan la actividad de la microglía y actúan como mediadores de la respuesta inflamatoria (liberación de citoquinas) y de la producción de ROS. En humanos, la forma predominante en el cerebro es ROCK2. El fasudil es un inhibidor de rho quinasa, aprobado en China y Japón para el tratamiento de vasoespasmo cerebral e isquemia, que ha ensayado en fase II y también investigado para uso compasivo contra la esclerosis lateral amiotrófica (ELA) (34). Además, la vía rhoA/ROCK es importante para el control de la plasticidad sináptica, lo que la convierte en una diana terapéutica muy interesante en el control de la disfunción sináptica, un fenómeno común a múltiples enfermedades neurodegenerativas (35).
En este contexto, y como parte de un proyecto dedicado a la investigación de nuevos fármacos multidiana en la esclerosis lateral amiotrófica, investigamos una quimioteca de estructuras fusionadas que combinan el fasudil con la compuestos relacionados con inductores naturales de Nrf2, como los ácidos ferúlico y cafeico. Uno de estos compuestos, de estructura 10, mostró el perfil resumido en la figura 15, estudiado en colaboración con la Dra. Isabel Lastres-Becker, del Departamento de Bioquímica de la Universidad Autónoma, que incluye tanto la capacidad de inhibir ROCK2 como la de inducir Nrf2. Este compuesto fue también activo en linfoblastos de pacientes de ELA portadores de la mutación SOD-1 (36).
7. CONCLUSIONES
Las enfermedades neurodegenerativas son el principal desafío relativo a la salud que tienen que afrontar las sociedades desarrolladas en el futuro próximo. Estas enfermedades son uno de los campos más difíciles del descubrimiento de fármacos, lo que se atribuye a su naturaleza compleja y multifactorial, que hace difícil tratarlas con los fármacos convencionales, dirigidos a una sola diana. Los ligandos dirigidos a múltiples dianas pueden definirse como compuestos diseñados para que modulen al menos dos dianas diferentes y representan un nuevo paradigma en el descubrimiento de fármacos que es especialmente prometedor en el caso de las enfermedades con mecanismos patológicos complejos y multifuncionales, como las enfermedades neurodegenerativas.
Agradecimientos
El trabajo descrito en esta breve revisión no habría sido posible sin la ayuda de los colaboradores citados como coautores en la lista de referencias, junto con la de otros cuyo trabajo no he podido resumir aquí por limitaciones de espacio. A todos ellos, mi más profundo agradecimiento.
8. REFERENCIAS
1. Ramsay RR, Popovic-Nikolic MR, Nikolic K, Uliassi E, Bolognesi ML. A perspective on multi-target drug discovery and design for complex diseases. Clin Transl Med. 2018; 7: 3.
2. Hwang SH, Wecksler AT, Wagner K, Hammock BD. Rationally designed multitarget agents against inflammation and pain. Curr Med Chem. 2013, 20: 1783–1799
3. Korcsmáros T, Szalay MS, Böde C, Kovács IA, Csermely P. How to design multi-target drugs: Target search options in cellular networks. Expert Opin Drug Discov. 2007, 2:1-10.
4. Heneka MT. Carson MJ, El Khoury J, Landreth GE, Brosseron F et al. Neuroinflammation in Alzheimer’s disease. Lancet Neurol. 2015, 14: 388.
5. Perry VH, Nicoll JAR, Holmes C. Microglia in neurodegenerative disease. Nat Rev Neurol. 2010, 6: 193.
6. Sweeney P, Park H, Baumann M, Dunlop J, Frydman J, Kopito R, McCampbell A, Leblanc G, Venkateswaran A, Nurmi A, Hodgson R. Protein misfolding in neurodegenerative diseases: implications and strategies. Transl Neurodegener 2017, 6: 6.
7. Vaz M, Silvestre S. Alzheimer’s disease: Recent treatment strategies. Eur J Pharmacol. 2020, 887: 173554.
8. Graham WV, Bonito-Oliva A, Sakmar TP. Update on Alzheimer’s disease therapy and prevention strategies Annu Rev Med. 2017, 68: 413-430.
9 Bachurin SO, Bovina EV, Ustyugov AA. Drugs in clinical trials for Alzheimer’s disease: The major trends. Med Res Rev. 2017, 37: 1186-1225.
10. Buendía I, Michalska P, Navarro E, Gameiro I, Egea J, León R. Nrf2-ARE pathway: An emerging target against oxidative stress and neuroinflammation in neurodegenerative diseases. Pharmacol Ther. 2016, 157, 84.
11. Silva-Islas CA, Maldonado PD. Canonical and non-canonical mechanisms of Nrf2 activation. Pharmacol Res. 2018, 134: 92-99.
12. Cores A, Piquero M, Villacampa M, León R, Menéndez JC. NRF2 regulation processes as a source of potential drug targets against neurodegenerative diseases. Biomolecules 2020, 10:904.
13. Wang Y, Shi Y. Wei H. J. Calcium dysregulation in Alzheimer’s disease: A target for new drug development. Alzheimers Dis Parkinsonism 2017, 7, 374.
14. Brini, M.; Calì, T.; Ottolini, D.; Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cell Mol Life Sci. 2014, 71: 2787-2814.
15. Dubois C, Prevarskaya N, Vanden Abeele F. The calcium-signaling toolkit: Updates needed. Biochim Biophys Acta 2016, 1863(6 Pt B):1337-43.
16. González-Lafuente L, Egea J, León R, Martínez-Sanz FJ, Monjas L, Pérez C, Merino C, García de Diego AM, Rodríguez-Franco MI, García AG, Villarroya M, López MG, de los Ríos C. Benzothiazepine CGP37157 and its isosteric 2′-methyl analogue provide neuroprotection and block cell calcium entry. ACS Chem Neurosci. 2012, 3: 519.
17. Ruiz, A.; Alberdi, E.; Matute, C. CGP37157, an inhibitor of the mitochondrial Na+/Ca2+ exchanger, protects neurons from excitotoxicity by blocking voltage-gated Ca2+ channels. Cell Death Dis. 2014, 5: 1156.
18. Loulousis MM, Darcy YL, Copello JA. Modulation by CGP-37157 (CGP) analogs of the sarcoplasmic reticulum calcium ATPase (SERCA). Biophys J. 2016, 110: 598a.
19. Buendía I, Tenti G, Michalska P, Méndez-López I, Luengo E, Satriani M, Padín-Nogueira F, López MG, Ramos MT, García AG, Menéndez JC, León R. ACS Chem Neurosci. 2017, 8: 67−81
20. Tenti G, Ramos MT, Menéndez JC. One-pot access to a library of structurally diverse nicotinamide derivatives via a three-component formal aza [3+3] cycloaddition. ACS Comb Sci. 2012, 14: 551−557.
21. Tenti G, León R, Egea J, Villarroya M, Fernández JC, Padín JF, Sridharan V, Ramos MT, Menéndez JC. Identification of 4,6-diaryl-1,4-dihydropyridines as a new class of neuroprotective agents. MedChemCommun 2013, 4: 590-594.
22. Tenti G, Parada E, León R, Egea J, Martínez-Revelles S, Briones AM, Sridharan V, López MG, Ramos MT, Menéndez JC. New 5-unsubstituted dihydropyridines with improved CaV1.3 selectivity as potential neuroprotective agents against ischemic injury. J Med Chem. 2014, 57: 4313-4323.
23. Michalska P, Tenti G, Satriani M, Cores A, Ramos MT, García AG, Menéndez JC, León R. Aza-CGP37157-lipoic hybrids designed as novel Nrf2-inducers and anti-oxidants exert neuroprotection against oxidative stress and show neuroinflammation inhibitory properties. Drug Devel. Res. 2020, 81: 283-294.
24. Cores A, Michalska P, Pérez JM, Crisman E, Gómez C, Villacampa M, Menéndez JC, León R. Enantioselective synthesis and pharmacological evaluation of aza-CGP37157-lipoic acid hybrids for the treatment of Alzheimer’s disease. Antioxidants 2022, 11: 112.
25. Farooqui AA, Therapeutic potentials of curcumin for Alzheimer’s disease. Springer, Cham (Suiza), 2016.
26. Peng Y, Ao M, Dong B, Jiang Y, Yu L, Chen Z, Hu C, Xu R. Anti-inflammatory effects of curcumin in inflammatory diseases: Status, limitations and countermeasures. Drug Des Devel Ther 2021, 15: 4503–4525.
27. Shin JW, Chun, K.; Kim, D. H.; Kim, S. J.; Kim, S. H.; Cho, N. C.; Na, H. K.; Surh, Y. J. Curcumin induces stabilization of Nrf2 protein through Keap1 cysteine modification. Biochem. Pharmacol. 2020, 173: 113820.
28. Lee, W. H.; Loo, C. Y.; Bebawy, M.; Luk, F.; Mason, R. S.; Rohanizadeh, R. Curcumin and its derivatives: Their application in neuropharmacology and neuroscience in the 21st century. Curr. Neuropharmacol. 2013, 11, 338-378.
29. Soeda, Y.; Takashima, A. New insights into drug discovery targeting Tau protein. Front. Mol. Neurosci. 2020, 13, 590896.
30. Kim, N.; Do, J.; Jae-sung, B.; Jin, H. K.; Kim, J.-H.; Inn, K.-S.; Oh, M. S.; Lee, J. K. Piperlongumine inhibits neuroinflammation via regulating NF-κB signaling pathways in lipopolysaccharide-stimulated BV2 microglia cells. J. Pharmacol. Sci. 2018, 137, 195-201.
31. Cores A, Estévez V, Villacampa M, Menéndez JC. Three-component access to 2-pyrrolin-5-ones and their use in target-oriented and diversity-oriented synthesis. RSC Advances 2016, 6: 39433-39443.
32. Cores A, Carmona-Zafra N, Martín-Cámara O, Sánchez JD, Duarte P, Villacampa M, Bermejo-Bescós P, Martín-Aragón S, León R, Menéndez JC. Curcumin-piperlongumine hybrids with a multitarget profile elicit neuroprotection in in vitro models of oxidative stress and hyperphosphorylation. Antioxidants, 2022, 11: 28.
33. Cores A, Abril S, Michalska P, Duarte P, Olives AI, Martín MA, Villacampa M, León R, Menéndez JC. Bisavenanthramide analogues as Nrf2 inductors and neuroprotectors in in vitro models of oxidative stress and hyperphosphorylation. Antioxidants 2021, 10: 941.
34. Koch JC, Kuttler J, Maass F, Lengenfeld T, Zielke E, Bahr M, Lingor P. Compassionate use of the ROCK inhibitor fasudil in three patients with amyotrophic lateral sclerosis. Front. Neurol. 2020, 11: 173.
35. Martín-Cámara O, Cores A, López-Alvarado P, Menéndez JC. Emerging targets in drug discovery against neurodegenerative diseases: Control of synapsis disfunction by the RhoA/ROCK pathway. Eur J Med Chem 2021, 225: 113742.
36. Martín-Cámara O, Arribas-Blázquez M, Wells G, Morales M, Martín-Requero A, Porras G, Martínez A, Giorgi G, López-Alvarado P, Lastres-Becker I, Menéndez JC. Dual rho kinase inhibition/NRF2 signalling activation by fasudil derivatives as a new multitargeted approach to the potential treatment of amyotrophic lateral sclerosis. J Med Chem 2022, 65: 1867-1882.