RESUMEN:
Los productos naturales han contribuido históricamente al descubrimiento de fármacos como fuente de moléculas bioactivas, debido a la gran diversidad y complejidad estructural que presentan. Así, han aportado moléculas “cabeza de serie” para el desarrollo de fármacos en distintas áreas terapéuticas, con una representación muy destacada en el tratamiento del dolor y de la inflamación, trastornos de la coagulación, trastornos metabólicos, así como en el tratamiento del cáncer y enfermedades infecciosas. En las últimas décadas se ha producido un cambio de paradigma en las estrategias de descubrimiento de fármacos que ha permitido la identificación de nuevos productos naturales activos en dianas terapéuticas. La Química Combinatoria y las pruebas biológicas de alto rendimiento (“High Throughput Screening”), junto al desarrollo de las técnicas computacionales, han contribuido decisivamente al diseño y optimización de quimiotecas de derivados de productos naturales en base a su actividad biológica. En paralelo, los avances tecnológicos en el campo de las ciencias ómicas y en el procesamiento de datos han llevado a un abordaje multidimensional del proceso de descubrimiento de fármacos. Estas poderosas herramientas permitirán analizar el potencial farmacológico de los productos naturales y de sus derivados y, llegar a convertir a estas moléculas en productos activos con baja toxicidad. En la era de la Medicina de Precisión, los productos naturales siguen siendo moléculas con un gran potencial en el desarrollo farmacéutico, ya que a diferencia de otras estrategias terapéuticas, presentan una relación coste-beneficio favorable lo que permitirá su uso futuro en esta disciplina.
Palabras Clave: Descubrimiento de fármacos; Productos naturales; Compuestos inspirados en productos naturales; Medicina de Precisión
ABSTRACT:
Natural products have historically contributed to drug discovery as a source of bioactive molecules, due to their great diversity and structural complexity. They have provided “lead” molecules for the development of drugs in different therapeutic areas, with a very prominent representation in the treatment of pain and inflammation, coagulation disorders, metabolic disorders, as well as in the treatment of cancer and infectious diseases. In recent decades there has been a paradigm shift in drug discovery strategies that has allowed the identification of new active natural products in therapeutic targets. Combinatorial Chemistry and biological tests (High Throughput Screening), together with the development of computational techniques, have contributed decisively to the design and optimization of libraries of natural product derivatives based on their biological activity. In parallel, technological advances in the field of Omics sciences and in data processing lead to a multidimensional approach in the drug discovery process. These powerful tools will allow the analysis of the pharmacological potential of natural products and their derivatives for the conversion of these molecules to active products with low toxicity. In the Precision Medicine era, natural products continue to be molecules with great potential in pharmaceutical development, since, unlike other therapeutic strategies, they have a favorable cost-benefit ratio, which will allow their future use in this discipline.
Keywords: Drug discovery; Natural products; Natural product inspired compounds; Precision Medicine
1. INTRODUCCIÓN
El descubrimiento de fármacos es un proceso complejo, lento, que supone una gran inversión económica sin que se puedan asegurar garantías de éxito. A pesar de que en los últimos años la aprobación de fármacos biológicos se ha consolidado, representando más del 25% de los nuevos fármacos aprobados en el periodo de 2015-2019, tradicionalmente el descubrimiento de un nuevo fármaco se ha basado en la identificación de nuevas entidades químicas, que a día de hoy sigue constituyendo la fuente más productiva en la obtención (1). Estas entidades pueden obtenerse bien por síntesis química o por un proceso de aislamiento a partir de distintas fuentes naturales como sucede con los productos naturales, con un papel destacado como moléculas bioactivas de partida en el descubrimiento y desarrollo de nuevos fármacos. El número de nuevas entidades químicas derivadas de productos naturales aprobadas entre 1981 y 2014 fue de 1328, siendo la mayoría de ellas fármacos antibacterianos, antitumorales o antivirales. Se estima que más de la mitad de los fármacos en uso clínico son derivados de productos naturales.
Los productos naturales son metabolitos secundarios que los organismos vivos han desarrollado a lo largo de su evolución como mecanismos defensivos frente a patógenos. Estos compuestos desempeñan diversas funciones biológicas, incluyendo la regulación de mecanismos endógenos de defensa y la interacción con otros organismos, lo que explicaría la relevancia de los mismos en enfermedades infecciosas y en cáncer. Por todo ello, los productos naturales son capaces de comportarse como compuestos activos en una gran variedad de procesos biológicos. Además de considerarse como una fuente de estructuras privilegiadas, los productos naturales presentan tres importantes características estructurales: diversidad, complejidad y quiralidad, ésta última correlacionándose positivamente con la capacidad de interaccionar eficazmente con dominios de proteínas.
La importancia de los productos naturales o derivados de los mismos como fuente de nuevos fármacos en el periodo 1981-2019 ha quedado reflejada en una revisión recientemente publicada (2). Los autores analizan los que son propiamente productos naturales, aquellos derivados de un producto natural por ligeras modificaciones por semisíntesis o aquellos inspirados en productos naturales que contienen grupos farmacóforos del producto natural de origen. A finales de 2019 se mantiene el éxito de los productos naturales frente a las moléculas de síntesis como fuente de nuevos fármacos. Se estimó que sólo el 28% de ellas tendrían un origen exclusivamente sintético, sin relación directa o indirecta con productos naturales.
2. LOS PRODUCTOS NATURALES EN LA TERAPÉUTICA
Es interesante señalar que, a lo largo de la historia, los productos naturales han aportado moléculas “cabezas de serie” para el desarrollo de fármacos en distintas áreas terapéuticas, con una representación muy destacada en el tratamiento del dolor y de la inflamación, trastornos de la coagulación, trastornos metabólicos, así como en el tratamiento del cáncer y de enfermedades infecciosas (3).
Cabe destacar que entre los fármacos más prescritos en EEUU se encuentran algunos derivados de productos naturales, como es el caso de las estatinas atorvastatina y simvastatina o de fármacos opioides para el tratamiento del dolor como la hidrocodona, un derivado de la codeína. En concreto, las principales estatinas, fármacos que supusieron un avance importante en el tratamiento de la hipercolesterolemia, son derivados de un producto natural la mevastatina, que se obtuvo del hongo Penicillium citrinum. Además, el fármaco rosuvastatina se desarrolló como un producto mimético sintético del producto natural mevastatina. Ambos compuestos presentan en su estructura grupos farmacóforos comunes, pero también sustituyentes químicos diferentes lo que ha permitido optimizar las estructuras y la obtención de nuevos derivados (4).
Numerosos ejemplos ilustran el potencial de los productos naturales o de moléculas inspiradas en ellos como fármacos en el tratamiento del cáncer. Así, encontramos diterpenos antitumorales de amplio uso clínico como el paclitaxel, obtenido del tejo del Pacífico (Taxus brevifolia Nutt.), comercializado como Taxol, probablemente uno de los fármacos más utilizados en clínica en el tratamiento de tumores sólidos; o su análogo docetaxel con mayor eficacia. Otros ejemplos representativos son los inhibidores de topoisomerasas derivados del alcaloide camptotecina, obtenido de la corteza de Camptotheca acuminata Decne.: irinotecan y topotecan, con utilidad clínica en tumores hematológicos; o los alcaloides obtenidos de Catharanthus roseus (L.)G.Don: vincristina y vinblastina y sus derivados semisintéticos como vinorelbina, también de amplio uso en linfomas y leucemias (5, 6).
Finalmente señalar que el Premio Nobel de Fisiología y Medicina del año 2015 puso en valor el papel de la Medicina Tradicional China y de los productos naturales con el descubrimiento por la Dra. Youyou Tu de la artemisinina, lactona sesquiterpénica aislada de la especie vegetal Artemisia annua L. conocida como ajenjo dulce. Este compuesto y sus derivados son actualmente utilizados como fármacos antimaláricos (7). Este Premio Nobel fue compartido con los doctores Campbel y Omura por el descubrimiento de otro producto natural, avermectina producida por una cepa de Streptomyces para infecciones parasitarias causadas por nematodos. Este compuesto fue modificado químicamente para aumentar su actividad y seguridad bajo el nombre de ivermectina, que se comercializó en 1981 para uso animal y pronto se convirtió en uno de los fármacos veterinarios más vendidos en el mundo para el tratamiento de la oncocercosis y la filariasis linfática (8).
3. ESTRATEGIAS Y METODOLOGÍAS EN EL DESCUBRIMIENTO DE FÁRMACOS INSPIRADOS EN PRODUCTOS NATURALES
El descubrimiento de fármacos inspirados en productos naturales ha experimentado un gran desarrollo con tres etapas claramente diferenciadas. La investigación se inicia con el uso de estrategias relativamente simples durante los primeros años, aplicando ensayos de cribado, lo que se conoce en terminología científica como “screening fenotípico” basado en el uso de bioensayos. En décadas sucesivas, la investigación evoluciona paralelamente a procesos más diversos y complejos, con la Química Combinatoria y las pruebas biológicas de alto rendimiento en los años 90s. Los avances tecnológicos e instrumentales acompañan el desarrollo en las últimas dos décadas con novedosas técnicas computacionales, las ciencias ómicas y la Bioinformática (9).
3.1 Los primeros 30 años (1940-1970s): “screening fenotípico”
En esta etapa un gran porcentaje de las nuevas entidades químicas aprobadas fueron aisladas de fuentes naturales, con predominio de moléculas obtenidas de plantas, bacterias y hongos. Los años 1950s y 1960s se consideran una edad de oro en la investigación de productos naturales, pues en estos años emergen numerosos fármacos de origen natural. Sin embargo, en la segunda década se observa que el porcentaje general de nuevas entidades químicas aprobadas de origen vegetal disminuye, dando paso a otras de origen bacteriano o fúngico (3, 10).
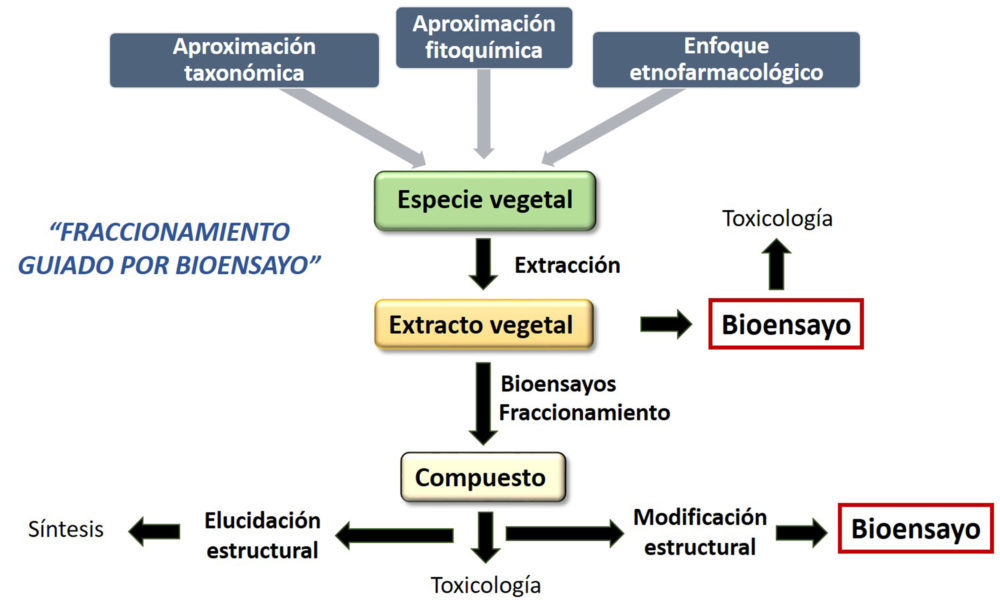
La estrategia tradicionalmente utilizada para el aislamiento de productos naturales era el “screening fenotípico” basado en el uso del bioensayo. Un extracto (mezcla compleja), obtenido en muchos casos de una especie vegetal en base a aproximaciones etnofarmacológicas o taxonómicas, era sometido al aislamiento guiado por biensayo. El bioensayo permitía estudiar la actividad antes de conocer el mecanismo. La aplicación repetida de distintos métodos de fraccionamiento conducía a la obtención de distintas fracciones del extracto que, junto a la determinación de la actividad biológica, llevaba al aislamiento del compuesto puro que se completaba con la elucidación estructural (Fig.1).
Figura 1. Esquema del proceso de aislamiento de productos naturales guiado por bioensayo.
En estos primeros 30 años se sigue el paradigma: (1) “screening fenotípico”, (2) aislamiento de compuestos y caracterización estructural y, (3) modo de acción en algunos casos. Sin embargo, esta estrategia mostró numerosas deficiencias derivadas de la complejidad estructural que presentaban los extractos y el bajo rendimiento en la obtención de productos naturales.
3.2 Período 1970s-2000s: Química Combinatoria y “High Throughput Screening”
Esta etapa se acompaña de una gran expansión de nuevas estrategias químicas que permitieron obtener un gran número de moléculas, así como por el desarrollo de ensayos de cribado dirigidos a evaluar la interacción de un compuesto con la diana terapéutica (habitualmente una enzima, complejo enzimático o un receptor) que resultará en el efecto farmacológico deseado.
Adicionalmente se exploran nuevas fuentes de productos naturales poco estudiadas hasta ese momento. En concreto, la biodiversidad de los ecosistemas marinos resulta ser una fuente natural inagotable en el descubrimiento de nuevos fármacos antitumorales (11, 12). Extractos obtenidos de numerosos invertebrados marinos (tunicados, corales, esponjas…) permitieron el aislamiento y la obtención de diversos fármacos. En la actualidad, ocho fármacos de origen marino han sido aprobados en el tratamiento de distintos tipos de cáncer. El primer fármaco fue la citarabina, aislada en 1969 y obtenido de una esponja, con uso clínico en el tratamiento de la leucemia mieloide crónica. Sucesivamente se aprobarían fludarabina y nelarabina, también indicadas en tumores hematológicos; trabectadina o eribulina en 2010 para el tratamiento del cáncer de mama metastásico.
Algunas de estas moléculas de origen marino han cobrado gran interés en la actualidad. Es el caso de la plitidepsina, desarrollada por la empresa española Pharmamar e indicada en el tratamiento del mieloma múltiple, a la que diversas evidencias científicas señalan como potencial tratamiento anti-COVID 19. Más recientemente se han aprobado anticuerpos conjugados (brentuximab vedotin y polazutumab vedotin) dónde se conjuga una molécula de origen marino, es decir, un producto antitumoral con un anticuerpo monoclonal que identifica y se dirige a la célula tumoral, ofreciendo una elevada selectividad en el tratamiento del cáncer.
Las dificultades técnicas en el aislamiento de productos naturales llevan en los años 1990s al desarrollo de la Química Combinatoria, con la síntesis de librerías de compuestos que se evalúan mediante las pruebas biológicas de alto rendimiento, lo que se conoce como “Screening de alto rendimiento” (High Throughput Screening). Ello ha permitido llevar a cabo el cribado de millones de compuestos frente a cientos de dianas moleculares en distintas áreas terapéuticas como el cáncer, enfermedades infecciosas o enfermedades cardiovasculares, entre otras (9).
En esta etapa, el interés por los productos naturales decae, en parte debido a las barreras técnicas para llevar a cabo las pruebas biológicas de alto rendimiento con los extractos y los propios productos naturales aislados frente a distintas dianas moleculares. Sin embargo, los resultados no fueron tan prometedores como se esperaba, y el rendimiento de obtención de moléculas activas “cabezas de serie” fue solo del 0.01%, quizá debido a la falta de diversidad estructural y complejidad que si aportan los productos naturales. A partir de este momento se constata una nueva oportunidad para los productos naturales, resurgiendo el interés por los mismos, con el desarrollo de nuevas estrategias químicas para la obtención de moléculas inspiradas en ellos. Entre ellas se incluyen la síntesis orientada a la biodiversidad, el concepto y uso de estructuras privilegiadas, o la quimiomodulación de bioactividades (13).
El grupo de investigación al que pertenezco ha trabajado en el desarrollo de quimiotecas que han permitido identificar requerimientos estructurales relacionados con la actividad farmacológica y acceder a los productos más activos y con menor toxicidad. En este contexto, se llevó a cabo un estudio de quimiomodulación de la actividad antiinflamatoria y antitumoral de una quimioteca obtenida a partir de dos diterpenos: ácido ent-kaurénico y ácidograndiflorénico. Estos diterpenos se aislaron de la especie Tamania chardonii (A.C.Sm.) Cuatrec, y se eligieron como compuestos “cabeza de serie” para la obtención de una quimioteca de 79 derivados que nos permitió realizar estudios de relación estructura-actividad farmacológica (SAR). Los resultados obtenidos permitieron concluir que la actividad biológica se modulaba por simples modificaciones en la estructura de los compuestos cabezas de serie utilizados para el desarrollo de la quimiotecas, permitiendo obtener compuestos con distintas actividades biológicas, en concreto con potencial antiinflamatorio y antitumoral (14, 15).
3.3. Periodo 2000-2020: nuevas tecnologías
El avance tecnológico ha acompañado las dos últimas décadas con el desarrollo de técnicas computacionales, la secuenciación del genoma en 2001 y el desarrollo de las ciencias ómicas y la Bioinformática, contribuyendo a configurar la Medicina de Precisión.
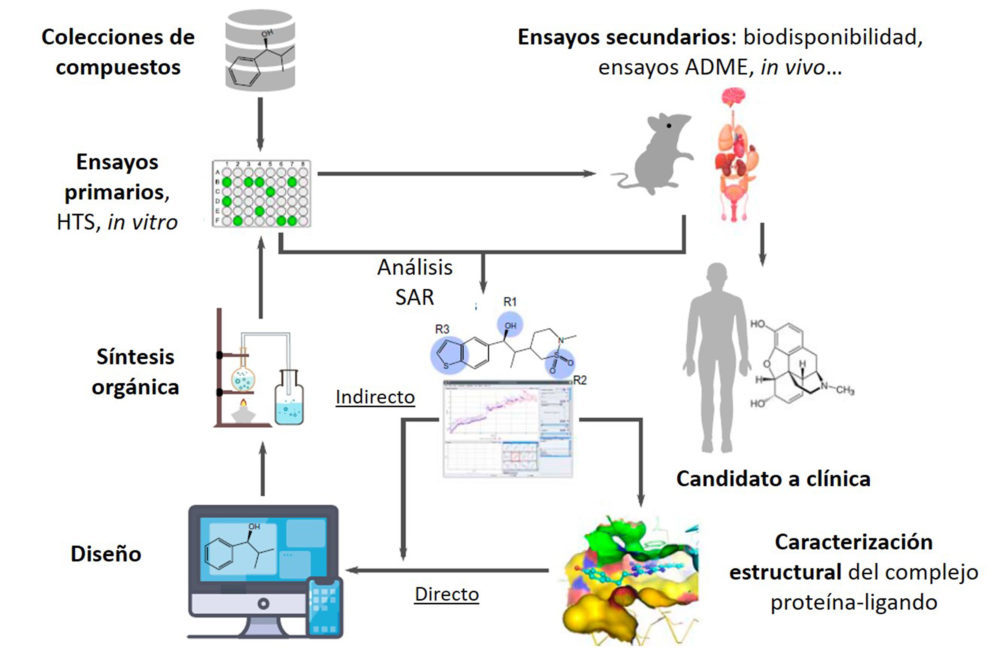
La mayoría de los fármacos que están en uso clínico son el resultado de un proceso de investigación muy complejo. Se requiere la unión de esfuerzos de diferentes disciplinas científicas para desarrollar un fármaco con efectos clínicos beneficiosos y mínimos efectos adversos. La Figura 2 muestra las etapas principales del desarrollo de un fármaco (16). El proceso comienza con la investigación sobre las causas de una enfermedad, que en algunos casos puede llevar a la identificación de una o varias dianas moleculares asociadas a esa enfermedad específica. Los pasos siguientes implican la identificación de compuestos activos en la diana molecular y la optimización de su actividad biológica. El diseño de fármacos asistido por ordenador, al poder acceder a la estructura tridimensional de las proteínas, permite predecir que una proteína diana pueda unirse a una pequeña molécula y, por tanto, optimizar la estructura química de dichas moléculas en base a la afinidad de unión, seleccionando candidatos para su evaluación experimental. El siguiente paso será identificar un compuesto “prototipo” que muestre la actividad biológica buscada a partir de la evaluación de colecciones de compuestos en ensayos celulares. En paralelo se realizan los estudios de relación estructura-actividad en el diseño de series de compuestos hasta obtener un compuesto “cabeza de serie”, así como estudios in silico que permiten predecir el modo de unión del ligando a una diana. Los compuestos activos se someterán a distintos tipos de estudios en animales (farmacocinéticos, toxicológicos…), cuyos resultados contribuirán a la selección de candidatos para ser evaluados en ensayos clínicos y, finalmente ser incluidos en la terapéutica humana.
Figura 2. Etapas en el proceso de descubrimiento de fármacos. Adaptado de Chan et al. (16).
En este contexto, estudios computacionales de Docking Molecular y Dinámica Molecular realizados por el grupo de investigación han permitido predecir la capacidad de unión al sitio activo del receptor de tipo Toll, TLR-4, de una serie de derivados del diterpeno solidagenona con el fin de evaluar si estos compuestos podrían interaccionar con esta diana terapéutica. Estos modelos ayudan a predecir la actividad de un derivado bromado de esta quimioteca, al acoplarse en el bolsillo hidrofóbico de la proteína adaptadora MD-2 ocupando el lugar de unión del lipopolisacarido LPS. Posteriormente, estos resultados fueron confirmados en modelos celulares que pusieron de manifiesto la actividad antiinflamatoria de este derivado al inhibir la producción del mediador proinflamatorio óxido nítrico cuando los macrófagos se estimulaban con distintos ligandos de receptores TLRs. Por tanto, se confirma el potencial de los diterpenos derivados de solidagenona como inhibidores de receptores TLRs (17).
4. EL FUTURO DEL DESCUBRIMIENTO DE FÁRMACOS INSPIRADOS EN PRODUCTOS NATURALES
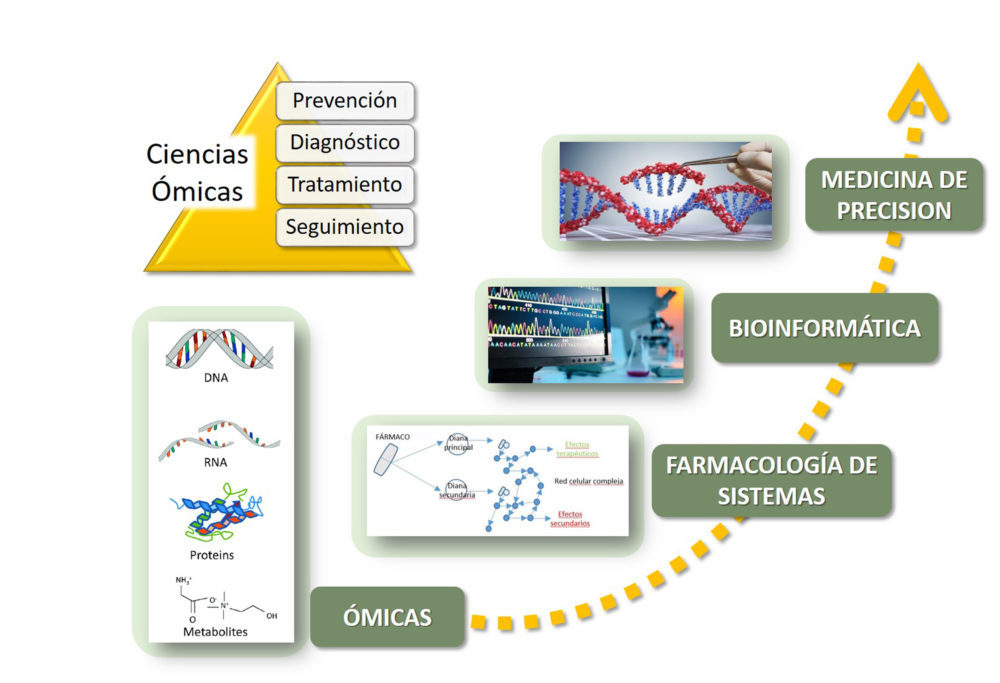
A mediados del siglo XX, la irrupción de la Biología Molecular y el desarrollo de las ciencias ómicas genera gran cantidad de información cuyo potencial se ha visto reforzado por la Farmacología de Sistemas, un nuevo paradigma que persigue descubrir medicaciones efectivas con pocos efectos adversos, al identificar y validar las dianas farmacológicas, explorando el mecanismo de acción y mejorar su uso clínico con la dosis adecuada para ser administrada a la medida del paciente (18, 19).
La Farmacología de Sistemas, junto a las herramientas de análisis de datos nos lleva al objetivo último de llevar a cabo ensayos clínicos que identifiquen a la población susceptible y nos permita aproximarnos a una medicina estratificada, cada vez más personalizada, basada en las características individuales de cada paciente en el tratamiento de enfermedades crónicas; siendo por el momento la Oncología el campo más innovador en Medicina de Precisión (Fig.3) (20).
Figura 3. Nuevas tecnologías aplicadas al desarrollo de fármacos.
En este contexto, los avances tecnológicos e instrumentales también han supuesto una revolución en el descubrimiento de fármacos inspirados en productos naturales que permitirán obtener mejores candidatos a fármacos. Se pueden señalar tres grandes actuaciones: 1) Avances en las técnicas analíticas que facilitarán los procesos de extracción de productos naturales de forma eficiente (extracción con fluidos supercríticos…); 2) Técnicas computacionales como el diseño y cribado de fármacos asistido por ordenador, y 3) Las nuevas tecnologías de las que se sirven las ciencias ómicas (genómica, proteómica, metabolómica, transcriptómica….), esenciales para el avance en el conocimiento de las bases moleculares de los procesos biológicos (21-24).
Estas nuevas tecnologías han incrementado significativamente el volumen de datos generados, por lo que ha sido necesario impulsar el diseño y mejora de herramientas computacionales y bioinformáticas que tengan capacidad de analizar eficientemente miles de datos con la mínima intervención humana. Estas herramientas para el análisis de los datos, permiten hacer minería de datos, establecer asociaciones matemáticas entre la estructura y la actividad o aplicar la inteligencia artificial (25).
Por tanto, en el momento actual, el descubrimiento de fármacos basados en productos naturales está ligado a la integración de los datos provenientes de distintas fuentes: recursos quimioinformáticos con valiosa aplicación en el análisis y manejo de bases de datos públicas que contienen información para realizar cribado virtual, quimiogenómica y análisis estructura-actividad (DrugBank, ChEMBL, Binding Database y PubChem); y aproximaciones computacionales con técnicas de Docking y Dinámica Molecular, Inteligencia artificial y datos generados por las ciencias ómicas basadas en la biología de sistemas. Todo ello permite un nuevo abordaje para el descubrimiento de fármacos (23, 26-28). Adicionalmente, el avance en el conocimiento de las vías moleculares del cáncer a partir de datos genómicos, ayudará a explorar nuevas dianas de actuación de los productos naturales y posicionarlos como fármacos de utilidad en la Medicina de Precisión, dirigidos a actuar en vías de señalización específicas en cáncer (18, 27, 29, 30).
5. CONCLUSIONES
Los productos naturales han contribuido históricamente al descubrimiento de fármacos como fuente de moléculas activas, aportando una gran diversidad estructural que ha sido optimizada a lo largo de la evolución para interaccionar con distintas biomoléculas desempeñando funciones biológicas específicas.
En los últimos años, la investigación en el desarrollo de nuevos fármacos ha experimentado un progreso sin precedentes, gracias a los avances en distintas disciplinas como la Química Analítica, Biología Molecular, Quimioinformática, Ciencias Ómicas, que junto al desarrollo de técnicas computacionales y la revolución tecnológica en el procesamiento de datos han contribuido a implementar la Medicina de Precisión. En el momento actual, asistimos a una optimización del proceso de descubrimiento de fármacos multidimensional, con poderosas herramientas que permitirán analizar el potencial farmacológico de los productos naturales o de productos derivados de ellos y llegar a convertir a estas moléculas en productos activos con baja toxicidad.
Por todo ello, los productos naturales siguen siendo moléculas con un gran potencial en el desarrollo farmacéutico, ya que a diferencia de otras estrategias terapéuticas presentan una relación coste-beneficio favorable, lo que les permitirá un uso futuro en Medicina de Precisión.
Agradecimientos
Mi agradecimiento a aquellas personas que a lo largo de mi vida personal y profesional confiaron en mí, sin cuya ayuda hoy no estaría aquí.
En primer lugar, al Profesor Ángel Villar, académico numerario de esta institución con quien me unen lazos muy estrechos, por animarme a iniciar la carrera académica, invitándome a venir con él a la Universidad Complutense. Muchas gracias por sus enseñanzas, pero también muy importante para mi ha sido el apoyo y el cariño recibido a durante todo este tiempo. Agradecimiento que hago también extensivo a todos mis compañeros del departamento de Farmacología, Farmacognosia y Botánica de la Facultad de Farmacia, por todo lo compartido.
No puedo olvidarme en este momento de mis profesores de la Facultad de Farmacia de la Universidad de Valencia, en especial, los del departamento de Farmacología.
Quiero dar las gracias a mi grupo de investigación en productos naturales. Especial mención al Dr Lisardo Boscá, Académico Correspondiente de esta institución, a quien tuve la gran suerte de conocer a la vuelta de mi estancia postdoctoral y ha sido un apoyo constante, transmitiéndome su entusiasmo por la investigación. Agradecimiento que hago extensivo también a las Dras Sonsoles Hortelano del Instituto de Salud Carlos III y a la Dra. Ana Estevez de la Universidad de la Laguna, por su amistad y profesionalidad, lo que nos ha permitido formar un grupo multidisciplinar desde hace muchos años. También a todos los becarios que han participado a lo largo de estos años en nuestras investigaciones y, que hoy están en pleno desarrollo profesional, entre los que incluyo a mis actuales colaboradoras. Gracias Irene y Laura por vuestra dedicación y esfuerzo a esta actividad que tanto nos gusta.
Mi reconocimiento a investigadores con los que he venido colaborando: a la Dra. Rocío Herrero, catedrática y directora del grupo de investigación en nuevas formulaciones de administración oftálmica, de la Facultad de Farmacia: Muchas gracias Rocío por confiar siempre en mí, lo que ha permitido que hayamos emprendido muchos proyectos juntas. También a otros grupos de investigación como la Dra. Abdalla de la Universidad de Sao Paulo.
Y en el plano personal más íntimo, una mención muy especial a mi familia. Mi más profundo agradecimiento a mis padres, que con su esfuerzo y sacrificio me han permitido llegar hasta aquí. A mi marido Juan por la paciencia y comprensión que me has demostrado en todo momento. A mi hermano Adolfo y demás familia.
He tenido la inmensa fortuna de contar también con buenos amigos tanto en el ámbito académico como fuera de él, a los que quiero también decir gracias. Gracias nuevamente a todos por estar conmigo en este momento.
6. REFERENCIAS
1. Mullard A. 2019 FDA drug approvals. Nat Rev Drug Discov. 2020;19:79-84.
2. Newman DJ and Cragg GM. Natural Products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019. J Nat Prod. 2020;83:770-803.
3. Patridge E, Gareiss P, Kinch MS and Hoyer D. An analysis of FDA-approved drugs: natural products and their derivatives. Drug Discov Today. 2016;21:204-207.
4. Rodrigues T, Reker D, Schneider P and Schneider G. Counting on natural products for drug design. Nat Chem. 2016;8:531-541.
5. Oberlies NH and Kroll DJ. Camptothecin and taxol: historic achievements in natural products research. J Nat Prod. 2004;67:129-135.
6. Martino E, Casamassima G, Castiglione S, Cellupica E, Pantalone S, Papagni F, Rui M, Siciliano AM and Collina S. Vinca alkaloids and analogues as anti-cancer agents: Looking back, peering ahead. Bioorg Med Chem Lett. 2018;28:2816-2826.
7. Zheng WR, Li EC, Peng S and Wang XS. Tu Youyou winning the Nobel Prize: Ethical research on the value and safety of traditional Chinese medicine. Bioethics. 2020;34:166-171.
8. Campbell WC. History of avermectin and ivermectin, with notes on the history of other macrocyclic lactone antiparasitic agents. Curr Pharm Biotechnol. 2012;13:853-865.
9. Katz L and Baltz RH. Natural product discovery: past, present, and future. J Ind Microbiol Biotechnol. 2016;43:155-176.
10. Heinrich M and Gibbons S. Ethnopharmacology in drug discovery: an analysis of its role and potential contribution. J Pharm Pharmacol. 2001;53:425-432.
11. Wang E, Sorolla MA, Krishnan PDG and Sorolla A. From seabed to bedside: A review on promising marine anticancer compounds. Biomolecules. 2020;10:248.
12. Stien D. Marine microbial diversity as a source of bioactive natural products. Mar Drugs. 2020;18:215.
13. Laraia L and Waldmann H. Natural product inspired compound collections: evolutionary principle, chemical synthesis, phenotypic screening, and target identification. Drug Discov Today Technol. 2017;23:75-82.
14. Hueso-Falcon I, Cuadrado I, Cidre F, Amaro-Luis JM, Ravelo AG, Estevez-Braun A, de Las Heras B and Hortelano S. Synthesis and anti-inflammatory activity of ent-kaurene derivatives. Eur J Med Chem. 2011;46:1291-1305.
15. Hueso-Falcon I, Giron N, Velasco P, Amaro-Luis JM, Ravelo AG, de las Heras B, Hortelano S and Estevez-Braun A. Synthesis and induction of apoptosis signaling pathway of ent-kaurane derivatives. Bioorg Med Chem. 2010;18:1724-1735.
16. Chan HCS, Shan H, Dahoun T, Vogel H and Yuan S. Advancing drug discovery via Artificial Intelligence. Trends Pharmacol Sci. 2019;40:592-604.
17. Cuadrado I, Amesty A, Cedron JC, Oberti JC, Estevez-Braun A, Hortelano S and de Las Heras B. Semisynthesis and inhibitory effects of solidagenone derivatives on TLR-mediated inflammatory responses. Molecules. 2018;23:3197.
18. Fang J, Cai C, Wang Q, Lin P, Zhao Z and Cheng F. Systems Pharmacology-based discovery of natural products for precision oncology through targeting cancer mutated genes. CPT Pharmacometrics Syst Pharmacol. 2017;6:177-187.
19. Bradshaw EL, Spilker ME, Zang R, Bansal L, He H, Jones RDO, Le K, Penney M, Schuck E, Topp B, Tsai A, Xu C, Nijsen M and Chan JR. Applications of Quantitative Systems Pharmacology in model-informed drug discovery: Perspective on impact and opportunities. CPT Pharmacometrics Syst Pharmacol. 2019;8:777-791.
20. Janiaud P, Serghiou S and Ioannidis JPA. New clinical trial designs in the era of precision medicine: An overview of definitions, strengths, weaknesses, and current use in oncology. Cancer Treat Rev. 2019;73:20-30.
21. Machado H, Tuttle RN and Jensen PR. Omics-based natural product discovery and the lexicon of genome mining. Curr Opin Microbiol. 2017;39:136-142.
22. Khaw KY, Parat MO, Shaw PN and Falconer JR. Solvent supercritical fluid technologies to extract bioactive compounds from natural sources: A review. Molecules. 2017;22:1186.
23. Duarte Y, Marquez-Miranda V, Miossec MJ and Gonzalez-Nilo F. Integration of target discovery, drug discovery and drug delivery: A review on computational strategies. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2019;11:e1554.
24. Atanasov AG, Zotchev SB and Dirsch VM. Natural products in drug discovery: advances and opportunities. Nat Rev Drug Discov. 2021;20:200-216.
25. Schneider P, Walters WP, Plowright AT, Sieroka N, Listgarten J, Goodnow RA, Jr., Fisher J, Jansen JM, Duca JS, Rush TS, Zentgraf M, Hill JE, Krutoholow E, Kohler M, Blaney J, Funatsu K, Luebkemann C and Schneider G. Rethinking drug design in the artificial intelligence era. Nat Rev Drug Discov. 2020;19:353-364.
26. Tung CW. Public databases of plant natural products for computational drug discovery. Curr Comput Aided Drug Des. 2014;10:191-196.
27. Fang J, Liu C, Wang Q, Lin P and Cheng F. In silico polypharmacology of natural products. Brief Bioinform. 2018;19:1153-1171.
28. Thomford NE, Senthebane DA, Rowe A, Munro D, Seele P, Maroyi A and Dzobo K. Natural products for drug discovery in the 21st century: Innovations for novel drug discovery. Int J Mol Sci. 2018;19:1578.
29. Wolfender JL, Litaudon M, Touboul D and Queiroz EF. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Nat Prod Rep. 2019;36:855-868.
30. Atanasov AG, Yeung AWK and Banach M. Natural products for targeted therapy in precision medicine. Biotechnol Adv. 2018;36:1559-1562.