1. INTRODUCCIÓN Y CONCEPTOS
La European Society of Parenteral and Enteral Nutrition (ESPEN) define la Nutrición Clínica (NC) como la disciplina que se ocupa de la prevención, diagnóstico y tratamiento de los cambios nutricionales y metabólicos relacionados con enfermedades agudas o crónicas y con condiciones causadas por un exceso o falta de energía (1).
El Soporte Nutricional (SN) es la provisión de los nutrientes necesarios para cubrir las necesidades (basales y/o derivadas de la situación patológica del paciente) por vía oral, enteral o parenteral, con el objetivo de mejorar o mantener el estado nutricional.
El Soporte Nutricional Especializado (SNE) incluye la intención terapéutica, es decir, que no se limita a la Nutrición Enteral (NE) o Parenteral (NP) para mantener y/o restaurar el estado de nutrición óptimo y la salud. El SNE está considerado como una terapia de alta complejidad, cuyo empleo se asocia con un riesgo elevado de aparición de complicaciones. Algunas de ellas son extremadamente graves y pueden llegar a tener consecuencias fatales para el paciente, mientras que otras, con carácter menos grave, tienen el riesgo de interferir con los objetivos nutricionales de los pacientes (2).
La NE consiste en el aporte de nutrientes al organismo a través de la vía digestiva, mediante una fórmula definida. Incluye la vía oral y la administración directa al tubo digestivo, vía nasogástrica, nasoentérica o percutánea. La NP es la administración de los nutrientes por la vía intravenosa, y ésta puede ser parcial o total en función si cubre o no respectivamente el 100 % de los requerimientos de macro y micronutrientes (Figura 1).
Figura 1: Algoritmo de decisión para el tratamiento, oral, enteral o parenteral. Se decide el tipo de alimentación oral, enteral o parenteral dependiendo de la integridad del tracto gastrointestinal. Si el tracto no es funcionate se aporta Nutrición Parenteral. La Nutrición Parenteral será Periférica cuando se alargue menos de 7 días (menor requerimiento de nutrientes, siendo la vía de acceso es de menor calibre); la Nutrición Parenteral será Central, para tratamientos más largos que requieren más nutrición, más osmolaridad). Si el tracto es funcionante se selecciona la Nutrición oral o la Enteral. Si la ingesta cubre más del 60% de las ingestas recomendadas de energía y nutrientes y puede darse por boca se elige dieta oral con suplementos. Cuando la Ingesta sea insuficiente (<50 % RDA): Nutrición Enteral. Para periodos menores de 6 semanas se aportará la nutrición enteral con Sondas Nasoentéricas, bien Nasogástricas (nariz-estómago) si no hay riesgo de aspiración o nasoduodenales (nariz-duodeno) y Nasoyeyunal (nariz-yeyuno) cuando haya riesgo. Para una Nutrición Enteral de más de 6 semanas, se emplearám Ostomías (acceso directo quirúrgico de la sonda) que se conocen por Gastroctomía (aporte directo a estómago) o Yeyonostomía (acceso directo a Yeyuno).
Cuando un paciente necesita NE o NP, ya sea de forma transitoria o definitiva, y no requiere de permanencia en el hospital, se puede realizar la administración de la nutrición en el domicilio del paciente siempre que sea posible. La utilización de la nutrición artificial fuera del ámbito hospitalario (NAD) ha demostrado su efectividad y seguridad a lo largo de los años, ya que permite una mejora de la calidad de vida de algunos pacientes que de otra forma estarían obligados a una estancia hospitalaria prolongada, con los riesgos y costes asociados a la misma (3). La NAD puede administrarse tanto por vía parenteral (NPD) como por vía enteral (NED) fuera del entorno hospitalario, pero siempre con los controles oportunos.
En los países occidentales, hasta el 50 % de los pacientes hospitalizados están malnutridos, y sólo el 8% reciben un diagnóstico de malnutrición durante su estancia hospitalaria (4).
En España se realizó en el año 2010 el estudio PREDyCES (5) (Prevalencia de la Desnutrición y Costes Asociados en España), en el que participaron 31 hospitales e incluyó una muestra de más de 1500 pacientes. Utilizando como test de cribado nutricional el NRS 2002, el MNA y marcadores antropométricos y bioquímicos, este estudio mostró que 1 de cada 4 pacientes hospitalizados en España (23,7 %) está en riesgo de desnutrición, de los cuales un 37 % son mayores de 70 años. Este simple hecho implica, en primer lugar, una recuperación subóptima de muchos pacientes y, en segundo lugar, un aumento del tiempo en la estancia hospitalaria, de los reingresos, de las tasas de infección y de mortalidad, especialmente en los mayores de sesenta y cinco años.
La medicina hoy está cambiando intensamente y a un ritmo vertiginoso, debido entre otros factores, a razones demográficas y por los formidables avances científico-técnicos que se están produciendo. Cada vez existen más pacientes complejos, cuyos resultados finales en términos de la medicina que se puede practicar en ellos, la experiencia que reciben en su proceso asistencial y los recursos económicos que se emplean en cubrir lo anterior, son mejorables o presentan aún recorrido de mejora.
Son muchos los profesionales que prestan asistencia y cuidan a estos pacientes complejos y la realidad en España es positiva. Sin embargo, la no priorización de la nutrición y una prestación en un modelo organizativo fragmentado en general, indican que hay margen de mejora. Los profesionales sanitarios no pueden ser meros espectadores ante este hecho, y su rol está cambiando de forma inexorable. Ya no es suficiente con obtener resultados finales en salud con el excelente ejercicio de las competencias profesionales clásicas, sino que su rol y ámbito precisan ser ampliados con aspectos relacionados con la gestión, reingeniería de procesos, innovación y aplicación de las nuevas tecnologías. Por lo tanto, podemos afirmar que el profesional sanitario de alto valor en el antropoceno inmediato debe construir una organización más operativa y holística, pero sobre todo enfocada a las necesidades individuales de cada paciente. Por ejemplo, deben liderar equipos complejos y optimizar la eficiencia para hacer que su tarea clínica sea sostenible en el tiempo y mejorar así la experiencia de los pacientes en todo su recorrido asistencial.
El entorno en el que trabajan esos clínicos está cambiando de forma importante y se hace necesario, por ejemplo, usar todo el potencial disruptivo que ofrecen las Tecnologías de la Información y Comunicación (TICs) para ofrecer cuidados a distancia, facilitando al enfermo su permanencia en casa, en la comunidad o en un entorno más familiar. Por otro lado, la tendencia internacional apunta a un desarrollo cada vez mayor del domicilio como centro de cuidados. En 2012, un metaanálisis de 61 ensayos de asignación aleatoria y controlados encontró que los pacientes hospitalizados en el hogar tenían una tasa de mortalidad a los seis meses entre un 19 % y un 38 % menor que los hospitalizados (6). Todo esto hace que el rol de los profesionales sanitarios sea más complejo en este entorno, y sólo los más capacitados serán definitivamente los que podrán co-crear con sus pacientes la modalidad de prestación sanitaria y de salud que satisfaga de forma adecuada a éstos y a ellos mismos para, finalmente, poder implementar dichas mejoras.
2. EPIDEMILOGÍA Y CONSECUENCIAS DE LA DESNUTRICIÓN RELACIONADA CON LA ENFERMEDAD
El concepto de desnutrición se refiere a una situación clínica provocada por un déficit de nutrientes (proteínas, nutrientes energéticos, otros nutrientes), que conlleva cambios en la composición corporal de los sujetos (pérdida de peso, de masa magra y masa grasa) que van a afectar a la función de los distintos tejidos y órganos del individuo y que repercuten negativamente en la evolución clínica de los sujetos (7). El origen de ese déficit de nutrientes puede deberse a una ingesta inadecuada (pérdida de apetito, problemas socioeconómicos), a un aumento de las pérdidas (diarrea, síndromes malabsortivos) o a un aumento de los requerimientos (ligados a la enfermedad).
De acuerdo con el documento de consenso de definición y clasificación de la desnutrición entre la ESPEN y la ASPEN (American Society for Parenteral and Enteral Nutrition), es importante conocer la existencia de inflamación para poder clasificar de forma adecuada la desnutrición . Esto nos sirve para distinguir la desnutrición por ayuno (característica de los países subdesarrollados o de los pacientes con anorexia nerviosa) en la que la causa de la desnutrición es el déficit de nutrientes, de la desnutrición relacionada con la enfermedad (DRE) mucho más prevalente en nuestro entorno sanitario, de etiología multifactorial y en la que siempre está presente un componente inflamatorio más o menos importante.
En los pacientes con DRE crónica (insuficiencia respiratoria, renal, cardíaca, hepática, obesidad sarcopénica, artritis reumatoide, cáncer de páncreas, etc.) existe una inflamación crónica de grado leve a moderado, mientras que en aquellos con DRE aguda (infecciones graves, politraumatismos, quemaduras, etc.) existe un componente inflamatorio agudo de grado importante.
La DRE ocurre en todos los niveles de atención sanitaria (atención primaria, especializada, residencias y hospitales). Es un problema que afecta a todos los países y se calcula que en Europa el 5 % de la población está desnutrida o en riesgo de desnutrición y este porcentaje aumenta al 10 % entre los ancianos. En el estudio PREDyCES, la prevalencia de DRE fue mayor en los pacientes con enfermedades neoplásicas (35 %), del sistema circulatorio (29 %) y respiratorias (28 %). La prevalencia de DRE también varía según el nivel asistencial. Así se calcula que afecta al 2% en ancianos sanos en residencias públicas españolas, al 5-8% de los ancianos en domicilio, al 50 % de los ancianos enfermos institucionalizados, a un 44% de los ancianos ingresados en hospital por patología médica y hasta un 65 % de los ancianos ingresados por patología quirúrgica (5).
La DRE altera la respuesta inmunitaria facilitando la aparición de infecciones, además de favorecer la aparición de úlceras por presión. Todo ello retrasa la recuperación del paciente y, por lo tanto, se prolonga la estancia hospitalaria. Se incrementa la tasa de reingresos prematuros y se altera la independencia del individuo y su calidad de vida. Lo cual contribuye a aumentar la morbimortalidad y repercute negativamente en los costes sanitarios.
Según los resultados del estudio PREDyCES, el coste de la hospitalización se incrementa al menos un 50% en los sujetos con desnutrición (5). Un porcentaje destacado de pacientes (10 %) se desnutren durante su estancia hospitalaria, y este subgrupo representa los costes más elevados. Asimismo, en este estudio se pudo observar que el coste se multiplicaba por dos en los pacientes desnutridos (12.237 € vs. 6.408 €). Los costes directos de la desnutrición hospitalaria se estimaron en 1,143 millones anuales en 2009, lo que supone el 1,8 % del gato sanitario del sistema nacional de salud (8).
3. NUTRICIÓN ARTIFICIAL DOMICILIARIA: TIPOLOGÍA E INDICACIONES
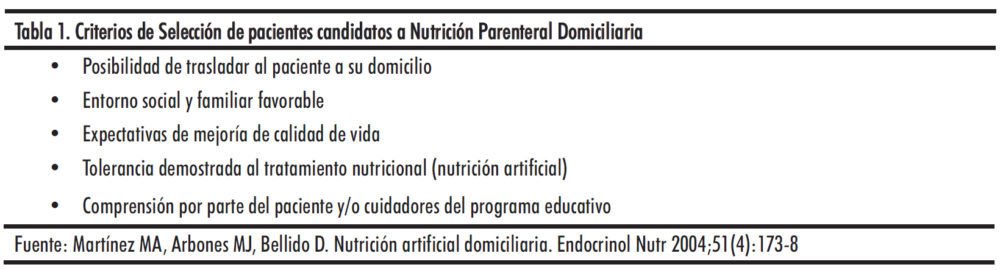
Según las guías de la ASPEN, las indicaciones del soporte nutricional especializado domiciliario son las mismas que las del hospitalario (9). Se considera a un paciente candidato al soporte nutricional domiciliario cuando cumple criterios de inclusión derivados de su enfermedad de base y unas condiciones sociales que permiten un mantenimiento adecuado en el medio no hospitalario (10) (Tabla 1).
En el caso de la NPD, los pacientes candidatos presentan un síndrome de intestino corto con capacidad funcional absortiva intestinal, debido a una escasa longitud intestinal o a una afectación de las áreas absortivas. Algunos ejemplos son: pacientes con múltiples resecciones intestinales por enfermedad de Crohn, casos de enteritis rádica o trombosis mesentérica. Por tanto, la NPD estaría indicada cuando el tracto gastrointestinal no es funcional o accesible, en los casos de fallo intestinal y en pacientes malnutridos con mala respuesta al tratamiento con NE, así como en aquellos casos en que es imposible utilizar la nutrición enteral por imposibilidad de obtener un acceso al tubo digestivo.
La NPD se utilizó por primera vez en 1967 en EE.UU. Los primeros pacientes europeos se localizan en Dinamarca en 1970. En España, los primeros casos datan de 1984, indicada, en un principio, para el fallo intestinal sin enfermedad maligna de base. En relación con el paciente oncológico, la NPD ha experimentado, en siete años, un incremento de un 43 % (11).
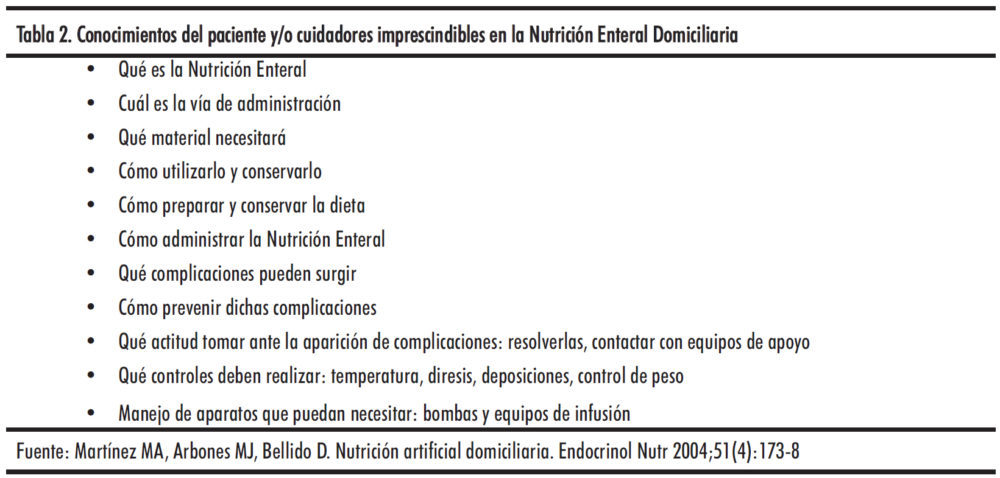
Son candidatos a la NED aquellos pacientes que no pueden cubrir sus necesidades nutricionales mediante la alimentación oral, pero mantienen una capacidad funcional intestinal suficiente para ser alimentados por vía digestiva (Figura 1). Además de la indicación por la patología de base, se deben valorar ciertos criterios para el mantenimiento del soporte nutricional en el domicilio del paciente. La situación clínica del paciente debe ser apropiada para permitir su traslado al domicilio y debe encontrarse estabilizada la enfermedad de base. Antes de que el paciente se traslade a su domicilio, hay que asegurarse que tolera perfectamente el tratamiento, manteniendo las mismas características respecto a volumen, fórmula y tiempos de infusión que se pretende aplicar en el domicilio. En el caso de la NED, si el paciente presentara diarrea o molestias abdominales, y en la NPD, trastornos hidroelectrolíticos o metabólicos (fundamentalmente hiperglucemia), se debería retrasar el momento del alta hasta la estabilización del paciente (9) (Tabla 2).
El entorno familiar y social del paciente debe ser favorable, así como las expectativas de mejora de la calidad de vida, ya que una de las principales finalidades del soporte nutricional domiciliario es mejorar la calidad de vida de los pacientes, además de restaurar o mantener un adecuado estado nutricional. En el caso de la NPD, se debe estimar una duración del tratamiento de 4-5 semanas, como mínimo, y una expectativa de vida igual o superior a 3 meses (10).
La composición de la NP que el paciente se administrará en su domicilio debe establecerse antes del alta, cuando esté ingresado en el hospital, y las modificaciones se realizarán en función de la situación clínica y los resultados analíticos (12). Las necesidades nutricionales de cada paciente se deben individualizar, considerando la enfermedad de base y el estado nutricional. Lo más frecuente es que la NPD se utilice durante un periodo de tiempo prolongado, por lo que se debe asegurar un aporte completo de todos los nutrientes esenciales, a fin de evitar deficiencias posteriores (3). En el caso de la NED, las fórmulas de NE son productos constituidos por una mezcla de macro y micronutrientes que se administran por vía digestiva. Se dispone en el mercado de distintos tipos de dietas, como se especifica a continuación: fórmulas completas generales, fórmulas especiales, suplementos, módulos y productos dietéticos. Estas fórmulas y productos se clasifican en función de la complejidad de los nutrientes, contenido de proteínas y calorías, así como su contenido en fibra y su osmolaridad.
4. SOPORTE NUTRICIONAL ARTIFICIAL EN UN CONTEXTO DE ATENCIÓN SANITARIA LÍQUIDA Y TRANSFORMACIÓN DIGITAL
El modelo asistencial en el que se presta la NPD está organizado en silos, lo que provoca fragmentación de cuidados, con un problema añadido, por la existencia de una enfermedad de base a manejar clínicamente. La evidencia indica que la fragmentación del sistema incrementa el gasto en un 77,6 % (13).
Los planes de nutrición parenteral para los pacientes oncológicos y quirúrgicos complejos son, en general, bien implementados mientras el paciente está en el hospital. Sin embargo, no existe una buena comunicación con los prestadores de atención primaria, bien por ser insuficiente o por estar poco estructurada, con lo cual, puede ocasionar un impacto negativo para su tratamiento y recuperación nutricional. Desafortunadamente, el paciente no transita de la mejor forma posible por el sistema, ya que los sistemas de salud siguen sin poner el foco en el paciente, sino en las enfermedades concretas. El paciente es quien más sufre la fragmentación de cuidados; así pues, el propio enfermo debe convertirse en el elemento integrador necesario en la trayectoria de cuidados (Figura 2).
Figura 2. Modelo asistencial en Nutrición Artificial Domiciliaria. La utilización de nuevas Tecnologías de la información y Comunicación mejora y agiliza la interrelación profesional sanitario-paciente reduce el gasto sanitario y mejores resultados de salud. Esta interacción lleva al concepto de Hospital líquido (que fluye). Para más datos consultar texto. Modificado de Martínez MA, Arbones MJ, Bellido D. Nutrición artificial domiciliaria. Endocrinol Nutr 2004;51(4):173-8
Es evidente que esto se corregirá, en parte, con la implementación entre niveles. En estos momentos, no toda España dispone de esta herramienta y, fundamentalmente, las interconsultas hospitalarias actúan como mecanismo de coordinación entre servicios. Es por ello que la propia HCE, allí donde está implantada, es un elemento integrador esencial para facilitar la comunicación.
En la última década se ha acuñado el concepto de “hospital líquido”, que pretende sacar la atención sanitaria de las cuatro paredes físicas del hospital mediante el uso de diferentes herramientas de base tecnológica, por ejemplo, las TICs. De esta forma, se mejora la interrelación profesional sanitario-paciente y también las que existen entre los diferentes profesionales sanitarios implicados, teniendo como principales objetivos facilitar la atención de los pacientes y la promoción del intercambio de conocimientos entre profesionales. Los elementos que forman parte de la iniciativa hospital líquido son, entre otros: e-Salud (e-Health), las redes sociales, los portales temáticos y los espacios virtuales (14) (Figura 2).
Ningún proyecto de transformación digital sería comprensible sin tener en cuenta a las personas involucradas, aquellas que deben necesariamente llevarlo a cabo: personal sanitario y pacientes. Así, serán los propios trabajadores de los centros sanitarios quienes tengan que poner en práctica las estrategias diseñadas para derribar, metafóricamente hablando, las paredes de los centros y para ello deben recibir la formación necesaria. Además, se debe ser capaz de demostrar las ventajas de estas nuevas formas de proceder, para implicarles en ellas a fin de que formen parte de los procesos de mejora necesarios para afinarlos. Deben sentirse escuchados, que se les tiene en cuenta, que son parte del proceso y no meros ejecutores.
Respecto a los pacientes, no se puede olvidar que sin ellos nada de este proyecto de transformación tendría sentido y, por lo tanto, sus opiniones y solicitudes deben formar parte también de los procesos de transformación. Deben ser ellos quienes marquen las prioridades, identifiquen sus necesidades y participen en la puesta en marcha de las iniciativas tendentes a extender los procesos más allá de los límites físicos de los centros.
Un nuevo modelo basado en redes de información sobre el cual compartimos conocimiento y que potencia la participación y conversación, ha derivado en un nuevo tipo de sociedad a la que los ciudadanos se están adaptando y empiezan a aprovechar todas aquellas herramientas que hacen la vida más fácil y pueden también mejorar su salud. De esta forma ha aparecido el movimiento de los “e-pacientes”, que son aquellos que integran lo digital en todo lo que concierne a su salud o la de otras personas de su entorno: búsqueda de información, participación en redes sociales o comunidades de pacientes, comunicación con profesionales e instituciones, etc. (Figura 2).
No existe un límite definido de lo que es un “e-paciente” y lo que no, ya que tanto los grados de alfabetización digital como los de empoderamiento son muy variables en cada persona. Pero sí podemos decir que el e-paciente es en definitiva aquella persona que quiere tener un mayor poder de participación y desea ser responsable en la toma de decisiones que afectan a su salud. De manera análoga, existe el concepto de “e-profesional” de la salud, ya que éstos no pueden quedarse atrás o actuar de forma reactiva ante las nuevas demandas de la sociedad, sino que deben adoptar una actitud proactiva y aceptar las tecnologías móviles, y por tanto la TICs en general, como una oportunidad única de mejorar en su trabajo y aportar valor a las personas que atienden (15).
5. HUMANIZACIÓN Y MEJORA DE LA CALIDAD DE VIDA EN EL PACIENTE CON NUTRICIÓN ARTIFICIAL DOMICILIARIA
Según el Diccionario de la Lengua Española (16) humanizar es “hacer humano, familiar, afable a alguien o algo”. Es “ablandarse, desenojarse, hacerse benigno”. Qué duda cabe que, cuando un ciudadano se acerca a un centro sanitario porque necesita asistencia sanitaria, espera recibir una atención “humanizada”. Esta palabra la usamos habitualmente para expresar el deseo de que algo sea bueno, se ajuste a la condición humana, responda a la dignidad de la persona. No es lo mismo ser humano, que vivir y comportarse humanamente.
Los profesionales de la salud deben caracterizarse por poseer riqueza de humanidad, manifestada especialmente por un compromiso con los sujetos vulnerables. Se traduce también en una predisposición a escuchar y comprender a las personas, por su interioridad, mundo y cultura. Cuidar es una tarea fundamental de la condición humana (17).
Las principales barreras de la humanización de la asistencia sanitaria son la falta de tiempo de los profesionales, la escasez de recursos humanos y económicos, la insuficiente formación y sensibilización de profesionales sanitarios, así como la formación de los propios pacientes. Estos factores también deben aplicarse al ámbito de la gestión y organización sanitaria relativa a la NAD, es por ello que se debe analizar concienzudamente los procesos de atención a los pacientes candidatos a NAD, desde una perspectiva de mejora de su calidad de vida y un adecuado fomento de su experiencia en la cadena de cuidados sanitarios.
Un ejemplo paradigmático de tratamiento nutricional en el domicilio es el del paciente oncológico. La NAD es una alternativa terapéutica fácil y asequible para aquellos pacientes oncológicos con fallo oral o intestinal, que no requieran otras medidas terapéuticas de ámbito hospitalario. El principal objetivo de la NAD es mejorar la calidad de vida del paciente oncológico. Ello implica un enfoque multidisciplinario y coordinado entre el equipo responsable del soporte, la familia y todos los profesionales implicados en el tratamiento.
Es difícil valorar los efectos de la nutrición en este aspecto en un paciente con cáncer avanzado: la mejoría del estado funcional, la disminución de los síntomas y el menor número de complicaciones son variables difíciles de medir en estos pacientes. Pero lo que indiscutiblemente brinda un adecuado soporte nutricional es la posibilidad de adelantar el alta hospitalaria con la consecuente reintegración del paciente a su medio. Esto repercute positivamente en el estado anímico del paciente y, en muchas ocasiones, le permite reincorporarse a un ritmo de vida razonablemente normal. En general, se acepta que la NAD representa un cambio positivo en la calidad de vida de los pacientes con cáncer (18).
Un estudio reciente desarrollado en el ámbito del paciente oncológico define los criterios de selección que permiten la identificación de pacientes que se pueden beneficiar de la NAD. Esta investigación, llevada a cabo por Ruggeri et al. (19), ha demostrado que la NAD puede ser eficaz para evitar la muerte por desnutrición en el 73 % de los pacientes, y para mantener o mejorar el estado de funcionalidad o Karfnosky Performance Status (KPS) durante al menos un mes en el 90 % de los casos. Asimismo, se demuestra que los beneficios proporcionados por la NAD en el grado de supervivencia y de la calidad de vida dependen del grado de caquexia al inicio de la NAD.
Los pacientes que reciben NPD requieren un estrecho seguimiento para comprobar la eficacia del tratamiento, realizar las modificaciones necesarias en función de la evolución clínica y detectar y resolver los problemas que pudieran surgir. Este seguimiento se realizará por todos los profesionales implicados en el proceso, la Unidad de Nutrición, el Servicio de Farmacia y el Servicio de Hospitalización a Domicilio, cuando sea necesario. Se deben realizar evaluaciones clínicas y analíticas con una frecuencia que se deberá ajustar en función de la estabilidad del paciente, la patología de base y la tolerancia al tratamiento (20).
6. EPIDEMIOLOGÍA Y EFICIENCIA DEL SOPORTE NUTRICIONAL A DOMICILIO
En España, sólo un tercio de los pacientes con riesgo de desnutrición al alta reciben apoyo nutricional (suplementos orales o nutrición enteral/parenteral) (21). Sin embargo, sabemos que un adecuado soporte nutricional mejora el estado general del paciente, aumenta la tolerancia al tratamiento y su eficacia, disminuyendo así mismo la mortalidad; en definitiva, existen evidencias de que el estado nutricional incide en los resultados finales de morbimortalidad, coste y calidad de vida (22). Por otro lado, la disminución de los costes del tratamiento con respecto a los costes hospitalarios se estima en un 75 % en los pacientes con NED y en 60-76 % en pacientes con NPD (23).
Según los datos obtenidos del registro del grupo NADYA-SENPE (www.nadya-senpe.com) del año 2017 (24), se registraron 308 pacientes con NPD (54,5 % mujeres) -38 niños y 270 adultos-, procedentes de 45 hospitales españoles; en total 312 episodios, lo que representa una tasa de prevalencia de 6,61 pacientes/millón de habitantes/año. El diagnóstico más frecuente en adultos fue “oncológico paliativo” (25,6 %), seguido de “otros”. En niños fue la enfermedad de Hirschsprung, con seis casos (15,8 %). El primer motivo de indicación fue síndrome de intestino corto tanto en niños (55,3 %) como en adultos (33,7 %). El tipo de catéter más utilizado fue el tunelizado tanto en niños (74,3 %) como en adultos (38,2 %). Finalizaron 81 episodios; la causa más frecuente fue el fallecimiento (62,9 %) y que pasaron a ser tratados por vía oral (34,7 %). Estos datos indican que se mantiene el incremento progresivo de centros y profesionales colaboradores en el registro de pacientes que reciben NPD, y que las principales indicaciones de NPD y de motivo de finalización, también se mantienen estables.
Si comparamos el uso de NPD en España frente a otros países europeos, empleando como fuente de datos el registro nacional del Grupo NADYA (Nutrición Artificial Domiciliaria y Ambulatoria) de la Sociedad Española de Nutrición Parenteral y Enteral (SENPE), la prevalencia de NPD presenta una tasa entre dos y cinco veces inferior a las de otros países europeos, mientras que las tasas de población subsidiaria de este tipo de tratamiento se estima que podrían ser similares a las de países como Reino Unido, Italia o Alemania (25). Los estudios epidemiológicos llevados a cabo en Europa por el Home Artificial Nutrition Working Group de la ESPEN registraron en 2011 una prevalencia de adultos con NPD de entre 3,25 y 6,6 pacientes/millón de habitantes. Respecto a la variabilidad de uso de la NPD en pacientes con cáncer, varía del 60 % en Italia al 20-30 % en España, Francia y Bélgica y sólo el 8% en Reino Unido (22). Según los registros NADYA-SENPE, la patología oncológica ocupa el primer lugar para indicar NPD desde 2003. En 2013, el grupo oncológico ocupaba el 30,7 % (en tratamiento paliativo 20,1 % y con tratamiento radical 10,6 %), seguida por otras patologías. En el último registro publicado, de 2014, se observa un ligero aumento en el tratamiento de esta patología, ya la neoplasia paliativa ocupaba el 20,4 % y la neoplasia con tratamiento radical, el 11,8 % (26).
Los estudios de coste-efectividad de la NPD son muy escasos y poco extrapolables a nuestro país por estar realizados en diferentes sistemas sanitarios. Dentro del ámbito europeo de Reino Unido, Francia y Holanda, la evidencia científica disponible sugiere que, comparada con la alternativa de trasplante intestinal, la NPD resultó en un menor coste por año de vida al tiempo que parece ser claramente más adecuada de la perspectiva de la coste-efectividad comparada con el mismo tipo de tratamiento administrado en el hospital (27).
7. ROL DE LA FARMACIA HOSPITALARIA EN LA NUTRICIÓN DOMICILIARIA
El documento desarrollado por el Grupo de Nutrición de la Sociedad Española de Farmacia Hospitalaria (SEFH) con la propuesta de estandarización del SNE (28) supuso una mejora en la práctica de esta modalidad terapéutica entre nuestro colectivo. Estos estándares reflejan la práctica considerada de referencia para asegurar una atención nutricional de calidad, segura y eficiente.
La NPD se ha de preparar en condiciones de estricta asepsia, en cabinas de flujo laminar horizontal y por un servicio acreditado para ello, realizándose así a través de los Servicios de Farmacia Hospitalaria (SFH). Desde el SFH se preparan las bolsas de NP de forma individualizada para cada paciente, en función de su patología y requerimientos nutricionales. El farmacéutico encargado de la terapia parenteral ha de realizar un control de calidad para comprobar que las condiciones de preparación son correctas, así como del material de elaboración, todo ello previo a la dispensación del tratamiento. La dispensación de NPD requiere tradicionalmente del desplazamiento del paciente o sus familiares al hospital una o dos veces por semana. Si el paciente está a cargo de la Unidad de Hospitalización a Domicilio (UHD), un miembro de dicha unidad es el responsable de recoger las nutriciones semanalmente.
El desplazamiento del paciente al hospital, además de la recogida de la terapia parenteral, es necesario para la colocación por parte de enfermería de las vías de accesos para facilitar la alimentación a lo largo de la semana, así como para la recogida de todo el material requerido para poder alimentarse de la mejor manera posible y evitar complicaciones innecesarias.
Como alternativa a la elaboración de la NP en el Servicio de Farmacia, existen servicios de catering que elaboran las dietas de forma individualizada de acuerdo con la solicitud del SFH. El paciente gana en comodidad puesto que se le garantiza el suministro periódico de la NP en el domicilio del paciente, incluso en periodo de vacaciones allí donde se encuentre temporalmente, evitando los desplazamientos al hospital. El área de nutrición artificial se encarga de la realización de un seguimiento estrecho y monitorización de los pacientes, por lo que ante cualquier cambio en los parámetros clínicos o analíticos se valora la suplementación o sustitución de cualquier nutriente que sea necesario.
La NED, a diferencia de la NPD, no se dispensa en los SFH, sino que se recoge en las oficinas de farmacia con una receta médica que requiere visado de inspección. Constituyen una excepción los pacientes ingresados en la UHD, a los que sí se dispensa la NE desde el Servicio de Farmacia. En algunas CC.AA., como Cataluña y Galicia, la NED se dispensa en el SFH, donde además se llevan a cabo las actividades de seguimiento y racionalización del tratamiento.
Una vez establecida la necesidad de NAD, es preciso llevar a cabo un riguroso programa de educación y entrenamiento a los pacientes y/o cuidadores que permita poner en práctica una nutrición eficaz, reduciendo al máximo las complicaciones y procurando facilitar en lo posible la independencia y autosuficiencia de los pacientes. El programa debe comprender aspectos tales como: conocimiento del motivo de la indicación, método de administración, cuidados de la vía de acceso y material necesario, correcta manipulación y almacenaje de la fórmula, mantenimiento del equipo de administración y normas de infusión, reconocimiento y respuesta adecuada ante complicaciones, descripción de la estructura sanitaria de apoyo, modo de contacto ante cualquier duda o problema y garantizar todos los aspectos éticos y legales (29).
Los equipos multidisciplinares aportan importantes beneficios a los pacientes y a los profesionales que los atienden. Estos beneficios incluyen mejoras en los resultados en salud, mayor satisfacción de los usuarios y un uso más eficiente de los recursos. En la práctica clínica actual, aunque cada vez el movimiento hacia un mayor trabajo en equipo parece despertar, se detecta aún, la escasa existencia de trabajo conjunto estructurado y continuado entre los agentes implicados en la nutrición parenteral domiciliara. Existe recorrido de mejora en la coordinación entre dichos agentes. Parece necesaria una participación mayor de endocrinos, nutricionistas y farmacéuticos de hospital en las unidades multidisciplinares que atienden a los pacientes con NAD, además de seguir participando en comisiones de tumores y comisiones de nutrición pero que a veces avanzan de forma paralela, sin demasiada interconexión.
El campo de la NAD no debe ser ajeno a la aplicación del concepto “Gestión Clínica”, entendido como la estrategia que permite sistematizar y ordenar los procesos de atención sanitaria de forma adecuada y eficiente. Esto implica algo más que un modelo de administración de nuestros servicios de salud. Se trata de un verdadero cambio de actitud no sólo del personal administrativo, sino de todo el personal asistencial, que deberá asumir el liderazgo de las tareas administrativas garantizando el logro de los objetivos de la institución. Para ello tendrá como eje de todas las actividades médicas y administrativas al paciente que acude a solicitar nuestra atención (30).
Finalmente, todos estos profesionales sanitarios deben ser copartícipes del concepto “Decisión Clínica Compartida”, en la que hay dos expertos, el profesional sanitario que pone la técnica y el paciente que pone la vida, que juntos elaboran el plan terapéutico personalizado, en un diálogo de búsqueda de las actuaciones más adecuadas.
8. CONCLUSIONES
Desafortunadamente, muchas veces la nutrición queda relegada a un segundo plano en las políticas estratégicas de salud y en nuestras organizaciones no se integra como objetivo prioritario. Se eclipsa el problema por la existencia de otras enfermedades de base. Sin embargo, el problema nutricional es sistémico clínicamente y no es órgano-dependiente.
Con los datos que disponemos en España procedentes del registro NADYA, podemos afirmar que el empleo de la NPD es menor respecto a otros países de similares características socioeconómicas y sanitarias de nuestro entorno. No obstante, a fecha de hoy no se tiene seguridad de cuál sería la tasa ideal de empleo de la NPD.
Debido a esa lógica sistémica y, por lo tanto, a la necesidad de un abordaje multidisciplinar y coordinado, es probable que la nutrición requiera un cambio estratégico general. Es de gran importancia la coordinación del equipo de soporte, con una estructura básica de médico y farmacéutico expertos, enfermería especializada y dietista, así como la importancia de la gestión global del paciente, es decir, aspectos no sólo clínicos, sino de organización y gestión global de un proceso.
En cuanto a la transformación tecnológica en el ámbito de la salud, resaltar que debe basarse en el componente humano. Tecnología y experiencia de paciente han de ir siempre de la mano para lograr mejores resultados y una gran calidad en cuanto a la experiencia y atención de pacientes.
Se recomienda el empleo de NPD en pacientes con enfermedad benigna y fallo intestinal, ya que demuestra beneficios en el estatus nutricional, calidad de vida y supervivencia. Por otro lado, otros estudios sugieren que en pacientes con cáncer avanzado en tratamiento paliativo, con expectativa de vida de más de tres meses y con fallo intestinal, la calidad de vida puede mejorar sensiblemente con la NPD.
Por último, se demuestra que la NPD es una alternativa con un balance de coste-efectividad adecuado en relación con la atención hospitalaria clásica, lo que redunda en la adopción del criterio de eficiencia como elemento de priorización en sanidad.
9. REFERENCIAS
- ESPEN guidelines on definitions and terminology of clinical nutrition. Clin Nutr. 2017 Feb;36(1):49-64. doi: 10.1016/j.clnu.2016.09.004. Epub 2016 Sep 14.
- ConT-SEE. Terms, concepts and definitions in clinical artificial nutrition. The ConT-SEEN Project Endocrinología, Diabetes y Nutrición (English ed.), Volume 65, Issue 1, January 2018, Pages 5-16.
- de Cos Blanco AI, Gómez Candela C. Concepto, Objetivos, Sistemática de trabajo y composición del Grupo Español de Nutrición Artificial Domiciliaria y Ambulatoria. (NADYA). En: Manual de nutrición artificial domiciliaria y ambulatoria. Procedimientos educativos y terapéuticos. NADYA. Disponible en https:// nadya-senpees.sserver.es/pdf/manualn.pdf
- Wendy Everett, Christina Badaracco, Sharon McCauley, «From hospital to home: Why nutrition counts» Health Affairs, 2020. Disponible en https://www.healthaffairs.org/do/10.1377/hblog20200117.329745/full/
- Plana Vila M et al. The burden of hospital malnutrition in Spain: methods and development of the PREDyCES® study. Nutr Hosp. 2010 Nov-Dec;25(6):1020-4.
- Caplan GA, Sulaiman NS, Mangin DA, Armanino Ricotta N, Wilson AD, Barclay L, A meta-analysis of Hospital in the home, Med J Aust, 2012;197(9):512-9.
- GLIM criteria for the diagnosis of malnutrition – A consensus report from the global clinical nutrition community. Clin Nutr. 2019 Feb;38(1):1-9.
- León-Sanz M et al. PREDyCES study: The cost of hospital malnutrition in Spain. Nutrition. 2015 Sep;31(9):1096-102.
- A.S.P.E.N. Board of Directors and the Clinical Guidelines Task Force. Guidelines for the use of parenteral and enteral nutrition in adult and pediatric patients. JPEN 2002;26:1SA-138SA.
- Gómez Candela C, de Cos Blanco AI. Selección de pacientes candidatos a Nutrición Artificial Domiciliaria y Ambulatoria. En: Manual de nutrición artificial domiciliaria y ambulatoria. Procedimientos educativos y terapéuticos. NADYA. Disponible en https://nadya-senpees. sserver.es/pdf/manualn.pdf
- Wande-Berghe C. Cuerda-Compes C, Álvarez-Hernández J, Pereira-Cunill JL, Carabaña-Pérez F, Gómez-Candela C, Nutrición parenteral domiciliara en paciente oncológicos. Hos Domic 2017, vol. 1, pp. 65-72.
- Moreno Villares JM. Composición de las fórmulas de nutrición parenteral. Nutr Hosp Supl. 2009;2(1):8-12.
- Frandsen BR, Joynt Ke, Rebitzer JB, Jha AK. Care fragmentation, quality and costs among chronically ill patients. AJMC, 2015;21(5): 355-62.
- La eSalud y el Hospital Líquido. Disponible en https://hablandoesalud.wordpress.com/2017/01/09/la-esalud-y-el-hospital-liquido/
- Los nuevos e-Pacientes y la adaptación de los Profesionales de salud. Disponible en https://saludconectada.com/1-3-los-nuevos-e-pacientes-la-adaptacion-los-profesionales-salud/?shared=email&msg=fail
- RAE. Diccionario de la Lengua Española. In Real Academia Española; 2018. Available from: http://dle.rae.es/?id=KnbmIsL
- Plan de Humanización de la Asistencia Sanitaria 2016-2019: Consejería de Sanidad de Madrid. Disponible en https://www.comunidad.madrid/transparencia/sites/default/files/plan/document/881_232_bvcm017902_0.pdf
- Cozzaglio L, Balzola F, Cosentino F, DeCicco M, Fellagara P, Gaggiotti G, Gallitelli L, Giacosa A, Orban A, Fadda M, Gavazzi C, Pirovano F, Bozzetti F. Outcome of cancer patients receiving home parenteral nutrition. Italian Society of Parenteral and Enteral Nutrition (S.I.N.P.E.). JPEN J Parenter Enteral Nutr 1997;21(6):339-42.
- Ruggeri E et al. Home artificial nutrition in palliative care cancer patients: Impact on survival and performance status. Clin Nutr. 2020 Feb 22. pii: S0261-5614(20)30084-4.
- Gómez Enterría P, Laborda González L. Preparación, métodos y pautas de administración de la nutrición parenteral domiciliaria. Seguimiento de los pacientes. Educación a pacientes y cuidadores. Nutr Hosp Supl. 2009;2(1):18-24.
- Segura A, Pardo J, Jara C, Zugazabeitia L, Carulla J, de las Peñas R, et al, An epidemiological evaluation of the prevalence of malnutrition in Spanish patients with locally advanced or metastatic cancer. Clin Nutr.2005; 24(5):801-14. S
- Pressoir M, Desne S, Berchery D, Rossignol G, Poiree B, Meslier M, et al, Prevalence, risk factors and clinical implications of malnutrition in French Comprehensive Cancer Centres. Br J Cancer 2010;102(6):966e71.
- C. Gómez Candela et al. Soporte Nutricional en el Paciente Oncológico. Capítulo XIII Nutrición artificial domiciliaria en el paciente oncológico. Disponible en https://seom.org/seomcms/images/stories/recursos/infopublico/publicaciones/soporteNutricional/pdf/cap_13.pdf
- Nutrición parenteral domiciliaria en España 2017. Informe del Grupo de Nutrición Artificial Domiciliaria y Ambulatoria NADYA. Disponible en https://dialnet.unirioja.es/servlet/articulo?codigo=6718855
- González Aguilera B et al. Documento de consenso de expertos de Andalucía y Extremadura sobre la nutrición parenteral domiciliaria. Nutr Hosp 2017;34(4): 784-91.
- Wanden-Berghe C, Pereira Cunill JL, Cuerda Compés C, Moreno Villares JM, Pérez de la Cruz A, Burgos Peláez R, et al. Nutrición parenteral domiciliaria en España durante 2014. Informe del Grupo de Nutrición Artificial Domiciliaria y Ambulatoria NADYA. Nutr Hosp 2015;32:2380-4.
- Roskott AM, Groen H, Rings E, Haveman J, Ploeg RJ, Serlie MJ, et al. Cost-effectiveness of intestinal transplantation for adult patients with intestinal failure: A simulation study. Am J Clin Nutr 2015;101:79-86.
- Calvo MV, Sirvent M (coordinadoras). Estándares de práctica del farmacéutico de hospital en el soporte nutricional especializado: desarrollo y criterios de evaluación. Farm Hosp. 2009;33 (supl 1):5-80.
- Curso SEFH de Nutrición Artificial Domiciliaria. Disponible en http://formacion.sefh.es/dpc/sefh-curso-nutricion/curso-nutricion-modulo10.pdf
- Pérez JJ, García J, Tejedor M. Gestión clínica: conceptos y metodología de implantación. Rev Calidad Asistencial 2002;17(5):305-11.
AGRADECIMIENTOS
El agradecimiento o gratitud debe estar siempre presente en nuestras vidas, de ello se nutre nuestra alma. Así lo reflejó el genial Miguel de Cervantes en “El ingenioso hidalgo don Quijote de La Mancha”. Cuando Don Quijote deja en libertad a los galeotes que iban a las galeras y ellos se burlaron del mismo, les espetó: “de gente bien nacida es agradecer los beneficios que reciben, y uno de los pecados que más a Dios ofende es la ingratitud”. Mi profundo agradecimiento a los miembros de esta Real Academia Nacional de Farmacia por el indescriptible honor que me hacen con este nombramiento y por su amable acogida. Asimismo, quiero expresar mi agradecimiento a la Junta de Gobierno de esta Real Academia por haberme elegido como Académico Correspondiente, y a la Sección Quinta “Salud Pública, Alimentación y Medio Ambiente” por haberme propuesto; en especial a mi mentor y director de tesis doctoral, el Excmo. Sr. D. Francisco José Sánchez Muniz. Al profesor Sánchez Muniz le agradezco las muchas enseñanzas que me ha brindado, su buen humor y empatía, la importancia del trabajo en equipo, persistir y no rendirse nunca, explorar hasta el infinito y, sobre todo, su amistad y confianza. Quisiera reiterar mi agradecimiento a esta insigne institución por este nombramiento como Académico Correspondiente.
Doy gracias a mi familia, en particular a José Manuel, mi padre, y a María del Carmen, mi madre; también a mi pareja Pilar y a mi hija Gabriela, y a todos los amigos que me han acompañado y a buen seguro me acompañarán en mi camino vital. La familia es la cuna donde la vida comienza, a partir de ahora será un honor para mí formar parte de esta nueva familia académica.
ANEXO I. ABREVIATURAS
DRE, la desnutrición relacionada con la enfermedad; ESPEN, European Society of Parenteral and Enteral Nutrition; HCE, Historia Clínica Electrónica; KPS estado de funcionalidad de Karfnosky; MNA, mini-nutritional assessment; NAD, nutrición artificial fuera del ámbito hospitalario o domiciliaria; NADYA, Nutrición Artificial Domiciliaria y Ambulatoria; NC, nutrición clínica; NE, nutrición enteral; NED, nutrición parenteral domiciliaria; NP, nutrición parenteral; NPD, nutrición parenteral domiciliaria; NRS, nutritional Risk Screening; SEFH, Sociedad Española de Farmacia Hospitalaria; SFH, Servicios de Farmacia Hospitalaria; SENPE, Sociedad Española de Nutrición Parenteral y Enteral; SN, soporte nutricional; SNE. Soporte Nutricional Especializado; TICs, Tecnologías de la Información y Comunicación; UHD, Unidad de Hospitalización a Domicilio.