RESUMEN:
El cannabidiol está despertando un creciente interés como agente antitumoral. Sin embargo, no se ha estudiado su efecto en cáncer de ovario, uno de los tumores más agresivos en mujeres. En el presente trabajo se ha evaluado, por primera vez, el potencial uso del cannabidiol en solución y encapsulado en nanopartículas funcionalizadas con ácido fólico en cáncer de ovario, ya que estos tumores sobreexpresan los receptores de ácido fólico, permitiendo una acumulación selectiva de estas nanoformulaciones en las células tumorales. El cannabidiol en solución inhibe la proliferación y migración de las células SKOV-3. En terapia de combinación, aumenta significativamente la eficacia antitumoral del paclitaxel, presentando un efecto sensibilizador y sinérgico. En los modelos in ovo, la administración previa de cannabidiol en solución seguido de su coadministración con paclitaxel muestra un efecto inhibitorio sobre el crecimiento tumoral significativamente superior al paclitaxel en monoterapia. Las nanopartículas desarrolladas son eficazmente internalizadas por las células SKOV-3, presentando las nanopartículas con ácido fólico una captación más rápida. Aunque en los estudios de eficacia antitumoral in vitro las nanopartículas funcionalizadas no presentan una actividad antiproliferativa superior al cannabidiol en solución o a las nanopartículas no funcionalizadas, en los modelos in ovo su eficacia antitumoral es significativamente superior, indicando que el desarrollo de nanopartículas funcionalizadas con ácido fólico es una buena estrategia para vectorizar el cannabidiol a tumores de ovario. Por último, las nanopartículas de cannabidiol potencian el efecto antitumoral del paclitaxel, presentando las formulaciones funcionalizadas con ácido fólico una mayor eficacia que el cannabidiol en solución.
Palabras Clave: Ácido fólico, cannabinoides, cáncer de ovario, canoencapsulación, paclitaxel, terapia de combinación, vectorización activa
ABSTRACT:
Cannabidiol has become in a potential anticancer agent. Nevertheless, it has not been evaluated in ovarian cancer, one of the most aggressive tumors in women. In this work, the potential use of cannabidiol in solution and encapsulated into polymeric nanoparticles coated with folic acid was evaluated for the first time for the treatment of ovarian cancer. Ovarian tumors over-express folic acid receptors and folic-acid-coated nanoformulations trend to be selectively accumulated at tumor site. Cannabidiol in solution administered as monotherapy inhibits the proliferation and migration of SKOV-3 cells. In combination therapy, it significantly increases the antitumor efficacy of paclitaxel, showing a sensitizer and synergistic effect. In ovo, the previous administration of cannabidiol in solution followed by its co-administration with paclitaxel, shows a significantly higher inhibitory effect on ovarian tumor growth than single paclitaxel. The developed nanoparticles are efficiently uptaken by SKOV-3 cells, showing folic acid coated formulations a faster internalization. Although coated formulations do not exhibit a higher in vitro antiproliferative effect compared to cannabidiol in solution or non-coated formulations, in ovo its antitumoral efficacy is significantly higher. This indicates thatfolic acid-coated nanoparticles represent a good strategy to target cannabidiol to ovarian tumors. Finally, cannabidiol-loaded nanoparticles improve the in vitro antiproliferative effect of paclitaxel, showing folic acid-coated-formulations a better efficacy than cannabidiol in solution.
Keywords: Folic acid, cannabinoids, nanoencapsulation, ovarian cancer, paclitaxel, combination therapy, active targeting
1. INTRODUCCIÓN
El cáncer constituye un importante problema de salud pública global, con una estimación de más de 23 millones de casos en el año 2030 (1). En la población femenina, el cáncer de ovario constituye una de las neoplasias más importantes debido a su elevada mortalidad, solo el 45 % de las mujeres presentan una tasa de supervivencia superior a 5 años. De hecho, esta patología es conocida como el “asesino silencioso”, ya que en la mayor parte de los casos (≈80%) es diagnosticado en estadios avanzados de la enfermedad, al presentar una sintomatología inespecífica que se confunde con otras patologías (2, 3), lo que dificulta el tratamiento y aumenta considerablemente la mortalidad.
La resección quirúrgica del tumor constituye la principal estrategia terapéutica, y suele combinarse con otras estrategias disponibles, principalmente con quimioterapia, debido, sobre todo, al riesgo de diseminación de las células tumorales por la cavidad intraperitoneal durante la operación (4, 5).Por lo general, los regímenes quimioterápicos utilizados incluyen una combinación de un “compuesto de platino” (cisplatino o carboplatino) y un taxano (paclitaxel o docetaxel). La doxorrubina, gemcitabina y ciclofosfamida, entre otros, también son utilizados en el tratamiento de cánceres ováricos (6).
Los tratamientos quimioterápicos actuales son, en su mayoría, muy tóxicos y presentan efectos adversos considerables que limitan la dosis utilizada y comprometen, en muchos casos, la adherencia al tratamiento (7, 8). En este contexto, la aparición de nuevos agentes anticancerígenos con una menor toxicidad y que potencien la actividad de los tratamientos actuales resulta altamente beneficioso, ya que nos permitirían reducir la dosis de los quimioterápicos convencionales y, por consiguiente, los efectos adversos sin repercutir en la eficacia terapéutica. Uno de estos nuevos potenciales agentes antitumorales son los cannabinoides.
En las últimas décadas, los cannabinoides han surgido como potenciales activos de interés en una gran variedad de patologías tales como esclerosis múltiple, epilepsia, dolor y cáncer (9, 10). De hecho, diversas formulaciones a base de cannabinoides están comercializadas para el tratamiento de diversos trastornos. Precisamente, una de las patologías donde presentan un importante potencial terapéutico es el cáncer. Por un lado, los cannabinoides son útiles como agentes paliativos, al combatir las náuseas y vómitos relacionados con los tratamientos quimioterápicos y el dolor relacionado con el cáncer; de hecho, diversas formulaciones a base cannabinoides están comercializadas con este propósito. Por otro, como agentes antitumorales per se, al inhibir la proliferación, migración e invasión de las células tumorales y al presentar un potencial efecto coadyuvante con quimioterápicos convencionales (11, 12).
En terapia antitumoral, el cannabidiol es uno de los cannabinoides más prometedores (13). Es el segundo fitocannabinoide más abundante, por detrás del Δ9-tetrahidrocannabinol, cuya principal ventaja frente a otros es la ausencia de efectos psicótropos (14). De hecho, diversas investigaciones han demostrado que el CBD disminuye los efectos psicótropos del Δ9-tetrahidrocannabinol (15). El CBD ha demostrado un importante potencial anticancerígeno en una gran variedad de tumores tales cómo cáncer de mama, próstata, glioma, neoplasias hematológicas y tumores gastrointestinales, entre otros (16-18). Sin embargo, el potencial antitumoral de los cannabinoides en general y el CBD en particular, no ha sido evaluado en cáncer de ovario. No obstante, cabe destacar que el sistema cannabinoide endógeno, concretamente los receptores específicos de cannabinoides tipo I se han encontrado sobreexpresados en tumores de ovario, estando relacionada esta sobreexpresión con una mayor agresividad de la enfermedad. Esto sugiere que los cannabinoides pueden presentar un importante potencial terapéutico en este tipo de tumores (19).
Además, el CBD ha demostrado ser útil en terapia de combinación al potenciar, por ejemplo, el efecto antiproliferativo de la vinblastina y vincristina en leucemia (20, 21) y de la temozolomida en glioma (22, 23). De hecho, actualmente se están llevando a cabo diversos ensayos clínicos para evaluar el potencial del CBD en combinación con radioterapia y/o los tratamientos quimioterápicos convencionales en glioma, mieloma múltiple y tumores gastrointestinales (NCT03607643, NCT03529448, NCT03246113).
Sin embargo, a pesar del potencial terapéutico del CBD su elevada liposolubilidad dificulta el diseño y desarrollo de formulaciones eficaces, siendo necesario el uso de solventes no acuosos y surfactantes para su administración (24). El uso de nanopartículas poliméricas como trasportadores de CBD permitiría su administración en vehículos acuosos. Además, desde el punto de vista terapéutico, el uso de estos sistemas resultaría altamente beneficioso en terapia antitumoral. El endotelio vascular alterado y el menor drenaje linfático que caracteriza a los tumores hace que los nanosistemas tiendan a acumularse a nivel tumoral (25).
Por otro lado, la incorporación de ligandos reconocidos por receptores sobreexpresados en las células tumorales posibilitaría una mayor captación por parte de los tumores, incrementando la eficacia terapéutica (26). En cáncer de ovario, un ligando prometedor es el ácido fólico, ya que el 90 % de los tumores de ovario sobreexpresan receptores de folato (27, 28). Por todo ello, en este trabajo se han diseñado nanopartículas poliméricas de CBD funcionalizadas con ácido fólico. Se seleccionó el polímero biocompatible y biodegradable PLGA, ya que está aprobado por la FDA para diversas aplicaciones biomédicas.
El objetivo del presente trabajo de investigación ha sido diseñar, desarrollar y evaluar nanopartículas poliméricas de CBD eficaces para el tratamiento de cáncer de ovario en monoterapia o en combinación con agentes antineoplásicos convencionales.
2. MATERIALES Y MÉTODOS
2.1 Materiales
El CBD es de THC-Pharma (Alemania), y la DOX, CIS y PTX, son de Fisher-Scientific (España). El resómero de PLGA-RG®-502 (PLGA-502) (v.i. 0.16–0.24 dL/,) de Evonik®(Alemania) y el alcohol polivinílico de Sigma-Aldrich (USA). El ácido fólico y todos los reactivos de funcionalización son Fisher-Scientific (España). Todos los solventes orgánicos utilizados (etanol, metanol, acetonitrilo y diclorometano) son grado HPLC (Fisher-Scientific, España). El reactivo MTT es de Sigma-Aldrich (USA). El medio de cultivo RPMI-1640- GlutaMAX™-I, la Tripsina (0.25 %), gentamicina (10 mg/ml), glutamina y la matriz extracelular Geltrex® son de Gibco (Life-Technologies, USA). El suero bovino fetal es de Biowest (Francia) y el kit de apoptosis con Annexin-V FITC ioduro de propidio (V13242) de Invitrogen (Life-Technologies, USA).
2.2 Cultivos celulares
Las líneas celulares SKOV-3 y OAW-42 de cáncer de ovario son de American Type Culture Collection (ATCC) y de European Collection of Authenticated Cell Cultures (ECACC) respectivamente. Las células se mantuvieron a 37 ºC con un 5 % de CO2, utilizando RPMI-1640 enriquecido con glutamina (200 mM) y RPMI-1640 GlutaMAX™ como medio de cultivo para la células OAW-42 y SKOV-3 respectivamente. El medio de cultivo se suplemento con suero bovino fetal (10 % v/v) y gentamicina (1 % v/v). Los experimentos se realizaron entre los pases celulares 5-30.
2.3. Actividad antitumoral in-vitro del CBDsol
2.3.1.Estudios de viabilidad celular
La actividad antiproliferativa del CBDsol se evaluó en las células OAW-42 y SKOV-3. Las células se sembraron en placas de 96 pocillos (1.5 104 células/ cm2) y se trataron (24 horas después) con CBDsol (6.25-50 µM) durante 24 y 48 horas. La viabilidad celular se determinó mediante MTT. Como control negativo y positivo de muerte celular se emplearon células tratadas con medio de cultivo y Triton-X (1 % v/v), respectivamente. La solución patrón de CBD se preparó en etanol absoluto (20 mM) y se diluyó con medio de cultivo. Se calcularon los valores de CI50 de CBD utilizando el programa CompuSyn-Software (ComboSyn, ,USA). En células SKOV-3 también se evaluó el efecto de concentraciones bajas de CBD (100-1000 nM) tras 24, 48 y 72 horas de incubación.
2.3.2. Evaluación de apoptosis
Las células SKOV-3 se trataron con CBD en solución (20 y 30 µM) durante 24 y 48 horas. A continuación, las células se levantaron, tiñeron con Annexin V-FITC y ioduro de propidio, y se mantuvieron en oscuridad a temperatura ambiente durante 15 minutos. Posteriormente, se analizaron mediante el citómetro FACSCan BectonDickinson, USA).
2.3.3. Ensayos de migración celular
El efecto del CBDsol en la migración de células tumorales de ovario se evaluó en las células SKOV-3 (altamente invasiva) mediante:
- Ensayo de “cierre de la herida”
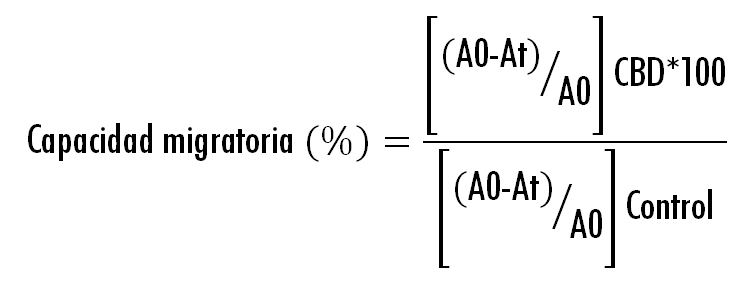
Las células se sembraron en placas Ibidi de 8 pocillos a una densidad de (55000 células/pocillo). Tras 24 horas, las células, completamente confluentes, se trataron con mitomicina-C (25 μg/ml) durante 30 minutos para inhibir la proliferación celular. En la monocapa celular se generó un hueco con una pipeta de 200 µLy se trataron con CBD (5 y 15 µM) durante 24 horas. A diferentes tiempos (0, 12 y 24 horas) las células se fotografiaron para evaluar la migración celular a través del hueco generado, determinando el área del hueco a cada tiempo mediante el software Image J. La capacidad migratoria de las células (%) se determinó de manera relativa con respecto al control (células tratadas con medio de cultivo) utilizando la siguiente ecuación (29):
Donde A0 es el área del hueco generado a t=0 y At el área a t= 6 o 24 horas.
- Ensayo de migración Transwell
Las células se sembraron en insertos Transwell (8 µm de tamaño de poro) de placas de 24 pocillos (105 células/inserto) (Falcon, USA) y se trataron con CBDsol (15 y 30 µM) durante 24 horas. Las células presentes en la parte superior del inserto se eliminaron con una torunda de algodón. Las células que migraron a la parte inferior del inserto se fijaron con metanol y se tiñeron con cristal violeta (0.1 % v/v). Tras varios lavados, el cristal violeta se extrajo con una solución de ácido acético al 10 % y la absorbancia se midió a 595 nm. Paralelamente, se llevó a cabo un ensayo de viabilidad celular (105 células/ pocillo en placas de 24 pocillos) para corregir los resultados del experimento de migración celular.
Finalmente, se calcularon los porcentajes de migración celular, expresados de manera relativa con respecto al control (100 %).
2.3.4. Ensayos de invasión celular
El efecto del CBDsol en la invasión de las células SKOV-3 se determinó mediante el ensayo tipo Transwell. Los insertos Transwell (8 µm de tamaño de poro) de placas de 24 pocillos (Falcon, USA) fueron previamente cubiertos con una solución de Geltrex (150µL/cm2). Las células SKOV-3 se añadieron a la cámara superior del inserto en medio de cultivo libre de suero bovino. En la cámara inferior se añadió medio de cultivo con suero al 10 % como quimioatrayente. El CBDsol (15 and 30µM) se añadió en ambas cámaras. Después de 24 horas, los insertos se lavaron cuidadosamente con PBS y las células remanentes en la cámara superior se eliminaron con una torunda de algodón. A continuación, las células presentes en la cámara inferior del inserto (células que han invadido) se fijaron, tiñeron y cuantificaron siguiendo el protocolo descrito en el apartado 2.3.3 para el ensayo de migración Transwell.
Los resultados obtenidos se corrigieron con los datos de viabilidad celular. El porcentaje de invasión también se calculó y expresó de manera relativa con respecto al control (100 %).
2.3.5. Estudios de combinación con otros antineoplásicos
– Estudios de sensibilización (preadministración):
El objetivo es evaluar si la administración previa de concentraciones subterapéuticas de CBD (muerte celular <10 %) incrementa la sensibilidad de las células tumorales de ovario al PTX, DOX y CIS. Las células SKOV-3 se sembraron en placas de 96 pocillos (1.5 104 células/cm2) y se trataron, 24 horas después, con CBDsol (1 y 10 µM). A continuación, las células se trataron exclusivamente con PTX (10-500 nM), DOX (0.5-60 µM) y CIS (1-100 µM). Tras 48 horas de incubación se determinó la viabilidad celular mediante MTT y se calcularon los valores de CI50 . Se consideró que se producía un efecto sensibilizador si había una disminución estadísticamente significativa en los valores de CI50 en las células pretratadas con CBD. – Estudios de sinergismo (coadministración): Las células SKOV-3 se sembraron en placas de 96 pocillos (1.5 104 células / cm2) y se trataron, 24 horas después, con las diferentes combinaciones de CBD en solución (10, 15 y 20 µM) y PTX (10-500 nM), DOX (0.5-60 µM) o CIS (1-100 µM). Tras 48 horas, la viabilidad celular se determinó mediante MTT. Se calcularon los valores de CI50 y los IC utilizando el Software CompuSyn (30). IC >1 indican antagonismo, IC= 1 efecto aditivo y IC<1 sinergismo(31).
También se determinó el efecto de la combinación de CBD y PTX en la inducción de apoptosis. Las células SKOV-3 se trataron con PTX (100 nM) o PTX (100 nM)+ CBD 20 µM durante 48 horas. La apoptosis se determinó por citometría de flujo siguiendo el protocolo descrito en el apartado 2.3.2.
– Pre + coadministración:
Las células SKOV-3 se sembraron en placas de 96 pocillos (1.5 104 células / cm2) y se trataron, 24 horas después, con CBDsol (10 µM) durante 24 horas. A continuación, el medio se descartó, y las células se trataron con las combinaciones de CBD (10µM) + PTX (10-500 nM) durante 48 horas. La viabilidad celular se determinó por MTT y se calcularon los valores de CI50.
2.4.Actividad antitumoral in vivo del CBD en solución
2.4.1. Actividad del CBDsol en monoterapia
La actividad anticancerígena del CBDsol también se terminó in vivo, usando el modelo “in ovo“, en el que los tumores se generan sobre la MCA de embriones de pollo (32). Los huevos de gallina fecundados (DDE=0) se incubaron a 37 °C y 47 % de humedad relativa, bajo rotación automática(180 ºC / 4 horas). El DDE=4, se realiza un pequeño orificio (3 mm) en la cáscara del huevo, se tapa con cinta adhesiva y se introducen de nuevo en el incubador sin rotación. El DDE=8, el orificio se agranda y la MCA se “araña” suavemente sin comprometer la viabilidad del embrión. A continuación se inoculan las células SKOV-3 (2•106 cells/huevo) suspendidas en una solución de Geltrex®. El DDE=11, los tumores ya formados, se rodean con un anillo de silicona y se tratan con: CBDsol diariamente (100 µM) y medio de cultivo RMPI 1640 que sirve como control. Al menos se trataron 7 huevos por condición. Los huevos se mantuvieron en el incubador hasta el DDE=13.5. El crecimiento del tumor se monitorizó por microscopía (Lumenera INFINITY2-1 CDD), calculando el área de los tumores antes y después del tratamiento, utilizando la siguiente ecuación:
Crecimiento tumoral (%)=[Área del tumor antes del tratamiento ]DDE:11*100/ [Área del tumor tras el tratamiento] DDE:13.5
2.4.2. Actividad del CBDsol en combinación con PTX
La combinación del CBD y PTX también se ha evaluado en este modelo, utilizando el protocolo de pre + coadministración. El DDE=11, los tumores se trataroncon CBD en solución (100 µM) o medio RPMI-1640 durante 24 horas. A continuación, en el DDE=12 se administró el PTX (100µM). El CBD en solución se añade diariamente hasta el DDE=13.5. Al menos se trataron 7 huevos por condición. El crecimiento del tumor se monitorizó tal y como describimos en el apartado anterior (2.4.1).
2.5. Desarrollo de las nanopartículas de CBD
2.5.1. Elaboración de las nanopartículas de CBD
Se empleó el método de evaporación-extracción del solvente. La fase orgánica (PLGA+ CBD disueltos en 1 ml de diclorometano), se goteó sobre una solución acuosa de PVA y se sonicó (Fisher Scientific-Sonicator,USA). La suspensión resultante se mantuvo en agitación (500 rpm) durante 3 horas a temperatura ambiente para evaporar el diclorometano. Las nanopartículas se recolectaron por centrifugación (15000 rpm durante 35 minutos) (Beckman-Coulter-Avanti, USA), se lavaron tres veces con agua desmineralizada para eliminar el exceso de PVA y se liofilizaron durante 24 horas a −50 ºC y 0.2 mbar. Como crioprotector se añadió 1 ml de una solución de sacarosa al 3 % (p/v). Para la optimización del protocolo de elaboración de la formulación se emplearon diferentes porcentajes de CBD (1,5-3 %); diferentes porcentajes de PVA (1 y 3 %) y diferentes tiempos de sonicación (2-5).
2.5.2.Funcionalización de las nanopartículas de CBD
El ácido fólico se incorporó a la superficie de las nanopartículasno liofilizadas y recién preparadas. En primer lugar, se activaron los grupos COOH libres de la superficie de las nanopartículas mediante la adición de 1-etil-3-(3-dimetilaminopropil) carbodiimida y N-hidroxisuccinimida( pH de 4.7). La suspensión se mantuvo en agitación durante 2 horas. Las nanopartículas se recolectaron por centrifugación, se re-suspendieron en PBS (pH 7.4, 9 ml) que contenía 6 mg de ácido fólico y se mantuvieron en agitación 4 horas. Finalmente, las formulaciones funcionalizadas se recolectaron y liofilizaron.
2.5.3. Caracterización de las nanopartículas de CBD no funcionalizadas y funcionalizadas con ácido fólico
Las nanopartículas se caracterizaron determinando:
– Tamaño de partícula, índice de polidispersión y potencial zeta:
Se determinaron por dispersión dinámica de luz láser Microtrac®-Zetatrac™ Particle-Analyzer (Microtrac, USA).
– Morfología
Las nanopartículas se suspendieron en agua purificada y añadieron sobre una oblea de silicio adherida a un soporte metálico. Se secaron a vacío, se metalizaron con una capa de 20 nm de oro y se observaron al microscopio electrónico de barrido (Jeol-JSM-6335F, Japón).
– Determinación del contenido en CBD y eficacia de encapsulación
Las nanopartículas liofilizadas se disolvieron en diclorometano (5 mg/ml). El CBD se extrajo con la adición de fase móvil de HPLC en agitación. Las muestras se filtraron y analizaron por HPLC (33). La eficacia de encapsulación se calculó mediante la siguiente ecuación:
– ATR
La presencia de ácido fólico en la superficie de las nanopartículas se confirmó mediante espectroscopia infrarroja utilizando la técnica de ATR (Attenuated Total Reflection) mediante el espectofotómetro Nicolet-Magna-750 equipado con Spectra-Tech H-ATR (LabX, USA) en un rango de 4000 a 400 cm−1.
– Estudios de liberación in vitro del CBD
Las nanopartículas de CBD liofilizadas se suspendieron (5 mg/ml) en PBS (pH=7.4 +Tween-80 0.5 % (p/v)) y se introdujeron en un baño termostatizado a 37±0.5 ºCon una agitación constante de 100 rpm. A distintos tiempos, se extrajeron alícuotas, se centrifugaron, filtraron y analizaron por HPLC.
2.5.4. Estudios en cultivos celulares
– Eficacia antitumoral in vitro
La citotoxidad de las formulaciones de CBD en un rango de concentraciones de CBD de 5-50 µM, se evaluó en las células SKOV-3 siguiendo el protocolo descrito en el apartado 2.3.1.
– Estudios de internalización:
La captación de las nanopartículas no funcionalizadas y funcionalizadas con ácido fólico se evaluó por microscopía de fluorescencia empleando las nanopartículas cargadas con DiO. Las células SKOV-3 se sembraron, a una densidad de 30000 células/pocillo en placas Ibidi de 8 pocillos. 12 horas más tarde se trataron con una concentración de nanopartículas de 1 mg/ml y se incubaron a 37 ºC y un 5 % CO2 durante 0.5, 1, 2, 4, 6 y 8 horas. A cada tiempo, las células se lavaron con PBS, fijaron con paraformaldehído 4 % (p/v), tiñeron con DAPI y red-Phalloidin y se observaron por microscopía de fluorescencia (EVOS™, Fisher-Scientific, USA).
2.5.5. Actividad antitumoral in vivo de las nanopartículas de CBD
La actividad antitumoral en monoterapia de las nanopartículasde CBD también se evaluó en tumores derivados de las células SKOV-3 generados sobre la MCA de embriones de pollo, tal y como describimos en el apartado 2.4.1. En el DDE=11 los tumores se trataron diariamente (hasta el DDE=13.5) con las diferentes formulaciones de CBD: i) CBDsol,ii) CBD-Nps y iii) FA-CBD-Nps a una concentración de CBD de 100µM. Las formulaciones de nanopartículas blancas (PLGA-Nps y FA-PLGA-Nps) también se evaluaron.
2.5.6. Estudios de combinación con PTX
Se determinó el efecto antitumoral in vitro de las nanopartículas de CBD, no funcionalizadas y funcionalizadas con ácido fólico en combinación con el paclitaxel (10-500 nM) en las células SKOV-3 siguiendo el protocolo de pre + coadministración recogido en el apartado 2.3.5.
Figura 1: estudios de viabilidad celular de células SKOV-3 (A) y OAW-42 (b) tratadas con CBD (6.25-50μm) durante 24 y 48 horas. Viabilidad celular de células SKOV-3 tratadas con CBD a concentraciones nanomolares (100-1000 nm) durante 24-72 horas
2.6. Análisis estadístico de los resultados
Los datos están expresados como una media ±DE de al menos tres experimentos diferentes. El test ANOVA simple seguido de Test de Turkey se utilizó para la comparación de múltiples grupos. La comparación de dos grupos se realizó utilizando la prueba T-Student. Las diferencias estadísticamente significativas se expresaron como: * (p<0.05) y ** (p<0.01).
3. RESULTADOS Y DISCUSIÓN
3.1. Actividad antitumoral in vitro del CBDsol en monoterapia
El CBD inhibe la proliferación de ambas líneas celulares de cáncer de ovario, OAW-42 y SKOV-3 (Figura 1), siendo estas últimaslas más sensibles al presentar los valores de CI50 más bajos (Tabla 1). Las diferencias encontradas pueden atribuirse a su distinto perfil histológico. Aunque ambas son células tumorales de ovario epiteliales (los tumores más frecuentes), las células OAW-42 son exclusivamente de tipo seroso y las SKOV-3 son una mezcla de tipo seroso y de células claras. Este hecho podría explicar que presenten una mayor sensibilidad al CBD. De hecho, también se han encontrado diferencias con tratamientos quimioterápicos convencionales, como es el caso de los taxanos, siendo las células SKOV-3 mucho más sensibles al PTX y docetaxel (34). Teniendo en cuenta la mayor sensibilidad de las células SKOV-3 al CBD, así como su elevado grado de invasividad; se seleccionaron para el resto de los estudios llevados a cabo en el presente trabajo de investigación.
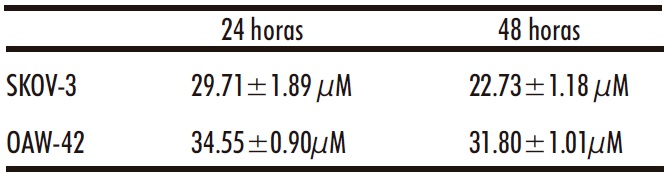
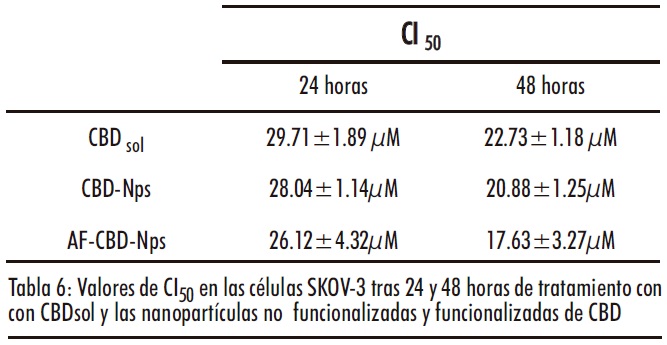
Tabla 1: Valores de CI50 de las células SKOV-3 y OAW-42 tratadas con CBD (6.25-50µM) durante 24 y 48 horas
Hay autores que han demostrado que algunos cannabinoides presentan un efecto bifásico, y a concentraciones bajas (en el intervalo nanomolar) estimulan la proliferación de las células tumorales (35, 36). En el caso del CBD, no se apreció este efecto bifásico, concentraciones de 100-1000 nM no modificaron la viabilidad de las células SKOV-3 durante 24-72 horas de incubación (Figura 1C).
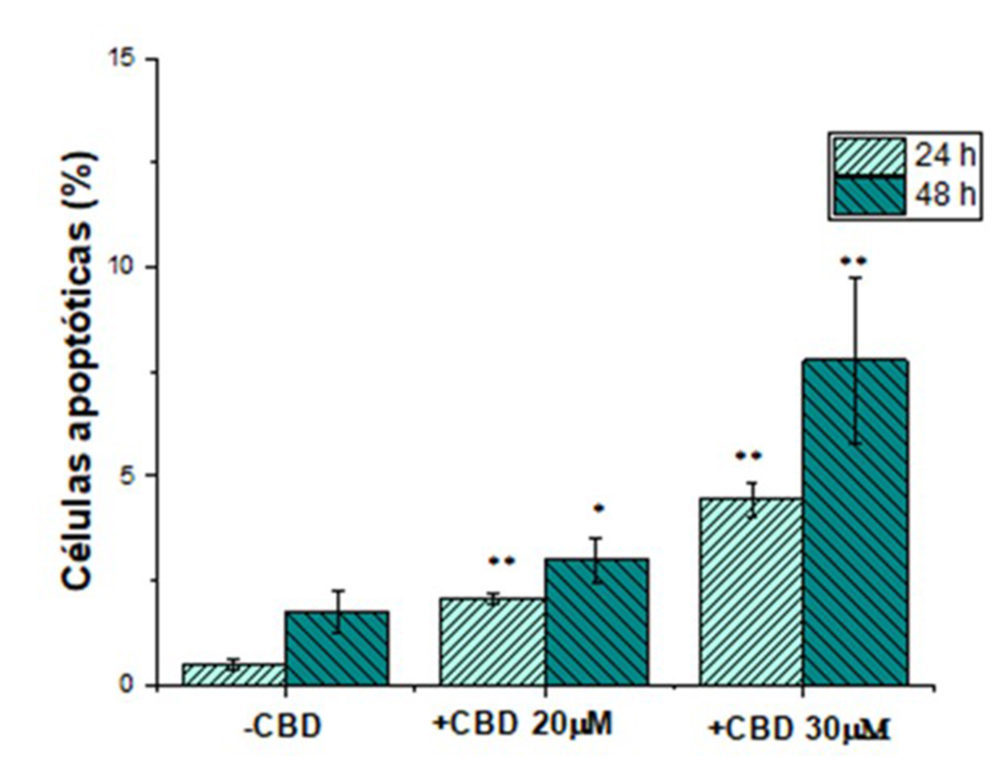
Figura 2: Porcentaje de células SKOV-3 en apoptosis obtenidos por citometría de flujo tras el tratamiento con medio de cultivo (-CBD), CBD 20 y 30μm durante 24 y 48 horas. * (p<0.05) y ** (p <0.01) indican diferencias estadísticamente significativas con el control
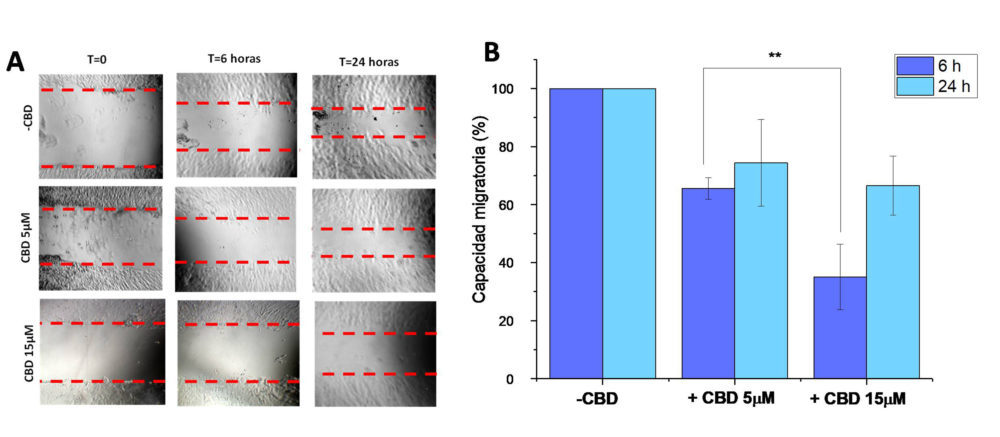
Figura 3: ensayo de migración celular de ” cierre de herida” de las células SKOV-3 tratadas con medio de cultivo (-CBD) y CBD 5 y 15μm durante 6 y 24 horas (A). capacidad migratoria relativa (%) de cada una de las células (b)
La apoptosis es uno de los mecanismos responsables de la muerte celular del CBD (37, 38). En el presente trabajo, la inducción de apoptosis se evaluó por citometría de flujo. Tal y como se puede observar en la Figura 2, el tratamiento del las células SKOV-3 con CBDsol incrementó ligeramente el porcentaje de células apoptóticas. Los valores obtenidos (<10 % en todos los casos) son muy inferiores a los publicados en otros tumores. Por ejemplo, en células de cáncer de cérvix, concentraciones de CBD equivalentes a la CIsol presentaron porcentajes de apoptosis en el intervalo de 28.6-51 % (dependiendo de la línea celular). Esto indica que la inducción de apoptosis no es el mecanismo principal de muerte en las células SKOV-3.
Además del efecto antiproliferativo, algunos autores han demostrado que el CBD inhibe la migración e invasión de células tumorales de mama, glioma y cérvix (39-41). Estas propiedades serían especialmente interesantes en el caso de tumores de ovario, debido a la tendencia a metastatizar. Por ello, en el presente trabajo se ha comprobado el efecto del CBD en la migración e invasión de las células SKOV-3.
Figura 4: resultados de migración (A) e invasión (b) de las células SKOV-3 tratadas con medio de cultivo (-CBD) y con CBD 15 y 30μm durante 24 horas en los ensayos tipo transwell. * diferencias estadísticamente significativas (p<0.05)
Tal y como se puede observar en el ensayo de “cierre de la herida” (Figura 3), el tratamiento con CBD (a concentraciones inferiores a los valores de CI50) inhibe la migración de las células SKOV-3. Sin embargo, diferencias estadísticamente significativas entre ambas concentraciones (p<0.05) solo se observaron a tiempos de incubación cortos. A las 24 horas, se observó una disminución de la capacidad migratoria de las células SKOV-3 en torno al 30 %.
En el ensayo de migración Transwell (Figura 4A), también se observó un efecto inhibitorio de la migración celular, del ≈12 y 30 % a concentraciones de CBD de 15 y 30 µM respectivamente, y aunque deberían realizarse más estudios en este sentido, se puede concluir que el CBD presenta un efecto inhibitorio de la migración de las células SKOV-3. Sin embargo, en el ensayo de invasión tipo Transwell (Figura 4B), solo se observó una ligera inhibición de la invasión de las células SKOV-3 (≈14 %) a concentraciones de CBD de 30 µM.
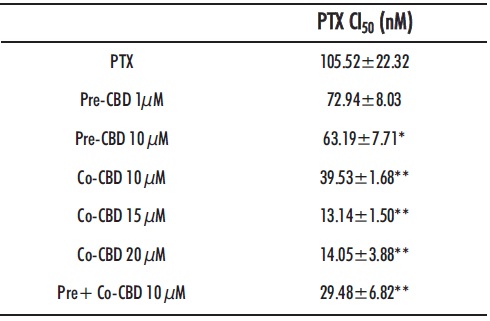
Tabla 2: CI50 del paclitaxel en las células SKOV-3. *y ** indican diferencias estadísticas mente significativas (p<0.05 y p <0.01 respectivamente) entre los valores de CI50 de las células tratadas con PTX y con las diferentes combinaciones de CBD y PTX
3.2. Estudios de combinación del CBDsol
Una vez demostrado el efecto inhibitorio del CBD sobre las células tumorales de ovario, se ha evaluado su combinación con agentes antineoplásicos convencionales utilizados en el tratamiento de tumores ováricos: cisplatino, paclitaxel y doxorrubicina.
La combinación de CBD (1-20µM) y PTX (10-500 nM) fue altamente eficaz. Por un lado, la administración previa de CBDsol sensibilizó a las células SKOV-3 frente al PTX (Figura 5A), observándose una disminución de los valores de CI50 del PTX. Sin embargo, diferencias estadísticamente significativas entre las células pretratadas y no tratadas con CBD solo se observaron con la administración de CBD 10 µM (Tabla2). En la coadministración de ambos compuestos, CBD+PTX, se observó un efecto sinérgico moderado (Figura 5B), ya que se obtuvieron valores de IC comprendidos en el intervalo de 0.71-1.01 en todas las combinaciones (Tabla S1 de material complementario). La coadministración de ambos agentes sería altamente beneficiosa. En primer lugar, hay que tener en cuenta que el CBD presenta, en general, una baja toxicidad, especialmente en comparación con los tratamientos quimioterápicos. En segundo lugar, el efecto sinérgico de ambos compuestos permitiría reducir la dosis de PTX y, por consiguiente, sus efectos adversos. Por ejemplo, la combinación de CBD 10µM y PTX 100 nM produce una muerte celular (≈60 %) similar que la administración de PTX 500 nM. Además, diversos autores han demostrado que el CBD inhibe el dolor neuropático asociado al PTX (42-44), haciendo esta combinación aún más interesante.
Los resultados de citometría de flujo demostraron que este efecto sinérgico del CBD y PTX puede atribuirse a un incremento en la inducción de apoptosis (Figura 5D). Mientras que en las células tratadas con PTX (100 nM) durante 48 horas el porcentaje de células apoptóticas fue en torno al 50 %, en las células tratadas con PTX (100 nM) + CBD (20µM) fue significativamente ( p<0.01) superior (≈80 %). Cabe decir que otros autores encontraron resultados similares en células de cáncer de estómago tratadas con PTX y anandamida (un endocannabinoide), demostrando que este endocannabinoide incrementa de manera considerable la apoptosis inducida por el PTX (45).
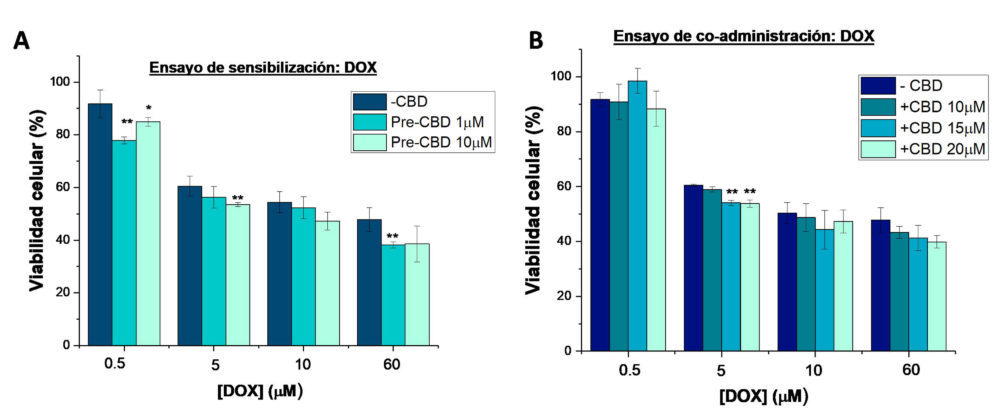
Figura 6: Viabilidad de las células SKOV-3 en los diferentes ensayos de combinación del CBD y DOX: A) ensayo de sensibilización con la administración previa de CBD (1 y 10μm) durante 24 horas, seguida del tratamiento con DOX (0.5-60 μm) durante 48 horas y b) ensayo de coadminsitración con el tratamiento de las células durante 48 horas con las diferentes combinaciones de cbD (10-20μm) y DOX (0.5-60 μm).* (p<0.05) y ** (p<0.01) indican diferencias estadísticamente significativas con el DOX como tratamiento único
Debido a los prometedores resultados obtenidos en los estudios de sensibilización y coadministración con el PTX, se evaluó la combinación de ambos protocolos (pre+co-administración). Tal y como se puede observar en la Figura 5C, esta estrategia de tratamiento resultó altamente efectiva, produciéndose una disminución en los valores de CI50 del PTX en torno al 70 %. De hecho, siguiendo este protocolo la combinación de PTX 10 nM y CBD 10µM produce un efecto similar que la administración de PTX 100 nM.
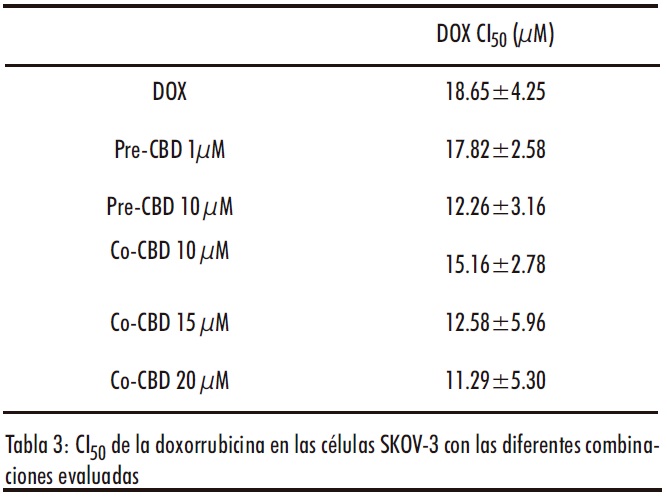
La combinación del CBD con DOX también sería altamente prometedora, ya que el CBD ha demostrado tener un efecto cardioprotector sobre la toxicidad cardiaca inducida por la DOX, su principal efecto adverso (46, 47). Sin embargo, la combinación con el CBD no fue eficaz (Figura 6A). Por un lado, en los estudios de sensibilización, aunque se observó una disminución de los valores de CIsol en las células pretratadas con CBD, no se observaron diferencias estadísticamente significativas (Tabla 3). Por otro lado, la coadministración de CBD (10-20µM) y DOX (0.5-60µM) no resultó eficaz (Figura 6B). De hecho se obtuvieron IC>1 (Tabla S2 material complementario) en todas las combinaciones evaluadas, a excepción de la combinación de DOX 5µM con CBD 10 y 15µM, donde se obtuvieron IC de 0.8 y 0.92 respectivamente, lo que nos indica un antagonismo moderado entre ambos fármacos.
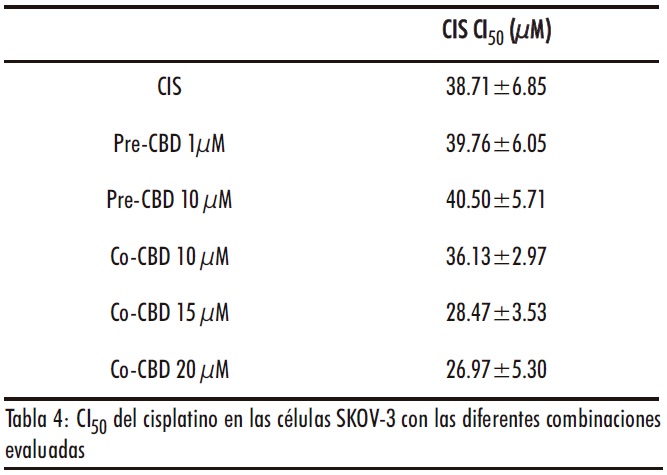
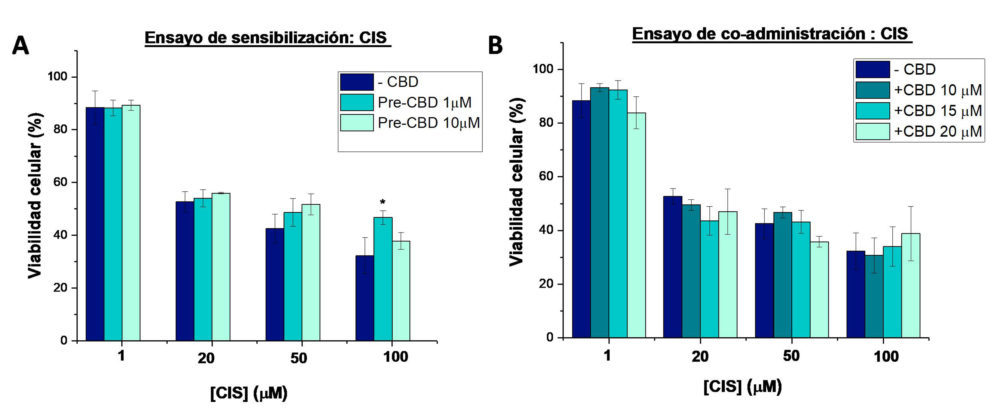
Finalmente, la combinación con CIS también resulto ineficaz (Figura 7 A y B). En las células pretratadas con CBD, se observaron incluso valores de CI50 de CIS ligeramente superiores a las células no tratadas, aunque sin diferencias estadíticamente significativas (Tabla 4).
En los estudios de combinación se obtuvieron IC>1 (Tabla S3 material complementario), incluso superiores a 2 en algunas combinaciones, indicando que se produce un antagonismo ligeramente superior que con la DOX.
3.3. Eficacia antitumoral in ovo del CBDsol
En las últimas décadas este modelo ha sido propuesto como una gran herramienta terapéutica en investigación sobre el cáncer, convirtiéndose en un paso intermedio entre los cultivos celulares y los animales de experimentación (48). Precisamente, uno de los tumores donde más se ha utilizado es el de ovario (49), indicando incluso algunos autores la similitud entre los tumores formados en este modelo con los extraídos de pacientes (50), y convirtiéndolo en una excelente herramienta de investigación.
Figura 7: Viabilidad de las células sKOV-3 en los diferentes ensayos de combinación del cbD y DOX: A) ensayo de sensibilización con la administración previa de cbD (1 y10µm) durante 24 horas, seguida del tratamiento con cIs (1-100 µm) durante 48 horas y b) ensayo de coadministración con el tratamiento de las células durante 48 horas con las diferentes combinaciones de CBD (10-20µm) y CIS (1-100 µm).* (p<0.05) indica diferencias estadísticamente significativas con el CIS como tratamiento único
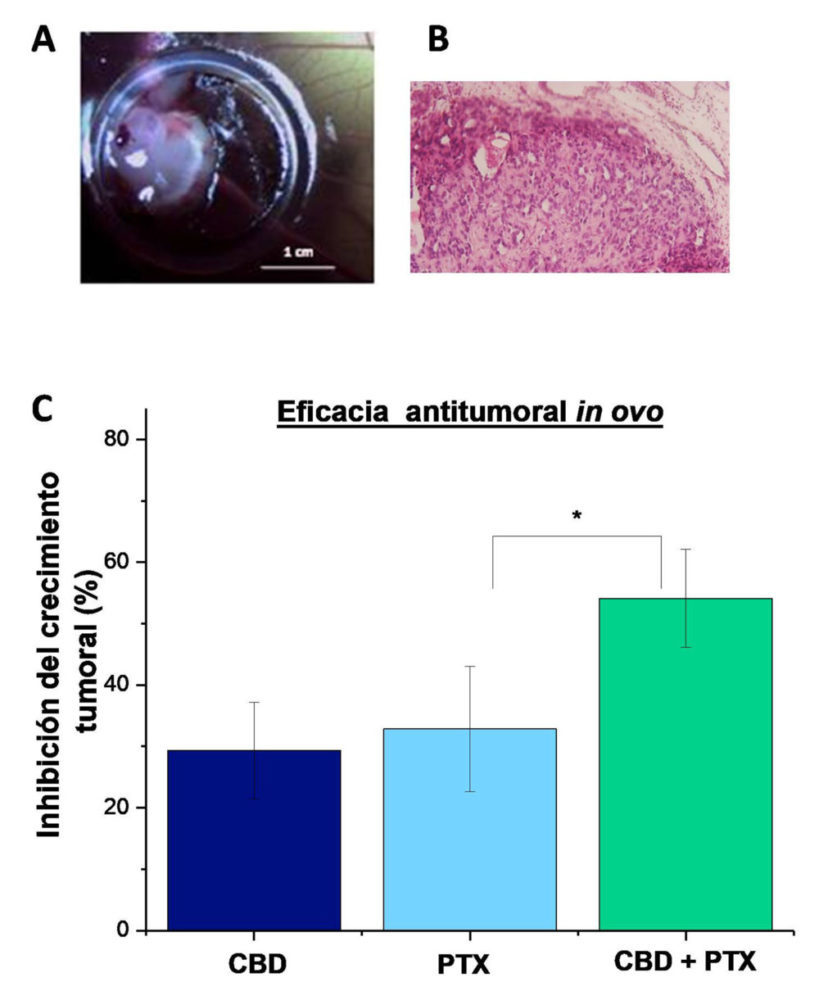
En la Figura 8A, se observa un ejemplo de los tumores de cáncer de ovario generados sobre la MCA de embriones de pollo. El análisis histopatológico del mismo (tinción hematoxilina-eosina) (Figura 8B) indica que las células tumorales invadieron la MCA del embrión, así como la formación de una neovasculatura tumoral.
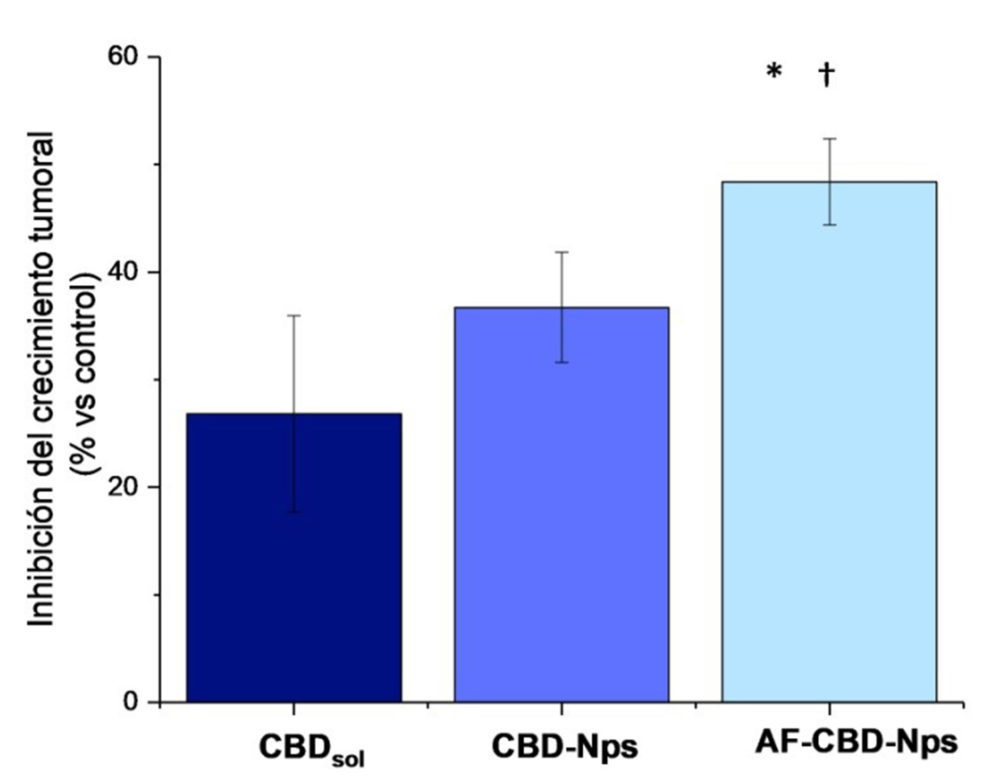
Tal y como se puede observar en la Figura 8C, la administración diaria de CBD durante 60 horas (a una concentración de 100 µM), significativamente (p <0.05), disminuyó el crecimiento de tumores de ovario con respecto al control (tumores tratados con medio de cultivo celular), observándose además un efecto inhibitorio similar (≈40 %) al PTX (100µM una sola administración). Por último, en este modelo, la combinación de CBD y PTX, siguiendo el protocolo de pre + coadministración confirmó los resultados obtenidos en cultivos celulares, corroborando el potencial interés de incluir el CBD en los regímenes de quimioterapia basados en PTX. Mientras que en los tumores tratados únicamente con PTX se observó una disminución del crecimiento tumoral ≈40 %, en los tratados con CBD+PTX, se apreció una reducción significativamente superior (p<0.05) del ≈60% (Figura 8C).
Figura 8: Inhibición del crecimiento tumoral de los diferentes tratamientos administrados: CBD (100μm administrado diariamente), PtX (100 μm una sola administración durante) y la combinación de ambos. *(p<0.05) indica diferencias
estadísticamente significativas entre la combinación de CBD+PtX y el PtX como tratamiento único
3.4. Desarrollo y caracterización de las nanopartículas cargadas con CBD
3.4.1. Caracterización física de las formulaciones
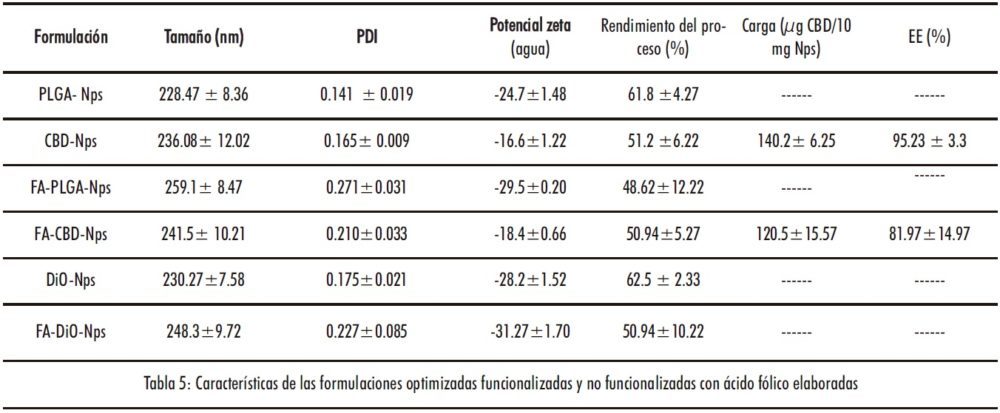
Las características de las formulaciones desarrolladas durante la optimización del protocolo de nanoencapsulación están recogidas en la Tabla S4 de material complementario. Con el objetivo de conseguir el menor tamaño posible, el mayor contenido en CBD y la menor velocidad de liberación se seleccionaron como adecuados para elaborar las nanopartículas poliméricas de CBD un tiempo de sonicación de 2 minutos, una concentración de PVA del 1 % y un ratio de CBD: PLGA de 1.5: 100 mg. La incorporación de ácido fólico a la superficie de las nanopartículas produjo un ligero aumento del tamaño de partícula con respecto a las formulaciones no funcionalizadas (Tabla 5). No obstante, solo se apreciaron diferencias estadísticamente significativas en las nanopartículas no cargadas con CBD. Se observó también un aumento en la polidispersión de las formulaciones, con valores de PDI>0.2 en todas las formulaciones funcionalizadas con ácido fólico.
En cuanto a la carga superficial, cabe destacar que todas las formulaciones presentaron un potencial zeta negativo debido a los grupos carboxilo libres del PLGA. La incorporación de AF a la superficie de las nanopartículas produjo, como era de esperar, una reducción en el valor del potencial zeta aunque, en todos los casos, esta disminución fue muy pequeña. La unión de los grupos carboxilo activados del PLGA con el grupo amino libre del ácido fólico debería producir un aumento de la carga superficial de las nanopartículas; sin embargo, el ácido fólico presenta dos grupos carboxilos libres, siendo, probablemente, los responsables de esta ligera disminución en el potencial zeta de las nanopartículas funcionalizadas. Por otro lado, desde el punto de vista morfológico, no se apreció ningún cambio (Figura 9). Todas las nanopartículas presentaron una forma esférica y una superficie lisa y sin poros.
3.4.2. Carga, eficacia de encapsulación y estudios de liberación
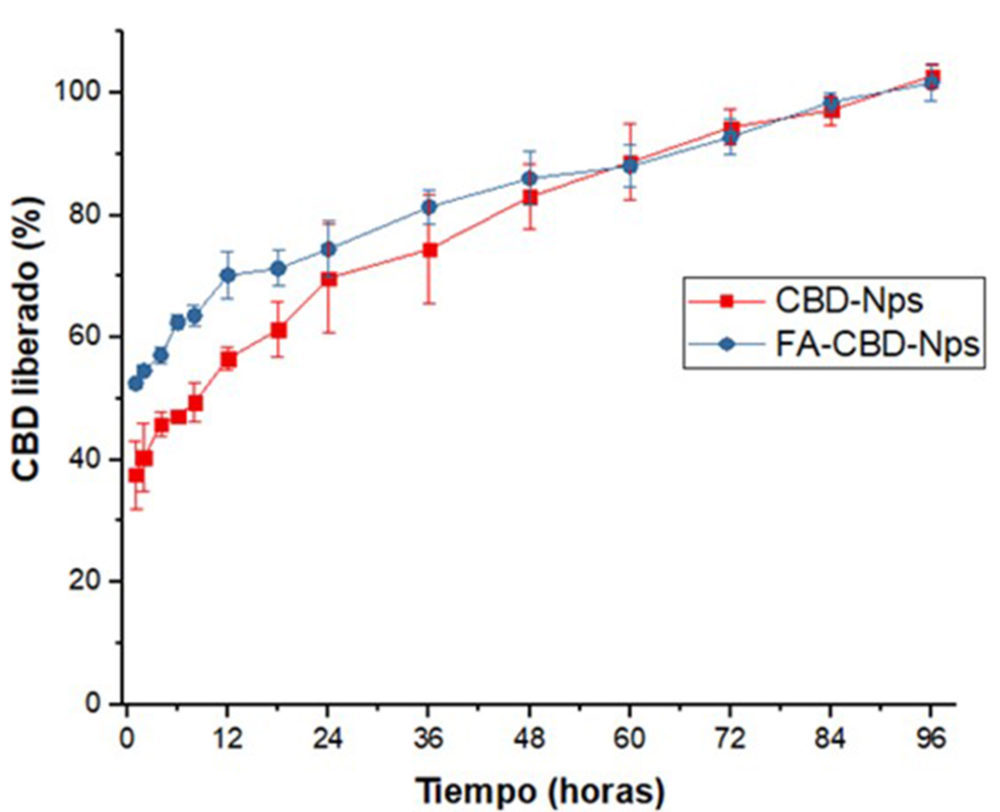
Los valores de carga y eficacia de encapsulación de las formulaciones de CBD están recogidos en la Tabla 5. La incorporación de AF a la superficie de las nanopartículas produjo una disminución no significativa (p>0.05) del contenido en CBD, probablemente, debido a una pérdida durante el proceso de funcionalización. También se observó una liberación más rápida, debido al mayor efecto burst durante los primeros 60 minutos del ensayo (≈37 y 50 % del CBD liberado en las CBD-Nps y FA-CBD-Nps respectivamente) (Figura 10).No obstante, en ambas formulaciones, se apreció una liberación controlada del CBD durante al menos 72 horas, con aproximadamente el 90 % del CBD liberado.
Figura 9: Imágenes obtenidas por microscopía electrónica de todas la nanopartículas desarrolladas
3.4.3. ATR
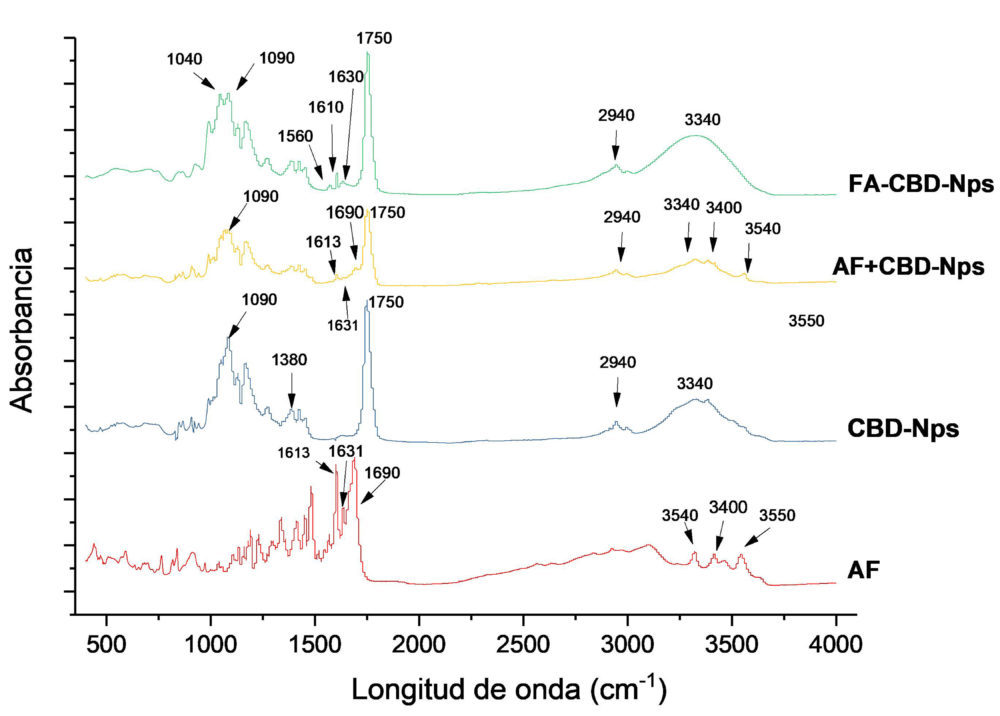
Estos estudios confirmaron la unión de ácido fólico a la superficie de las nanopartículas de CBD. En el espectro de ATR de las nanopartículas de CBD no funcionalizadas (Figura 11), se pueden apreciar los picos característicos del PLGA: 3340 cm− 1 (O-H), a 2940 cm− 1 (C-H), 1750 cm− 1 (C-O de los grupos ester), 1380 cm− 1 (-CH3 del ácido láctico) y 1090 cm− 1 (C-O), (51, 52). En las formulaciones funcionalizadas con ácido fólico, se ha producido un engrosamiento de la banda de 3340 cm− 1, probablemente debido a la contribución de las vibraciones de estiramiento de los enlaces N-H la molécula de ácido fólico, así como también aparecen diversos picos en el intervalo de 1700-1500 cm− 1, que pueden atribuirse al anillo de pterina y fenilo del ácido fólico. Además, en las FA-CBD-Nps ha desaparecido el pico de 3540 cm− 1, que junto con el pico de 3400 cm− 1, corresponde a las vibraciones del enlace N-H de la amina primaria; amina que ha desaparecido debido a la unión con el PLGA. Estos dos picos están presentes en el espectro del ácido fólico y de la mezcla física del mismo con las CBD-Nps, donde el pico de 3400 cm− 1 parece estar enmascarado en la banda del PLGA en torno a 3340 cm− 1 (enlaces O-H) (53, 54). Los resultados obtenidos nos indican la unión de la molécula de ácido fólico sobre la superficie de las nanopartículas.
Figura 10: Perfil de liberación in vitro de las nanopartículas Figura 11: Espectros de Atr del ácido fólico (AF) funcionalizadas y no funcionalizadas con ácido fólico las nanopartículas no funcionalizadas (CBD- Nps), la mezcla física de ambos (AF+cbD-Nps) y las nanopartículas funcionalizadas con ácido fólico ( AF-cbD-Nps)
3.4.4. Estudios de captación en las células SKOV-3
Tal y como se puede apreciar en la Figura 12, se produjo una internalización más rápida en las formulaciones funcionalizadas con folato. En las formulaciones no funcionalizadas no se apreció una captación considerable hasta las 2 horas de incubación. Sin embargo, en nanopartículas con ácido fólico se observó incluso a los 30 minutos. Estas diferencias en la captación pueden atribuirse a la presencia del ácido fólico. Precisamente, la internalización a tiempos cortos obtenida con las nanopartículas de folato resulta muy interesante para nuestros objetivos debido a la rápida liberación del CBD a partir de las nanopartículas en los primeros 90 minutos. Sin embargo, tras 8 horas de incubación ambas formulaciones presentaron una captación similar.
Figura 12: estudios de internalización de las nanopartículas no funcionalizadas y funcionalizadas con ácido fólico en células sKOV-3. tinción con DAPI ( núcleo celular): azul; tinción con red-Phalloidin ( citoesqueleto): rojo, tinción con DiO: (nanopartículas): verde
3.4.5. Eficacia antitumoralde las nanopartículas de CBD en monoterapia
3.4.5.1. Eficacia antitumoral in vitro
Mientras que las nanopartículas no cargadas no presentaron citotoxidad, las nanopartículas cargadas con CBD (funcionalizadas y no funcionalizadas con ácido fólico) presentaron una actividad antiproliferativa similar o ligeramente superior ( a concentraciones bajas) al CBDsol (Figura 13). De hecho, se observó una disminución en los valores de CI50 en las formulaciones de nanopartículas de CBD. Sin embargo, las diferencias no fueron estadísticamente significativas (Tabla 6).
Cabe destacar que en estos ensayos el CBDsol está completamente disponible para las células lo que podría dificultar encontrar diferencias significativas entre la solución y las nanopartículas, en las que el CBD se libera de manera prolongada. De hecho, nanoformulaciones de otros agentes antitumorales presentaron resultados similares, mostrando una eficacia parecida e incluso en algún caso inferior al fármaco libre, probablemente debido a esta liberación controlada (55).
Figura 13: estudios de viabilidad en células sKOV-3 de las nanopartículas de CBD funcionalizadas y no funcionalizadas con ácido fólico
3.4.5.2. Eficacia antitumoral in vivo
La eficacia antitumoral de las nanopartículas de CBD desarrolladas también se evaluó en los modelos in ovo. Tal y como se puede observar en la Figura 14, las nanopartículas presentaron una mayor inhibición del crecimiento tumoral que el CBDsol. Sin embargo, diferencias estadísticamente significativas solo se observaron con las nanopartículas funcionalizadas. Esta mayor actividad antitumoral podría deberse a una mayor captación de las formulaciones debido a la presencia de ácido fólico. Cabe decir que este modelo es más representativo que los cultivos celulares en monocapa y permitiría apreciar mejor el proceso de vectorización. De hecho, otros autores han encontrado resultados similares con nanopartículas de otros agentes antitumorales funcionalizadas con ácido fólico, y mientras que en cultivos celulares las nanopartículas funcionalizadas presentaron una actividad antiproliferativa similar a las formulaciones no funcionalizadas, en estudios in vivo se observó una mayor eficacia, debido a una mayor captación (55-57).
Figura 14: Inhibición del crecimiento tumoral de los diferentes tratamientos delas nanopartículas de cbD no funcionalizadas y funcionalizadas con ácido fólico.* y † indican diferencias estadísticamente significativas ( p<0.05) de las nanopartículas funcionalizadas con el CBDsol y con las nanopartículas no funcionalizadas respectivamente
3.4.6. Estudios de combinación de la nanopartículas de CBD
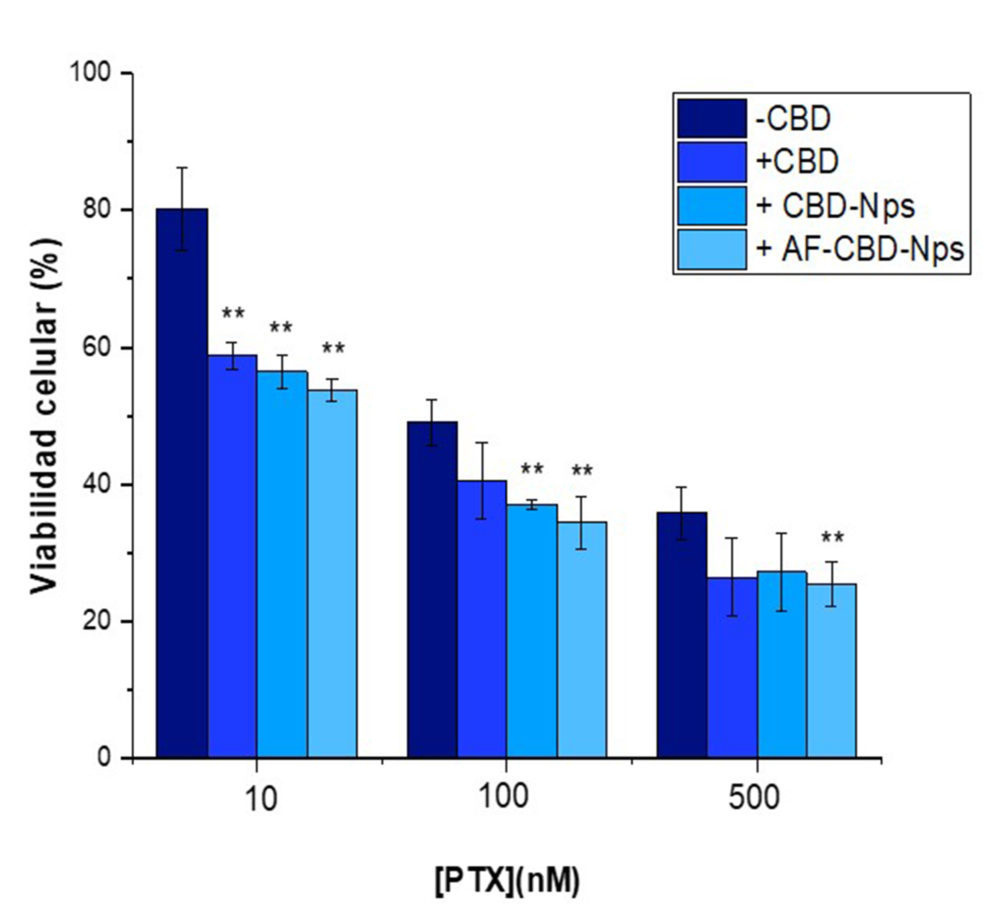
Tal y como podemos observar en la Figura 15, las nanopartículas de CBD, administradas de acuerdo al protocolo de pre + coadministración, potenciaron la actividad antiproliferativa del PTX, disminuyendo significativamente (p<0.01) los valores de CI50 de este antineoplásico (Tabla 7).
Tabla 7: Valores de CI50 del PTX combinado con CBDsol y las nanopartículas de CBD no funcionalizadas ( CBD-Nps) y funcionalizadas con ácido fólico ( AF-CBD-Nps).** indica diferencias estadísticamente significativas (p <0.01) en los valores de CI50 del PTX administrado en monoterapia o junto con los diferentes formulaciones de CBD. † Indica diferencias estadísticamente significativas en los valores de CI50 de PTX +CBDsol y PTX+AF-CBD-Nps
Aunque ambas formulaciones de nanopartículas, no funcionalizadas y funcionalizadas con ácido, presentaron una mayor disminución de los valores de CI50 que el CBDsol, solo se consiguieron diferencias estadísticamente significativas (p<0.05) con las nanopartículas funcionalizadas con ácido fólico.
Figura 15: Actividad antiproliferativa del PtX administrado en monoterapia (-CBD) o en combinación con CBDsol (+cbD) y las formulaciones de nanopartículas de CBD nofuncionalizadas ( +cbD-Nps) y funcionalizadas con ácido fólico (+AF-cbD-Nps) siguiendo el protocolo de pre+coadministración a una concentración de CBD de 10µm
4. CONCLUSIONES
El CBD, administrado en monoterapia, resulta útil en el tratamiento de tumores de ovario altamente invasivos, debido a su capacidad para inhibir el crecimiento y migración de las células tumorales. Además, debido a su capacidad para potenciar el efecto citotóxico del placlitaxel, resulta útil su uso en terapia de combinación, permitiendo reducir la dosis, y por consiguiente, los efectos adversos de este antineoplásico para conseguir el mismo efecto antitumoral.
El desarrollo de las nanopartículas poliméricas de PLGA constituye un buen recurso tecnológico para administrar el CBD, presentando una actividad anticancerígena similar o ligeramente superior al CBD en solución. Además, la incorporación de ácido fólico a la superficie de estas formulaciones es un buen recurso de vectorización a tumores de ovario, incrementando significativamente la eficacia de las formulaciones de nanopartículas de CBD en los modelos in ovo. Además, estas formulaciones demostraron in vitro potenciar significativamente el efecto antitumoral del PTX.
5. LISTA DE ABREVIATURAS
AF-CBD-Nps Nanopartículas cargadas con cannabidiol y funcionalizadas con ácido fólico
AF-DiO-Nps Nanopartículas cargadas con DiO y funcionalizadas con ácido fólico
AF-PLGA-Nps Nanopartículas blancas funcionalizadas con ácido fólico
CBD Cannabidiol
CBD-Nps Nanopartículas cargadas con cannabidiol
CBD sol Cannabidiol en solución
CI50 Concentración inhibitoria 50
CIS Cisplatino
DDE Día de desarrollo embrionario
DiO Perclorato de 3,3′-Dioctadeciloxacarbocianina
DiO-Nps Nanopartículas cargadas con DiO
DOX Doxorrubicina
EE Eficacia de encapsulación
IC Índice de combinación
MCA Membrana corioalantoidea de embriones de pollo fecundados
PLGA Poli-láctico-co-glicólico
PLGA-Nps Nanopartículas blancas
PTX Paclitaxel
PVA Alcohol polivinílico
6. AGRADECIMIENTOS
Los autores agradecen al Ministerio de Educación, Cultura y Deporte la concesión de la ayuda para contratos predoctorales de Formación del Profesorado Universitario a Ana Isabel Fraguas Sánchez (Referencia FPU 14/06441).
7. REFERENCIAS
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a cancer journal for clinicians. 2018;68(6):394-424.
Mizushima T, Miyamoto H. The Role of Androgen Receptor Signaling in Ovarian Cancer. Cells. 2019;8(2). - Moufarrij S, Dandapani M, Arthofer E, Gomez S, Srivastava A, Lopez-Acevedo M, et al. Epigenetic therapy for ovarian cancer: promise and progress. Clinical epigenetics. 2019;11(1):7.
- Armstrong DK, Alvarez RD, Bakkum-Gamez JN, Barroilhet L, Behbakht K, Berchuck A, et al. NCCN Guidelines Insights: Ovarian Cancer, Version 1.2019. J Natl Compr Canc Netw. 2019;17(8):896-909.
- Tsibulak I, Zeimet AG, Marth C. Hopes and failures in front-line ovarian cancer therapy. Crit Rev Oncol Hematol. 2019;143:14-9.
- Chandra A, Pius C, Nabeel M, Nair M, Vishwanatha JK, Ahmad S, et al. Ovarian cancer: Current status and strategies for improving therapeutic outcomes. Cancer medicine. 2019.
- Livshits Z, Rao RB, Smith SW. An approach to chemotherapy-associated toxicity. Emerg Med Clin North Am. 2014;32(1):167-203.
- Kalaydina RV, Bajwa K, Qorri B, Decarlo A, Szewczuk MR. Recent advances in “smart” delivery systems for extended drug release in cancer therapy. Int J Nanomedicine. 2018;13:4727-45.
- Fraguas-Sanchez AI, Torres-Suarez AI. Medical Use of Cannabinoids. Drugs. 2018;78(16):1665-703.
- Pisanti S, Bifulco M. Medical Cannabis: A plurimillennial history of an evergreen. Journal of cellular physiology. 2018.
- !!! INVALID CITATION !!! {Fraguas-Sanchez, 2018 #3}.
- Daris B, Tancer Verboten M, Knez Z, Ferk P. Cannabinoids in cancer treatment: Therapeutic potential and legislation. Bosnian journal of basic medical sciences. 2019;19(1):14-23.
- Pisanti S, Malfitano AM, Ciaglia E, Lamberti A, Ranieri R, Cuomo G, et al. Cannabidiol: State of the art and new challenges for therapeutic applications. Pharmacology & therapeutics. 2017;175:133-50.
- Cohen K, Weizman A, Weinstein A. Positive and Negative Effects of Cannabis and Cannabinoids on Health. Clinical pharmacology and therapeutics. 2019.
- McAllister SD, Soroceanu L, Desprez PY. The Antitumor Activity of Plant-Derived Non-Psychoactive Cannabinoids. Journal of neuroimmune pharmacology : the official journal of the Society on NeuroImmune Pharmacology. 2015;10(2):255-67.
Likar R, Nahler G. The use of cannabis in supportive care and treatment of brain tumor. Neurooncol Pract. 2017;4(3):151-60. - Kiskova T, Mungenast F, Suvakova M, Jager W, Thalhammer T. Future Aspects for Cannabinoids in Breast Cancer Therapy. Int J Mol Sci. 2019;20(7).
- Pagano E, Borrelli F. Targeting cannabinoid receptors in gastrointestinal cancers for therapeutic uses: current status and future perspectives. Expert Rev Gastroenterol Hepatol. 2017;11(10):871-3.
- Messalli EM, Grauso F, Luise R, Angelini A, Rossiello R. Cannabinoid receptor type 1 immunoreactivity and disease severity in human epithelial ovarian tumors. American journal of obstetrics and gynecology. 2014;211(3):234.e1-6.
- Holland ML, Panetta JA, Hoskins JM, Bebawy M, Roufogalis BD, Allen JD, et al. The effects of cannabinoids on P-glycoprotein transport and expression in multidrug resistant cells. Biochemical pharmacology. 2006;71(8):1146-54.
- Scott KA, Dalgleish AG, Liu WM. Anticancer effects of phytocannabinoids used with chemotherapy in leukaemia cells can be improved by altering the sequence of their administration. International journal of oncology. 2017;51(1):369-77.
- López-Valero I, Saiz-Ladera C, Torres S, Hernandez-Tiedra S, Garcia-Taboada E, Rodriguez-Fornes F, et al. Targeting Glioma Initiating Cells with A combined therapy of cannabinoids and temozolomide. Biochemical pharmacology. 2018;157:266-74.
- López-Valero I, Torres S, Salazar-Roa M, Garcia-Taboada E, Hernandez-Tiedra S, Guzman M, et al. Optimization of a preclinical therapy of cannabinoids in combination with temozolomide against glioma. Biochemical pharmacology. 2018;157:275-84.
- Viudez-Martínez A, García-Gutierrez MS, Navarron CM, Morales-Calero MI, Navarrete F, Torres-Suarez AI, et al. Cannabidiol reduces ethanol consumption, motivation and relapse in mice. Addiction biology. 2018;23(1):154-64.
Fraguas-Sánchez AI, Martín-Sabroso C, Fernández-Carballido A, Torres-Suarez AI. Current status of nanomedicine in the chemotherapy of breast cancer. Cancer chemotherapy and pharmacology. 2019;84(4):689-706. - Bertrand N, Wu J, Xu X, Kamaly N, Farokhzad OC. Cancer nanotechnology: the impact of passive and active targeting in the era of modern cancer biology. Advanced drug delivery reviews. 2014;66:2-25.
- Guan LY, Lu Y. New developments in molecular targeted therapy of ovarian cancer. Discov Med. 2018;26(144):219-29.
- Gupta A, Kaur CD, Saraf S, Saraf S. Targeting of herbal bioactives through folate receptors: a novel concept to enhance intracellular drug delivery in cancer therapy. J Recept Signal Transduct Res. 2017;37(3):314-23.
- Grada A, Otero-Vinas M, Prieto-Castrillo F, Obagi Z, Falanga V. Research Techniques Made Simple: Analysis of Collective Cell Migration Using the Wound Healing Assay. J Invest Dermatol. 2017;137(2):e11-e6.
- Kommineni N, Saka R, Bulbake U, Khan W. Cabazitaxel and thymoquinone co-loaded lipospheres as a synergistic combination for breast cancer. Chemistry and physics of lipids. 2018.
- Chou TC. Drug combination studies and their synergy quantification using the Chou-Talalay method. Cancer research. 2010;70(2):440-6.
- Van Hoesen K, Meynier S, Ribaux P, Petignat P, Delie F, Cohen M. Circulating GRP78 antibodies from ovarian cancer patients: a promising tool for cancer cell targeting drug delivery system? Oncotarget. 2017;8(63):107176-87.
- Hernan Pérez de la Ossa D, Ligresti A, Gil-Alegre ME, Aberturas MR, Molpeceres J, Di Marzo V, et al. Poly-epsilon-caprolactone microspheres as a drug delivery system for cannabinoid administration: development, characterization and in vitro evaluation of their antitumoral efficacy. Journal of controlled release : official journal of the Controlled Release Society. 2012;161(3):927-32.
- Beaufort CM, Helmijr JC, Piskorz AM, Hoogstraat M, Ruigrok-Ritstier K, Besselink N, et al. Ovarian cancer cell line panel (OCCP): clinical importance of in vitro morphological subtypes. PloS one. 2014;9(9):e103988.
- Hart S, Fischer OM, Ullrich A. Cannabinoids induce cancer cell proliferation via tumor necrosis factor alpha-converting enzyme (TACE/ADAM17)-mediated transactivation of the epidermal growth factor receptor. Cancer research. 2004;64(6):1943-50.
- McKallip RJ, Nagarkatti M, Nagarkatti PS. Delta-9-tetrahydrocannabinol enhances breast cancer growth and metastasis by suppression of the antitumor immune response. Journal of immunology (Baltimore, Md : 1950). 2005;174(6):3281-9.
- Ligresti A, Moriello AS, Starowicz K, Matias I, Pisanti S, De Petrocellis L, et al. Antitumor activity of plant cannabinoids with emphasis on the effect of cannabidiol on human breast carcinoma. The Journal of pharmacology and experimental therapeutics. 2006;318(3):1375-87.
- Fraguas-Sánchez AI, Fernández-Carballido A, Torres-Suarez AI. Phyto-, endo- and synthetic cannabinoids: promising chemotherapeutic agents in the treatment of breast and prostate carcinomas. Expert opinion on investigational drugs. 2016;25(11):1311-23.
- Elbaz M, Nasser MW, Ravi J, Wani NA, Ahirwar DK, Zhao H, et al. Modulation of the tumor microenvironment and inhibition of EGF/EGFR pathway: novel anti-tumor mechanisms of Cannabidiol in breast cancer. Molecular oncology. 2015;9(4):906-19.
- Ramer R, Merkord J, Rohde H, Hinz B. Cannabidiol inhibits cancer cell invasion via upregulation of tissue inhibitor of matrix metalloproteinases-1. Biochemical pharmacology. 2010;79(7):955-66.
- Vaccani A, Massi P, Colombo A, Rubino T, Parolaro D. Cannabidiol inhibits human glioma cell migration through a cannabinoid receptor-independent mechanism. British journal of pharmacology. 2005;144(8):1032-6.
- Ward SJ, McAllister SD, Kawamura R, Murase R, Neelakantan H, Walker EA. Cannabidiol inhibits paclitaxel-induced neuropathic pain through 5-HT(1A) receptors without diminishing nervous system function or chemotherapy efficacy. British journal of pharmacology. 2014;171(3):636-45.
- Ward SJ, Ramirez MD, Neelakantan H, Walker EA. Cannabidiol prevents the development of cold and mechanical allodynia in paclitaxel-treated female C57Bl6 mice. Anesthesia and analgesia. 2011;113(4):947-50.
- King KM, Myers AM, Soroka-Monzo AJ, Tuma RF, Tallarida RJ, Walker EA, et al. Single and combined effects of Delta(9) -tetrahydrocannabinol and cannabidiol in a mouse model of chemotherapy-induced neuropathic pain. British journal of pharmacology. 2017;174(17):2832-41.
- Miyato H, Kitayama J, Yamashita H, Souma D, Asakage M, Yamada J, et al. Pharmacological synergism between cannabinoids and paclitaxel in gastric cancer cell lines. J Surg Res. 2009;155(1):40-7.
- Fouad AA, Albuali WH, Al-Mulhim AS, Jresat I. Cardioprotective effect of cannabidiol in rats exposed to doxorubicin toxicity. Environmental toxicology and pharmacology. 2013;36(2):347-57.
- Hao E, Mukhopadhyay P, Cao Z, Erdelyi K, Holovac E, Liaudet L, et al. Cannabidiol Protects against Doxorubicin-Induced Cardiomyopathy by Modulating Mitochondrial Function and Biogenesis. Molecular medicine (Cambridge, Mass). 2015;21:38-45.
- Ribatti D. The chick embryo chorioallantoic membrane (CAM) assay. Reproductive toxicology (Elmsford, NY). 2017;70:97-101.
- Lokman NA, Elder AS, Ricciardelli C, Oehler MK. Chick chorioallantoic membrane (CAM) assay as an in vivo model to study the effect of newly identified molecules on ovarian cancer invasion and metastasis. Int J Mol Sci. 2012;13(8):9959-70.
- Vu BT, Shahin SA, Croissant J, Fatieiev Y, Matsumoto K, Le-Hoang Doan T, et al. Chick chorioallantoic membrane assay as an in vivo model to study the effect of nanoparticle-based anticancer drugs in ovarian cancer. Scientific reports. 2018;8(1):8524.
- Sharma D, Maheshwari D, Philip G, Rana R, Bhatia S, Singh M, et al. Formulation and optimization of polymeric nanoparticles for intranasal delivery of lorazepam using Box-Behnken design: in vitro and in vivo evaluation. Biomed Res Int. 2014;2014:156010.
- Jang JH, Jeong SH, Lee YB. Preparation and In Vitro/In Vivo Characterization of Polymeric Nanoparticles Containing Methotrexate to Improve Lymphatic Delivery. Int J Mol Sci. 2019;20(13).
- Singh R, Kesharwani P, Mehra NK, Singh S, Banerjee S, Jain NK. Development and characterization of folate anchored Saquinavir entrapped PLGA nanoparticles for anti-tumor activity. Drug development and industrial pharmacy. 2015;41(11):1888-901.
- Gupta A, Kaur CD, Saraf S, Saraf S. Formulation, characterization, and evaluation of ligand-conjugated biodegradable quercetin nanoparticles for active targeting. Artificial cells, nanomedicine, and biotechnology. 2016;44(3):960-70.
- Yao S, Li L, Su XT, Wang K, Lu ZJ, Yuan CZ, et al. Development and evaluation of novel tumor-targeting paclitaxel-loaded nano-carriers for ovarian cancer treatment: in vitro and in vivo. J Exp Clin Cancer Res. 2018;37(1):29.
- Luiz MT, Abriata JP, Raspantini GL, Tofani LB, Fumagalli F, de Melo SMG, et al. In vitro evaluation of folate-modified PLGA nanoparticles containing paclitaxel for ovarian cancer therapy. Materials science & engineering C, Materials for biological applications. 2019;105:110038.
- Ak G, Yilmaz H, Gunes A, Hamarat Sanlier S. In vitro and in vivo evaluation of folate receptor-targeted a novel magnetic drug delivery system for ovarian cancer therapy. Artificial cells, nanomedicine, and biotechnology. 2018;46(sup1):926-37.
DECLARACIÓN DE TRANSPARENCIA
Los autores de este manuscrito declaran no tener ningún tipo de conflicto de intereses.