1. INTRODUCCIÓN
1.1. Consumo de Fructosa
La fructosa es un monosacárido que ha estado presente de manera natural en nuestra dieta desde hace miles de años, principalmente en las frutas, la miel, pero además, en las últimas décadas, motivado por la occidentalización de la dieta, se ha posicionado como una de las principales fuentes de azúcares añadidos en los países desarrollados, ya que se utiliza como edulcorante frecuentemente en la industria alimentaria, estando presente en una amplia variedad de alimentos procesados y bebidas azucaradas, ya sea en forma de sacarosa o en forma de jarabe de maíz alto en fructosa (JMAF). Existen principalmente dos tipos de JMAF de acuerdo con su contenido de fructosa: JMAF 42 y JMAF 55, que contienen un 42% y un 55% de fructosa respectivamente. El JMAF se empezó a producir y a introducir en la industria alimentaria a partir de la década de 1960. Curiosamente, hasta 1970 en EEUU, el empleo del mismo apenas constituía un 1% de los endulzantes calóricos. Sin embargo, esta proporción se incrementó sustancialmente hasta el 42% en el año 2000 (1). Esto se debe principalmente a dos motivos: su alto poder edulcorante y su bajo coste (2).
El aumento del consumo de fructosa como azúcar añadido en forma de JMAF ha mostrado una relación proporcional a lo largo del tiempo con el aumento de la obesidad en la población en EEUU. Sin embargo, en los últimos años la tendencia al incremento se ha ido atenuando (1 y 3).
Todos estos datos han provocado que la fructosa sea objeto de estudio por la comunidad científica que ha mostrado su preocupación acerca de los posibles efectos adversos y su implicación en el desarrollo y progresión de enfermedades metabólicas, como la obesidad, la resistencia a la insulina, la diabetes tipo 2 o la dislipidemia (4).
1.2. Enfermedades metabólicas relacionadas con el consumo de fructosa
Según numerosos estudios, realizados tanto en humanos como en animales de experimentación, un elevado consumo de fructosa se considera un factor clave en el incremento de las tasas mundiales de diabetes, obesidad y otras enfermedades metabólicas, además de estar relacionado con unos mayores índices de riesgo cardiometabólico.
También es un hecho ampliamente demostrado que la sobreexposición a la fructosa en la alimentación en animales de experimentación reproduce las alteraciones características asociadas al hígado graso y al síndrome metabólico tales como hipertensión, obesidad, resistencia a la insulina, diabetes y dislipemia (5). Un inconveniente de algunos de estos estudios es que la cantidad de fructosa añadida a la dieta de los animales excede al consumo promedio de la población general. Por lo que son necesarios más estudios que evalúen los efectos de los azúcares añadidos en la dieta a largo plazo y en cantidades no tan excesivas. También existen estudios de intervención a corto plazo en humanos en los que con dosis similares al consumo medio de fructosa se han observado cambios en la cantidad de lípidos circulantes y en la sensibilidad a la insulina (6).
Otros trabajos han puesto de manifiesto como el consumo crónico de fructosa aumenta el potencial adipogénico en células precursoras de adipocitos y la adiposidad visceral, provoca una situación de dislipemia y altera la sensibilidad a la insulina en personas con sobrepeso u obesidad. Además, induce resistencia a la leptina, lo que puede contribuir al aumento de peso y a una alteración en la regulación del metabolismo energético (7).
En relación con el metabolismo de los lípidos, la fructosa estimula la acumulación de lípidos hepáticos, lo que contribuye a una esteatosis, provoca una situación de hipertrigliceridemia, además de favorecer un aumento del colesterol hepático (8). También se ha observado que la fructosa promueve el desarrollo de hígado graso no alcohólico (NAFLD) y uno de los mecanismos involucrados es su efecto inductor de la lipogénesis hepática de novo.
Por otro lado, estudios como el realizado por Bocarsly et al. en 2010 (9) demostraron que, las cantidades de fructosa presentes en el JMAF pueden ser adictivas, causando efectos similares a los de las drogas de abuso. Otros autores también han observado que el consumo elevado de fructosa (10) aumenta la hiperactividad en los niños y el déficit de atención y altera la capacidad para distinguir distintos sabores.
A diferencia de la glucosa, la fructosa no estimula la secreción de insulina, ni promueve el aumento de producción de ghrelina. Dado que estas moléculas se encargan de regular la ingesta de alimentos y el peso corporal, la fructosa en la dieta podría contribuir al consumo excesivo de calorías y al aumento de peso corporal (11).
1.3. Estructura y metabolismo de la fructosa y la glucosa
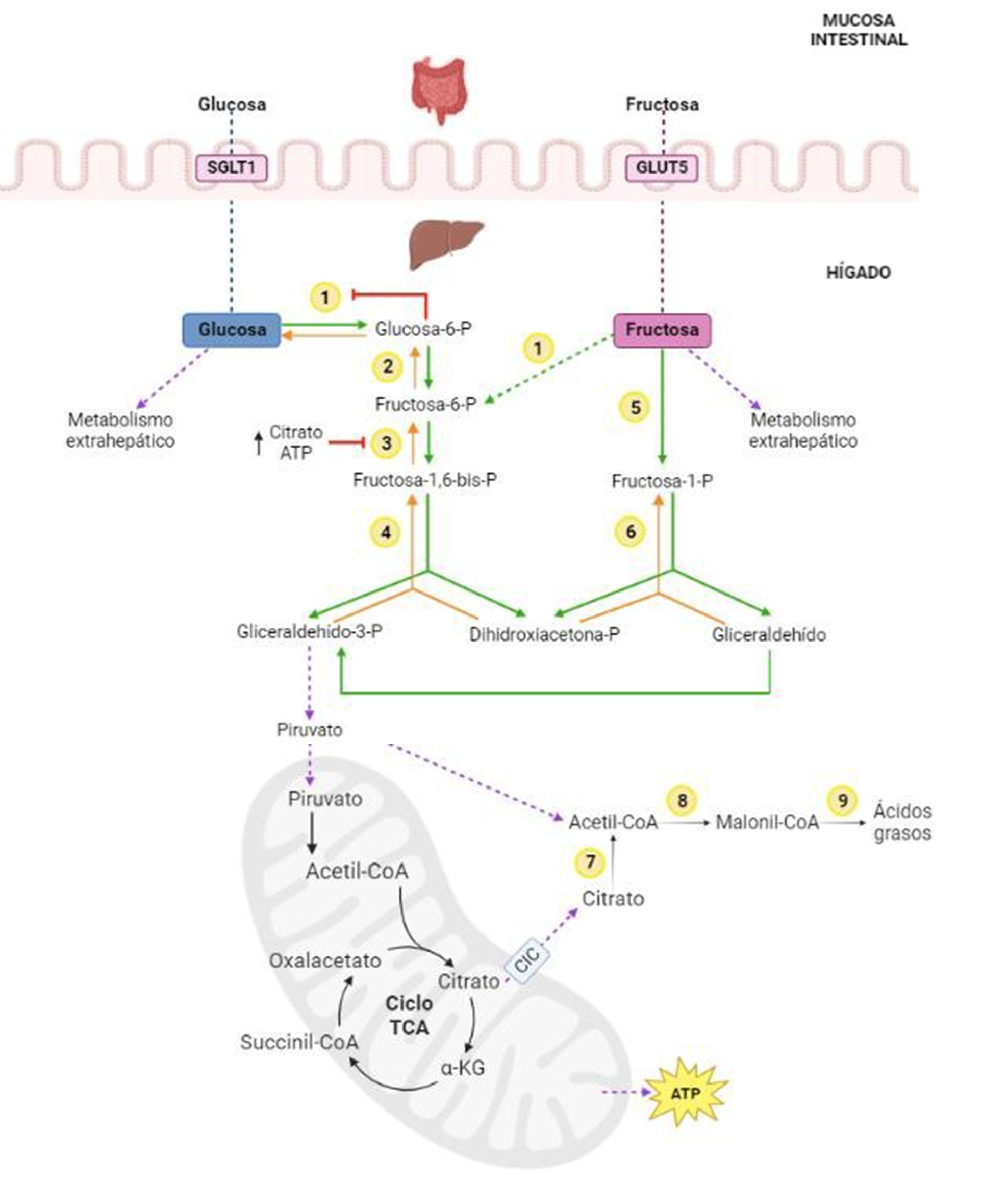
La fructosa y la glucosa son monosacáridos que son isómeros estructurales, únicamente difieren en la configuración de sus dos primeros carbonos, ya que ambas moléculas presentan la misma fórmula química (C6H12O6) y peso molecular (180 g/mol). Mientras que la glucosa presenta un grupo aldehído en el carbono número 1, la fructosa cuenta con un grupo cetona en el carbono número 2 (Figura 1).
Figura 1. Estructura de la D-glucosa y la D-fructosa. En morado se señala la diferencia entre el grupo aldehído de la glucosa y el grupo ceto de la fructosa.
Las vías de absorción y el metabolismo de la glucosa y la fructosa vienen determinadas por las diferencias que presentan ambos monosacáridos en su estructura, tal y como se muestra en la Figura 2.
Figura 2. Absorción de la glucosa y la fructosa y metabolismo posterior en el organismo. Relación con la lipogénesis de novo. Las enzimas están señaladas con números (1: Hexoquinasa; 2: Glucosa fosfato isomerasa; 3: PFK1 (Fosfofructoquinasa 1); 4: Aldolasa; 5: Fructoquinasa; 6: Aldolasa B; 7: ACLY (ATP citrato liasa); 8: ACC (Acetil-CoA carboxilasa); 9: FAS (Ácido graso sintasa). Los transportadores de glucosa y fructosa en un recuadro rosa. Figura creada con BioRender.com
Tras la digestión de los alimentos, la glucosa obtenida se absorbe principalmente a través del intestino delgado, donde se transporta al interior del enterocito mediante una proteína cotransportadora de glucosa y sodio que se encuentra en la membrana apical de los enterocitos, denominada SGLT1 (del inglés, Sodium-glucose cotransporter 1). Una vez dentro del enterocito accede al torrente sanguíneo gracias al transportador de glucosa GLUT2 (del inglés, Glucose transporter). En sangre se distribuye a los diferentes tejidos de nuevo gracias a la presencia de distintos transportadores de la familia GLUT, donde la glucosa puede experimentar distintas vías metabólicas en función de las necesidades energéticas del organismo. Entre estas vías metabólicas se encuentran la glucólisis y la glucogenogénesis. La glucosa y la fructosa comparten intermediarios metabólicos y enzimas en su metabolismo, pero mientras que la glucosa se metaboliza preferentemente a través de la glucolisis en todas las células del organismo, la fructosa lo hace a través de la fructólisis, que tiene lugar principalmente en el hígado.
La glucólisis es la principal vía metabólica de utilización de glucosa, para producir energía en forma de ATP (adenosín trifosfato) y otros productos intermedios. En primer lugar, la glucosa se transforma en glucosa-6-fosfato (G6P) por la acción de una hexoquinasa, siendo este paso uno de los puntos de regulación de la vía metabólica. A continuación, la glucosa fosfato isomerasa cataliza la formación de fructosa-6-fosfato a partir de la G6P, la cual vuelve a fosforilarse en el carbono número 1 gracias a la enzima PFK1 (Fosfofructoquinasa 1) para formar fructosa-1,6-bifosfato. Esta reacción resulta inhibida por el producto final de la glucólisis (ATP) y por el citrato (producto intermediario del ciclo del ácido cítrico), por lo que es el punto de control principal de la ruta.
Tras la fosforilación, la fructosa-1,6-bisfosfato se va a escindir dando lugar a dos productos metabólicos: la dihidroxiacetona fosfato (DHP) y el gliceraldehido-3-fosfato (GAP) gracias a la acción de una aldolasa. La reacción catalizada por la aldolasa se ve favorecida gracias al uso inmediato del GAP en la reacción siguiente. Posteriormente tendrán lugar varias reacciones consecutivas a través de las cuales el gliceraldehído-3-fosfato se convertirá finalmente en piruvato (12 y 13).
Sin embargo, la fructosa se absorbe de forma pasiva desde la luz intestinal a los enterocitos a través de un transportador específico, GLUT5. Posteriormente, es enviada a la circulación plasmática a través del transportador de glucosa GLUT2. La fructosa actúa como sustrato en el hígado para la fructoquinasa, también conocida como cetohexoquinasa (KHK), que fosforila rápidamente al monosacárido generando fructosa-1-fosfato. Tras esta reacción, la aldolasa B metaboliza la fructosa- 1-fosfato a dihidroxiacetona fosfato (DHAP) y gliceraldehído (GA). Este último puede ser fosforilado para generar gliceraldehido-3-fosfato (GAP) y converger con la vía glucolítica para continuar su degradación posterior en el ciclo del ácido cítrico o proporcionar sustrato para la lipogénesis (14 y 15).
Tanto el ATP como el citrato inhiben por retroalimentación a la fosfofructoquinasa para controlar de forma muy estricta la ruta glucolítica. Sin embargo, en la fructólisis no existe este mecanismo de control de la vía, por lo que la acumulación de triosas proporciona una fuente inagotable de sustrato para la síntesis de ácidos grasos y consecuentemente fosfolípidos y triglicéridos.
1.4. Lipogénesis
La lipogénesis es el proceso de síntesis de ácidos grasos a partir de acetil CoA y está sometida tanto a regulación nutricional como hormonal. Entre las enzimas involucradas en este proceso metabólico caben destacar la FAS (ácido graso sintasa, Fatty Acid Synthase), la ACC (acetil-CoA carboxilasa) y la ACLY (ATP y citrato ligasa). Además de estas enzimas existen otras proteínas que regulan la lipogénesis, entre ellas los factores de transcripción como el receptor X hepático (LXR), la proteína 1c de unión al elemento regulador de esteroles (SREBP-1c) o la proteína de unión al elemento de respuesta a carbohidratos (ChREBP), que inducen la expresión de las enzimas lipogénicas (16).
En la lipogénesis de novo los carbohidratos de la dieta pueden utilizarse para fabricar ácidos grasos, que normalmente se almacenan en forma de triglicéridos (TG). Si se produce un exceso en el consumo de carbohidratos en la dieta, el organismo incrementa la síntesis de ácidos grasos de manera endógena. Para ello, como se ha mostrado anteriormente, la mitocondria proporciona los sustratos necesarios en forma de acetil CoA y ATP (Figura 2).
Se ha puesto de manifiesto que la lipogénesis de novo se ve alterada en los tejidos lipogénicos en enfermedades metabólicas como la obesidad, el hígado graso no alcohólico o el síndrome metabólico (17). Tal y como se ha mencionado anteriormente, los productos de la fructólisis (DHAP y GA3P), al incorporarse a la glucólisis dan lugar a piruvato, que mediante la acción posterior de la piruvato deshidrogenasa generan acetil CoA, el cual sirve de sustrato para la formación de ácidos grasos.
Además, la acción de la hormona tiroidea juega un papel esencial en la oxidación y síntesis de lípidos en el hígado, ejerciendo efectos directos en la expresión de genes relacionados con su metabolismo. Se ha demostrado de hecho, que estimula al receptor THRa, que a su vez regula la expresión de genes lipogénicos como la enzima FAS y también está relacionada con el factor de transcripción ChREBP (18).
1.5. Hormonas tiroideas
Dietas con una ingesta elevada de azúcares simples, como la fructosa, promueven mecanismos hormonales que conducen a múltiples alteraciones metabólicas que favorecen el sobrepeso y la obesidad. En este contexto, es fundamental comprender los mecanismos subyacentes que vinculan el consumo de fructosa con la aparición y progresión de estas enfermedades metabólicas.
Una vía de investigación emergente se centra en la relación entre el metabolismo de la fructosa y las hormonas tiroideas, las cuales desempeñan un papel esencial en la regulación del metabolismo energético y la homeostasis corporal. Se ha planteado la hipótesis por la que el consumo excesivo de fructosa podría tener un impacto negativo en la función tiroidea. De hecho, varios estudios han demostrado esta asociación entre el consumo elevado de fructosa y la alteración de las hormonas tiroideas (19 y 20).
Las hormonas tiroideas, principalmente la tiroxina (T4) y la triyodotironina (T3), influyen en múltiples procesos fisiológicos, tales como el crecimiento, el desarrollo, el metabolismo basal, la termogénesis y el metabolismo de lípidos y carbohidratos. Son sintetizadas y liberadas por la glándula tiroides en respuesta a estímulos hormonales. Sin embargo, en las últimas décadas se ha observado un aumento preocupante en los trastornos relacionados con las hormonas tiroideas, como son el hipertiroidismo y el hipotiroidismo.
La relación entre las hormonas tiroideas y el metabolismo energético es compleja y se ve influenciada por diversos factores, tales como los transportadores y los genes diana involucrados en su acción. Tanto la síntesis y el transporte de las hormonas tiroideas como su actividad en tejidos diana están estrictamente reguladas a través de la expresión de diversos genes. Entre ellos podemos destacar B- cell lymphoma 3 (BCL3), Gen de la proteína hepática inducible por hormona tiroidea (SPOT14), glutathione S-transferase Alpha 2 (GSTA2), thyroid hormone receptor alpha (THRa), monocarboxylate transporter 8 (MCT8) y monocarboxylate transporter 10 (MCT10). Todos ellos se muestran en la Figura 3. Estas proteínas desempeñan papeles fundamentales en la función y regulación de las hormonas tiroideas y podrían verse afectadas por el consumo de fructosa (21 y 22).
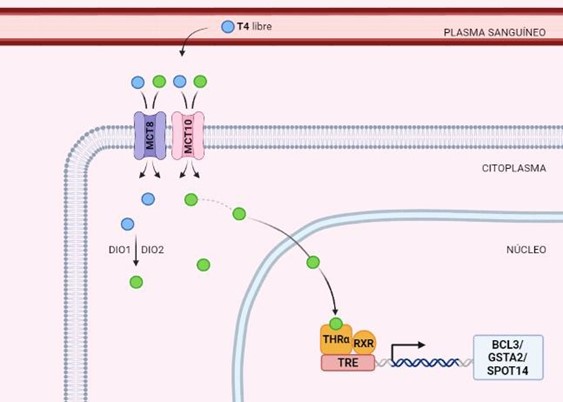
Figura 3. Proceso de activación de la transcripción de BCL3, GSTA2 y SPOT14 a partir de la T4 libre en plasma. La T4 libre se introduce en la célula a través de transportadores (MTC8 y MTC10), se activa por DIO1/2 que permite su conversión a T3. La T3 accede al núcleo celular, se une al receptor (THRa) que forma un dímero con el receptor RXR (receptor X retinoide), los cuales se unen a la región TRE del gen diana y activan su transcripción.
BCL3 es un gen que está implicado en la regulación de la respuesta inflamatoria y la proliferación celular. Se ha demostrado que juega un papel fundamental en la modulación de la función tiroidea al interaccionar con factores de transcripción y regular la expresión de genes tiroideos (23). Por otro lado, SPOT14 sensible a la hormona tiroidea, también llamado THRSP (gen sensible a la hormona tiroidea), es un gen involucrado en la síntesis y oxidación de ácidos grasos en el hígado y otros tejidos, pero también está relacionado con la regulación de la actividad tiroidea y el metabolismo energético (24).
A su vez, GSTA2 codifica para una enzima antioxidante que participa en la detoxificación de compuestos reactivos y metabolitos tóxicos. Además de su función en la protección celular contra el estrés oxidativo, también se ha relacionado con la homeostasis y la regulación de la función tiroidea (25).
En cuanto a MCT8 y MCT10 son transportadores específicos que facilitan el transporte de las hormonas tiroideas a través de las membranas celulares. Estos son esenciales para el transporte intracelular y para la acción de la T3 y la T4 en los tejidos diana (26). MCT8 transporta únicamente T4, mientras que MCT10 transporta T3, rT3 y T4 (27).
Por último, el receptor de hormonas tiroideas, THRalfa, es un receptor que se une a las hormonas tiroideas y regula genes específicos en respuesta a las mismas a través de los TRE (Elementos de Respuesta a las hormonas Tiroideas). Este juega un papel fundamental en la regulación del metabolismo, el desarrollo y la función de distintos tejidos y órganos en el organismo (28).
En este trabajo, se explorará la posible interacción entre el consumo de fructosa y las hormonas tiroideas, analizando específicamente los transportadores MCT8 y MCT10, el receptor THR alfa, así como los genes diana BCL3, SPOT14 y GSTA2. Estos componentes se consideran claves en la modulación de los efectos de las hormonas tiroideas en el metabolismo y podrían desempeñar un papel relevante en la respuesta metabólica y los trastornos asociados con el consumo excesivo de fructosa.
1.6. Programación fetal
La programación fetal, es el proceso mediante el cual los factores ambientales y nutricionales durante la etapa de desarrollo prenatal, pueden influir en la salud y en el riesgo de desarrollar enfermedades a lo largo de la vida adulta. Existen evidencias de que la dieta materna, específicamente el consumo de azúcares añadidos como la fructosa durante el embarazo, desempeña un papel significativo en la programación fetal y puede tener efectos duraderos en la salud, tanto del feto como del individuo en la edad adulta. Múltiples estudios han investigado la asociación entre el consumo de fructosa durante el embarazo y el desarrollo de enfermedades crónicas en la descendencia. Concretamente, se ha demostrado que una ingesta elevada de fructosa durante la gestación puede tener repercusiones adversas en el metabolismo de la descendencia, tales como aumentar el riesgo de obesidad, diabetes tipo 2, enfermedad cardiovascular y alterar la función hormonal (29 y 30). El mecanismo preciso mediante el cual la fructosa ejerce dicha programación fetal aún no está completamente elucidado. Sin embargo, se ha propuesto que la exposición prenatal a niveles excesivos de fructosa puede alterar la expresión génica, modificar la regulación hormonal y comprometer el desarrollo y la función de órganos y tejidos clave en el feto. Estos cambios epigenéticos y moleculares podrían tener consecuencias a largo plazo en la salud metabólica y el riesgo de enfermedades en la descendencia (31, 32 y 33).
2. OBJETIVOS
Con estos antecedentes nos propusimos investigar el posible impacto nutrigenómico en las hormonas tiroideas, su función, regulación y metabolismo. Se examinó en ratas de 3 meses de edad el efecto del tratamiento con distintas dietas, tales como la adición de fructosa al agua de bebida, una dieta occidental o la adición de sal al tratamiento con fructosa, sobre la funcionalidad de las hormonas tiroideas. Además, nos planteamos analizar la relación existente entre la programación fetal y los efectos observados, estudiando si dichos efectos están condicionados por el tratamiento recibido por las madres durante la gestación.
Con este propósito, establecimos los siguientes objetivos:
Evaluar si el tratamiento con fructosa en ratas macho durante un periodo de 21 días tiene algún impacto en la expresión génica de los genes diana de la hormona tiroidea: BCL3, GSTA2 y SPOT14, así como en los transportadores MCT8 y MCT10, en hígado e íleon.
Estudiar si la adición de sal al tratamiento con fructosa potencia los efectos producidos por la fructosa sola en los genes mencionados anteriormente.
Evaluar si una dieta occidental o Western diet (rica en fructosa y colesterol) produce los mismos efectos que únicamente la ingesta de fructosa en los genes descritos, para determinar si la presencia de colesterol potencia los efectos inducidos por la fructosa.
Analizar si los efectos observados están influenciados por la ingesta materna de fructosa y, por lo tanto, implican procesos de programación fetal.
3. MATERIAL Y MÉTODOS
3.1.Diseño experimental
En la figura 4 se detalla el diseño experimental que se llevó a cabo. Se emparejaron ratas Sprague- Dawley macho y hembra, y una vez confirmado el inicio de la gestación, las ratas gestantes hembras (generación F0) fueron alimentadas con una dieta estándar y se dividieron en dos grupos en función de la bebida administrada durante este periodo. El grupo de madres-Control recibió agua sin ningún tipo de aditivo, mientras que el grupo de madres-Fructosa recibió agua con una solución de fructosa al 10% (p/v).
Después del parto, la camada se estandarizó y, tanto las madres como las crías recibieron agua sin aditivos en ambos grupos hasta los 3 meses de edad, el comienzo de la segunda parte del estudio. La lactancia finalizó en el día 21 y solo las ratas macho (generación F1) continuaron el estudio recibiendo una dieta estándar y agua sin ningún suplemento. A los 3 meses de edad, todas las ratas macho, tanto las provenientes de madres-Control como de madres-Fructosa, fueron divididas en varios grupos dependiendo de la dieta que recibieron:
Grupo Control: recibieron una dieta sólida estándar y agua sin ningún aditivo (CC y FC).
Grupo de Fructosa: recibieron una dieta sólida estándar y agua con una solución de fructosa al 10% p/v. (CF y FF).
Grupo de Fructosa y sal: recibieron una dieta sólida estándar y agua con una solución de fructosa al 10% p/v y cloruro sódico al 0,9% p/v (CFSal y FFSal).
Grupo de Fructosa y colesterol: recibieron una dieta sólida estándar suplementada con un 2% de colesterol y agua suplementada con fructosa al 10% p/v (CFCol y FFCol) (Figura 4).
Figura 4. Diseño experimental. Creada con BioRender.com
Después de los 21 días de tratamiento, se procedió al sacrificio de las ratas. Se establecieron un total de 8 grupos experimentales de ratas macho (Figura 4). La primera letra de cada grupo indica el tratamiento administrado a las madres, mientras que la segunda letra representa el tratamiento recibido por los descendientes.
La recolección de la sangre se realizó utilizando tubos Vacutainer® con EDTA-K2. Para obtener el plasma, las muestras de sangre fueron sometidas a centrifugación (20 min, 3000 rpm, 4ºC), se dividieron en diferentes alícuotas y se almacenaron a -80ºC hasta el momento de la medición de los parámetros correspondientes. Por otro lado, los tejidos obtenidos fueron congelados en nitrógeno líquido inmediatamente después de su obtención y se conservaron a -80ºC hasta el momento de medir los parámetros deseados.
3.2. Ensayos de parámetros moleculares
3.2.1. Homogeneización de los tejidos y extracción del ARN
Para la extracción de ARN, se tomaron 100mg de muestra a los cuales se les añadió Tri Reagent® (Invitrogen, ThermoFisher, EEUU) y se homogeneizaron utilizando un TissueLyser LT (Qiagen, EEUU). Tri Reagent es un reactivo que permite lisar las células e inactivar las nucleasas para prevenir la degradación del ácido ribonucleico, gracias a que contiene fenol y tiocianato de guanidina.
El homogenado obtenido se centrifugó durante 10 minutos, a 16000g y 4ºC. Por último, se llevó a cabo el aislamiento del ARN con bromocloropropano (BCP), que produce la formación de una fase acuosa y otra orgánica. Se centrifugaron de nuevo las muestras en las mismas condiciones, lo que permitió extraer el ARN disuelto en la fase acuosa, mientras que el ácido desoxirribonucleico (ADN) y las proteínas permanecen en la fase orgánica y en la interfase.
3.2.2. Purificación del ARN. Cuantificación, determinación del grado de pureza e integridad del ARN. Tratamiento con DNasa.
El ARN aislado se purificó utilizando un kit de Invitrogen, ThermoFisher (EEUU): Ribopure TM. A continuación, el ARN obtenido se cuantificó y se identificó su grado de pureza. Para la cuantificación se utilizó un NanoDrop® One (ThermoFisher, EEUU) y se analizaron los siguientes parámetros:
Relación de absorbancias a 260 y 230nm (A260/230), que evalúa una posible contaminación con solventes orgánicos.
Relación de absorbancias a 260 y 280nm (A260/280), que determina una posible contaminación con proteínas.
La relación de las absorbancias en cuanto al grado de pureza de las muestras fue óptima en el rango entre 1.8 y 2.0.
Para determinar la integridad del ARN extraído se cargaron 500 nanogramos de ARN con tampón de carga y se realizó una electroforesis (90V, 20 minutos) en gel de agarosa (2% p/v) al que se añadió Midori Green Advance (Nippon Genetics). En el revelado del gel se observaron las bandas correspondientes al ARN ribosomal (18S y 28S) (se muestran en la Figura A1 del anexo).
Para asegurar la total eliminación del posible ADN contaminante en la muestra y evitar su interferencia en los posteriores análisis, se utilizó el kit Turbo DNA-freeTM (Invitrogen, ThermoFisher, EE.UU.), el cual contiene DNasas (desoxirribonucleasas) que degradan el ADN presente en la muestra. A continuación, se determinó de nuevo la concentración de ARN, siguiendo el protocolo mencionado anteriormente.
Por último, se realizó una reacción en cadena de la polimerasa (PCR) para comprobar la ausencia de ADN contaminante en las muestras utilizando los cebadores de RPS29 (proteína ribosomal S29), gen utilizado como gen de referencia. Tal y como se esperaba, no se observaron bandas de ADN en las muestras de ARN tratadas con DNasa.
3.2.3. Retrotranscripción
Para cuantificar la expresión génica o cantidad de ARNm de las muestras, es necesario convertir previamente el ARNm en ADN complementario (cDNA). Así, se realizó una retrotranscripción (reacción en cadena de la polimerasa transcriptasa inversa, RT-PCR) con el kit SuperScript® II Reverse Transcriptase (Invitrogen, EEUU) y el Termociclador iCycler (BioRad, EEUU), para la cual se utilizaron 2,5 ng de ARN tratado con DNasa de muestras de hígado e íleon.
Tras la retrotranscripción se llevó a cabo una PCR convencional (a punto final) con cebadores específicos del gen RPS29 y una electroforesis en gel de agarosa para asegurar que el ADNc obtenido era funcional obteniéndose el producto de amplificación del gen de referencia (Figura A2 del anexo).
3.2.4. Estudio de la expresión génica
La qPCR o PCR a tiempo real es una técnica que combina la amplificación y la detección en un mismo paso, ya que correlaciona el producto de la PCR de cada ciclo con una señal fluorescente, la cual aumenta de manera proporcional según avanzan los ciclos y el producto se amplifica. Para ello es necesario el empleo de un fluoróforo, que en nuestro caso fue SyBR-Green I, el cual tras asociarse al ADN de doble cadena emite una señal fluorescente (34).
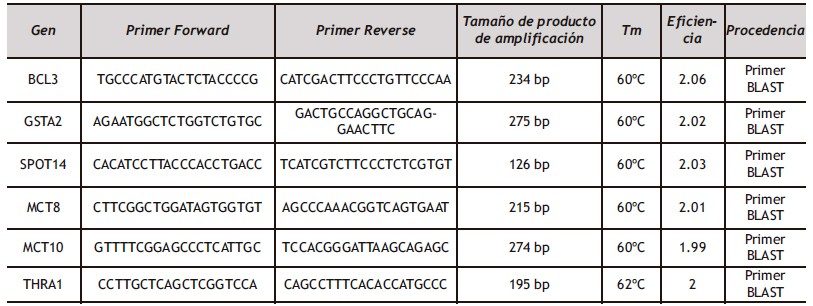
3.2.4.a Diseño de primers
La información sobre los primers empleados en el presente estudio se muestran en la Tabla A1 del anexo. Se utilizó Primer Blast para diseñar las parejas de cebadores en las siguientes condiciones: temperatura de melting (Tm) de 60ºC y de 100 a 300 pb de producto de amplificación. Se confirmó que los cebadores amplificaban de forma específica en la secuencia FASTA de los genes diana y se validó su secuencia con Beacon Designer.
3.2.4.b Preparación de la curva de calibrado
La utilización de la técnica de PCR a tiempo real para la cuantificación y estudio de la expresión génica precisa de la realización de una recta de calibrado para poder relacionar los valores de la señal de amplificación resultantes obtenidos en las muestras con la cantidad de ADN de las mismas. También se calculó la eficiencia de las parejas de primers (E) utilizando los Cp de las rectas de calibrado realizadas.
Las rectas de calibrado se realizaron para cada pareja de cebadores preparando diluciones seriadas 1:10 del ADNc de partida y obteniendo las concentraciones finales de 50, 5, 0.5 y 0.05 ng/mL
Por último, para verificar que los cebadores amplificaban el producto esperado y no se amplificaban productos no deseados, se llevó a cabo una curva de melting y una electroforesis en del de agarosa al 1% (p/v) (Figura A3 del anexo).
3.2.4.c Protocolo PCR a tiempo real para la cuantificación de la expresión génica
Se analizaron las muestras de ADNc obtenido a partir de hígado e íleon con los cebadores mencionados anteriormente en un Termociclador CFX96 Touch Real-Time PCR Detection System (BioRad, EEUU). En el protocolo de amplificación se llevó a cabo con un volumen total de 20mL por muestra y por duplicado. Para cuantificar la expresión génica se utilizó el método de Pfaffl, también conocido como el método 2- Ct (35).
Para cada muestra, los volúmenes de reactivos añadidos fueron: 6mL de agua mili-Q estéril, 1mL de cebador F (10mM), 1mL de cebador R (10mM), 2mL de muestra de ADNc y 10mL de SyBR Green Premix Ex Taq (Takara Bio Inc., Japón).
En cuanto al ADNc, para garantizar que los valores de Cp obtenidos tras la PCR se pudiesen interpolar en la recta de calibrado, la concentración utilizada fue de 5ng/mL, obtenida a partir de una dilución 1/30 del ADNc de partida en las muestras procedentes de hígado e íleon. Además, con esto se aseguraba que los valores de Cp se mantuvieran por debajo de los 33 ciclos, a partir de los cuales aumenta el riesgo de obtener amplificaciones inespecíficas y disminuye la eficiencia.
La cuantificación de la expresión génica mediante q-PCR requiere de un gen de referencia, para corregir las variaciones no específicas y experimentales, ya que su expresión se mantiene constante independientemente de las condiciones experimentales. Como gen de referencia se utilizó RPS29.
3.2.8. Análisis estadístico
El análisis de los datos obtenidos en función de los efectos del tratamiento recibido se realizó mediante un análisis de varianza de doble vía (ANOVA). Los resultados correspondientes a cada grupo experimental se presentaron como la media ± error estándar (S.E.).
Para evaluar la significancia de cada una de las varianzas, se utilizó la corrección de Bonferroni cuando se obtuvieron resultados estadísticamente significativos (p<0,05). El análisis estadístico se llevó a cabo mediante el software SPSS (versión 27).
De esta forma, aquellos resultados que presentaron significancia estadística se muestran:
Con almohadillas (#) si se presentan diferencias estadísticamente significativas (# P<0.05; ## P<0.01; ### P<0.001) entre los descendientes tratados con la misma dieta durante su edad adulta (21 días), pero procedentes de madres tratadas con diferente dieta durante la gestación (Factor madre: M; Madres control vs. Madres fructosa).
Con asteriscos (*) si se presentan diferencias estadísticamente significativas (* P<0.05; ** P<0.01; *** P<0.001) entre los descendientes tratados con diferente dieta durante su edad adulta (21 días), pero procedentes de madres tratadas con la misma dieta durante la gestación (Factor dieta: D).
El valor de η2 determina la proporción de varianza atribuida a la influencia de la madre (M), de la dieta en la descendencia (D) o a la interacción entre ambos parámetros (M*D).
4. RESULTADOS Y DISCUSIÓN
Con el objetivo de facilitar la organización y el análisis de los resultados, se han llevado a cabo dos estudios por separado en función de la dieta de la descendencia en la edad adulta (Fructosa vs Fructosa y sal; Fructosa vs Western diet). Además, se ha considerado el tejido involucrado en dichos estudios, que incluyen hígado e íleon.
Los datos obtenidos de la medición de la expresión génica de FAS, ACLY, PNPL3 y SREBP1c han sido cedidos, obtenidos anteriormente por el mismo grupo de investigación.
Los datos obtenidos, tanto de la medición de la expresión génica de THRa, como los datos de concentración de hormonas tiroideas en plasma proceden del anterior trabajo de investigación realizado.
4.1. Efectos de la Fructosa vs Fructosa + sal
4.1.1. Hígado
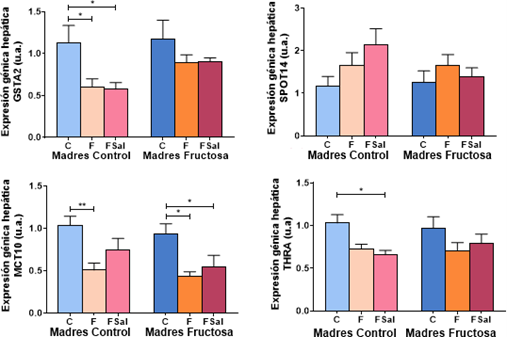
Tras el análisis estadístico realizado sobre los resultados de expresión génica en hígado, ANOVA de doble vía, se observaron diferencias estadísticamente significativas por el efecto del tratamiento recibido en la descendencia en la edad adulta (D) en cuanto a la expresión de GSTA2 (p=0,010), MCT10 (p=0,000) y THRA (p=0,007) (Tabla 1).ay HIG GSTA2 HIG SPOT14 HIG
Tras la corrección de Bonferroni, se obtuvieron los resultados que se muestran en la Figura 5. En los resultados de la expresión génica obtenidos en hígado se puede observar que tanto GSTA2, THRa y MCT10 presentan perfiles muy similares. De esta manera, se observa que la suplementación con fructosa, tanto sola como con sal, provoca una reducción en la expresión de GSTA2 en comparación con el grupo control, tanto en los descendientes de madres control como en los de madres fructosa si bien solo se alcanzaron diferencias significativas en los descendientes de madres control (Figura 5).
Tabla 1. ANOVA de doble vía expresión génica de GSTA2, SPOT14, MCT10 y THRa en hígado. p valor: representa la probabilidad de obtener un resultado igual o más extremo que el observado, asumiendo que la hipótesis nula es verdadera . η2: representa la proporción de la varianza total en una variable de interés, en este caso: a la influencia de la madre (M), a de la dieta en la descendencia.
Figura 5. Expresión génica de GSTA2, SPOT14, MCT10 y THRa en hígado de machos F1 tras los 21 días de tratamiento (barra azul: agua-C; barra naranja: fructosa-F; barra rosa: fructosa+sal-FSal). Las barras más claras pertenecen a los machos F1 descendientes de madres control (recibieron agua sin aditivos durante la gestación), mientras que las oscuras pertenecen a machos F1 descendientes de madres fructosa (recibieron fructosa como tratamiento en el agua de bebida durante la gestación). Los datos presentados son las medias ± error estándar (S.E.). El símbolo * indica diferencias estadísticamente significativas entre dietas, y el # entre la ingesta materna.
En cuanto a la expresión de THRa en hígado se observa un perfil similar al de GSTA2 en los descendientes de madres control pero en los descendientes de madres fructosa esa tendencia a la disminución de la expresión se atenúa (Figura 5). Y en la expresión del transportador MCT10, el perfil es el mismo que en los casos anteriores, pero en este gen la reducción en la expresión es significativa, tanto en los descendientes de madres control como en los hijos de madres-fructosa.
Por último, en la expresión de SPOT14 en hígado observamos una tendencia al aumento de la expresión en los descendientes de madres control que recibieron fructosa (CF) que es más pronunciada cuando se añade sal (CFSal), alcanzando valores casi-significativos (p=0,052 CFSal respecto a CC); tendencia que, sin embargo, no se llega a apreciar en hijos de madres fructosa (Figura 5).
Es de reseñar, además, que el gen diana GSTA2 en hígado parece responder mejor al transportador MCT10 y a THRa que a la concentración de T4 (Tabla A2 del anexo).
4.1.2. Íleon
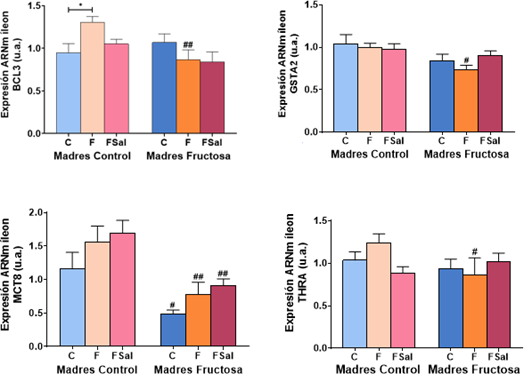
El análisis de varianza ANOVA de doble vía realizado sobre la expresión de BCL3 en el íleon (Tabla 2) muestra que se encuentran diferencias significativas debidas a la influencia del tratamiento recibido por la madre durante la gestación (M; p=0,034) y por el efecto de la interacción entre ambos tratamientos (M*D; p=0,021).
También se observan diferencias estadísticamente significativas en GSTA2 (p=0,008) influenciadas por la dieta recibida por la madre durante la gestación (M). Por último, se encontraron diferencias estadísticamente significativas relativas a la expresión de MCT8 (p=0,000) por el efecto del tratamiento recibido por la madre (M) y también por la dieta recibida por la descendencia (D; p=0,048).
Tras la corrección a posteriori de Bonferroni, se muestran los datos obtenidos de la expresión génica analizada en íleon (Figura 6). En cuanto a la expresión génica de BCL3, el consumo de fructosa en descendientes de madres control (CF) produce un aumento de la expresión estadísticamente significativo con respecto al grupo control (CC), que no se observa cuando los descendientes tomaron fructosa y sal. Este efecto inducido únicamente por el consumo de fructosa no se observó en los descendientes de madres fructosa (FF). Por ello, encontramos que la expresión de BCL3 en los animales suplementados con fructosa procedentes de madres fructosa (FF) es significativamente inferior a la de los animales descendientes de madres control que recibieron la misma dieta (CF) poniendo de manifiesto un efecto claro derivado de la dieta materna.
Tabla 2. ANOVA de doble vía expresión génica de BCL3, GSTA2, MCT8 y THRa en íleon. p valor: representa la probabilidad de obtener un resultado igual o más extremo que el observado, asumiendo que la hipótesis nula es verdadera . η2: representa la proporción de la varianza total en una variable de interés, en este caso: a la influencia de la madre (M), a de la dieta en la descendencia (D) o a la interacción entre ambos parámetros (M*D).
Figura 6. Expresión génica de BCL3, GSTA2, MCT8 y THRa en íleon de machos F1 tras los 21 días de tratamiento (barra azul: agua-C; barra naranja: fructosa-F; barra rosa: fructosa+sal-FSal). Las barras más claras pertenecen a los machos F1 descendientes de madres control (recibieron agua sin aditivos durante la gestación), mientras que las oscuras pertenecen a machos F1 descendientes de madres fructosa (recibieron fructosa como tratamiento en el agua de bebida durante la gestación). Los datos presentados son las medias ± error estándar (S.E.). El símbolo * indica diferencias estadísticamente significativas entre dietas, y el # entre la ingesta materna.
Comparando la expresión génica de GSTA2, se observa que la ingesta de fructosa provoca una ligera tendencia a la disminución de la expresión de GSTA2 frente al grupo control (FC) en los descendientes de madres fructosa (grupo FF) alcanzando valores significativamente inferiores a los encontrados en los descendientes de madres control que también consumieron fructosa (CF). Ello muestra que el cambio en la expresión es dependiente del tratamiento recibido por la madre durante la gestación. Estos efectos no se observan cuando se añade sal a la dieta (Figura 6).
Con respecto a la expresión de THRa en el íleon, guarda un perfil similar al de la expresión de BCL3. Así observamos que la expresión del gen en los machos que recibieron fructosa y son descendientes de madres control (CF) experimenta una tendencia al aumento provocado por la fructosa con respecto al grupo control (CC). Además, los machos que consumieron fructosa y eran descendientes de madres fructosa (FF), mostraron, al igual que en BCL3, una expresión significativamente menor de THRa al de los procedentes de madres control que recibieron el mismo tratamiento (CF). Este efecto no se observó al añadir sal a la dieta.
Esto indica que el efecto observado en los genes diana de las hormonas tiroideas es dependiente del tratamiento recibido por la madre durante la gestación y de la fructosa recibida por la descendencia durante el tratamiento, aunque estos efectos desaparecen con la adición de sal a la dieta. Además, la respuesta de BCL3 y GSTA2 parece ser más sensible a los transportadores y al receptor que a la concentración de T4 en plasma (Tabla A2 del anexo).
Curiosamente, en cuanto a la expresión génica de MCT8 se observa que la adición de sal al tratamiento con fructosa acentúa la tendencia al aumento de expresión del transportador observada únicamente por el efecto de la fructosa, tanto en descendientes de madres control como en descendientes de madres fructosa. Sin embargo, todos los descendientes de madres fructosa mostraron una expresión significativamente menor a la encontrada en los machos descendientes de madres control que recibieron la misma dieta (Figura 6).
Varios estudios han demostrado que THRa está estrechamente involucrado en la respuesta de los genes diana a la señal hormonal de la hormona tiroidea (36). Por ejemplo, estudios de interferencia génica han revelado la correlación entre la expresión de THRa y la expresión de los genes diana en diversos tejidos y células (37 y 38), incluso en la ausencia de hormona.
Además, se ha observado que los transportadores MCT8 y MCT10 tienen una alta afinidad por la hormona tiroidea y pueden facilitar el transporte intracelular de la hormona tiroidea hacia los núcleos de las células objetivo, así, la coordinación entre THRa y los transportadores MCT8 y MCT10 contribuye a la eficiencia del transporte intracelular de las hormonas tiroideas y la especificidad de la respuesta de los genes diana. Esto asegura una disponibilidad adecuada de T4 para la unión a THRa y la activación de la respuesta de los genes diana.
4.2. Efectos de la fructosa vs Fructosa + Colesterol
4.2.1. Hígado
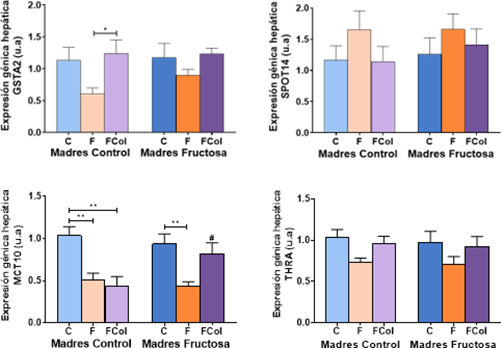
Se llevó a cabo el estudio de los efectos del tratamiento de fructosa frente a los efectos del tratamiento de fructosa y colesterol en la expresión hepática de los genes de la Tabla 3, utilizando un análisis de varianza ANOVA de doble vía. Se observaron diferencias estadísticamente significativas debido a la dieta recibida por la descendencia (D) en la expresión de GSTA2 (p=0,015), MCT10 (p=0,000) y THRA (p=0,021).
Tras el test de Bonferroni a posteriori, en la expresión de los genes en el hígado se observó que, en el gen GSTA2, aunque la tendencia era la misma, tanto en los descendientes de madres-control como en los de madres-fructosa, únicamente existen diferencias estadísticamente significativas en la expresión de GSTA2 en los descendientes de madres control. De hecho, observamos en este grupo que la adición de colesterol en la dieta combinada con fructosa (CFCol) provoca un aumento.
En la expresión del gen diana SPOT14 se halló un perfil completamente inverso, dado que el efecto del consumo de fructosa por parte de los descendientes fue el contrario. Tanto en descendientes de madres-control como en descendientes de madres-fructosa (CF y FF) se observa como la ingesta de fructosa provoca una tendencia al aumento de la expresión comparado con sus grupos control respectivos (CC y FC) y dicho aumento se atenúa o desaparece al añadir colesterol a la dieta sólida (CFCol y FFCcol) (Figura 7).
Para poder encontrar una explicación a estos resultados, se midieron las expresiones del transportador de hormona tiroidea y de su receptor alfa. Así, se encontró en los descendientes que provenían de madres-fructosa, una disminución estadísticamente significativa de la expresión de MCT10 en los machos que consumieron fructosa (FF) frente a los que recibieron agua durante el tratamiento (FC), e incluso cuasi-significativo (P=0,06) respecto a los que además tomaron colesterol (FFCol). Sin embargo, en los descendientes de madres control, la fructosa provoca una reducción significativa de la expresión (CF) que se observa también cuando se añade colesterol a la dieta (CFCol) (Figura 7).
En cuanto a la expresión de THRa, guarda un perfil similar al de GSTA2 e inverso a la de SPOT14, la reducción de la expresión observada debida al consumo de fructosa tanto en descendientes de madres control como de madres fructosa desaparece cuando la fructosa se combina con colesterol en la dieta, pero las diferencias no llegan a ser significativas (Figura 7).
Tabla 3. ANOVA de doble vía expresión génica de GSTA2, SPOT14 , MCT10 y THRa en hígado. p valor: representa la probabilidad de obtener un resultado igual o más extremo que el observado, asumiendo que la hipótesis nula es verdadera . η2: representa la proporción de la varianza total en una variable de interés, en este caso: a la influencia de la madre (M), a de la dieta en la descendencia (D) o a la interacción entre ambos parámetros (M*D).
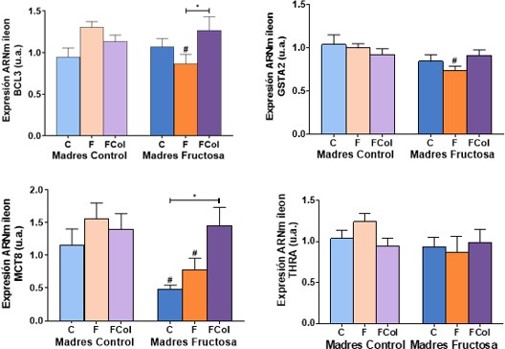
Figura 7. Expresión génica de GSTA4, SPOT14, MCT10 y THRa en hígado de machos F1 tras los 21 días de tratamiento (barra azul: agua-C; barra naranja: fructosa-F; barra morada: fructosa+colesterol-Fcol). Las barras más claras pertenecen a los machos F1 descendientes de madres control (recibieron agua sin aditivos durante la gestación), mientras que las oscuras pertenecen a machos F1 descendientes de madres fructosa (recibieron fructosa como tratamiento en el agua de bebida durante la gestación). Los datos presentados son las medias ± error estándar (S.E.). El símbolo * indica diferencias estadísticamente significativas entre dietas, y el # entre la ingesta materna.
4.2.2. Íleon
En los resultados del análisis de varianza ANOVA de doble vía en relación a la expresión de los genes en íleon (Tabla 4) se observa que, en BCL3 existen diferencias estadísticamente significativas debidas a la interacción entre el tratamiento de la madre durante la gestación y el que recibió la descendencia en la edad adulta (M*D; p=0,026). En cuanto a la expresión de GSTA2, se encontraron diferencias estadísticamente significativas influenciadas por el tratamiento recibido por la madre durante la gestación (M; p=0,020). Por otro lado, en la expresión del gen MCT8, se observaron diferencias estadísticamente significativas tanto por el efecto del tratamiento recibido por los machos en la edad adulta (D; p=0,039), como por el efecto de la dieta de la madre durante la gestación (M; p=0,017).
Tras la corrección de Bonferroni, la expresión génica analizada en el íleon muestra un perfil muy similar para los genes BCL3, MCT8 y THRa. Así, en la expresión del gen diana BCL3 se observa que en descendientes de madres control el consumo de fructosa (CF) produce un aumento de la expresión que no llega a ser significativo con respecto al grupo control (CC) y que se ve atenuado por la adición de colesterol a la dieta (CCol), al igual que ocurre en MCT8 y THRa. Sin embargo, sí existen diferencias significativas entre los machos que consumieron fructosa, que eran descendientes de madres control (CF) que presentan una expresión superior de BCL3 y MCT8 a los que recibieron el mismo tratamiento y eran descendientes de madres fructosa (FF). Este mismo efecto se puede observar en GSTA2 (indicado en la figura con almohadilla, #). Además, en BCL3 se observan diferencias estadísticamente significativas entre los machos que consumieron fructosa (FF) y los que consumieron fructosa y colesterol añadido a la dieta (FFCol), en los descendientes de madres fructosa (Figura 8).
Tabla 4. ANOVA de doble vía expresión génica de BCL3, GSTA2, MCT8 y THRa en íleon. p valor: representa la probabilidad de obtener un resultado igual o más extremo que el observado, asumiendo que la hipótesis nula es verdadera . η2: representa la proporción de la varianza total en una variable de interés, en este caso: a la influencia de la madre (M), a de la dieta en la descendencia (D) o a la interacción entre ambos parámetros (M*D).
Figura 8. Expresión génica de BCL3, GSTA2, MCT8 y THRa en íleon de machos F1 tras los 21 días de tratamiento (barra azul: agua-C; barra naranja: fructosa-F; barra morada: fructosa+colesterol-Fcol). Las barras más claras pertenecen a los machos F1 descendientes de madres control (recibieron agua sin aditivos durante la gestación), mientras que las oscuras pertenecen a machos F1 descendientes de madres fructosa (recibieron fructosa como tratamiento en el agua de bebida durante la gestación). Los datos presentados son las medias ± error estándar (S.E.). El símbolo * indica diferencias estadísticamente significativas entre dietas, y el # entre la ingesta materna.
Por último, el perfil de THRa es similar al observado para BCL3 para los descendientes de madres control, pero en el caso de THRa no se hallaron diferencias estadísticamente significativas. La fructosa produce una tendencia al aumento de la expresión en los descendientes de madres control (CF), que desaparece al añadir colesterol a la dieta. A su vez, el consumo materno de fructosa durante la gestación produce una disminución de la expresión en animales suplementados con fructosa (FF) comparado con los descendientes de madres control que recibieron el mismo tratamiento (CF), efecto que también desparece al añadir colesterol a la dieta. Por lo que el efecto en la expresión génica que se observa está influenciado no solo por la dieta recibida por la descendencia en la edad adulta, sino también por el tratamiento recibido por la madre durante la gestación. Curiosamente en el hígado, este efecto de la dieta materna no se daba.
Según los resultados obtenidos, los genes diana de las hormonas tiroideas BCLA3, GSTA2 y SPOT14 parecen tener una respuesta más significativa y pronunciada hacia los transportadores estudiados (MCT8 y MCT10) para cada uno de los tejidos (hígado e íleon) y, especialmente al receptor de hormonas tiroideas THRa, que a la concentración de T4 libre en plasma (Tabla A2 del anexo), para los cuales no se obtuvieron diferencias significativas. Por lo que la actividad de los transportadores y la disponibilidad de THRa tienen un papel relevante en su regulación.
4.3. Genes lipogénicos
4.3.1. Hígado
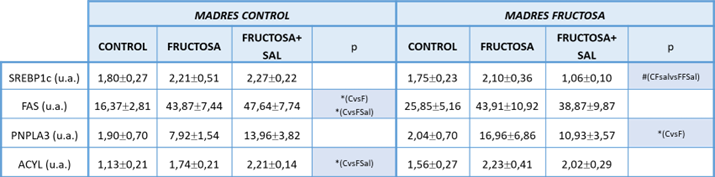
Teniendo en cuenta que habíamos encontrado una respuesta clara de la expresión hepática de SPOT14 a las diferentes dietas y dado que es un gen lipogénico y la lipogénesis es una vía regulada por las hormonas tiroideas, quisimos comprobar si había alguna relación entre los resultados aquí encontrados y los descritos dentro del mismo grupo de investigación con anterioridad. En el caso de la expresión génica analizada para SPOT14 en hígado (Figura 5), el perfil mostrado es muy similar a la expresión de los genes FAS, ACLY y PNPLA3 en el estudio de los efectos de la fructosa frente a los efectos del tratamiento con fructosa y sal, como se muestra en la Tabla 5. Y también se observa un perfil similar cuando se comparan los datos de expresión de SPOT14 (Figura 7) y la de los genes lipogénicos obtenidos para fructosa y Western diet, tanto para descendientes de madres control como hijos de madres-fructosa (Tabla 6). Sin embargo, es muy llamativo que el perfil de expresión de SPOT14 difiere de los resultados obtenidos para SREBP1C, un factor de transcripción eminentemente lipogénico.
Tabla 5. Resultados de la expresión génica de SREBP1c, FAS, PNPLA3 y ACLY en hígado de machos F1 tras los 21 días de tratamiento (Fructosa vs Fructosa+Sal). Los datos de expresión génica presentados son las medias ± error estándar (S.E.). En la columna p se representan las diferencias estadísticamente significativas entre grupos, el símbolo * indica diferencias estadísticamente significativas entre dietas, y el # entre la ingesta materna.
Tabla 6. Resultados de la expresión génica de SREBP1c, FAS, PNPLA3 y ACLY en hígado de machos F1 tras los 21 días de tratamiento (Fructosa vs Fructosa+colesterol). Los datos de expresión génica presentados son las medias ± error estándar (S.E.). En la columna p se representan las diferencias estadísticamente significativas entre grupos, el símbolo * indica diferencias estadísticamente significativas entre dietas, y el # entre la ingesta materna.
El gen SPOT14, u homólogo sensible de SPOT14 a la hormona tiroidea (THRSP), es un gen lipogénico cuya expresión está regulada por diversos factores de transcripción, entre los que se encuentran el receptor de la hormona tiroidea, receptor X hepático (LXR) o la proteína de unión al elemento regulador de esteroles hepáticos 1c (SREBP-1c). Todo esto implica que su regulación y expresión juegan un papel relevante en la patogenia relacionada con la obesidad (39).
Por otra parte, SPOT14 es un cofactor de transcripción con una amplia presencia en tejidos lipogénicos y responde rápidamente a estímulos lipogénicos, entre ellos la hormona tiroidea, la cual es un potente inductor de la lipogénesis, o una dieta rica en carbohidratos (40, 41 y 42). De hecho, SPOT14 actúa como cofactor en la interacción de la hormona tiroidea con sus respectivos receptores, además de en la activación de la transcripción de enzimas lipogénicas a través de los receptores de hormonas tiroideas (42 y 43).
Los niveles de colesterol también son relevantes en cuanto a la regulación de la expresión de SPOT14, lo que está estrechamente relacionado con los genes lipogénicos FAS, PNPLA3 y ACLY.
En otros estudios, se ha visto cómo un aumento de la expresión de SRBEP-1c aumentaba la actividad del promotor de THRSP (SPOT14) (39). Sin embargo, la relación entre SREBP-1c y SPOT14 puede ser compleja y estar influenciada por otros factores de regulación génica, ya que existen diversos mecanismos moleculares que influyen y la expresión génica de SPOT14 no responde solo al gen SREBP-1c. Todo esto sugiere que los modelos estudiados en este trabajo, sobre todo en el estudio del efecto de la fructosa frente al de la fructosa con colesterol añadido a la dieta, la lipogénesis parece responder más a THRa que a SREBP1C.
5. CONCLUSIONES
En base a los resultados obtenidos, las conclusiones del presente estudio son las siguientes:
En el contexto del metabolismo de las hormonas tiroideas, mientras que en hígado no se observan diferencias nutrigenómicas entre los descendientes de madres control y los de madres fructosa, en íleon hay una clara influencia de la dieta materna.
La expresión hepática estudiada de los genes diana para hormonas tiroideas muestra una mayor respuesta a las diferentes dietas principalmente en el transportador MCT10 y THRa, que a la concentración plasmática de T4.
La expresión intestinal estudiada de los genes diana para hormonas tiroideas muestra una mayor respuesta a las diferentes dietas en el transportador MCT8 en los descendientes de madres fructosa, mientras que está más relacionada con THRa en los hijos de madres control, sin tener relación alguna con la concentración plasmática de T4.
Los cambios de expresión provocados por la fructosa en SPOT14 presentan un perfil similar al de otros genes lipogénicos estudiados anteriormente, como ACLY, FAS y PNPLA3; y muestra un perfil diferente a SREBP-1c. Este hecho sugiere que, en los modelos estudiados en el presente trabajo, la función de THRa es más relevante en la lipogénesis que la del factor SREBP-1c.
LISTA DE ABREVIATURAS
ACC Acetil CoA carboxilasa
ACLY ATP citrato sintasa
ATP Adenosín trifosfato
BCL3 de sus siglas en inglés “B-cell lymphoma 3-encoded protein”
BCP Bromocloropropano
CC Grupo Control-Control
cDNA DNA complementario
CF Grupo Control- Fructosa
CFCol Grupo Control- Fructosa+colesterol
CFSal Grupo Control- Fructosa+sal
ChREBP Proteína de unión al elemento de respuesta a carbohidratos
CIC Transportador mitocondrial de citrato
DHP Dihidroxiacetona fosfato
EDTA-K2 Ácido etilendiaminotetraacético dipotásico
FAS Ácido graso sintasa
FC Grupo Fructosa- Control
FF Grupo Fructosa- Fructosa
FFCol Grupo Fructosa- Fructosa+colesterol
FFSal Grupo Fructosa- Fructosa+sal
G6P Glucosa-6-fosfato
GA Gliceraldehido
GA3P Gliceraldehido-3-fosfato
GAP Gliceraldehído fosfato
GLUT Transportador de glucosa
GSTA2 Gen de la glutatión S-transferasa alpha2
JMAF Jarabe de maíz alto en fructosa
LXR Receptor X hepático
MCT8 Gen del transportador de monocarboxilatos 8, en humanos codificado por el gen SLC16A2
MCT10 Gen del transportador de monocarboxilatos 10, en humanos codificado por el gen SLC16A10
PFK1 Fosfofructoquinasa 1
PNPLA3 Gen de la proteína 3 que contiene el dominio de la fosfolipasa similar a la patatina
qPCR Reacción en cadena de la polimerasa en tiempo real
RPS29 Gen de la proteína ribosomal 40S 29S
rT3 Triyodotironina inversa
SGLT1 Cotransportador sodio-glucosa 1
SPOT14 Gen de la proteína hepática inducible por hormona tiroidea, en humanos está codificada Por el gen THRSP
SREBP-1c Proteína 1c de unión al elemento regulador de esteroles
T3 Triyodotironina
T4 Tiroxina
THRa Receptor de la hormona tiroidea alpha
TRE Elementos de Respuesta a las hormonas Tiroideas
6. REFERENCIAS
- Jorge Hugo Kasangian (2012). “Jarabe de maíz de alta fructosa, y su relación con la obesidad y la industria alimenticia moderna”.
- López, M. L. P., Villavicencio, A. Z., Aguirre, B. A. R., & Gómez, M. A. C. (2020). Consumo de fructosa y sus implicaciones para la salud. Medicina e Investigación Universidad Autónoma del Estado de México, 8(2), 38-44.
- Zago, L., Zugasti, B., Zuleta, Á., Presner, N., Lobbe, V., & De la Plaza, M. (2017). “Análisis crítico del consumo de fructosa parte 1. la fructosa en la alimentación. aspectos metabólicos. Critical analysis of fructose consumption part one. The fructose on nutrition. metabolic aspects”. Actualización en Nutrición, 18(1), 26-36.
- Carvallo, P., Carvallo, E., Barbosa-da-Silva, S., Mandarim-de-Lacerda, C. A., Hernández, A., & del-Sol, M. (2019). Efectos metabólicos del consumo excesivo de fructosa añadida. International Journal of Morphology, 37(3), 1058- 1066.
- Hannou, S. A., Haslam, D. E., McKeown, N. M., & Herman, M. A. (2018). Fructose metabolism and metabolic disease. The Journal of clinical investigation, 128(2), 545–555. https://doi.org/10.1172/JCI96702
- Stanhope, K. L., Medici, V., Bremer, A. A., Lee, V., Lam, H. D., Nunez, M. V., Chen, G. X., Keim, N. L., & Havel, P. J. (2015). A dose-response study of consuming high-fructose corn syrup-sweetened beverages on lipid/lipoprotein risk factors for cardiovascular disease in young adults. The American journal of clinical nutrition, 101(6), 1144– 1154. https://doi.org/10.3945/ajcn.114.100461
- Vasselli J. R. (2008). Fructose-induced leptin resistance: discovery of an unsuspected form of the phenomenon and its significance. Focus on “Fructose-induced leptin resistance exacerbates weight gain in response to subsequent high-fat feeding” by Shapiro et al. American journal of physiology. Regulatory, integrative and comparative physiology, 295(5), R1365–R1369. https://doi.org/10.1152/ajpregu.90674.2008
- Shi, J. H., Lu, J. Y., Chen, H. Y., Wei, C. C., Xu, X., Li, H., Bai, Q., Xia, F. Z., Lam, S. M., Zhang, H., Shi, Y. N.,Cao, D., Chen, L., Shui, G., Yang, X., Lu, Y., Chen, Y. X., & Zhang, W. J. (2020).
- Liver ChREBP Protects Against Fructose-Induced Glycogenic Hepatotoxicity by Regulating L-Type Pyruvate Kinase. Diabetes, 69(4), 591–602. https://doi.org/10.2337/db19-0388
- Bocarsly, M. E., Powell, E. S., Avena, N. M., & Hoebel, B. G. (2010). High-fructose corn syrup causes characteristics of obesity in rats: increased body weight, body fat and triglyceride levels. Pharmacology, biochemistry, and behavior, 97(1), 101–106. https://doi.org/10.1016/j.pbb.2010.02.012
- Arango Ramírez, J. S., Lopera, J., Macias, C., & Rua, F. (2019, Agosto). Cuestiones sociocientíficas en la clase de ciencias naturales: el caso del jarabe de maíz de alta fructuosa en la industria alimentaria. In Vl Congreso Nacional de Investigación en Educación en Ciencias y Tecnología.
- Loza-Medrano, S. S., Baiza-Gutman, L. A., Ibáñez-Hernández, M. Á., Cruz-López, M., & Díaz-Flores, M. (2018). Alteraciones moleculares inducidas por fructosa y su impacto en las enfermedades metabólicas. Revista Médica del Instituto Mexicano del Seguro Social, 56(5), 491-504.
- Herrera, E.; Ramos M.P.; Roca P.; and Viana, M.: “Bioquímica Básica”. Ed. Elsevier, 2014.
- Lehninger, A.L.; Nelson, D.L.; and Cox M.M.: “Principios de Bioquímica”. 5ª Edición. Ed. Omega, S.A. Barcelona. 2009.
- Shi, Y. N., Liu, Y. J., Xie, Z., & Zhang, W. J. (2021). Fructose and metabolic diseases: too much to be good. Chinese medical journal, 134(11), 1276–1285. https://doi.org/10.1097/CM9.0000000000001545
- Bray, G. A., Nielsen, S. J., & Popkin, B. M. (2004). Consumption of high-fructose corn syrup in beverages may play a role in the epidemic of obesity. The American journal of clinical nutrition, 79(4), 537–543. https://doi.org/10.1093/ajcn/79.4.537
- Angosto, M. C. (2015). Lipogénesis de “novo” y termogénesis. Monografías de la Real Academia Nacional de Farmacia.
- Ameer, F., Scandiuzzi, L., Hasnain, S., Kalbacher, H., & Zaidi, N. (2014). De novo lipogenesis in health and disease. Metabolism: clinical and experimental, 63(7), 895–902. https://doi.org/10.1016/j.metabol.2014.04.003
- Mendoza, A., Tang, C., Choi, J., Acuña, M., Logan, M., Martin, A. G., Al-Sowaimel, L., Desai, B. N., Tenen, D. E.,
- Jacobs, C., Lyubetskaya, A., Fu, Y., Liu, H., Tsai, L., Cohen, D. E., Forrest, D., Wilson, A. A., & Hollenberg, A. N. (2021). Thyroid hormone signaling promotes hepatic lipogenesis through the transcription factor ChREBP. Science signaling, 14(709), eabh3839. https://doi.org/10.1126/scisignal.abh3839
- Johnson, R. J., Nakagawa, T., Sanchez-Lozada, L. G., Shafiu, M., Sundaram, S., Le, M., Ishimoto, T., Sautin, Y. Y., & Lanaspa, M. A. (2013). Sugar, uric acid, and the etiology of diabetes and obesity. Diabetes, 62(10), 3307–3315. https://doi.org/10.2337/db12-1814
- Douard, V., & Ferraris, R. P. (2013). The role of fructose transporters in diseases linked to excessive fructose intake. The Journal of physiology, 591(2), 401–414. https://doi.org/10.1113/jphysiol.2011.215731
- Silva, J. E., & Bianco, S. D. (2008). Thyroid-adrenergic interactions: physiological and clinical implications. Thyroid official journal of the American Thyroid Association, 18(2), 157–165. https://doi.org/10.1089/thy.2007.0252
- Neto, J. G. O., Romão, J. S., Pazos-Moura, C. C., & Oliveira, K. J. (2023). Fructose consumption induces molecular adaptations involving thyroid function and thyroid-related genes in brown adipose tissue in rats. Brazilian journal of medical and biological research = Revista brasileira de pesquisas médicas e biológicas, 55, e12240. https://doi.org/10.1590/1414-431X2022e12240
- Matsubara, K., Sanoh, S., Ohta, S., Kitamura, S., Sugihara, K., & Fujimoto, N. (2012). An improved thyroid hormone reporter assay to determine the thyroid hormone-like activity of amiodarone, bithionol, closantel and rafoxanide. Toxicology letters, 208(1), 30–35. https://doi.org/10.1016/j.toxlet.2011.10.004
- Colbert, C. L., Kim, C. W., Moon, Y. A., Henry, L., Palnitkar, M., McKean, W. B., Fitzgerald, K., Deisenhofer, J., Horton, J. D., & Kwon, H. J. (2010). Crystal structure of Spot 14, a modulator of fatty acid synthesis. Proceedings of the National Academy of Sciences of the United States of America, 107(44), 18820–18825. https://doi.org/10.1073/pnas.1012736107
- Bárez-López, S., Grijota-Martínez, C., Liao, X. H., Refetoff, S., & Guadaño-Ferraz, A. (2019). Intracerebroventricular administration of the thyroid hormone analog TRIAC increases its brain content in the absence of MCT8. PloS one, 14(12), e0226017. https://doi.org/10.1371/journal.pone.0226017
- Friesema, E. C., Ganguly, S., Abdalla, A., Manning Fox, J. E., Halestrap, A. P., & Visser, T. J. (2003). Identification of monocarboxylate transporter 8 as a specific thyroid hormone transporter. The Journal of biological chemistry, 278(41), 40128–40135. https://doi.org/10.1074/jbc.M300909200
- de Calvo, O. L., & de Santos, L. C. (2020). Expertos en fisiología: resumen de lo que debes saber de las hormonas tiroideas. Revista Médico Científica, 33(2), 31-45.
- Brent G. A. (2012). Mechanisms of thyroid hormone action. The Journal of clinical investigation, 122(9), 3035– 3043. https://doi.org/10.1172/JCI60047
- Li, M., Reynolds, C. M., Segovia, S. A., Gray, C., & Vickers, M. H. (2015). Developmental Programming of Nonalcoholic Fatty Liver Disease: The Effect of Early Life Nutrition on Susceptibility and Disease Severity in Later Life. BioMed research international, 2015, 437107. https://doi.org/10.1155/2015/437107
- Rangel-Huerta, O. D., Pastor-Villaescusa, B., Aguilera, C. M., & Gil, A. (2015). A Systematic Review of the Efficacy of Bioactive Compounds in Cardiovascular Disease: Phenolic Compounds. Nutrients, 7(7), 5177–5216. https://doi.org/10.3390/nu7075177
- Vickers, M. H., Krechowec, S. O., & Breier, B. H. (2007). Is later obesity programmed in utero?. Current drug targets, 8(8), 923–934. https://doi.org/10.2174/138945007781386857
- Liao, X. P., Yu, Y., Marc, I., Dubois, L., Abdelouahab, N., Bouchard, L., Wu, Y. T., Ouyang, F., Huang, H. F., & Fraser, W. D. (2019). Prenatal determinants of childhood obesity: a review of risk factors 1. Canadian journal of physiology and pharmacology, 97(3), 147–154. https://doi.org/10.1139/cjpp-2018-0403
- Wang, P., Wu, T., Fu, Q., Liao, Q., Li, Y., Huang, T., Li, Y., Zhou, L., & Song, Z. (2022). Maternal High-Fructose Intake Activates Myogenic Program in Fetal Brown Fat and Predisposes Offspring to Diet-Induced Metabolic Dysfunctions in Adulthood. Frontiers in nutrition, 9, 848983. https://doi.org/10.3389/fnut.2022.848983
- Aguilera, P., Tachiquín, M. R., Graciela, M., Munive, R., & Olvera, B. P. (2014). PCR en tiempo real. Herramientas moleculares aplicadas en ecología: aspectos teóricos y prácticos. México DF: SEMARNAT, INECC, UAM-I, 175- 201.
- Pfaffl M.W., (2001) “A new mathematical model for relative quantification in real-time RT-PCR”. Nucleic Acids Research, 29 (9). e45-e45.
- Martínez, M. E., Lary, C. W., Karaczyn, A. A., Griswold, M. D., & Hernandez, A. (2019). Spermatogonial Type 3 Deiodinase Regulates Thyroid Hormone Target Genes in Developing Testicular Somatic Cells. Endocrinology, 160(12), 2929–2945. https://doi.org/10.1210/en.2019-00259
- Vella, K. R., Ramadoss, P., Costa-E-Sousa, R. H., Astapova, I., Ye, F. D., Holtz, K. A., Harris, J. C., & Hollenberg,
N. (2014). Thyroid hormone signaling in vivo requires a balance between coactivators and corepressors. Molecular and cellular biology, 34(9), 1564–1575. https://doi.org/10.1128/MCB.00129-14 - Xu, X., Wang, X., Liu, H., & Liu, Z. (2016). Expression of thyroid hormone responsive spot 14 homolog and thyroid hormone receptor β1 in human breast cancer tissues and its clinical significance. Int J Clin Exp Med, 9(6), 9381- 9388.
- Wu, J., Wang, C., Li, S., Li, S., Wang, W., Li, J., Chi, Y., Yang, H., Kong, X., Zhou, Y., Dong, C., Wang, F., Xu, G., Yang, J., Gustafsson, J. Å., & Guan, Y. (2013). Thyroid hormone-responsive SPOT 14 homolog promotes hepatic lipogenesis, and its expression is regulated by liver X receptor α through a sterol regulatory element-binding protein 1c-dependent mechanism in mice.
- Hepatology (Baltimore, Md.), 58(2), 617–628. https://doi.org/10.1002/hep.26272
- Kinlaw, W. B., Tron, P., & Friedmann, A. S. (1992). Nuclear localization and hepatic zonation of rat “spot 14” protein: immunohistochemical investigation employing anti-fusion protein antibodies. Endocrinology, 131(6), 3120– 3122. https://doi.org/10.1210/endo.131.6.1446647
- Kinlaw, W. B., Tron, P., & Witters, L. A. (1993). Thyroid hormone and dietary carbohydrate induce different hepatic zonation of both “spot 14” and acetyl-coenzyme-A carboxylase: a novel mechanism of coregulation. Endocrinology, 133(2), 645–650. https://doi.org/10.1210/endo.133.2.8102096
- Chou, W. Y., Cheng, Y. S., Ho, C. L., Liu, S. T., Liu, P. Y., Kuo, C. C., Chang, H. P., Chen, Y. H., Chang, G. G., & Huang, S. M. (2007). Human spot 14 protein interacts physically and functionally with the thyroid receptor. Biochemical and biophysical research communications, 357(1), 133–138. https://doi.org/10.1016/j.bbrc.2007.03.103
- Chou, W. Y., Ho, C. L., Tseng, M. L., Liu, S. T., Yen, L. C., & Huang, S. M. (2008). Human Spot 14 protein is a p53-dependent transcriptional coactivator via the recruitment of thyroid receptor and Zac1. The international journal of biochemistry & cell biology, 40(9), 1826–1834. https://doi.org/10.1016/j.biocel.2008.01.014
MATERIAL ANEXO
Figura A1. Comprobación de la integridad del ARN obtenido mediante electroforesis en gel de agarosa. Bandas correspondientes al ARN ribosomal 18S (abajo) y 28S (arriba).
Figura A2. Funcionalidad del cDNA mediante electroforesis en gel de agarosa. Bandas correspondientes al producto de amplificación de los cebadores correspondientes a RPS29 con un tamaño de 236pb. A la izquierda se encuentra el marcador molecular cuya primera banda corresponde a 100pb.
Tabla A1. Secuencia de los primers (cebadores) F y R de los genes BCL3, GSTA2, SPOT14, MCT8, MCT10 y THRa1 con el tamaño del producto de amplificación en pares de bases (bp), temperatura de melting (Tm), eficiencia y su procedencia.

Figura A3. Electroforesis en gel de agarosa de las rectas de calibrado de BCL3 y GSTA2.
Tabla A2. Concentración (ng/L) de T4 libre en plasma de machos F1 tras los 21 días de tratamiento. Los datos presentados son las medias ± error estándar (S.E.). En la columna p se representan las diferencias estadísticamente significativas, el símbolo * indica diferencias estadísticamente significativas entre dietas, y el # entre la ingesta materna.