1. INTRODUCCIÓN
1.1. Cáncer
El cáncer mata a 7,5 millones de personas cada año (1). En 2019, Estados Unidos registró un total de 1.918.030 casos nuevos y un total de 609.360 personas fallecidas por esta enfermedad (2). En Chile, el mismo año se registraron 28.492 defunciones por neoplasias y tumores, convirtiéndose en la primera causa de muerte de ese año en nuestro país (3). Actualmente, las terapias para esta enfermedad incluyen intervención quirúrgica, radiación y uso de quimioterapias, lo que causa la muerte de células tumorales y sanas. Por esta razón, es necesario seguir investigando nuevas tecnologías que busquen obtener terapias innovadoras contra células tumorales específicas, sin afectar a las células sanas (4).
El cáncer corresponde al proceso fisiopatológico de proliferación descontrolada de células que se multiplican de manera autónoma y que adquieren la capacidad de invadir a otros tejidos (5). Para que una célula se convierta en una célula neoplásica, deben ocurrir mutaciones que se van transmitiendo de célula a célula mediante sucesivas duplicaciones (6). El cáncer comprende seis características biológicas adquiridas: entre estas se encuentran el mantenimiento de la proliferación, la señal de crecimiento, la resistencia a la muerte celular, la inmortalidad replicativa, la inducción de angiogénesis, la activación de la invasión y la metástasis. En la última década, se han añadido a esta lista dos funciones: la programación del metabolismo energético y la evasión de la destrucción inmunitaria (7).
1.2. Cáncer e inmunidad
Para la destrucción inmunitaria de un tumor, se activa una maquinaria apoptótica compuesta por reguladores y efectores. Los reguladores se dividen en dos, que son las vías extrínseca e intrínseca. La primera recibe y procesa señales extracelulares inductoras de apoptosis, como por ejemplo, al ligando/receptor de Fas, y el segundo, que detecta señales intracelulares, como por ejemplo, el estrés oxidativo. Ambos activan a las proteasas, caspasas 8 y 9 respectivamente, lo que genera una cascada de proteólisis, que activa a otras caspasas efectoras, como la caspasa 3, responsables de la fragmentación del ADN, por ende, de la apoptosis (7-8).
La respuesta inmunitaria es un proceso en el que participan un conjunto de células linfoides y mieloides; sin embargo, para esta revisión nos enfocaremos principalmente en los linfocitos B y linfocitos T. Para activar a las células T, ocurre un proceso llamado presentación antigénica, en el que se ligará el receptor clonotípico de las células T (TCR por sus siglas en inglés) con el complejo principal de histocompatibilidad (MHC por sus siglas en inglés) unido al péptido antigénico presente en la célula presentadora de antígeno (una célula dendrítica, un macrófago o un linfocito B). Este sistema en humanos es más conocido como antígeno leucocitario humano (HLA por sus siglas en inglés), y se subdivide en HLA-1 y HLA-2 (9-10).
Los tumores desarrollan múltiples mecanismos para reducir la presentación de antígenos y escapar al reconocimiento inmunitario, incluyendo la supresión de la función de las células dendríticas y la regulación a la baja de la expresión de HLA-I por las células tumorales, interfiriendo de esta manera con la maquinaria de procesamiento y presentación de antígenos (9-10).
1.3. Inmunoterapia contra el cáncer
Para contrarrestar esto último, se han desarrollado otro tipo de terapias inmunológicas en el tratamiento del cáncer. Un ejemplo de estas terapias son los anticuerpos monoclonales que se conocen como inhibidores del punto de chequeo, que inhiben a los puntos de control para amortiguar la hiperactivación de las células T. La inhibición, mediada por anticuerpos, del antígeno 4 asociado a linfocitos T citotóxicos (CTLA-4 por sus siglas en inglés), fue el primer bloqueo de la proteína de punto de chequeo que demostró ser eficaz en la inmunoterapia contra el cáncer (10-11).
Las células T se activan mediante un modelo de dos señales, es decir, requieren de señalización del receptor de antígeno y una señalización coestimuladora de CD28. El mecanismo del CTLA-4 es translocarse a la superficie de las células T para competir con CD28 por unirse a CD80 y CD86, lo que da como resultado la inhibición de la proliferación y activación de las células T (11).
La señalización inhibidora de las células T también puede ser inducida, por medio de la proteína de muerte celular programada 1 (PD-1 por sus siglas en inglés) y su ligando llamado ligando 1 de la proteína de muerte celular programada (PDL-1 por sus siglas en inglés). En los últimos años, se ha investigado la vía PD-1/PD-L1 y se ha descubierto que está implicada en la modulación de la tolerancia inmunológica y que al inhibir esta vía se ha evidenciado una gran eficacia clínica, una respuesta duradera y una baja toxicidad. El objetivo de las inmunoterapias contra el cáncer dirigidas a la señalización de PD-1/PD-L1 es normalizar el sistema inmunológico. Sin embargo, esta terapia solo beneficia a una fracción de los pacientes (11-12). Es por esto que se han desarrollado otras terapias inmunológicas que se describirán a continuación.
Existen terapias inmunológicas de edición genética, como la terapia basada en el Receptor Antígeno Quimérico (CAR por sus siglas en inglés) de células T, que es una terapia aprobada por la Administración de Alimentos y Medicamentos (FDA por sus siglas en inglés) el 18 de octubre del año 2017 para el tratamiento del linfoma de células B grandes (13-14). Esta terapia está enfocada en la manipulación genética de la célula T para modificar un gen de receptor de célula T en linfocitos autólogos. De esta forma, al administrar al paciente las células T, estas reconocen al antígeno específico del cáncer (15-16).
La aplicación de la terapia CAR-T inicia con una extracción de células mononucleares de la sangre periférica (PBMCs por sus siglas en inglés) del paciente, para poder transfectarlas con el gen que reconoce a un antígeno cancerígeno específico. Esta modificación, realizada in vitro, se efectúa a través de una transfección de un vector viral, utilizando lentivirus. Las células resultantes expresan receptores específicos CARs/TCRs en su superficie y, una vez aprobados los controles de calidad y amplificación celular, estas son administradas en el paciente vía infusión para ejercer su capacidad antitumoral (17-18).
Dentro de las ventajas de esta tecnología se observa que es mejor que otras terapias inmunológicas, debido a que requiere de una infusión de dosis única y, en caso de que el cáncer vuelva, puede reactivarse la memoria inmunológica. Las desventajas son que: a) sólo está aprobada para cánceres hematológicos, b) presenta un costo de referencia que va desde los 373 mil dólares, c) las toxicidades asociadas al tratamiento y d) la recaída de los tumores con antígeno negativo. Para la producción de esta terapia, CAR-T, se utiliza un vector viral, lo que significa un aumento en el tiempo de producción de la terapia, y por ende, el costo de la terapia aumenta (19-20). Por esta razón, se han investigado otras tecnologías para producir células T autólogas (20).
1.4. Tecnología de edición CRISPR-Cas9
Por otra parte, la tecnología de repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas (CRISPR por sus siglas en inglés), es una tecnología de edición genómica que simula a una tijera molecular personalizada, usada por los científicos para editar genomas (21).
El mecanismo de CRISPR consiste en que la estructura sintética de secuencia de ARN guía incluida en la ribonucleoproteína (sgRNA por sus siglas en inglés), dirige a la endonucleasa Cas9 a una secuencia de ADN, con el objetivo de causar una rotura de doble cadena (DSB por sus siglas en inglés) en el genoma. El DSB generado por dos dominios distintos de la nucleasa Cas9 es sujeto a mecanismos de reparación del ADN mediados por el hospedero, que en ausencia de una plantilla de reparación, ocurrirá por medio de una unión de extremos no homólogos (NHEJ por sus siglas en inglés), lo que provoca inserciones y deleciones aleatorias (21-22).
Por otro lado, en presencia de una plantilla donante, puede iniciar la vía de reparación dirigida por homología (HDR por sus siglas en inglés), libre de errores, para crear las mutaciones deseadas mediante recombinación homóloga, lo que constituye la base para llevar a cabo modificaciones precisas de genes, permitiendo realizar inserciones (knock-in) o eliminaciones (knock-out) (21-22).
Debido a las desventajas de las terapias existentes, surge la pregunta que se responderá en esta revisión :
¿Se pueden modificar las células T a través de CRISPR-Cas9 junto a vectores virales, en forma dependiente o independiente de la tecnología CAR-T, con el objetivo de aumentar la eficacia de la inmunoterapia contra el cáncer?
Para responder esta pregunta se plantea el siguiente objetivo: Evaluar la evidencia clínica que respalda el uso de edición génica mediante CRISPR-Cas9 para mejorar o reemplazar la inmunoterapia CAR-T en el tratamiento del cáncer.
2. METODOLOGÍA
2.1. Pregunta de investigación
La pregunta fue formulada con base en la estrategia PICO, según la cual el Problema es que los pacientes se hacen resistentes a las terapias de primera línea, la Intervención es que las células T son susceptibles de ser modificadas mediante la tecnología CRISP-Cas9 junto a vectores lentivirales. Las comparaciones corresponden a la forma dependiente o independiente de la tecnología CAR-T, y los Outcomes son para aumentar la eficacia de la inmunoterapia contra el cáncer sin afectar la seguridad.
2.2. Estrategias de búsqueda
Para esta revisión se realizó una búsqueda de ensayos clínicos, con aplicación de la terapia CRISPR-Cas9 dependiente o independiente de la tecnología CAR-T en células T, en pacientes con cáncer hematológico o sólido. La búsqueda se realizó en la base de datos electrónica PubMed, que comprende más de 37 millones de citaciones para literatura biomédica de MEDLINE, revistas de las ciencias de la vida y libros en línea. La estrategia de búsqueda se desarrolló combinando operadores booleanos como: “AND”, “OR” y palabras claves como “Non-viral”, “CRISPR”, “T cell receptor”. La combinación utilizada para la búsqueda fue la siguiente: (Non-viral) OR (CRISPR) AND (T cell receptor).
2.3. Selección de estudios y extracción de datos.
Se incluyeron todos los estudios clínicos publicados después del 2020 que aplicaron la tecnología CRISPR-Cas9 en pacientes con cáncer, sólidos o hematológicos, en modelos experimentales in vivo en pacientes humanos y en ratas, publicaciones en inglés y español. Por otro lado, se excluyeron artículos de revisión, estudios preclínicos in vitro o ex vivo y editoriales, además, de todos los artículos que mencionan actualizaciones de la terapia CAR-T, y aquellos que señalan otras formas de vector no viral usada en CAR-T, como el uso de transposones.
2.4. Análisis de los datos
Se identificaron un total de 473 estudios en la búsqueda de literatura. Después de excluir los textos incompletos, se descartaron documentos de antigüedad mayor a 5 años y se excluyeron aquellos ensayos que no fuesen clínicos. Luego, se procedió a evaluar su relevancia, de tal manera que 13 estudios se sometieron a una revisión exhaustiva para evaluar su elegibilidad. Posteriormente, se eliminaron aquellos ensayos clínicos que no mencionaban la tecnología de edición genética, CRISPR-Cas9. Un total de 6 estudios cumplieron con la elegibilidad.
2.5. Características de los estudios clínicos incluidos.
Los estudios incluidos abordaron estudios sobre edición de genes utilizando la tecnología CRISPR-Cas9 para potenciar el efecto de la terapia CAR-T (cuatro estudios); mientras que, dos estudios modifican a la célula T por tecnologías independientes a CAR-T. Los estudios recopilados mencionan resultados en pacientes pediátricos y adultos con cánceres sólidos, tres estudios; y cánceres hematológicos, tres estudios.
2.6. Criterios de validación externa e interna.
Se ejecutó una metodología SQUIRE 2.0 con el propósito de validar la calidad metodológica de los artículos incluidos en esta revisión, los criterios de validación incluyen un título en que se especifica el tipo de ensayo y se declara la tecnología utilizada, un resumen que sintetiza de forma precisa toda la información clave y se declara la metodología experimental, es decir, explica a grandes rasgos las modificaciones de las células T. Además, informa los resultados obtenidos y sus conclusiones. Por su parte, la introducción contextualiza la información e introduce mediante una síntesis del conocimiento actual del problema que se está valorando y menciona el objetivo del estudio. En la metodología se describen los aspectos éticos implicados en el estudio, la intervención y sus componentes con el detalle suficiente como para que otros puedan reproducirla, las muestras, instrumentos, procedimientos y análisis estadístico, y se detallan los métodos cualitativos y cuantitativos utilizados para realizar inferencias a partir de los datos. Se presentan los resultados observados con las intervenciones realizadas. Se consideran los beneficios, los daños, los resultados inesperados, los problemas y los fallos. Finalmente, en la discusión y conclusión se resumen los logros y dificultades más importantes y los principales cambios observados en los resultados clínicos. Se comparan los resultados del estudio con hallazgos de otros estudios, detectados a partir de una amplia revisión bibliográfica. Se sugieren los aspectos que debieran modificarse para mejorar los resultados en el futuro (23). De esta manera, todos los artículos que se consideraron cumplen con estos criterios.
3. RESULTADOS
3.1. Aspectos generales del diseño de las terapias
Para elaborar terapia celular mediante CRISPR-Cas9 se utilizaron vectores virales, que fueron: a) vectores lentivirales (LV), debido a que actualmente se utilizan para tratar enfermedades genéticas y terapias como la terapia CAR-T (24-25); y b) vectores virales adenoasociados (AAV), para los cuales se ha demostrado estabilidad al transferir genes, logrando modificar fenotipos de enfermedades con nula toxicidad en humanos (26-27).
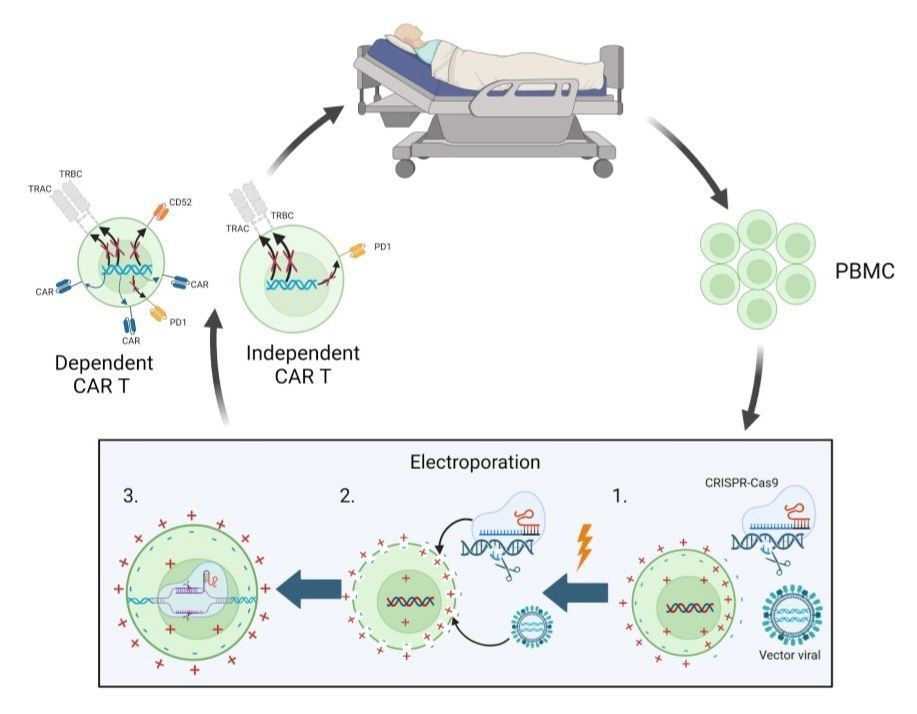
Para la creación de estas terapias, en la mayoría de los casos se extrajeron PBMC autólogas y luego se realizó un proceso de electroporación, técnica utilizada en la transferencia de genes, en la cual se les aplica impulsos eléctricos a las células para despolarizarlas y permitir la entrada de los sgRNA junto a CRISPR-Cas9 para editar el genoma celular (28-29). La Figura 1 expone cómo se realizan las terapias inmunológicas autólogas en los ensayos recopilados.
Figura 1: Terapia celular inmunológica. En el recuadro se esquematiza el tratamiento in vitro de las células para su edición genética mediante CRISPR-Cas9, usando electroporación; estas se pueden incorporar al paciente en forma dependiente o independiente de CAR T. Imagen de elaboración propia. Creado con BioRender.com, el 7 de octubre de 2023.
3.2 Infusión de las células creadas
Algunos ensayos señalan la administración de una quimioterapia linfodepletora como terapia ambientadora previa a la infusión de las células creadas. Mientras que, otros ensayos no utilizaron quimioterapia linfodepletora debido al alto riesgo de inmunosupresión por: a) disminución de seguridad, pues la linfodepleción podría causar proliferación descontroladas de células CAR-T con alteración de PD-1; b) podría causar aumento de posibilidades de que los pacientes contraigan enfermedades infecciosas intrahospitalarias (30).
3.3. Ensayos clínicos CAR-T-dependientes
Los ensayos de esta categoría se resumen en la Tabla 1.
3.3.1. Terapia de cáncer sólido en pacientes adultos
Este estudio fue realizado con una estrategia diferente a la de los otros ensayos; el Dr. Wang et al. utilizaron como blanco una proteína llamada mesotelina (MSLN), proteína que se expresa en varios tumores sólidos, pero que se encuentra en baja cantidad en los tejidos sanos. Los antecedentes de este estudio fueron dos ensayos, uno preclínico y uno clínico; ambos demuestran una baja eficacia y una alta seguridad al inocular células CAR-T dirigidas a MSLN. En este estudio combinaron la tecnología CRISPR-Cas9 con una transducción lentiviral para producir células CAR-T, dirigidas a MSLN con alteración en PD1. Para fabricar las células MPTK-CAR-T, se extrajeron por leucoféresis los PBMC de pacientes sanos mediante centrifugación el día 0. Las células obtenidas se separaron con perlas magnéticas anti CD4-CD8. Luego, estas células se electroporaron con CRISPR-Cas9 y los sgRNA dirigidos al TCR y PD1 de los linfocitos, junto a un vector lentiviral que codifica el P4 CAR, que es un constructo utilizando el P4scFv derivado de un anticuerpo anti-MSLN completamente humano (30).
Este ensayo clínico de 17 pacientes adultos con tumores sólidos avanzados o metastásicos expresaba mesotelina positiva; sin embargo, dos pacientes se excluyeron por no contar con resultados o no expresar PD-L1. Los pacientes del estudio tenían diferentes tipos de cáncer: A. Seis pacientes tenían cáncer de páncreas, B. Tres pacientes con cáncer de vías biliares, C. Uno con cáncer gástrico, D. Una paciente con cáncer de trompas de Falopio, E. Un paciente con cáncer de esófago, F. Una paciente con cáncer de ovario, G. Una con cáncer de cuello uterino y H. Una con cáncer de mama triple negativo (30).
A diferencia de los otros estudios, en este ensayo los pacientes no recibieron terapia de preacondicionamiento.Las razones mencionadas en el estudio son: 1) El riesgo de proliferación incontrolada de las células MPTK-CAR-T, debido a su modificación del gen PD1, 2) El aumento del riesgo de probabilidad de que los pacientes contraigan enfermedades intrahospitalarias, 3) Otros estudios han evidenciado que la terapia linfodepletora de quimioterapia presenta más riesgos que beneficios. Los pacientes recibieron una dosis de células MPTK-CAR-T que iba en aumento y que estaba dividida en cuatro niveles: 1) 0,1–0,2 × 10 6 células CAR-T/kg, 2) 0,5–1,0 × 10 6 células CAR-T/kg, 3) 1,5–3,0 × 10 6 células CAR-T/kg y 4) 4,5–9,0× 106 células CAR-T/kg. Los individuos en estudio no presentaron neurotoxicidad, síndrome de liberación de citoquinas (RSC por sus siglas en inglés), tampoco presentaron reacciones autoinmunes (30).
Por otro lado, luego de la infusión: A. Los pacientes 5 y 16 evidenciaron un aumento de IL-6B. Los pacientes 13 y 14 evidenciaron un aumento de IL-10 y C. El paciente 17 evidenció un aumento de IL-8. Sin embargo, ningún paciente presentó otra citocina elevada más de 10 veces su valor inicial. Los efectos adversos incluyeron derrame pleural, ascitis y derrame pericárdico leve. La mayoría fue manejable clínicamente y su gradificación fue de 3 o menos. Dos semanas después de la infusión, se tomaron biopsias cuyo resultado indicó un alto nivel de células MPTK-CAR-T, lo que señala la efectividad de la terapia, pero tras 3 semanas se volvieron indetectables, lo que demuestra que las células MPTK-CAR-T podrían transitar e infiltrarse en los tumores, pero no persisten más de un mes en ellos. Sin embargo, esta terapia no logró la remisión del cáncer (30).
3.3.2. Terapia de cáncer hematológico en pacientes adultos
En el primer ensayo de esta sección, Zhang et al. buscaron una forma alternativa de producir CAR-T, con un vector AAVS1 para crear una secuencia CAR anti-CD19, que se llamó 19bbz. Elaboraron diferentes grupos celulares con distintos vectores para evaluar la eficacia preclínica: A. Utilizando las técnicas de electroporación y CRISPR-Cas9 se combinaron por HDR las células T y el vector AAVS1 con la secuencia CAR, creando a las células AAVS1-19bbz, B. Realizando el mismo procedimiento con un vector lentiviral, que se denominaron células LV-19bbz, C. También integraron una secuencia CAR anti-CD19 en el gen PD1 creando células PD1-19bbz a partir de células T de dos pacientes sanos y D. Crearon otro grupo de células CAR-T, denominadas células LV-19bbz_PD1-KO, estas presentaban eliminación de PD1, gracias a la combinación de lentivirus y CRISPR-Cas9 (20). Los resultados preclínicos evidenciaron que las células más eficaces fueron las PD1-19bbz (20).
Luego de obtener los resultados pre clínicos se realizó un ensayo clínico de fase 1 para evaluar la seguridad y eficacia de las células PD1-19bbz, en el tratamiento de pacientes con Linfoma no Hodgkin de células B refractario/ en recaída (r/r B-NHL por sus siglas en inglés). Para este ensayo se inscribieron a 8 pacientes que no habían sido tratados previamente con CAR-T. Previa a la infusión de células T a los pacientes se les aplicó una terapia linfodepletora utilizando ciclofosfamida combinada con fludarabina, 25 mg/m2 de cada fármaco, de 4-2 días previos a la infusión de las células PD1-19bbz (20).
Todos los pacientes experimentaron eventos de toxicidad hematológica transitoria y reversibles, principalmente relacionada al tratamiento de la quimioterapia, no se encontraron otros eventos adversos. Algunos pacientes presentaron un RSC leve. Después de los primeros 6 meses se observó una respuesta duradera en cinco pacientes (5/8), mientras que se observó recaída en dos pacientes (2/8), el paciente restante logró una remisión parcial. Estas células proliferaron y se mantuvieron in vivo durante los 12 meses de evaluación del estudio, logrando la remisión completa de siete de 8 pacientes. Los científicos destacan que las células PD1-19bbz infundidas en los pacientes a una baja dosis y un bajo porcentaje de células CAR-T, demuestran que las células CAR-T estudiadas integradas con PD1 tienen una alta seguridad y eficacia para pacientes r/r B-NHL (20).
En el segundo ensayo, Wang et al. diseñaron células CAR-T de doble objetivo CD19/CD22 (CTA101), ellos utilizaron células autólogas, es decir que provienen del mismo paciente, porque existen antecedentes de que el uso de estas células presenta una mayor eficacia en el tratamiento de la leucemia linfoblástica aguda de células B refractaria (LLA r/r por sus siglas en inglés). Para crear las células CTA101, se les quitó la región TRAC y el gen CD52 mediante la tecnología CRISPR/Cas9, para evitar el rechazo de las células por el sistema inmune del paciente. La terapia se combinó con Alemtuzumab, que es un anticuerpo monoclonal anti-CD52 (31).
Las células se activaron por medio de perlas magnéticas combinadas con anticuerpos anti-CD3 y anti-CD28, para luego cultivarlas en medio X-VIVO 15 y con IL-2. Las perlas se retiraron antes de la electroporación con CRISPR-Cas9 y la cadena de ARN guía. Se realizó un ensayo de fase 1 de las células CTA101 en pacientes adultos con LLA r/r. Una semana previa a la infusión de las células, los pacientes recibieron una quimioterapia de preacondicionamiento con ciclofosfamida, fludarabina y alemtuzumab, con dosis no informadas (31).
Luego de 4 días de la infusión de las células CTA101, aparecieron los efectos adversos de la terapia. Tres pacientes de los 6 que participaron del estudio experimentaron infecciones: dos de ellos infecciones por citomegalovirus, un paciente desarrolló neumonía bacteriana, otro sepsis por hongos; y otros tres pacientes experimentaron citopenia que duró más de 28 días. Además, cinco de los 6 pacientes presentaron RSC de grado 1-2. Uno de los 6 pacientes (16,7%) presentó RSC de grado 3, con hipoxia. Los síntomas se resolvieron en 7 días con la administración de oxígeno, una dosis de tocilizumab (8 mg/kg) y glucocorticoides. El día 28 luego de la infusión de las células, 5 de 6 pacientes evidenciaron una respuesta de remisión incompleta, lo que indica que el tratamiento fue parcialmente efectivo. Por otro lado, el día 54 luego de la infusión, el paciente 6 sufrió un paro cardíaco debido a causas desconocidas y fue reanimado con éxito, pero murió debido a una insuficiencia cardíaca. El paciente 2 recibió un trasplante alogénico de células madre hematopoyéticas alogénicas en remisión el día 60 (31).
3.3.3. Terapia de cáncer hematológico en pacientes Pediátricos
Ottaviano et al. diseñaron una terapia inmunológica para probarla en pacientes pediátricos con LLA r/r, de entre 11 meses a 11 años. Estos autores utilizaron la tecnología CRISPR–Cas9 para alterar la cadena alfa del TCR (TRAC por sus siglas en inglés) y también el marcador celular (CD52), ambas modificaciones realizadas en el gen HLA de la célula T. Para ello, los autores extrajeron PBMC de donantes adultos sanos, al día siguiente se activaron y transdujeron con el vector lentiviral, con el objetivo de eliminar el TCR y CD52. Luego de 2 días de cultivo, las células se electroporaron para introducir el RNA de CRISPR-Cas9. Para el día 11, el cultivo se sometió a depleción de células TCRαß mediante columnas magnéticas. Luego, las células se criopreservaron hasta su uso en ensayos clínicos (32).
Previo a la infusión de estas células, se realizó un control de calidad de estas, mediante citometría de flujo. Se evaluó la expresión de CAR19, el knockout de TCRαß y CD52. Además, se realizaron otras pruebas como el análisis Western blot para Cas9 que confirmó que la proteína Cas9 fuera indetectable al final del proceso. Y otras evaluaciones in vitro con el propósito de determinar y evaluar la citotoxicidad. En este estudio participaron 8 niños y 2 se excluyeron antes del tratamiento (P1 y P4), por lo que sólo 6 niños fueron sometidos al ensayo (P2-P3-P5-P6-P7-P8). A ellos se les aplicó una terapia de preacondicionamiento que comprendía: a) dos pacientes con inotuzumab; tres pacientes con esteroides y vincristina; y un paciente con dosis altas de citarabina, con dosis no mencionadas. Además, se efectúa un postratamiento si se logra la remisión completa, que consiste en un trasplante de células madre hematopoyéticas (TCMH por sus siglas en inglés). Este fue alogénico y provenía de pacientes sanos (32).
Al inocular las células, a los pacientes se les controló constantemente. En el día 28, cuatro niños (P2-P5-P7-P8) se encontraban en remisión morfológica completa y presentaban enfermedad mínima residual (ERM por sus siglas en inglés) negativa. Sin embargo, uno presentaba ERM limítrofe detectada por PCR. Mientras que los otros dos pacientes (P3 y P6) no mostraron expansión de las células inoculadas y experimentaron enfermedad progresiva (PD por sus siglas en inglés), es decir, que la enfermedad empeoró (32).
El paciente 7 (P7) de 1,4 años de edad presentó enfermedad injerto contra hospedero (EICH por sus siglas en inglés) a nivel cutáneo, que fue confirmado mediante biopsia cutánea y cuyo tratamiento fue la aplicación de corticoides a nivel tópico y se resolvió rápidamente. Sin embargo, los autores desconocen la causa y plantean dos hipótesis: a) se debe a las células T derivadas de su primer donante de trasplante; b) se debe a la terapia en evaluación. Por otro lado, el paciente 2 (P2) desarrolló una EICH cutánea de grado 2 tras el TCMH y necesitó corticoides a nivel tópico y sistémico por 3 semanas. En este paciente no se detectaron las células infundidas en la sangre periférica ni en la médula ósea tras el trasplante, y la EICH se atribuyó al donante del TCM alogénico, debido a que el niño sobrevivió al final del tratamiento (32).
Todos los pacientes experimentaron RSC en un plazo de 2 a 7 días; los pacientes (P7 y P8) requirieron intervenciones adicionales por ser de grado 2. Ambos recibieron fluidos para la hipotensión y fueron tratados con tocilizumab. P7 recibió dos dosis de tocilizumab y desarrolló un síndrome de neurotoxicidad de grado 4, asociado a la terapia con células inmunoefectoras, que se manifestó como convulsiones generalizadas, lo que requirió cuidados intensivos y tratamiento antiepiléptico. Sin embargo, este paciente sobrevivió al final del estudio. Los resultados finales de este estudio señalan que, de los 6 pacientes, cuatro fallecieron, mientras que el paciente 2 y el paciente 7 sobrevivieron a este estudio (32).
3.4. Ensayos Clínicos CAR-T-independientes
Los ensayos de esta categoría se resumen en la Tabla 2.
3.4.1. Terapia de cáncer sólido – remoción del TCR con vectores no virales
En este estudio, Foy et al. realizaron un ensayo con una muestra de 16 pacientes con diferentes tumores sólidos metastásicos, en recaída o refractarios. A estos pacientes se les realizó una biopsia del tumor y se les extrajeron PBMCs, para más tarde comparar ambos ADNs mediante secuenciación de exoma completo (WES por sus siglas en inglés). Se compararon las dos secuencias para saber cuáles eran neoantígenos, es decir, antígenos que aparecen solo en el tejido tumoral y no en el tejido sano. Posteriormente, sintetizaron los péptidos correspondientes a los neoantígenos y les fijaron un fluorocromo, para luego exponerlos a linfocitos CD8 y evaluar la afinidad de los péptidos por los CD8; así los que resultaron con mayor afinidad serían su blanco para esta nueva terapia con neoantígenos. Para los 16 pacientes se identificó una mediana de 102 mutaciones somáticas no sinónimas (NSM por sus siglas en inglés) (33).
Para crear la terapia, clonaron los TCR que fueran capaces de reconocer a los neoantígenos, para eso, sacaron PBMC de los pacientes para exponerlos a este péptido que sintetizaron que tenía fluorescencia y así podían identificar qué células T son las que reconocen a los neoantígenos. De esas células T, clonaron el TCRα y es el que usaron como TCR endógeno. Después, las células CD8 se electroporaron con la nucleasa CRISPR-Cas9 para desactivar los TCR endógenos y un plásmido HR que codifica al TCR transgénico, luego se cultivaron por 11 días y se criopreservaron (33).
De los 16 pacientes seleccionados: 11 presentaban cáncer colorrectal estable de microsatélite 2, cáncer de mama con receptores hormonales positivos; 1 cáncer de ovario; 1 melanoma; y 1 cáncer de pulmón. A los pacientes se les dividió por dosis: A. El nivel 3 estaba conformado por nueve pacientes que recibieron tres neoTCR, B. El nivel 2, formado por tres pacientes con dos neoTCR y C. El nivel 1 tenía a cuatro pacientes con un neoTCR. El primer nivel recibió una terapia de preacondicionamiento linfodepletor de 300 mg/m2 de ciclofosfamida y 30 mg/m2 de fludarabina durante 3 días, los pacientes pertenecientes a los otros dos niveles recibieron la misma dosis de fludarabina, una dosis mayor de ciclofosfamida, 600 mg/m2 y ésta se aplicó por 4 días (33).
Se confirmó la funcionalidad de la terapia luego de realizar una microscopía de fluorescencia en cuatro muestras de biopsia, que detectaba a los neo-TCR, las muestras se obtuvieron luego de la infusión de las células. El resultado evidenció que las células estaban frecuentemente en contacto con células tumorales. Todos los pacientes experimentaron pancitopenia de grado 3-4, respuesta que se correlaciona con la terapia de preacondicionamiento aplicada. Un paciente desarrolló RSC luego de una neutropenia febril, llegando a encefalitis grado 3, los síntomas cesaron luego de 4 días de corticoides a dosis altas. La eficacia de la terapia se expresó con cinco pacientes que mantuvieron enfermedad estable; la enfermedad progresó en diez pacientes y un paciente no fue evaluado posteriormente (33).
3.4.2. Terapia de cáncer hematológico – remoción del TCR con vectores virales
Stadtmauer y otros investigadores realizaron un ensayo clínico de fase 1, con el objetivo de evaluar la seguridad de la edición de células mediante la tecnología CRISPR-Cas9 en tres pacientes con cáncer avanzado refractario. Para el estudio tomaron las PBMC de los pacientes y, mediante electroporación con CRISPR-Cas9, eliminaron el TCR endógeno y el receptor PD1. A continuación, con un vector lentiviral, agregaron un TCR transgénico NY-ESO-1, cuya función es reconocer mejor las células cancerosas, luego las infundieron en el paciente y evaluaron su evolución. El vector lentiviral se utilizó para expresar un TCR restringido a HLA-A2*0201 específico para el péptido SLLMWITQC en NY-ESO-1 y LAGE-1 (34).
El estudio incluyó tres pacientes, uno con sarcoma metastásico y dos con mieloma refractario avanzado. Los niveles de las células inoculadas en estos pacientes fueron estables por los primeros 9 meses, la infusión no provocó toxicidades clínicas asociadas a la terapia. En este estudio se modificó solo el TCR y no utilizaron la tecnología CAR, debido a que este antígeno es un potencial causante de RSC. Esto permite conocer si la edición de genes con CRISPR-Cas9 genera toxicidades. No obstante, los pacientes recibieron terapia de preacondicionamiento, que consistió en una quimioterapia linfodeplectora con ciclofosfamida y fludarabina, de dosis no registradas, por un plazo de 5 a 3 días antes de la administración de las células, que correspondía a una dosis de 1 × 10 8 células/ kg (34).
Las infusiones fueron bien toleradas y no se produjeron eventos adversos graves, no hubo casos de RSC. Las mejores respuestas fueron enfermedad estable en 2 pacientes por al menos nueve meses; sin embargo, al finalizar el estudio, se menciona que “la enfermedad ha progresado negativamente en todos los pacientes”. Uno de los pacientes con mieloma refractario murió, los otros dos están recibiendo otras terapias. Según los autores, es interesante observar que la citotoxicidad antitumoral más potente se observó en el único paciente que tuvo regresión tumoral después de la infusión de células T diseñadas con CRISPR-Cas9 (34).
4. DISCUSIÓN Y CONCLUSIÓN
En esta revisión se analizó un total de 6 ensayos clínicos, apreciándose que no existe aún una estrategia totalmente exitosa, esto podría deberse a varias razones. Una de estas podría ser el hecho de utilizar células heterólogas para elaborar células genéticamente modificadas con actividad antitumoral, con mayores efectos adversos que al utilizar células autólogas, sin embargo, en el ensayo de pacientes pediátricos se utilizan células heterólogas porque en los niños existen limitaciones en el volumen de sangre a extraer, condicionando a que el rendimiento podría ser insuficiente para el tratamiento in vitro que se realizará.
Por otro lado, si se analizan las terapias linfodepletoras utilizadas, se observa que: A. El estudio que no realizó quimioterapia previa obtuvo resultados de empeoramiento del cáncer, B. Hay tres ensayos que no mencionan las dosis de quimioterapia utilizada (31, 32 y 34); los resultados obtenidos de estos ensayos son, que en el primero un paciente muere durante el tratamiento, y el resto necesitó otras terapias; mientras que en el segundo ensayo sobrevivió sólo un paciente de los 3 del estudio, C. Por otro lado, el ensayo realizado con niños (32) evidenció diferentes reacciones inflamatorias en infantes, que no se pueden discutir en mayor profundidad, dado que los autores no declaran la dosis de quimioterapia utilizada. Sin embargo, cabe resaltar que la edad de la mayoría de los niños consideraba un estado en el que su sistema inmune aún estaba en formación, causando que los niños estuviesen expuestos a patógenos intrahospitalarios, concluyendo con una sobrevida de dos niños entre los 4 participantes.
Otra razón por la cual el tratamiento de CAR-T no sea tan exitoso puede ser porque no se ha estandarizado el número de células a infundir, dado que, según lo expuesto en las tablas 1 y 2 se aprecian dosis desde 0,46 a 9 x 106 células/kg en los ensayos CAR-T-dependientes, mientras en los ensayos CAR-T-independientes se observan dosis entre 1 a 40 x 106 células/kg, entendiéndose que cada dosis se ajustaba de acuerdo al tipo de cáncer y al tipo de paciente.
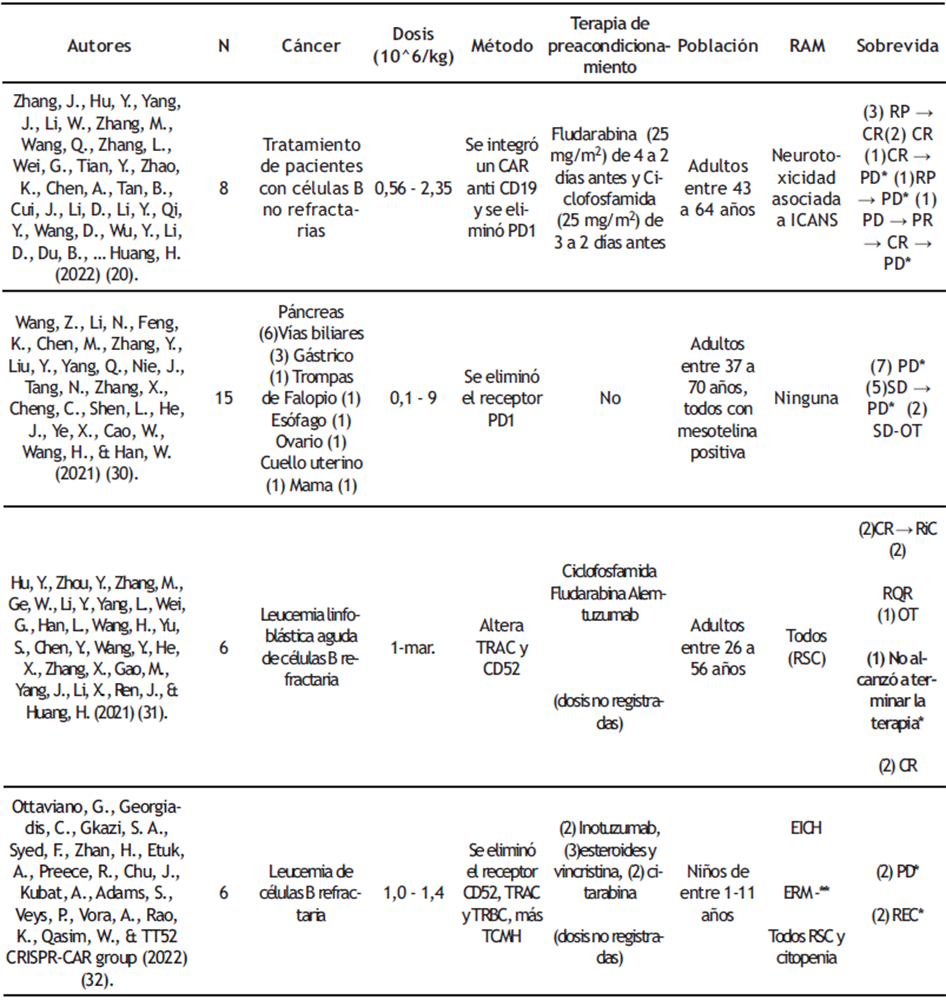
Tabla 1: Resumen de los ensayos clínicos CAR-T dependientes
*Los pacientes con (*) mueren.
Abreviaturas: -**: recaída; CR: remisión completa por sus siglas en inglés; CRi: remisión incompleta por sus siglas en inglés; EICH: enfermedad injerto contra huésped por sus siglas en inglés, que al ser negativa significa que es de bajo riesgo; ERM: enfermedad mínima residual por sus siglas en inglés); N: número de pacientes; En Sobrevida el paréntesis corresponde al número de pacientes con esa característica; OT: otra terapia; PD: enfermedad progresiva por sus siglas en inglés; PR: respuesta parcial por sus siglas en inglés; RAM: reacciones adversas al medicamento o terapia; REC: paciente en recaída; RQR: requirió quimioterapia de rescate; RSC: síndrome de liberación de citoquinas por sus siglas en inglés; SD: enfermedad estable por sus siglas en inglés; SD-OT: enfermedad estable por recibir otra terapia; TCMH: trasplante de células madres hematopoyéticas por sus siglas en inglés, que provenían de pacientes sanos.
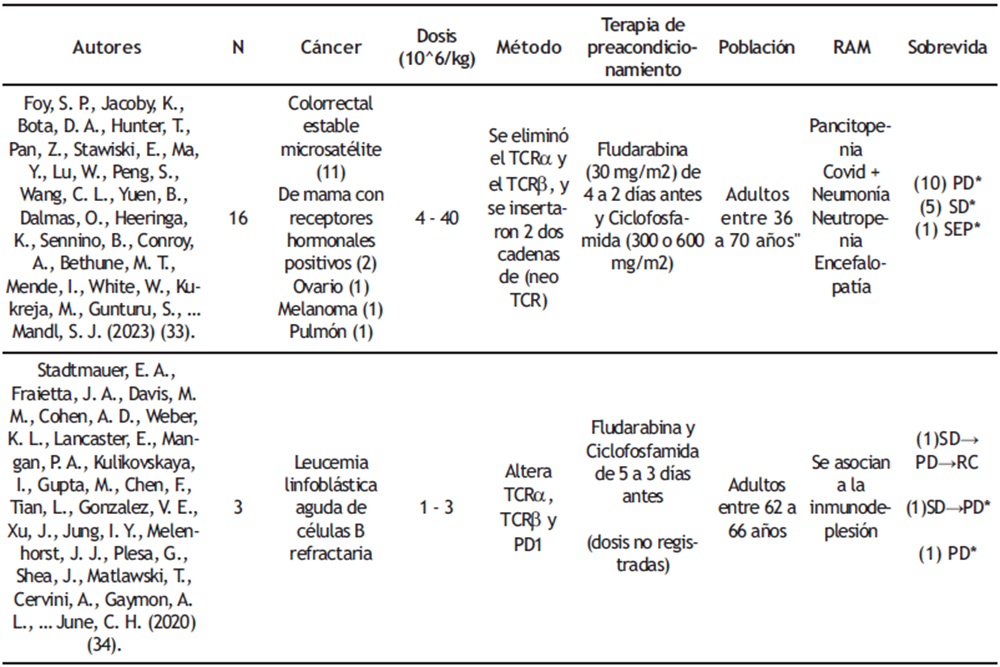
Tabla 2: Resumen de los ensayos clínicos CAR-T independientes
*Los pacientes con (*) mueren.
Abreviaturas: CR: remisión completa; CRi: remisión incompleta; N: número de pacientes; en “Sobrevida”, el paréntesis corresponde al número de pacientes con esa característica; Neo TCR: TCR específico de neoantígeno que es aislado de células T circulantes de pacientes desde una biblioteca HLA; evolución a; PD: enfermedad progresiva por sus siglas en inglés; RAM: reacciones adversas al medicamento o terapia; REC: paciente en recaída; SEP: sin evaluación posterior; SD: enfermedad estable por sus siglas en inglés.
Por otra parte, el síndrome de liberación de citoquinas es una reacción inflamatoria que se puede observar en cinco de los 6 ensayos, por lo que es una reacción adversa preponderante en este tipo de terapias inmunológicas. El ensayo que no presentó esta reacción inmune fue el último ensayo, así pareciera que el utilizar células CAR-T aumenta la probabilidad de producir el RSC. Debido a esto, se recomienda contrastar el uso de CAR con las terapias basadas en CRISPR-Cas9, para las cuales a la fecha existen menos ensayos clínicos.
En esta revisión se evaluaron ensayos clínicos de fase 1, por lo que el número de pacientes es bastante pequeño, y por consiguiente, se necesitan ensayos de fase 2 y 3 con un mayor número de pacientes para evaluar mejor la eficacia y seguridad de las terapias. Por otro lado, los ensayos evaluados fueron testeados en pacientes con cánceres muy avanzados de tipo: metastásico, refractarios y recidivantes, por los criterios de inclusión que se aplicaron en cada estudio. Al ser todos ensayos con metodologías diferentes, es más difícil comparar la eficacia de estos.
Finalmente, es necesario señalar las limitaciones para formular conclusiones de esta revisión, debido al limitado número de estudios que cumplieron con los criterios de inclusión, la gravedad de las condiciones de los pacientes incluidos y el bajo número de voluntarios que participaron en los ensayos que fueron de fase I. De esta manera, podemos enunciar como conclusión que se requieren más estudios para validar la seguridad y eficacia de las terapias que aplican la tecnología CRISPR-Cas9, en forma CAR-T dependiente o independiente.
Agradecimientos
Esta revisión fue la culminación de la asignatura Seminario de Licenciatura en la carrera de Química y Farmacia de la Escuela de Química y Farmacia, de la Facultad de Farmacia de la Universidad de Valparaíso, Valparaíso, Chile.
5. REFERENCIAS
- Gilbertson, R. J. Mapping cancer origins. Cell, 2011, 145(1), 25–29. https://doi.org/10.1016/j.cell.2011.03.019
- Siegel, R. L., Miller, K. D., Fuchs, H., & Jemal, A. Cancer Statistics, 2022. CA: A Cancer Journal for Clinicians, 2022, 72(1), 7-33. https://doi.org/10.3322/caac.21708
- Gob.Cl. Obtenido el 8 de Agosto de 2023 de https://www.ine.gob.cl/docs/default-source/nacimientos-matrimonios-y-defunciones/publicaciones-y-anuarios/anuarios-de-estad%C3%ADsticas-vitales/anuario-de-estad%C3%ADsticas-vitales-2019.pdf?sfvrsn=97729b7b_5
- Zaimy, M. A., Saffarzadeh, N., Mohammadi, A., Pourghadamyari, H., Izadi, P., Sarli, A., Moghaddam, L. K., Paschepari, S. R., Azizi, H., Torkamandi, S., & Bazzaz, J. T. New methods in the diagnosis of cancer and gene therapy of cancer based on nanoparticles. Cancer Gene Therapy, 2017 24(6), 233-243. https://doi.org/10.1038/cgt.2017.16
- León, Joel de, & Pareja, Arturo. Inmunología del cáncer II: bases moleculares y celulares de la carcinogénesis. Horizonte Médico (Lima), 2019, 19(2), 84-92. https://dx.doi.org/10.24265/horizmed.2019.v19n2.11
- Sermer, D., & Brentjens, R. J. CAR-T‐cell therapy: full speed ahead. Hematological Oncology, 2019, 37(S1), 95-100. https://doi.org/10.1002/hon.2591
- Hanahan, D., & Weinberg, R. A. Hallmarks of Cancer: The next generation. Cell, 2011, 144(5), 646-674. https://doi.org/10.1016/j.cell.2011.02.013
- Porter, A. G., & Jänicke, R. U. Emerging roles of Caspase-3 in apoptosis. Cell Death & Differentiation, 1999, 6(2), 99-104. https://doi.org/10.1038/sj.cdd.4400476
- Waldman, A. D., Fritz, J. M., & Lenardo, M. J. A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nature reviews. Immunology, 2020, 20(11), 651–668. https://doi.org/10.1038/s41577-020-0306-5
- Jhunjhunwala, S., Hammer, C. y Delamarre, L. Presentación de antígenos en el cáncer: conocimientos sobre la inmunogenicidad del tumor y la evasión inmune. Reseñas de la naturaleza. Cáncer 2021, 21 (5), 298–312. https://doi.org/10.1038/s41568-021-00339-z
- Cercek, A., Lumish, M., Sinopoli, J., Weiss, J., Shia, J., Lamendola-Essel, M., El Dika, I. H., Segal, N., Shcherba, M., Sugarman, R., Stadler, Z., Yaeger, R., Smith, J. J., Rousseau, B., Argiles,
- G., Patel, M., Desai, A., Saltz, L. B., Widmar, M., Iyer, K., … Diaz, L. A., Jr PD-1 Blockade in Mismatch Repair-Deficient, Locally Advanced Rectal Cancer. The New England Journal of Medicine, 2022,386(25), 2363–2376. https://doi.org/10.1056/NEJMoa2201445
- Francisco, L. M., Sage, P. T., & Sharpe, A. H. The PD-1 pathway in tolerance and autoimmunity. Immunological Reviews, 2010, 236, 219–242. https://doi.org/10.1111/j.1600-065X.2010.00923.x
- Office of the Commissioner. FDA approves CAR-T cell therapy to treat adults with certain types of large B-cell lymphoma. U.S. Food and Drug Administration. 2017. Obtenido el 1 de septiembre de 2023. https://www.fda.gov/news-events/press-announcements/fda-approves-car-t-cell-therapy-treat-adults-certain-types-large-b-cell-lymphoma.
- FDA approves second CAR-T-Cell therapy. National Cancer Institute, 2017, 25 octubre. Obtenido el 1 de septiembre de 2023. https://www.cancer.gov/news-events/cancer-currents-blog/2017/yescarta-fda-lymphoma
- Hacein-Bey-Abina S, von Kalle C, Schmidt M, et al. A serious adverse event after successful gene therapy for X-linked severe combined immunodeficiency. N Engl J Med. 2003;348(3):255-256.
- Mohanty, R., Chowdhury, C. R., Arega, S., Sen, P., Ganguly, P., & Ganguly, N. CAR-T cell therapy: A new era for cancer treatment (Review). Oncology Reports. 2019. https://doi.org/10.3892/or.2019.7335
- Qin, X., Wu, F., Chen, C., & Li, Q. Recent advances in CAR-T cells therapy for colorectal cancer. Frontiers in Immunology, 2022, 13. https://doi.org/10.3389/fimmu.2022.904137
- Zhao, L., & Cao, Y. Engineered T cell therapy for cancer in the clinic. Frontiers in Immunology, 2019, 10. https://doi.org/10.3389/fimmu.2019.02250
- Labanieh, L., Majzner, R. G., & Mackall, C. L. Programming CAR-T cells to kill cancer. Nature Biomedical Engineering, 2018, 2(6), 377-391. https://doi.org/10.1038/s41551-018-0235-9 .
- Zhang, J., Hu, Y., Yang, J., Li, W., Zhang, M., Wang, Q., Zhang, L., Wei, G., Tian, Y., Zhao, K., Chen, A., Tan, B., Cui, J., Li, D., Li, Y., Qi, Y., Wang, D., Wu, Y., Li, D., Du, B., … Huang, H. Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL. Nature, 2022, 609(7926), 369–374. https://doi.org/10.1038/s41586-022-05140-y
- Khan, A., & Sarkar, E. CRISPR/CAS9 encouraged CAR-T cell immunotherapy reporting efficient and safe clinical results towards cancer. Cancer treatment and research communications, 2022, 33, 100641. https://doi.org/10.1016/j.ctarc.2022.100641
- Jiang, F., & Doudna, J. A. CRISPR–CAS9 structures and mechanisms. Annual Review of Biophysics, 2017, 46(1), 505-529. https://doi.org/10.1146/annurev-biophys-062215-010822
- SQUIRE | SQUIRE 2.0 guidelines. (s/f). Squire-statement.org. Recuperado el 9 de diciembre de 2023, de https://www.squire-statement.org/index.cfm?fuseaction=page.viewpage&pageid=471
- Naldini, L., Blömer, U., Gallay, P., Ory, D., Mulligan, R., Gage, F. H., Verma, I. M., & Trono, D. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science (New York, N.Y.), 1996, 272(5259), 263–267. https://doi.org/10.1126/science.272.5259.263)
- Perry, C., & Rayat, A. C. M. E. Lentiviral Vector Bioprocessing. Viruses, 2021, 13(2), 268. https://doi.org/10.3390/v13020268
- Zincarelli, C., Soltys, S., Rengo, G., & Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular therapy : the journal of the American Society of Gene Therapy, 2008, 16(6), 1073–1080. https://doi.org/10.1038/mt.2008.76
- Mingozzi, F., & High, K. A. Therapeutic in vivo gene transfer for genetic disease using AAV: progress and challenges. Nature reviews. Genetics, 2011, 12(5), 341–355. https://doi.org/10.1038/nrg2988
- Wong, T. K., & Neumann, E. Electric field mediated gene transfer. Biochemical and biophysical research communications, 1982, 107(2), 584–587. https://doi.org/10.1016/0006-291x(82)91531-5
- Laustsen, A., & Bak, R. O. Electroporation-Based CRISPR/Cas9 Gene Editing Using Cas9 Protein and Chemically Modified sgRNAs. Methods in molecular biology (Clifton, N.J.), 2019, 1961, 127–134. https://doi.org/10.1007/978-1-4939-9170-9_9
- Wang, Z., Li, N., Feng, K., Chen, M., Zhang, Y., Liu, Y., Yang, Q., Nie, J., Tang, N., Zhang, X., Cheng, C., Shen, L., He, J., Ye, X., Cao, W., Wang, H., & Han, W. Phase I study of CAR-T cells with PD-1 and TCR disruption in mesothelin-positive solid tumors. Cellular & molecular immunology, 2021, 18(9), 2188–2198. https://doi.org/10.1038/s41423-021-00749-x
- Hu, Y., Zhou, Y., Zhang, M., Ge, W., Li, Y., Yang, L., Wei, G., Han, L., Wang, H., Yu, S., Chen, Y., Wang, Y., He, X., Zhang, X., Gao, M., Yang, J., Li, X., Ren, J., & Huang, H. CRISPR/Cas9-Engineered Universal CD19/CD22 Dual-Targeted CAR-T Cell Therapy for Relapsed/Refractory B-cell Acute Lymphoblastic Leukemia. Clinical cancer research, 2021, 27(10), 2764–2772. https://doi.org/10.1158/1078-0432.CCR-20-3863
- Ottaviano, G., Georgiadis, C., Gkazi, S. A., Syed, F., Zhan, H., Etuk, A., Preece, R., Chu, J., Kubat, A., Adams, S., Veys, P., Vora, A., Rao, K., Qasim, W., & TT52 CRISPR-CAR group Phase 1 clinical trial of CRISPR-engineered CAR19 universal T cells for treatment of children with refractory B cell leukemia. Science translational medicine, 2022, 14(668), eabq3010. https://doi.org/10.1126/scitranslmed.abq3010
- Foy, S. P., Jacoby, K., Bota, D. A., Hunter, T., Pan, Z., Stawiski, E., Ma, Y., Lu, W., Peng, S., Wang, C. L., Yuen, B., Dalmas, O., Heeringa, K., Sennino, B., Conroy, A., Bethune, M. T., Mende, I., White, W., Kukreja, M., Gunturu, S., … Mandl, S. J. Non-viral precision T cell receptor replacement for personalized cell therapy. Nature, 2023, 615(7953), 687–696. https://doi.org/10.1038/s41586-022-05531-1
- Stadtmauer, E. A., Fraietta, J. A., Davis, M. M., Cohen, A. D., Weber, K. L., Lancaster, E., Mangan, P. A., Kulikovskaya, I., Gupta, M., Chen, F., Tian, L., Gonzalez, V. E., Xu, J., Jung, I. Y., Melenhorst, J. J., Plesa, G., Shea, J., Matlawski, T., Cervini, A., Gaymon, A. L., … June, C. H. CRISPR-engineered T cells in patients with refractory cancer. Science (New York, N.Y.), 2020, 367(6481), eaba7365. https://doi.org/10.1126/science.aba7365