Trabajo ganador del Premio GSK 2024 en el Concurso Científico de la Real Academia Nacional de Farmacia.
1. INTRODUCCIÓN
1.1. ¿Qué es el glioblastoma multiforme?
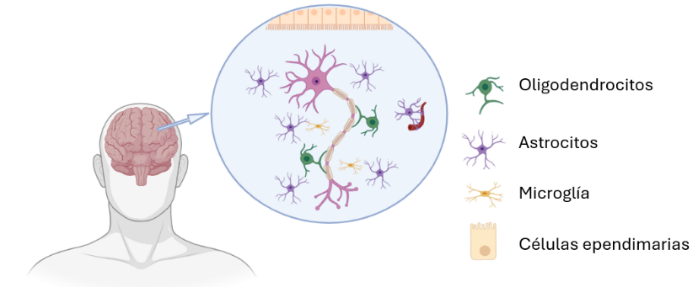
Los gliomas suponen un 30% de los tumores cerebrales primarios y de ellos el 80% son malignos (1). La OMS los clasifica en función de las características de las células y de su agresividad. De esta forma, en función de los criterios histopatológicos, se dividen en astrocitomas, ependiomas, oligodendrogliomas y oligoastrocitomas (Figura 1). Todas ellas son células gliales que se encargan de rodear, proteger y sostener las neuronas del cerebro y de la médula espinal.
Por otro lado, la gradación relacionada con el pronóstico de la enfermedad los divide en gliomas de bajo grado o astrocitomas (grados 1 y 2), que suelen ser tumores poco agresivos, y los grados 3 y 4, astrocitoma anaplásico y glioblastoma multiforme (GBM), respectivamente (1-4).
El GBM es el tumor más frecuente (supone el 50% de todos los tipos de gliomas diagnosticados, así como el 25% de los tumores intracraneales)(1), y de todos ellos es el más maligno; solo el 33% de los pacientes sobrevive al año y el 5% llega a vivir más de 5 años tras su diagnóstico(4), afectando tanto a adultos como a niños (60% y 3% de los tumores cerebrales, respectivamente)(2). Dicho tumor puede actuar sobre cualquier estructura neuroanatómica, pero se ha visto que en adultos es más común en los hemisferios cerebrales y en los niños en la fosa posterior (4).
Además, se caracteriza por tener un crecimiento infiltrativo difuso, muy rápido y muy poco diferenciado de las células gliales. Se origina en la sustancia blanca y estudios histológicos demuestran su gran heterogeneidad, característica que da su segundo nombre «multiforme». Aproximadamente, el 90% de los GBM se presentan directamente, es decir, son primarios (GBM1), pero sin embargo el 5% de los mismos se desarrollan a partir de un astrocitoma de bajo grado que ha ido evolucionando y sufriendo una transformación anaplásica, originando los GBM secundarios (GBM2).
Hasta la fecha son pocos los factores de riesgo que se han asociado con el desarrollo de la enfermedad, entre ellos destaca la exposición a la radiación ionizante y nuclear, el cloruro de vinilo, los pesticidas, el tabaco o el trabajo de refinamiento de petróleo.
Figura 1. Clasificación del glioblastoma en función de los criterios histopatológicos. localización de las células gliales a nivel neuronal. Creado con Biorender.
1.2 Estrategias actuales en el tratamiento del GBM y sus limitaciones
1.2.1 Resección quirúrgica
Después del diagnóstico y en función del tamaño y la localización del tumor, a los pacientes se les somete a la RQ seguida de la QT y RT; estos tres procesos son el tratamiento de elección del GBM.
Numerosos estudios destacan que cuanto mayor es la extracción de la masa tumoral, mayor es la supervivencia general. Sin embargo, la resección completa del tumor no suele ser posible dada la naturaleza infiltrativa tan grande del tumor, además de la falta de claridad de las zonas afectadas, todo ello sumado a los déficits neurológicos asociados al postoperatorio (2).
Dada la gran importancia de la RQ, se han ido implementando mejoras para dar solución a algunas de sus limitaciones. Entre ellas destaca la cirugía guiada por fluoresceína sódica (FLS-Na) o el ácido 5-aminolevulínico (5-ALA). Ambas sustancias se administran en el organismo vía intravenosa (FLS-Na) o vía oral (5-ALA) y son capaces de penetrar en el área tumoral, atravesando la barrera hematoencefálica (BHE), y permitiendo una RQ mayor y más completa gracias a que mejora la identificación y diferenciación de las estructuras tumorales comparado con las sanas. Además, se ha visto que el 5-ALA, pese a ser un metabolito producido de manera natural por el organismo, al llegar a las células tumorales se convierte en la protoporfirina IX (PPIX) por vía enzimática, metabolito que emite fluorescencia si se excita con una longitud de onda de 375 a 440 nm. Muchos estudios han demostrado que la transformación del ALA en PPIX es altamente selectiva, ya que tejidos sanos no son capaces de producir dicho metabolito al exponerse al 5-ALA (3).
1.2.2. Tratamiento adyuvante
1.2.2.a. Radioterapia
La RT emplea potentes haces de energía para destruir células cancerosas; dicha energía proviene de fuentes como son los protones o los rayos X. El objetivo principal de la RT es mejorar el control local del tumor sin inducir neurotoxicidad; se suele emplear a las 3 ó 5 semanas después de la RQ.
Los estudios que se han realizado testando esta opción de tratamiento de forma aislada son escasos, pequeños y heterogéneos, tanto para la primera aparición del tumor como para recurrencias. Sin embargo, lo que sí se conoce es que la administración de la RT junto con la RQ aporta entre 9 y 10 meses de media de supervivencia para los pacientes. Y además, la adición de la temozolomida (TMZ) aumenta la supervivencia en 14 meses (2, 5).
1.2.2.b. Quimioterápicos: temozolomida
La TMZ es el quimioterápico de elección en el tratamiento del GBM; actúa como agente alquilante del DNA. Este fármaco puede atravesar la BHE y, una vez en el citosol, se hidroliza espontáneamente dando lugar al 3-metil-(triazen-1-il)imidazol-4-carboxamida (MTIC) que se escinde formando el metildiazonio, una forma catiónica altamente reactiva responsable de ceder grupos metilos en las bases púricas y pirimidínicas del DNA, mayoritariamente en el N7 de la guanina (70%), pero también en el O6 de la guanina (6%) y en la adenina en el N3 (9%). Esta metilación daña a las células induciendo su apoptosis y deteniendo el ciclo celular en fase G2/M (2).
La respuesta a este tratamiento depende en gran medida del estado de metilación del promotor del gen metilguanina-O6-metiltransferasa (MGMT). Este gen se localiza en la banda cromosómica 10q26 y expresa una enzima reparadora del DNA que elimina los grupos alquilo de la guanina, impidiendo de esta forma los efectos letales de la QT con agentes alquilantes. Por tanto, los pacientes que obtienen mayores beneficios con este tratamiento son aquellos cuyos tumores presentan una metilación aberrante en las citoquinas de los dinucleótidos, ya que de esta forma el gen estaría silenciado total o parcialmente y, por ende, la expresión de la proteína MGMT estaría disminuida o ausente. Aproximadamente el 55% de los pacientes con GBM son resistentes a la TMZ por este sistema reparador del DNA.
En resumen, el tratamiento del GBM, pese a que es amplio y emplea tanto la RQ, RT y QT, la esperanza de vida de los pacientes no supera los 14 meses, y además se acompaña de recurrencias que pueden aparecer 7 meses después del diagnóstico. Esto es un problema, ya que no hay una guía de tratamiento para combatir dichas recurrencias y la única esperanza de estas personas es entrar en diferentes ensayos clínicos con tratamientos innovadores.
1.3. Retos en el tratamiento del GBM
Para mejorar la terapia existente para el tratamiento del GBM, es importante tener en cuenta tres factores importantes. En primer lugar, la selección de las subpoblaciones más resistentes debido a la heterogeneidad del tumor; en segundo lugar, la barrera fisiológica que protege a las células neuronales (BHE) del paso de sustancias al espacio neuronal y, por último, la inducción de una fuerte inmunosupresión local que favorece la evasión del SI. Todo ello limita la eficacia de las inmunoterapias (IT) emergentes.
1.3.1. Heterogeneidad del tumor
Como se ha mencionado anteriormente, las células de GBM se caracterizan por ser muy heterogéneas y proliferar rápidamente, infiltrándose en tejidos sanos y produciendo recaídas. Las células tumorales son de varias formas y tamaños, pero no solo son heterogéneas en apariencia, sino también en expresión génica y fenotípica (2).
De esta manera, analizando los distintos perfiles de expresión génica, se establecieron cuatro subtipos moleculares de GBM: proneural, neural, clásico y mesenquimal, lo que contribuye al desarrollo de microambientes tumorales distintos que determinan la habilidad del tumor de invadir tejidos sanos, además de ofrecer resistencia a la RT y QT. Cabe mencionar que los tumores pueden estar compuestos por varias subpoblaciones celulares diferentes, lo que aumenta la dificultad del tratamiento.
La alteración más frecuente identificada en el GBM es la pérdida de heterogeneidad en la región cromosómica 10q, región que contiene genes implicados en el control del ciclo celular y en la reparación del DNA. Entre ellos destacan genes como el PTEN (supresor tumoral), el gen TP53, que codifica la proteína p53, o el gen RB1, también denominado gen del retinoblastoma, que controla la transición G1-S en el ciclo celular y el MGMT. Este último y, como se ha mencionado anteriormente, depende del patrón de metilación del DNA, como es el caso también de las mutaciones en H3F3A que afectan a aminoácidos críticos (K27 y G34) de la histona H3.3 (4, 5).
Además, las células tumorales del GBM acumulan mutaciones genéticas comunes que modulan la liberación y señalización de factores de crecimiento como son el factor de crecimiento endotelial vascular (VEGF), el factor de crecimiento epidérmico (EGF), el factor de crecimiento derivado de plaquetas (PDGF) y el factor de crecimiento hepatocitario (HGF). Estas modificaciones en las células tumorales hacen que se expresen en mayor medida dichos factores de crecimiento, haciendo que el tumor crezca más rápido o evada el SI o invada tejidos circundantes (2).
Cabe destacar la amplificación del gen EGFR, ya que en la mitad de los casos incluye una variante truncada del gen que codifica para una proteína sin dominio extracelular que se mantiene activa (EGFRvIII)(4).
Por último, una de las mutaciones más importantes es la que se produce en el dominio de unión del sustrato de la enzima isocitrato deshidrogenasa NADPH dependiente (IDH) tipo 1 y 2. La IDH es una enzima involucrada en el metabolismo celular y en el estrés oxidativo, en concreto, cataliza la descarboxilación oxidativa del isocitrato a α-cetoglutarato y dióxido de carbono con la reducción del NADP+ a NADPH. La formación de NADPH se emplea en la regeneración del glutatión reducido, metabolito que actúa como principal antioxidante celular que favorece la supervivencia celular. Como reflejo de su importancia, el estado mutacional de la IDH se ha incluido como nuevo criterio de clasificación de los tumores cerebrales según la OMS. Además, es un marcador esencial que debe diagnosticarse antes de iniciar la terapia, ya que se ha visto que las mutaciones en dicha enzima se relacionan con un mejor pronóstico de la enfermedad (3, 4).
1.3.1. Inmunosupresión
Se han descubierto numerosas vías por las que las células tumorales son capaces de inducir la inmunosupresión, escapando de la acción del SI y aumentando la velocidad de proliferación.
Por un lado, las células de GBM pueden secretar citoquinas y quimioquinas tumorales que influyen en el aumento del número de macrófagos en la zona tumoral, aumento de linfocitos T reguladores (Treg) y la inhibición de la maduración de las células dendríticas (DC) y de la función celular de las células natural killer (NK). Además, las células tumorales pueden expresar moléculas inmunosupresoras, por ejemplo, el ligando-1 de muerte programada (PD-L1) que previene la proliferación y activación de los linfocitos T (2).
1.3.2. Barreras protectoras
A diferencia de otros tipos de tumores, los tumores cerebrales cuentan con una barrera protectora, la BHE, una estructura neurovascular caracterizada por la ausencia de fenestraciones y células con uniones estrechas, responsable del control de la homeostasis neuronal y de la penetración de sustancias al cerebro. Sin embargo, las células tumorales inducen aberraciones en la BHE, dando como resultado la formación de la barrera tumoral cerebral (BTB) caracterizada por tener una estructura y permeabilidad irregulares. La naturaleza tan heterogénea de la BTB permite generar zonas de hipoxia, lo que aumenta la resistencia a los tratamientos, que explican el fallo de la radioterapia (2).
Por último, en las células tumorales se ha visto que hay un aumento de la expresión de transportadores localizados tanto en la BHE como en la BTB; es el caso de la glicoproteína P (P-gp), encargada de expulsar fármacos del espacio neuronal a la sangre, disminuyendo la eficacia de los tratamientos. Este es el caso de la TMZ, sustrato de la P-gp (2).
2. TRATAMIENTO
2.1. Nuevos tratamientos inmunoterápicos
Este trabajo consiste en realizar una revisión bibliográfica de los últimos estudios que muestran los resultados de ensayos clínicos llevados a cabo en base al uso de nuevos tratamientos inmunoterápicos contra el GBM.
Actualmente se han desarrollado nuevos tratamientos inmunoterápicos, entre los que destacan terapias angiogénicas, vacunas peptídicas y celulares, terapias CART, inhibidores de puntos de control y virus oncológicos. Para ello, se han empleado bases de datos que registran los ensayos clínicos autorizados en EEUU, Clinical Trials (https://clinicaltrials.gov/) para profundizar en ensayos clínicos realizados con algunos de los fármacos estudiados en este trabajo. Para la elaboración de las tablas finales incluidas en el apartado de resultados, se ha filtrado por condición clínica (GBM) y posteriormente por tratamiento; además, solo se han seleccionado aquellos estudios que han sido completados, tengan o no resultados.
2.1.1. Terapias antiangiogénicas: bevacizumab (Avastin®)
El GBM es uno de los cánceres más vascularizados que existen y es que, como se ha mencionado anteriormente, este tumor se caracteriza por tener altos niveles de expresión del factor angiogénico VEGF. Bevacizumab (BEV) es un anticuerpo monoclonal humanizado contra dicho factor, siendo capaz de reducir el crecimiento del tumor, el edema cerebral y promover la regresión del tumor. Diversos ensayos clínicos en fase II y fase III han demostrado que su uso aislado, pese a que aumenta la supervivencia libre de progresión (PFS)¹ en 3-4 meses más, la supervivencia global (OS)² no varía. Dichos ensayos clínicos se realizaron tanto en GBM recurrente como de nuevo diagnóstico (3).
Desafortunadamente, se ha visto que la combinación del BEV junto con la TMZ y la RT no aumenta el OS y además que dicho anticuerpo puede interferir en la acción de otros agentes como es el caso de la TMZ, ya que reduce los niveles del quimioterápico en las células de GBM por disminuir la permeabilidad vascular (6-8).
Por tanto, como no se ha podido demostrar en ningún ensayo clínico que aumente los OS, la aprobación del BEV para el tratamiento del GBM de nuevo diagnóstico se ha retrasado o parado incluso en algunas regiones, como es el caso de la Unión Europea (UE). Sin embargo, la FDA sí lo ha aprobado para los estados de recurrencia del tumor y actualmente se siguen practicando ensayos clínicos junto con terapias inmunológicas (3), como se desarrollará más adelante.
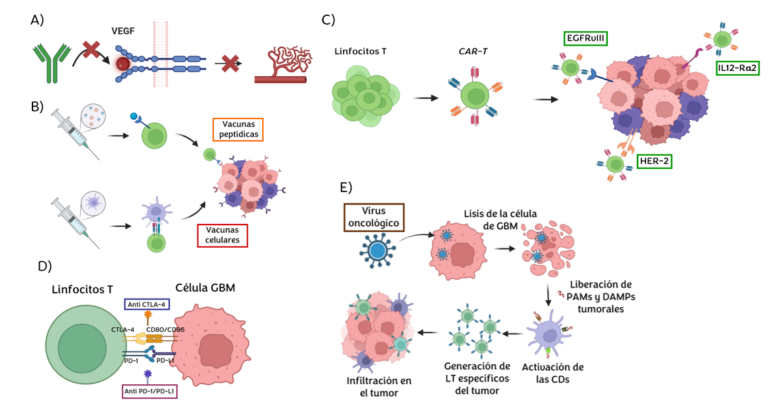
Figura 2. Tratamientos inmunoterápicos; A) Terapias antiangiogénicas (Bevacizumab); B) vacunas peptídicas y celulares; C) Terapias CAR-T; d) Inhibidores de puntos de control (ICI); e) Terapia con virus oncológicos. Creado con Biorender.
2.1.2. Vacunas
A lo largo de este trabajo se ha mencionado en numerosas ocasiones que el GBM es un tumor con elevada heterogeneidad antigénica que además tiene la capacidad de evadir el SI. Para combatir estos problemas, se buscó como solución inducir una respuesta inmunitaria activa atacando múltiples antígenos (Ag) tumorales esenciales en el desarrollo del tumor. En nuestro organismo, cuando hay un cambio patológico, las células dendríticas lo detectan y migran a los órganos linfoides donde, a través del MHC I y II, presentan los Ag extraños para la activación de linfocitos T (3).
La mayor dificultad que presenta el diseño de las vacunas contra el GBM es la identificación de Ag específicos tumorales, es decir, proteínas que o bien estén mutadas o se sobreexpresen en las células tumorales, pero no en células sanas. Actualmente se han desarrollado dos tipos de vacunas contra el tumor, las peptídicas y las celulares.
2.1.2.a. Vacunas peptídicas
Las vacunas peptídicas usan epítopos antigénicos de 8 a 25 aminoácidos que, en el caso del GBM, incluyen péptidos del EGFR, IDH1 y heat shock proteins (HSP). Además, algunos estudios sugieren que el citomegalovirus (HCMV) está presente en el 80% de los individuos sanos en su forma latente asintomática, pero en el GBM expresa epítopos específicos que no se encuentran en tejidos sanos, pudiendo ser un posible objetivo para la terapia del tumor. Pese a sus ventajas, como son la rápida síntesis y su bajo precio, el mayor de sus inconvenientes es que, ante la pérdida del Ag seleccionado en las células tumorales, resulta en la evasión de la respuesta inmunitaria y la consecuente resistencia al tratamiento (2).
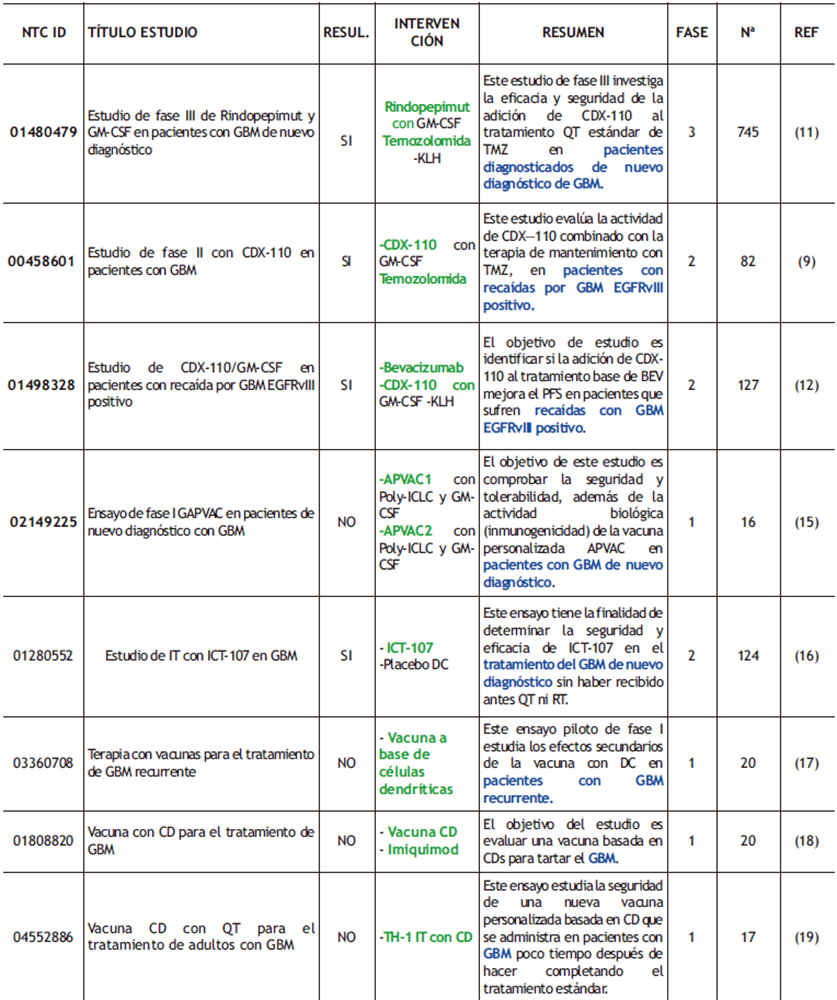
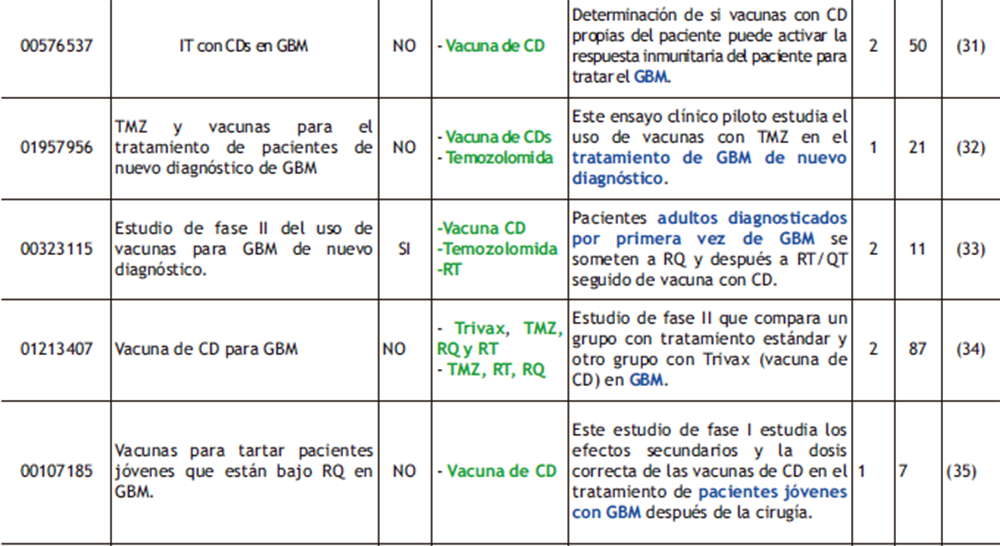
Rindopepimut (también denominado, CDX-110) es una vacuna peptídica que induce una respuesta inmunitaria de tipo humoral y celular contra el receptor truncado EGFvIII. En 2015, la FDA describió esta vacuna como una “terapia rompedora” por los resultados que reveló un estudio (NTC 00458601, tabla 1)(9), ya que además de ser tolerada por los pacientes, los beneficios en OS y PFS eran prometedores, con una media de 21,8 y 5,5 meses respectivamente (3, 10). Este estudio se precedió de otro, ACT IV (NTC 01480479, tabla 1)(11), que evaluaba la eficiencia y seguridad de CDX-110 en combinación con RQ y QT, pero se suspendió por no mejorar el OS. Estos resultados se relacionaron con la pérdida de la expresión de EGFRvIII independientemente del tratamiento que recibiesen. Posteriormente, este fallo se atribuyó a la selección de un único Ag en la elaboración de la vacuna, porque, pese a que la expresión de este receptor es del 30% en los tumores de GBM, solo algunas células tumorales expresan el Ag, y por ello el número de células diana no es suficiente para la destrucción de todo el tumor. El último estudio que se indica en la tabla 1 (NTC 01498328)(12) se realizó con el objetivo de comprobar si pese a que no se mejoraba el OS (como se había visto anteriormente, ACT IV), el PFS mejoraba en pacientes tratados con CDX-110 y BEV (10, 13).
Por otro lado, están las vacunas peptídicas personalizadas (APVAC), que pueden ser una opción para aquellos pacientes que no expresan mutaciones en los Ag previamente descritos. Hay dos niveles de individualización: en el primero de ellos, un conjunto de Ag previamente identificados y sus péptidos correspondientes se definen y generan por adelantado, mientras que los tumores de los pacientes y, si fuese necesario, su sangre periférica, se analizan durante la fase de screening molecular para así saber su expresión antigénica y la inmunogenicidad individual (14).
En el segundo de estos niveles, en un entorno verdaderamente individualizado en cada tumor, se identifican Ag nuevos, la mayoría de ellos mediante análisis de expresión génica y además por la identificación de las mutaciones somáticas específicas de una muestra del tumor del paciente. De esta manera se debe estudiar tanto la presentación antigénica como su inmunogenicidad para posteriormente administrárselo a los pacientes. Todo ello prolonga la ventana de tiempo hasta que se puede empezar el tratamiento (14).
El equipo de investigadores de GAPVAC, proyecto financiado por la UE, puso en marcha un ensayo clínico de fase I (NTC02149225, ver tabla 1)(15) en el que pacientes con GBM fueron expuestos a dos tipos de vacunas personalizadas adaptadas al perfil genético y proteómico individual de cada uno. El primer tipo de APVAC se individualizó mediante el uso de un reservorio de péptidos que se suelen sobreexpresar en el GBM, mientras que la segunda APVAC se basó en Ag mutados específicos de cada persona. Ambas presentaron buena tolerancia y valores elevados de OS y PFS (29 y 14,2 meses, respectivamente) (14, 15).
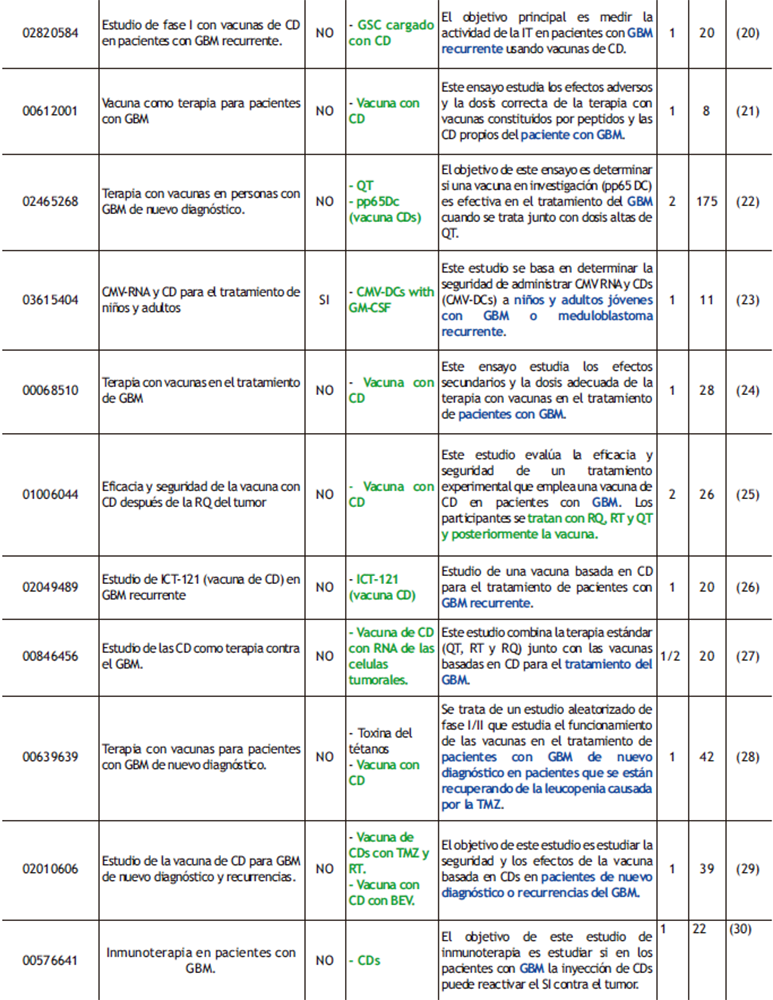
Tabla 1. ensayos clínicos completados realizados con vacunas peptídicas y celulares donde se destacan los fármacos empleados (verde) y las condiciones de los pacientes (azul). ReSUl (ReSUlTAdoS); Nª (NÚMeRo de PARTICIPANTeS); ReF (ReFeReNCIAS).
2.1.2.b. Vacunas celulares
Las células dendríticas (CDs) son las encargadas de presentar los Ag en el SI para desencadenar un conjunto de respuestas contra el Ag presentado. En la terapia con vacunas de células dendríticas, estas se aíslan de la sangre del paciente y ex vivo se activan con Ag tumorales; después, dichas células activas se insertan en el paciente, pretendiendo que se active la respuesta inmune contra los componentes tumorales.
Un ejemplo de vacunas con CD es ICT-107, una vacuna a su vez cargada con 6 Ag tumorales como EGFR, TRP-2, MAGE-1, gp100 (glicoproteína 100), AIM-2 e IL13-Rα2. De los ensayos clínicos realizados con esta vacuna, se ha elegido el que incorpora resultados de la página del ClinicalTrials (NCT01280552, ver tabla 1)(16), donde demostraron que la administración de la misma aumentaba tanto el OS como el PFS en 2 meses en comparación con el placebo (3, 16).
Se han realizado más ensayos clínicos usando este tipo de vacunas (tabla 1); sin embargo, la mayoría llega a fase II con pocos pacientes. Y, pese a que son seguras, no se ha visto que aumenten los OS cuando se compara con la terapia estándar, aunque su combinación sí puede ser prometedora, a pesar de que los resultados finales están en espera.
2.1.3. Terapia con células CAR-T
En la terapia con células CAR-T (del inglés chimeric antigen receptor T cells), se obtienen los linfocitos T de sangre periférica del paciente para luego, in vitro, modificarlos genéticamente añadiéndoles un gen con el receptor quimérico de Ags (CAR). Este permite que un Ag específico de las células cancerígenas sea reconocido por los linfocitos T. Posteriormente, las células CAR-T se reinoculan en el paciente, vía intravenosa, intratumoral o intracraneal.
Estas células CAR-T son capaces de identificar específicamente las células cancerígenas portadoras de ese Ag y lisarlas durante el tiempo que el Ag esté expresado en la membrana de las células tumorales. Además, son capaces de reconocer los Ag en forma de carbohidrato, proteína o glucolípido sin la necesidad del complejo principal (o mayor) de histocompatibilidad (MHC). En el caso concreto del GBM, gracias al análisis histoquímico, se han identificado varias dianas de tratamiento, sin embargo, la elevada heterogeneidad del tumor no es del todo compatible con la elevada selectividad de las células CAR-T. Es por esto que, generaciones más recientes de CAR permiten combinar varias proteínas y dominios, mejorando así la potencia antitumoral (3).
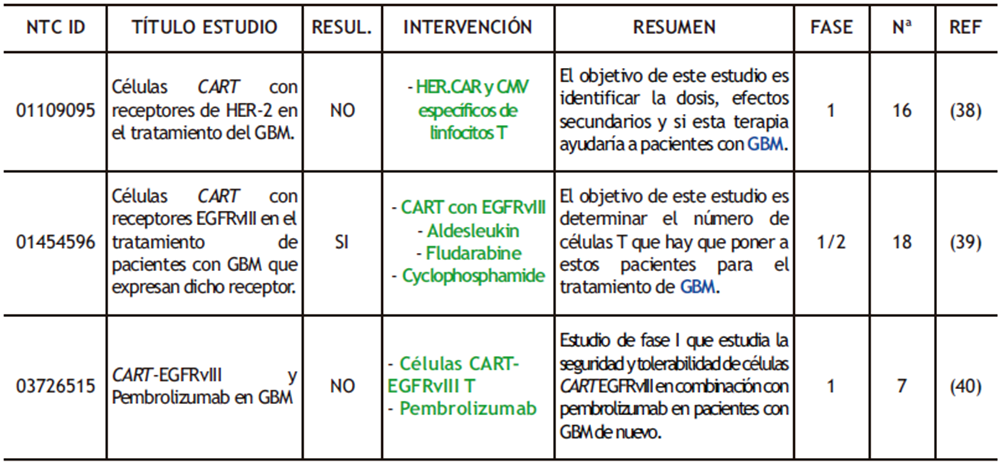
Actualmente, en el tratamiento del GBM, los receptores empleados en las células CAR-T son el receptor alfa 2 de la interleucina-13 (IL13-Rα2), el receptor del factor de crecimiento epidérmico humano 2 (HER2) y la variante III del receptor de crecimiento epidérmico (EGFRvIII). Los dos primeros se encuentran sobreexpresados en pacientes con GBM, en un 75% y 80% respectivamente. Ensayos clínicos han demostrado que la terapia con células CAR-T cargadas con EGFRvIII y con HER2 aumentaba el OS en 8 y 11,1 meses respectivamente (ver tabla 2) (36, 37).
2.1.4 Inhibidores de puntos de control inmunitario (ICI)
Como se ha mencionado anteriormente, una forma que tienen las células tumorales de evadir el SI es mediante la expresión de moléculas inmunosupresoras, como es el caso de la expresión de PD-L1 en las células de GBM. PD-1 es una de las proteínas de puntos de control inmunitario que se encuentra en los linfocitos T; se encarga de actuar como un tipo de “interruptor” que evita que los linfocitos T ataquen a otras células normales del organismo cuando se unen a PD-L1 (proteína que se expresa en células normales o tumorales) (Figura 2). Es decir, la unión de PD-1 con PD-L1 suprime la activación e infiltración del linfocito T, inhibe la secreción de factores inflamatorios e inactiva la señalización del receptor TCR. Pese al éxito de Ac contra PD-1/PD-L1 (Pembrolizumab y Nivolumab) en el tratamiento del melanoma, su uso en el GBM se está evitando debido a su dificultad para atravesar la BHE (2, 3). Se han desarrollado varios ensayos clínicos, todos ellos de fases I y II; algunos siguen activos y de los finalizados solo uno de ellos tiene resultados.
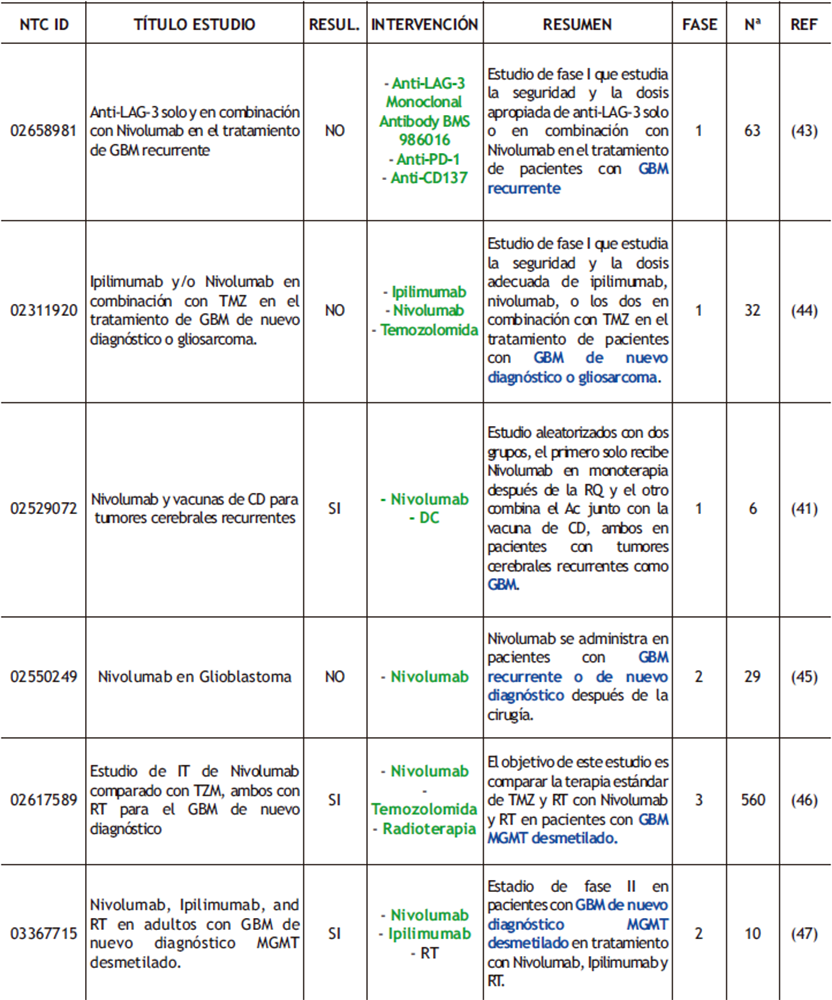
En este ensayo (NCT02529072, tabla 3) se compararon dos grupos aleatorizados; el primero de ellos se trató con Nivolumab y el segundo de ellos combinó el uso de vacunas de CDs con Nivolumab, ambos tras la RQ del tumor. Los resultados revelaron que ambas terapias eran seguras y, además, que la combinación en el uso de las vacunas junto con los ICI mejora los OS y PFS a 15,3 y 6,3 meses respectivamente, frente al uso aislado del Nivolumab que resultó en un OS de 8 meses y un PFS de 4,3 meses (41).
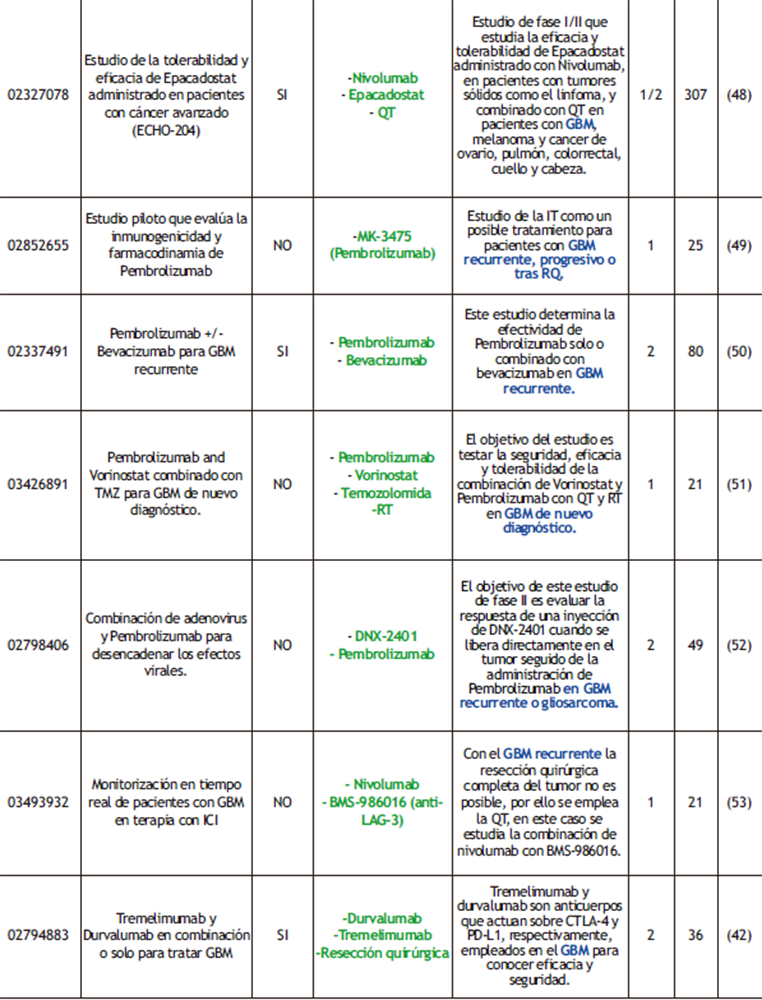
Otro de los ICIs mejor estudiados es CTLA-4, un inhibidor de la estimulación de los linfocitos T por competición con la molécula coestimuladora CD28 en la unión a sus ligandos CD80 y CD86 (Figura 2). Ipilimumab fue el primer inhibidor aprobado por la FDA contra CTLA-4. Centrándonos en el GBM, el estudio NCT02794883 (tabla 3) reveló que la combinación del bloqueo de CTLA-4 con PD-1 aumentaba el OS respecto a la administración única del inhibidor de PD-1, pero disminuía si se comparaba con la administración del inhibidor de CTLA-4 aislado; PFS aumentaba en ambos casos (42).
Pese a que CTLA-4 y PD-1 son los focos en los que se están basando los principales ensayos clínicos, se están empezando a estudiar otros ICI para que, mediante su uso combinado se mejore el tratamiento y se puedan tener mejores respuestas. Entre estos nuevos ICI destaca LAG-3, expresado en numerosas células inmunitarias, como por ejemplo los linfocitos T, o CD47 que como PD-L1, su expresión en las células manda una señal al SI de “no me comas”, bloqueando el ataque de los macrófagos al tumor.
Tabla 2. Ensayos clínicos completados realizados con CAR-T donde se destacan los fármacos empleados (verde) y las condiciones de los pacientes (azul). RESUL (RESULTADOS); Nª (NÚMERO DE PARTICIPANTES); REF (REFERENCIAS).
2.1.5. Terapia con virus oncológicos
La viroterapia oncológica (OV) emplea tanto virus naturales como virus modificados genéticamente, que se liberan intratumoralmente o después de la cirugía en la cavidad de resección, con el objetivo de infectar y lisar las células tumorales, provocando de forma simultánea una respuesta inmunitaria contra las mismas (54).
Centrándonos en el GBM, la terapia génica basada en OV está enfocada en la liberación de material genético que contiene secuencias de genes supresores de tumores, genes suicidas o genes de citoquinas inmunomoduladoras para aumentar la respuesta inmune. Los OV están programados para infectar y replicarse selectivamente en las células tumorales. Además, debido a la respuesta fisiológica a la infección, los OV inician el reclutamiento de neutrófilos, células NK, macrófagos, linfocitos T y sus respectivas citoquinas, revirtiendo de esta manera la inmunosupresión tumoral.
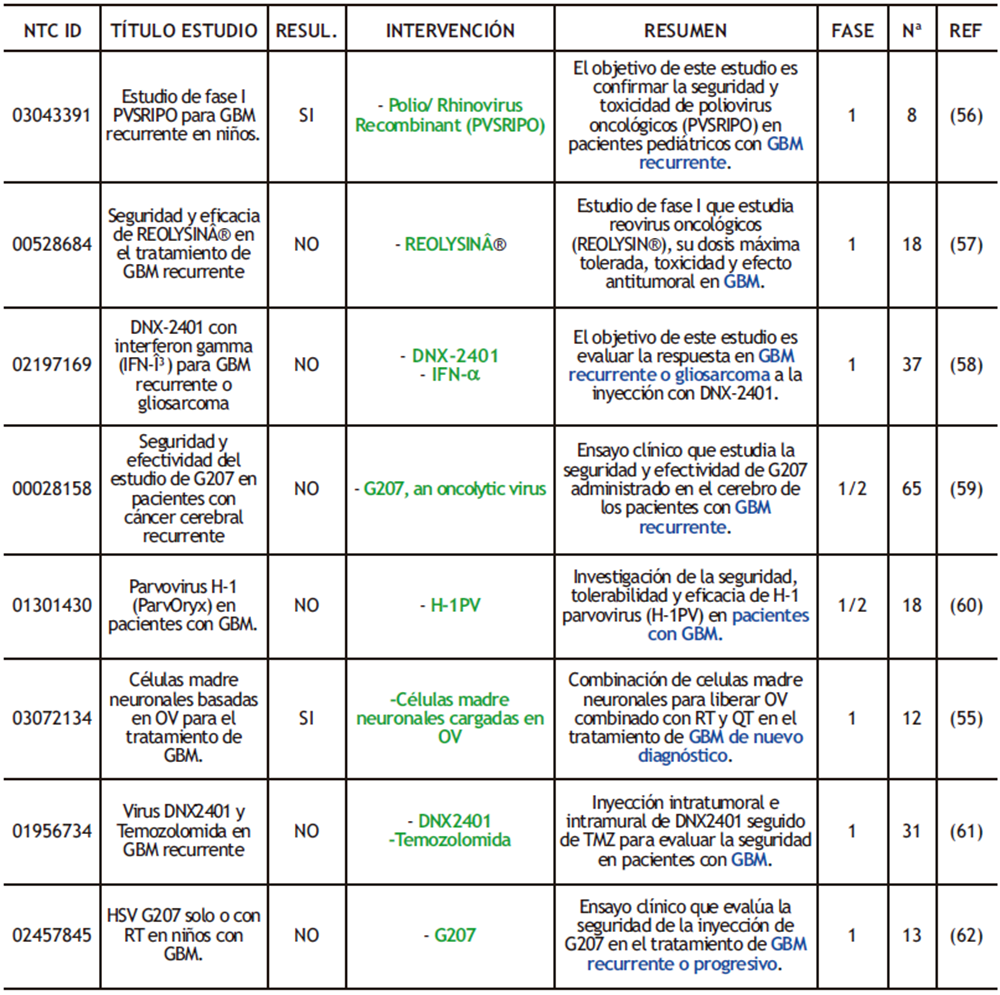
Actualmente, los OV están siendo testados en ensayos clínicos de fases I y II para comprobar su eficacia contra el GBM usando diferentes tipos virales como el virus del herpes simple (HSV), adenovirus, virus de la enfermedad de Newcastle, reovirus, parvovirus H1, sarampión o el virus de la polio. Según la información obtenida de los ensayos clínicos aprobados por el NIH, ClinicalTrials, de los 17 estudios de fase I y fase II, 2 de ellos presentan resultados.
El objetivo del primer ensayo (NCT03072134, tabla 4) era comprobar si el uso de los OV, específicamente los adenovirus, se podían aplicar junto con la RT y QT como adyuvante de la RQ en pacientes con GBM de nuevo diagnóstico, dando como resultados un OS de 18.4 meses y PFS de 9,1 meses (55). El segundo (NTC03043391, tabla 4) se realizó en niños con el objetivo de identificar la dosis adecuada y, además, medir el OS, obteniendo un valor de 4.1 meses (56).
Tabla 3. Ensayos clínicos completados realizados con ICI donde se destacan los fármacos empleados (verde) y las condiciones de los pacientes (azul). RESUL (RESULTADOS); Nª (NÚMERO DE PARTICIPANTES); REF (REFERENCIAS).
Tabla 4. Ensayos clínicos completados realizados con OV donde se destacan los fármacos empleados (verde) y las condiciones de los pacientes (azul). RESUL (RESULTADOS); Nª (NÚMERO DE PARTICIPANTES); REF (REFERENCIAS).
3. CONCLUSIONES
Actualmente, los ensayos clínicos realizados en el campo del GBM y la IT se centran en la investigación de vacunas peptídicas y celulares, células CAR-T, ICI y OV. Diversos estudios han demostrado la seguridad y eficacia de la IT en el tratamiento de los tumores malignos; sin embargo, en el caso del GBM, continúa en estudio. Son muchos los factores que ponen a prueba este tipo de terapia en dicho tumor cerebral, como por ejemplo la inmunosupresión local en el microambiente tumoral después del tratamiento, lo que hace que la eficacia de la terapia se vea reducida o limitada en una minoría de los pacientes; la elevada heterogeneidad celular de las células de GBM, así como la falta de Ag tumorales específicos; y, por último, la toxicidad crónica y las implicaciones a largo plazo de los efectos adversos asociados a la IT.
Pese a los resultados esperanzadores de los ensayos clínicos de fase I/II, la transición a ensayos de fase II/III continúa siendo desafiante y es que son muy pocos los ensayos de fase III que han podido publicarse con grandes cohortes de pacientes y estrategias inmunitarias para tratar el GBM.
El empleo de la terapia convencional (RQ, QT y RT) junto con la IT podría actuar sobre diferentes dianas tumorales, y de forma sinérgica, como tratamiento combinado podría lograr grandes resultados terapéuticos. Sin embargo, se requiere optimizar estos tratamientos para mejorar el éxito de estas terapias, por ejemplo, usando marcadores tumorales apropiados para cada paciente. Es decir, ensayos preclínicos que emplean inhibidores de puntos de control bien conocidos en GBM dan buenos resultados, pero en cambio en ensayos clínicos realizados con grandes cohortes de pacientes no resultan ser tan prometedores. Esto se debe a las múltiples características genómicas y epigenéticas del GBM que son las que determinan la eficacia de los distintos tratamientos. Aquí reside la importancia de estudiar y tratar de entender la naturaleza molecular del tumor, tanto las rutas de señalización que conllevan la evolución del cáncer como los Ag específicos que se expresan.
Teniendo en cuenta las limitaciones de cada una de las opciones dentro de la IT, los investigadores están optando por la terapia combinada. Por ejemplo, el uso de OV y de células CAR-T combinados aumenta la eficacia frente al uso de ambas terapias aisladas, ya que los OV inducen inflamación local que atrae a linfocitos T al tumor, lo que aumentaría la concentración de CAR-T y por tanto, su efectividad. Sin embargo, el mayor problema de esta combinación es el rápido aclaramiento de los OV, presentando un desafío para su uso en la práctica clínica en un futuro.
Además, considerando la heterogeneidad del tumor entre los pacientes como la causa fundamental de los fallos en la IT, los tratamientos estudiados más esperanzadores son las vacunas individualizadas, así como la combinación de bloqueadores de puntos de control junto con terapia individualizada basada en el subtipo tumoral. Sin embargo, se necesita mucha investigación para poder desarrollarse y llevarse a la clínica.
Y es que son muchas las preguntas que se nos pueden plantear ante la idea del uso de la IT como opción de tratamiento: ¿durante cuánto tiempo se utilizarían? ¿Sería posible que se desarrollasen nuevas vías de evasión de las células de GBM para escapar de los tratamientos? ¿Se podría desarrollar autoinmunidad como efecto adverso a la IT? La activación del SI puede desencadenar efectos secundarios en el paciente, ya que, al potenciar su acción para erradicar el tumor, podría actuar sobre el propio organismo, afectando a cualquier órgano o agudizando alguna enfermedad autoinmune ya presente en la persona con GBM. Pero a pesar de estas limitaciones y el desconocimiento que supone, el uso de la IT en numerosas ocasiones es la única opción de los pacientes. Por ello, es importante la investigación en este campo con el objetivo de poner a su disposición distintas terapias que puedan mejorar tanto su calidad de vida como limitar la progresión del tumor. Además, se pueden extraer conclusiones acerca de estudios realizados anteriormente para que, una vez empleados en ensayos clínicos con mayor cantidad de pacientes o en clínica, den los mejores resultados posibles.
En resumen, las estrategias IT desarrolladas en el tratamiento del GBM aportan ligeros beneficios en OS y PFS, lo que supone que la esperanza de vida de los pacientes que sufren esta enfermedad siga siendo de pocos meses. Sin embargo, la terapia combinada puede suponer una alternativa esperanzadora en un futuro, además de la importancia de seguir invirtiendo en investigación en esta área con el fin de no solo mejorar la vida de los pacientes, sino poder acabar con el desarrollo de la enfermedad.
Lista de Abreviaturas
GBM: Glioblastoma multiforme
RQ: Resección Quirúrgica
RT: Radioterapia
QT: Quimioterapia
SI: Sistema inmune
OMS: Organización Mundial de la Salud
BHE: Barrera hematoencefálica
FLS Na: Fluoresceína sódica
5-ALA: Ácido 5-aminolevulínico
PPIX: Protoporfirina IX
TMZ: Temozolomida
MGMT: metilguanina-O6-metiltransferasa
IT: Inmunoterapias
VEGF: factor de crecimiento endotelial vascular
EGF: factor de crecimiento epidérmico
PDGF: factor de crecimiento derivado de plaquetas
HGF: factor de crecimiento hepatocitario
IDH: isocitrato deshidrogenasa NADPH dependiente
Treg: Linfocitos T reguladores
DC: celulas dendríticas
NK: celulas natural killer
BTB: barrera tumoral cerebral
P-gp: glicoproteína P
BEV: Bevacizumab
PFS: progression free survival
OS: overall survival
HSP: heat shock proteins
hCMV: citomegalovirus
CAR-T: Chimeric antigen receptor T cells
MHC: complejo principal (o mayor) de histocompatibilidad
IL13-Rα2: receptor alfa 2 de la interluquina-13
HER-2: receptor del factor de crecimiento epidérmico humano 2
EGFRvIII: variante III del receptor de crecimiento epidérmico
1 PFS (progression free survival): tiempo durante o después del tratamiento en el que el cáncer ni crece ni se disemina.
2 OS (overall survival): tiempo desde la aleatorización hasta el fallecimiento del paciente por cualquier causa.
4. REFERENCIAS
- Rong L, Li N, Zhang Z. Emerging therapies for glioblastoma: current state and future directions. J Exp Clin Cancer Res. 2022;41(1):142.
- Janjua TI, Rewatkar P, Ahmed-Cox A, Saeed I, Mansfeld FM, Kulshreshtha R, et al. Frontiers in the treatment of glioblastoma: Past, present and emerging. Adv Drug Deliv Rev. 2021;171:108-38.
- Rodríguez-Camacho A, Flores-Vazquez JG, Moscardini-Martelli J, Torres-Rios JA, Olmos-Guzman A, Ortiz-Arce CS, et al. Glioblastoma Treatment: State-of-the-Art and Future Perspectives. Int J Mol Sci. 2022;23(13).
- Castañeda CA CS, Orrego E, García-Corrochano P, Deza P, Heinike H, et al. . Glioblastoma: análisis molecular y sus implicancias clínicas. Rev Peru Med Exp Salud Pública. 2015.
- Davis ME. Glioblastoma: Overview of Disease and Treatment. Clin J Oncol Nurs. 2016;20(5 Suppl):S2-8.
- Chinot OL, Wick W, Mason W, Henriksson R, Saran F, Nishikawa R, et al. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014;370(8):709-22.
- Gilbert MR, Dignam JJ, Armstrong TS, Wefel JS, Blumenthal DT, Vogelbaum MA, et al. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014;370(8):699-708.
- Narita Y. Bevacizumab for glioblastoma. Ther Clin Risk Manag. 2015;11:1759-65.
- Celldex-Therapeutics. A Phase II Study of CDX-110 With Radiation and Temozolomide in Patients With Newly Diagnosed Glioblastoma Multiforme 2018 [Available from: https://clinicaltrials.gov/study/NCT00458601?cond=Glioblastoma%20Multiforme&intr=CDX-110&rank=1.
- Weller M, Butowski N, Tran DD, Recht LD, Lim M, Hirte H, et al. Rindopepimut with temozolomide for patients with newly diagnosed, EGFRvIII-expressing glioblastoma (ACT IV): a randomised, double-blind, international phase 3 trial. Lancet Oncol. 2017;18(10):1373-85.
- Celldex-Therapeutics. An International, Randomized, Double-Blind, Controlled Study of Rindopepimut/GM-CSF With Adjuvant Temozolomide in Patients With Newly Diagnosed, Surgically Resected, EGFRvIII-positive Glioblastoma 2018 [Available from: https://clinicaltrials.gov/study/NCT01480479.
- Celldex-Therapeutics. A Phase II Study of Rindopepimut/GM-CSF in Patients With Relapsed EGFRvIII-Positive Glioblastoma 2020 [Available from: https://clinicaltrials.gov/study/NCT01498328
- Schuster J, Lai RK, Recht LD, Reardon DA, Paleologos NA, Groves MD, et al. A phase II, multicenter trial of rindopepimut (CDX-110) in newly diagnosed glioblastoma: the ACT III study. Neuro Oncol. 2015;17(6):854-61.
- Bunse L, Bunse T, Kramer C, Chih YC, Platten M. Clinical and Translational Advances in Glioma Immunotherapy. Neurotherapeutics. 2022;19(6):1799-817.
- Immatics-Biotechnologies-GmbH. A Phase I Trial of Actively Personalized Peptide Vaccinations Plus Immunomodulators in Patients With Newly Diagnosed Glioblastoma Concurrent to First Line Temozolomide Maintenance Therapy 2018 [Available from: https://clinicaltrials.gov/study/NCT02149225.
- Precision-Life-Science-Group. A Randomized, Double-blind, Controlled Phase IIb Study of the Safety and Efficacy of ICT-107 in Newly Diagnosed Patients With Glioblastoma Multiforme (GBM) Following Resection and Chemoradiation 2017 [Available from: https://clinicaltrials.gov/study/NCT01280552.
- Mayo-Clinic. Pilot Clinical Trial of Allogeneic Tumor Lysate-Pulsed Autologous Dendritic Cell Vaccination in Recurrent Glioblastoma 2023 [Available from: https://clinicaltrials.gov/study/NCT03360708
- Fuente-MDL. Dendritic Cell Vaccine For Malignant Glioma and Glioblastoma Multiforme in Adult and Pediatric Subjects 2022 [Available from: https://clinicaltrials.gov/study/NCT01808820
- The-Cooper-Health-System. A Phase I Study of Th-1 Dendritic Cell Immunotherapy in Combination With Standard Chemoradiation for the Adjuvant Treatment of Adult Glioblastoma 2024 [Available from: https://clinicaltrials.gov/study/NCT04552886
- Besta FIRCCSINC. A Phase I Study of Immunotherapy With GSC -Loaded Dendritic Cells in Patients With Recurrent Glioblastoma 2019 [Available from: https://clinicaltrials.gov/study/NCT02820584
- Jonsson-Comprehensive-Cancer-Center. Phase I Study of Glioma-Associated Antigen (GAA) Peptide-pulsed Dendritic Cell Vaccination in Malignant Glioma Patients 2015 [05/11/2024]. Available from: https://clinicaltrials.gov/study/NCT00612001
- University-of-Florida. ATTAC-II: A Phase II Randomized, Blinded, and Placebo-controlled Trial of CMV RNA-Pulsed Dendritic Cells With Tetanus-Diphtheria Toxoid Vaccine in Patients With NewlyDiagnosed Glioblastoma 2024 [Available from: https://clinicaltrials.gov/study/NCT02465268
- A Phase 1 Trial of CMV RNA-Pulsed Dendritic Cells With Tetanus-Diphtheria Toxoid Vaccine in Pediatric Patients and Young Adults With WHO Grade IV Glioma, Recurrent Malignant Glioma, or Recurrent Medulloblastoma 2021 [Available from: https://clinicaltrials.gov/study/NCT03615404
- Jonsson-Comprehensive-Cancer-Center. Phase I Dose Escalation Study of Autologous Tumor Lysate-Pulsed Dendritic Cell Immunotherapy for Malignant Gliomas 2020 [Available from: https://clinicaltrials.gov/study/NCT00068510
- Clinica-Universidad-Navarra. Prospective, Phase II Clinical Trial to Evaluate Efficacy and Safety of Autologous Dendritic Cell Vaccination in Glioblastoma Multiforme Patients After Complete Surgical Resection With Fluorescence Microscope 2014 [Available from: https://clinicaltrials.gov/study/NCT01006044
- Precision-Life-Science-Group. Immunological Targeting of CD-133 in Recurrent Glioblastoma: A Multi-center Phase I Translational and Clinical Study of an Autologous CD-133 DC Vaccine 2018 [Available from: https://clinicaltrials.gov/study/NCT02049489
- Phase I/II Trial of Vaccine Therapy With Tumor Stem Cell Derived mRNA- Transfected Dendritic Cells in Patients Receiving Standard Therapy for Glioblastoma 2015 [Available from: https://clinicaltrials.gov/study/NCT00846456
- Anti-Tumor Immunotherapy Targeted Against Cytomegalovirus in Patients With Newly Diagnosed Glioblastoma Multiforme During Recovery From Therapeutic Temozolomide-induced Lymphopenia 2023 [Available from: https://clinicaltrials.gov/study/NCT00639639
- Phase I Trial of Vaccination With Autologous Dendritic Cells Pulsed With Lysate Derived From an Allogeneic Glioblastoma Stem-like Cell Line for Patients With Newly Diagnosed or Recurrent Glioblastoma 2021 [Available from: https://clinicaltrials.gov/study/NCT02010606
- A Phase l Trial of Tumor Associated Antigen Pulsed Dendritic Cell Immunotherapy for Patients With Brain Stem Glioma and Glioblastoma 2014 [Available from: https://clinicaltrials.gov/study/NCT00576641
- Phase ll Trial of Tumor Lysate-Pulsed Dendritic Cell Immunotherapy for Patients With Atypical or Malignant, Primary or Metastatic Brain Tumors of the Central Nervous System 2019 [Available from: https://clinicaltrials.gov/study/NCT00576537
- Mayo-Clinic. Pilot Clinical Trial of Allogeneic Tumor Lysate-Pulsed Autologous Dendritic Cell Vaccination in Newly Diagnosed Glioblastoma 2023 [Available from: https://clinicaltrials.gov/study/NCT01957956
- Dartmouth-Hitchcock-Medical-Center. A Phase II Feasibility Study of Adjuvant Intra-Nodal Autologous Dendritic Cell Vaccination for Newly Diagnosed Glioblastoma Multiforme 2018 [Available from: https://clinicaltrials.gov/study/NCT00323115.
- Activartis-Biotech. First Line Standard Therapy of Glioblastoma Multiforme With or Without add on Treatment With Trivax, an Anti-tumour Immune Therapy Based on Tumour-lysate Charged Dendritic Cells 2016 [Available from: https://clinicaltrials.gov/study/NCT01213407
- Jonsson-Comprehensive-Cancer-Center. Phase I Dose Escalation Study of Autologous Tumor Lysate-Pulsed Dendritic Cell Immunotherapy for Malignant Gliomas in Pediatric Patients 2020 [Available from: https://clinicaltrials.gov/study/NCT00107185
- Ahmed N, Brawley V, Hegde M, Bielamowicz K, Kalra M, Landi D, et al. HER2-Specific Chimeric Antigen Receptor-Modified Virus-Specific T Cells for Progressive Glioblastoma: A Phase 1 Dose-Escalation Trial. JAMA Oncol. 2017;3(8):1094-101.
- O’Rourke DM NM, Desai A, Melenhorst JJ, Mansfield K, Morrissette JJD, et al. A single dose of peripherally infused EGFRvIII-directed CAR T cells mediates antigen loss and induces adaptive resistance in patients with recurrent glioblastoma. Sci Transl Med. 2017.
- Administration of HER2 Chimeric Antigen Receptor Expressing CMV-Specific Cytotoxic T Cells Ins Patients With Glioblastoma Multiforme (HERT-GBM) 2019 [Available from: https://clinicaltrials.gov/study/NCT01109095
- A Phase I/II Study of the Safety and Feasibility of Administering T Cells Expressing Anti-EGFRvIII Chimeric Antigen Receptor to Patients With Malignant Gliomas Expressing EGFRvIII 2019 [Available from: https://clinicaltrials.gov/study/NCT01454596
- University-of-Pennsylvania. Phase 1 Study of EGFRvIII-Directed CAR T Cells Combined With PD-1 Inhibition in Patients With Newly Diagnosed, MGMT-Unmethylated Glioblastoma 2023 [Available from: https://clinicaltrials.gov/study/NCT03726515
- AVeRT: Anti-PD-1 Monoclonal Antibody (Nivolumab) in Combination With DC Vaccines for the Treatment of Recurrent Grade III and Grade IV Brain Tumors 2020 [Available from: https://clinicaltrials.gov/study/NCT02529072.
- Northwestern-University. A Phase II, Open Label, Clinical Trial Of Pre-Surgical and Adjuvant Treatment of Recurrent Malignant Glioma With Tremelimumab and Durvalumab (MEDI4736) Alone and in Combination to Determine Immunologic Changes From Treatment 2022 [Available from: https://clinicaltrials.gov/study/NCT02794883
- Sidney-Kimmel-Comprehensive-Cancer-Center-JohnsHopkins. A Phase I Trial of Anti-LAG-3 or Anti-CD137 Alone and in Combination With Anti-PD-1 in Patients With Recurrent GBM 2023 [Available from: https://clinicaltrials.gov/study/NCT02658981
- (NCI) N-C-I. Phase I Study of Ipilimumab, Nivolumab, and the Combination in Patients With Newly Diagnosed Glioblastoma 2023 [Available from: https://clinicaltrials.gov/study/NCT02311920
- Clinica-Universidad-Navarra. Phase II Study of Neoadjuvant Nivolumab in Patients With Glioblastoma Multiforme 2017 [Available from: https://clinicaltrials.gov/study/NCT02550249.
- Squibb. B-M. A Randomized Phase 3 Open Label Study of Nivolumab vs Temozolomide Each in Combination With Radiation Therapy in Newly Diagnosed Adult Subjects With Unmethylated MGMT (Tumor O-6-methylguanine DNA Methyltransferase) Glioblastoma (CheckMate 498: CHECKpoint Pathway and Nivolumab Clinical Trial Evaluation 498) 2023 [Available from: https://clinicaltrials.gov/study/NCT02617589
- NYU-Langone-Health. A Phase II, Open-label, Single Arm Trial of Nivolumab, Ipilimumab, and Short course Radiotherapy in Adults With Newly Diagnosed, MGMT Unmethylated Glioblastoma 2022 [Available from: https://clinicaltrials.gov/study/NCT03367715
- Incyte-Corporation. A Phase 1/2 Study of the Safety, Tolerability, and Efficacy of Epacadostat Administered in Combination With Nivolumab in Select Advanced Cancers (ECHO-204) 2023 [Available from: https://clinicaltrials.gov/study/NCT02327078
- PY W. A Pilot Surgical Trial To Evaluate Early Immunologic Pharmacodynamic Parameters For The PD-1 Checkpoint Inhibitor, Pembrolizumab (MK-3475), In Patients With Surgically Accessible Recurrent/Progressive Glioblastoma 2022 [Available from: https://clinicaltrials.gov/study/NCT02852655
- Phase II Study of Pembrolizumab (MK-3475) With and Without Bevacizumab for Recurrent Glioblastoma 2020 [Available from: https://clinicaltrials.gov/study/NCT02337491
- Institute HLMCCaR. A Phase I Trial of Pembrolizumab and Vorinostat Combined With Temozolomide and Radiation Therapy for Newly Diagnosed Glioblastoma 2023 [Available from: https://clinicaltrials.gov/study/NCT03426891.
- DNAtrix I. A Phase II, Multi-center, Open-label Study of a Conditionally Replicative Adenovirus (DNX-2401) With Pembrolizumab (KEYTRUDA®) for Recurrent Glioblastoma or Gliosarcoma (CAPTIVE/KEYNOTE-192) 2021 [Available from: https://clinicaltrials.gov/study/NCT02798406
- National-Institute-of-Neurological-Disorders-Stroke-NINDS). Cytokine Microdialysis For Real Time Immune Monitoring in Glioblastoma Patients Undergoing Checkpoint Blockade 2023 [Available from: https://clinicaltrials.gov/study/NCT03493932
- Huang B, Li X, Li Y, Zhang J, Zong Z, Zhang H. Current Immunotherapies for Glioblastoma Multiforme. Front Immunol. 2020;11:603911.
- Lesniak M. Neural Stem Cell Oncolytic Adenoviral Virotherapy of Newly Diagnosed Malignant Glioma 2022 [Available from: https://clinicaltrials.gov/study/NCT03072134
- Oncology II. Phase Ib Study of Oncolytic Polio/Rhinovirus Recombinant Against Recurrent Malignant Glioma in Children 2024 [Available from: https://clinicaltrials.gov/study/NCT03043391
- Oncolytics-Biotech. A Phase I/II Clinical Trial to Evaluate Dose Limiting Toxicity and Efficacy of Intralesional Administration of REOLYSIN® for the Treatment of Patients With Histologically Confirmed Recurrent Malignant Gliomas 2014 [Available from: https://clinicaltrials.gov/study/NCT00528684
- DNAtrix I. A Phase 1b, Randomized, Multi-center, Open-label Study of a Conditionally Replicative Adenovirus (DNX-2401) and Interferon Gamma (IFN-γ) for Recurrent Glioblastoma or Gliosarcoma (TARGET-I) 2018 [Available from: https://clinicaltrials.gov/study/NCT02197169
- MediGene. An Open-Label Phase Ib/II Study of the Safety, Tolerability and Efficacy of G207, a Genetically Engineered Herpes Simplex Type-1 Virus, Administered Intracerebrally to Patients With Recurrent Malignant Glioma 2005 [Available from: https://clinicaltrials.gov/study/NCT00028158
- Phase I/IIa Study of Intratumoral/Intracerebral or Intravenous/Intracerebral Administration of Parvovirus H-1 (ParvOryx) in Patients With Progressive Primary or Recurrent Glioblastoma Multiforme 2022 [Available from: https://clinicaltrials.gov/study/NCT01301430
- Clinica-Universidad-Navarra. Phase I Trial of Combination of DNX-2401 (Formerly Named Delta-24-RGD) Oncolytic Adenovirus With a Short Course of Temozolomide for Treatment of Glioblastoma at First Recurrent 2017 [Available from: https://clinicaltrials.gov/study/NCT01956734
- Friedman G. Phase I Clinical Trial of HSV G207 Alone or With a Single Radiation Dose in Children With Recurrent Supratentorial Brain Tumors 2024 [Available from: https://clinicaltrials.gov/study/NCT02457845 .