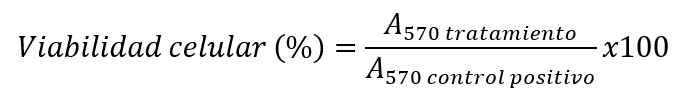Con la intención de vehiculizar fármacos cannabinoides (agonistas CB2) de forma selectiva hacia la placa de ateroma, se han obtenido nanopartículas biocompatibles y biodegradables. Para ello, las nanopartículas PEGyladas, han sido funcionalizadas con un péptido capaz de unirse selectivamente a proteínas endoteliales de adhesión sobreexpresadas en la placa aterosclerótica (vascular cell adhesion molecule 1, VCAM-1). Las partículas han sido caracterizadas fisicoquímicamente, in vitro en cultivos celulares e in vivo en un modelo animal de aterosclerosis (ratones deficientes en apolipoproteína E, ApoE-/-), demostrando un óptimo control espacio-temporal de la liberación del cannabinoide y una respuesta farmacológica superior. Dado que los fármacos agonistas CB2 presentan alta lipofilia y baja disponibilidad, la introducción de nanosistemas selectivos para la vehiculización de estos fármacos antiaterogénicos, mejoraría su biodisponibilidad y eficacia.
El trabajo presentado muestra parte de los resultados obtenidos de un proyecto previo. Estos resultados nos han avalado para la concesión de una nueva ayuda de financiación para abordar una estrategia más avanzada que implica la introducción de elementos de diagnóstico y de un fitocannabinoide.
Palabras clave: nanomedicina; receptores CB2; aterosclerosis; cannabinoides; inflamación
ABSTRACT:
In order to selectively deliver cannabinoid drugs (CB2 agonists) to the atherosclerotic plaque, biocompatible and biodegradable nanoparticles have been obtained. For this purpose, the PEGylated nanoparticles have been functionalized with a peptide capable of selectively binding to endothelial adhesion proteins overexpressed in the atherosclerotic plaque (vascular cell adhesion molecules 1, VCAM-1). The particles have been characterized physicochemically, in vitro in cell cultures and in vivo in an animal model of atherosclerosis (apolipoprotein E-deficient ApoE-/- mice), demonstrating optimal spatiotemporal control of cannabinoid release and superior pharmacological response. Given that CB2 agonist drugs present high lipophilicity and low availability, the introduction of selective nanosystems for the vehiculation of these antiatherogenic drugs would improve their bioavailability and efficacy.
The work presented shows part of the results obtained from a previous project. These results have supported us for the award of a new funding grant to address a more advanced strategy involving the introduction of diagnostic elements and a phytocannabinoid.
Keywords: nanomedicine; CB2 receptors; atherosclerosis; cannabinoids; inflammation
1. INTRODUCCIÓN
Las enfermedades cardiovasculares son la principal causa de muerte a nivel mundial, siendo la aterosclerosis la causa principal de muerte y discapacidad prematura en sociedades desarrolladas (1). Se trata de una patología silente y devastadora siendo una de las principales causas de muerte a nivel mundial (31%). El tratamiento actual se basa fundamentalmente en el uso de estatinas y más recientemente en su uso combinado con inhibidores de PCSK9, sin embargo, es insuficiente e inespecífico. El reconocimiento de que la inflamación desempeña un papel fundamental en la patogenia de la aterosclerosis, sugiere que el receptor cannabinoide CB2 juega un el papel fundamental en esta enfermedad. El proceso aterosclerótico es complejo y se caracteriza por la deposición de lípidos oxidados en la pared arterial, formando la conocida placa de ateroma y ocasionando estrechamiento, endurecimiento de los vasos sanguíneos y trombosis (2). El primer paso del proceso aterosclerótico es la disfunción endotelial, incrementando la permeabilidad a lipoproteínas y células inmunes (3). Altos niveles de lípidos plasmáticos conllevan la activación de vías moleculares que favorecen la producción del anión superóxido, cuyo exceso provoca la oxidación de los lípidos, oxLDL. Los lípidos oxidados se acumulan en la pared arterial y estimulan a las células endoteliales para producir citoquinas proinflamatorias (TNFα, IL-1b), sopreexpresar moléculas de adhesión (VCAM-1, ICAM-1) y generar factores de crecimiento de macrófagos (MSCF), desencadenando una respuesta inflamatoria característica de la enfermedad (4,5). Los macrófagos fagocitan las partículas de oxLDL y se transforman en las denominadas células espumosas, formando el core de la placa de ateroma. Recientemente, el Sistema Endocanabinoide (SEC) se relaciona con el desarrollo de la patología aterosclerótica. En especial el SEC regula la función vascular a nivel local modulando las células endoteliales, células musculares lisas vasculares y células inflamatorias (macrófagos y linfocitos) a través del receptor CB2. Este receptor está ampliamente expresado en el sistema vascular e inmune, caracterizándose por tener propiedades inmunosupresoras y antiinflamatorias, introduciendo a agonistas selectivos CB2 como potenciales candidatos terapéuticos para la aterosclerosis, como se vio en estudios de administración oral de cannabinoides naturales (6,7).
Dado que estos fármacos presentan alta lipofilia y baja disponibilidad, la Nanomedicina, mediante el desarrollo de nanosistemas selectivos para la vehiculización de estos fármacos antiaterogénicos, mejoraría su biodisponibilidad y eficacia.
Por todo ello, el objetivo de este proyecto ha sido dirigir de forma selectiva el cannabinoide JWH-133, agonista CB2 sin capacidad de atravesar la barrera hematoencefálica. El JWH-133 se ha encapsulado en nanopartículas (NPs) biodegradables funcionalizadas con un péptido selectivo para VCAM-1 sobreexpresada en la placa aterosclerótica.
2. MATERIALES Y MÉTODOS – RESULTADOS
2.1. Producción de las NPs conteniendo JWH-133 y funcionalización de su superficie y Caracterización fisicoquímica de los sistemas obtenidos
La síntesis de las NPs se llevó a cabo mediante nanoprecipitación (8). La funcionalización se realizó mediante la unión covalente entre el grupo tiol del péptido de unión a VCAM-1 (VCAM-1 Binding Peptide, BP) (VHPKQHRGGSKGC, Innovagen) con el grupo funcional de maleimida en tampón HEPES 10 Mm/EDTA 0.4 Mm a pH 7. Se ensayaron diferentes medios de conjugación, así como diferentes ratios de polímeros.
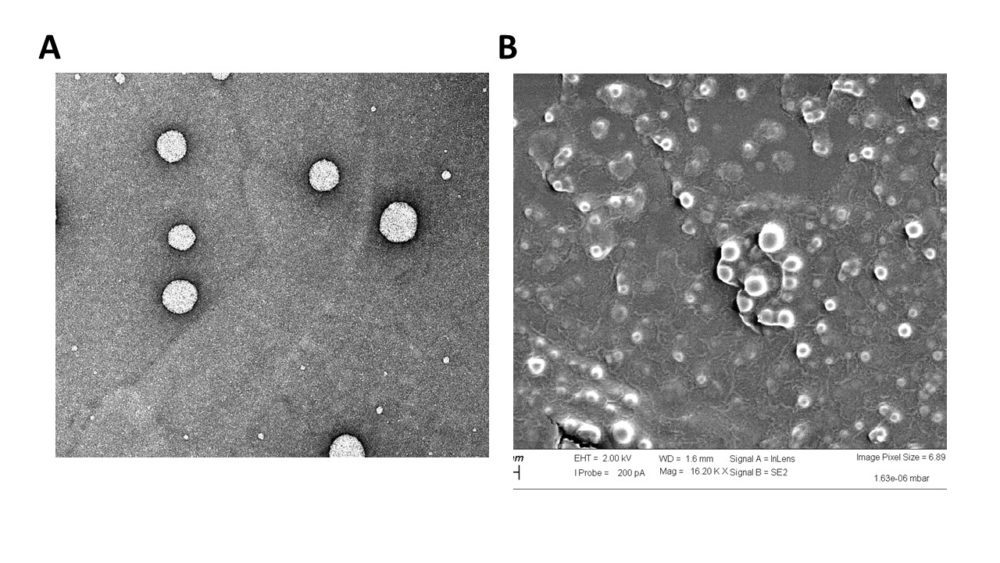
Se han obtenido NPs esféricas con una estructura interna tipo núcleo-corteza probablemente debido a la PEGilación y funcionalización de la superficie (Figura 1), monodispersas con diámetro inferior a 170 nm y un índice de polidispersión PDI <0.2, y una carga superficial negativa (potencial zeta ~ -25mV), para todas las formulaciones.
Figura 1. Aspecto y morfología de las NPs obtenidas. Imágenes de microscopía electrónica de (A) transmisión (TEM) y (B) de barrido (SEM)
2.2. Ensayos in vitro de citotoxicidad, “uptake” y especificidad
Cultivo celular. Para los ensayos in vitro se han utilizado células endoteliales humanas de la línea celular Human Umbilican Vein Endothelial Cells (HUVEC, CRL-1730, ATCC).
Citotoxicidad. La toxicidad de las NPs se evaluó mediante ensayos de MTT que permite determinar la funcionalidad mitocondrial de las células tratadas.
En términos de viabilidad celular, como control positivo se dejaron pocillos con células sin tratar (100% supervivencia), mientras que para el control negativo las células se trataron con DMSO (0% supervivencia). Finalmente, se determina la absorbancia del formazán formado a 570 nm (A570) en un lector de placas (Synergy HT, BioTek Instruments). La viabilidad celular relativa (%) de cada concentración de NPs, fármaco libre y condición de tratamiento se calcula como:
- Uptake celular. La capacidad de las NPs funcionalizadas para unirse a las moléculas de adhesión VCAM-1 sobreexpresadas en células HUVEC (previa estimulación con TNFa) se estudió mediante microscopía de fluorescencia fijando las células con parafolmaldheido (PFA 4%) (ECLIPSE Ti, Nikon) y en células en suspensión por citometría de flujo (MACSQuant® Analyzer 10, Miltenyi Biotec). Para ello las partículas fueron teñidas con el fluoróforo nile red.
- Citoquinas. Los niveles de citoquinas pro-inflamatorias, IL-6, y anti-inflamatorias, IL-10, se evaluaron en células endoteliales estimuladas con TNFα tras el tratamiento con: fármaco libre, NP Blancas, y NPs conteniendo JWH-133 sin funcionalizar y NPs funcionalizadas. La concentración de IL-6 e IL-10 en el medio de cultivo celular tras el tratamiento se determinó mediante kits ELISA específicos (Invitrogen).
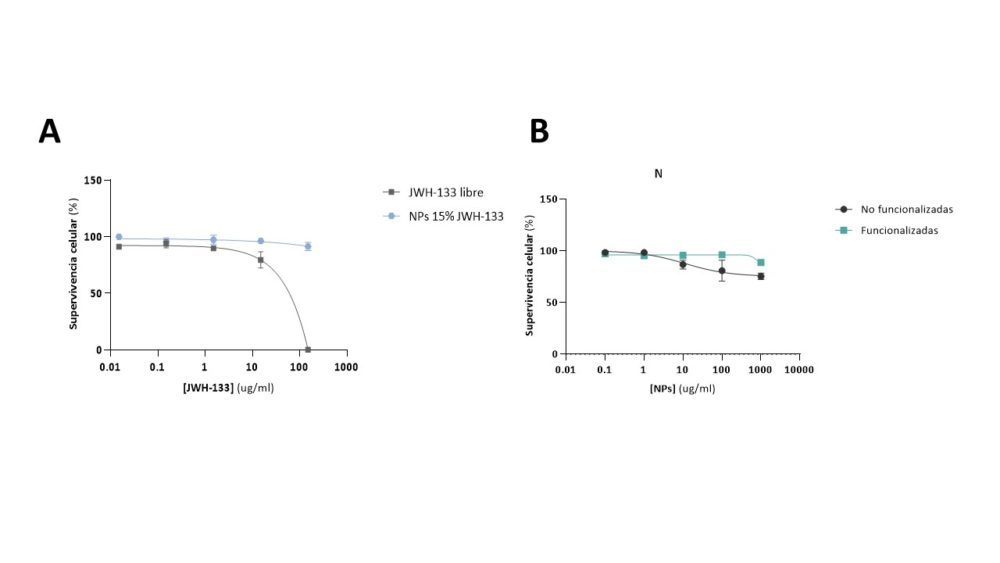
Figura 2. Viabilidad celular en cultivos HUVEC de NPs cargadas con fármaco (A) sin funcionalizar y (B) funcionalizadas superficialmente. Los valores de supervivencia celular se muestran en función de la concentración del fármaco.
2.3. Estudios in vivo de biodistribución y targeting
La capacidad de unión de las NPs a la aorta (targeting) y la acumulación de las NPs en otros órganos (corazón, hígado, riñones, bazo y cerebro) se estudió por citometría de flujo (MACSQuant® Analyzer 10, Miltenyi Biotec). Para ello, se administró una dosis única de NPs fluorescentes vía i.p. equivalente a 7.5 mg/Kg de fármaco. Tras 2 h, los animales se sacrificaron y se extrajeron los órganos. Las muestras de los distintos órganos se perfundieron y lavaron con PBS frío. Posteriormente se procedió a la homogenización y filtrado para el análisis por citometría de flujo (MACSQuant® Analyzer 10, Miltenyi Biotec). Para descartar la autoflorescencia de cada tejido, la fluorescencia del grupo control en cada órgano se tomó como basal y se ajustó para cada tipo tisular. Se obtuvieron los valores de fluorescencia para cada órgano por duplicado. La suma de la fluorescencia de todos los tejidos analizados por animal se tomó como el 100%, y la fluorescencia de cada órgano se ha expresado como la normalización respecto al total (%Fluorescencia relativa).
2.4. Estudios de eficacia del tratamiento con NPs conteniendo JWH-133 en un modelo animal in vivo de aterosclerosis inducida por modificación genética en ratones ApoE-/-
Los ensayos con animales se realizaron de acuerdo con las Guías Institucionales de la Unión Europea relativas al cuidado y uso de animales de laboratorio (Directiva del Consejo de Europa 86/609/CEE (Nº Proyecto 05/02/2021/002). Los animales fueron suministrados por Charles River Laboratories (Francia) y se han mantenido siguiendo la normativa vigente.
Diseño experimental. Se utilizó el modelo animal de aterosclerosis inducida por modificación genética en ratones apoE knock-out, ApoE-/- (Charles River Laboratories) (9,10). Los animales fueron alimentados con una dieta de alto contenido en grasa “High fat diet” (HF) durante 22 semanas, comenzando a la edad de 6 semanas. A partir de las 20 semanas de edad, ya estaba establecida la aterosclerosis, momento en el cual los ratones se randomizaron a uno de los 3 grupos siguientes: (i) Control, (ii) JWH-133 libre y (iii) NPs-JWH-133 (Figura 3).
Figura 3. Diseño Experimental
El tratamiento se llevó a cabo en grupos de 10 ratones macho y 6 hembras por cohorte. La dosis de fármaco JWH-133 administrada, tanto libre como encapsulado en la NPs, fue de 7.5 mg/Kg durante 8 semanas por vía intraperitoneal 2 veces por semana, manteniendo la dieta HF.
El peso de los animales fue controlado semanalmente hasta el momento del sacrificio.
Tras el tratamiento (28 semanas de edad), se procedió al sacrificio de los animales que fueron previamente anestesiados con ketamina/xilacina (80/10 mg/kg) vía i.p. y seguidamente se realizó una punción cardíaca para la extracción de sangre y la posterior obtención de suero sanguíneo. Se extrajeron corazón y aorta desde su parte más distal del cayado aórtico hasta la bifurcación ilíaca.
Se cuantificó el desarrollo de las placas de ateroma a lo largo del tejido aórtico mediante la medición del área de las placas (análisis morfométrico mediante Image J) y acumulación lipídica mediante Tinción Oil Red-O.
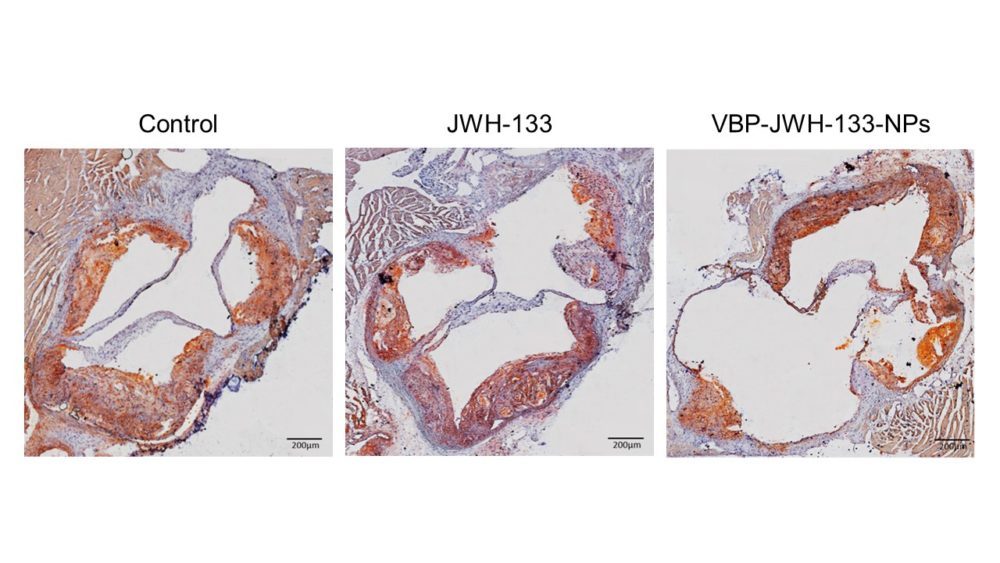
El nivel lipídico en las placas de ateroma de la válvula aórtica, una de las regiones más ateroscleróticas, fue significativamente superior en el grupo control, tanto en hembras (19.56%) como en machos (23.10%). Se observó una drástica reducción en el grupo tratado con NPs, siendo del 6.44% en machos y del 10.52% en hembras, indicando un descenso del porcentaje lipídico a más de la mitad. El tratamiento con el fármaco JWH-133 libre redujo también el nivel de lípidos ateroscleróticos, al 15.72% en el caso de las hembras y al 14.43% en machos, siendo claramente menos efectivo que con el tratamiento con NPs (Figura 4).
Figura 4. Eficacia del tratamiento. Imágenes representativas de la tinción con Oil Red O de las válvulas aórticas de ratones ApoE-/- machos según el grupo de tratamiento y cuantificación del área (%) de tinción con Oil Red O. (n=10). n.s.: no significativo, *p<0.05, **p<0.01, ***p< 0.001, ****p<0.0001.
Respecto al perfil lipídico e inflamatorio (citoquinas), el grupo tratado con NPs conteniendo el agonista CB2 presentó niveles significativamente inferiores de los principales factores ateroscleróticos: colesterol = 418.43mg/dl, triglicéridos = 93.06 mg/dl e IL-6 = 39.12 pg/ml, en comparación con el grupo control (colesterol = 896.47 mg/dl, triglicéridos= 188.15 mg/dl e IL-6 = 62.40 pg/ml). Presentando el grupo tratado con fármaco libre niveles lipídicos similares al grupo control.
Las variables anti-aterogénicas, HDL-c e IL-10, se encontraron significativamente elevadas en el grupo tratado con nanosistemas (81.31 mg/dl y 72.44 pg/ml) frente al grupo control (40.48 mg/dl y 47.14 pg/ml) y al grupo fármaco libre (53.68 mg/dL y 47.39 pg/ml).
Los niveles de nitritos en suero se estimaron mediante la reacción de Griess. Los resultados muestran que estos niveles se encontraron aumentados en el grupo tratado con NPs conteniendo el cannabinoide, 156,89nM, respecto al control, 45.27nM, y al fármaco libre, 120.13 nM.
3. DISCUSIÓN DE RESULTADOS
Las formulaciones, están constituidas por 3 tipos de PLGA, polímero aprobado por la FDA. La presencia de PEG ha contribuido a la acción prolongada del cannabinoide al proporcionar mayor hidrofilia al sistema y enmarcarlo frente al sistema fagocítico mononuclear lo que se traduce en un aumento el tiempo de circulación sistémica (11) ya que ha demostrado ser farmacológicamente superior al fármaco libre en una pauta de administración in vivo de 2 veces en semana. Un contenido del 10% de PLGA-PEG-Mal ha permitido la unión estable y covalente del péptido de unión a la molécula VCAM-1, el VCAM-1 BP (VHPKQHRGGSKGC) lo que permite la unión selectiva de las NPs tanto a las células endoteliales humanas HUVEC estimuladas con TNFα como a las placas de ateroma de ratones ApoE-/-, según los ensayos de bioistribución, lo que valida la estrategia de targeting seleccionada en este trabajo (12) y que puede explicarse debido a la sobreexpresión de moléculas VCAM-1 que contribuye al reclutamiento de linfocitos y macrófagos, y por lo tanto a la consecuente inflamación (5). Las NPs diseñadas además han demostrado no ser tóxicas tanto in vitro como in vivo y ha contribuido a reducir la toxicidad del fármaco 3.5 veces en cultivos celulares. Esto podría explicarse debido al pequeño tamaño de las NPs (menor a 170 nm) y a su capacidad de liberar el fármaco en el lugar deseado.
La superioridad de la eficacia del tratamiento farmacológico de las NPs diseñadas en este trabajo conteniendo el cannabinoide frente a este en su forma libre también ha quedado patente en varios aspectos demostrando que la nanomedicina, y en concreto las NPs de PLGA son una estrategia farmacológica prometedora para la vehiculización de cannabinoides. De forma resumida se ha logrado: (i) disminuir significativamente el nivel de lípidos en las placas de ateroma, (ii) el grosor de las placas es menor, (iii) los niveles séricos de colesterol y triglicéridos totales se reducen a la mitad, (iv) aumenta los niveles de HDL-c, (v) reduce los niveles de IL-6 (citoquina pro-inflamatoria) y aumenta la concentración de IL-10 (citoquina anti-inflamatoria). Los niveles de nitritos en suero son un indicativo de la disponibilidad del óxido nítrico (NO), los cuales se encontraron aumentados en el grupo tratado con NPs conteniendo el cannabinoide respecto al grupo control y al grupo tratado con el fármaco libre, indicando una mayor disponibilidad y metabolismo de NO, lo cual es beneficioso para la aterosclerosis (13,14). Probablemente, todo esto se pueda explicar debido a la mejora de las propiedades farmacocinéticas del fármaco que al estar vehiculizado en estas NPs mejora en varios aspectos: solubilidad, acceso a la diana terapéutica y minimización de efectos tóxicos.
Por otro lado, cabe destacar las diferencias encontradas en machos y hembras las cuales se pueden explicar debido a la gran relevancia de las diferencias en los factores de riesgo, el perfil lipídico, el desarrollo y la progresión de la aterosclerosis según el género (15,16). En el grupo control, las hembras presentaron menores niveles de colesterol y triglicéridos que los machos, así como de IL-6, reflejando el efecto ateroprotector del género femenino. De igual modo, la cantidad de placas y los niveles lipídicos de las mismas fueron menores en hembras, aunque existentes. El tratamiento con NPs mejoró y ocasionó un gran descenso en todos los parámetros aterogénicos más notablemente en machos que en hembras, aunque en ambos casos se vio una clara acción de los nanosistemas selectivos. En ambos géneros se observó la efectividad del cannabinoide libre y más aún de la nanoformulación, aunque siendo claramente más señalada en machos, donde la aterosclerosis inicial era mucho mayor.
4. CONCLUSIONES
Los nanosistemas diseñados se unen específicamente a células endoteliales humanas y a las regiones ateroscleróticas desarrolladas en ratones ApoE-/- de forma selectiva mediante las moléculas VCAM-1. La efectividad del cannabinoide agonista CB2 como tratamiento para la aterosclerosis fue superior con la nanoformulación, ya que el grupo tratado con NPs conteniendo JWH-133 presentó menor número de placas, de menor grosor, con menor deposiciones lipídicas y un perfil sérico de lípidos y citoquinas pro-inflamatorias mejorado. Las NPs de PLGA diseñadas en este trabajo suponen una estrategia farmacológica prometedora para la vehiculización de cannabinoides para el tratamiento de la aterosclerosis.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses.
5. REFERENCIAS
1. Libby P. The changing landscape of atherosclerosis. Nature. 021;592(7855):524–33. Available from: http://dx.doi.org/10.1038/s41586-021-03392-8
2. Vergallo R, Crea F. Atherosclerotic Plaque Healing. N Engl J Med. 2020;383(9):846–57.
3. Tyrrell DJ, Goldstein DR. Ageing and atherosclerosis: vascular intrinsic and extrinsic factors and potential role of IL-6. Nat Rev Cardiol. 2021;18(1):58–68. Available from: http://dx.doi.org/10.1038/s41569-020-0431-7
4. Wolf D, Ley K. Immunity and Inflammation in Atherosclerosis. Circ Res. 2019;124(2):315–27.
5. Yin L, Bai J, Yu WJ, Liu Y, Li HH, Lin QY. Blocking VCAM-1 Prevents Angiotensin II-Induced Hypertension and Vascular Remodeling in Mice. Front Pharmacol. 2022;13(February):1–12.
6. Hoyer FF, Steinmetz M, Zimmer S, Becker A, Lütjohann D, Buchalla R, et al. Atheroprotection via cannabinoid receptor-2 is mediated by circulating and vascular cells in vivo. J Mol Cell Cardiol. 2011;51(6):1007–14. Available from: http://dx.doi.org/10.1016/j.yjmcc.2011.08.008
7. Steffens S, Veillard NR, Arnaud C, Pelli G, Burger F, Staub C, et al. Low dose oral cannabinoid therapy reduces progression of atherosclerosis in mice. Nature. 2005;434(7034):782–6.
8. Durán-Lobato M, Álvarez-Fuentes J, Fernández-Arévalo M, Martín-Banderas L. Receptor-targeted nanoparticles modulate cannabinoid anticancer activity through delayed cell internalization. Sci Rep [Internet]. 2022;12(1):1–17. Available from: https://doi.org/10.1038/s41598-022-05301-z
9. D’Uscio L V., Baker TA, Mantilla CB, Smith L, Weiler D, Sieck GC, et al. Mechanism of endothelial dysfunction in apolipoprotein E-deficient mice. Arterioscler Thromb Vasc Biol. 2001;21(6):1017–22.
10. Meir KS, Leitersdorf E. Atherosclerosis in the apolipoprotein E-deficient mouse: A decade of progress. Arterioscler Thromb Vasc Biol. 2004;24(6):1006–14.
11. Padín-González E, Lancaster P, Bottini M, Gasco P, Tran L, Fadeel B, et al. Understanding the Role and Impact of Poly (Ethylene Glycol) (PEG) on Nanoparticle Formulation: Implications for COVID-19 Vaccines. Front Bioeng Biotechnol. 2022;10(June):1–16.
12. Thayse K, Kindt N, Laurent S, Carlier S. Vcam‐1 target in non‐invasive imaging for the detection of atherosclerotic plaques. Biology (Basel). 2020;9(11):1–21.
13. Peng R, Luo M, Tian R, Lu N. Dietary nitrate attenuated endothelial dysfunction and atherosclerosis in apolipoprotein E knockout mice fed a high-fat diet: A critical role for NADPH oxidase. Arch Biochem Biophys. 2020;689:108453. Available from: https://doi.org/10.1016/j.abb.2020.108453
14. Herman AG, Moncada S. Therapeutic potential of nitric oxide donors in the prevention and treatment of atherosclerosis. Eur Heart J. 2005;26(19):1945–55.
15. Man JJ, Beckman JA, Jaffe IZ. Sex as a Biological Variable in Atherosclerosis. Circ Res. 2020;1297–319.
16. Vakhtangadze T, Singh Tak R, Singh U, Baig MS, Bezsonov E. Gender Differences in Atherosclerotic Vascular Disease: From Lipids to Clinical Outcomes. Front Cardiovasc Med. 2021;8(June):1–6.