El progreso de los países en vías de desarrollo está totalmente condicionado por el elevado impacto de un grupo de veinte entidades olvidadas o desatendidas producidas por diversos agentes etiológicos. Aunque para muchas de ellas se dispone de un tratamiento eficaz, tanto las reinfecciones frecuentes como las resistencias asociadas, dificultan enormemente su control. Hasta el momento actual, solamente se dispone de vacunas comerciales para afrontar las infecciones por el virus del Dengue y rabia. Algunas de las razones que justifican su falta de disponibilidad tienen que ver con la baja eficacia de las vacunas clásicas junto con los largos periodos de desarrollo y el escaso interés de la industria farmacéutica. Además, y en cuanto a las enfermedades olvidadas de origen parasitario, su complejidad biológica y estructural junto con su arsenal inmunomodulador, las ha convertido en un difícil reto a nivel profiláctico. La pandemia de SARS-CoV-2 nos ha enseñado el potencial que presentan la tecnología de vacunas de ARNm. La flexibilidad de las plataformas disponibles asociado a la incorporación de nuevas e innovadoras aproximaciones tecnológicas de inmunoinformática, ofrece una nueva esperanza para permitir que en un futuro próximo se solucionen muchos de los problemas sanitarios asociados a la pobreza.
Palabras clave: enfermedades tropicales desatendidas; zoonosis parasitarias; pobreza; vacunas; ARNm
ABSTRACT:
The progress of low and middle income countries is absolutely dependent on the high impact of twenty forgotten or neglected entities caused by a wide range of etiological agents. Although there are available treatments against many of them, reinfections and drug resistance hamper their control. Until now, only commercial vaccines are effective to manage for Dengue virus and rabies. Some reasons are the low efficacy of conventional vaccines, the long lasting development and the lack of industrial involvement. Moreover, the biological and structural complexity and immunomodulatory arsenal of the neglected parasitic diseases make this an important prophylactic challenge. SARS-CoV-2 pandemic showed the real potential of mRNA vaccine technology. The flexibility of the platform associated with the new and innovative technological immunoinformatic approaches offer a new hope to face many of the sanitary problems related to poverty population for the near future.
Keywords: neglected tropical diseases; parasitic zoonoses; poverty; vaccines; mRNA
1. INTRODUCCIÓN
La prevalencia, distribución, control y manejo de las enfermedades infecciosas depende en gran medida de las condiciones socioeconómicas, culturales y ambientales que las acompañan. En comunidades empobrecidas, especialmente en países en vías de desarrollo, una amplia mayoría de sus habitantes viven en ambientes de superpoblación, con falta de agua potable o condiciones inadecuadas de higiene, generando así un caldo de cultivo idóneo para la adquisición y transmisión de enfermedades (1).
A este respecto, la Organización de las Naciones Unidas (ONU) define el estado de desarrollo de un país en base a su Índice de Desarrollo Humano (HDI, del inglés Human Development Index). Este indicador tiene en cuenta numerosos factores para definir la longevidad y calidad de vida de los habitantes de una región, su educación y sus estándares de vida. En una escala de 0 a 1, se clasifica como país en vías de desarrollo todo aquel que no alcanza una puntuación de 0,80. Según el Human Development Report 2021-2022, en este año todavía se encuentran por debajo de ese umbral 125 países (2).
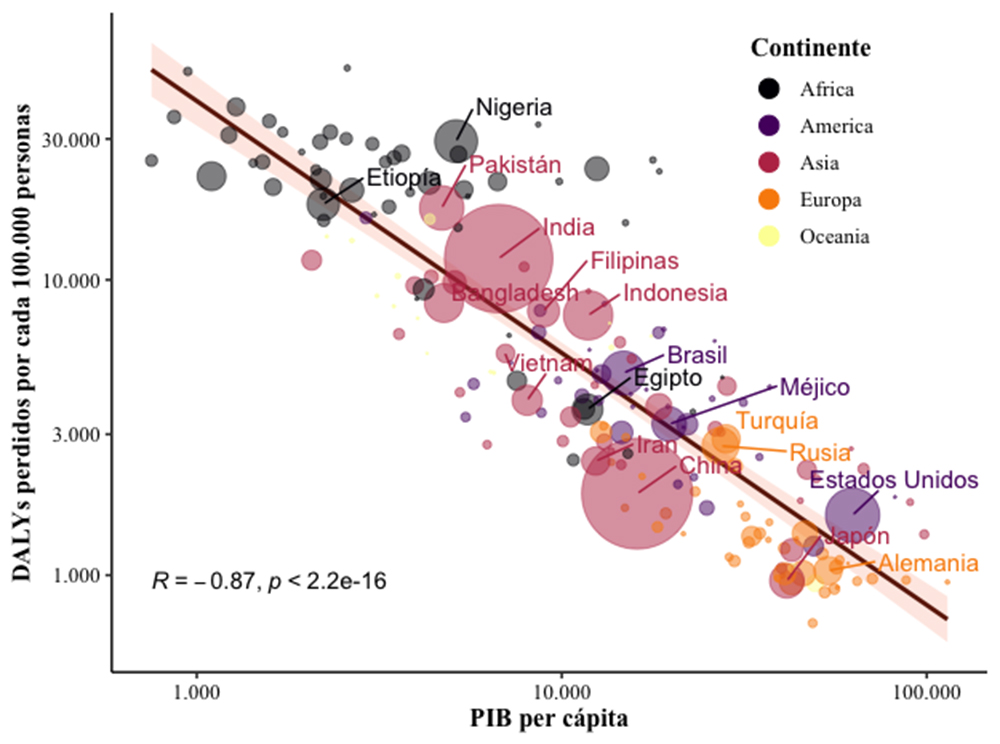
A pesar de esta elevada cifra, el HDI global se está incrementando, aunque de manera desigual entre regiones. Una medida de ese progreso es la reducción en morbilidad causada por enfermedades, contabilizada en DALYs (del inglés Disability Adjusted Life-Years). El guarismo, en números absolutos, se ha mantenido más o menos constante a lo largo de los últimos treinta años, pero al ajustarlo a la expansión y envejecimiento poblacional, se observa una clara tendencia descendente. Entre las diez causas principales de ese descenso, cinco son consecuencia directa de un mejor manejo de algunas enfermedades infecciosas: infecciones de las vías respiratorias bajas, sarampión, tétanos, malaria (todas ellas afectan principalmente a niños) y tuberculosis (afecta principalmente a adultos). Asimismo, se incluyen entre las causas principales enfermedades que cursan con diarrea, que también pueden estar provocadas por agentes infecciosos (3). A pesar de esta reducción generalizada, la carga que ejercen las enfermedades infecciosas sigue siendo desproporcionadamente superior en los países con menores recursos, con una fuerte correlación (R=0.87, p<2,2×10-16; vía correlación de Pearson) entre una mayor morbilidad y un menor producto interior bruto per cápita (Figura 1).
Figura 1. Correlación entre la morbilidad de las enfermedades infecciosas y el producto interior bruto per cápita. Gráfico de burbujas. El tamaño de cada burbuja representa la población de cada país. Representados aparecen 186 de los 194 países mundiales. Solo se muestran los nombres de países con una población superior a 75 millones de habitantes. R y p-valor obtenidos mediante correlación de Pearson entre las variables de DALYs perdidos por cada 100.000 personas y Producto interior bruto per cápita (PIB per cápita). Datos del año 2019, tomados de https://ourworldindata.org/burden-of-disease.
En las regiones tropicales y subtropicales del planeta, donde se concentran la amplia mayoría de países en vías de desarrollo, hay cuatro infecciones o grupos de infecciones principales: VIH, malaria, tuberculosis y enfermedades tropicales desatendidas (NTDs) (4). Estas últimas fueron definidas en el año 2005 por los científicos David H. Molyneux, Peter J. Hotez y Alan Fenwick como “condiciones que promueven la pobreza y, a menudo, estigmatizan, teniendo lugar principalmente en áreas rurales de países en vías de desarrollo” (5). Inicialmente incluían 13 entidades, aunque a día de hoy son ya 20, englobando infecciones causadas por parásitos, bacterias, virus y hongos, así como envenenamientos por mordedura de serpiente (6). Las más prevalentes son las parasitosis (Tabla 1) y dentro de ellas las producidas por helmintos que habitualmente cursan de forma crónica con alteraciones que pueden estar presentes durante años o décadas (7). Por otro lado, las NTDs de origen vírico, como Dengue o Chigungunya, desencadenan cuadros agudos. En las primeras se han llevado a cabo programas integrados de tratamientos masivos conocidos como MDA (Mass Drug Administration), auspiciados por diferentes agencias internacionales y organizaciones no gubernamentales, que han conseguido reducir la prevalencia y la gravedad de estas afecciones. Sirva como ejemplo los programas para la eliminación de la oncocercosis en África (8). No obstante, otras infecciones, sobre todo las producidas por virus, son más difíciles de manejar por no disponer de fármacos adecuados. Esto hace necesario afrontar estas patologías mediante el desarrollo y la aplicación de vacunas efectivas.
2. VACUNAS FRENTE A ENFERMEDADES TROPICALES DESATENDIDAS
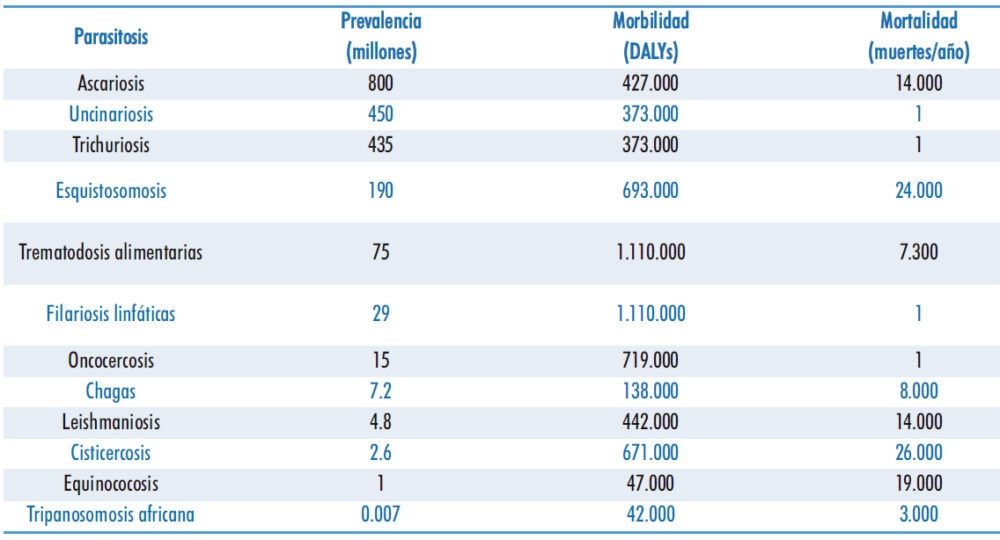
Las NTDs agrupan condiciones que tienen como característica común la capacidad de promover la pobreza y estigmatizar, principalmente en regiones en vías de desarrollo. Bajo esta premisa, algunos autores han denominado vacunas “anti-pobreza” a aquellas dirigidas a su prevención. Sin embargo, a pesar de su importancia capital, esta investigación queda lejos de las prioridades de la industria farmacéutica. Como ejemplo, la inversión combinada en el desarrollo de vacunas contra esquistosomosis, uncinariosis, leishmaniosis y enfermedad de Chagas no superó los 20 millones de dólares en el año 2015 (7), mientras que su prevalencia combinada superaba los 650 millones de personas (Tabla 1).
Tabla 1. Prevalencia, morbilidad y mortalidad de enfermedades olvidadas producidas por parásitos
Más allá de esta falta de interés industrial y la baja inversión público-privada, el desarrollo de vacunas contra NTDs tiene otros retos que superar. El principal es la dificultad de diseñar vacunas que generen protección elevada y duradera contra las NTDs parasitarias, cuyos agentes causales tienen una elevada complejidad genética, estructural y en su ciclo de vida. Hoy en día, la vacuna antimalárica MosquirixTM, comercializada por la farmacéutica GSK, es la única vacuna disponible contra infecciones parasitarias en humanos. Se ha aprobado para su uso en niños menores de 5 años en algunos países africanos (9), aunque no carece de limitaciones tanto en su seguridad, con un preocupante incremento en casos de meningitis en individuos vacunados, como en su capacidad protectora, reducida y poco duradera (10). A este éxito relativo en la lucha contra el paludismo no le ha seguido el de ningún otro parásito.
Actualmente solo encontramos vacunas licenciadas para dos NTDs, ambas de origen vírico, dengue y rabia. La vacuna contra la rabia fue una de las primeras en desarrollarse, por los eminentes científicos Louis Pasteur y Emile Roux en 1885. La vacuna era un virus atenuado que se producía en tejido nervioso de conejo. Este fue el modo de producción habitual durante casi un siglo, aunque desde los años 80s se ha sustituido por producciones más modernas y limpias en cultivos celulares o huevos embrionados. Estas vacunas son de administración intramuscular y pueden ser usadas tanto pre- como post-exposición. Con una letalidad en individuos no vacunados superior al 99%, se calcula que la vacuna administrada convenientemente después de la exposición previene el 99% de las potenciales muertes (11). El dengue es la otra NTD que dispone de una vacuna comercial, Dengvaxia, producida por Sanofi y recomendada ya en varios países con dengue endémico. Esta vacuna está compuesta por virus quiméricos entre el virus de la fiebre amarilla y los cuatro serotipos patogénicos de Dengue (12). Aunque la vacuna está siendo utilizada con éxito, las estrategias de vacunación contra el dengue deberían mejorarse. Todavía hay preocupaciones en cuanto a su seguridad, pues incrementa el riesgo de manifestaciones de dengue grave en individuos no infectados. Además, en términos de respuesta inmune, hay una producción desigual de anticuerpos neutralizantes específicos para los cuatro serotipos y es necesario caracterizar mejor la respuesta inmune en diferentes grupos poblacionales (13). Es por ello, que hay diversos candidatos en fases clínicas de desarrollo, algunos de ellos en fase III.
Poniendo el foco en el desarrollo de vacunas contra NTDs causadas por parásitos, el escenario es todavía más desolador que el de las NTDs víricas. Hasta la fecha, solo encontramos candidatos vacunales en ensayos clínicos contra uncinariosis, esquistosomosis y leishmaniosis (14).
2.1. Vacunas contra protozoos
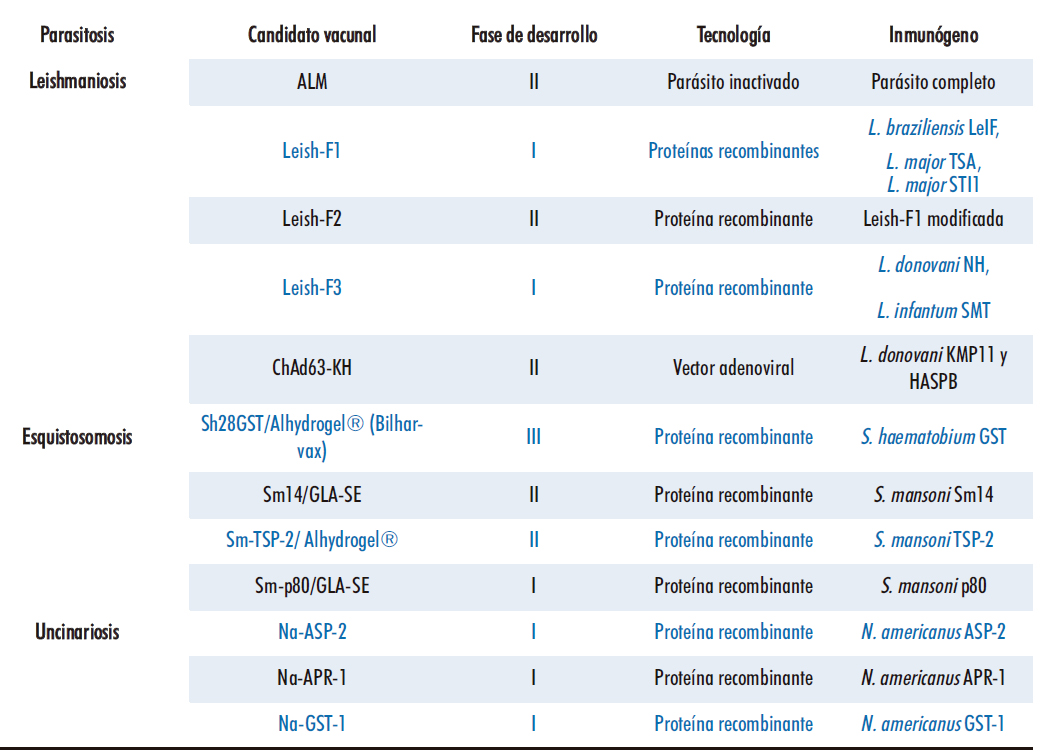
Entre las NTDs causadas por protozoos, la leishmaniosis presenta los candidatos vacunales más avanzados. Actualmente, hay cuatro vacunas autorizadas para uso veterinario y diversos candidatos en fases clínicas para su uso en humanos (Tabla 2). Entre ellas encontramos vacunas de primera generación, como la ALM compuesta por Leishmania autoclavada que ha llegado a ensayos clínicos de fase II. Vacunas de segunda generación, como Leish-F1, compuesta de proteínas recombinantes de L. major y L. braziliensis, generandose una buena respuesta inmune en voluntarios sanos y siendo eficiente en casos de leishmaniosis cutánea y mucocutánea. Por otra parte, la vacuna Leish-F3, compuesta por el glicocáliz de L. donovani y la 24-c-metiltransferasa de L. infantum, demostró una respuesta inmunitaria robusta contra la leishmaniosis visceral, altos niveles de producción de citocinas en respuesta a cada componente de la vacuna, considerándose una vacuna segura y bien tolerada en voluntarios humanos. Otras vacunas de desarrollo más moderno, como ChAd63-KH, que utiliza vectores adenovirales expresando los antígenos de L. donovani KMP-11 y HASPB han demostrado ser seguras vía intramuscular, induciendo una producción fuerte de INF-γ y activación de células dendríticas, encontrándose actualmente en fase II (15).
Tabla 2. Candidatos vacunales contra NTDs de etiología parasitaria en fases clínicas
En el caso de los tripanosomas, nos encontramos dos escenarios muy diferentes. Por un lado, el interés por desarrollar una vacuna contra la tripanosomosis africana es actualmente nulo por parte de la industria. El reducido número de nuevas infecciones anuales y la gran variabilidad antigénica que muestra el parásito en su superficie ha limitado cualquier intento de investigación en esta entidad. Debido a la falta de vacuna y a la ausencia de quimioprofilaxis, la enfermedad es controlada a través de la detección de nuevos casos y su tratamiento, y, en menor medida, su control vectorial (16). Por otro lado, el interés en desarrollar nuevos candidatos vacunales contra la enfermedad de Chagas es elevado. Los antichagásicos son el único tratamiento eficaz en la fase inicial de la enfermedad. Hoy, el mejor tratamiento profiláctico es el control vectorial, para lo que el desarrollo de una vacuna sería de gran ayuda. Además, una vacuna combinada con la terapia farmacológica representaría un gran avance en el tratamiento de los pacientes crónicos (13). Se ha probado una gran variedad de plataformas de vacunas en modelos animales, incluyendo vacunas de ADN, peptídicas, de proteínas recombinantes, vectores virales y bacterianos y parásitos vivos atenuados. Algunos candidatos han demostrado la capacidad de reducir los daños cardiacos y la necrosis asociada a la infección, principalmente a través de la activación de células T CD4+ y CD8+ y la producción de INF-γ (17).
2.2. Vacunas antihelmínticas
Los helmintos infectan a más de un cuarto de la población mundial, causando principalmente una elevada morbilidad. A pesar del uso de tratamientos masivos en niños en edad escolar y otras medidas de control, estos parásitos se están extendiendo a nuevas regiones. Por tanto, el desarrollo de vacunas contra estas infecciones sería una medida óptima para su control, tanto desde el punto de vista de su coste como su efectividad a largo plazo. Además, esta efectividad no se ve amenazada por la aparición de resistencias o las reinfecciones, como lo hace la de los tratamientos masivos. Sin embargo, el desarrollo de vacunas antihelmínticas es inherentemente complejo. Se trata de organismos multicelulares eucarióticos con múltiples fases en su ciclo de vida en las que existe cierta especificidad antigénica. Además, su capacidad inmunomoduladora, así como su refinada evasión de la respuesta inmune aumentan esta complejidad (18). En la actualidad, únicamente existen candidatos vacunales en fases clínicas contra dos de las NTDs causadas por helmintos, la esquistosomosis y la uncinariosis (14).
La esquistosomosis causa elevada morbilidad y mortalidad en muchas regiones. Su control, al igual que el de muchas otras helmintosis, se ha centrado en las últimas décadas en tratamientos masivos con praziquantel. Aunque es el tratamiento de elección, presenta algunos inconvenientes, principalmente no es efectivo contra las formas juveniles de los parásitos y no evita las reinfecciones. Hasta la fecha, más de cien antígenos candidatos se han identificado y probado contra alguna de las tres especies principales causantes de infecciones en humanos (Schistosoma mansoni, S. japonicum y S. haematobium). De estos, solo unos pocos han demostrado cierto nivel de protección y de estos solo un selecto grupo ha llegado a ensayos clínicos (19). Actualmente, únicamente cuatro candidatos se encuentran en fases clínicas, uno contra la infección por S. haematobium y tres contra S. mansoni (Tabla 2).
La proteína recombinante Sh-28GST, derivada de la glutation S-transferasa de 28 kDa de S. haematobium se encuentra actualmente en fase clínica III. En estudios preclínicos, aunque la vacuna no reducía la carga de gusanos, si disminuía de forma significativa la presencia de huevos tanto en tejidos como en heces (20). En su formulación para humanos la proteína recombinante se adsorbe en Alhydrogel como adyuvante y ha mostrado una buena tolerancia y respuesta inmune tipo Th-2 en fases clínicas I y II. Sin embargo, el primer ensayo en fase III en niños infectados generó una protección muy reducida, que podría ser achacada al uso repetido de praziquantel en la población de estudio o el régimen vacunal diseñado para bloquear la producción de IgG4 en lugar de inducir la producción de anticuerpos protectores IgG3 (21).
Tres candidatos se encuentran actualmente en fases clínicas contra la infección por S. mansoni, compuestos de diferentes proteínas recombinantes derivadas del parásito. Sm14 es una molécula de unión a ácidos grasos, cuya función es vehicular esteroles y ácidos grasos provenientes del hospedador (22). En estudios clínicos se ha formulado en una emulsión con el adyuvante glucopiranosil lípido A. En estudios de fase clínica I, la vacuna demostró ser segura y producir potentes respuestas inmunes humorales específicas contra Sm-14, sin causar una producción elevada de anticuerpos IgE. En la actualidad ya se ha concluido un estudio en fase IIa y otro en fase IIb está aprobado, pero aún no se conocen los resultados (19).
La proteína de superficie tetraspanina 2 de S. mansoni (Sm-TSP-2), es una proteína transmembrana cuyo dominio extracelular ha demostrado inducir respuestas protectoras de anticuerpos IgG1 e IgG3 en individuos con inmunidad natural, pero no en infectados crónicos o no infectados (23). Para ensayos clínicos de fase I se ha formulado en Alhydrogel, al igual que Sh-28GST, pero no se dispone todavía de resultados.
Por último, Sm-p80 corresponde a la subunidad mayor de la calpaína, proteasa del tegumento del helminto expresada en varias fases de su ciclo vital. Juega un papel fundamental en la evasión de la respuesta inmune y es, por tanto, crítica para la supervivencia del parásito. Estudios preclínicos en primates con formulación análoga a la Sm14 han mostrado una reducción superior al 93% de hembras adultas del parásito y al 89% de huevos en los tejidos. La vacuna ha entrado recientemente en estudios de fase clínica I que siguen teniendo lugar en la actualidad (24).
El otro grupo de helmintosis para el que el desarrollo de vacunas a alcanzado fases clínicas son las geohelmintosis. Se calcula que más de un cuarto de la población mundial está en riesgo de contraer una de estas infecciones y aunque existen fármacos disponibles y eficaces, que son donados de manera gratuita a países endémicos, solo la mitad de los niños en riesgo recibieron tratamiento en 2016 (25). Dentro de las NTDs, hay cinco geohelmintos causantes de infección en humanos: Ascaris lumbricoides, Ancylostoma duodenale, Necator americanus, Trichuris trichiura y Strongyloides stercoralis. Actualmente, los candidatos vacunales más avanzados están dirigidos a la infección por N. americanus (Tabla 2).
NaASP-2 es una proteína secretada por larvas infectivas de N. americanus a su entrada en el hospedador. Entró en estudios de fase clínica I junto con el adyuvante Alhydrogel en Brasil. Sin embargo, la inyección de una única dosis produjo urticaria en varios participantes. Estas reacciones se asociaron con altos niveles de IgE anti-Na-ASP-2, observados también en poblaciones de zona endémica de infección (26).
Por otro lado, Na-APR-1 (aspartato-proteasa de N. americanus expresada en la planta del tabaco) y Na-GST-1 (glutatión-S-transferasa recombinante de N. americanus expresada en levaduras) también entraron en estudios de fase clínica I en adultos sanos en Gabón. Utilizando un régimen de tres dosis de vacunación han demostrado alta seguridad. En términos de respuesta inmune, tras la tercera dosis se observó un marcado aumento de células T CD4+ específicas productoras de IL-2 y TNFα que además se han correlacionado con los niveles de IgG específicos. Sin embargo, Na-APR-1 no fue capaz de inducir respuesta inmunitaria de células T (27).
Para el resto de los helmintos causantes de NTDs, la selección y prueba de candidatos vacunales se encuentra en fases preclínicas. Dentro de estas enfermedades, existen diferencias. Algunas, como la dracunculiasis, debido a su bajísima prevalencia, no tiene ni siquiera candidatos vacunales en fases preclínicas. Sin embargo, está a punto de conseguirse la erradicación de la enfermedad (solo 27 casos en 2020). De esta manera, sería la primera enfermedad erradicada sin el uso de una vacuna, ni la existencia de tratamiento (28). El avance en otras entidades viene impulsado por su importancia veterinaria, mucho más que por su impacto en infecciones humanas. Son por ejemplo la equinococosis (29), para la que hay abundantes estudios de vacunación en perros o la fasciolosis para la que se disponen de diversos candidatos en ovejas (30). Finalmente, cabe destacar el papel que podría tener el desarrollo de vacunas contra NTDs en la prevención de cánceres asociados a infección. Se calcula que en países en vías de desarrollo el 24,5% de los cánceres están causados por infecciones, porcentaje que se eleva al 28,5% si consideramos las zonas más pobres del continente, donde son prevalentes las NTDs (31). Infecciones crónicas con parásitos como Opistorchis viverrini o Clonorchis sinensis en el sudeste asiatico o Schistosoma haematobium en África, han demostrado su potencial carcinogénico (32). En este sentido, las vacunas de ARNm han sido utilizadas frente a ciertos tipos de cáncer, demostrando ser eficaces y seguras y de gran potencial para el futuro tratamiento de los pacientes. A raíz de la pandemia de SARS-CoV-2, las vacunas de ARNm han resultado ser una excelente herramienta para su prevención. A pesar de la complejidad etiológica de muchas de las NTDs, las vacunas de ARNm podrían ser la solución para el control de estas enfermedades.
3. VACUNAS DE ARNm
El descubrimiento del ARN mensajero (ARNm) en la década de los 60 del siglo pasado fue reconocido con el premio Nobel. Desde entonces se piensa que puede aprovecharse su potencial para tratar o prevenir muchas enfermedades, sobre todo a partir de los años 70 cuando se demostró que podía ser introducido en las células y, por tanto, ser capaz de expresar antígenos de interés vacunal. Pero fue preciso solventar una importante serie de retos de innovación (como evitar su degradación por nucleasas) hasta poder llegar a testar la primera vacuna basada en el ARNm en la década de los 90, la de la gripe. Posteriormente, se ha tratado de aplicar esta tecnología para prevenir infecciones por importantes patógenos como el virus de la rabia o el del Ébola ya en la década de los 10 del siglo XXI (33). La experiencia acumulada durante décadas, principalmente para el desarrollo de vacunas veterinarias, ha permitido en el inicio de la década de los 20 con la llegada de la pandemia de COVID-19, contar con todo lo necesario, incluido el interés político y empresarial para financiar el reto de descubrir el potencial real y práctico de una vacuna basada en el ARNm.
Dicho potencial científico -algo que ya era evidente para la comunidad científica- ha sido validado a nivel poblacional mundial en tiempo récord, gracias a la investigación y a la cooperación entre las entidades gubernamentales, las compañías farmacéuticas y los reguladores legales, que han permitido el desarrollo acelerado de la plataforma de vacunas ARNm para combatir la pandemia.
El ARNm es el enlace entre el ADN en el núcleo y la maquinaria de síntesis de proteínas en el citoplasma. Para evitar la detección por parte del sistema inmunitario innato y permitir así la traducción, el ARNm sintético puede ser optimizado en su secuencia, modificado químicamente y protegido. La naturaleza de la tecnología del ARNm permite una rápida optimización, con combinaciones y posibilidades moleculares casi ilimitadas para la expresión de proteínas complejas que son difíciles o imposibles de generar con los sistemas de expresión actuales. Las vacunas basadas en el ARNm son una modalidad emergente, ofreciendo alternativas a las vacunas vivas y de subunidades con plazos de desarrollo más rápidos y menor riesgo (34,35). Hoy en día ya se asume que el ARNm proporciona una gran plataforma para el desarrollo de vacunas y potencialmente de terapias.
3.1. Plataformas de vacunas ARNm: nanopartículas lipídicas
Dado que el ARNm es frágil y se degrada fácilmente, es necesario protegerlo hasta que es captado por las células. En este sentido, las plataformas de vacunas basadas en ARNm utilizan diversos mecanismos y materiales para su transporte protegido. La ingeniería para el desarrollo de estas nanopartículas que pueden encapsular la molécula de ARNm codificante del antígeno vacunal requiere una gran experiencia y cooperación multidisciplinar en disciplinas de bioinformática o la biología estructural funcional (y computacional). Estas plataformas son las que tienen el potencial de desarrollar nuevas vacunas frente a enfermedades olvidadas y que afectan de manera desproporcionada a los países en desarrollo (36).
Diversas plataformas basadas en estas moléculas ofrecen ahora nuevas tecnologías y enfoques para lograr vacunas de tercera generación. Fundamentalmente, se utilizan nanomateriales (tamaño <100-200 nm) lipídicos o nanopartículas lipídicas que son seguros y muy eficaces haciendo llegar el ARNm a las células del sistema inmunitario, fundamentalmente debido a su tamaño nanométrico y a sus propiedades fisicoquímicas (37). Destacan las plataformas de microemulsiones, liposomas, virosomas, nanogeles, micelas y dendrímeros (35). Estas plataformas vehiculan vacunas diseñadas genéticamente y son herramientas prometedoras en medicina humana y veterinaria (38,39), abriendo la nueva era de la “nano-vacunología”. Recientemente, han surgido sistemas de entrega capaces de proteger el ARN de las ribonucleasas, al tiempo que lo dirigen a las células inmunitarias y sirven como adyuvantes. Son uno de los temas más relevantes en el campo de la nanotecnología médico-farmacéutica.
En este sentido, las innovadoras formulaciones en nanopartículas lipídicas (LNP) están emergiendo como una solución óptima para proteger el ARNm. Las LNP también facilitan la especificidad del órgano y mejoran la entrega exitosa de la carga de ARNm que codifica las proteínas patógenas al sitio citoplasmático de acción (40). A la hora de diseñar o elegir una plataforma hay que tener en cuenta una serie de factores fundamentales, básicamente las propiedades fisicoquímicas de la NPs. Las LNP son los vectores no virales más investigados para las vacunas de ácidos nucleicos (41) y varias formulaciones basadas en lípidos, como los liposomas, las nano-emulsiones o los portadores lipídicos nanoestructurados se consideran sistemas de entrega adecuados para los ácidos nucleicos.
Los propios liposomas catiónicos actúan como inmunomoduladores estimulando la respuesta inmunitaria innata de forma independiente del antígeno (o patógeno) (42,43). Sin embargo, los lípidos catiónicos no están exentos de toxicidad. Los lípidos ionizables muestran una mejor tolerabilidad en comparación con los lípidos catiónicos, que son más propensos a causar toxicidad celular. Además, las partículas que contienen lípidos catiónicos son propensas a la agregación, lo que provoca efectos indeseables (44). Se han llevado a cabo diferentes modificaciones estructurales en los lípidos ionizables para mejorar su eficacia en la administración de ácidos nucleicos (45,46). Por lo tanto, las formulaciones lipídicas innovadoras están hechas de lípidos catiónicos ionizables combinados con lípidos estructurales estabilizadores y ácido nucleico para producir LNP cargadas con ARNm. También se sabe que la incorporación de lípidos auxiliares PEGlicados en las LNP prolonga el tiempo de circulación, debido a su efecto de barrera estérica. Esta característica reduce la unión de las LNP a las proteínas plasmáticas y disminuye la eliminación por el sistema reticuloendotelial (44,47). El control del tamaño de los PEG-lípidos unidos a las LNP puede utilizarse para dirigir su velocidad de difusión fuera de las nanopartículas y controlar el periodo de tiempo en la circulación sanguínea (48,49). Controlar el tiempo de circulación de las LNP es importante para evitar la toxicidad y aumentar la eficacia.
El almacenamiento a largo plazo es otro reto para las vacunas de ARNm. La mayoría de las vacunas comerciales y los fármacos biológicos son productos liofilizados que se almacenan a temperatura ambiente o refrigerada. La liofilización es una técnica de secado aplicada para la conservación de productos biológicos y nanopartículas farmacéuticas (50). El requisito de almacenamiento en frío de las vacunas COVID-19 basadas en ARNm sigue siendo una limitación importante. Estudios recientes han demostrado que las LNP liofilizadas que contienen ARN conservan sus propiedades biofísicas y su capacidad de expresión proteica in vivo durante 21 meses a 4ºC (40,51).
3.2. Avances en el desarrollo de vacunas ARNm frente a enfermedades tropicales olvidadas.
El desarrollo, la fabricación y el despliegue de las vacunas de ARNm han entrado ahora en una fase de rápida aceleración. La tecnología del ARNm también podría permitir acelerar el desarrollo y el acceso a las vacunas para algunas enfermedades tropicales desatendidas, con avances significativos frente a muchas de ellas (36). Para muchos candidatos vacunales, como en el caso de la rabia, la potencia de la vacuna depende de la formación de partículas. De hecho, la rabia es la única NTD que en la actualidad dispone de vacunas de ARNm en desarrollo. Principalmente basadas en una glicoproteína de la cubierta del virus que incluida en vacunas ARNm induce una respuesta inmunitaria neutralizante que protege frente a la infección por el virus en ratones y en primates no humanos. En un ensayo clínico en humanos en fase I se ha visto que administrando dosis bajas de la vacuna se reproducen las respuestas inmunitarias neutralizantes en animales cumpliendo los requerimientos de la OMS para continuar con los ensayos clínicos (52).
Frente a virus transmitidos por artrópodos como es el caso del virus del dengue transmitido por mosquitos, también se están ensayando proteínas de la membrana y proteínas estructurales de la cubierta viral codificadas por ARNm modificados en la secuencia nucleotídica para aumentar su estabilidad y nivel de expresión así como su encapsulación en LNPs. Se están consiguiendo resultados prometedores en ratones de laboratorio gracias a la protección total (respuestas neutralizantes humorales y celulares) que induce la vacuna, independientemente de posibles mutaciones en las regiones inmunodominantes serotipo específicas (53,54). Igualmente, frente al virus Chikungunya no existen vacunas ni tratamientos. Sin embargo, hay personas que desarrollan inmunidad humoral natural a través de anticuerpos monoclonales. Hoy en día se está trabajando para tratar la enfermedad con vacunas terapéuticas ARNm que codifiquen esos anticuerpos en LNPs. Los datos preliminares sugieren que puede prevenirse la enfermedad en humanos con efectos adversos aceptables, resaltando el potencial de la plataforma como herramienta terapéutica (55).
La gran mayoría de las vacunas de ARNm que se están desarrollando son para prevenir infecciones por virus, como es el caso de los Flavivirus (56). Para patógenos más complejos, el mayor reto es el diseño de antígenos que cubran mecanismos esenciales para los que se requieren herramientas innovadoras que proporcionen correlaciones de protección a partir de ensayos vacunales en animales de laboratorio (52). Aunque el potencial para desarrollar vacunas ARNm contra parásitos pluricelulares u organismos con ciclos de vida y mecanismos de evasión de la respuesta inmunológica complejos está por descubrir, se están obteniendo avances significativos en esta dirección. Se están realizando esfuerzos importantes para prevenir la malaria. Recientemente, se ha preparado una vacuna a partir de una nano-emulsión catiónica cargada con ARNm que codifica el factor inhibidor de la migración de macrófagos secretada por los parásitos de la malaria. La nano-vacuna parece mejorar el desarrollo de células T auxiliares e induce anticuerpos IgG contra el paludismo y respuestas de células T de memoria. Además, la proteína del circumesporozoito (CSP) es un antígeno inmunodominante de la superficie de la fase invasiva del parásito de la malaria y ha demostrado un potencial inmunogénico y protector en otra vacuna experimental de ARNm contra la malaria (57,58). Otros avances en la aplicación de nano-vacunas contra parásitos más complejos, como las garrapatas y los patógenos, que transmiten alientan nuevas aplicaciones frente a zoonosis parasitarias (34).
3.3. Oportunidades para el desarrollo de vacunas ARNm frente a patógenos complejos: nano-vacunología computacional
Las vacunas de ARNm también tienen gran potencial para prevenir enfermedades infecciosas y parasitarias complejas para las que no se disponen de vacunas efectivas. Las vacunas basadas en epítopos sintéticos tienen un importante potencial inmuno-profiláctico contra Fasciola hepatica en modelos experimentales, pero también han mostrado efectos inmunológicos significativos contra Leishmania spp. (59,60). Dado que un epítopo antigénico es una unidad básica que provoca una respuesta inmunitaria celular o humoral, las vacunas multiepitópicas (MEV) compuestas por una serie de péptidos son un enfoque ideal para la prevención y el tratamiento de muchas infecciones, incluidas las enfermedades parasitarias (61–63). Aunque el diseño de MEV eficaces sigue siendo un reto, especialmente el incluir epítopos que puedan inducir células T y B y producir respuestas eficaces, es un objetivo prioritario. En primer lugar, depende de la selección de antígenos candidatos apropiados y de sus epítopos inmunodominantes, que pueden predecirse mediante métodos inmunoinformáticos modernos. Se trata de una estrategia novedosa contra las enfermedades infecciosas que puede proporcionar un nivel de inmunización seguro y una reducción de los costes de producción de la vacuna (64). Posteriormente, una estimulación completa del sistema inmunitario puede lograrse combinando la secuencia de codificación de los péptidos con epítopos universales T helper que ayuda en las respuestas inmunitarias inducidas por péptidos largos. Además, la interesante posibilidad de incluir otros adyuvantes para mejorar así la eficacia de las vacunas peptídicas (65).
Gracias a los avances bioinformáticos, cada vez es más fácil consultar la información genómica y proteómica de todo tipo de organismos patógenos (66). La construcción de conjuntos específicos de péptidos de patógenos podría representar plataformas útiles para desarrollar vacunas seguras y eficaces. Y para ello resultan imprescindibles las herramientas bioinformáticas que permiten predecir la unión de los péptidos al HLA-II, entrando así en el campo de la vacunología computacional para el diseño de vacunas (67). En el campo de la inmunología esto ha llevado al desarrollo de lo que se conoce como inmunoinformática, un enfoque multidisciplinar que pretende hacer uso de herramientas computacionales, matemáticas y bioinformáticas para comprender mejor el sistema inmunitario en su conjunto y predecir automáticamente soluciones profilácticas para combatir enfermedades, como las vacunas (67,68).
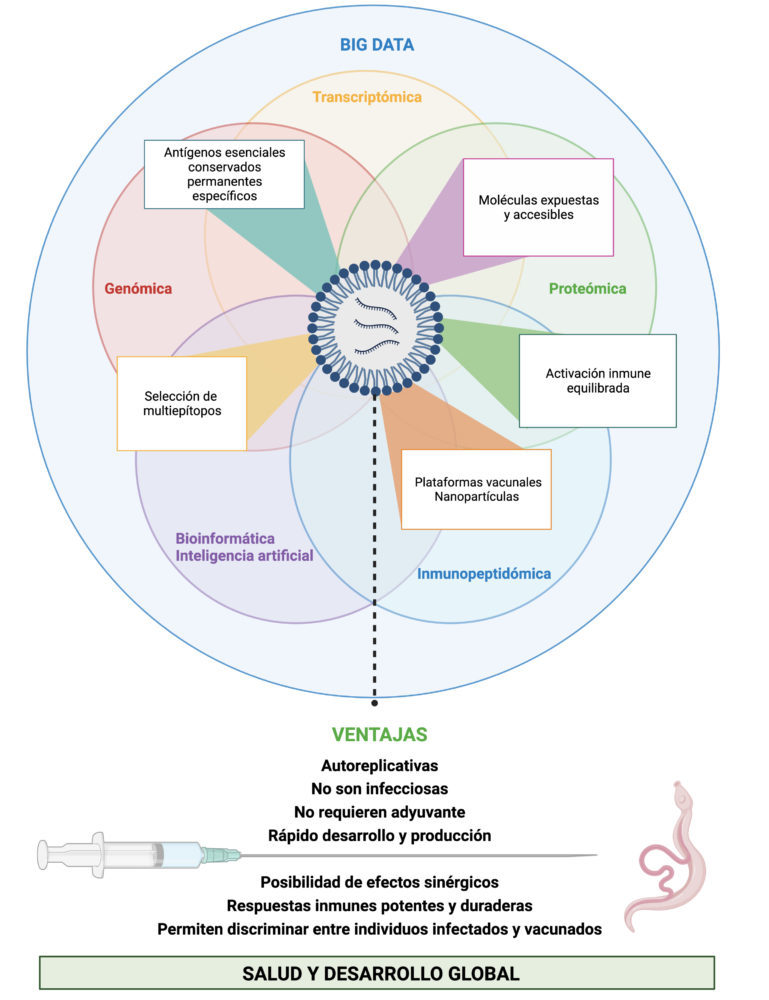
La inteligencia artificial está desempeñando un papel importante en la inmunoinformática al permitir la identificación de secuencias antigénicas de forma automática y optimizada gracias a la enorme cantidad de datos disponibles (69). La vacunología inversa, mediante algoritmos predictivos de “machine learning” permite identificar epítopos o secuencias antigénicas a partir del proteoma de un organismo, sin necesidad de comprobar previamente su antigenicidad de forma experimental (70). El desarrollo de vacunas inteligentes aplicando algoritmos predictivos e inteligencia artificial al conjunto de datos-ómicos es también una realidad hoy en día evitando las ineficiencias y los fracasos del proceso clásico de desarrollo de vacunas reduciendo el tiempo de comercialización de las mismas (Fig. 2) (68,71).
Figura 2. Impacto global de la integración de las vacunas ARNm con la inmunoinformática para el diseño de vacunas inteligentes asequibles. El potencial de las plataformas de vacunas ARNm junto con las ventajas de integrarlas con herramientas predictivas para el desarrollo de vacunas frente a microorganismos complejos puede permitir desarrollar vacunas realmente efectivas y favorecer la implantación de nuevas instalaciones de producción en países con bajos recursos. Creada con Biorender.com
En el caso de los parásitos, debido a su gran complejidad biológica, sería muy deseable integrar el mayor número posible de antígenos de forma que se puedan desarrollar vacunas multiestadío y multiespecie. Lo cual puede llegar a ser posible mediante la selección e inclusión de epítopos esenciales, conservados y expuestos en sistemas de nanopartículas lipídicas que induzcan respuestas inmunes equilibradas y duraderas (72). Siguiendo esta estrategia asistida por ordenador, se ha identificado un conjunto de epítopos contra la infección por Trypanosoma cruzi (73). También se están tratando de aplicar aproximaciones computacionales similares “in silico” para diseñar proteínas de fusión que puedan ser codificadas por secuencias de ARNm que se auto-amplifiquen una vez administradas en vectores virales para prevenir la leishmaniosis (63). La combinación de la inteligencia artificial con las técnicas de las vacunas basadas en epítopos es un paso adelante para construir moléculas de ARNm con una mayor probabilidad de éxito. Permitiendo incluso desarrollar en un futuro vacunas frente a organismos complejos como los helmintos, parásitos que contribuyen de forma mayoritaria a los daños causados por las NTDs (40% del total) y para los que pueden suponer la única opción, a día de hoy, de reproducir y contrarrestar sus propiedades únicas de biomimetismo modulador inmunológico (38,74).
4. CONCLUSIONES Y PERSPECTIVAS FUTURAS
El desarrollo de vacunas seguras y eficaces para proteger las enfermedades infecciosas y especialmente las enfermedades desatendidas del mundo en desarrollo es de vital importancia en salud pública. De hecho, la Organización Mundial de la Salud (OMS) y la Coalición para la Preparación ante las Epidemias (CEPI, del inglés) han hecho un llamamiento a la acción para desarrollar vacunas contra patógenos que suponen una amenaza crítica para la salud pública. Junto con las enfermedades tropicales desatendidas, las enfermedades infecciosas emergentes y reemergentes también amenazan la salud pública mundial ya que pueden dar lugar a pandemias de forma imprevisible. En este sentido, la velocidad, la escalabilidad y la flexibilidad que ofrece la plataforma de vacunas ARNm son adecuadas para una respuesta rápida a los desafíos venideros. Hasta hace dos años, las vacunas de ARNm nunca habían sido aprobadas. Ahora, los avances científicos ofrecen esperanzas para el control de las enfermedades infecciosas. Se está por tanto abriendo un mundo de posibilidades a medida que los desarrollos de la investigación exploran nuevas aplicaciones e innovaciones con la tecnología del ARNm.
La industria farmacéutica estudia a fondo el mercado de los productos antes de generarlos. Si el mercado no es prometedor en términos financieros, se desestima. Si añadimos las dificultades para desarrollar vacunas contra NTDs, principalmente parasitarias, la probabilidad de poder desarrollar vacunas reales frente a estas entidades es escasa. A modo de ejemplo, el desarrollo de una vacuna contra la esquistosomosis utilizando tecnología de ARNm sería por tanto un reto en el horizonte cercano, integrando los sistemas de salud humana, animal y su entorno compartido, así como su contexto social y económico. Es decir, aplicar estrategias multidisciplinares denominadas “One Health” que incluyan los organismos de decisión y financiación. El Horizonte 2030 tiene como objetivo estratégico disminuir el impacto negativo de las NTDs en los países en vías de desarrollo, pero también minimizar el riesgo que conllevan los nuevos desafíos de la globalización y el nuevo paradigma de la pobreza.
Las plataformas de nanotecnologías permitirían integrar diferentes dianas moleculares vacunales, basadas en multiepítopos seleccionados con estrategias inteligentes de nano-vacunología, permitiendo el desarrollo de herramientas profilácticas que eviten las reinfecciones y que tengan gran impacto en la salud mundial, como por ejemplo las vacunas ARNm intravaginales en desarrollo contra el herpes genital o los avances contra la gripe estacional o el virus de Epstein-Barr.
5. REFERENCIAS
1. Tosam MJ, Ambe JR, Chi PC. Global Emerging Pathogens, Poverty and Vulnerability: An Ethical Analysis. In: Socio-cultural Dimensions of Emerging Infectious Diseases in Africa. 2019.
2. UNDP. Human Development Report 2021/2022. 2022.
3. Abbafati C, Abbas KM, Abbasi-Kangevari M, Abd-Allah F, Abdelalim A, Abdollahi M, et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020;396(10258):1204–22.
4. Hotez PJ, Alvarado M, Basáñez MG, Bolliger I, Bourne R, Boussinesq M, et al. The Global Burden of Disease Study 2010: Interpretation and Implications for the Neglected Tropical Diseases. PLoS Negl Trop Dis. 2014;8(7).
5. Molyneux DH, Hotez PJ, Fenwick A. “ Rapid-Impact Interventions ”: How a Policy of Integrated Control for Africa ’ s Neglected Tropical Diseases Could Benefi t the Poor. PLoS Med. 2005;2(11):1064–70.
6. World Health Organization. Neglected tropical diseases [Internet]. [cited 2022 Oct 20]. Available from: https://www.who.int/neglected_diseases/diseases/en/
7. Hotezhttps PJ, Hotez FPJ. The global fight to develop antipoverty vaccines in the anti-vaccine era. Hum Vaccin Immunother. 2018;0(0):1–4.
8. Colebunders R, Basáñez M, Siling K, Post RJ, Rotsaert A, Mmbando B, et al. From river blindness control to elimination : bridge over troubled water. 2018;1–15.
9. Laurens MB, Laurens MB. RTS , S / AS01 vaccine ( Mosquirix TM ): an overview. Hum Vaccin Immunother. 2020;16(3):480–9.
10. Mahmoudi S, Keshavarz H. Efficacy of phase 3 trial of RTS , S / AS01 malaria vaccine : The need for an alternative development plan. 2017;5515.
11. Liu C, Cahill JD. Epidemiology of Rabies and Current US Vaccine Guidelines. 2020;(August):51–3.
12. Pinheiro-michelsen JR, Oliveira S. Anti-dengue Vaccines : From Development to Clinical Trials. 2020;11(June):1–18.
13. Vuitika L, Prates-syed WA, Dinis J, Silva Q, Crema KP, Nelson C, et al. Vaccines against Emerging and Neglected Infectious Diseases : An Overview. Vaccines. 2022;10(1385):1–11.
14. Bottazzi ME, Hotez PJ. “ Running the Gauntlet ” : Formidable challenges in advancing neglected tropical diseases vaccines from development through licensure , and a “ Call to Action .” 2019;15(10):2235–42.
15. Article R. Leishmania Vaccines Entered in Clinical Trials : A Review of Literature. 2019;
16. Büscher P, Cecchi G, Jamonneau V, Priotto G. Human African Trypanosomiasis. Lancet. 2017;390:2397–409.
17. Dumonteil E. The Case for the Development of a Chagas Disease Vaccine : Why ? How ? When ? 2021;
18. Zawawi A, Else KJ, Else KJ. Soil-Transmitted Helminth Vaccines : Are We Getting Closer ? 2020;11(September):1–18.
19. Molehin AJ. Schistosomiasis vaccine development : update on human clinical trials. 2020;1–7.
20. Boulanger D, Warter A, Sellin B, Linder V, Pierce R, Chippaux J, et al. Vaccine potential of a recombinant glutathione S-transferase cloned from Schistosoma haematobium in primates experimentally infected with an homologous challenge. Vaccine. 199AD;28(17):319–26.
21. Riveau G, Schacht A, Dompnier J, Deplanque D, Seck M, Waucquier N, et al. Safety and efficacy of the rSh28GST urinary schistosomiasis vaccine : A phase 3 randomized , controlled trial in Senegalese children. 2018;1–22.
22. Tendler M, Simpson AJG. Acta Tropica The biotechnology-value chain : Development of Sm14 as a schistosomiasis vaccine. 2008;108:263–6.
23. Tran MH, Pearson MS, Bethony JM, Smyth DJ, Jones MK, Duke M, et al. Tetraspanins on the surface of Schistosoma mansoni are protective antigens against schistosomiasis. 2006;12(7):835–40.
24. Zhang W, Molehin AJ, Rojo JU, Sudduth J, Pramodh K, Kim E, et al. Sm-p80-based schistosomiasis vaccine: double-blind pre- clinical trial in baboons demonstrates comprehensive prophylactic and parasite transmission blocking efficacy. Ann N Y Acad Sci. 2019;1425(1):38–51.
25. Jourdan PM, Lamberton PHL, Fenwick A, Addiss DG. Soil-transmitted helminth infections. Lancet. 2018;391(10117):252–65.
26. Diemert DJ, Frcp C, Pinto AG, Freire J, Jariwala A, Tribolet L, et al. Generalized urticaria induced by the Na -ASP-2 hookworm vaccine : Implications for the development of vaccines against helminths. J Allergy Clin Immunol. 130(1):169-176.e6.
27. Id YDM, Betouke ME, Id O, Id FS, Id KAS, Labuda LA, et al. Characterization of T cell responses to co- administered hookworm vaccine candidates Na-GST-1 and Na-APR-1 in healthy adults in Gabon. PLoS Negl Trop Dis. 2021;15(10):1–16.
28. Hopkins DR, Weiss AJ, Roy SL, Yerian S, Cama VA. Progress Toward Global Eradication of Dracunculiasis , January 2020 – June 2021. Centers Dis Control Prev MMWR. 2021;70(44).
29. Wen H, Vuitton L, Tuxun T, Li J, Vuitton DA, Zhang W, et al. Echinococcosis: Advances in the 21st century. Clin Microbiol Rev. 2019;32(2):1–39.
30. Zhang J, Sun Y, Zheng J. Prospects for liver fluke vaccines. Exp Parasitol. 2021;230:108170.
31. Parkin DM, Hämmerl L, Ferlay J, Kantelhardt EJ. Cancer in Africa 2018 : The role of infections. Int J Cancer. 2020;2103(May 2019):2089–103.
32. Plummer M, Martel C De, Vignat J, Ferlay J, Bray F, Franceschi S. Global burden of cancers attributable to infections in 2012 : a synthetic analysis. Lancet Glob Heal. 2015;4(9):e609–16.
33. Dolgin E. The tangled history of mRNA vaccines. Nature. 2021;597:318–25.
34. Jackson NAC, Kester KE. The promise of mRNA vaccines : a biotech and industrial perspective. npj Vaccines. 2020;3–8.
35. John S, Yuzhakov O, Woods A, Deterling J, Hassett K, Shaw CA, et al. Multi-antigenic human cytomegalovirus mRNA vaccines that elicit potent humoral and cell-mediated immunity. Vaccine. 2018;36(12):1689–99.
36. Sparrow E, Hasso-agopsowicz M, Kaslow DC, Singh K, Rao R, Chibi M, et al. Leveraging mRNA Platform Technology to Accelerate Development of Vaccines for Some Emerging and Neglected Tropical Diseases Through Local Vaccine Production. 2022;3(July).
37. Das A, Ali N. Nanovaccine: an emerging strategy. Expert Rev Vaccines. 2021;20(10):1273–90.
38. Aida V, Pliasas VC, Neasham PJ, North JF, Mcwhorter KL, Glover SR, et al. Novel Vaccine Technologies in Veterinary Medicine : A Herald to Human Medicine Vaccines. Front Vet Sci. 2021;8(April):1–20.
39. Feng C, Li Y, Emiliano B, Chen E, Tao W. Emerging vaccine nanotechnology : From defense against infection to sniping cancer. Acta Pharm Sin B. 2022;12(5):2206–23.
40. Tsakiri M, Naziris N, Demetzos C. Innovative vaccine platforms against infectious diseases : Under the scope of the COVID-19 pandemic. Int J Pharm. 2021;610(August):121212.
41. Aldosari BN, Alfagih IM, Almurshedi AS. Lipid Nanoparticles as Delivery Systems for RNA-Based Vaccines. Pharmaceutics. 2021;13(206):1–26.
42. Christensen D, Korsholm K, Rosenkrands I, Linderstrøm T, Andersen P, Agger E. Cationic liposomes as vaccine adjuvants. Expert Rev Vaccines. 2007;6:785–96.
43. Lonez C, Vandenbranden M, Ruysschaert J. Cationic lipids activate intracellular signaling pathways ☆. Adv Drug Deliv Rev. 2012;64(15):1749–58.
44. Samaridou E, Heyes J, Lutwyche P. Lipid nanoparticles for nucleic acid delivery : Current perspectives. Adv Drug Deliv Rev. 2020;154–155:37–63.
45. Heyes J, Palmer L, Bremner K, Maclachlan I. Cationic lipid saturation influences intracellular delivery of encapsulated nucleic acids. J Control Release. 2005;107:276–87.
46. Semple SC, Akinc A, Chen J, Sandhu AP, Mui BL, Cho CK, et al. Rational design of cationic lipids for siRNA delivery. Nat Biotechnol. 2010;28(2).
47. Hajj KA, Whitehead KA. Tools for translation: non-viral materials for therapeutic mRNA delivery. Nat Publ Gr. 2017;2:1–17.
48. Webb MS, Saxon D, Wong FMP, Lim HJ, Y LDM. Comparison of different hydrophobic anchors conjugated to poly ( ethylene glycol ): effects on the pharmacokinetics of liposomal vincristine. Biochim Biophys Acta. 1998;1372:272–82.
49. Morrissey D V, Lockridge JA, Shaw L, Blanchard K, Jensen K, Breen W, et al. Potent and persistent in vivo anti-HBV activity of chemically modified siRNAs. Nat Biotechnol. 2005;23(8):1002–7.
50. Luo W, Reilly O, Kim R, Zhang W, Patel SM, Bogner RH, et al. European Journal of Pharmaceutics and Biopharmaceutics Impact of formulation on the quality and stability of freeze-dried nanoparticles. Eur J Pharm Biopharm. 2021;169(July):256–67.
51. Uddin MN, Roni MA. Challenges of Storage and Stability of mRNA-Based COVID-19 Vaccines. Vaccines. 2021;9(1033):1–9.
52. Aldrich C, Leroux I, Bidet K, Alexandru M, Loeliger E, Schoenborn-kellenberger O, et al. Proof-of-concept of a low-dose unmodified mRNA-based rabies vaccine formulated with lipid nanoparticles in human volunteers : A phase 1 trial. Vaccine. 2021;39(8):1310–8.
53. Pinto AK, Brien JD, Richner JM. A Dengue Virus Serotype 1 mRNA-LNP Vaccine Elicits Protective Immune Responses. J Virol. 2021;95(12):e02482-20.
54. Zhang M, Sun J, Li M, Jin X. Modified mRNA-LNP Vaccines Confer Protection against Experimental DENV-2 Infection in Mice. Mol Ther Methods Clin Dev. 2020;18(September):702–12.
55. August A, Attarwala HZ, Himansu S, Kalidindi S, Lu S, Pajon R, et al. A phase 1 trial of lipid-encapsulated mRNA encoding a monoclonal antibody with neutralizing activity against Chikungunya virus. Nat Med. 2021;27:2224–33.
56. Wollner CJ, Richner JM. mRNA Vaccines against Flaviviruses. Vaccines. 2021;9(148):1–13.
57. Garcia AB, Siu E, Sun T, Exler V, Brito L, Hekele A, et al. Neutralization of the Plasmodium-encoded MIF ortholog confers protective immunity against malaria infection. Nat Commun. 2018;9(2714):1–13.
58. Mallory KL, Taylor JA, Zou X, Waghela IN, Schneider CG, Sibilo MQ, et al. Messenger RNA expressing PfCSP induces functional , protective immune responses against malaria in mice. npj Vaccines. 2021;84:1–12.
59. Vicente B, López-Abán J, Rojas-Caraballo J, Del Olmo E, Fernández-Soto P, Muro A. Protection against Schistosoma mansoni infection using a Fasciola hepatica-derived fatty acid binding protein from different delivery systems. Parasites and Vectors. 2016;9(1):1–13.
60. Zhang J, He J, Liao X, Xiao Y, Liang C, Zhou Q, et al. Immunobiology Development of dominant epitope-based vaccines encoding Gp63 , Kmp-11 and Amastin against visceral leishmaniasis. Immunobiology. 2021;226(3):152085.
61. Arya A, Arora SK. A T-cell epitope-based multi-epitope vaccine designed using human HLA specific T cell epitopes induces a near-sterile immunity against experimental visceral leishmaniasis in hamsters. Vaccines. 2021;9(10).
62. Sanches RCO, Tiwari S, Ferreira LCG, Oliveira FM, Lopes MD, Passos MJF, et al. Immunoinformatics Design of Multi-Epitope Peptide-Based Vaccine Against Schistosoma mansoni Using Transmembrane Proteins as a Target. Front Immunol. 2021;12(March):1–16.
63. Savar NS, Shengjuler D, Doroudian F, Vallet T, Mac Kain A, Arashkia A, et al. An alphavirus-derived self-amplifying mRNA encoding PpSP15-LmSTI1 fusion protein for the design of a vaccine against leishmaniasis. Parasitol Int. 2022;89(28):102577.
64. Goumari M, Farhani I, Nezafat N, Mahmoodi S. Multi-Epitope Vaccines (MEVs), as a Novel Strategy Against Infectious Diseases. Curr Proteomics. 2020;17(5):354–64.
65. Ghaffari-Nazari H, Tavakkol-Afshari J, Jaafari MR, Tahaghoghi-Hajghorbani S, Masoumi E, Jalali SA. Improving multi-epitope long peptide vaccine potency by using a strategy that enhances CD4+ T Help in BALB/c mice. PLoS One. 2015;10(11):1–12.
66. Adamczyk-Poplawska M, Markowicz S, Jagusztyn-Krynicka EK. Proteomics for development of vaccine. J Proteomics. 2011;74(12):2596–616.
67. De Groot AS, Moise L, Terry F, Gutierrez AH, Hindocha P, Richard G, et al. Better epitope discovery, precision immune engineering, and accelerated vaccine design using Immunoinformatics tools. Front Immunol. 2020;11(April):1–13.
68. Russo G, Reche P, Pennisi M, Pappalardo F. The combination of artificial intelligence and systems biology for intelligent vaccine design. Expert Opin Drug Discov. 2020;15(11):1267–81.
69. Mohanty E, Mohanty A. Role of artificial intelligence in peptide vaccine design against RNA viruses. Informatics Med Unlocked. 2021;26(January):100768.
70. Ong E, Wang H, Wong MU, Seetharaman M, Valdez N, He Y. Vaxign-ML: Supervised machine learning reverse vaccinology model for improved prediction of bacterial protective antigens. Bioinformatics. 2020;36(10):3185–91.
71. Yang Z, Bogdan P, Nazarian S. An in silico deep learning approach to multi-epitope vaccine design: a SARS-CoV-2 case study. Sci Rep. 2021;11(1):1–21.
72. Joon S, Singla RK, Shen B. Vaccines and Immunoinformatics for Vaccine Design. Adv Exp Med Biol. 2022;1368:95–110.
73. Michel-Todó L, Reche PA, Bigey P, Pinazo MJ, Gascón J, Alonso-Padilla J. In silico Design of an Epitope-Based Vaccine Ensemble for Chagas Disease. Front Immunol. 2019;10(November):1–16.
74. Anderson RM. An urgent need: vaccines for neglected tropical diseases. Lancet Infect Dis. 2021;21(12):1621–3.