1. INTRODUCICIÓN
La respuesta inflamatoria es uno de los principales mecanismos efectores del sistema inmune innato frente a situaciones de peligro del organismo como las infecciones microbianas o el daño tisular. La respuesta inmune innata constituye la primera línea de defensa y se desencadena tras el reconocimiento de patrones moleculares asociados a patógenos (PAMPs) y de patrones moleculares asociados a daño (DAMPs), que conducen al reclutamiento de células inflamatorias y a la liberación de mediadores proinflamatorios. Los PAMPs se encuentran en microorganismos como el lipopolisacárido (LPS) de las membranas de bacterias Gram-negativas, ácidos nucleicos bacterianos o virales, péptidos bacterianos como flagelina, y polisacáridos como los b-glucanos.
Los DAMPs son moléculas endógenas liberadas en situaciones de estrés o daño, como las proteínas asociadas a la cromatina, proteínas de choque térmico, cristales de uratos, adenosina trifosfato extracelular (ATP), especies reactivas de oxígeno (ROS) y fragmentos de la matriz extracelular (1).
Los receptores de reconocimiento de patógenos (PRRs), localizados en la membrana celular o en el espacio intracelular, son responsables del reconocimiento de estímulos proinflamatorios. Se han identificado distintas familias de PRRs, entre ellas las que reconocen patógenos, que incluyen los receptores tipo Toll (TLRs), receptores tipo NOD (proteínas con dominio de oligomerización y unión a nucleótidos, NLRs), receptores RIG-1 (proteína inducible por ácido retinoico), receptores tipo lectina C (CLRs), receptores tipo AIM2 (o ausentes en melanoma, ALRs) y pirina, entre otros (2, 3). La unión de los PAMPs y DAMPs a los PRRs conduce a la activación de múltiples vías de señalización que promueven la expresión de varías citoquinas, como es la vía del factor de transcripción nuclear NF-kB, factores reguladores del interferón (IRF) o la formación del inflamasoma (2).
Entre los PPRs, los receptores NLRs y ALRs pueden formar complejos multiproteicos denominados inflamasomas, con un papel destacado en la respuesta inmune innata, iniciando una respuesta de defensa frente a patógenos y células dañadas. La desregulación de esta respuesta puede originar una inflamación crónica que contribuye al desarrollo de diversas patologías. Estudios recientes sugieren que la familia NLR y los complejos del inflamasoma están implicados en el desarrollo y progresión de varias enfermedades inflamatorias, por lo que constituyen una nueva diana terapéutica de gran interés en la búsqueda de nuevos tratamientos (3, 4).
2. INFLAMASOMA Y MECANISMOS DE ACTIVACIÓN
El concepto de inflamasoma, (complejo proteico con un peso molecular aparente > 700 kDa) fue propuesto inicialmente por Tschopp en 2002 (5). En las últimas dos décadas, se ha avanzado en el conocimiento de los distintos tipos de inflamasomas, definiendo sus componentes, así como los mecanismos moleculares responsables de su activación y regulación (6).
Los inflamasomas contienen en su estructura tres componentes esenciales para su activación:
- Una proteína sensora: (un NLR, como NLRP1, NLRP3 y NLRC4 o un ALR como AIM2), capaz de reconocer tanto PAMPs como DAMPs.
- Una proteína adaptadora denominada proteína asociada a la apoptosis (Apoptotic-Associated Speck-like Protein, ASC) que actúa como puente de unión entre NLRs/AIM2, y
- Una molécula efectora, la pro-caspasa-1 que actúa como precursora de caspasa-1.
En función de la proteína sensora que estimula su ensamblaje, se pueden clasificar en inflamasomas que contienen dominios de oligomerización unidos a nucleótidos (NOD-NATCH) y dominios ricos en leucina (NLRs), y en inflamasomas que carecen de estos dominios (no-NLRs) (7).
En concreto, los receptores tipo NOD (NLRs) son una familia de receptores intracelulares que se clasifican en base a su homología estructural compartida de 3 dominios funcionales: un dominio amino terminal que contiene los dominios de reclutamiento de caspasa”C” (CARD) o de pirina (PYD); un dominio central NATCH responsable de la oligomerización, presente en todas las proteínas NLR, y un dominio carboxi terminal rico en repeticiones de leucina (LRR) que se une al ligando (8). Los inflamasomas más conocidos dentro de esta familia reciben los nombres de NLRP1, NLRP2, NLRP3, NLRP6, NLRP12 y NLRC4.
Algunos miembros de esta familia de receptores como NLRP1, NLRP3 y NLRC4 intervienen en la formación de los inflamasomas denominados canónicos al activar directamente caspasa-1 (9).
Adicionalmente, los No-NLRs incluyen los inflamasomas AIM2 y Pirina. AIM2 es un receptor ALR capaz de reconocer ADN patógeno citosólico y nuclear. Los miembros de esta familia incluyen AIM2 y la proteína 16 inducible de interferón gamma (IFi16) que actúan como sensores de ADN activando el inflamasoma. Contienen un dominio N-terminal de pirina (PYD) y otro dominio formado por una proteína nuclear inducible por interferón con unión C-terminal al DNA con un dominio de repeticiones de 200 aminoácidos (HIN200).
La activación de NLR/AIM2 por PAMPs and DAMPs inicia el reclutamiento de la proteína adaptadora ASC al complejo por interacción con el dominio pirina, formando una estructura supramolecular denominada piroptosoma. La proteína ASC desempeña un papel crítico en el ensamblaje del inflamasoma, ya que para su formación completa, requiere la unión de la pro-caspasa-1 a la proteína ASC a través de la interacción de los dominios CARD-CARD (10). La formación del inflamasoma resulta en la activación autocatalítica de la pro-caspasa-1 para formar enzimáticamente la caspasa-1, que procesa y activa la maduración de las formas precursoras pro-IL-1b, pro-IL-18 a las formas bioactivas IL-1b y IL-18. Estas citoquinas proinflamatorias promueven la activación de NF-kB a través de los receptores transmembrana IL-1R e IL-18r induciendo la inflamación (11). La mayoría de los inflamasomas utilizan ASC para iniciar su ensamblaje, pero en algunos casos particulares, la pro-caspasa-1 puede ser reclutada directamente interaccionando con los NLRs a través del dominio CARD (5).
Además, un sustrato directo y esencial de caspasa-1 es la proteína gasdermina D (GSDMD). La caspasa-1 hidroliza el fragmento N-terminal de gasdermina (GSDMD-NT) formando poros en la membrana plasmática, y originando un tipo de muerte celular necrótica programada denominada piroptosis. La piroptosis incluye también la liberación de contenido intracelular, como los oligómeros del inflamasoma y el ADN mitocondrial, factores que contribuyen a la respuesta inflamatoria (12).
Por todo ello, los inflamasomas desempeñan un papel destacado en la patogénesis y progresión de numerosas enfermedades inflamatorias, constituyendo en la actualidad una diana prometedora para el desarrollo de nuevas terapias (4, 9, 13). Los inflamasomas más estudiados han sido:
- NLRP1, primer inflamasoma identificado, actúa como sensor de la toxina letal del Bacillus anthracis, responsable del proceso infeccioso conocido como carbunco o ántrax, o de la infección por Toxoplasma gondii. Se trata del único inflamasoma cuya proteína receptora contiene dos dominios de muerte: un dominio PYD N-terminal y un dominio CARD C-terminal. Debido a ello, se ha descrito la activación de caspasa-1 en ausencia de ASC por interacción directa entre los dominios CARD de NLRP1 y la procaspasa-18 (14).
- NLPR3 es el inflamasoma mejor caracterizado hasta el momento. A diferencia de otros, es el único inflamasoma que se activa por estímulos de diversa naturaleza, habiéndose descrito su implicación en numerosas enfermedades inflamatorias y autoinmunes. La importancia de NLRP3 como regulador de la homeostasis inmune ha quedado evidenciada por el hecho de que mutaciones en el gen NLRP3 causan enfermedades autoinmunes como el síndrome de Muckle-Wells y el síndrome autoinflamatorio familiar inducido por el frío (FCAS) (15).
- NLRC4 es un importante sensor para la formación del inflamasoma tras el reconocimiento de proteínas bacterianas, como flagelina o proteínas del sistema de secreción tipo III (T3SS). Entre los NLRs, NLRC4 presenta características especiales al requerir sensores adicionales, como la familia NLR de proteínas inhibidoras de apoptosis (NAIPs), que actúan como receptores citosólicos para flagelina y T3SS. Tras la unión al ligando, las NAIPs reclutan y co-oligomerizan con NLRC4, activando la caspasa-1 (16).
- AIM2, inflamasoma no-NLR, es un sensor del ADN de virus y bacterias patógenas, incluyendo citomegalovirus, Francisella tularensis y virus vaccinia. A diferencia del inflamasoma NLRC4, AIM2 no contiene dominios CARD, necesitando reclutar a ASC para su activación (17). AIM2 es un receptor citosólico perteneciente a la familia de proteínas PYHIN que contienen un dominio Pirina N-terminal (PYH) y un dominio C-terminal HIN200 que se une directamente al ADN del patógeno. Una vez sucede la oligomerización del receptor con la proteína adaptadora ASC, se produce la activación de la caspasa-1 (18).
- Pirina es un inflamasoma capaz de detectar las modificaciones covalentes de la familia de proteínas Rho inducidas por toxinas bacterianas, aunque no es un sensor directo de PAMPs. Contiene un dominio PYD N-terminal que interacciona con ASC induciendo la activación posterior de caspasa-1 con producción de IL-1β e IL-18 (19).
3. VÍAS DE ACTIVACIÓN DEL INFLAMASOMA NLRP3
La activación del inflamasoma NLRP3 ha sido descrita en varios tipos celulares como neutrófilos, macrófagos, microglia, linfocitos, células epiteliales, osteoblastos, neuronas y células dendríticas, de ahí su relación con enfermedades inflamatorias en distintos órganos como piel, cerebro, corazón e hígado (9, 20, 21).
A semejanza de otros inflamasomas, el complejo inflamasoma NLRP3 está formado por un sensor (proteína NLRP3), un adaptador (proteína ASC) y un efector (caspasa-1) (22). El inflamasoma NLRP3 humano comprende dominios PYD, NACHT y LRR. El dominio NACTH es fundamental para la asociación de NLRP3 determinando su función. Una vez activado, NLRP3 se une directamente a la proteína Ser/Thr quinasa NEK7, un co-activador de NLRP3 recientemente identificado, sufriendo una transición conformacional hidrolizando el ATP a ADP (23, 24). La hidrólisis del ATP estimula el ensamblaje y reclutamiento de la proteína adaptadora ASC y de pro-caspasa-1, con escisión posterior de caspasa-1 y activación de NLRP3.
El inflamasoma NLRP3 puede ser activado por un amplio espectro de estímulos, desde ATP extracelular y toxinas bacterianas formadoras de poros a micropartículas. Se han descrito tres vías principales que regulan su actuación interfiriendo con su ensamblaje, denominadas vía canónica, no canónica y, más recientemente, la vía alternativa.
En la vía canónica, la activación del inflamasoma NLRP3 se considera un proceso dirigido por dos señales, una señal “priming” preestimuladora a través de los receptores TLRs que regula la expresión de los componentes del inflamasoma, y una señal de activación. La primera señal estimula la expresión de pro-IL-1β y de NLRP3 a nivel transcripcional, principalmente a través de la regulación de la vía de señalización de TLRs-NF-κB. La primera señal o “priming” también controla las modificaciones post-transcripcionales de NLRP3 como ubiquitinación y fosforilación, que ejercen un papel regulador en la activación de NLRP3 (25).
La segunda señal es específica del inflamasoma, depende del flujo de ión K+, e inicia la formación y activación del complejo del inflamasoma. A diferencia de la mayoría de PRRs, NLRP3 puede ser activado por estímulos asociados tanto con PAMPs como DAMPs, entre los que se incluyen ATP extracelular, toxinas bacterianas formadoras de poros (nigericina), virus, hongos, protozoos, ROS producidos por disfunción mitocondrial, así como micropartículas como los cristales de monourato sódico (MSU), asbestos o silica, lo que determina que NLRP3 sea el inflamasoma más versátil (25, 26).
Además, se ha descrito la vía no canónica dirigida por la caspasa-11. La activación de esta vía mediada por LPS citosólico también conduce al ensamblaje del inflamasoma NLRP3 (27). El reconocimiento de caspasa-11 por el LPS intracelular, junto a la acción de proteínas de unión a interferón (Proteínas de unión a guanilato, GBPs) produce la polimerización de caspasa-11 y su activación autocatalítica. A diferencia de caspasa-1, la caspasa-11 activada no puede escindir pro-IL-1β y pro-IL-18, pero sí GSDMD para generar GSDMD-NT, con capacidad para formar poros en la membrana plasmática y, por tanto, mediando la salida de K+. Esta es la teoría aceptada en la actualidad para explicar la activación de NLRP3 por la vía no canónica.
Así mismo, se ha descrito una tercera vía denominada activación alternativa del inflamasoma NLRP3 que es independiente de la salida de K+, pero que se induce a través de la vía TLR4-RIPK1-FADD-caspasa 8 por estimulación con LPS en ciertas condiciones. FADD-caspasa-8 representa una vía extrínseca de apoptosis. Además, la activación de NLRP3 por la vía alternativa no causa muerte celular por piroptosis (28). La vía de señalización FADD-caspasa 8 facilita la activación del inflamasoma NLRP3 por aumento de la expresión de NRLP3 y de pro-IL-1β a nivel transcripcional a través de la activación de la vía de NF-κB. De forma simultánea, FADD-caspasa 8 promueve la activación de pro-caspasa-1 directamente a través de su unión al inflamasoma NLRP3-ASC.
4. EL INFLAMASOMA NLRP3 EN ENFERMEDADES INFLAMATORIAS
Numerosos estudios han evaluado el papel que desempeña el inflamasoma en la inmunidad y como factor patológico en enfermedades crónicas (3, 9). La activación del inflamasoma NLRP3 desencadena procesos inflamatorios, que regulan la respuesta inmune. Sin embargo, una activación persistente y excesiva del inflamasoma NLRP3 está íntimamente ligada a la patogénesis de numerosas enfermedades crónicas, como las enfermedades cardiovasculares, metabólicas, neurológicas, enfermedades autoinmunes, cáncer, así como un grupo de enfermedades autoinflamatorias raras conocida como síndrome periódico asociado a criopirina, entre otras (4, 29).
Las mutaciones en el gen NLRP3 constituyen un factor etiológico de un grupo de enfermedades raras autoinflamatorias conocidas como síndrome periódico asociado a criopirina (CAPS), caracterizada por fiebre e inflamación sistémica recurrente. CAPS incluye tres fenotipos: Síndrome Autoinflamatorio Familiar inducido por Frío (FCAS), Síndrome de Muckle-Wells (MWS) y Enfermedad Autoinflamatoria Multisistémica de Inicio Neonatal / Síndrome Articular Cutáneo Neurológico Crónico Infantil / Síndrome Inflamatorio Crónico (CINCA/NOMID) (15).
Estas mutaciones en NLRP3 se traducen en una activación continua de caspasa-1 con hipersecreción de IL-1β, produciendo un estado de inflamación crónica. Por ello, se ha descrito un aumento de la expresión de IL-1β y de IL-18 en monocitos y macrófagos de pacientes con CAPS sin estímulo externo (30). Además de las células señaladas, NLRP3 puede activarse en otros tipos celulares relacionados con enfermedades inflamatorias en distintos órganos. Así, el inflamasoma NLRP3 ha sido implicado en enfermedades del Sistema Nervioso Central (SNC) como esclerosis múltiple, enfermedad de Alzheimer y Parkinson o en el daño cerebral traumático (31, 32). A su vez está implicado en enfermedades metabólicas como gota, diabetes tipo 2, y obesidad por resistencia a la insulina; enfermedad hepática del hígado graso no alcohólico (33); enfermedades cardiovasculares como aterosclerosis y otras patologías cardiacas (21, 34); y en enfermedades autoinmunes como artritis reumatoide o lupus eritematoso sistémico (35-37). Por otra parte, evidencias científicas avalan la participación de NLRP3 en la patogénesis de la depresión (38).
La inflamación crónica inducida por los inflamasomas también puede afectar a todos los estadios del desarrollo de tumores, causando alteración del microambiente, neoangiogénesis, proliferación de células tumorales y metástasis, al ser las citoquinas proinflamatorias mediadores importantes de la tumorogénesis inducida por la inflamación (39, 40). Por el contrario, en cáncer de colon se ha descrito un efecto supresor de la formación de tumores por el inflamasoma NLRP3. Por tanto, la activación del inflamasoma NLRP3 puede aumentar o inhibir la progresión del tumor y la metástasis dependiendo del tipo de tumor y del contexto en que se encuentra.
NLRP3 también está implicado en patologías de la piel como acné, dermatitis atópica, psoriasis y vitíligo (4). Estudios más recientes sobre la enfermedad por Coronavirus (COVID-19) apoyan la teoría de que el inflamasoma NLRP3 participa en el desarrollo de los síntomas respiratorios, cardiovasculares y neurológicos en pacientes con COVID-19 (41).
En conjunto, la inflamación mediada por la activación del inflamasoma NLRP3 está implicada en una amplia variedad de enfermedades, por lo que la modulación del estado de activación del inflamasoma puede ser beneficioso en el tratamiento de diversas enfermedades crónicas con un claro componente inflamatorio.
5. TERPENOS
Los productos naturales y sus derivados representan una fuente destacada en el descubrimiento de moléculas bioactivas para el desarrollo de nuevos agentes terapéuticos. En particular, los terpenos constituyen una alternativa potencial en el tratamiento de enfermedades inflamatorias, al haber sido descritos tradicionalmente en la literatura como agentes antiinflamatorios. Hasta el momento, su mecanismo de acción se había asociado a la inhibición de vías de señalización clásicas, como la activación del factor de transcripción NF-kB y de proteín quinasas activadas por mitógenos (MAPKs) en varios modelos experimentales de inflamación (42-45).
En los últimos años y dada la descripción del inflamasoma como una diana emergente en inflamación, numerosos estudios han evaluado la actividad de diterpenos y triterpenos como inhibidores de la activación canónica del inflamasoma NLRP3 (29, 46-49) (Figura 1, Tabla 1). De acuerdo con ello, esta revisión se ha centrado en examinar de forma crítica la literatura científica publicada sobre los terpenos más prometedores como potenciales inhibidores del inflamasoma NLRP3.
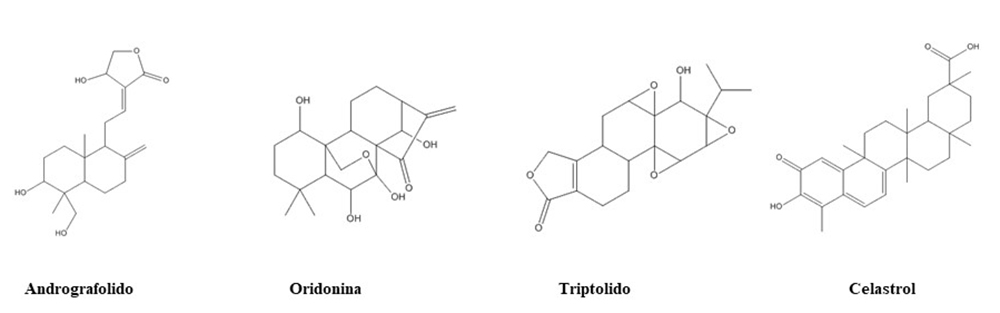
Figura. 1. Estructuras químicas de terpenos inhibidores de la activación del inflamasoma NLRP3.
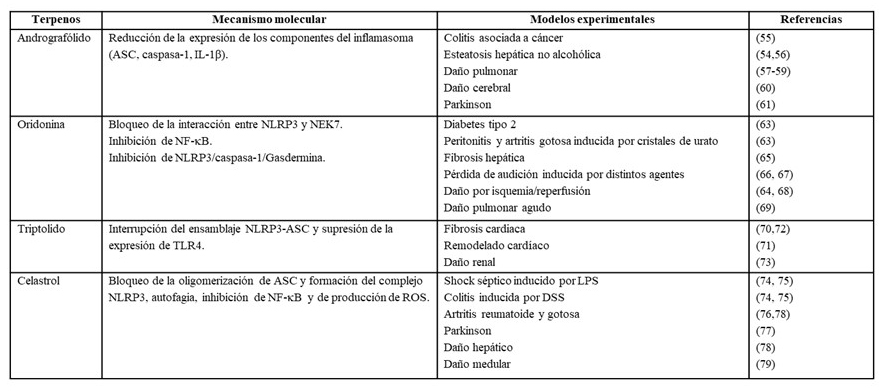
Tabla 1. Principales terpenos inhibidores de la activación del inflamasoma NLRP3 en modelos experimentales.
Artenólido
Partenólido es una lactona sesquiterpénica aislada de la especie vegetal Tanacetum parthenium Sch. Bip. (Asteraceae), tradicionalmente utilizada por sus propiedades antiinflamatorias atribuidas a la inhibición de la vía de activación de NF-κB. Fue el primer producto natural descrito como inhibidor de la activación del inflamasoma NLRP3 por su acción directa sobre caspasa-1 (50). Este mecanismo ha sido relacionado con los efectos protectores mostrados por este compuesto en un modelo murino de resistencia a la insulina inducida por obesidad (51).
Andrografólido
Andrografolido es un diterpeno aislado de Andrographis paniculata (Burm.f.) Nees (Acanthaceae), utilizado en el tratamiento de enfermedades inflamatorias (52). Estudios recientes señalan la acción inhibidora de este diterpeno en la formación del inflamasoma NLRP3 como mecanismo responsable de los efectos antiinflamatorios mostrados en distintos modelos preclínicos de enfermedad de hígado graso no alcohólico, daño pulmonar, artritis reumatoide y colitis asociada a cáncer (53-55). En estos modelos, los efectos inhibitorios de andrografólido se han relacionado con la interrupción del ensamblaje NLRP3-caspasa-1, produciendo inhibición de la activación de caspasa-1 y, por tanto, disminución de la secreción de IL-1β. Además, se ha descrito que un derivado de este compuesto es capaz de reducir la esteatosis hepática, fibrosis y daño hepático, por sus propiedades antioxidantes relacionadas con la regulación del factor eritroide 2 (Nrf2) y antinflamatorias al atenuar la activación de NLRP3, resultados corroborados en un modelo murino de esteatosis inducido por una dieta alta en grasas y colesterol (56). Mecanismos similares se encuentran implicados en los efectos protectores mostrados por este diterpeno y sus derivados en modelos animales de daño pulmonar inducido por distintos agentes como LPS, ovoalbúmina o partículas de silica (57-59). Así mismo, ha mostrado actividad sobre la neuroinflamación presente en modelos de daño cerebral por hemorragia intracerebral y en enfermedad de Parkinson (60, 61).
Oridonina
Oridonina es un diterpeno ent-kaurano obtenido de la especie Rabdosia rubescens, (Hemsl.) Hara (Lamiaceae), ampliamente utilizado en la Medicina Tradicional China. Numerosos estudios han puesto de manifiesto las propiedades antiinflamatorias de este diterpeno atribuidas a la reducción de varios mediadores proinflamatorios por su efecto inhibidor a nivel de la activación del factor de transcripción NF-κB, de su translocación nuclear y de su unión al ADN (62).
Un estudio más reciente ha caracterizado a oridonina como un inhibidor covalente selectivo e irreversible del inflamasoma NLRP3, al inhibir el ensamblaje y la activación de NLRP3, disminuyendo la producción de IL-1β (63). Desde el punto de vista mecanístico, oridonina es capaz de bloquear la interacción NLRP3-NEK7, indispensable para la activación de NLRP3, gracias a la presencia en su estructura de un grupo carbonilo a-b-insaturado a través de adición de Michael y unión covalente al residuo de cisteína C279 en el dominio NATCH de la proteína NLRP3, un paso relevante para la posterior oligomerización y reclutamiento de ASC. Sin embargo, oridonina no actúa sobre la actividad ATPasa de NLRP3 o en el reclutamiento de ASC (63). Así mismo, se han descrito efectos inhibidores dosis-dependientes de este diterpeno sobre la escisión de caspasa-1, secreción de IL-1β, y muerte celular tras la estimulación del inflamasoma con distintos agonistas de NLRP3. Adicionalmente, oridonina mostró efectos terapéuticos en modelos de enfermedades crónicas como peritonitis, artritis gotosa, diabetes tipo 2 y fibrosis hepática. Los efectos protectores de oridonina mostrados en la atenuación del daño por isquemia/reperfusión en extremidades se asocian con sus efectos antiinflamatorios relacionados con el inflammasoma NLRP3 (63-65).
Además, este compuesto era capaz de prevenir la pérdida de audición relacionada con la acumulación de ROS y de inflamación en modelos murinos. Así, se demostraron los efectos protectores de oridonina atribuidos a la inhibición de la vía de NLRP3/caspasa-1/gasdermina D, disminuyendo la muerte celular por piroptosis, cuando el agente inductor es un antibiótico aminoglucósido como la kanamicina o un bloqueo de la interacción NLRP3-NEK7, cuando existe pérdida de audición por ruido (66, 67).
Adicionalmente, oridonina ha mostrado efectos protectores en enfermedades cardiovasculares como el infarto de miocardio al disminuir la fibrosis miocárdica y preservar la función cardíaca en modelos animales (68). Así mismo, este diterpeno podría ser eficaz frente al daño pulmonar agudo al reducir la inflamación mediante la regulación de la expresión de componentes del inflamasoma NLRP3 e inhibición de la vía de NF-kB, así como por sus propiedades antioxidantes dependientes de la inhibición de Nrf2 (69).
Triptolido
Triptolido es el principio activo de la especie Tripterygium wilfordii Hook F (Celastraceae), ampliamente utilizada en la Medicina Tradicional China. Los efectos antifibróticos de este diterpeno han sido descritos en un modelo murino de fibrosis cardiaca por reducción de la inflamación cardiaca (70). El estudio de los mecanismos moleculares implicados indica que la inhibición de la activación del inflamasoma NLRP3 se produce por un mecanismo dual, al regular la expresión de los componentes del inflamasoma como NLRP3 y ASC, a la vez que bloquea el ensamblaje ASC-NLRP3. Triptolido mostró efectos beneficiosos sobre la remodelación cardiaca mejorando la función cardiaca y la hipertrofia ventricular, al disminuir la inflamación por su acción inhibidora de NLRP3 en corazones expuestos a una sobrecarga de presión de forma crónica (71). En un modelo de fibrosis cardiaca en ratas se ha descrito que la inhibición de la activación de NLRP3 que ejerce este diterpeno se asocia a su efecto inhibidor de la vía de NF-kB (72). De forma semejante, se ha observado que actúa como regulador de la expresión de NLRP3 y de TLR4 con mejoría significativa de parámetros de función renal en un modelo de daño renal en ratas tratadas con triptolido, con reducción de la producción de citoquinas proinflamatatorias (73).
Celastrol
El triterpeno celastrol es un compuesto bioactivo aislado también de Tripterygium wilfordii Hook F. (Celastraceae) con propiedades antiinflamatorias atribuidas a la inhibición de la activación del inflamasoma NLRP3, demostrado tanto en estudios in vitro como in vivo. Resultados obtenidos en modelos animales han puesto de manifiesto los efectos protectores de celastrol en modelos de shock séptico inducido por LPS y colitis inducida por sulfato de dextrano sódico (DSS) (74, 75). Los mecanismos implicados incluyen el bloqueo de la oligomerización de ASC y la activación de autofagia, que conducen a la inhibición de la activación de caspasa-1 y disminución de la liberación de citoquinas IL-1β e IL-18, bloqueando la activación del inflamasoma NLRP3. Se ha descrito además, que celastrol es capaz de inhibir la activación del inflamasoma y la escisión de caspasa-1 inducida por LPS/ATP, así como la vía de NF-κB y la producción de ROS, comportándose como un inhibidor dual en la vía de activación del inflamasoma al inhibir tanto el “priming” como la activación. Estos mecanismos son responsables del efecto protector mostrado por este compuesto en modelos animales de artritis reumatoide en ratas y de Parkinson en ratones (76, 77). Así mismo, ha mostrado efecto protector en artritis gotosa inducida por cristales de urato en ratones por un mecanismo relacionado con la inhibición de la ubiquitinación de K63 en NLRP3, suprimiendo así la activación de este inflamasoma (78). Celastrol también mostró actividad antiinflamatoria y neuroprotectora en un modelo de daño medular en ratas al reducir la activación de la microglia por inhibición de la vía del inflamasoma NLRP3, así como la expresión de proteínas relacionadas con la muerte celular por piroptosis (NLRP3, ASC, Caspasa-1 y GSDMD) con disminución de la producción de citoquinas proinflamatorias (TNF-α, IL-1β, IL-18) (79).
Otros terpenos
Artesunato, un derivado de la lactona sesquiterpenica artemisinina obtenida de la especie Artemisia annua L. (Asteraceae), redujo significativamente la neuroinflamación en un modelo de lesión cerebral traumatica, por sus efectos inhibitorios en la activación de NF-kB, en la liberación de citoquinas proinflamatorias y en la activación del inflamasoma NLRP3 (80). Los efectos protectores de este compuesto fueron también descritos en un modelo murino de distress respiratorio agudo (81).
Dehidrohispanolona es un diterpeno labdánico aislado de las partes aéreas de especies del género Ballota (Lamiaceae). Este diterpeno, así como algunos derivados han mostrado efectos antiinflamatorios en vías inflamatorias clásicas (43, 44). Las propiedades antiinflamatorias de algunos análogos han sido atribuidas recientemente a su actuación sobre la diana del inflamasoma NLRP3. Así, derivados oxima de dehidrohispanolona han sido descritos como inhibidores selectivos de NLRP3 (82).
Más recientemente se ha descrito que el diterpeno dehidroisohispanolona es capaz de inhibir la activación de caspasa-1 y la posterior secreción de IL-1β mediante la inhibición del inflamasoma NLRP3 en macrófagos. Estudios de Docking molecular confirmaron que este diterpeno adoptaba una conformación favorable en el bolsillo ATP del inflamasoma NLRP3 mediante la formación de un enlace covalente con la cisteína 415, confirmándose, de este modo, la inhibición directa del inflamasoma NLRP3. Además, este compuesto ejerce su actividad antiinflamatoria actuando como un inhibidor dual tanto de la activación de NF-kB como de NLRP3, disminuyendo también la piroptosis (83).
El triterpeno betulina, abundante en varias especies del género Betula (Betulaceae) también es capaz de reducir la inflamación hepática en ratas inducida por cisplatino por un mecanismo relacionado con la inhibición del inflamasoma NLRP3 por su acción sobre caspasa-1, reduciendo los niveles de IL-1b (84).
En conjunto, los resultados mostrados identifican al inflamasoma NLRP3 como una diana molecular implicada en el mecanismo de acción de estos terpenos. Este hecho reafirma el papel de los productos naturales como agentes terapéuticos prometedores en el tratamiento de varias enfermedades inflamatorias. Además, los efectos inhibitorios de la activación del factor de transcripción NF-kB atribuidos a los compuestos terpénicos permiten abrir nuevas estrategias para desarrollar moléculas que sean inhibidores duales y que puedan, simultáneamente, suprimir la activación del inflamasoma y la activación dependiente de NF-κB (Figura 2).
Figura. 2. Vías de señalización implicadas en la regulación del inflamasoma NLRP3 por terpenos. En la activación canónica del inflamasoma se requieren dos señales: señal 1 o “priming” dónde los TLRs reconocen a los PAMPs como el lipopolisacárido LPS induciendo la activación de NF-κB y su translocación al núcleo, produciendo la transcripción de pro-IL-1β, pro-IL-18 y de los componentes del inflamasoma; la señal 2 o activación, está inducida por diversos estímulos (ATP, Nigericina, ROS). La activación de caspasa-1 induce la maduración y liberación de las citoquinas proinflamatorias IL-1β y IL-18, produciendo el ensamblaje y oligomerización del complejo del inflamasoma NLRP3. Los diterpenos y triterpenos señalados son potentes inhibidores del inflamasoma NLRP3, actuando en distintas etapas de las vías implicadas en la activación del mismo.
6. CONCLUSIONES
La búsqueda de nuevos agentes antiinflamatorios sigue siendo un área de investigación relevante debido a la complejidad del proceso inflamatorio, así como por la implicación de la inflamación en numerosas patologías.
Evidencias científicas recientes señalan al inflamasoma NLRP3 como un factor intrínseco destacado en el sistema inmune innato en respuesta a una amplia variedad de estímulos, ya que su desregulación se ha asociado con el desarrollo y progresión de enfermedades inflamatorias y autoinmunes. La activación de NLRP3 y la liberación de citoquinas proinflamatorias (IL-1β, IL-18) ha sido demostrada en enfermedades con componente inflamatorio. Por todo ello, el conocimiento del proceso que interviene en la activación y regulación del inflamasoma abre nuevas posibilidades para el desarrollo de terapias antiinflamatorias constituyendo NLRP3, caspasa-1 e IL-1β nuevas dianas terapéuticas de gran interés. Hasta el momento, no se dispone de ningún inhibidor del inflamasoma NLRP3 de uso clínico.
Los terpenos son un grupo de productos naturales que presentan una gran diversidad estructural y biológica. Estudios recientes han revelado que son compuestos capaces de inhibir la activación del inflamasoma NLRP3 modulando la patogenicidad de la enfermedad inflamatoria. Los estudios resumidos señalan a los terpenos como agentes reguladores de NLRP3 mostrando efectos beneficiosos en varios modelos experimentales de enfermedades inflamatorias crónicas (colitis, artritis gotosa, daño pulmonar agudo…). Tradicionalmente, estos compuestos han sido identificado como potentes inhibidores del factor de transcripción NF-κB, un factor regulador de la transcripción de citoquinas y quimioquinas proinflamatorias implicadas en distintas enfermedades inmunes e inflamatorias crónicas. A su vez, NF-κB es una señal activadora del inflamasoma, siendo responsable de la síntesis de sus componentes, por lo que la actuación sobre esta vía puede también resultar en una disminución de los niveles de IL-1b.
Aunque todavía no se conocen con exactitud los mecanismos exactos por los que los terpenos regulan la activación del complejo del inflamasoma, estudios recientes sugieren que estos compuestos representan una aproximación terapéutica en la búsqueda de nuevos agentes antiinflamatorios. Los efectos inhibitorios combinados de los terpenos, tanto a través de la vía TLR4-NF-κB, como en el proceso de activación del inflamasoma NLRP3, pueden posicionar a estos compuestos como candidatos prometedores en la búsqueda de terapias nuevas y efectivas en el tratamiento de enfermedades inflamatorias mediadas por NLRP3.
7. REFERENCIAS
- Chen GY and Núñez G. Sterile inflammation: sensing and reacting to damage. Nat Rev Immunol. 2010;10:826-37.
- Akira S, Uematsu S and Takeuchi O. Pathogen recognition and innate immunity. Cell. 2006;124:783-801.
- Lamkanfi M and Dixit VM. Inflammasomes and their roles in health and disease. Annu Rev Cell Dev Biol. 2012;28:137-61.
- Seok JK, Kang HC, Cho YY, Lee HS and Lee JY. Therapeutic regulation of the NLRP3 inflammasome in chronic inflammatory diseases. Arch Pharm Res. 2021;44:16-35.
- Martinon F, Burns K and Tschopp J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Mol Cell. 2002;10:417-26.
- Place DE and Kanneganti TD. Recent advances in inflammasome biology. Curr Opin Immunol. 2018;50:32-38.
- Angosto-Bazarra D, Molina-Lopez C, Penin-Franch A, Hurtado-Navarro L and Pelegrin P. Techniques to study inflammasome activation and inhibition by small molecules. Molecules. 2021;26:1704.
- Schroder K and Tschopp J. The inflammasomes. Cell. 2010;140:821-32.
- Li Y, Huang H, Liu B, Zhang Y, Pan X, Yu XY, Shen Z and Song YH. Inflammasomes as therapeutic targets in human diseases. Signal Transduct Target Ther. 2021;6:247.
- Sharma D and Kanneganti TD. The cell biology of inflammasomes: Mechanisms of inflammasome activation and regulation. J Cell Biol. 2016;213:617-29.
- Martinon F, Mayor A and Tschopp J. The inflammasomes: guardians of the body. Annu Rev Immunol. 2009;27:229-65.
- Shi J, Zhao Y, Wang K, Shi X, Wang Y, Huang H, Zhuang Y, Cai T, Wang F and Shao F. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 2015;526:660-5.
- Strowig T, Henao-Mejia J, Elinav E and Flavell R. Inflammasomes in health and disease. Nature. 2012;481:278-86.
- Franchi L, Warner N, Viani K and Nunez G. Function of Nod-like receptors in microbial recognition and host defense. Immunol Rev. 2009;227:106-28.
- Hoffman HM, Mueller JL, Broide DH, Wanderer AA and Kolodner RD. Mutation of a new gene encoding a putative pyrin-like protein causes familial cold autoinflammatory syndrome and Muckle-Wells syndrome. Nat Genet. 2001;29:301-5.
- Miao EA, Leaf IA, Treuting PM, Mao DP, Dors M, Sarkar A, Warren SE, Wewers MD and Aderem A. Caspase-1-induced pyroptosis is an innate immune effector mechanism against intracellular bacteria. Nat Immunol. 2010;11:1136-42.
- Schattgen SA and Fitzgerald KA. The PYHIN protein family as mediators of host defenses. Immunol Rev. 2011;243:109-18.
- Lugrin J and Martinon F. The AIM2 inflammasome: Sensor of pathogens and cellular perturbations. Immunol Rev. 2018;281:99-114.
- Schnappauf O, Chae JJ, Kastner DL and Aksentijevich I. The Pyrin inflammasome in health and disease. Front Immunol. 2019;10:1745.
- Mata-Martinez E, Diaz-Munoz M and Vazquez-Cuevas FG. Glial cells and brain diseases: Inflammasomes as relevant pathological entities. Front Cell Neurosci. 2022;16:929529.
- Liao Y, Liu K and Zhu L. Emerging roles of inflammasomes in cardiovascular diseases. Front Immunol. 2022;13:834289.
- de Zoete MR, Palm NW, Zhu S and Flavell RA. Inflammasomes. Cold Spring Harb Perspect Biol. 2014;6:a016287.
- Duncan JA, Bergstralh DT, Wang Y, Willingham SB, Ye Z, Zimmermann AG and Ting JP. Cryopyrin/NALP3 binds ATP/dATP, is an ATPase, and requires ATP binding to mediate inflammatory signaling. Proc Natl Acad Sci U S A. 2007;104:8041-6.
- Sharif H, Wang L, Wang WL, Magupalli VG, Andreeva L, Qiao Q, Hauenstein AV, Wu Z, Nunez G, Mao Y and Wu H. Structural mechanism for NEK7-licensed activation of NLRP3 inflammasome. Nature. 2019;570:338-343.
- Swanson KV, Deng M and Ting JP. The NLRP3 inflammasome: molecular activation and regulation to therapeutics. Nat Rev Immunol. 2019;19:477-489.
- Latz E, Xiao TS and Stutz A. Activation and regulation of the inflammasomes. Nat Rev Immunol. 2013;13:397-411.
- Ruhl S and Broz P. Caspase-11 activates a canonical NLRP3 inflammasome by promoting K(+) efflux. Eur J Immunol. 2015;45:2927-36.
- Gaidt MM, Ebert TS, Chauhan D, Schmidt T, Schmid-Burgk JL, Rapino F, Robertson AA, Cooper MA, Graf T and Hornung V. Human monocytes engage an alternative inflammasome pathway. Immunity. 2016;44:833-46.
- Blevins HM, Xu Y, Biby S and Zhang S. The NLRP3 inflammasome pathway: a review of mechanisms and inhibitors for the treatment of inflammatory diseases. Front Aging Neurosci. 2022;14:879021.
- Agostini L, Martinon F, Burns K, McDermott MF, Hawkins PN and Tschopp J. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 2004;20:319-25.
- Dempsey C, Rubio Araiz A, Bryson KJ, Finucane O, Larkin C, Mills EL, Robertson AAB, Cooper MA, O’Neill LAJ and Lynch MA. Inhibiting the NLRP3 inflammasome with MCC950 promotes non-phlogistic clearance of amyloid-beta and cognitive function in APP/PS1 mice. Brain Behav Immun. 2017;61:306-316.
- Wallisch JS, Simon DW, Bayir H, Bell MJ, Kochanek PM and Clark RSB. Cerebrospinal fluid NLRP3 is increased after severe traumatic brain injury in infants and children. Neurocrit Care. 2017;27:44-50.
- Sharma BR and Kanneganti TD. NLRP3 inflammasome in cancer and metabolic diseases. Nat Immunol. 2021;22:550-559.
- Duewell P, Kono H, Rayner KJ, Sirois CM, Vladimer G, Bauernfeind FG, Abela GS, Franchi L, Nunez G, Schnurr M, Espevik T, Lien E, Fitzgerald KA, Rock KL, Moore KJ, Wright SD, Hornung V and Latz E. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals. Nature. 2010;464:1357-61.
- Kahlenberg JM and Kaplan MJ. The inflammasome and lupus: another innate immune mechanism contributing to disease pathogenesis? Curr Opin Rheumatol. 2014;26:475-81.
- Spel L and Martinon F. Inflammasomes contributing to inflammation in arthritis. Immunol Rev. 2020;294:48-62.
- Mathews RJ, Robinson JI, Battellino M, Wong C, Taylor JC, Biologics in Rheumatoid Arthritis G, Genomics Study S, Eyre S, Churchman SM, Wilson AG, Isaacs JD, Hyrich K, Barton A, Plant D, Savic S, Cook GP, Sarzi-Puttini P, Emery P, Barrett JH, Morgan AW and McDermott MF. Evidence of NLRP3-inflammasome activation in rheumatoid arthritis (RA); genetic variants within the NLRP3-inflammasome complex in relation to susceptibility to RA and response to anti-TNF treatment. Ann Rheum Dis. 2014;73:1202-10.
- Fleshner M, Frank M and Maier SF. Danger signals and inflammasomes: stress-evoked sterile inflammation in mood disorders. Neuropsychopharmacology. 2017;42:36-45.
- Moossavi M, Parsamanesh N, Bahrami A, Atkin SL and Sahebkar A. Role of the NLRP3 inflammasome in cancer. Mol Cancer. 2018;17:158.
- Karki R and Kanneganti TD. Diverging inflammasome signals in tumorigenesis and potential targeting. Nat Rev Cancer. 2019;19:197-214.
- Vora SM, Lieberman J and Wu H. Inflammasome activation at the crux of severe COVID-19. Nat Rev Immunol. 2021;21:694-703.
- de las Heras B and Hortelano S. Molecular basis of the anti-inflammatory effects of terpenoids. Inflamm Allergy Drug Targets. 2009;8:28-39.
- Jimenez-Garcia L, Higueras MA, Herranz S, Hernandez-Lopez M, Luque A, de Las Heras B and Hortelano S. A hispanolone-derived diterpenoid inhibits M2-Macrophage polarization in vitro via JAK/STAT and attenuates chitin induced inflammation in vivo. Biochem Pharmacol. 2018;154:373-383.
- Marco JL. Isolation, reactivity, pharmacological activities and total synthesis of hispanolone and structurally related diterpenes from Labiatae plants. Bioorg Med Chem Lett. 2020;30:127498.
- Kishore V, Yarla NS, Bishayee A, Putta S, Malla R, Neelapu NR, Challa S, Das S, Shiralgi Y, Hegde G and Dhananjaya BL. Multi-targeting Andrographolide and its natural analogs as potential therapeutic agents. Curr Top Med Chem. 2017;17:845-857.
- Hortelano S, Gonzalez-Cofrade L, Cuadrado I and de Las Heras B. Current status of terpenoids as inflammasome inhibitors. Biochem Pharmacol. 2020;172:113739.
- Hua F, Shi L and Zhou P. Phenols and terpenoids: natural products as inhibitors of NLRP3 inflammasome in cardiovascular diseases. Inflammopharmacology. 2022;30:137-147.
- Islam MT, Bardaweel SK, Mubarak MS, Koch W, Gawel-Beben K, Antosiewicz B and Sharifi-Rad J. Immunomodulatory effects of diterpenes and their derivatives through NLRP3 inflammasome pathway: a review. Front Immunol. 2020;11:572136.
- Del Prado-Audelo ML, Cortes H, Caballero-Floran IH, Gonzalez-Torres M, Escutia-Guadarrama L, Bernal-Chavez SA, Giraldo-Gomez DM, Magana JJ and Leyva-Gomez G. Therapeutic applications of terpenes on inflammatory diseases. Front Pharmacol. 2021;12:704197.
- Juliana C, Fernandes-Alnemri T, Wu J, Datta P, Solorzano L, Yu JW, Meng R, Quong AA, Latz E, Scott CP and Alnemri ES. Anti-inflammatory compounds parthenolide and Bay 11-7082 are direct inhibitors of the inflammasome. J Biol Chem. 2010;285:9792-9802.
- Chinta PK, Tambe S, Umrani D, Pal AK and Nandave M. Effect of parthenolide, an NLRP3 inflammasome inhibitor, on insulin resistance in high-fat diet-obese mice. Can J Physiol Pharmacol. 2022;100:272-281.
- Tan WSD, Liao W, Zhou S and Wong WSF. Is there a future for andrographolide to be an anti-inflammatory drug? Deciphering its major mechanisms of action. Biochem Pharmacol. 2017;139:71-81.
- Lo CW, Lii CK, Hong JJ, Chuang WT, Yang YC, Huang CS and Chen HW. Andrographolide inhibits IL-1beta release in bone marrow-derived macrophages and monocyte infiltration in mouse knee joints induced by monosodium urate. Toxicol Appl Pharmacol. 2021;410:115341.
- Cabrera D, Wree A, Povero D, Solis N, Hernandez A, Pizarro M, Moshage H, Torres J, Feldstein AE, Cabello-Verrugio C, Brandan E, Barrera F, Arab JP and Arrese M. Andrographolide ameliorates inflammation and fibrogenesis and attenuates inflammasome activation in experimental non-alcoholic steatohepatitis. Sci Rep. 2017;7:3491.
- Guo W, Sun Y, Liu W, Wu X, Guo L, Cai P, Wu X, Wu X, Shen Y, Shu Y, Gu Y and Xu Q. Small molecule-driven mitophagy-mediated NLRP3 inflammasome inhibition is responsible for the prevention of colitis-associated cancer. Autophagy. 2014;10:972-85.
- Liu YT, Chen HW, Lii CK, Jhuang JH, Huang CS, Li ML and Yao HT. A diterpenoid, 14-deoxy-11, 12-didehydroandrographolide, in Andrographis paniculata reduces steatohepatitis and liver injury in mice fed a high-fat and high-cholesterol diet. Nutrients. 2020;12:523.
- Li T, Zhang C, Wei Y, Zhong H, Shan L, Yu P, Wang Y and Xu L. Andrographolide derivative AL-1 ameliorates LPS-induced acute lung injury by inhibiting NLRP3 inflammasome and lung permeability. Curr Pharm Des. 2022;28:2508-2517.
- Peng S, Gao J, Liu W, Jiang C, Yang X, Sun Y, Guo W and Xu Q. Andrographolide ameliorates OVA-induced lung injury in mice by suppressing ROS-mediated NF-kappaB signaling and NLRP3 inflammasome activation. Oncotarget. 2016;7:80262-80274.
- Song Z, Wang L, Cao Y, Liu Z, Zhang M, Zhang Z, Jiang S, Fan R, Hao T, Yang R, Wang B, Guan Z, Zhu L, Liu Z, Zhang S, Zhao L, Xu Z, Xu H and Dai G. Isoandrographolide inhibits NLRP3 inflammasome activation and attenuates silicosis in mice. Int Immunopharmacol. 2022;105:108539.
- Li X, Wang T, Zhang D, Li H, Shen H, Ding X and Chen G. Andrographolide ameliorates intracerebral hemorrhage induced secondary brain injury by inhibiting neuroinflammation induction. Neuropharmacology. 2018;141:305-315.
- Ahmed S, Kwatra M, Ranjan Panda S, Murty USN and Naidu VGM. Andrographolide suppresses NLRP3 inflammasome activation in microglia through induction of parkin-mediated mitophagy in in-vitro and in-vivo models of Parkinson disease. Brain Behav Immun. 2021;91:142-158.
- Wang S, Yang H, Yu L, Jin J, Qian L, Zhao H, Xu Y and Zhu X. Oridonin attenuates Abeta1-42-induced neuroinflammation and inhibits NF-kappaB pathway. PLoS One. 2014;9:e104745.
- He H, Jiang H, Chen Y, Ye J, Wang A, Wang C, Liu Q, Liang G, Deng X, Jiang W and Zhou R. Oridonin is a covalent NLRP3 inhibitor with strong anti-inflammasome activity. Nat Commun. 2018;9:2550.
- Zhao X, Liu Y, Wang L, Yan C, Liu H, Zhang W, Zhao H, Cheng C, Chen Z, Xu T, Li K, Cai J and Qiao T. Oridonin attenuates hind limb ischemia-reperfusion injury by modulating Nrf2-mediated oxidative stress and NLRP3-mediated inflammation. J Ethnopharmacol. 2022;292:115206.
- Liu D, Qin H, Yang B, Du B and Yun X. Oridonin ameliorates carbon tetrachloride-induced liver fibrosis in mice through inhibition of the NLRP3 inflammasome. Drug Dev Res. 2020;81:526-533.
- Li M, Zhang Y, Qiu S, Zhuang W, Jiang W, Wang C, Zhang S, Zhou Z, Sun T, Ke Z, Guo W, Qiao Y and Shi X. Oridonin ameliorates noise-induced hearing loss by blocking NLRP3 – NEK7 mediated inflammasome activation. Int Immunopharmacol. 2021;95:107576.
- Wu L, Chen M, Li M, Wang Y, Li Y, Zheng L, Ke Z, Liu K, Qiao Y and Shi X. Oridonin alleviates kanamycin-related hearing loss by inhibiting NLRP3/caspase-1/gasdermin D-induced inflammasome activation and hair cell pyroptosis. Mol Immunol. 2022;149:66-76.
- Gao RF, Li X, Xiang HY, Yang H, Lv CY, Sun XL, Chen HZ, Gao Y, Yang JS, Luo W, Yang YQ and Tang YH. The covalent NLRP3-inflammasome inhibitor Oridonin relieves myocardial infarction induced myocardial fibrosis and cardiac remodeling in mice. Int Immunopharmacol. 2021;90:107133.
- Yang H, Huang J, Gao Y, Wen Z, Peng L and Ci X. Oridonin attenuates carrageenan-induced pleurisy via activation of the KEAP-1/Nrf2 pathway and inhibition of the TXNIP/NLRP3 and NF-kappaB pathway in mice. Inflammopharmacology. 2020;28:513-523.
- Pan XC, Liu Y, Cen YY, Xiong YL, Li JM, Ding YY, Tong YF, Liu T, Chen XH and Zhang HG. Dual role of Triptolide in interrupting the NLRP3 Inflammasome Pathway to attenuate cardiac fibrosis. Int J Mol Sci. 2019;20:360.
- Li R, Lu K, Wang Y, Chen M, Zhang F, Shen H, Yao D, Gong K and Zhang Z. Triptolide attenuates pressure overload-induced myocardial remodeling in mice via the inhibition of NLRP3 inflammasome expression. Biochem Biophys Res Commun. 2017;485:69-75.
- Shen J, Ma H and Wang C. Triptolide improves myocardial fibrosis in rats through inhibition of nuclear factor kappa B and NLR family pyrin domain containing 3 inflammasome pathway. Korean J Physiol Pharmacol. 2021;25:533-543.
- He L, Peng X, Liu G, Tang C, Liu H, Liu F, Zhou H and Peng Y. Anti-inflammatory effects of triptolide on IgA nephropathy in rats. Immunopharmacol Immunotoxicol. 2015;37:421-427.
- Yu X, Zhao Q, Zhang X, Zhang H, Liu Y, Wu X, Li M, Li X, Zhang J, Ruan X and Zhang H. Celastrol ameliorates inflammation through inhibition of NLRP3 inflammasome activation. Oncotarget. 2017;8:67300-67314.
- Shaker ME, Ashamallah SA and Houssen ME. Celastrol ameliorates murine colitis via modulating oxidative stress, inflammatory cytokines and intestinal homeostasis. Chem Biol Interact. 2014;210:26-33.
- Jing M, Yang J, Zhang L, Liu J, Xu S, Wang M, Zhang L, Sun Y, Yan W, Hou G, Wang C and Xin W. Celastrol inhibits rheumatoid arthritis through the ROS-NF-kappaB-NLRP3 inflammasome axis. Int Immunopharmacol. 2021;98:107879.
- Zhang C, Zhao M, Wang B, Su Z, Guo B, Qin L, Zhang W and Zheng R. The Nrf2-NLRP3-caspase-1 axis mediates the neuroprotective effects of Celastrol in Parkinson’s disease. Redox Biol. 2021;47:102134.
- Yan CY, Ouyang SH, Wang X, Wu YP, Sun WY, Duan WJ, Liang L, Luo X, Kurihara H, Li YF and He RR. Celastrol ameliorates Propionibacterium acnes/LPS-induced liver damage and MSU-induced gouty arthritis via inhibiting K63 deubiquitination of NLRP3. Phytomedicine. 2021;80:153398.
- Dai W, Wang X, Teng H, Li C, Wang B and Wang J. Celastrol inhibits microglial pyroptosis and attenuates inflammatory reaction in acute spinal cord injury rats. Int Immunopharmacol. 2019;66:215-223.
- Gugliandolo E, D’Amico R, Cordaro M, Fusco R, Siracusa R, Crupi R, Impellizzeri D, Cuzzocrea S and Di Paola R. Neuroprotective effect of artesunate in experimental model of traumatic brain injury. Front Neurol. 2018;9:590.
- Cui Y, Weng W, Ding Q, Su Q and Wang X. The protective effect of artesunate on LPS-induced acute respiratory distress syndrome through inhibiting NLRP3 inflammasome signaling. Evid Based Complement Alternat Med. 2022;2022:7655033.
- Gonzalez-Cofrade L, Oramas-Royo S, Cuadrado I, Amesty A, Hortelano S, Estevez-Braun A and de Las Heras B. Dehydrohispanolone derivatives attenuate the inflammatory response through the modulation of inflammasome activation. J Nat Prod. 2020;83:2155-2164.
- Gonzalez-Cofrade L, Cuadrado I, Amesty A, Estevez-Braun A, de Las Heras B and Hortelano S. Dehydroisohispanolone as a promising NLRP3 inhibitor agent: bioevaluation and molecular docking. Pharmaceuticals (Basel). 2022;15:825.
- Eisa NH, El-Sherbiny M and Abo El-Magd NF. Betulin alleviates cisplatin-induced hepatic injury in rats: Targeting apoptosis and Nek7-independent NLRP3 inflammasome pathways. Int Immunopharmacol. 2021;99:107925.