La incontinencia urinaria representa un grave problema social, médico y económico, que sufre un aumento progresivo, debido al incremento en la expectativa de vida que los avances sociales, sanitarios y culturales han conseguido. Se calcula que en el mundo presentan aproximadamente incontinencia urinaria unos doscientos millones de personas con una gran repercusión económica de gran trascendencia que puede desbordar las previsiones de cobertura de los diferentes sistemas de servicios de asistencia sanitaria. Nuestro grupo del Departamento de Fisiología de la UCM lleva varios años estudiando la fisiología del tracto urinario inferior (TUI) con el objeto de determinar los neurotransmisores y receptores que regulan estas estructuras. Este mayor conocimiento de la Fisiología y Fisiopatología del TUI ha permitido que estas disfunciones puedan ser corregidas con métodos farmacológicos frente a la alternativa tradicional de la cirugía.
Palabras clave: micción; incontinencia; neurotransmisión química; neurotransmisores; receptores
ABSTRACT:
Urinary incontinence represents a serious social, medical and economic problem, which suffers a progressive increase, due to the increase in life expectancy that social, health and cultural advances have achieved. It is estimated that in the world there are approximately two hundred million people in urinary incontinence with a great economic impact of great importance that can exceed the coverage forecasts of the different systems of health care services. Our group from the Department of Physiology of the UCM has been studying the physiology of the lower urinary tract (LUT) for several years in order to determine the neurotransmitters and receptors that regulate these structures. This greater knowledge of the Physiology and Pathophysiology of the LUT has allowed these dysfunctions to be corrected with pharmacological methods compared to the traditional alternative of surgery.
Keywords: micturition; urinary incontinence; chemical neurotransmission; neurotransmitters; receptors
1. INTRODUCCIÓN
La continencia urinaria es una función básica que se adquiere en la infancia y que se debe mantener hasta las edades más avanzadas, en ausencia de procesos patológicos. De acuerdo con la Sociedad Internacional de Continencia, la incontinencia urinaria se define como la pérdida involuntaria de orina que condiciona un problema higiénico y/o social, y que se puede demostrar objetivamente (1).
La incontinencia urinaria representa un grave problema social, médico y económico, que sufre un aumento progresivo, debido al incremento en la expectativa de vida que los avances sociales, sanitarios y culturales han conseguido. Socialmente, la incontinencia urinaria, es una causa de malestar, dependencia y sentimiento de aislamiento social. Incluso, en ocasiones, contribuye a la hospitalización de estas personas y su alejamiento del medio ambiente familiar. Además, se debe tener en cuenta los daños psicológicos y la pérdida de autoestima que sufre el enfermo incontinente.
Es importante destacar que entre un 10-15% de los sujetos mayores de 65 años que viven en sus domicilios padecen incontinencia urinaria, entre los ancianos hospitalizados el porcentaje asciende a un 30-40% y se alcanza la máxima prevalencia (50-60%) entre los ingresados en centros residenciales. Se calcula que en el mundo presentan aproximadamente incontinencia urinaria unos doscientos millones de personas. En EE.UU. se gastan anualmente más de 16.000 millones de dólares en los costes directos e indirectos causados por estos pacientes. Se ha estimado incluso que la incontinencia urinaria tiene una prevalencia tan importante como algunas enfermedades crónicas entre las que se encuentran el asma, la isquemia coronaria y la úlcera gástrica (2). En España 4 millones de personas padecen síntomas de urgencia miccional, aumento de la frecuencia miccional e incontinencia urinaria, esto conlleva una gran repercusión económica de gran trascendencia que puede desbordar las previsiones de cobertura de los diferentes sistemas de servicios de asistencia sanitaria. Por ejemplo, el gasto en absorbentes de incontinencia urinaria en nuestro país representa un coste anual de 154 millones de euros (3).
Aunque la edad avanzada por sí sola no conlleva a los escapes de orina, en el envejecimiento normal o fisiológico se van presentando una serie de cambios que la favorecen. Entre estos cambios se incluyen (4):
- Disminución de la elasticidad vesical, lo que disminuye la capacidad de la vejiga y requiere un vaciamiento más frecuente.
- Disminución en la fuerza de contracción del músculo detrusor, lo que conduce a un vaciamiento incompleto de la vejiga y a un incremento del volumen residual.
- Incremento en las contracciones espontáneas del músculo detrusor.
- Disminución en la capacidad de posponer la micción.
- Disminución en la presión de cierre uretral.
- Disminución de la fuerza de los músculos pélvicos de soporte.
La mayor prevalencia de incontinencia urinaria en las mujeres postmenopáusicas se debe fundamentalmente a la deficiencia de estrógenos que causa atrofia del epitelio uretral y que conduce a una reducción en la eficiencia de los esfínteres uretrales. La pérdida de tono de los músculos del suelo de la pelvis, que se producen no solo por la edad sino también por los embarazos múltiples, los partos traumáticos o una intervención pelviginecológica puede contribuir a la incontinencia urinaria en la mujer.
En el varón la hiperplasia benigna de próstata ocasiona la obstrucción del cuello de la vejiga y de la uretra prostática que motiva cambios a nivel vesical de variada trascendencia clínica. El incremento progresivo de la resistencia al vaciamiento vesical por el crecimiento de la hiperplasia prostática, motiva una respuesta funcional y anatómica del detrusor para compensar la obstrucción, aumentando la fuerza y el número de las contracciones vesicales. Mediante este mecanismo se supera la resistencia y se consigue vaciar correctamente la vejiga, sin orina residual. Si la hiperplasia prostática se prolonga en el tiempo se genera una hiperplasia vesical cuyos mecanismos compensadores son insuficientes, lo que determina un vaciamiento incompleto de la vejiga urinaria que motiva la presencia de orina residual. La distensión vesical genera cambios isquémicos en la pared muscular y alteraciones hidrodinámicas que afectan al tracto urinario superior, con uropatía obstructiva que puede conducir finalmente a la insuficiencia renal crónica.
2. FISIOLOGÍA DEL TRACTO URINARIO INFERIOR (TUI)
En los últimos años se han producido cambios considerables en la farmacoterapia de las disfunciones miccionales, que han permitido que muchas de estas patologías, sobre todo aquellas que aparecen en neuropatologías encubiertas, no evidentes, con el trasfondo funcional, no orgánico, puedan ser corregidas con métodos farmacológicos frente a la alternativa tradicional de la cirugía.
De este modo, las derivaciones urinarias supravesicales, las cistostomias permanentes, la cirugía correctora de supuestas alteraciones cérvico uretrales orgánicas y numerosas esfinterotomías han sido sustituidas por otras estrategias terapéuticas en las que se incluye la farmacológica. Junto a ello, han aparecido nuevos fármacos que han conseguido resultados terapéuticos eficaces (5).
Todo ello es consecuencia de un mayor conocimiento de la Fisiología y Fisiopatología del tracto urinario inferior. Nuestro grupo del Departamento de Fisiología de la UCM primero en la Facultad de Veterinaria y desde el año 2001 en la Facultad de Farmacia lleva varios años estudiando la fisiología del tracto urinario inferior con el objeto de determinar los neurotransmisores y receptores que regulan estas estructuras.
La principal función de la vejiga urinaria es transformar la continua función excretora de los riñones en un proceso intermitente de evacuación. Para ello, el funcionamiento del tracto urinario inferior requiere un complejo sistema neural de regulación que coordina la actividad vegetativa y somática de sus diferentes componentes.
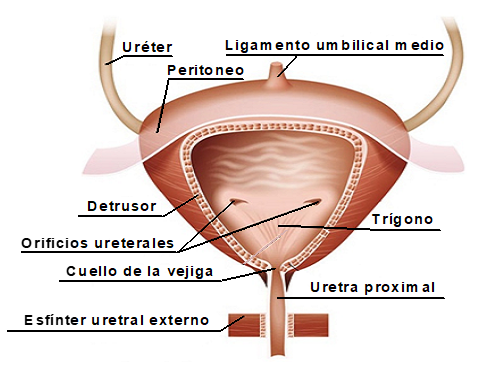
La vejiga se divide en dos partes: el cuerpo y la base. El cuerpo vesical es la porción superior y más amplia de la vejiga, que aumenta considerablemente de volumen cuando está llena de orina. La capa muscular de la vejiga corresponde al músculo detrusor, cuya contracción es esencial para garantizar el vaciado completo de la vejiga. La base comprende el cuarto inferior de la vejiga, se encuentra localizada caudalmente al cuerpo y en ella desembocan los uréteres. La base se estrecha constituyendo el cuello vesical y se continúa inmediatamente con la uretra proximal. El conjunto de los dos orificios ureterales superiores y otro orificio inferior y caudal presenta una forma de triángulo invertido, motivo por lo que esta zona recibe el nombre de trígono vesical (6). (Figura 1).
Figura 1. Estructura de la vejiga urinaria y la uretra (6).
La uretra es el último segmento de las vías urinarias responsable de la conducción de la orina al exterior. Su anatomía difiere en relación al sexo, ya que en el masculino, además de su función urinaria, es responsable del transporte del semen a nivel de su porción anterior, esponjosa o peneana. La uretra masculina se extiende desde el cuello vesical hasta la extremidad libre del pene o meato uretral, en la que se distinguen tres regiones: prostática, membranosa y esponjosa o peneana. La uretra prostática atraviesa el espesor de la próstata de la que recibe su secreción por los conductos eyaculatorios. A continuación se dispone la porción membranosa de la uretra, la cual, atraviesa el periné donde se rodea de un anillo de fibras musculares estriadas constituyendo el denominado esfínter uretral externo o rabdoesfínter de control voluntario. La última, y porción más larga de la uretra es la esponjosa o peneana que finaliza en el glande en un orificio denominado meato urinario. La uretra femenina, que únicamente conduce la orina al exterior, es más corta que la masculina, y desemboca en la extremidad anterior de la vulva, inmediatamente por detrás del clítoris. La uretra está formada por una capa interna o mucosa, una media (solo en los machos) o conectiva laxa (en las hembras) y una externa o muscular lisa con fibras longitudinales y transversales, cuyo cierre es producido como consecuencia de la contracción involuntaria y voluntaria, esta última variable según las especies, de los esfínteres uretrales interno y externo, respectivamente (6).
El almacenamiento y la eliminación periódica de orina producida en los riñones es regulada por el sistema nervioso que coordina la actividad recíproca de dos unidades funcionales en el tracto urinario inferior: un reservorio (la vejiga urinaria) y una región de salida (el cuello vesical y la uretra proximal, así como la musculatura estriada del denominado esfínter uretral externo o rabdoesfínter). La regulación de la vejiga urinaria y la uretra es dependiente de dos grupos de nervios periféricos: simpáticos y parasimpáticos con sus correspondientes vías aferentes y eferentes.
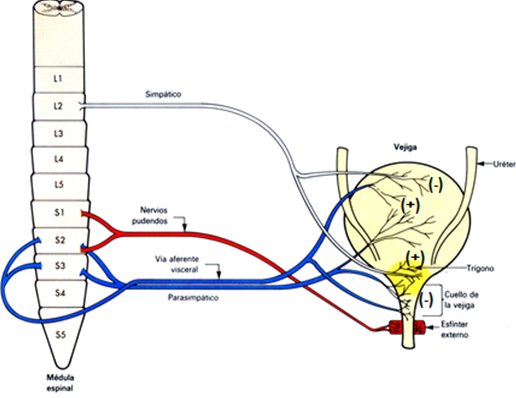
Estas dos funciones de llenado y vaciado vesical son el resultado de una compleja interrelación en la que participan, de forma sinérgica, la unión ureterovesical, la pared del cuerpo de la vejiga, el cuello vesical y la uretra. La uretra presenta una inervación somática, a través del nervio pudendo, responsable de la contracción voluntaria del músculo estriado del esfínter uretral externo y una inervación vegetativa responsable de la contractilidad involuntaria de la musculatura lisa del esfínter uretral interno (7). (Figura 2).
Figura 2. Inervación del Tracto Urinario Inferior (TUI) (6).
3. REGULACIÓN DEL TRACTO URINARIO INFERIOR (TUI)
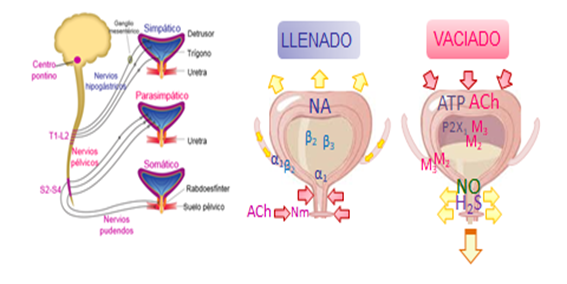
La médula espinal recibe influencias de niveles superiores del sistema nervioso central (tronco del encéfalo, tálamo y corteza cerebral). La regulación ejercida por el sistema nervioso autónomo es modulada por centros medulares y encefálicos de forma antagónica. Así la activación del sistema nervioso simpático favorece el llenado de la vejiga mientras que el sistema nervioso parasimpático regula su vaciado (8). (Figura 3).
Figura 3. Regulación nerviosa del llenado y vaciado de la vejiga urinaria (6)
Los centros motores simpáticos estimulan la contracción del músculo liso del cuello de la vejiga y la uretra proximal y la relajación del músculo detrusor en el cuerpo de la vejiga. Las neuronas preganglionares simpáticas se localizan en la columna intermediolateral de los segmentos medulares toracolumbares T11-L2. Dichas fibras preganglionares liberan acetilcolina (ACh) que se une a receptores nicotínicos de las neuronas postganglionares, las cuales, discurren por el nervio hipogástrico liberando noradrenalina (NA) en sus terminaciones (9,10,11). Este neurotransmisor produce una potente relajación del detrusor vía activación de los receptores adrenérgicos β2 y β3 y la contracción del cuello vesical y la uretra proximal a través de la unión de la NA a receptores adrenérgicos α1 y de la endotelina-1 a receptores ETA (12,13,14,15).
La inervación somática es responsable de la contracción voluntaria del músculo estriado del esfínter uretral externo. Dichas fibras se originan en las astas ventrales de los segmentos medulares sacros S2-S4, salen por las raíces ventrales y constituyen el nervio pudendo. La estimulación de dicho nervio produce la contracción del músculo estriado uretral externo, como consecuencia de la liberación de ACh y su unión con receptores nicotínicos musculares. Los nervios hipogástrico, pélvico y pudendo llevan, además, señales sensoriales a través de aferentes que van desde la vejiga y la uretra a la médula espinal lumbosacra. Las aferentes del nervio pélvico, monitorizan el volumen de la vejiga en la fase de llenado. Dicha inervación sensorial está integrada por aferentes tipo III (Aδ) débilmente mielinizadas presentes en la capa muscular y por aferentes tipo IV (C) amielínicas de localización más dispersa en el músculo y en el interior del urotelio. Las fibras C que pueden ser sensibles o insensibles a la neurotoxina sensorial, capsaicina, presentan un umbral más alto de generación de impulsos en respuesta al estiramiento de la pared vesical que las fibras Aδ. Estas últimas, además, responden principalmente a la distensión vesical mientras que las fibras C también pueden ser activadas por varios neurotransmisores, como la adenosina 5’-trifosfato (ATP) y las taquicininas, liberados desde el urotelio y del músculo detrusor (16).
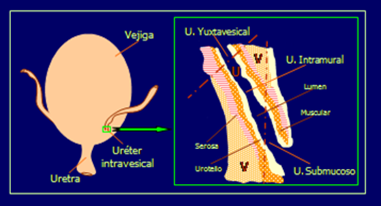
Figura 4. Estructura del uréter intravesical (6)
La micción es el proceso de evacuación de la orina de la vejiga a través de la uretra, cuando se ha alcanzado un dintel de llenado vesical. Esta actividad es producida por un acto reflejo que, a través de una vía espino-bulbo-espinal, coordina la actividad del denominado centro pontino de la micción o núcleo de Barrington y de la substancia gris periacueductal del tronco del encéfalo.
La capacidad de adaptación de la vejiga al llenado de orina tiene un límite, a partir del cual la sensación de repleción vesical, que era imperceptible, se hace molesta y posteriormente dolorosa.
Cuando se alcanza un dintel de llenado de la vejiga urinaria, surge la sensación de llenado vesical y el deseo miccional, sensación que irá aumentando progresivamente. Las fibras parasimpáticas del nervio pélvico constituyen la principal inervación excitadora del detrusor y tienen su origen en los segmentos medulares sacros S2-S4 (Núcleo de Onuf) (17). En el nervio pélvico discurren tanto fibras sensitivas como motoras. Las fibras nerviosas sensitivas detectan el grado de distensión de la pared de la vejiga, siendo dicha señal mecánica, responsable del inicio de los reflejos que provocan el vaciado de la vejiga. La activación del sistema nervioso parasimpático, a través de la columna intermediolateral de la médula sacra, libera ACh a nivel de los ganglios del plexo pélvico (efecto nicotínico) donde estimulan las fibras postganglionares que, a su vez, liberan ACh en la unión ureterovesical y en el músculo detrusor e inducen su contracción vía activación de los receptores muscarínicos M2 y M3 (11). La secreción de ACh, desde las terminaciones nerviosas parasimpáticas, se produce conjuntamente con ATP, la cual, actúa como cotransmisor parasimpático responsable del inicio de la contracción de la pared vesical por activación de los receptores purinérgicos P2X1-3. Asimismo, los nervios parasimpáticos ejercen un efecto relajante en el músculo liso del cuello de la vejiga y de la uretra proximal a través de la liberación de óxido nítrico (NO) y de sulfuro de hidrógeno (SH2) (18,19,20).
El NO, cuya liberación es modulada por receptores adrenérgicos α2 y canales de K+ sensibles al voltaje (Kv) de localización presináptica, produce relajación del cuello de la vejiga y la uretra a través de un mecanismo dependiente de la activación de la guanilato ciclasa soluble (21). Se ha identificado, además, un componente inhibidor independiente de NO que representa más del 50% de la relajación de la base de la vejiga vía activación de la ciclooxigenasa-1 (COX-1) y de la bomba Na+-K+ ATPasa. Entre los neurotransmisores inhibidores cabe destacar el ATP, la 5-HT y péptidos, como el VIP, el PACAP 38 y el péptido relacionado con el gen de la calcitonina (CGRP), los cuales, desempeñan un papel crucial en la relajación del cuello vesical (22,23,24). Así, el ATP produce la relajación del músculo liso del cuello de la vejiga a través de receptores purinérgicos P2Y1 y A2A, mientras que la 5-HT, cuyo efecto es modulado por receptores serotoninérgicos presinápticos 5-HT2A, induce la relajación vía receptores musculares 5-HT7acoplados a la vía de la proteína cinasa A (PKA) sin involucrar activación de los canales de K+ de membrana.
Finalmente el VIP y el PACAP 38 promueven relajación del cuello de la vejiga a través de los receptores VPAC2, mientras que el CGRP y la ET-1 producen relajación de la base de la vejiga vía activación de receptores CGRP2 y ETB , respectivamente, acoplados a la vía de la PKA (15,25). Otros péptidos como la BK provocan un efecto dual, relajante y/o contráctil, a través de la activación de receptores de BK B2 presentes en las terminaciones nerviosas y en el músculo liso, respectivamente (26). Asimismo, inhibidores de la fosfodiesterasa 4 y hormonas esteroideas gonadales promueven una potente relajación de la base de la vejiga (27). Recientemente, se ha identificado, un papel clave del H2S como molécula gaseosa señalizadora en la neurotransmisión del cuello vesical, produciendo la relajación de la musculatura lisa a través de la activación de canales KATP y de la liberación de neuropéptidos sensoriales inhibidores como el PACAP 38 y el CGRP (28,29).
Estos mediadores, en conjunto, provocan la relajación involuntaria del esfínter interno. Este hecho junto con la relajación voluntaria del esfínter estriado uretral externo promueve el vaciado completo de la vejiga urinaria.
Estudios urodinámicos realizados en la unión uréterovesical, unidad funcional constituida por un componente ureteral (uréter intravesical) y otro vesical (detrusor circundante) (Figura 4), muestran dos tipos de ondas denominadas rápidas y lentas. Las ondas rápidas representan la actividad peristáltica ureteral, la cual favorece el transporte del bolo de orina a través del uréter y su vaciado en la vejiga urinaria, mientras que las ondas lentas, debidas a la influencia del detrusor, impiden el reflujo vesicoureteral una vez evacuado el bolo de orina a la vejiga (30). Estudios in vitro han demostrado un control adrenérgico (31) y colinérgico (32) en la actividad de esta unidad funcional. La inervación adrenérgica desempeña un papel fisiológico en la coordinación del uréter intravesical durante la fase de llenado de la vejiga urinaria. La noradrenalina estimula ambos componentes contráctiles (actividad fásica y tono) de la musculatura lisa ureteral. Dicha respuesta es mediada a través de receptores α1 y α2 adrenérgicos. La relajación de la pared ureteral se produce a través de la estimulación de receptores β1 y β2 adrenérgicos (33). Diversos estudios han demostrado la existencia de una población heterogénea de receptores muscarínicos en el uréter intravesical. Así un 83% de dicha población pertenece al subtipo M2 mientras que el 17% restante está formado por una mezcla de receptores M1, M3 y M4 (34). Estos receptores muscarínicos cuando son estimulados por la acetilcolina provocan la contracción de la musculatura lisa ureteral (35). La existencia de esta rica inervación en el uréter intravesical permite a esta estructura regular el paso del bolo de orina desde el uréter a la vejiga urinaria y el cierre del mismo una vez producida la descarga de la orina a la vejiga, como sucede durante la fase de llenado vesical bajo regulación simpática. Por el contrario, durante la fase de vaciado de orina se produce una potente contracción del musculo detrusor de la vejiga urinaria por acción del sistema nervioso parasimpático. En esta situación la acetilcolina no solo contrae el músculo detrusor sino también el detrusor circundante y el uréter intravesical, es decir la unión uréterovesical, evitando el reflujo vésicoureteral de orina durante la micción de crucial importancia desde el punto de vista patológico.
Diversos estudios han demostrado que el NO, la adenosina, el NPY, el VIP, el CGRP, la 5HT, el H2Sy las taquicininas están involucrados en la neurotransmisión de la unión uréterovesical (36,37,38,39,40). El NO y el CGRP participan en la neurotransmisión inhibitoria ureteral relajando el músculo liso a través de un mecanismo dependiente del GMPc y del AMPc, respectivamente, mediante la activación de canales de K+ sensibles a la glibenclamida. La adenosina modula la neurotransmisión excitadora ureteral y relaja la musculatura lisa a través de receptores purinérgicos P1 postsinápticos del subtipo A2B por un mecanismo independiente del NO o de prostaglandinas (41). El NPY potencia la actividad fásica y el tono ureteral inducidos por la noradrenalina, activando receptores Y2 (42). También, se ha puesto de manifiesto que las taquicininas, péptidos que coexisten en terminaciones primarias sensibles a la capsaicina, están implicadas en la neurotransmisión excitadora no adrenérgica no colinérgica, provocando la contracción del uréter intravesical a través de receptores NK2 (43).
4. CONCLUSIÓN
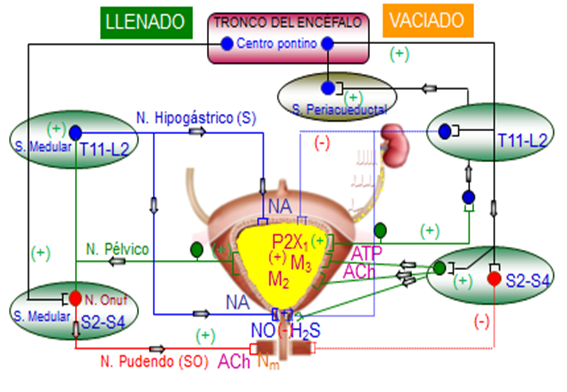
Por todo lo comentado, el almacenamiento y eliminación periódica de orina por el tracto urinario inferior constituye un acto fisiológico automatizado regulado por medio de una rica inervación autónoma y somática que permite generar un complejo mecanismo de coordinación entre la unión uréterovesical, la vejiga urinaria y la uretra (Figura 5).
Figura 5. Regulación nerviosa de la función vesical y uretral (6)
5. REFERENCIAS
1. Abrams P, Blaivas JG, Stanto SL, Andersen JT. The standardization of terminology of lower urinary tract function. Scand J Urol Nephrol Suppl 1988; 114:5-19.
2. Payne CK. Phatophysiology and evaluation of urinary incontinence and overactive bladder. Urology 1998; 51:3-10.
3. Juarranz Sanz M, Terrón Barbosa R, Roca Guardiola M, Soriano Llora T M, Villamor Borrego M, Calvo Alcántara MJ. Tratamiento de la incontinencia urinaria. Atención Primaria 2002; 30:323-332.
4. Mold JW. Pharmacotheraphy of urinary incontinence. Am Farm Physician 1996; 54:673-680.
5. Andersson KE, Wein AJ. Pharmacology of the lower urinary tract: basis for current and future treatments of urinary incontinence. Pharmacological Reviews 2004; 56: 581-631.
6. Hernández Rodríguez MV. Fisiología de las vías urinarias. En: Fisiología Veterinaria. Editor: Albino García Sacristán. Editorial Tébar Flores. Madrid, 2018, pp. 565-575. (ISBN: 978-84-7360-571-7).
7. Andersson KE, Arner A. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiological Reviews 2004; 84: 935-986.
8. De Groat WC, Downie JW, Lewin RM, Longlin AT, Morrison JFB. Basic neurophysiology and neuropharmacology. En: Incontinence, 1st International Consultation on Incontinence. Eds. Abrams P. Khoury S Wein A., Plymouth, UK, Health Publications Ltd, 1999: pp 105-154.
9. García Sacristán A, Casanueva, CR, Castilla C, Labadia A. Adrenergic receptors in the urethra and prostate of the horse. Res Vet Sci 1984; 36: 57-60.
10. Labadia A, Rivera L, Costa G, García Sacristán A. Influence of the autonomic nervous system in the horse urinary bladder. Res Vet Sci 1988; 44: 282-285.
11. Prieto D, Benedito S, Rivera L, Hernández M, García Sacristán A. Autonomic innervation of the equine urinary bladder. Anat Histol Embryol 1990; 19: 276-287.
12. Rivera L, Benedito S, Prieto D, Hernández M, Labadia A, García Sacristán A. and -adrenoceptors in the sheep urinary bladder. Res Vet Sci 1991; 50: 259-263.
13. García Pascual A, Costa G, García Sacristán A, Andersson KE. Calcium dependence of contractile activation of isolated sheep urethra I: Response to electrical stimulation. Pharmacology Toxicology 1991; 69: 263-269.
14. García Pascual A, Costa G, García Sacristán A, Andersson KE. Calcium dependence of contractile activation of isolated sheep urethra II: Response to exogenous noradrenaline. Pharmacology Toxicology 1991; 69: 270-275.
15. Arteaga JL, Orensanz LM, Martinez MP, Barahona MA, Martinez-Saenz A, Fernandes VS, Bustamante S, Carballido J, Benedito S, García Sacristán A, Prieto, D, Hernandez, M. Endothelin ETB receptors are involved in the relaxation to the pig urinary bladder neck. Neurourol Urodyn 2012, 31: 688-694.
16. Andersson KE. Bladder activation: afferent mechanisms. Urology 2002; 59:43-50.
17. Rivera L, Prieto D, Hernández M, Benedito S, García Sacristán A. Distribution and function of cholinergic receptors in the sheep detrusor muscle. J Auton Nerv Syst 1991; 34: 95-102.
18. García Pascual A, Gosta G, Isla M, Jimenez E, García Sacristán A. Potassium-induced contraction in the lamb proximal urethra : involvement of norepinephrine and different calcium entry pathway. J Pharmacol Exp Ther 1991; 256: 127-134.
19. García Pascual A, Costa G, García Sacristán A, Andersson KE. Relaxation of sheep urethral smooth muscle induced by electrical stimulation of nerves: involvement of nitric oxide. Acta Physiol Scand 1991; 141: 531-539.
20. Blaha I, López-Oliva ME, Martinez P, Recio P, Agis-Torres A, Martinez A, Benedito S, García Sacristán A, Prieto D, Fernandes VS, Hernández, M. Bladder dysfunction in obese Zucker rat: Role of TRPA1 channels, oxidative stress and hydrogen sulfide. Oxid Med Cell Longev 2019; 2019: 5641645.
21. Hernández M, Barahona MV, Recio P, Navarro-Dorado J, Bustamante S, Benedito S, García Sacristán A, Prieto D, Orensanz LM Role of neuronal voltage-gated K+ channels in the modulation of the nitrergic neurotransmission of the pig urinary bladder neck. Br J Pharmacol 2008; 153: 1251-1258.
22. Recio P, Barahona MV, Orensanz LM, Bustamante S, Martinez AC, Benedito S, García Sacristán A, Prieto D, Hernández M. 5-hydroxytryptamine induced relaxation in the pig urinary bladder neck. Br J Pharmacol 2009; 157: 271-280.
23. Hernández M, Barahona MV, Recio P, Benedito S, Martinez C, Rivera L, García Sacristán A, Prieto D, Orensanz LM. Neuronal and smooth muscle receptors involved in the PACAP and VIP induced relaxations of the pig urinary bladder neck. Br J Pharmacol 2006; 149: 100-109.
24. Martinez-Sanz A, Recio P, Orensanz LM, Fernándes VS, Martinez MP, Bustamante S, Carballido J, García Sacristán A, Prieto D, Hernández M. Role of calcitonin gene-related peptide in inhibitory neurotransmission to the pig bladder neck. J Urol 2011; 186: 728-735.
25. Arteaga JL, Orensanz LM, Martinez MP, Barahona MV, Recio P, Martinez-Saenz, A, Fernandes VS, Ribeiro ASF, García Sacristán A, Prieto D, Hernández M. Mechanisms involved in endothelin-1-induced contraction of the pig urinary bladder neck. Neurourol Urodyn 2112; 31: 156-161.
26. Ribeiro ASF, Fernandes VS, Martínez MP, Martínez-Sáenz A, Pazos MR, Orensanz LM, Recio P, Bustamante S, Carballido J, García Sacristán A, Prieto D, Hernández M. Neuronal and non-neuronal bradykinin receptors are involved in the contraction and/or relaxation to the pig bladder neck smooth muscle. Neurourol Urodyn 2014; 33: 558-565.
27. Ribero ASF, Fernandes VS, Martínez-Saenz A, Martínez MP, Barahona MV, Orensanz LM, Blaha I, Serrano-Margüello D, Bustamante S, Carballido J, García Sacristán A, Prieto D, Hernández M. Powerful relaxation of phosphodiesterase type 4 inhibitor rolipram in the pig and human bladder neck. J Sex Med 2014; 11: 930-941.
28. Fernandes VS, Ribeiro ASF, Martínez MP, Orensanz LM, Martínez-Saenz A, Barahona MV, Recio P, Bustamante S, Carballido J, García Sacristán A, Prieto D, Hernández M. Endogenous hydrogen sulfide plays a powerful role in the inhibitory neurotransmission to the pig bladder neck. J Urol 2013; 189: 1567-1573.
29. Fernandes VS, Ribeiro ASF, Barahona MV, Orensanz LM, Martínez-Saenz A, Recio P, Martínez AC, Bustamante S, Carballido J, García Sacristán A, Prieto D, Hernández M. Hydrogen sulfide mediated inhibitory neurotransmission to the pig bladder neck: role of KATP channels, sensory nerves and calcium signaling. J Urol 2013; 190: 746-756.
30. Dixon JS, Jen PY, Yeung CK, Chow LT, Mathews R, Gearhart JP, Gosling JA. The structura and autonomic innervation of the vesico-uretic junction in cases of primary uretic reflux. Br J Urol1998; 81: 146-151.
31. Rivera L, Hernández M, Benedito S, Prieto D, García Sacristán A. Mediation of contraction and relaxation by alpha and beta-adrenoceptors in the ureterovesical junction of the sheep. Res Vet Sci 1992; 52: 57-61.
32. Rivera L, Hernandez M, Benedito S, Prieto D, García Sacristán A. Mediation of contraction by cholinergic muscarinic receptors in the ureterovesical junction. J Auton Pharmacol 1992; 12: 175-181.
33. Hernández M, Prieto D, Simonsen U, Rivera L, Barahona MV, García Sacristán A. Noradrenaline modulates smooth muscle activity of the isolated intravesical ureter of the pig through different types of adrenoceptors. Br J Pharmacol 1992; 107: 924-931.
34. Hernández M, García Sacristán A, Orensanz LM. Muscarinis binding sites of the pig intravesical uréter. J Auton Phermacol 1995: 15: 351-359.
35. Hernández M, Simonsen U, Prieto D, Rivera L, García P, Ordaz E, García Sacristán A. Different muscarinic receptor subtypes mediating the phasic activity and basal tone of pig isolated intravesical ureter. Br J Pharmacol 1993; 110: 1413-1420.
36. Hernández M, Prieto D, Orensanz LM, Barahona MV, Jimenez-Cidre M, Rivera L, García Sacristán A, Simonsen U. Involvement of a glibenclamide-sensitive mechanisms in the nitrergic neurotransmission of the pig intravesical ureter. Br J Pharmacol 1997; 120: 609-616.
37. Hernández M, Barahona MV, Simonsen U, Recio P, Rivera L, Martínez AC, García Sacristán A, Orensanz LM, Prieto D. Characterization of the 5-hydroxytryptamine receptors mediating contraction in the pig isolated intravesical ureter. Br J Pharmacol 2003; 138: 137-144.
38. Hernández M, Barahona MV, Recio P, Rivera L, Benedito S, Martínez AC, García Sacristán A, Orensanz LM, Prieto D. Heterogeneity of neuronal and smooth muscle receptors involved in the VIP- and PACAP-induced relaxations of the pig intravesical ureter. Br J Pharmacol 2004; 141: 123-131.
39. Fernandes VS, Ribeiro ASF, Martínez MP, Barahona MV, Orensanz LM, Martínez-Saenz A, Recio P, Benedito S, Bustamante S, García Sacristán A, Prieto D, Hernández M.: Hydrogen sulfide plays a key role in the inhibitory neurotransmission to the pig intravesical ureter. PLoS ONE 2014, 9(11): e113580.
40. Ribeiro ASF, Fernandes VS, Martínez MP, López Oliva ME, Barahona MV, Recio, P, Martinez AC, Blaha I, Orensanz LM, Bustamante S, García Sacristán A, Prieto D, Hernández M. Pre- and post-junctional bradykinin B2 receptors regulate smooth muscle tension to the pig intravesical ureter. Neurourol Urodyn 2016; 35: 115-121.
41. Hernández M, Barahona MV, Bustamante MV, García Sacristán A, Orensanz L. A2B adenosine receptors mediate relaxation of the pig intravesical ureter adenosine modulation of non adrenergic non cholinergic excitatory neurotransmission. Br J Pharmacol 1999; 126: 969-974.
42. Prieto D, Hernández M, Rivera L, García Sacristán A, Simonsen U. Distribution and functional effects of neuropeptide Y on equine ureteral smooth muscle and resistance arteries. Reg Pept 1997; 69: 155-165.
43. Bustamante S, Orensanz LM, Barahona MV, Contreras L, García Sacristán A, Hernández, M. Tachykininergic excitatory neurotransmission in the pig intravesical ureter. J Urol 2000; 164: