El presente trabajo aborda el inicio de la toxicocinética en España por el grupo del Prof. Bartolomé Ribas en los años 60 del siglo pasado, así como la colaboración interdisciplinar que se produce entre académicos de la Real Academia Nacional de Farmacia (RANF) y más concretamente con el grupo del Prof. Rafael Cadórniga, que fue pionero de los estudios de Biofarmacia y Farmacocinética en España. Dicha colaboración científica constituye un magnífico ejemplo del trabajo interdisciplinar entre académicos así como de la fuerte interrelación entre la toxicocinética y la farmacocinética. El trabajo también desarrolla los conceptos, métodos y avances en toxicocinética, incidiendo en los métodos analíticos para la determinación de muy bajas concentraciones de sustancias tóxicas en el organismo animal y humano, los modelos multicompartimentales, los modelos toxicocinéticos con base fisiológica (PBTK), los modelos toxicocinéticos/toxicodinámicos (TX/TD), los modelos poblacionales los métodos bayesianos en toxocicinética así como el futuro de esta disciplina basado también en el uso de metodologías basadas en la inteligencia artificial. Actualmente la toxicocinética juega un papel fundamental en el desarrollo de nuevos medicamentos, así como en la evaluación de la seguridad alimentaria y de los riesgos medioambientales.
Palabras clave: toxicocinética; farmacocinética; ranf; colaboración académica
ABSTRACT:
This paper addresses the beginning of toxicokinetics in Spain by the group of Prof. Bartolomé Ribas in the 60s of the last century, as well as the interdisciplinary collaboration that occurs between academics of the Royal National Academy of Pharmacy (RANF) and more specifically with the group of Prof. Rafael Cadórniga, who was a pioneer of Biopharmacy and Pharmacokinetics studies in Spain. This scientific collaboration is a magnificent example of interdisciplinary work between academics as well as the strong interrelationship between toxicokinetics and pharmacokinetics. The work also develops the concepts, methods and advances in toxicokinetics, focusing on analytical methods for the determination of very low concentrations of toxic substances in the animal and human organism, multicompartmental models, physiologically based toxicokinetic models (PBTK), toxicokinetic / toxicodynamic models (TX / TD), population models, Bayesian methods in toxicokinetics as well as the future of this discipline also based on the use of methodologies based on artificial intelligence. Currently, toxicokinetics plays a fundamental role in the development of new medicines, as well as in the evaluation of food safety and environmental risks.
Keywords: toxicokinetics; pharmacokinetics; ranf; academic collaboration
1. INTRODUCCIÓN
En el antiguo colegio de Fonseca, en Santiago de Compostela, coincidieron, en los años 50 del siglo pasado, dos jóvenes farmacéuticos que llegarían a ser destacados científicos y respetados miembros de la Real Academia Nacional de Farmacia: Rafael Cadórniga Carro y Bartolomé Ribas Ozonas. Ambos desarrollaron una brillante trayectoria profesional comprometida con el cuidado de la salud y la prevención de la enfermedad. Como investigadores, compartieron su entusiasmo por la mejora de la terapéutica farmacológica y la salud pública, objetivos prioritarios de la práctica de la Farmacia en el siglo XXI. Como académicos, su trabajo fue reconocido por los miembros de la Corporación y ambos ocuparon cargos de responsabilidad en la Junta de Gobierno. El Dr. Rafael Cadórniga ocupó la presidencia (1992-1997) y el Dr. Bartolomé Ribas fue Secretario General (2012-2017). En la década de los años 80 del siglo pasado, ambos académicos inician una intensa colaboración científica en al campo de la toxicocinética de metales pesados que se refleja en diversas publicaciones científicas internacionales y que sienta los cimientos de esta disciplina en España.
El objetivo de este trabajo es hacer una revisión de los avances de la toxicocinética en la últimas décadas, a la vez que profundizar en los inicios de esta disciplina en España, lo que constituye un magnífico ejemplo de la colaboración entre grupos y a su vez de la colaboración científica entre académicos de la Real Academia Nacional de Farmacia (RANF).
2. TRAYECTORIA D RAFAEL CADÓRNIGA: EVOLUCIONANDO HACIA LA FARMACOCINÉTICA
Rafael Cadórniga Carro (1927-1999) fue catedrático de Farmacia Galénica en las Facultades de Farmacia en las Universidades de Santiago de Compostela y Complutense de Madrid. Con una sólida formación físico-química, el Dr. Cadórniga inició sus investigaciones estudiando las propiedades superficiales de las agentes tensoactivos y su capacidad para formar micelas coloidales (1). Pronto intuyó la posible aplicación de estas estructuras al diseño de formulaciones de liberación modificada de fármacos. En efecto, las asociaciones entre tensoactivos aniónicos y ciertos fármacos catiónicos modificaba el proceso de absorción, incrementando su biodisponibilidad, cuando se administraban por vía oral. Pronto surgió la necesidad de confirmar el comportamiento de estas asociaciones en modelos experimentales para evaluar las consecuencias del aumento de la biodisponibilidad. El diseño y desarrollo de los Drug Delivery Systems continua siendo en la actualidad un área importante para la investigación farmacéutica. A finales de los años 60 el Dr. Cadórniga analiza el concepto de “availability” por primera vez en la bibliografía española, término que acabaría denominándose “biodisponibilidad”. Los estudios “in-vitro in-vivo” llevaron al Prof. Cadórniga a establecer el concepto de “caducidad biofarmacéutica” que se incorporó posteriormente a los criterios de calidad en la producción industrial de medicamentos (2).
El estudio de los factores que modifican la biodisponibilidad despertó el interés del Prof. Cadórniga por la farmacocinética. Por sus conocimientos en cinética química resolvió con facilidad la aplicación de modelos matemáticos para la caracterización de los parámetros farmacocinéticos, especialmente el aclaramiento y el área bajo la curva de concentraciones en sangre. Sus comentarios sobre la variabilidad intra e interindividual se produjeron con anterioridad a los enunciados por el Prof. Lewis B. Sheiner en la Universidad de San Francisco que permitieron, posteriormente, el desarrollo de la farmacocinética de poblaciones (3).
La incorporación del Prof. Cadórniga al Hospital Clínico Universitario de Santiago de Compostela como Jefe de Servicio de Farmacia Hospitalaria facilitó, sin duda, la colaboración con diferentes especialistas médicos y muy especialmente con el Prof. José Peña Guitian, catedrático de Pediatría, con el que inició los programas de Farmacocinética Clínica. Estos programas se dirigieron, en principio, a mejorar la calidad del tratamiento en niños epilépticos, ampliándose posteriormente a otras áreas de la terapéutica farmacológica.
El Prof. Rafael Cadórniga ingresó, como Académico de Número en la Real Academia Nacional de Farmacia el 14 de Abril de 1983. Su discurso de ingreso titulado “Vigencia de la educación farmacéutica. Posible proyección a un futuro” recoge su experiencia como docente e investigador manifestando las necesidades de un cambio en los estudios de Farmacia que ya eran una realidad en los Estados Unidos y en los países más adelantados de Europa. Esta concepción de la farmacia fue anticipada por el Dr. Gerad Levy, profesor de ciencias farmacéuticas en la Universidad de Buffalo (New York). En 1980 publicó en la revista Pharm Inter las nuevas exigencias que se requerían para la formación de los futuros farmacéuticos que incorporaban, entre otras disciplinas, la Biofarmacia y la Farmacocinética (4).
El Prof. Cadórniga fue un pionero en el campo de la Biofarmacia y Farmacocinética y contribuyó decisivamente en la incorporación de estas disciplinas en los planes de estudio de la licenciatura de Farmacia. Esta aportación ha sido reconocida en todo el ámbito sanitario, como recordaba, con especial sensibilidad, en un homenaje celebrado en el Ministerio de Sanidad, uno de sus buenos amigos, el ilustre farmacólogo y miembro de la Academia, el Prof. Juan Tamargo Menéndez. En el mismo sentido se pronunciaron los ponentes que participaron en la sesión necrológica organizada por la Real academia Nacional de Medicina el 26 de Octubre de 1999. En este acto académico, el Prof. Espinos Pérez, catedrático de Patología Médica y miembro de la Corporación, señalaba: “Gracias al extraordinario perfeccionamiento en la metodología analítica y sus conocimientos de informática, el Prof. Cadórniga contribuyó decisivamente al desarrollo de la Farmacocinética tanto en la docencia como en la investigación farmacéutica”. En 1984 el Prof. Cadórniga recibía la medalla de honor del Scientific Committee of European Congress of Biopharmaceutics and Pharmacokinetics, en reconocimiento a sus importantes contribuciones que forman ya parte de la historia de estas disciplinas (5).
Durante más de 20 años el Dr. Cadórniga colaboró estrechamente con investigadores españoles y extranjeros de reconocido prestigio como los doctores D. Breimer, J. Hirtz, W. Rischel, L. Zatureski, etc., quienes le tuvieron especial aprecio personal. Su escuela, iniciada en la Universidad de Santiago hace 70 años se extendió pronto a otras universidades españolas donde jóvenes profesores universitarios e investigadores de la cuarta generación están hoy en la vanguardia de la investigación en las áreas de tecnología farmacéutica, biofarmacia y farmacocinética.
3.TRAYECTORIA DE BARTOLOMÉ RIBAS. LOS INICIOS DE LA TOXICOCINÉTICA EN ESPAÑA
El Prof. Ribas Ozonas completó su formación en París como becario estudiando técnicas fisiológicas y farmacológicas, radiobiología y utilización de radioelementos lo que tendría gran influencia en su brillante carrera como investigador incorporado a centros oficiales como el Consejo Superior de Investigaciones Científicas y el Instituto de Salud Carlos III, donde ocupó la plaza de Jefe de Área de Toxicología.
La actividad investigadora del Prof. Ribas se desarrolló principalmente en el campo de la toxicología analítica, estudiando el comportamiento de los metales pesados desde un punto de vista sanitario. Su preocupación por los efectos tóxicos de estas sustancias fue para él una prioridad en toda su carrera profesional. Los metales pesados ingresan en el organismo por diferentes vías como el agua, el aire, los alimentos y, ocasionalmente, la exposición cutánea. Una vez que alcanzan la circulación sistémica se distribuyen en diferentes órganos y tejidos, alcanzando, incluso, el sistema nervioso central. Cuando la exposición es crónica se llega a producir una acumulación, que se asocia a efectos tóxicos con variedad de manifestaciones. Los metales pesados alteran diferentes mecanismos celulares afectando al crecimiento, diferenciación, procesos de reparación y apoptosis. Algunos metales pesados pueden producir alteraciones epigenéticas que afectan a la expresión de los genes. Los mecanismos de acción son similares en los metales pesados, incluyendo generación de ROS, destrucción de las defensas antioxidantes, inhibición enzimática y stress oxidativo (6).
El Dr. Ribas Ozonas ingresa en la Real Academia Nacional de Farmacia el 5 de Abril de 1990 con el discurso titulado “Tóxicos metálicos y búsqueda de nuevos marcadores” (7). En su exposición recurre a la denominación de tóxicos metálicos en línea con las nuevas tendencias que se inclinan por el cambio de metales pesados. En una reciente publicación en el International Journal of Environmental and Public Health, se afirma “para ser consecuente los investigadores deberían utilizar correctamente las definiciones aceptadas. La serie V a Zn son considerados metales de transición, As es un metaloide, Se es un no metal y Ba es un alcalinotérreo. La denominación de metales pesados se ha puesto en cuestión estos últimos años a pesar de que su uso es habitual en la bibliografía internacional. La principal razón es que debería recurrirse a una expresión que haga referencia a su importancia química y biológica. Por ello varios autores han propuesto considerarles “elementos potencialmente tóxicos” que es una denominación más acertada para estos elementos químicos, muchos de los cuales son responsables de graves intoxicaciones (8).
A partir de 1960 el Prof. Ribas Ozonas inicia sus publicaciones sobre la exposición de metales pesados como el cinc, níquel, rubidio, cadmio, etc., en animales de laboratorio. Sus principales objetivos fueron conocer la absorción oral de algunos de estos elementos, caracterizar su distribución tisular y valorar las consecuencias de su acumulación cuando los animales estaban expuestos a administraciones prolongadas o a sobredosificación. Además, trató de establecer posibles relaciones entre la acumulación tisular y los efectos tóxicos en los animales. Un buen ejemplo fue la relación de los efectos neurológicos de cadmio y níquel con la acumulación en estructuras cerebrales (9-12).
En algunas de estas publicaciones figura como coautor el Prof. Santos Ruiz, insigne farmacéutico, catedrático y destacado miembro de esta Real Academia de la que fue director.(1976-1991). El Dr. Ribas se incorporó temporalmente a la cátedra de Bioquímica que gozaba de gran prestigio en la Universidad Complutense. A finales de los años 70 se incorpora como coautora la Dra. Sainz Vadillo, colaboradora del Prof. Cadórniga, lo que refleja el inicio de la colaboración con la cátedra de Farmacia Galénica de la Universidad Complutense (13-14).
4. IMPORTANCIA DE LA COLABORACIÓN INTERDISCIPLINAR
En octubre de 1975 el Prof. Rafael Cadórniga toma posesión como nuevo catedrático de Farmacia Galénica en la Universidad Complutense de Madrid. Sustituye en el cargo a otro ilustre miembro de la Real Academia Nacional de Farmacia, el Prof. Eugenio Sellés Martí (1904-1997) con motivo de su jubilación. A comienzos de 1976 se produce el reencuentro entre los Dres. Cadórniga y Ribas después de 25 años de un trabajo intenso y productivo en las aulas y laboratorios. El Dr. Ribas acudió al encuentro con el Dr. Cadórniga por sus conocimientos sobre farmacocinética para aplicar los tratamientos matemáticos al estudio de la exposición de animales de laboratorio a diferentes metales pesados. Para el Prof. Ribas era de interés caracterizar correctamente los procesos de absorción, distribución y eliminación de estos elementos tóxicos. Ello le permitiría establecer relación entre la bioacumulación y los efectos tóxicos que afectaban a órganos y tejidos, como, por ejemplo, las alteraciones neurológicas o metabólicas. El reencuentro de estos dos científicos permitió establecer las bases para una investigación interdisciplinar sobre toxicocinética de los metales pesados en modelos experimentales. Aunque los progresos en los métodos analíticos y en los sistemas de cálculo en los parámetros que definen la exposición han cambiado radicalmente debe destacarse esta colaboración entre dos destacados miembros de la Real Academia Nacional de Farmacia hace más de 40 años.
El primer trabajo firmado por los Doctores Ribas y Cadórniga se publica en la Revista Española de Fisiología en 1984 aunque con anterioridad se habían presentado varias comunicaciones en congresos nacionales e internacionales. El trabajo, titulado “Farmacocinética del cadmio-109 en sangre y en estructuras cerebrales de rata” se ocupó del cálculo de los parámetros farmacocinéticos de este radionuclido aplicando modelos compartimentales (15). Los valores experimentales medidos con un contador gamma Packar 5110 se ajustaron a un modelo bicompartimental abierto, que permiten caracterizar con precisión la curva bioexponencial obtenida tras la administración, por vía intravenosa de una dosis de 20μCi de cadmio-109. La posible asociación de ciertos efectos neurológicos del cadmio y su capacidad de acceso al sistema nervioso central se estudió su distribución en estructuras cerebrales como hipotálamo, mesencéfalo, cerebelo, etc. Después de la administración intracerebroventricular se comprueba la permanencia del Cd en el compartimento cerebral, existiendo un intercambio entre las estructuras cerebrales y el líquido cefalorraquídeo. Con esta publicación se inició formalmente la colaboración interdisciplinar en el campo de la farmacocinética, siendo la Real Academia de Farmacia el punto de encuentro entre ambos científicos.
En los años siguientes continuó la colaboración interdisciplinar en las que intervinieron los equipos del Prof. Cadórniga y del Prof. Ribas. Se ampliaron los estudios toxicocinéticos a otros metales pesados responsables de intoxicaciones en humanos y en diversas especies animales. Entre ellos destacan el Níquel, Rubidio, Zinc, etc. Los resultados de esta investigación se presentaron en congresos nacionales y extranjeros publicándose posteriormente (16-19).
Los estudios toxicológicos permiten conocer los efectos adversos de los productos químicos sobre órganos diana y predecir variables tan importantes como la capacidad de acumulación o la relación dosis-respuesta. Para conocer la toxicidad se requieren ensayos recurriendo a animales de laboratorio como modelos experimentales. Además deben seguirse protocolos estrictos para evitar el sufrimiento de estos modelos animales como exigen las normas establecidas por numerosos organismos e instituciones científicas.
El Dr. Ribas Ozonas es consciente de las posibilidades que ofrecen los modelos animales en los estudios toxicológicos y del control al que deben estar sometidos estos experimentos, como se recoge en este párrafo: “En ausencia de datos en humanos, la investigación con animales de experimentación es el método más fiable para detectar los efectos tóxicos más importantes que producen las sustancias químicas y para predecir los riesgos para los humanos y para la salud ambiental”.
A pesar de la gran utilidad de estos ensayos desde el siglo XIX se ha producido un intenso debate sobre la conveniencia de su uso indiscriminado. El conocido principio de las tres erres (reemplazo, reducción y refinamiento) fue enunciado por primera vez en el libro Principles of Humane Technique publicado en 1959 y considerado en la Directiva 2010/63/UE del Parlamento Europeo y del Consejo de 22 de septiembre de 2010 relativa a la protección de los animales utilizados para fines científicos (texto pertinente a efecto del EEE). Todo ello ha llevado a promocionar la investigación toxicológica por métodos alternativos.
La Asociación Española de Toxicología se adhiere al “Acuerdo de Transparencia en experimentación animal promovido por la Confederación de Sociedades Científicas de España (COSCE)” en colaboración con la Asociación Europea para la investigación animal publicado en 2016. El documento reconoce el papel relevante de la investigación en modelos experimentales en el área de la salud y particularmente en el progreso de la Medicina. Sin el uso de animales no dispondríamos de la mayoría de medicamentos, incluidas vacunas, así como de determinadas técnicas quirúrgicas que se aplican en medicina humana y veterinaria.
Los principales métodos alternativos recurren a diferentes estrategias, siendo las más relevantes: a) utilizar organismos tales como bacterias, hongos, plantes o invertebrados que sustituyen, en los experimentos, a los animales de laboratorio; b) utilizar modelos matemáticos in silico para la predicción e integración de los datos; c) utilizar embriones en las etapas iniciales de peces, anfibios, reptiles y mamíferos; d) recurrir a métodos in vitro: órganos y cultivos celulares, estrategias de experimentación integrada (Integrated Texturing Strategies).
El profesor Ribas recoge en su discurso de ingreso en la Real Academia Nacional de Farmacia y en algunas de sus publicaciones de los años 80 aportaciones en la búsqueda de marcadores para los metales pesados de interés toxicológico. Así analiza los posibles marcadores para evaluar la nerfrotoxicidad y discute la evolución de los resultados analíticos para la separación de proteínas en la orina de los animales, desde las técnicas clásicas como la filtración o la cromatografía a las últimas técnicas instrumentales. Debemos también destacar sus experiencias con la metalotioneina asociada con la intoxicación por cadmio. El Dr. Ribas detalla sus experiencias con la cromatografía líquida de alta eficacia en la evaluación de las isometalotioneinas para su aplicación en toxicología. Sin duda se estaba acercando a los biomarcadores de exposición que serían fundamentales para los estudios toxicocinéticos (7).
El Instituto Nacional de la Salud de EE.UU. define al biomarcador como “aquella característica que puede ser medida de forma objetiva y evaluada como un indicador de un proceso biológico normal o una respuesta farmacológica a un agente terapéutico. Ejemplos bien conocidos son la medida de la filtración glomerular o de la presión sanguínea”. Posteriormente esta definición se extiende al uso de agentes tóxicos para los seres vivos como los metales pesados y diferentes contaminantes del medio ambiente. El Dr. Ribas en sus investigaciones sobre la exposición a metales pesados expresaba, en los años sesenta la siguiente reflexión: “Se necesita con urgencia disponer de biomarcadores de exposición a tóxicos en dosis subclínicas y a aquellas dosis que actualmente estamos recibiendo en nuestras dietas e inhalando en nuestra atmósfera. Ello nos permitirá no solo conocer la sintomatología o la patogenia sino también detectar a nivel molecular las modificaciones previas a los mecanismos de regulación homeostática” (20-21).
Actualmente los biomarcadores se agrupan en: biomarcadores de exposición, biomarcadores de efecto y biomarcadores de susceptibilidad. Los primeros son sustancias exógenas o sin metabolitos o una interacción entre un agente xenobiótico y alguna diana molecular o celular.
El desarrollo de las técnicas analíticas ha permitido medir con exactitud y precisión cantidades muy bajas de los contaminantes potencialmente tóxicos, como los metales pesados. En definitiva, las concentraciones en fluidos biológicos y tejidos permiten predecir la posible toxicidad de los metales pesados, uno de los objetivos de la toxicocinética.
Mejorar la seguridad de los procesos de fabricación ha sido un objetivo prioritario para muchos sectores industriales como la minería, las fundiciones, la metalurgia, etc. Los accidentes y demandas laborales por contaminación llegaban a afectar a la economía de las empresas lo que obligó a tomar medidas correctoras en los manuales de procedimiento. Aunque la iniciación de los programas de seguridad se inician con la revolución industrial, su impulso definitivo se asocia con la revuelta de Chicago en 1886 con las reivindicaciones laborales de trabajo. A principios del siglo XX la Universidad de Harvard ofrece la primera licenciatura en Seguridad e Higiene en el Trabajo, se crean la Organización Internacional del Trabajo (OTI) y el Servicio de Prevención de Accidentes en Europa. Antes de 1950 toda esta actividad se convierte en una ciencia dedicada a minimizar los riesgos en el trabajo ante los nuevos procesos industriales. Lamentablemente los programas de mejora de la seguridad en la salud se establecieron con retraso en relación con los sectores industriales y muchas empresas de servicios.
La ciencia, la tecnología y la innovación han adquirido un gran desarrollo en los últimos años y se ha convertido en un determinante fundamental para el crecimiento y la competitividad. En el área de la salud este crecimiento se ha reflejado en una reducción de la morbimortalidad de las enfermedades y una mejora en la calidad de vida de aquellos pacientes con enfermedades crónicas.
En los proyectos de I+D+I se habla ampliamente de conceptos como la investigación multidisciplinar o investigación interdisciplinar. De hecho en el Horizonte Europa: un nuevo programa marco de la Unión Europea (2021-2027) hace especial incidencia en los programas de colaboración entre instituciones, equipos e investigadores.
La investigación entre disciplinas es hoy imprescindible para poder avanzar en el progreso científico y en el desarrollo tecnológico. Los científicos de las diferentes disciplinas deben plantearse nuevos retos y reconocer la necesidad de progresar frente a ellos a través de una investigación entre disciplinas bien sean multidisciplinar o interdisciplinar. La investigación multidisciplinar se aplica cuando los investigadores de diferentes disciplinas trabajan de forma independiente en un problema para una investigación común. Los investigadores permanecen dentro de su área y modelos a la investigación pero la abordan desde la perspectiva de la propia disciplina. Los resultados de la investigación, en este caso son complementarios entre sí.
La National Science Foundation define la investigación interdisciplinar como “una forma de investigación de individuos o equipos que integra información, datos, técnicas, herramientas, perspectivas, conceptos y teorías de dos o más disciplinas. Comprender o resolver problemas cuyas soluciones están más allá del alcance de una sola disciplina o área de investigación. Durante décadas la investigación interdisciplinar presentó dificultades para su desarrollo. Las denominadas “islas de investigación” eran habituales tanto en universidades como en centros de investigación.
Desde la perspectiva individual el trabajo interdisciplinario requiere mentes abiertas dispuestas a permitir lo nuevo, actitud para ir más allá del área de interés personal tradicional y aceptar la irrupción de lo diferente incluso al interior de lo que se considera de dominio propio.
La asociación del Prof. Cadórniga y el Prof. Ribas, destinada a progresar en el conocimiento de la toxicocinética de metales pesados en modelos experimentales, merece ser destacada por varios motivos:
- Esta asociación se produce hace más de 40 años cuando los investigadores trabajaban en condiciones precarias y con escaso apoyo institucional. Los intercambios de investigadores eran escasos y casi siempre se trataba de iniciativas personales.
- Se trata de un buen ejemplo de asociación en el que se progresa con dos disciplinas que en aquellos momentos tienen escaso arraigo en los estudios de Farmacia en España.
- La asociación estaba dirigida por dos ilustres farmacéuticos miembros de la Real Academia Nacional de Farmacia que alcanzaron cargos representativos en nuestra Corporación.
Finalmente, es interesante recordar las palabras de la Dra. Elizabeth H. Blackburn, especialista en Bioquímica y Premio Nobel de Medicina en 2009 por sus estudios sobre la telomerasa: “Una de las cosas realmente interesantes de investigar es la interdisciplinaridad. Hace unos años nunca hubiera pensado en la posibilidad de colaborar con psicólogos. Si hace diez años me hubieras dicho que estaría pensando seriamente en la meditación, hubiera dicho que uno de los dos estaba loco” (22).
5. TOXICOCINÉTICA: CONCEPTOS Y ESTADO ACTUAL
Actualmente está adquiriendo una gran importancia la evaluación de riesgos toxicológicos, no solo por parte de componentes individuales como pesticidas, metales pesados, etc. sino también de mezclas de compuestos. Todo ello hace que cada vez adquiera más importancia el conocimiento de los procesos cinéticos y de acumulación de tóxicos a través de la toxicocinética así como sus efectos, tanto en el hombre por exposición a ciertos xenobióticos, como en especies animales sometidas a riesgos medioambientales (23,24).
Se define la toxicocinética como el conjunto de procesos de ADME, es decir absorción, distribución, metabolismo y excreción de sustancias toxicas en el organismo. La toxicocinética juega por lo tanto un papel relevante en la evaluación de la disposición y acumulación de sustancias tóxicas, así como en la respuesta del organismo a estos agentes a través de una disciplina complementaria denominada toxicodinámica. Los fundamentos de la toxicocinética hay que buscarlos en la farmacocinética, con la que guarda una fuerte relación y con la que comparte objetivos y métodos de trabajo.
La toxicocinética juega un papel fundamental en el marco de los estudios toxicológicos, complementariamente a otras áreas de estudio como Genotoxicidad, Toxicidad (subcrónica y crónica), carcinogénesis, toxicología reproductiva, inmunotoxicidad, etc.
En el hombre, la toxicocinética puede considerarse como una rama dentro de la toxicología clínica que constituye una especialidad médica orientada al diagnóstico y tratamiento de las intoxicaciones. Las implicaciones actuales de la toxicocinética son muy numerosas en campos como el desarrollo de fármacos, toxicología reproductiva o la toxicocinética de metales pesados, entre otros (25,26). La toxicocinética tiene impacto en la nanomedicina a través de la evaluación de la toxicidad hepática de sistemas nanoparticulares (27).
Las publicaciones en el campo de la toxicocinética son numerosas a nivel internacional, especialmente desde los años 90. En España los primeros trabajos de toxicocinética sobre metales pesados se publican por parte del grupo del profesor Bartolomé Ribas de la Universidad complutense, en los años 80 y 90 del siglo pasado, algunos de ellos en colaboración con el grupo de profesor Rafael Cadórniga ya mencionadas en este artículo (16, 17, 18). Posteriormente se han realizado interesantes aportaciones en este campo por parte de otros grupos españoles (28, 29, 30).
5. 1. Avances en toxicocinética
Las bases científicas de la toxicocinética hay que buscarlas en la farmacocinética, considerando que muchos de los métodos y modelos que se utilizan para evaluar el comportamiento farmacocinético y farmacodinámico, como los modelos in silico, los modelos compartimentales y fisiológicos, la cinética de poblaciones o la estadística bayesiana, entre otros, se aplican en la actualidad para el análisis de datos toxicocinéticos.
5. 2. Avances analíticos en estudios toxicocinéticos
La determinación de niveles plasmáticos y tisulares de xenobióticos y otros elementos potencialmente tóxicos, habitual en el campo de la toxicocinética, requiere la utilización de técnicas analíticas específicas y sensibles, que permiten determinar con precisión los niveles de estas sustancias y sus metabolitos. Estos métodos pueden utilizarse en estudios de extrapolación cuantitativa in vitro in vivo (QIVIVE por sus siglas en inglés) y especialmente en estudios toxicocinéticos de disposición de elementos potencialmente tóxicos que requieren la cuantificación de estas sustancias en plasma y en diversos tejidos, tanto en especies animales como en el hombre (31,32).
Considerando las bajas concentraciones de sustancias tóxicas en sangre y tejidos, se requieren técnicas analíticas altamente sensibles y precisas para su cuantificación en tejidos y fluidos biológicos. La cromatografía liquida de alta resolución acoplada a detectores de espectrometría de masas (LC-MS por sus siglas en inglés) constituye una de las técnicas analíticas más interesantes ya que permite conseguir una alta especificidad y gran sensibilidad en la cuantificación de concentraciones muy bajas de tóxicos en diferentes tipos de matrices (32,33). Paralelamente, el desarrollo y validación de métodos analíticos siguiendo normativa internacional ICH/FDA, bajo un sistema de calidad, como las buenas prácticas de laboratorio (GLP por sus siglas en inglés) permite cubrir este objetivo (34).
5.3. Modelos in silico
Se han realizado diversos avances en las etapas de descubrimiento y desarrollo de nuevos fármacos, a través de modelos in silico para la predicción de propiedades farmacocinéticas de nuevos compuestos (ADME) y su relación con la toxicidad (ADME/Tox) (35,36,37).
Recientemente, modelos in silico basados en la inteligencia artificial mediante técnicas de Machine learning han sido utilizados para predecir el comportamiento toxicocinético de 65 compuestos de diferentes clases utilizando un modelo farmacocinético/toxicocinético con base fisiológica (36).
También se ha prestado atención al impacto de proteínas transportadores de fármacos y sus polimorfismos en la toxicocinética y la toxicidad de pesticidas. Estudios in vitro combinados con métodos in silico, han demostrado que algunos pesticidas modulan la actividad y la expresión de transportadores de fármacos así como la relevancia in vivo de este tipo de interacciones en el hombre, cuando ha sido expuesto a sustancias contaminantes presentes en el medio ambiente (38).
5.4. Modelos compartimentales
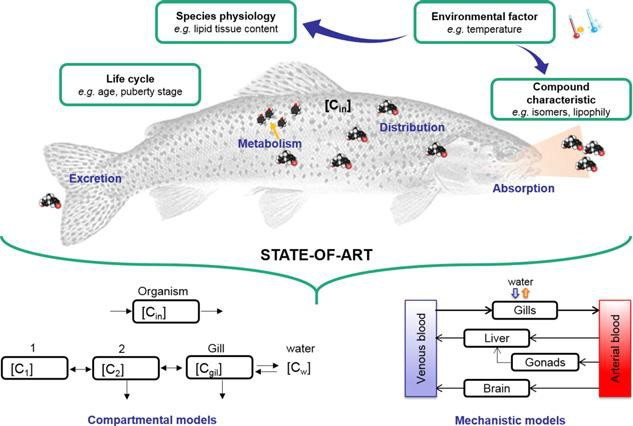
El análisis cinético de la acumulación de sustancias tóxicas en el organismo animal o humano se ha reflejado en diversas publicaciones que recurren al análisis farmacocinético convencional, basado en la utilización de modelos compartimentales y fisiológicos, para evaluar el comportamiento toxicocinético de diferentes compuestos y que permite, entre otras aplicaciones, la evaluación de riesgos medioambientales en diferentes ecosistemas (39,40). La Figura 1 muestra la aplicación de diferentes tipos de modelos toxicocinéticos, principalmente compartimentales y fisiológicos para la evaluación de riesgos medioambientales producidos por sustancias químicas (41).
Figura 1.- Aplicación de diferentes tipos de modelos toxicocinéticos para la evaluación de riesgos medioambientales producidos por sustancias químicas (41). Reproducido con permiso.
Se han propuesto diferentes tipo de modelos toxicocinéticos multicompartimentales para caracterizar la disposición de diferentes sustancias tóxicas. La toxina Tricoteceno-2 (T-2) es una micotoxina producida por especies de Fusarium que puede suponer un grave riesgo para la salud animal y humana. Un modelo tricompartimental toxicocinético que considera rápida y lenta metabolización ha sido utilizado para caracterizar la disposición de la toxina T2 en gambas tras su administración por vía intramuscular (39).
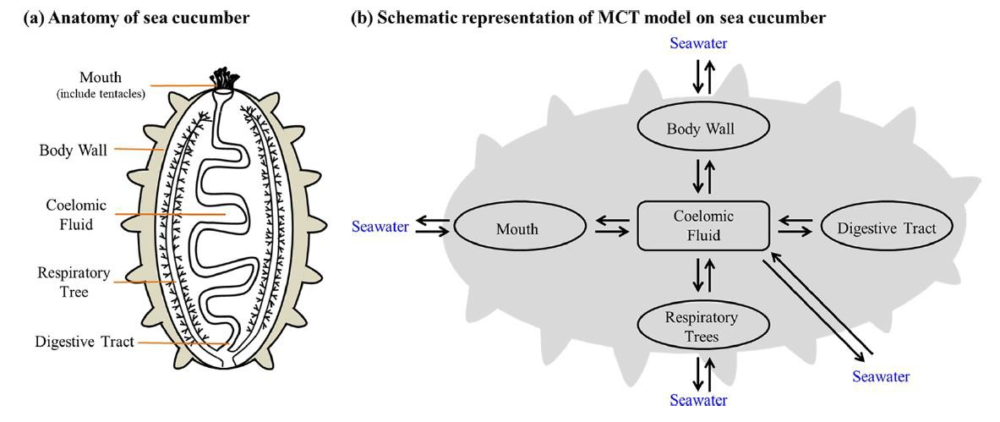
También se han utilizado modelos toxicocinéticos multicomparrimentales para caracterizar la bioacumulación y el metabolismo de diferentes antibióticos en el pepino de mar. Considerando la anatomía de los pepinos de mar el modelo considera cinco compartimentos, pared del cuerpo, boca, árboles respiratorios, tracto digestivo y líquido celómico como se observa en la Figura 2. El modelo permite predecir la acumulación y el metabolismo de antibióticos como sulfadiazina, trimetoprim, enroflozacino, ofloxacino, claritromicina y azitromicina en las diferentes estructuras anatómicas por exposición a dichos antibióticos en el agua de mar a diferentes concentraciones (40).
Figura 2.- Modelo toxicocinético multicompartimental para caracterizar la disposición de antibióticos en diferentes estructuras anatómicas del pepino de mar (40). Reproducido con permiso
5.5. Modelos poblacionales
Los modelos poblacionales han adquirido un enorme auge en los últimos años, especialmente en el campo de la farmacocinética clínica (42). Los modelos farmacocinéticos de población desarrollados por Lewis B. Sheiner y Stuart L. Beal en la década de los años 80 del siglo pasado, abordan el estudio de la variabilidad inter e intraindividual en la farmacocinética cuando el fármaco se administra en un grupo de población con características definidas (43,44). Un modelo de población está constituido por un modelo estructural y un modelo de varianza. El modelo estructural está a su vez constituido por un modelo farmacocinético habitualmente compartimental como los modelos mono y bicompartimental y un modelo de regresión. El modelo de regresión correlaciona parámetros fundamentales del modelo como el aclaramiento de eliminación el volumen aparente de distribución con covariables demográficas y clínicas que inciden en la farmacocinética. Adicionalmente los modelos poblacionales optimizan un modelo de varianza que cuantifica la magnitud de la variabilidad interindividual de los parámetros farmacocinéticos y la variabilidad residual de las concentraciones plasmáticas (42).
En los últimos años se han desarrollado modelos poblaciones en el campo de la toxicocinética de diferentes elementos tóxicos como metilmercurio (MeHg) en animales y en el hombre, habiéndose evaluado, por ejemplo, la relación entre la ingesta y las concentraciones así como la semi-vida de metilmercurio en el hombre utilizando un modelo toxicocinético poblacional (45,46).
Los modelos poblacionales en el campo de la toxicocinética pueden extenderse también a nivel toxicodinámico apareciendo los modelos toxicocinéticos/toxicodinámicos (TX/TD por sus siglas en inglés). Diversos autores han planteado utilizar modelos toxicocinéticos-toxicodinámicos (TX/TD) para la evaluación de riesgos ambientales en el campo de la ecotoxicología (47,48).
Como ejemplo, se han propuesto diferentes modelos TX/TD experimentales para evaluar los efectos letales en el crustáceo Daphnia magna expuesto a la acción de pesticidas agrícolas como trifeniltina (TFT). Este modelo se basa en la utilización de un modelo cinético monocompartimental asociado a un modelo probabilístico de supervivencia (49). Asimismo y utilizando un modelo poblacional cruzado colaborativo en ratones, se ha podido demostrar la compleja relación entra el perclorometileno (PERC) y su metabolito primerio triclorometano (TCA) en diferentes tejidos a nivel toxicocinético y toxicodinámico (50,51).
También se han desarrollado modelos de este tipo para simular la toxicidad crónica del cobre en el mejillón cebra, expresada en base al estrés oxidativo y basado en el reparto del cobre en fracciones subcelulares. Este modelo permite evaluar la absorción, metabolismo, desintoxicación y eliminación así como los niveles de metal en los lugares de acción relacionados con la respuesta tóxica (52).
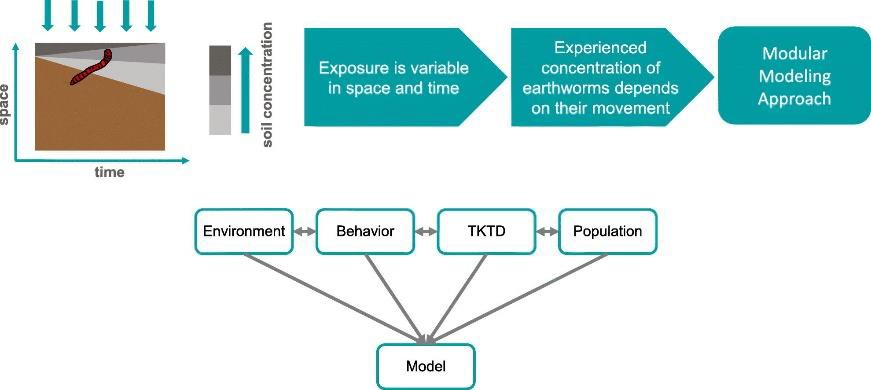
Se ha propuesto la utilización de modelos TK/TD espaciotemporales para la evaluación de riesgos medioambientales de productos químicos en organismos del suelo como las lombrices de tierra.
Este tipo de modelos espacio-temporales considera simultáneamente la evaluación de la exposición y el efecto. El modelo de exposición utiliza información espacio-temporal sobre variables ambientales como temperatura, humedad, contenido en materia orgánica y concentración de determinados productos químicos. El modelo de comportamiento utiliza la información del modelo de exposición para simular la alimentación y el movimiento de diferentes especies de lombrices. El modelo TK/TD está acoplado a un modelo de población que incorpora modelos de comportamiento poblacional de diferentes especies de lombrices de tierra como se observa en la Figura 3 (53).
Figura 3.- Modelos TK/TD espacio-temporales para simular la exposición a variables ambientales y su efecto en organismos del suelo (53). Reproducido con permiso
5.6. Modelos toxicocinéticos con base fisiológica (PBTK)
Los modelos farmacocinéticos con base fisiológica conocidos como modelos PBPK se introducen en el campo de la farmacocinética hacia finales de la década de los años 60 del siglo pasado y actualmente constituyen una herramienta habitual en el análisis farmacocinético de muchos fármacos, tanto en especies animales como en el hombre (54,55). A diferencia de los modelos compartimentales basados en ecuaciones poliexponenciales y constantes de velocidad de primer orden u ordenes alternativos, los modelos PBPK consideran al organismo dividido en compartimentos anatómicos como sistema circulatorio, órganos y tejidos. Estos modelos utilizan ecuaciones diferenciales ordinarias para el balance masa del fármaco en organismo, y parámetros con base fisiológica como el flujo sanguíneo, la permeabilidad de las membranas biológicas, el peso o tamaño de los tejidos o isotermas de fijación a estructuras celulares e intracelulares (56).
El concepto de modelos PBPK asociado habitualmente a la disposición de fármacos se sustituye por el acrónimo PBTK (por sus siglas en inglés) cuando se utilizan modelos con base fisiológica para evaluar el comportamiento toxicocinético de diferentes sustancias. En la década de los años 90 ya se propuso la utilización de un modelo poblacional toxicocinético PBTK para evaluar la distribución y eliminación de Benzeno y sus metabolitos en el hombre y este tipo de modelos comienzan a utilizarse en el campo de la toxicocinética coincidiendo con el cambio de siglo (57-62).
En los últimos años se ha observado un importante auge en la utilización de modelos PBTK para evaluar datos toxicocinéticos de diferentes sustancias (63-82). Como ejemplo, este tipo de modelos se han utilizado para caracterizar la toxicocinética y su variabilidad de sustancias como percloroetileno en ratón o para la disposición de contaminantes orgánicos como benzopireno y sus metabolitos en el esturión blanco (63,83). Diversos autores han utilizado modelos con base fisiológica, en los que se han incluido datos de respuesta toxicodinámica incluidos en modelos mixtos integrados, denominados modelos PBTK-TD (por sus siglas en inglés) (60,74,77).
Como ejemplo, se ha utilizado un modelo PBTK-PD para evaluar la bioacumulación de arsénico en peces de la especie Tilapia así como sus implicaciones para la salud humana a través del consumo alimentario de esta especie por el hombre (60). también se ha recurrido a este tipo de modelos para evaluar la toxicocinética y toxicodinámica de cadmio y plomo en pez cebra. el modelo consta de un submodelo pbtk que permite predecir la captación y disposición de los metales y un modelo toxicodinámico que predice la acumulación del metal en el cuerpo del animal hasta que se supera un umbral de concentración que incrementa la probabilidad de mortalidad (74).
Recientemente se han utilizado este tipo de modelos para evaluar la disposición de 4- nonylphenol (4-np) en el hombre y los cambios asociados a la edad evaluando la toxicidad en células epiteliales. El modelo permite predecir los cambios toxicocinéticos y toxicodinámicos de 4-np asociados con la edad, con importantes implicaciones en la evaluación de riesgos en el hombre por exposición a sustancias tóxicas ambientales (77).
5.7. Métodos bayesianos en toxicocinética
La necesidad de individualizar el comportamiento toxi- cocinético en humanos o en diferentes especies animales, disponiendo de información experimental limitada, hace que progresivamente se hayan introducido los métodos bayesianos en el campo de la toxicocinética. El método bayesiano permite individualizar los parámetros que definen el perfil toxicocinético de una sustancia, utilizando conjuntamente datos de concentración plasmática de la sustancia, con parámetros de población correspondientes a modelos poblacionales toxicocinéticos. Los antecedentes de la estadística bayesiana, con importantes implicaciones en la dosificación individualizada de fármacos, hay que buscarlos en el campo de la farmacocinética clínica y actualmente este tipo de metodología juega un papel fundamental en la dosificación de precisión basada en modelos (MIPD por sus siglas en inglés).desde hace dos décadas la estadística bayesiana comienza a utilizarse en el campo de la toxicocinética (42,84,85).
En estadística bayesiana, el comportamiento poblacional de la sustancia tóxica en humanos o en diferentes especies animales constituye la probabilidad previa de la hipótesis que se combina con información adicional sobre los niveles séricos de la sustancia tóxica en humanos o en la especie animal estudiada. Una estimación de la probabilidad máxima a posteriori (MAP por sus siglas en inglés) mediante métodos de regresión no lineal, o incluso recurriendo a métodos de inteligencia artificial como las redes neuronales artificiales, permite establecer de forma individualizada los parámetros toxicocinéticos en el hombre o en la especie animal estudiada (86).
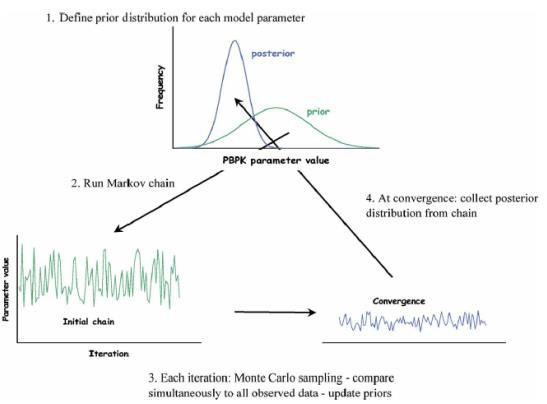
Alternativamente el método bayesiano puede recurrir a la utilización de métodos iterativos basados en las cadenas de markov asociada a simulación de montecarlo (MCMC por sus siglas en inglés) como se observa en la figura 4. Este método ha sido utilizado para la evaluación de riesgos producidos por la exposición a xenobióticos como diclorometano (DCM) (85).
Figura 4. Método iterativo basado en Cadenas de Markov y simulación de Montecarlo (MCMC) para la estimación de parámetros mediante estadística bayesiana a partir de un modelo toxicocinético PBPK (85). Reproducido con permiso
Más recientemente, diferentes estudios han recurrido a la estadística bayesiana con aplicaciones diversas. Modelos poblaciones toxicocinéticos (TXTK) de exposición a cadmio se han utilizado mediante una estrategia bayesiana MCMC para la evaluación de riesgos en diferentes entornos de exposición al cadmio mediante la estimación de parámetros toxicocinéticos de este xenobiótico en la población china (87). También se ha utilizado la estrategia bayesiana MCMC para el modelado PBPK del impacto de la enfermedad del hígado graso no alcohólico en la toxicocinética del percloroetileno en ratones (63). Una metodología similar se ha utilizado para el ajuste de datos de concentración de contaminantes orgánicos y sus metabolitos como benzopireno, pireno, azoxiestrobina o cloruro de 4-nitrobencilo en invertebrados acuáticos, utilizando un modelo compartimental toxicocinético de biotransformación. (88).
Alternativamente se ha recurrido al método bayesiano en estudios in vitro de toxicocinética de alto rendimiento (HTTK por sus siglas en inglés) para la estimación in vitro de parámetros como la fracción libre o el aclaramiento intrínseco con implicaciones en estudios de correlación in vitro in vivo para la predicción in silico del comportamiento toxicocinético (89).
6. FUTURO DE LA TOXICOCINÉTICA
Como ocurre en numerosos campos científicos el futuro de los estudios de toxicidad de fármacos y en particular de toxicocinética va a estar ligado a la inteligencia artificial mediante modelos basados en metodologías de deep learning, como las redes neuronales artificiales. Trabajos recientes han demostrado la utilidad de este tipo de metodología en toxicología predictiva. Actualmente se están utilizando técnicas de alto rendimiento que generan un elevado volumen de datos o big data sobre toxicidad de productos químicos que unidos a técnicas de inteligencia artificial basados en metodologías de deep learning permite generar modelos cuantitativos de relación estructura/actividad (QSAR) o de estructura/farmacocinética (QSPKR) para la predicción de la toxicidad, incluyendo asimismo el comportamiento toxicocinético (90,91).
5. CONCLUSIONES
La toxicocinética constituye una disciplina emergente, cuyos fundamentos y bases científicas se asientan en la farmacocinética y que tiene una fuerte proyección en la evaluación de la disposición y la respuesta por exposición a ciertos xenobióticos, tanto en el hombre como en especies animales sometidas a riesgos medioambientales.
Afortunadamente la colaboración interdisciplinar en el campo de la toxicocinética y en otras muchas disciplinas es, en la actualidad, una realidad y cada vez son más escasas las “islas de investigación”. En el campo de la salud este tipo de investigación es muy acusada y tanto en los hospitales como en los centros de atención primaria y en otras instituciones son habituales los equipos interprofesionales. Hoy los médicos, farmacéuticos, veterinarios y otros profesionales, abordan conjuntamente problemas relacionados con la mejora de la calidad de la terapéutica farmacológica y el cuidado de la salud.
6. REFERENCIAS
1. Domínguez-Gil A, Cadórniga R, González MC. Estudio biofarmacéutico de la asociación coloidal N-butil bromuro de escopolamina y lauril sulfato sódico I. Il Farmaco 1974; 29(4): 165-83.
2. Sesión necrológica en homenaje al Excmo. Sr. D. Rafael Cadórniga Carro. Anal Real Acad Farm 2000; 66: 449-69.
3. Cadórniga R. La obtención de un nuevo medicamento: azar y perseverancia en la investigación farmacéutica. Discurso Inaugural del curso académico 1986-87. Universidad Complutense. Madrid.
4. Carlucci A, Bregni C. Rafael Cadórniga: vigencia de uno de los pioneros de la biofarmacia y farmacocinética. Acta Farm Bonaerense 2003; 22(1): 87-90.
5. Sesión necrológica en memoria del Excmo. Sr. D. Rafael Cadórniga Carro. Ana Real Acad Med 1999, Tomo CXVI: 685-708.
6. Balali-Mood M, Naseri K, Tahergorabi Z. Toxic mechanisms of five heavy metals: mercury, lead, chromium, cadmiun and arsenic. Frontiers Pharmacology 2021; 4(7):1-13.
7. Ribas Ozonas B. Tóxicos metálicos y búsqueda de nuevos marcadores. Discurso de ingreso en la Real Academia Nacional de Farmacia. 05-04-1990.
8. Pourret O, Hursthouse A. It´s time to replace the term “Heavy Metals” with “Potentially Toxic Elements” when reporting environmental research. Inten J Envir Public Health 2019; 16: 1446-54.
9. Maté C, Ribas B, Acobettro RI, Santos Ruiz A. Lithium and rubidium effects on the motor activity of rats. An Real Acad Farm 1979; 45: 279-86.
10. Molina G, Ribas B, Delso JL, Galarza AM, García del Amo C, Santos Ruiz A. Datos preliminares sobre absorción y eliminación de zinc-65 en conejos. Rev Esp Fisiol 1961; 17(2): 81-8.
11. Ribas B, Pire I, García del Amo C, Santos Ruiz A. Influencia de la gestación sobre la distribución de cinc-65 en conejos inyectados por vía intramuscular y en su descendencia. Rev Esp Fisiol 1963; 19(2): 83-94.
12. Ribas B, Pire I, García Amo C, Santos Ruiz A. Acumulación de cinc-65 en feto y en estructuras placentarias de conejo en función de la edad de gestación. Rev Esp Fisiol 1963; 19(2): 95-103.
13. Ribas B, Bando I, Martínez Trueba MM, Santamaria J, Morcillo M. Metallothionein as a marker in mercury nephrotoxicity. En: Bach PH et al. Nephrotoxicity. Chapter 82: 531-5. Marcel Dekker, New York 1991.
14. Novelli ELB, Vieira EP, Rodrigues NL, Ribas B. Risk assessment of cadmium toxicity on hepatic and renal tissues of rats. Environ Res Section A 1998; 79: 102-5.
15. Arranz MA, Pérez Escolano MI, Saiz Vadillo MC, Basagoiti I, Katarneh SM, Ribas B, Cadórniga R. Farmacocinética del cadmio-109 en sangre y estructuras cerebrales de rata. Rev Esp Fisiol 1984; 40: 365-0.
16. Ribas B, Cadórniga R, Sainz Vadillo MC, Lobato N, de la Torre A, Bondia S.Pharmacokinetics of 63-nickel in the rat. Editor: Anke M, Schneider HJ, Bruckner C. Editorial: AWP Karl Marx Universität Leipzig. RDA. NICKEL 1980; 3: 93-100.
17. Ribas B, Acobettro RI, Sainz Vadillo MC, Arranz MA, Cadórniga R. Kinetics of 86- rubidium in blood and cerebral structures of the rat. En: Mineral Elements 80. Kolvistoinen M. The Academy of Finland, Helsinki 1981; II: 465-74.
18. Ribas B, Lobato Rodrigues N, Sánches Reus MI, Saiz Vadillo MC, García Martín MC, de la Torre AM, Bondia S, Tamarit Torres J, Caórniga R. Algunos datos sobre la significación bioquímica del níquel. Rev Esp Fisiol 1982; 38 (supl): 321-6.
19. Ribas B, Acobettro RI, Maté C, Santos Ruiz A. Some effects of rubidium chloride on the motor activity and brain serotonin concentrations of rats. Biochem Soc Trans 1979; 7: 533-4.
20. García Amo C, Ribas Ozonas B. Interreacciones en el metabolismo del zinc. Acciones de los iones calcio y cadmio sobre los niveles de cinc-65 en conejo. An Real Acad Farm 1967; (2): 197-208.
21. Ribas B, Dean M, Santos Ruiz A. Inhibitory effect of cadmium on alkaline phosphatase of kidney and prostate of guinea-pig. Trace Element Metabolism in Animals. Vol. I. Editorial CF Mills. E.S. Livingstone, Edinburgh-London. 1970: pp.1973-6.
22. Blackburn E. Telomere effect. Ed. Orion Paperbacks, 2018.
23. Braeuning A, Marx-Stoelting P.Mixture prioritization and testing: the importance of toxicokinetics. Arch Toxicol. 2021; 95(5):1863-1864.
24. Gergs A, Gabsi F, Zenker A, Preuss TG. Demographic Toxicokinetic- Toxicodynamic Modeling of Lethal Effects. Environ Sci Technol. 2016; 50(11):6017-24.
25. Zhong WZ, Williams MG, Branstetter DG. Toxicokinetics in drug development: an overview of toxicokinetic application in the development of PNU-101017, an anxiolytic drug candidate. Curr Drug Metab. 2000; 1(3):243-54.
26. Schwartz S. Providing toxicokinetic support for reproductive toxicology studies in pharmaceutical development. Arch Toxicol. 2001; 75(7):381-7.
27. Sun T, Kang Y, Liu J, Zhang Y, Ou L, Liu X, Lai R, Shao L.Nanomaterials and hepatic disease: toxicokinetics, disease types, intrinsic mechanisms, liver susceptibility, and influencing factors.J Nanobiotechnology. 2021; 19(1):108.
28. Llop S, Ballester F, Broberg K. Effect of Gene-Mercury Interactions on Mercury Toxicokinetics and Neurotoxicity. Curr Environ Health Rep. 2015; 2(2):179-94.
29. Jadán-Piedra C, Crespo Á, Monedero V, Vélez D, Devesa V, Zúñiga M. Effect of lactic acid bacteria on mercury toxicokinetics. Food Chem Toxicol. 2019; 128:147-153.
30. Veiga-Matos J, Remião F, Motales A. Pharmacokinetics and Toxicokinetics Roles of Membrane Transporters at Kidney Level. J Pharm Pharm Sci. 2020; 23:333-356.
31. Tolonen A, Pelkonen O. Analytical challenges for conducting rapid metabolism characterization for QIVIVE. Toxicology. 2015; 332:20-9.
32. Fu Y, Li W, Flarakos J. Critical considerations of matrix selection in LC-MS bioanalysis for toxicokinetic and pharmacokinetic assessment in drug development. Bioanalysis. 2021; 13(8):605-608.
33. Renkecz T, Scopchanova S, Hirka G, Szakonyiné IP. Development and Validation of an LC-MS-MS Method for the Quantification of Cyanate in Rat Plasma and Its Application to Toxicokinetic Bioanalysis. J Anal Toxicol. 2021; 45(9):1028-1035.
34. Yuzuriha T, Aizawa K, Okada J. Points to be considered for conducting toxicokinetic studies under GLP and for validating analytical methods. J Toxicol Sci. 1996; 21(5):505-9.
35. Alqahtani S. In silico ADME-Tox modeling: progress and prospects. Expert Opin Drug Metab Toxicol. 2017; 13(11):1147-1158.
36. Fagerholm U, Hellberg S, Alvarsson J, Spjuth O. In silico predictions of the human pharmacokinetics/toxicokinetics of 65 chemicals from various classes using conformal prediction methodology. Xenobiotica. 2022;52(2):113-118.
37. Roncaglioni A, Toropov AA, Toropova AP, Benfenati E. In silico methods to predict drug toxicity. Curr Opin Pharmacol. 2013; 13(5):802-6.
38. Guéniche N, Bruyere A, Le Vée M, Fardel O. Implication of human drug transporters to toxicokinetics and toxicity of pesticides. Pest Manag Sci. 2020; 76(1):18-25.
39. Ye L, Liu J, Wang Y, Sun L, Fang Z, Deng Q, Qiu M, Zhao J. Development of a three-compartment toxicokinetic model for T-2 toxin in shrimp by blindfold particle swarm optimization algorithm. Ecotoxicol Environ Saf. 2021; 208:111698.
40. Zhu M, Wang Z, Chen J, Xie H, Zhao H, Yuan X. Bioaccumulation, Biotransformation, and Multicompartmental Toxicokinetic Model of Antibiotics in Sea Cucumber (Apostichopus japonicus). Environ Sci Technol. 2020; 54(20):13175-13185.
41. Grech A, Brochot C, Dorne JL, Quignot N, Bois FY, Beaudouin R. Toxicokinetic models and related tools in environmental risk assessment of chemicals. Sci Total Environ. 2017; 578:1-15.
42. Martínez Lanao J. Conceptos en farmacocinética clínica. En Manual de Farmacia Clínica y Atención Farmacéutica. Herrera Carranza J (Ed). Elsevier. Madrid. 2003; pp. 143-174.
43. Sheiner LB, Beal SL. Evaluation of methods for estimating population pharmacokinetics parameters. I. Michaelis-Menten model: routine clinical pharmacokinetic data. J Pharmacokinet Biopharm. 1980; 8(6):553-71.
44. Beal SL, Sheiner LB. Estimating population kinetics. Crit Rev Biomed Eng. 1982; 8(3):195-222.
45. Pellicanò F, D’Orsi L, De Gaetano A, Panunzi S.A population approach for the estimation of methylmercury ToxicoKinetics in red mullets. Toxicol Appl Pharmacol. 2021;428:115679.
46. Jo S, Woo HD, Kwon HJ, Oh SY, Park JD, Hong YS, Pyo H, Park KS, Ha M, Kim H, Sohn SJ, Kim YM, Lim JA, Lee SA, Eom SY, Kim BG, Lee KM, Lee JH, Hwang MS, Kim J. Estimation of the Biological Half-Life of Methylmercury Using a Population Toxicokinetic Model. Int J Environ Res Public Health. 2015 ; 12(8):9054-67.
47. Jager T, Ashauer R. How to Evaluate the Quality of Toxicokinetic-Toxicodynamic Models in the Context of Environmental Risk Assessment. Integr Environ Assess Manag. 2018;14(5):604-614.
48. Santos FCF, van Gestel CAM, Amorim MJB. Toxicokinetics of copper and cadmium in the soil model Enchytraeus crypticus (Oligochaeta). Chemosphere. 2021; 270:129433.
49. Gergs A, Gabsi F, Zenker A, Preuss TG. Demographic Toxicokinetic- Toxicodynamic Modeling of Lethal Effects. Environ Sci Technol. 2016; 50(11):6017-24.
50. Cichocki JA, Furuya S, Venkatratnam A, McDonald TJ, Knap AH, Wade T, Sweet S, Chiu WA, Threadgill DW, Rusyn I. Characterization of Variability in Toxicokinetics and Toxicodynamics of Tetrachloroethylene Using the Collaborative Cross Mouse Population. Environ Health Perspect. 2017; 125(5):057006.
51. Luo YS, Cichocki JA, Hsieh NH, Lewis L, Wright FA, Threadgill DW, Chiu WA, Rusyn I.Using Collaborative Cross Mouse Population to Fill Data Gaps in Risk Assessment: A Case Study of Population-Based Analysis of Toxicokinetics and Kidney Toxicodynamics of Tetrachloroethylene.Environ Health Perspect. 2019; 127(6):67011.
52. Le TTY, Grabner D, Nachev M, García MR, Balsa-Canto E, Peijnenburg WJGM, Hendriks AJ, Sures B. Development of a toxicokinetic-toxicodynamic model simulating chronic copper toxicity to the Zebra mussel based on subcellular fractionation. Aquat Toxicol. 2021; 241:106015.
53. Roeben V, Oberdoerster S, Rakel KJ, Liesy D, Capowiez Y, Ernst G, Preuss TG, Gergs A, Oberdoerster C. Towards a spatiotemporally explicit toxicokinetic- toxicodynamic model for earthworm toxicity. Sci Total Environ. 2020 ; 722:137673.
54. Bischoff KB, Dedrick RL. Thiopental pharmacokinetics. J Pharm Sci. 1968; 57(8):1346-51.
55. Chen CN, Andrade JD. Pharmacokinetic model for simultaneous determination of drug levels in organs and tissues. J Pharm Sci. 1976; 65(5):717-24.
56. Bois FY, Brochot C. Modeling Pharmacokinetics. Methods Mol Biol. 2016; 1425:37-62.
57. Bois FY, Jackson ET, Pekari K, Smith MT. Population toxicokinetics of benzene. Environ Health Perspect. 1996; 104 Suppl 6(Suppl 6):1405-11.
58. Sweeney LM, Himmelstein MW, Gargas ML. Development of a preliminary physiologically based toxicokinetic (PBTK) model for 1,3-butadiene risk assessment. Chem Biol Interact. 2001; 135-136: 303-22.
59. Bogdanffy MS, Sarangapani R. Physiologically-based kinetic modeling of vapours toxic to the respiratory tract. Toxicol Lett. 2003; 138(1-2):103-17.
60. Ling MP, Liao CM, Tsai JW, Chen BC. A PBTK/TD modeling-based approach can assess arsenic bioaccumulation in farmed tilapia (Oreochromis mossambicus) and human health risks. Integr Environ Assess Manag. 2005;1(1):40-54.
61. Kim D, Andersen ME, Chao YC, Egeghy PP, Rappaport SM, Nylander-French LA. PBTK modeling demonstrates contribution of dermal and inhalation exposure components to end-exhaled breath concentrations of naphthalene. Environ Health Perspect. 2007; 115(6):894-901.
62. Jongeneelen FJ, Berge WF. A generic, cross-chemical predictive PBTK model with multiple entry routes running as application in MS Excel; design of the model and comparison of predictions with experimental results. Ann Occup Hyg. 2011;55(8):841-64.
63. Dalaijamts C, Cichocki JA, Luo YS, Rusyn I, Chiu WA. Quantitative Characterization of Population-Wide Tissue- and Metabolite-Specific Variability in Perchloroethylene Toxicokinetics in Male Mice. Toxicol Sci. 2021; 182(2):168-182.
64. Tan YM, Chan M, Chukwudebe A, Domoradzki J, Fisher J, Hack CE, Hinderliter P, Hirasawa K, Leonard J, Lumen A, Paini A, Qian H, Ruiz P, Wambaugh J, Zhang F, Embry M.PBPK model reporting template for chemical risk assessment applications. Regul Toxicol Pharmacol. 2020; 115:104691.
65. Breen M, Ring CL, Kreutz A, Goldsmith MR, Wambaugh JF.High-throughput PBTK models for in vitro to in vivo extrapolation. Expert Opin Drug Metab Toxicol. 2021; 17(8):903-921.
66. Schneckener S, Preuss TG, Kuepfer L, Witt J. A workflow to build PBTK models for novel species. Arch Toxicol. 2020; 94(11):3847-3860.
67. Tebby C, van der Voet H, de Sousa G, Rorije E, Kumar V, de Boer W, Kruisselbrink JW, Bois FY, Faniband M, Moretto A, Brochot C.A generic PBTK model implemented in the MCRA platform: Predictive performance and uses in risk assessment of chemicals. Food Chem Toxicol. 2020;142:111440.
68. Cooper AB, Aggarwal M, Bartels MJ, Morriss A, Terry C, Lord GA, Gant TW. PBTK model for assessment of operator exposure to haloxyfop using human biomonitoring and toxicokinetic data.Regul Toxicol Pharmacol. 2019; 102:1-12.
69. Bessems JG, Loizou G, Krishnan K, Clewell HJ 3rd, Bernasconi C, Bois F, Coecke S, Collnot EM, Diembeck W, Farcal LR, Geraets L, Gundert-Remy U, Kramer N, Küsters G, Leite SB, Pelkonen OR, Schröder K, Testai E, Wilk-Zasadna I, Zaldívar- Comenges JM.PBTK modelling platforms and parameter estimation tools to enable animal-free risk assessment: recommendations from a joint EPAA–EURL ECVAM ADME workshop. Regul Toxicol Pharmacol. 201; 68(1):119-39.
70. Olie JD, Bessems JG, Clewell HJ 3rd, Meulenbelt J, Hunault CC. Evaluation of semi- generic PBTK modeling for emergency risk assessment after acute inhalation exposure to volatile hazardous chemicals. Chemosphere. 2015; 132:47-55.
71. Ding J, Liu W, Zhang H, Zhu L, Zhu L, Feng J. Liver-Based Probabilistic Risk Assessment of Exposure to Organophosphate Esters via Dust Ingestion Using a Physiologically Based Toxicokinetic (PBTK) Model. Int J Environ Res Public Health. 2021;18(23):12469.
72. Zhang S, Wang Z, Chen J. Physiologically based toxicokinetics (PBTK) models for pharmaceuticals and personal care products in wild common carp (Cyprinus carpio). Chemosphere. 2019; 220:793-801.
73. Mit C, Bado-Nilles A, Daniele G, Giroud B, Vulliet E, Beaudouin R. The toxicokinetics of bisphenol A and its metabolites in fish elucidated by a PBTK model. Aquat Toxicol. 2022; 247:106174.
74. Zhang Y, Feng J, Gao Y, Liu X, Qu L, Zhu L. Physiologically based toxicokinetic and toxicodynamic (PBTK-TD) modelling of Cd and Pb exposure in adult zebrafish Danio rerio: Accumulation and toxicity. Environ Pollut. 2019; 249:959-968.
75. Liu YH, Yao L, Huang Z, Zhang YY, Chen CE, Zhao JL, Ying GG. Enhanced prediction of internal concentrations of phenolic endocrine disrupting chemicals and their metabolites in fish by a physiologically based toxicokinetic incorporating metabolism (PBTK-MT) model. Environ Pollut. 2022; 314:120290.
76. Fabian E, Gomes C, Birk B, Williford T, Hernandez TR, Haase C, Zbranek R, van Ravenzwaay B, Landsiedel R.In vitro-to-in vivo extrapolation (IVIVE) by PBTK modeling for animal-free risk assessment approaches of potential endocrine- disrupting compounds. Arch Toxicol. 2019; 93(2):401-416.
77. Jeong SH, Jang JH, Lee YB. Development of physiologically-based toxicokinetic- toxicodynamic (PBTK-TD) model for 4-nonylphenol (4-NP) reflecting physiological changes according to age in males: Application as a new risk assessment tool with a focus on toxicodynamics. Environ Pollut. 2022; 312:120041.
78. Kenyon EM. Arsenic toxicokinetic modeling and risk analysis: Progress, needs and applications. Toxicology. 2021;457:152809.
79. Schupp T. Read across for the derivation of Indoor Air Guidance Values supported by PBTK modelling. EXCLI J. 2018; 17:1069-1078.
80. Zhu YS, Yang JQ, Wang N, Deng ZQ, Qing Y, Wu M, Cai H, Liu H, He GS. Estimation of the bio-accessibility of methylmercury from aquatic foods using a PBTK model with an approximate Bayesian computation method in Chinese pregnant women. Food Chem Toxicol. 2022; 168:113372.
81. Gingrich J, Filipovic D, Conolly R, Bhattacharya S, Veiga-Lopez A. Pregnancy- specific physiologically-based toxicokinetic models for bisphenol A and bisphenol S. Environ Int. 2021; 147:106301.
82. Sarigiannis DA, Karakitsios S, Dominguez-Romero E, Papadaki K, Brochot C, Kumar V, Schuhmacher M, Sy M, Mielke H, Greiner M, Mengelers M, Scheringer M. Physiology-based toxicokinetic modelling in the frame of the European Human Biomonitoring Initiative. Environ Res. 2019; 172:216-230.
83. Grimard C, Mangold-Döring A, Alharbi H, Weber L, Hogan N, Jones PD, Giesy JP, Hecker M, Brinkmann M. Toxicokinetic Models for Bioconcentration of Organic Contaminants in Two Life Stages of White Sturgeon (Acipenser transmontanus). Environ Sci Technol. 2021; 55(17):11590-11600.
84. Maier C, Hartung N, Kloft C, Huisinga W, de Wiljes J. Reinforcement learning and Bayesian data assimilation for model-informed precision dosing in oncology. CPT Pharmacometrics Syst Pharmacol. 2021; 10(3):241-254.
85. Jonsson F, Johanson G. The Bayesian population approach to physiological toxicokinetic-toxicodynamic models–an example using the MCSim software. Toxicol Lett. 2003;138(1-2):143-50.
86. Hughes JH, Keizer RJ. A hybrid machine learning/pharmacokinetic approach outperforms maximum a posteriori Bayesian estimation by selectively flattening model priors.CPT Pharmacometrics Syst Pharmacol. 2021; 10(10):1150-1160.
87. Qing Y, Yang J, Zhang Q, Zhu Y, Ruiz P, Wu M, Zhao G, Zhao Q, Liu H, Cai H, Qin L, Zheng W, He G. Bayesian toxicokinetic modeling of cadmium exposure in Chinese population. J Hazard Mater. 2021; 413:125465.
88. Ratier A, Lopes C, Geffard O, Babut M. The added value of Bayesian inference for estimating biotransformation rates of organic contaminants in aquatic invertebrates. Aquat Toxicol. 2021;234:105811.
89. Wambaugh JF, Wetmore BA, Ring CL, Nicolas CI, Pearce RG, Honda GS, Dinallo R, Angus D, Gilbert J, Sierra T, Badrinarayanan A, Snodgrass B, Brockman A, Strock C, Setzer RW, Thomas RS. Assessing Toxicokinetic Uncertainty and Variability in Risk Prioritization. Toxicol Sci. 2019; 172(2):235-251.
90. Zhang J, Norinder U, Svensson F. Deep Learning-Based Conformal Prediction of Toxicity. J Chem Inf Model. 2021; 61(6):2648-2657.
91. Tang W, Chen J, Wang Z, Xie H, Hong H. Deep learning for predicting toxicity of chemicals: a mini review. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev. 2018; 36(4):252-271.