Introducción: En Ecuador se desconoce la diversidad de especies de Aeromonas y sus perfiles de resistencia a los antibióticos en la mayoría de ecosistemas acuáticos. Objetivo: Conocer la diversidad de especies del género Aeromonas y sus perfiles de resistencia a los antibióticos presentes en el balneario de aguas mineromedicinales “Santagua de Chachimbiro” y en el agua del lago volcánico cratérico Cuicocha. Metodología: Se analizaron muestras de agua del balneario “Santagua de Chachimbiro” y del lago volcánico cratérico Cuicocha, ubicados en la provincia de Imbabura-Ecuador. El aislamiento de las especies de Aeromonas se realizó por la técnica de siembra en profundidad y por filtración en membrana utilizando como medio de cultivo el agar R2A y el agar almidón ampicilina. Las bacterias se identificaron siguiendo el esquema propuesto Longa et al., (1997), complementadas con pruebas de las galerías Microgen. El perfil de resistencia a los antibióticos se determinó por el método de difusión en placas de Kirby y Bauer (1966) interpretándose según el CLSI (2019). Resultados: Se lograron identificar un total de 19 cepas del género Aeromonas pertenecientes a 6 especies. Los perfiles de resistencia a los antibióticos muestran diferentes patrones para cada una de las especies, aunque prevalecen las especies multiresistentes a los antibióticos amoxicilina, amoxicilina/ácido clavulánico, aztreonam, eritromicina y tetraciclina. Conclusiones: Se demuestra la presencia de diversas especies de Aeromonas en ambientes acuáticos del Ecuador con variados perfiles de resistencias y multiresistencia a los antibióticos.Palabras clave: aeromonas; ecosistema acuáticos; agua mineromedicinal; lago cratérico; resistencia a los antibióticosABSTRACT:
Introduction: In Ecuador, the diversity of Aeromonas species and their resistance profiles to antibiotics in most aquatic ecosystems are unknown. Objective: To know the diversity of species of the genus Aeromonas and their resistance profiles to antibiotics present in the mineralmedicinal water spa “Santagua de Chachimbiro” and in the water of the Cuicocha crater volcanic lake. Methodology: Water samples from the “Santagua de Chachimbiro” spa and from the volcanic crater lake Cuicocha, located in the province of Imbabura-Ecuador, were analyzed. The isolation of the Aeromonas species was carried out by the deep seeding technique and by membrane filtration using R2A agar and ampicillin starch agar as the culture medium. The bacteria were identified following the schemes proposed by Longa et al., (1997), complemented with tests of the Microgen galleries. The antibiotic resistance profile was determined by the plate diffusion method of Kirby and Bauer (1966) interpreted according to the CLSI (2019). Results: A total of 19 strains of the genus Aeromonas belonging to 6 species were identified. Antibiotic resistance profiles show different patterns for each of the species, although species multi-resistant to antibiotics amoxicillin, amoxicillin/clavulanic acid, aztreonam, erythromycin and tetracycline prevail. Conclusions: The presence of various species of Aeromonas in aquatic environments of Ecuador with varied profiles of resistance and multi-resistance to antibiotics is demonstrated.
Keywords: aeromonas; aquatic ecosystem; mineralmedicinal water; crateric lake; resistance to antibiotics
1. INTRODUCCIÓN
El papel del ambiente en la diseminación de las bacterias resistentes a los antibióticos es un hecho establecido desde hace varias décadas (1, 2). Se ha observado que los ecosistemas acuáticos pueden albergar una gran variedad de bacterias autóctonas y alóctonas portadoras de genes de resistencia a diversos antimicrobiano, lo cual ha recibido el nombre de resistomas ambientales (3).
Los resistomas ambientales hasta ahora detectados, incluyen una gran variedad de géneros y especies bacterianas presentes en diferentes tipos de ecosistemas acuáticos, tales como, lagos, manantiales de aguas termales, plantas de tratamientos y ríos (4, 5, 6, 7).
Entre los géneros de bacterias encontrados destaca el género Aeromonas, las cuales están presentes principalmente en ecosistemas acuáticos (4) pero también se les suele encontrar en ecosistemas terrestres y en los alimentos, de igual manera como miembros de la microbiota de animales (8).
Varias especies del género Aeromonas son capaces de causar enfermedades en diferentes especies de animales, incluidos los humanos, siendo en estos últimos, responsables de infecciones intestinales y extra intestinales tales como gastroenteritis, bacteriemia, infecciones de piel y tejidos blandos y sepsis con curso letal. La infección ocurre a menudo después del contacto o consumo de aguas o alimentos contaminados (8), lo que aumenta el riesgo para la salud humana (4). Por estas razones, algunos países han establecido normas para detectar Aeromonas spp. en aguas (9).
La resistencia a diversos grupos de antibióticos es otra característica resaltante de las especies de Aeromonas aisladas de muestras clínicas (4). Se han descrito altas tasas de resistencia contra penicilinas y cefalosporinas de primera generación y están asociadas con la producción de betalactamasas codificadas cromosómicamente (8). También, los genes cphA/imiS metalo-beta-lactamasa y tet, han sido implicados en la resistencia a los carbapenemes y las tetraciclinas (10).
La mayoría de los estudios sobre la detección de genes de resistencia a antibióticos se han limitado a las especies Aeromonas hydrophila, Aeromonas veronii, Aeromonas sobria y Aeromonas caviae, provenientes de muestras clínicas (10).
La incidencia de resistencia a los antibióticos en aislados ambientales de especies de Aeromonas se ha investigado muy poco, por lo que las implicaciones del contacto humano con aguas contaminadas con cepas de especies de Aeromonas son desconocidas.
En Ecuador, las aguas termales y los lagos de alta montaña son frecuentemente utilizadas por un amplio sector de la población, quienes acuden a ellas con fines recreativos y en muchos casos con fines curativos. En este sentido, el objetivo del presente trabajo fue determinar la diversidad de especies de Aeromonas y sus perfiles de resistencia a los antibióticos en ecosistemas acuáticos del Ecuador, de manera de conocer si existe en estos ecosistemas resistomas ambientales que pudieran ser un riesgo para la salud del público que acude a estos sitios.
2. MATERIALES Y MÉTODOS
2. 1 Materiales
2.1.1 Sitios de muestreos
Uno de los sitios donde se realizó parte de la investigación fue el balneario de aguas mineromedicinales “Santagua de Chachimbiro” ubicadas en el suroeste de la parroquia Tumbabiro, en el cantón Urcuqui, provincia Imbabura, en la Cordillera Occidental Andina ecuatoriana (Figura 1) a una altitud de 2672 m.s.n.m. y con una temperatura ambiente que varía entre los 16 y 22 °C. Las aguas termo minerales de Chachimbiro en el complejo Santagua, provienen de un acuífero hidrotermal profundo. El agua termal es de tipo clorurada sódica e hipertermal ya que la temperatura media del agua es de 55 °C (11).
Figura 1. Ubicación geográfica del Balneario “Santagua de Chachimbiro. Imbabura. Ecuador (Google Maps, 2021).
De igual forma, el estudio también se llevó a cabo en el lago volcánico cratérico Cuicocha. El lago Cuicocha es un lago cratérico ubicado en la cordillera occidental de los Andes ecuatorianos, ubicados a unos 100 km al norte de Quito, cerca de la población de Otavalo, en la Provincia de Imbabura (Figura 2). Está situado a una altura de 3072 metros sobre el nivel del mar, posee un diámetro de 3,2 km, una superficie de 3,78 km2 y una profundidad máxima de 148 metros. Presenta en el centro del lago dos islas, la isla Yerovi de una superficie de 0.26 km2 y la isla Wolf con una superficie de 0.41 km2 (12).
Es un lago cratérico adyacente al volcán Cotacachi que de acuerdo con los datos geológicos que se disponen, el volcán ha sufrido una serie de erupciones intensas con emisión de cenizas, lahares y el colapso de la caldera entre los años 2900 AC y 700 DC, llegándose a formar ulterior a estos acontecimientos, un lago en la caldera que ha sido cubierto, tanto por agua de lluvia como por agua hidrotermal proveniente del volcán (12).
2.2.2 Muestras
En el balneario de aguas mineromedicinales “Santagua de Chachimbiro” los puntos de la toma de muestra fueron cuatro. El primero, fue en la vertiente u ojo de agua. El segundo, en el tanque de almacenamiento. El tercer y cuarto punto fueron del agua de las piscinas. En todos los casos se tomó un volumen de 1 litro de muestras de agua, por duplicado en cada ocasión. Se realizaron tres muestreos en cada punto establecido, durante un periodo de un año, con un total de 24 muestras.
Para el lago Cuicocha las muestras de agua se recolectaron por duplicado en 6 sitios seleccionados a lo largo y ancho del lago a nivel de la superficie, durante 3 ocasiones a lo largo de un año, para un total de 36 muestras. Se identificaron las coordenadas geográficas de los sitios de recolección mediante un GPS marca Hanna. Para la recolección de las muestras se utilizaron frascos esterilizados y un muestreador de agua Van Dorn.
En todos los casos los muestreos se realizaron de acuerdo con la norma ecuatoriana sobre muestras de agua (13), transportándose las muestras hasta el laboratorio de análisis según lo indicado en la normativa (14).
Figura 2. Ubicación geográfica del lago Cuicocha. Provincia de Imbabura. Ecuador (Google Maps, 2021).
2.2 Metodología
2.2.1 Siembra y aislamiento
Para el aislamiento de las colonias de Aeromonas presentes en las muestras de agua, se utilizaron 2 técnica. La primera técnica fue la de siembra en profundidad utilizando diluciones seriadas hasta 10-3 de cada una de las muestras en solución fisiológica, y posteriormente de cada una de las diluciones y de la muestra sin diluir, se realizaron siembras de un volumen de 1 mL. En este caso se utilizó el agar R2A, incubándose a 30 °C durante un tiempo de 48 a 72 horas. Posteriormente se purificaron las colonias crecidas en agar soya tripticasa para su posterior identificación (15).
La segunda técnica fue la de filtración por membrana. De cada una de las muestras recolectadas de agua se filtraron un volumen de 100 mL, utilizando filtros de 0,45 mm de diámetro y un tamaño de poro de 0,45 mm (Millipor). Posteriormente, las membranas se colocaron sobre placas de Petri con agar almidón suplementado con 50 mg/mL de ampicilina (Merck). Las placas con los filtros se incubaron a una temperatura de 30 °C durante 48-72 horas. Finalizado el tiempo de incubación las colonias amarillas fueron seleccionadas y purificadas en agar almidón ampicilina para su posterior identificación (15).
2.2.2 Identificación de las colonias de Aeromonas aisladas
Cada una de las colonias aisladas fueron purificadas en placas de Petri con agar soya tripticasa. Seguidamente se les realizó la prueba de la oxidasa. Aquellas que resultaron oxidasa positiva, se les siguió las pruebas bioquímicas según lo descrito por Longa et al., (1997), (16).
Las cepas presuntivas de Aeromonas, purificadas en el agar Tripticasa-Soya, fueron sometidas a pruebas bioquímicas individuales, a fin de lograr su identificación a nivel de especie. Debido a que para el momento de realizar la identificación no se contó con el agente vibriostático O/129, del cual parte este esquema, la identificación debió complementarse con las pruebas bioquímicas individuales (16). De igual forma, se utilizó el método comercial de las galerías de identificación taxonómica MicrogenTM (2004), para confirmar la identificación de las cepas de Aeromonas.
2.2.3 Perfiles de resistencia a los antibioticos
La susceptibilidad a los antibióticos fue determinada a cada una de las cepas de Aeromonas identificadas, a través del método de difusión en discos de Kirby-Bauer (17). Se utilizo como cepa control, la cepa ATCC 25922 de Escherichia coli. Se chequearon los siguientes antibioticos: amoxicilina (AMX; 10 mg), amoxicilina/ácido clavulánico (AMC; 30 mg), aztreonam (ATM; 30 mg), cefalotina (CEF; 30 mg), ceftazidima (CAZ; 30 mg), cefepima (CEP; 30 mg), eritromicina (ERY; 15 μg), gentamicina (GEN; 10 mg), imipenem (IPM; 10 mg), tetraciclina (TET; 30 mg) y trimetoprim/sulfametoxazol (SxT; 25 mg).
Para la interpretación de los resultados de los antibiogramas se utilizó el manual del CLSI (2019) (18).
3. RESULTADOS
3.1 Diversidad de especies de Aeromonas
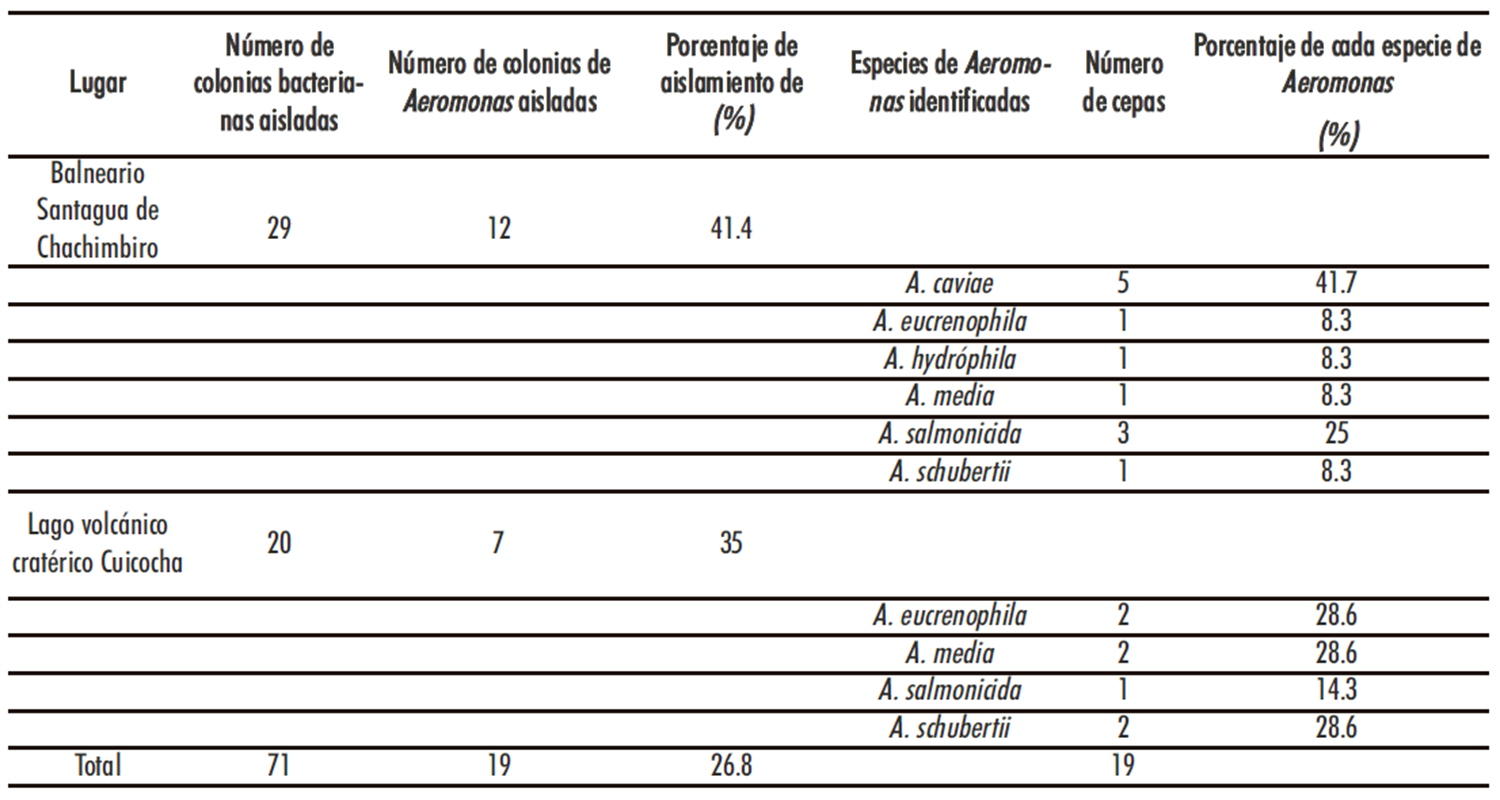
A partir de las 24 muestras de agua termal recolectadas en el balneario de aguas mineromedicinales “Santagua de Chachimbiro”, se logró aislar un total de 29 colonias de bacterias, de las cuales 12 (41,4 %) correspondieron a células de Aeromonas spp (Tabla 1), de acuerdo con las pruebas de Gram, oxidasa, fermentación de la glucosa, crecimiento en presencia de cloruro de sodio, Voges Proskauer y producción de ácido a partir del inositol.
En el caso del agua del lago volcánico craterico Cuicocha, de 20 cepas bacterianas aisladas, se pudo identificar como pertenecientes al género Aeromonas, un total de 7 (35 %) cepas bacterianas. (Tabla 1).
Tabla 1. Especies del género Aeromonas aisladas e identificadas de muestras de agua del balneario “Santagua de Chachimbiro” y del lago volcánico
cratérico Cuicocha. Ecuador
Los esquemas para la identificación de las especies de Aeromonas son variables. Algunos investigadores las han identificado, mediante la determinación de características morfológicas, nutricionales y fisiológicas, con posterior comparación con aquellas características descritas por otros investigadores (16).
El procedimiento utilizado permitió descartar la posibilidad de que los aislados estudiados pertenecieran al grupo de los Vibrio no halófilos, tales como V. cholerae y V. mimicus, los cuales, si no se realiza la prueba del agente vibriostático, se asemejan a Aeromonas en pruebas claves tales como la oxidasa y la utilización de la sacarosa. En este sentido, la utilización de prueba como el hidrolisis de la esculina, utilización de la arabinosa, de carboxilación de la ornitina y de la arginina y la reacción de Voges Proskauer, resolvió el problema planteado.
Al observar los datos señalados en la Tabla 1, se puede indicar que para el balneario de aguas mineromedicinales “Santagua de Chachimbiro” se logró identificar 12 cepas del género Aeromonas pertenecientes a las especies: Aeromonas caviae, Aeromonas eucrenophila, Aeromonas hydróphila, Aeromonas media, Aeromonas salmonicida y Aeromonas schubertii.
En el caso del agua del lago volcánico cratérico Cuicocha se pudo identificar un total de 7 cepas del género Aeromonas perteneciente a las especies Aeromonas caviae, Aeromonas eucrenophila, Aeromonas salmonicida subsp. Salmonicida y Aeromonas schubertii (Tabla 1).
Al analizar los datos de la Tabla 1, se observa que las especies con mayor frecuencia de aislamiento, considerando los dos ecosistemas analizados, fueron Aeromonas caviae (41,7 %), Aeromonas eucrenophila (36,9 %) Aeromonas media (36,9 %), Aeromonas shubertii (36,9 %).
3.2 Perfiles de resistencia a los antibióticos
En la Tabla 2 se resumen los resultados obtenidos en la determinación de los perfiles de resistencia y sensibilidad a los antibióticos de las especies del género Aeromonas identificadas en el balneario de agua mineromedicinal “Santagua de Chachimbiro” y en el agua del lago volcánico craterico Cuicocha en Ecuador.
En la presente investigación se observaron las mayores resistencia para el caso de los antibióticos amoxicilina, amoxicilina/ácido clavulánico, aztreonam, eritromicina y tetraciclina. Siendo los antibióticos más efectivos contra las cepas de las diferentes especies de Aeromonas, los antibióticos ceftazidima, cefepima, imipenem y trimetoprim/sulfametoxazol, resultados que corresponde a la susceptibilidad que se ha indicado para este género en diferentes tipos de muestras (8).
Tabla 2. Perfiles de resistencia a los antibióticos de especies de Aeromonas aisladas en ecosistemas acuáticos del Ecuador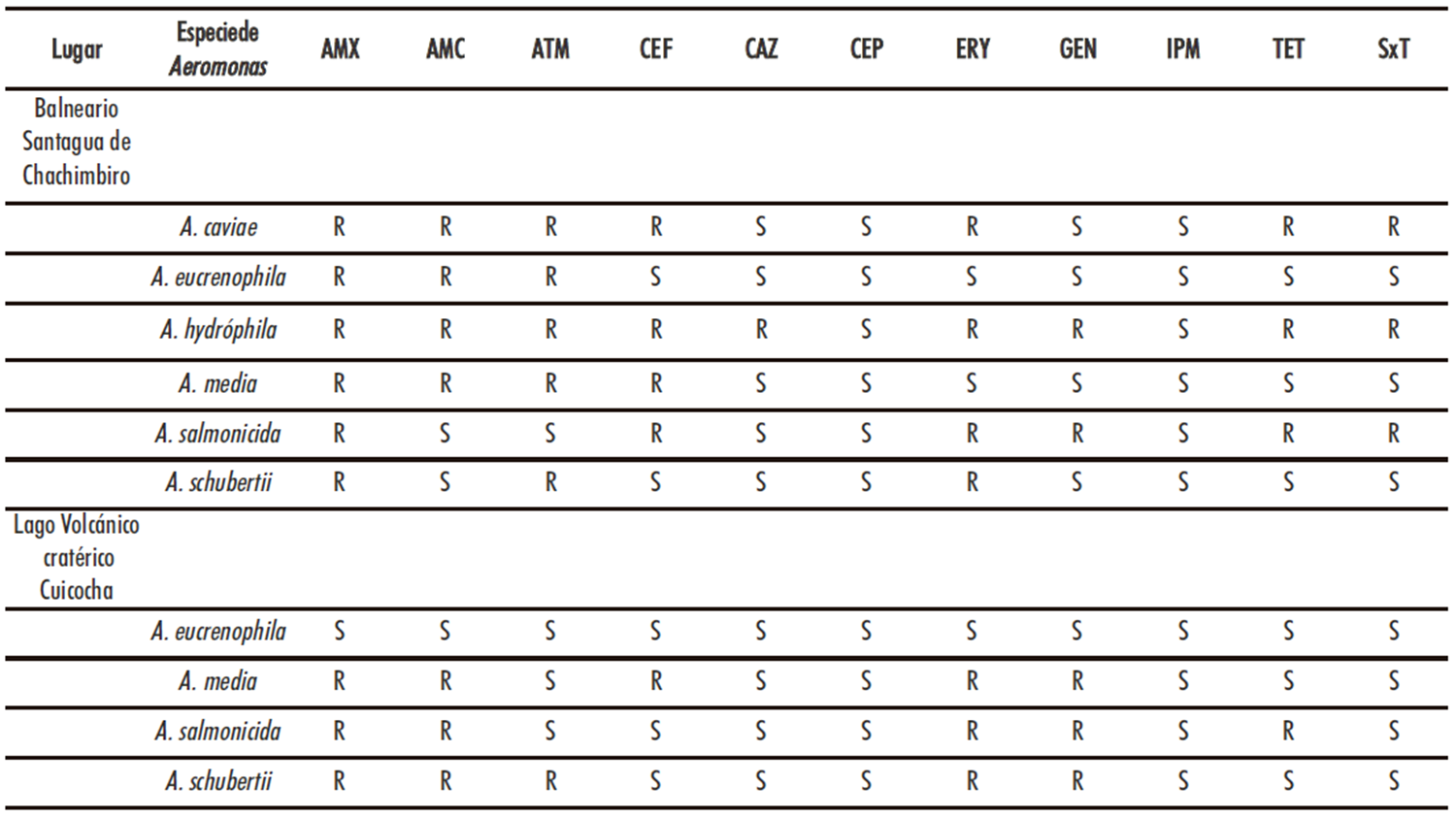
Nota: AMX: amoxicilina 10 μg. AMC: amoxicilina/ácido clavulánico 30 μg. ATM: aztreonam 30 μg. CEF: cefalotina 30 μg. CAZ: ceftazidima 30 μg. CEP: cefepima 30
μg. ERY: eritromicina 15 μg. GEN: gentamicina 10 μg. IPM: imipenem 10 μg. TET: tetraciclina 30 μg. SxT: trimetoprim/sulfametoxazol 2 5mg. R: Resistente. S: Sensible.
4. DISCUSIÓN
En diversas partes del mundo se han realizado estudios que han puesto en evidencia la presencia de especies de Aeromonas en diferentes tipos de ecosistemas acuáticos, incluyendo manantiales de aguas termales (19, 20). En este sentido, los resultados del presente trabajo son similares respecto a la presencia de especies de este género en las aguas estudiadas, aunque se difiere en el aspecto de las especies identificadas y sus porcentajes de aislamientos.
En la mayoría de los estudios realizados en ecosistemas acuáticos (4, 9, 15, 20), las especies prevalente han sido Aeromonas hydrophila y Aeromonas veronii, resultados diferentes a los obtenidos en la presente investigación.
En Ecuador existen varios estudios sobre el aislamiento y caracterización de este género bacteriano en muestras de aguas de balnearios mineromedicinales. Sin embargo, al comparar los resultados obtenidos en la presente investigación con los observados en otros balnearios de aguas mineromedicinales del Ecuador (21, 22), se puede señalar que especies del género Aeromonas se han aislados en estos tipos de ecosistemas, aunque existen variaciones en las especies identificadas y en la frecuencia de aislamiento.
Con respecto a las investigaciones donde se señale el aislamiento de especies del género Aeromonas en aguas de lagos volcánicos cratéricos, son escasas a nivel del mundo (6) y en Ecuador este trabajo sería el primero en evidenciar la presencia de este género bacterianos en las aguas de lagos volcánicos cratéricos, aunque se ha indicado la presencia de cepas de Aeromonas en otros lagos no volcánicos de alta montaña del Ecuador (23).
Las Aeromonas presentan un perfil típico de susceptibilidad a antibióticos, aunque los perfiles de resistencia varían entre los estudios, lo que parece estar relacionado con rasgos específicos de la cepa y presiones selectivas ambientales (8).
El porcentaje de cepas de Aeromonas resistentes a tetraciclina y/o trimetoprima/sulfametoxazol fue inferior a los reportados en ambientes clínicos (24), acuicultura (25) y plantas de tratamiento de aguas residuales (26), no así en los casos de Aeromonas aisladas en aguas potables, las cuales diversos autores han señalado resultados mayores o similares a los datos obtenidos en el presente trabajo (4, 23).
En diversos estudios realizados en los últimos años en diferentes tipos de ecosistemas acuáticos, como lo son los glaciares, los lagos volcánicos y los manantiales de aguas termales, han dejado al descubierto que en estos ambientes existen, desde tiempos prehistóricos, una diversidad de microorganismos con resistencias naturales a los antibióticos que han sobrevivido y se han adaptado a las condiciones extremas reinantes en esos ambientes, constituyendo un reservorio natural de bacterias y de genes asociados con la resistencia a los antibióticos denominados resistomas ambientales, los cuales han sido poco estudiados y que colocan el problema de la resistencia a los antibióticos en un contexto ambiental, ecológico y evolutivo, además del sanitario (5, 12, 27, 28).
Es decir, mucho antes de que surgiera la era de los antibióticos, las comunidades bacterianas naturales han interactuado con los microorganismos productores de antibióticos y desarrollados mecanismos de resistencia que le han permitido su adaptación y proliferación en distintos ambientes acuáticos y terrestres (29).
Los resultados obtenidos reflejan probablemente la existencia de presiones selectivas en los ecosistemas investigados debido a la presencia de microorganismos productores de antimicrobianos en estos ambientes, así como a la presencia de especies de bacterias patógenas proveniente de fuentes externas (29).
En lo que se refiere a estudios en otras partes del mundo sobre la presencia de especies del género Aeromonas resistente a antibióticos en muestras de agua de lagos volcánicos cratéricos, no se evidencian en la bibliografía.
En el caso de Ecuador, el presente trabajo sería el primero en señalar la presencia de especies del género Aeromonas resistentes a diversos antibióticos en muestras de agua de lagos volcánicos cratéricos. Sin embargo, Chávez en el año 2020 (23) en un estudio realizados en los lagos de alta montaña Yahuarcocha, Yambo y Colta, señala la presencia de cepas de bacterias del género Aeromonas resistente a diversos antibióticos, resultado similar a los obtenidos en la presente investigación.
Recientemente se ha señalado que las especies del género Aeromonas se encuentra en la interfaz de lo que se ha denominado “One Health”, concepto que integra la salud ambiental, animal y humana bajo una misma premisa y representa una prueba solida de este enfoque sanitario. Los miembros del género Aeromonas no solo son bacterias ambientales ubicuas, capaces de colonizar rápidamente y causar infecciones oportunistas en humanos y animales, sino que también son capaces de promover el intercambios de genes de resistencia a los antibióticos en los ambientes naturales, tales como los ecosistemas acuáticos (30).
5. CONCLUSIONES
Se evidencia que en el agua mineromedicinal del balneario “Santagua de Chachimbiro”. están presentes una mayor variedad de especies de Aeromonas en comparación de la observada en el agua del lago volcánico cratérico Cuicocha.
Se detecta por primera vez en el Ecuador la presencia de diversas especies del género Aeromonas en el agua de un lago volcánico cratérico.
Los resultados obtenidos en los perfiles de resistencia a los antibióticos de las distintas especies de Aeromonas encontradas, indican la presencia de especies resistentes y multiresistentes a una variedad de antimicrobianos, lo que evidencia el papel de las especies del género Aeromonas en la diseminación de los genes de resistencias a antibióticos en el ambiente y su posible papel en el establecimiento de resistomas ambientales.
Este trabajo señala la necesidad de estudiar y comprender la importancia de las aguas minerales naturales, como lo son las aguas mineromedicinales de uso público, así como las aguas de los lagos volcánicos, como reservorios de la diversidad bacteriana y de resistomas ambientales.
Conflicto de intereses
Los autores dejan constancias que no existe ningún tipo de conflicto de intereses con la investigación realizada y los resultados expresados en el presente artículo.
Agradecimientos
A la Dirección de Investigación de la Universidad Central del Ecuador por el financiamiento otorgado a través de los proyectos avanzados senior 011-2017, 045-2019 y 045-2022 que han permitido el desarrollo de una línea de investigación a la cual pertenece la presente investigación, así como a la Escuela Superior Politécnica del Chimborazo, la Universidad Nacional del Chimborazo, la Universidad UNIANDES y la Universidad de los Andes de Venezuela por la ayuda, colaboración y asesoramiento prestado.
6. REFERENCIAS
1. Baquero F, Martínez J, Cantón R. (2008). Antibiotics, and antibiotic resistance in water environments. Current Opinion in Biotechnology. Vol. 19 (3): 260-265.
2. Barón S, Granier S A, Larvor E, Jouy E, Cineux M, Wilhelm A, Gassilloud B, Le Bouquin S, Kempf I, Chauvin C. (2017). Aeromonas Diversity and Antimicrobial Susceptibility in Freshwater—An Attempt to Set Generic Epidemiological Cut-Off Values. Frontiers in Microbiology. Vol. 8: 503. https://www.frontiersin.org/article/10.3389/fmicb.2017.00503
3. Dante G, Sommer M. (2014). Genética de la resistencia microbiana. Investigación y Ciencias. Vol. Agosto: 28-34.
4. Figueira V, Vaz-Moreira I, Silva M, Manaia CM. (2011). Diversity and antibiotic resistance of Aeromonas spp. in drinking and wastewater treatment plants. Water Res. 45:5599–5611.
5. Andueza F, Albuja A, Arguelles P, Escobar S, Espinoza C, Araque J, Medina G. (2015). Antimicrobial resistance in strains Pseudomonas aeruginosa isolated from termal waters at Chimborazo, Ecuador. Anales de la Real Academia Nacional de Farmacia. Vol. 81(2): 158-163.
6. Gacad J & Briones J. (2020). Aeromonas veronii and Plesiomonas shigelloides (Gamma proteobacteria) isolated from Glossogobius aureus (Gobiidae) in Lake Sampaloc, Laguna, Philippines. Philippine Journal of Systematic Biology. Vol. 14 (1): 1-6.
7. González M, Viteri F, Villacís L, Escobar J, Araujo L, González A, Medina G, Araque J, Andueza F. (2021) Perfiles de susceptibilidad a los antibioticos en cepas del género Bacillus aisladas de ambientes acuáticos extremos del Ecuador. An. Real Acad. Farm. Vol. 87(1): 27-34.
8. Janda JM & Abbott SL. (2010) The genus Aeromonas: taxonomy, pathogenicity, and infection. Clin Microbiol Rev. Vol. 23: 35–73.
9. Di Bari M, Hachich EM, Melo AMJ, Sato MZ. (2007). Aeromonas spp. and microbial indicators in raw drinking water sources. Brazilian Journal of Microbiology. Vol. 38: 516–521.
10. Wu CJ, Chen PL, Wu JJ, Yan JJ, Lee CC, Lee HC, Lee NY, Chang CM, Lin YT, Chiu YC, Ko WC. (2012). Distribution and phenotypic and genotypic detection of a metallo-β-lactamase, CphA, among bacteraemic Aeromonas isolates. Journal of Medical Microbiology. Vol. 61: 712–719.
11. Carrera Villacrés D & Guevara García P. (2017). Fuentes termales del Ecuador. Escuela Superior Politecnica del Ejercito (ESPE). Quito. Ecuador. http://repositorio.espe.edu.ec/xmlui/handle/21000/11739.
12. González M, Araque J, Viteri F, Villacis L, Escobar S, Araujo L, Medina G, Andueza F. (2021). Microbiologia del agua del Lago craterico volcánico Cuicocha. Imbabura. Ecuador. Revista de la Facultad de Farmacia. Vol. 63 (1): 25-33
13. Instituto Ecuatoriano de Normalización (INEN) (1998a). NTE INEN 2 176-98 Agua. Calidad del agua. Muestreo. Técnicas de muestreo. Instituto Ecuatoriano de Normalización. Quito-Ecuador.
14. Instituto Ecuatoriano de Normalización (INEN). (1998b) NTE INEN 2 169-98 Agua. Calidad del agua. Muestreo. Manejo y conservación de muestras. Instituto Ecuatoriano de Normalización. Quito-Ecuador.
15. Andueza F. (2007). Diversidad Microbiana de las Aguas Mineromedicinales de los Balnearios de Jaraba. Tesis Doctoral. Universidad Complutense de Madrid, España.
16. Longa A, Vizcaya L, Nieves B, Bravo L, Bravo J. (1997). Estudio comparativo de 4 métodos para la identificación de especies del género Aeromonas. Rev. Cubana Med. Trop. Vol. 49 (2): 84-85.
17. Bauer AW, Kirby MM, Sherris JC, Truck M. (1966). Antibiotic susceptibility testing by a standardized single disk method. Am. J. Clin. Pathol. Vol. 45(4): 493-496.
18. Clinical and Laboratory Standards Institute (CLSI). (2019). Performance standards for antimicrobial susceptibility testing Clinical and Laboratory Standards Institute Wayne, PA.
19. De la Rosa M, Andueza F, Sánchez M, Rodríguez C, Mosso M. (2004) Microbiología de las aguas mineromedicinales de los Balnearios de Jaraba. Anales de la Real Academia Nacional de Farmacia. Vol. 70 (Extraordinario): 51-74.
20. Gutiérrez MG; Andueza F, Araque J, Lugo A, Chacón Z. (2018). Caracterización microbiológica y potencial biotecnológico de microorganismos aislados de las aguas termales de la Musuy, Municipio Rangel del Estado Mérida. Venezuela. Revista de la Sociedad Venezolana de Microbiología. Vol. 38 (1): 27-32.
21. Medina-Ramírez G, Naranjo K, Escobar S, Araque J, Djabayan P, Andueza, F (2016). Microbiota extremófila y resistomas ambientales de la fuente termal “Termas La Merced”. Quito. Ecuador. FIGEMPA: Investigación y desarrollo. Vol. 2 (7): 33-38. https://doi.org/10.29166/revfig.v1i2.867.
22. Andueza F, Araque J, Parra Y, Arciniegas S, Guailla R, Escobar S, Medina G. (2020). Diversidad bacteriana en aguas mineromedicinales del balneario “Urauco”. Pichincha. Ecuador. An. Real Acad. Farm. Vol. 90 (1): 9 – 18.
23. Chávez Nara R B. (2020). Aislamiento y caracterización fenotípica de Aeromonas spp. correlacionada con los parámetros físicos del agua y su sensibilidad a los antimicrobianos en tres sistemas acuáticos de los Andes ecuatorianos. Trabajo de titulación. Carrera de Medicina Veterinaria y Zootecnia. Universidad Central del Ecuador. Quito. Ecuador.
24. Chang YC, Shih DY, Wang JY, Yang SS. (2007). Molecular characterization of class 1 integrons and antimicrobial resistance in Aeromonas strains from foodborne outbreak-suspect samples and environmental sources in Taiwan. Diagnostic. Microbiology and Infectious Disease. Vol. 59:191–197.
25. Jacobs L, Chenia HY. (2007). Characterization of integrons and tetracycline resistance determinants in Aeromonas spp. isolated from South African aquaculture systems. International Journal of Food Microbiology. Vol. 114: 295–306.
26. Skwor T, Stringer S, Haggerty J, Johnson J, Duhr S, Johnson M, Seckinger M, Stemme M. (2020). Prevalence of Potentially Pathogenic Antibiotic-Resistant Aeromonas spp. in Treated Urban Wastewater Effluents versus Recipient Riverine Populations: a 3-Year Comparative Study. Applied and Environmental Microbiology. Vol. 86 (3): e02053-19.
27. Ishii S. (2019). Ecology of Pathogens and Antibiotic-resistant Bacteria in Environments: Challenges and Opportunities. Microbes Environ. Vol. 34(1): 1-4.
28. Yarzabal L, Buela L, Batista R. (2021). Climate change, melting cryosphere and frozen pathogens: Should we worry? Environmental Sustainability, Vol. (4): 489–501. https://doi.org/10.1007/s42398-021-00184-8.
29. Letten AD, Hall AR, Levine JM. (2021). Using ecological coexistence theory to understand antibiotic resistance and microbial competition. Nat. Ecol. Evol. Vol. 5: 431–441 https://doi.org/10.1038/s41559-020-01385-w.
30. Lamy B, Baron S, Barraud O. (2022). Aeromonas: the multifaceted middleman in the One Health world. Current Opinion in Microbiology. Vol. 65: 24-32. https://doi.org/10.1016/j.mib.2021.09.012