1. EUROPEAN MEDICINES AGENCY (EMA)
Lisocabtagene miraleucel (Breyanzi®) Bristol Myers Squibb
Indicación: Tratamiento de pacientes adultos con linfoma difuso de células B grandes (DLBCL) en recaída o refractario, linfoma mediastínico de células B grandes primario (PMBCL) y linfoma folicular de grado 3B (FL3B), después de dos o más líneas de terapia sistémica.
Tipo: Medicamento huérfano de terapia avanzada basado en células T autólogas modificadas genéticamente dirigida a CD19. Autorizado con anterioridad por FDA en febrero de 2021. Se administra como una composición definida de células T viables positivas para CAR (receptor de antígeno quimérico que consta de componentes CD8 y CD4), compuesto por el fragmento de cadena única de la región variable (scFv) del anticuerpo monoclonal FMC63, la región bisagra de IgG4, el dominio transmembrana CD28, el dominio coestimulador 4-1BB (CD137) y el dominio de activación zeta de CD3. Además, el medicamento incluye un receptor del factor de crecimiento epidérmico truncado no funcional (EGFRt) que se coexpresa en la superficie celular con el CAR específico de CD19. El medicamento se prepara a partir de las células T del paciente, obtenidas mediante leucoaféresis. Los linfocitos T CD8+ y CD4+ purificados son activados por separado y son transducidos mediante un vector lentiviral que contiene el transgén CAR anti-CD19. Las células T transducidas son expandidas en cultivo celular y son formuladas como viales de componentes CD8 y CD4 separados, que se unen al administrarse la dosis única del medicamento.
Mecanismo: Inmunoterapia celular autóloga genéticamente modificada dirigida a CD19, en la que el receptor de antígeno quimérico (CAR) se une al CD19 expresado en la superficie tanto de las células B tumorales como de las normales, induciendo la activación y proliferación de las células CAR T, la liberación de citocinas proinflamatorias y la muerte citotóxica de las células diana. La señalización de CD3 zeta es fundamental para iniciar la activación y la actividad antitumoral, mientras que la señalización de 4-1BB (CD137) mejora la expansión de las células T y la persistencia de la actividad.
Eficacia clínica: En un estudio clínico abierto y multicéntrico, de un solo brazo, sobre 193 pacientes evaluables con linfoma difuso de células B grandes refractario, la tasa de respuesta global fue del 73% (completa: 54%) y la mediana de la duración de la respuesta fue de 16,7 meses.
Efectos Adversos: Más comunes (≥ 20%): fatiga, síndrome de liberación de citocinas, dolor musculoesquelético, náuseas, cefalea, encefalopatía, infecciones, disminución del apetito, diarrea, hipotensión, taquicardia, mareos, tos, estreñimiento, dolor abdominal. dolor, vómitos y edema. Graves (46%): síndrome de liberación de citocinas, encefalopatía, sepsis, neutropenia febril, afasia, neumonía, fiebre, hipotensión, mareos y delirio.
Tebentafusp (Kimmtrak®) Immunocore
Indicación: tratamiento de pacientes adultos con melanoma uveal irresecable o metastásico positivos para HLA-A*02:01
Tipo: Medicamento huérfano biológico. Autorizado con anterioridad por FDA en enero de 2022. Proteína biespecífica con afinidad para el epítopo gp100 (280-288) HLA-A*02:01 YLEPGPVTA, un péptido lineal que forma parte de la proteína melanocítica PMEL humana, fusionada con un fragmento cadena única de la región variable (scFv) de un anticuerpo anti-CD3.
Mecanismo: La molécula tiene dos extremos activos. Uno reconoce las células tumorales diana y el otro se une a las células del sistema inmunitario y las activa. Actúa aproximando las células inmunitarias a las células cancerosas lo suficiente para que éstas sean destruidas de forma selectiva. Una vez que se une al complejo péptido-HLA específicos en la superficie de la célula diana, reclutan y activan las células T policlonales, a través de CD3, para liberar citocinas y mediadores citolíticos contra las células cancerosas diana.
Eficacia clínica: Un ensayo clínico en fase 3 aleatorizado vs. tratamiento de elección por el investigador (pembrolizumab, ipilimumab o dacarbazina) obtuvo una supervivencia global de 21,7 con tabentafusp vs. 16 meses con el tratamiento comparador, siendo la mediana de la supervivencia libre de progresión de 3,3 vs. 2,9 meses y la tasa de respuesta objetiva del 9,1 vs. 4,8%.
Efectos adversos: Más comunes (≥30%): síndrome de liberación de citocinas, sarpullido, pirexia, prurito, fatiga, náuseas, escalofríos, dolor abdominal, edema, hipotensión, piel seca, dolor de cabeza y vómitos; disminución del recuento de linfocitos, de la hemoglobina y del fosfato; aumento de creatinina, glucosa, AST y ALT. Graves (28%): síndrome de liberación de citocinas (10%), erupciones cutáneas (4,5%), pirexia (2,4%) e hipotensión (2%). Las reacciones adversas llevaron a la suspensión permanente del 3,3% de los tratamientos.
Daridorexant (Quviviq®) Idorsia
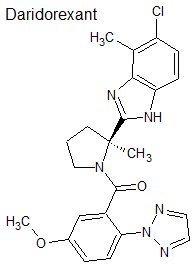
Indicación: Tratamiento de pacientes adultos con insomnio, caracterizado por dificultades para iniciar y/o mantener el sueño.
Tipo: Medicamento estándar. Autorizado con anterioridad por FDA en enero de 2022. Derivado bencimidazólico
Mecanismo: Antagonismo de los receptores de orexina. El sistema de señalización del neuropéptido orexina juega un papel relevante en el mantenimiento del estado de vigilia. El bloqueo de la unión de los neuropéptidos orexina A y orexina B a sus correspondientes receptores OX1R y OX2R suprime el impulso de vigilia.
Eficacia clínica: Dos ensayos clínicos aleatorizados y controlados con placebo sobre un total de 1,854 pacientes con insomnio crónico (18-88 años) de tres meses de duración. Las variables principales de eficacia para ambos estudios fueron el cambio desde el inicio hasta el mes 1 y 3 en la latencia hasta el sueño persistente (LPS, medida de la inducción del sueño) y el despertar después del inicio del sueño (WASO, medida de la persistencia del sueño), medidos mediante polisomnografía. A los tres meses los valores de persistencia del sueño (WASO) experimentaron una mejora del 31% (dosis de 50 mg), 23% (25 mg) y 11% (placebo), mientras que la latencia (LPS) fue reducida en un 45% (50 mg), 46% (25 mg) y 34% (placebo). Las diferencias de ambas dosis del fármaco respecto al placebo fueron estadísticamente significativas.
Efectos adversos: Más comunes (2-7%): Cefalea, somnolencia, fatiga, vértigo, náusea.
Relugolix (Orgovyx®) Myovant
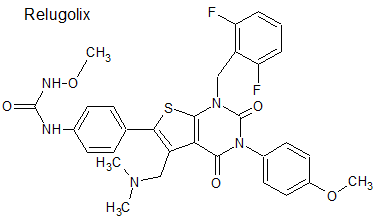
Indicación: Tratamiento de pacientes adultos con cáncer de próstata hormonosensible avanzado.
Tipo: Medicamento estándar. Autorizado con anterioridad por FDA en diciembre de 2020. Derivado tienopirimidínico.
Mecanismo: Antagonista hormonal que se une de forma competitiva a los receptores de la hormona liberadora de gonadotropina (GnRH) en la glándula pituitaria anterior, impidiendo que se una la GnRH nativa. Esto reduce la secreción de la hormona luteinizante (LH) y la hormona estimulante del folículo (FSH), lo que provoca una reducción en la producción de testosterona de los testículos.
Eficacia clínica: Estudio aleatorizado y abierto en hombres adultos con cáncer de próstata avanzado sensible a los andrógenos. Tasa de castración médica del 96,7 % en comparación con el 88,8 % en el grupo comparador (leuprorelina).
Efectos Adversos: Más comunes (≥10%): sofocos (54%), aumento de glucosa (44%), aumento de triglicéridos (35%), dolor musculoesquelético (30%), disminución de hemoglobina (28%), ALT elevada (27%), fatiga (26%), AST elevada (18%), estreñimiento (12%) y diarrea (12%). Graves (12%): infarto de miocardio (0,8 %), lesión renal aguda (0,6%), arritmia (0,6%), hemorragia (0,6%) e infección del tracto urinario (0,5%). La interrupción permanente del tratamiento debido a una reacción adversa se produjo en el 3,5 % de los pacientes.
Difelikefalina (Kapruvia®) Vifor Frexenius
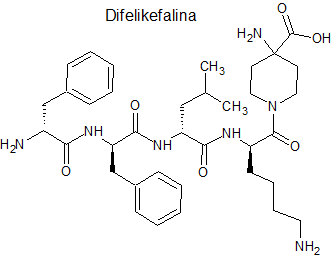
Indicación: Tratamiento del prurito de moderado a intenso asociado con la enfermedad renal crónica en pacientes adultos en hemodiálisis.
Tipo: Medicamento estándar. Autorizado con anterioridad por FDA en agosto de 2021. Péptido sintético: (D)Phe-(D)Phe-(D)Leu-(D)Lys-aminopiperidinacarboxilato.
Mecanismo: Agonista selectivo del receptor opioide kappa (k).
Eficacia clínica: Dos ensayos clínicos aleatorizados, multicéntricos, doble-ciego y controlados con placebo, sobre un total de 851. Tasa de respuesta (descenso 4 puntos o más en la escala WI-NRS; Worst Itching Intensity Numerical Rating Scale) del 37-40% vs. 21-26% con placebo.
Efectos Adversos: Más comunes (3-9%): diarrea, mareos, náusea, alteraciones de la marcha hiperpotasemia, cefalea y somnolencia%); graves (4,5 %), interrumpieron el tratamiento el 2,6 %.
Rimegepant (Vydura®) Biohaven
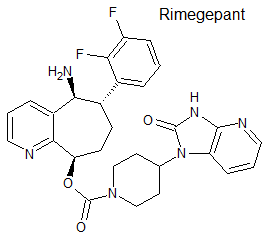
Indicación: Tratamiento agudo de la migraña con o sin aura en adultos; tratamiento preventivo de la migraña episódica en adultos que presentan al menos 4 ataques de migraña al mes.
Tipo: Medicamento estándar. Autorizado con anterioridad por FDA en febrero de 2020. Incluye heterociclos condensados con piridina: cicloheptapiridina e imidazopiridina.
Mecanismo: Antagonista del péptido relacionado con el gen de la calcitonina (CGRP).
Eficacia clínica: Crisis aguda: un ensayo clínico aleatorizado, doble ciego y controlado con placebo en 1466 pacientes; pacientes libres de dolor a las dos horas: 21,2% vs. 10,9%; pacientes sin síntomas más molestos (fotofobia, fonofobia y náusea): 35,1% vs. 26,8%. Prevención de la migraña: un ensayo clínico aleatorizado, doble ciego y controlado con placebo en 747 pacientes; reducción del número de días mensuales sin migraña: 4,3 vs. 3,5; pacientes respondedores (reducción de al menos un 50% del dolor y síntomas más molestos): 49,1% vs. 41,5%.
Efectos Adversos: Más común (2-3% vs. 0,8% placebo): náusea.
Brolucizumab (Veobu®) Novartis
Indicación: Tratamiento de adultos con degeneración macular asociada a la edad (DMAE) neovascular (húmeda) o con discapacidad visual debida al edema macular diabético (EMD)
Tipo: Medicamento biológico. Autorizado con anterioridad por FDA en octubre de 2019. Es un fragmento de cadena sencilla de la región variable (scFv) de un anticuerpo monoclonal humanizado frente a VEGF-A.
Mecanismo: Inhibidor del factor de crecimiento endotelial vascular (VEGF) humano. Se une a las tres isoformas principales de VEGF-A (VEGF110, VEGF121 y VEGF165), evitando así la interacción de éste con los receptores VEGFR-1 y VEGFR-2. Al inhibir el VEGF-A, brolucizumab suprime la proliferación de células endoteliales, la neovascularización y la permeabilidad vascular.
Eficacia clínica: Degeneración macular asociada a la edad (DMAE) neovascular (húmeda): dos ensayos clínicos aleatorizados, multicéntricos, doblemente enmascarados y controlados con comparador activo (aflibercept), sobre 1817 pacientes durante dos años; la variación media desde el inicio del tratamiento en la agudeza visual mejor corregida (BCVA) en la semana 48, medida por el puntaje de letra del estudio de tratamiento temprano de la retinopatía diabética (ETDRS) fue de 6,6-6,9 puntos vs. 6,8-7,6 con aflibercept; el porcentaje de pacientes con una mejora de al menos un 15% en BCVA fue del 29-34% vs. 25-30%.
Efectos Adversos: Más comunes (4-10%): visión borrosa, catarata, hemorragia conjuntival, mascas flotantes, dolor ocular, inflamación intraocular, aumento de la presión intraocular, hemorragia retiniana y desprendimiento de vítreo.
2. FOOD & DRUG ADMINISTRATION (FDA)
Sutimlimab (Enjaymo®) Bioverativ
Indicación: Para reducir la necesidad de transfusión de glóbulos rojos (RBC) debido a hemólisis en adultos con enfermedad por crioaglutininas (cold agglutinin disease; CAD).
Tipo: Medicamento huérfano biológico. Anticuerpo monoclonal humanizado (IgG4).
Mecanismo: Inhibe la vía clásica del complemento (CP) y se une específicamente al componente 1 de la proteína del complemento, subcomponente s (C1s), una serina proteasa que escinde C4, pero no inhibe la lectina ni las vías alternativas. La inhibición de la vía clásica del complemento a nivel de C1s evita el depósito de opsoninas del complemento en la superficie de los glóbulos rojos, lo que da como resultado la inhibición de la hemólisis en pacientes con CAD.
Eficacia clínica: Tasa de respuesta del 63%. Se define como paciente respondedor a aquél que experimentó un aumento desde el inicio en el nivel de hemoglobina (Hgb) ≥2 g/dL o un nivel de Hgb ≥12 g/dL en el momento de la evaluación (semanas 23, 25 y 26), sin transfusión de sangre desde la semana 5 hasta la 26, y ningún tratamiento para la CAD.
Efectos adversos: Más comunes (≥10%): infección del tracto respiratorio, infección viral, diarrea, dispepsia, tos, artralgia, artritis y edema periférico. Graves (13%): sepsis estreptocócica e infección de herida estafilocócica, artralgia e infección del tracto respiratorio; ninguna condujo a la interrupción del tratamiento.
Mitapivat (Pyrukynd®) Agios
Indicación: Tratamiento de la anemia hemolítica en adultos con deficiencia de piruvato cinasa (PK).
Tipo: Medicamento huérfano. Derivado de la quinolinosulfonamida.
Mecanismo: Activador de la piruvato cinasa que actúa uniéndose alostéricamente al tetrámero de la piruvato cinasa, aumentando su actividad enzimática. La forma de la piruvato cinasa de los glóbulos rojos (PK-R) está mutada en la deficiencia de PK, lo que conduce a una reducción de ATP, una vida útil más corta de los glóbulos rojos y hemólisis crónica.
Eficacia clínica: Tasa de respuesta del 40% vs. 0% con placebo. La respuesta se definió como un aumento de ≥1,5 g/dl en la concentración de hemoglobina (Hb), sostenido desde el inicio en 2 o más evaluaciones programadas (semanas 16, 20 y 24) durante el período de dosis fija sin transfusiones.
Efectos Adversos: Más comunes (≥10%): disminución de estrona (varones), aumento de urato, dolor de espalda, disminución de estradiol (varones) y artralgia. Graves (10%): fibrilación auricular, gastroenteritis, fractura de costillas y dolor musculoesquelético.
Faricimab (Vabysmo®) Genentech
Indicación: Tratamiento de la degeneración macular neovascular relacionada con la edad (húmeda) y edema macular diabético.
Tipo: Medicamento biológico. Anticuerpo monoclonal humanizado (IgG1) biespecífico.
Mecanismo: Actúa a través de la inhibición de dos vías, al bloquear al factor de crecimiento endotelial vascular A (VEGF-A) y a la angiopoyetina-2 (Ang-2). Al inhibir el VEGF-A, faricimab suprime la proliferación de células endoteliales, la neovascularización y la permeabilidad vascular. Al inhibir Ang-2, se cree que faricimab promueve la estabilidad vascular y desensibiliza los vasos sanguíneos frente a los efectos de VEGF-A.
Eficacia clínica: Se observaron reducciones en el grosor del subcampo central (central subfield thickness; CST) desde el inicio hasta el primer año de tratamiento en todos los brazos de tratamiento en dos estudios de fase 3 comparativos con aflibercept en cada una de las indicaciones, donde mostraron que faricimab no es inferior al comparador.
Efectos adversos: Más comunes: hemorragia conjuntival (6-8%), moscas volantes (3%), aumento de la presión intraocular (3%), dolor ocular (2-3%), lágrima del epitelio pigmentario de la retina (1-3%).
