RESUMEN:
Objetivos: revisar la evidencia publicada sobre el uso de AINE (coxibs y clásicos) y evaluar el riesgo cardiovascular (RCV) y gastrointestinal (RGI) asociado.
Material y métodos: fueron seleccionados los estudios de cohorte y caso-control que mostraban el RCV o RGI de los AINE versus no expuestos. Se calculó el RR ponderado y el intervalo de confianza 95% para todos los AINE conjuntamente y de forma individual.
Resultados: se observó un RCV significativo tanto con coxibs [RR= 1.24 (1.19-1.31)] como con AINE clásicos [RR= 1.18 (1.13-1.24)]. Para los coxibs sería elevado incluso a dosis bajas y en sujetos con RCV basal bajo. Por fármaco individual, rofecoxib [RR= 1.41 (1.33-1.50)] junto con diclofenaco [RR= 1.36 (1.27-1.47)] y etoricoxib [RR= 1.26 (1.08-1.48)] son los AINE con mayor RCV.
El metaanálisis sobre el RGI mostró riesgo con los coxibs [RR 1.64 (95% CI 1.44-1.86)]. Por fármaco individual, etoricoxib [RR 4.48 (95% CI 2.98-6.75)] presentó mayor riesgo seguido de rofecoxib [RR 2.02 (95% CI 1.56-2.61)] y celecoxib [RR 1.62 (95% CI 1.46-1.78)]. El riesgo también fue elevado para dosis bajas y edad <65 años.
Conclusión: según nuestro estudio, el uso de AINE (coxibs y clásicos) está relacionado con un incremento similar del RCV, incluso a dosis bajas y en pacientes con un RCV bajo-medio. Por otro lado, el uso de coxibs se relacionaría con un incremento del RGI, siendo elevado incluso para dosis bajas y edad <65 años. El riesgo para etoricoxib podría ser superior que para celecoxib y rofecoxib.
Palabras Clave: acontecimiento adverso, antiinflamatorios no esteroideos, inhibidores selectivos de ciclooxigenasa, riesgo cardiovascular, eventos gastrointestinales, metaanálisis, estudios observacionales.
ABSTRACT:
Introduction: the aim of this study is to review the current evidence on the clinical use of NSAIDs, coxibs and nonselective, and to evaluate its cardiovascular (CVR) and gastrointestinal risk (GIR) by means of a meta-analytic procedure.
Materials and methods: cohort and case-control studies showing CVR and GIR associated with NSAIDs versus no treatment were selected. We estimated the pooled RR and the 95% confidence interval (CI) for all NSAIDs as a whole and individually.
Results: both coxibs (RR, 1.22 [95%CI, 1.17-1.28]) and nonselective NSAIDs (RR 1.18 [95%CI, 1.12-1.24]) were associated with an increased CVR. The coxibs CVR remained even for low-dose and low-baseline CVR subgroups. Analysis by drug disclosed that rofecoxib (RR 1.39 [95%CI, 1.31- 1.47]), along with diclofenac (RR, 1.34 [95%CI, 1.26-1.42]) and etoricoxib (RR 1.27 [95%CI, 1.12-1.43]) were the NSAIDs associated with the highest CVR.
Gastrointestinal risk meta-analysis showed that coxibs were associated with a GIR increment [RR1.64 (95% CI 1.44-1.86)]. Analysis by drug disclosed that etoricoxib [RR 4.48 (95% CI 2.98-6.75)]presented the highest GIR followed by rofecoxib [RR 2.02 (95% CI 1.56-2.61)] and celecoxib [RR1.62 (95% CI 1.46-1.78)]. GIR was also high for <65 year-old and low-dose coxibs subgroups.
Conclusion: according to our study the use of NSAIDs (coxibs and nonselective) are associated with a similar CVR increment, even for low-dose and low-baseline CVR subgroups. On the other hand, the use of coxibs is associated with a GIR increased, which would be high even for low-dose coxibs and <65-year-old subgroups. The risk would be higher for etoricoxib than for celecoxib and rofecoxib.
Keywords: adverse drug reactions; nonsteroidal anti-inflammatory drugs; cardiovascular risk; meta-analysis; observational studies; cyclo-oxygenase 2 inhibitor; gastrointestinal events
1. INTRODUCCIÓN
En el año 2015 los fármacos para el tratamiento del dolor se encontraban en tercera posición de ventas de medicamentos a nivel mundial (1). El incremento de la población geriátrica esperado a nivel mundial (22% de la población en 2050) junto con el aumento de patologías relacionadas con dolor crónico, como las enfermedades reumáticas o el cáncer, hace que las expectativas de consumo de fármacos analgésicos en general y de los antiinflamatorios no esteroideos (AINE) en particular sigan aumentando (2).
Los AINE ejercen su efecto al reducir la síntesis de prostaglandinas por inhibición de la enzima ciclooxigenasa. Por su propio mecanismo de acción, los AINE clásicos o tradicionales como diclofenaco e ibuprofeno han sido relacionados con efectos adversos a nivel gastrointestinal (3, 4)
En el año 1999, los 2 primeros inhibidores selectivos de ciclooxigenasa 2 (coxibs), rofecoxib y celecoxib, irrumpieron en el mercado de los analgésicos/antiinflamatorios como una alternativa con menor toxicidad gastrointestinal que los AINE no selectivos (5-7). El amplio consumo de antiinflamatorios a nivel mundial (1) junto con los importantes ensayos clínicos publicados (5, 8-10) y la promoción realizada por la industria farmacéutica fueron parte de la clave de su éxito.
Sin embargo, existen dudas acerca de la mayor seguridad gastrointestinal de los coxibs sobre los AINE no selectivos a largo plazo en la práctica clínica habitual. La ausencia, en los ensayos clínicos, de un grupo control no expuesto a tratamiento antiinflamatorio no permite estimar de forma directa el exceso de riesgo gastrointestinal (RGI) relacionado con el uso de los coxibs. Además, las dosis utilizadas en estos ensayos clínicos fueron mayores de las utilizadas en la práctica habitual. Por otro lado, las personas en tratamiento concomitante con fármacos gastrolesivos como los antiagregantes, anticoagulantes o corticoides, y poblaciones con múltiples factores de riesgo no fueron representadas de forma adecuada en los ensayos clínicos.
La mayor parte de los metaanálisis de ensayos clínicos controlados publicados hasta el momento también incluyen estudios con un grupo control de sujetos en tratamiento con AINE no selectivos, con o sin tratamiento gastroprotector (11-14). Además se han encontrado 2 meta-análisis de ensayos clínicos donde el grupo control sí estaba compuesto por participantes que reciben placebo. Zeng et al.(15) mostraron un riesgo de eventos gastrointestinales superior para celecoxib tanto en dosis de 200 mg/día como de 100 mg/día. Por su parte, Bhala et al. (3) identificaron un riesgo aumentado para coxibs de complicaciones del tracto gastrointestinal superior como hemorragia, perforación y obstrucción [RR 1.81 (95% CI 1.17-2.81)].
Por otro lado, tras la comercialización de los coxibs pronto apareció una especial preocupación por sus efectos adversos cardiovasculares sugiriéndose asimismo un cierto riesgo cardiovascular (RCV) para los AINE clásicos (16). El estudio VIGOR (Vioxx Gastrointestinal Outcomes Research) que comparaba rofecoxib versus naproxeno detectó un riesgo de eventos cardiovasculares (infarto de miocardio, accidente cerebrovascular y mortalidad de origen cardiovascular) 2,38 veces superior para rofecoxib (8). En 2001, el estudio APPROVe (Adenomatous Polyp Prevention on Vioxx) que estudiaba el riesgo de pólipos adenomatosos en pacientes que recibían rofecoxib versus placebo, mostró un riesgo de infarto de miocardio 2 veces superior para rofecoxib (17).
Tras la retirada voluntaria de rofecoxib en 2004 por parte de Merck, se han publicado numerosos metaanálisis de ensayos clínicos con el fin de dilucidar el RCV del resto de coxibs que continúan comercializados, celecoxib, etoricoxib y valdecoxib. Los resultados publicados en ellos continúan siendo discrepantes. Mientras que Solomon et al. (18) observaron un riesgo de eventos cardiovasculares aumentado para celecoxib, Trelle et al. (19) no pudieron confirmar estos resultados para celecoxib ni tampoco para etoricoxib. Más adelante, De Vechis et (20) observaron un riesgo aumentado de eventos cardiovasculares serios para celecoxib pero no para etoricoxib.
Los datos publicados indican que el riesgo relativo (RR) de eventos cardiovasculares por AINE podría situarse en el rango de 1.0 y 2.0 (21, 22). De esta forma, los ensayos clínicos controlados, debido a su tamaño de muestra, revelan un número insuficiente de eventos adversos cardiovasculares como para identificar diferencias entre estudios individuales. Esta circunstancia, junto al hecho de que solo se hayan encontrado dos meta-análisis de estudios observacionales sobre el RCV de los AINE sin limitación de eventos (21, 23) y la creciente preocupación sobre el RCV de los AINE en los últimos años (24, 25), justificaría la necesidad de más estudios
De esta forma, el objetivo de nuestro trabajo fue intentar esclarecer el RCV de los AINE (coxibs y no selectivos) y el RGI de los coxibs mediante la realización de 2 meta-análisis de estudios observacionales sobre el RCV y el RGI de los AINE frente a no tratamiento antiinflamatorio basándonos en la guía PRISMA para la elaboración de revisiones sistemáticas (http//www. prisma- statement.org/).
2. MATERIAL Y MÉTODOS
2.1. Estrategia de búsqueda
Se realizó una búsqueda de estudios en Pubmed y Embase entre 1-octubre-1999 y 1-septiembre-2017, con restricción de idioma a español, inglés, francés e italiano. Se utilizaron términos MeSH (Medical Subject Headings) para la búsqueda en Pubmed y términos Emtrée (Embase Tree) en Embase, siempre que fue posible, en combinación con texto libre. La sintaxis de la búsqueda consistió en la recopilación de los nombres de los diferentes AINE, el grupo farmacológico, mecanismo de acción, términos relacionados con eventos cardiovasculares y gastrointestinales y términos relacionados con el tipo de estudio. Las estrategias detalladas de búsqueda están disponibles en el material complementario. Además, se realizó una búsqueda manual de las referencias contenidas en los artículos seleccionados.
Tras la eliminación de los duplicados fueron revisados los títulos y resúmenes de los artículos identificados seleccionando los estudios que cumplían los siguientes criterios de inclusión: 1) estudios observacionales de cohorte o caso-control, 2) con participantes>18 años en tratamiento activo en el momento del estudio, 3) que proporcionaban un valor de riesgo relativo (RR), odds ratio (OR), hazard ratio (HR) o incidence rate ratio (IRR) con un intervalo de confianza (IC) del 95% para cualquier evento cardiovascular/gastrointestinal de un AINE individual o por grupo farmacológico, 4) con sujetos no expuestos a tratamiento antiinflamatorio como grupo control en los estudios de cohorte y sujetos sin evento cardiovascular/gastrointestinal en estudios de caso-control.
Fueron excluidos aquellos estudios considerados no completos, cartas, comentarios, comunicaciones a congresos, series de casos, así como estudios observacionales realizados a partir de datos de ensayos clínicos aleatorizados. También fueron excluidos los estudios que incluían participantes con enfermedad oncológica, sometidos a procesos quirúrgicos, en tratamiento con AINE de uso tópico, intravenoso o intramuscular, o en tratamiento con aspirina por su efecto protector de la morbimortalidad cardiovascular. Por otro lado, para evitar duplicidades de casos, en aquella situación en la que 2 estudios coincidían en base de datos, periodo de estudio y variable medida, se excluyó aquel con un periodo de estudio más corto. Cualquier discrepancia en relación a los estudios seleccionados fue resuelta por consenso entre los autores.
2.2. Extracción de datos y calidad de los estudios
Se utilizó un formulario estandarizado para extraer los datos de los estudios seleccionados donde se incluía: nombre del autor principal, año de reclutamiento y periodo de seguimiento, año de publicación, país donde el estudio fue realizado, diseño del estudio, número, edad y sexo de los participantes, fármaco de estudio, RCV basal, evento cardiovascular/gastrointestinal analizado, factores de confusión utilizados para el ajuste de los resultados, estimador del riesgo utilizado y su valor con IC del 95%. Cuando estaba disponible, se obtuvo información sobre la dosis y la duración del tratamiento. No se contactó con los autores para cumplimentar el formulario en aquellos casos de falta de información publicada.
Las patologías cardiovasculares obtenidas en la búsqueda fueron agrupadas en eventos cerebrovasculares (accidente cerebrovascular, accidente cerebrovascular isquémico, accidente cerebrovascular hemorrágico, accidente isquémico transitorio, hemorragia intracraneal, hemorragia subaracnoidea), eventos cardiacos (angina inestable, arritmia, cardiopatía isquémica, evento cardiaco, fibrilación auricular, infarto miocardio, insuficiencia cardiaca, parada cardiaca y síndrome coronario agudo), eventos vasculares (embolismo pulmonar, trombosis venosa profunda y tromboembolismo venoso), mortalidad cardiovascular (mortalidad por accidente cerebrovascular, mortalidad cardiovascular, mortalidad por infarto miocardio y muerte súbita) y otros eventos cardiovasculares (resultados mostrados como variables combinadas).
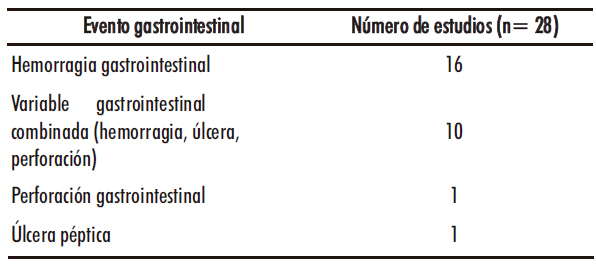
Las patologías gastrointestinales identificadas en los estudios fueron agrupadas bajo el término común acontecimientos adversos gastrointestinales (AAG).
Tabla 1. Descripción de los acontecimientos adversos gastrointestinales
 Para garantizar en la medida de lo posible la homogeneidad de los datos aportados, se evaluó la calidad de los estudios utilizando la escala Newcastle-Ottawa (NOS) (26). Esta escala está compuesta por 3 parámetros de calidad: selección, comparabilidad y exposición/resultado. La NOS asigna un máximo de 4 puntos para el primer parámetro, 2 para el segundo y 3 para el último. De esta forma, un estudio con la máxima calidad presentará una puntuación de 9, entre 6 y 8 puntos se habla de estudios de calidad intermedia y los estudios con una puntuación <6 tendrán una calidad baja. Para lograr una mayor homogeneidad entre los estudios incluidos en el meta-análisis, fueron excluidos aquellos estudios con un NOS <4.
Para garantizar en la medida de lo posible la homogeneidad de los datos aportados, se evaluó la calidad de los estudios utilizando la escala Newcastle-Ottawa (NOS) (26). Esta escala está compuesta por 3 parámetros de calidad: selección, comparabilidad y exposición/resultado. La NOS asigna un máximo de 4 puntos para el primer parámetro, 2 para el segundo y 3 para el último. De esta forma, un estudio con la máxima calidad presentará una puntuación de 9, entre 6 y 8 puntos se habla de estudios de calidad intermedia y los estudios con una puntuación <6 tendrán una calidad baja. Para lograr una mayor homogeneidad entre los estudios incluidos en el meta-análisis, fueron excluidos aquellos estudios con un NOS <4.
2.3. Análisis estadístico
El análisis de los datos se realizó con el programa informático Review Manager 5.3 de la Cochrane Collaboration (Londres, Reino Unido). Los valores de riesgo (RR, OR, HR e IRR) extraídos de cada estudio individual seleccionado fueron combinados para calcular el riesgo relativo ponderado utilizando el método de la varianza inversa genérica de DerSimonian and Laird (27). Este método asigna un peso a cada estudio que compone el metaanálisis en función de su error estándar. Para aumentar el poder estadístico fueron combinados los resultados de los estudios de cohorte y de caso-control.
Puesto que los eventos cardiovasculares y gastrointestinales se consideran poco frecuentes, asumimos que los resultados mostrados como OR, HR e IRR eran buenos estimadores del RR para realizar los cálculos estadísticos (28).
Para considerar la posible variabilidad existente en cada estudio y entre los estudios incluidos en el metaanálisis debido a los diferentes diseños, población incluida y fármacos estudiados, se utilizó un modelo de efectos aleatorios para así obtener un resultado más conservador.
En el metaanálisis sobre el RGI se generó el forest plot del modelo de efectos aleatorio para los coxibs como grupo farmacológico y para celecoxib, etoricoxib y rofecoxib por separado. Por su parte, en el metaanálisis sobre el RCV fueron realizados 3 análisis independientes, uno para AINE como grupo farmacológico, un segundo diferenciando entre AINE clásicos y coxibs, y un último análisis para cada fármaco por separado. En los 2 primeros análisis se incluyeron los estudios que proporcionaban los resultados tanto por grupo farmacológico como por fármaco individual. Sólo se analizaron como resultados de fármaco individual los correspondientes a celecoxib, etoricoxib, rofecoxib, valdecoxib, diclofenaco, ibuprofeno, naproxeno. Entre los AINE no selectivos, se seleccionaron ibuprofeno por su amplia utilización, diclofenaco por ser considerado uno de los de mayor RCV y naproxeno por ser considerado uno de los de menor RCV (3). Si un mismo estudio mostraba los dos tipos de resultados, se dio preferencia a la estimación por grupo farmacológico.
En ambos metaanálisis se planificó la realización de un análisis de subgrupos: por diseño de estudio, dosis, duración del tratamiento, edad y uso de medicación concomitante como antiagregantes/anticoagulantes y protectores gástricos en el metaanálisis sobre el RGI; y por dosis y RCV basal de los participantes en el caso del metaanálisis sobre el RCV. La dosis recibida se clasificó en baja y alta en función del punto de corte proporcionado en cada estudio. Para el RCV basal se establecieron 2 grupos: bajo-medio, parte de los participantes del estudio presentaban algún factor de RCV (hipertensión, dislipemia, tabaquismo, obesidad o insuficiencia renal) pero ninguno tenía antecedentes de enfermedad aterotrombótica o diabetes; y medio-alto, todos los participantes presentaban un factor de RCV y parte de ellos enfermedad aterotrombótica o diabetes.
La heterogeneidad estadística de los metaanálisis fue evaluada utilizando el test de Chi cuadrado (χ2 ) de Cochrane. Un valor de χ2 elevado respecto a sus grados de libertad proporciona indicios de heterogeneidad en los efectos de la intervención. Se consideró la presencia de heterogeneidad estadísticamente significativa cuando p< 0.05. Este test se complementó con el estadístico de Higgins (I2), el cual cuantifica la proporción de variabilidad entre estudios que es causada por la heterogeneidad en lugar de por azar. Un valor entre 0%-25% indica heterogeneidad insignificante, entre 26%-50% heterogeneidad baja, entre 51%-75% moderada y entre 76%-100% indica heterogeneidad alta (29).
Para comprobar la robustez de los resultados se realizó un análisis de sensibilidad. El objetivo de este análisis fue la evaluación de la influencia individual de los estudios por estimación del RR ponderado en ausencia de cada estudio. En el metaanálisis sobre el RCV este análisis fue complementado mediante la comparación de los resultados obtenidos con los resultantes de un modelo de efectos fijos y mediante el análisis de aquellos estudios con NOS >6. Por su parte, en el metaanálisis sobre el RGI el análisis de sensibilidad se complementó analizando solo aquellos estudios que mostraban los resultados ajustados por las principales variables de confusión (edad, historia de eventos gastrointestinales, toma de fármacos gastroprotectores y tratamientos concomitantes con medicamentos gastrolesivos).
El sesgo de publicación fue evaluado mediante la visualización del diagrama de embudo y el test de regresión de Egger (30).
3. RESULTADOS
3.1. Riesgo cardiovascular
3.1.a. Características y calidad de los estudios incluidos
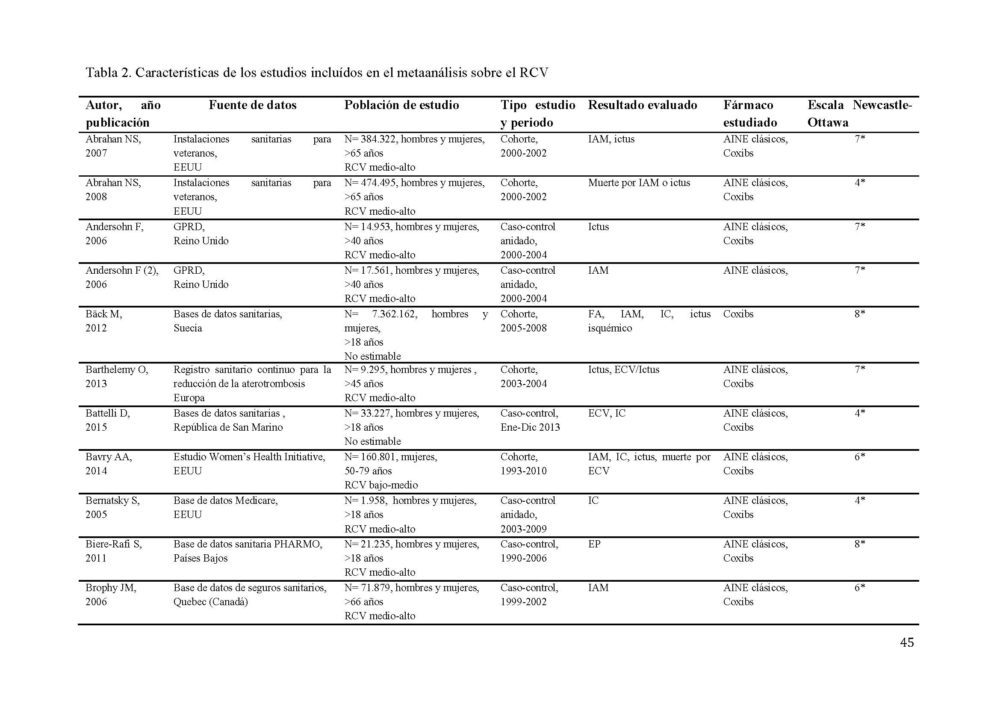
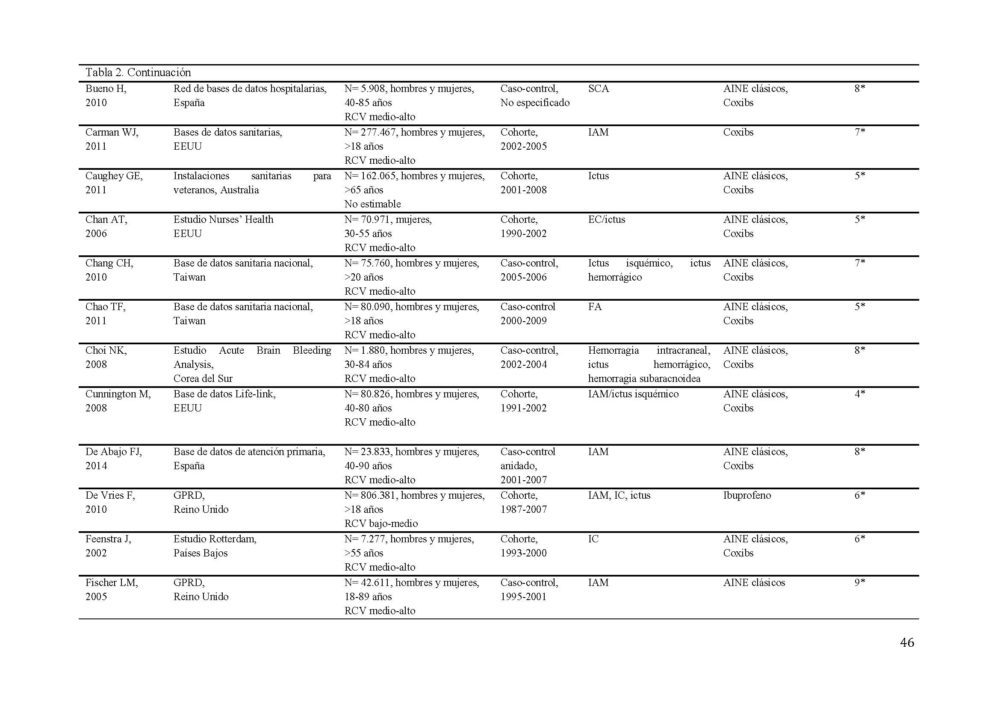
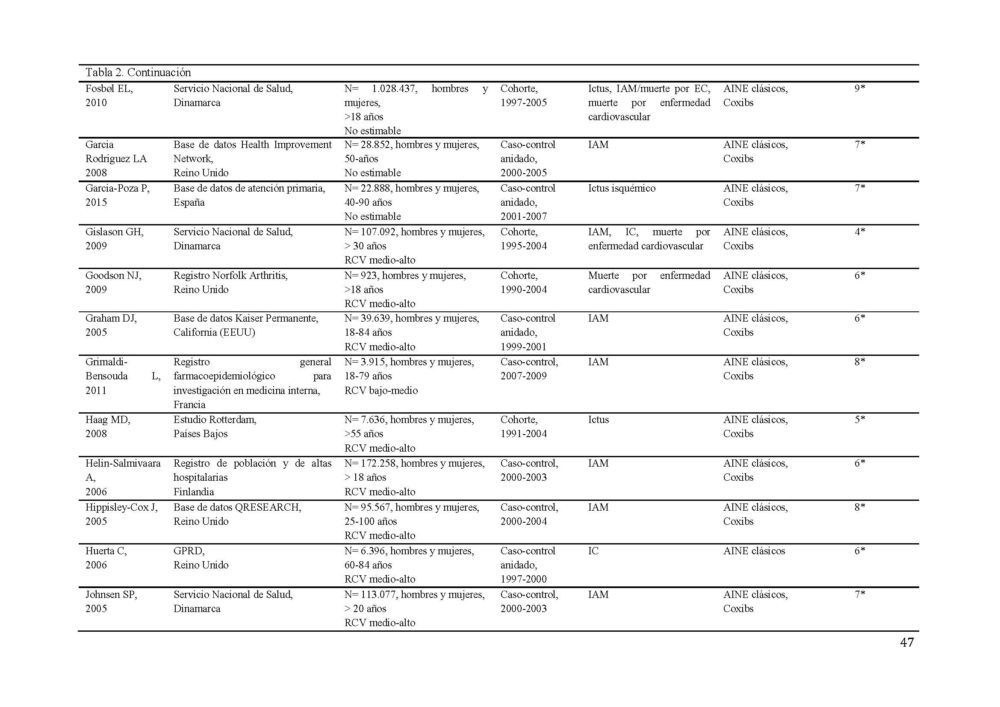
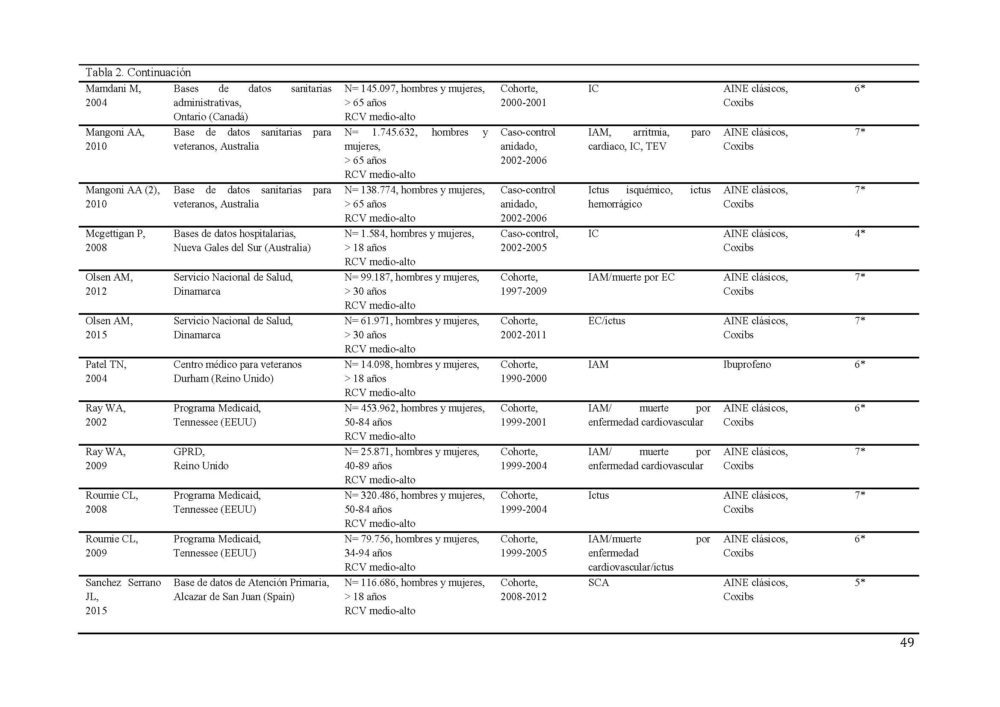
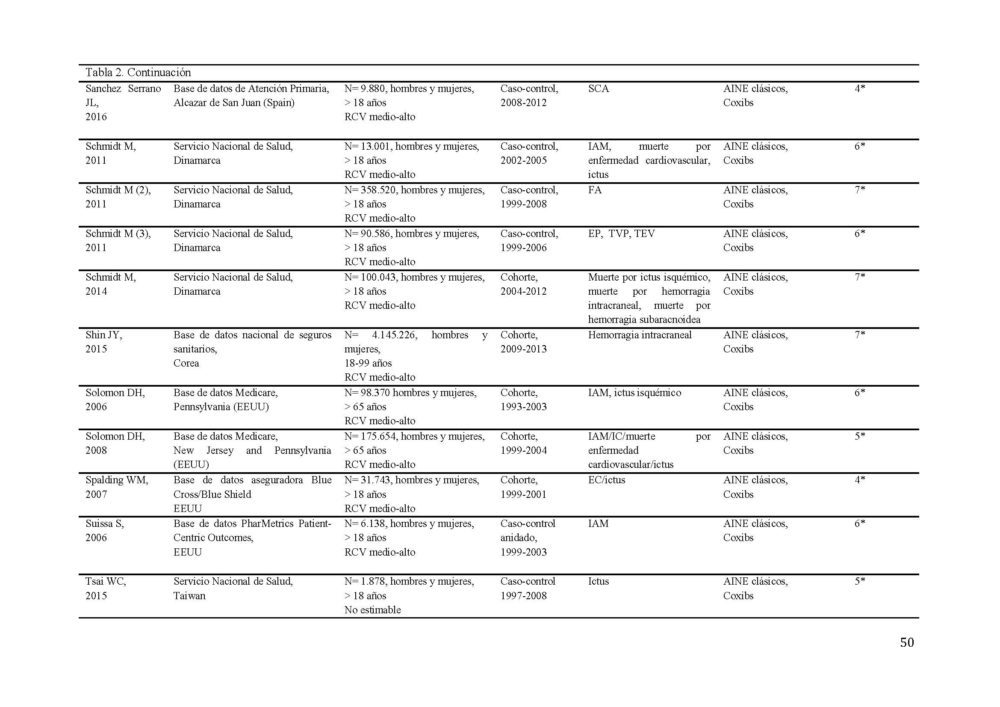
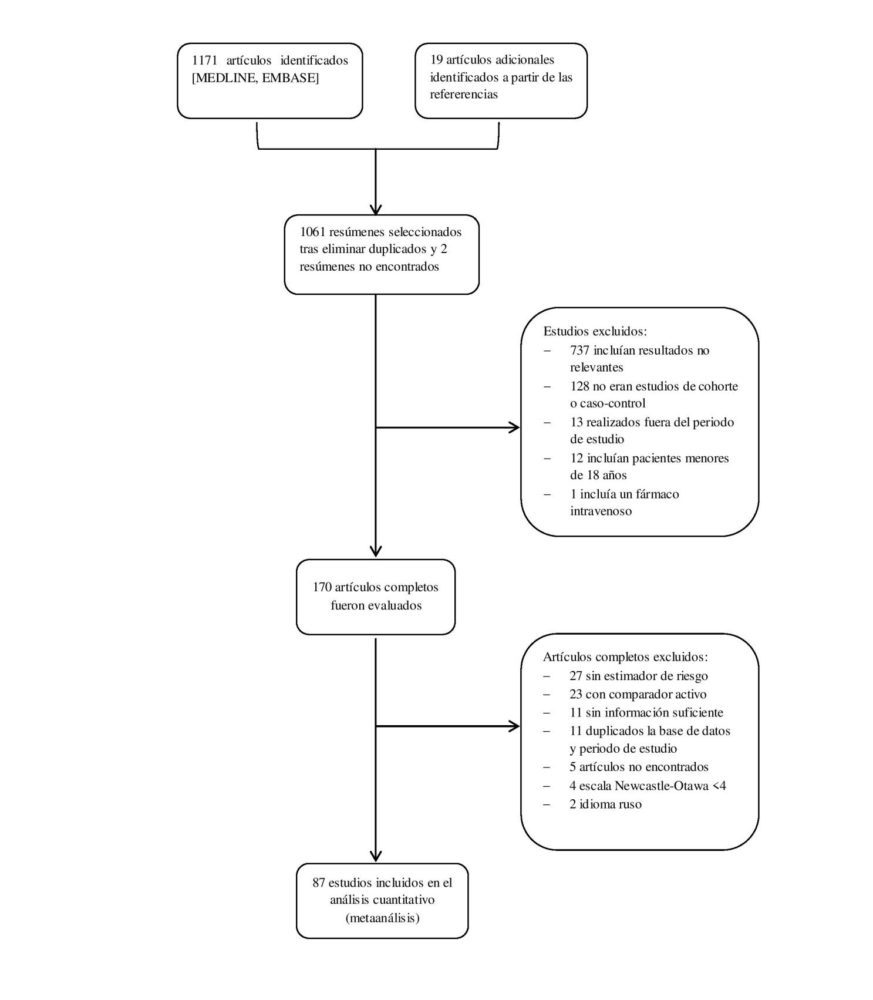
La búsqueda diseñada identificó 1190 potenciales estudios a incluir en el metaanálisis (figura 1). 1061 resúmenes fueron revisados tras eliminar los duplicados. Todos los estudios estaban publicados en inglés a excepción de 2 que lo estaban en ruso, los cuales, ante la imposibilidad de una traducción adecuada y la baja probabilidad de influencia en los resultados (0,001% de los estudios), fueron excluidos. De estos, 170 fueron seleccionados para una revisión más exhaustiva. Tras aplicar los criterios de inclusión, 87 estudios, 40 de cohorte y 47 caso-control, con más de 22 millones de participantes fueron seleccionados para constituir el metaanálisis (31–106). Las características detalladas de los estudios incluidos se muestran en la tabla 2.
Tabla 2. Características de los estudios incluídos en el metaanálisis sobre el RCV.
AINE, antiinflamatorio no esteroideo; EC, enfermedad coronaria; ECV, enfermedad cardiovascular; EP, embolismo pulmonar; FA, fibrilacion auricular; GPRD, General Practice Research Database; IAM, infarto agudo de miocardio; IC, insuficiencia cardiaca; RCV, riesgo cardiovascular; SCA, síndrome coronario agudo; TEV, tromboembolismo venoso; TVP, trombosis venosa profunda
El evento cardiovascular estudiado con más frecuencia fue el infarto de miocardio (37/77 estudios) seguido del accidente cerebrovascular (30/77 estudios). La mayor parte de los estudios incluían hombres y mujeres entre sus participantes, excepto 4 que sólo incluían mujeres (40, 47, 104, 105).
Los estudios presentaron una calidad media de 6 en la escala NOS. 37 de los 77 estudios tenían una calidad 7 o superior.
Figura 1. Diagrama de flujo de identificación y selección de estudios sobre el RCV
3.1.b. Metaanálisis
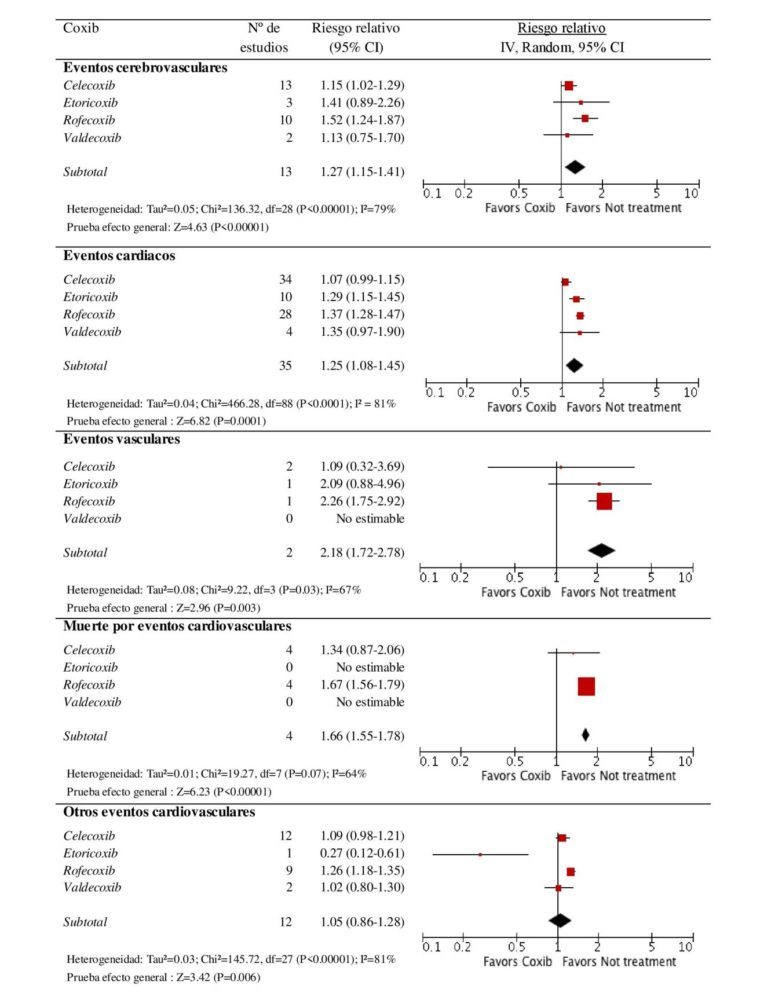
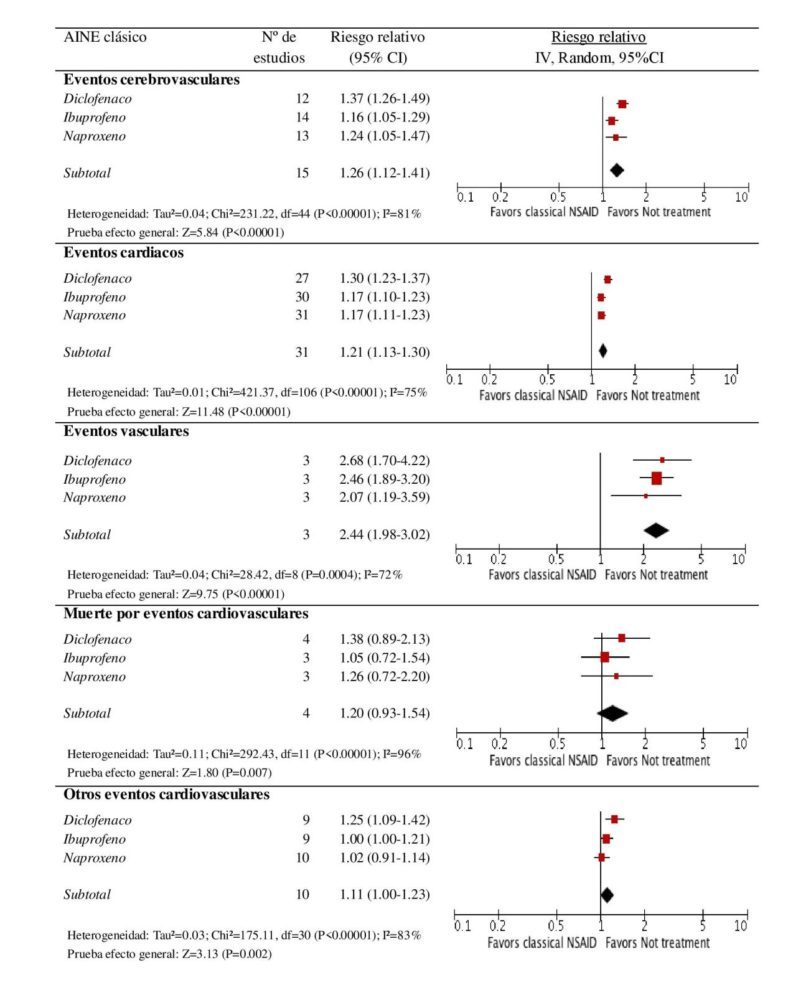
Cuando los AINE fueron analizados como un único grupo, se observó un RCV aumentado [RR=1.24 (1.18-1.29)] respecto a los participantes que no estaban en tratamiento antiinflamatorio. Este riesgo se mantuvo en las 5 categorías de eventos cardiovasculares: eventos cerebrovasculares [RR=1.20 (1.12-1.30)], eventos cardiacos [RR= 1.22 (1.18-1.27)], eventos vasculares [RR= 1,78 (1,35-2,33)], mortalidad por eventos cardiovasculares [RR= 1,35 (1.05-1.72)] y otros eventos cardiovasculares [RR= 1.08 (1.00-1.16)]. El análisis por subgrupo farmacológico mostró un riesgo ligeramente superior para coxibs [RR= 1.24 (1.19-1.31)] que para AINE clásicos [RR= 1.18 (1.13-1.24)]. Sin embargo, se debe puntualizar la existencia de heterogeneidad estadística alta en los 3 análisis con una I2 > 88% en todos los casos (P< 0.00001).
Figura 2. Comparación del efecto de los diferentes coxibs versus no tratamiento en los eventos cardiovasculares.
En el metaanálisis por fármaco individual se observó que, a excepción de valdecoxib [RR= 1.14 (0.89-1.24)], todos los AINE clásicos y coxibs analizados mostraron un incremento estadísticamente significativo del RCV respecto a los participantes sin tratamiento antiinflamatorio no esteroideo. Rofecoxib fue el que mayor RCV presentó [RR= 1.41 (1.33-1.50)] seguido de diclofenaco [RR=
1.36 (1.27-1.47)], etoricoxib [RR= 1.26 (1.08-1.48)], ibuprofeno [RR= 1.17 (1.10-1.25)], naproxeno [RR= 1.17 (1.09-1.26)] y celecoxib [RR= 1.14 (1.06-1.22)]. En este caso, la heterogeneidad encontrada también fue moderada-alta (I2 > 69% en todos los análisis). En las figuras 2 y 3 se muestran los forest plot de los resultados combinados por tipo de evento cardiovascular. Tanto en AINE clásicos como en coxibs, el mayor riesgo fue observado en la categoría de eventos vasculares [RRAINEclasico= 2.44 (1.98-3.02); RRcoxibs= 2.18 (1.72-2.78)].
22 estudios estimaron el efecto de la dosis en el RCV (31, 34, 35, 42, 43, 52, 55–59, 61, 65, 75, 82,86–88, 90, 102, 103, 106). El RR ponderado para la dosis alta de los AINE clásicos fue mayor que para la dosis baja [RRDbaja= 1.09 (1.01-1.18) vs RRDalta= 1.36 (1.15-1.61)]. Lo mismo sucedió con los coxibs [RRDbaja= 1.24 (1.18-1.31) vs RRDalta= 1.56 (1.29-1.89)]. Los resultados por fármaco individual se muestran en la tabla 3.
Tabla 3. Relación dosis-efecto para cada fármaco de forma individual sobre el RCV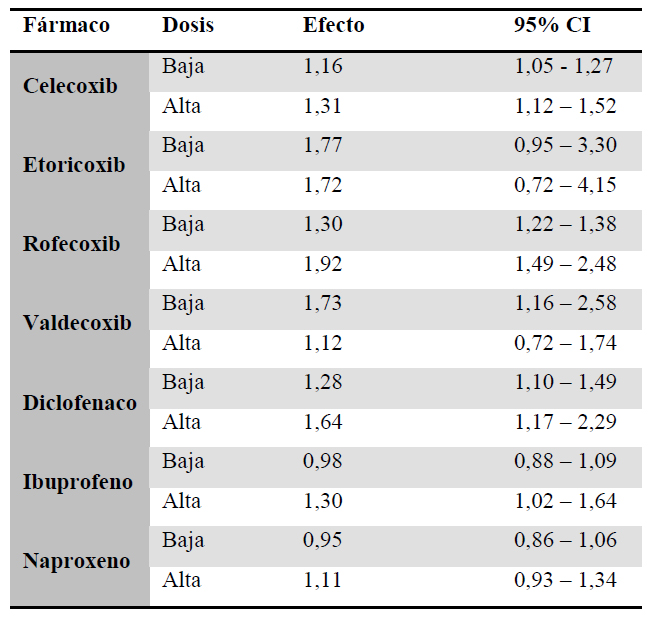 Dosis de corte habitual: celecoxib, 200 mg; etoricoxib, 60 mg; rofecoxib, 25 mg; valdecoxib, 10 mg; diclofenaco, 100 mg; ibuprofeno, 1200 mg; naproxeno, 1000 mg; Dosis de corte minoritaria: celecoxib, 300 mg; etoricoxib, 90, 120 mg; valdecoxib, 20 mg; diclofenaco, 150 mg; ibuprofeno, 1600, 1800 mg; naproxeno, 500, 750 mg
Dosis de corte habitual: celecoxib, 200 mg; etoricoxib, 60 mg; rofecoxib, 25 mg; valdecoxib, 10 mg; diclofenaco, 100 mg; ibuprofeno, 1200 mg; naproxeno, 1000 mg; Dosis de corte minoritaria: celecoxib, 300 mg; etoricoxib, 90, 120 mg; valdecoxib, 20 mg; diclofenaco, 150 mg; ibuprofeno, 1600, 1800 mg; naproxeno, 500, 750 mg
Figura 3. Comparación del efecto de los diferentes AINE clásicos versus no tratamiento en los eventos cardiovasculares.
El análisis de subgrupos según el RCV basal de los participantes mostró que aquellos pacientes con un riesgo bajo-medio presentaban un RCV inferior que aquellos con riesgo medio-alto [RRbajo-medio=1.09 (1.07-1.12); RRmedio-alto= 1.26 (1.20-1.32)], aunque en ambos casos se mantuvieron las diferencias estadísticamente significativas (tabla 4).
3.1.c. Estudio de la heterogeneidad
Tabla 4. Resumen del análisis de subgrupos. Los resultados se muestran como RR (IC95%)
AINE: Antiinflamatorios no esteroideos; AINEc: Antiinflamatorios no esteroideos clásicos; Coxibs: Inhibidores selectivos de ciclooxigenasa 2.
Dada la elevada heterogeneidad encontrada en los análisis realizados, se realizó un estudio de la misma mediante un análisis de subgrupos por diseño del estudio (tabla 4). El RCV ponderado resultante del análisis de los estudios de cohorte fue idéntico al de los estudios de caso-control [RR=1.24 (1.16-1.32)] y coincidente con el RCV del análisis principal. Por otro lado, aunque no era objetivo del estudio y no se incluyeron en el metaanálisis, se analizaron aquellos estudios resultantes de la búsqueda que comparaban el RCV de coxibs versus AINE clásicos. La comparación directa resultó en un riesgo mayor para los coxibs [RR= 1.22 (1.10-1.34)].
3.1.d. Análisis de sensibilidad
El análisis de sensibilidad reveló que el RR ponderado para los eventos cardiovasculares era similar independientemente del estudio suprimido en cada momento con una variación entre 1.21 (1.17-1.25) y 1.25 (1.19-1.31).
Por otro lado, todos los análisis fueron repetidos utilizando un modelo de efectos fijos, no encontrando diferencias significativas en los resultados obtenidos (no se muestran los resultados).
Posteriormente, fueron excluidos aquellos estudios con NOS< 6 para analizar conjuntamente los estudios de mayor calidad metodológica. Los resultados de RCV obtenidos no difirieron de forma significativa con los obtenidos inicialmente, tanto para los AINE como grupo farmacológico [RR=1.19 (1.15-1.24)] como también en el análisis de los subgrupos AINE clásicos [RR= 1.15 (1.09-
1.21)] y coxibs [RR= 1.24 (1.18-1.30)]. La heterogeneidad se mantuvo estadísticamente significativa con I2> 88% (P< 0.00001).
Finalmente fue repetido el metaanálisis excluyendo el estudio de Abraham et al (33) porque mostraba unos resultados de riesgo de mortalidad por eventos cardiovasculares muy superiores respecto al resto de estudios. Su eliminación no modificó el RCV de los AINE como grupo farmacológico pero si aumentó la precisión del resultado [RR= 1.21 (1.17-1.25)].
3.1.e. Evaluación del sesgo de publicación
El diagrama de embudo utilizado para evaluar el sesgo de publicación se muestra en la figura 4. La visualización del diagrama podría indicar una ligera asimetría en el caso de los AINE clásicos pero, la mayor parte de los estudios se distribuyeron alrededor del ápice del embudo. El test de regresión de Egger mostró una pendiente positiva de la recta de regresión y una ordenada en el origen de 1.843 (p<0.001), lo que sugiere la presencia de sesgo de publicación.
 Figura 4. Diagrama de embudo del metaanálisis sobre el RCV. La imagen A muestra todos los estudios sobre los AINE. La imagen B muestra los estudios sobre los AINE clásicos. La imagen C muestra los estudios sobre los coxibs. La imagen D muestra todos los estudios con NOS> 6. La imagen E muestra los estudios sobre AINE clásicos con NOS> 6. La imagen F muestra los estudios sobre coxibs con NOS> 6. Los RR se muestran en escala logarítmica.
Figura 4. Diagrama de embudo del metaanálisis sobre el RCV. La imagen A muestra todos los estudios sobre los AINE. La imagen B muestra los estudios sobre los AINE clásicos. La imagen C muestra los estudios sobre los coxibs. La imagen D muestra todos los estudios con NOS> 6. La imagen E muestra los estudios sobre AINE clásicos con NOS> 6. La imagen F muestra los estudios sobre coxibs con NOS> 6. Los RR se muestran en escala logarítmica.
3.2 Riesgo gastrointestinal
3.2.a. Características y calidad de los estudios incluidos
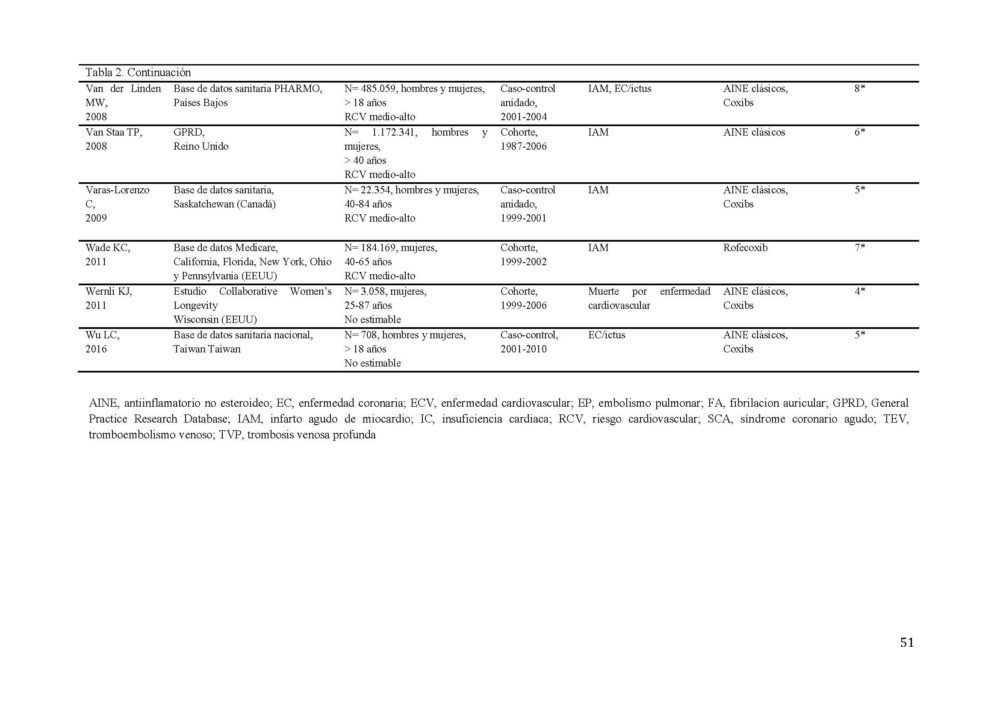
La búsqueda diseñada identificó 1994 potenciales estudios (figura 5). Tras eliminar los duplicados, 1861 títulos/resúmenes fueron revisados, dando lugar a 357 estudios para el análisis del texto completo. Tras aplicar los criterios de inclusión, 28 estudios de coxibs versus no tratamiento, cuatro de cohorte y 24 caso-control fueron seleccionados (107-134). Las características detalladas de los estudios incluidos se muestran en la tabla 5.
Figura 5. Diagrama de flujo de identificación y selección de estudios sobre el RGI
La fecha de publicación de los estudios estaba comprendida entre 2002 y 2014. Cinco estudios estaban limitados a personas mayores de 65 años. En 11 estudios el diagnóstico del evento gastrointestinal fue confirmado por endoscopia mientras que en el resto se basó en registros médicos de la historia clínica del paciente. Los estudios presentaron una calidad media de 6 en la escala NOS, 10 de los 28 estudios tenían una calidad 7 o superior. Además 15/28 estudios mostraron los resultados de RR ajustados por edad, sexo, historia de eventos gastrointestinales, toma de fármacos gastroprotectores y tratamientos concomitantes con medicamentos gastrolesivos (anticoagulantes, antiagregantes y corticoides) El AAG estudiado con más frecuencia fue la hemorragia gastrointestinal (16/28 estudios) seguido de la variable combinada hemorragia-perforación-úlcera (10/28 estudios), perforación gastrointestinal (1/28 estudios) y úlcera péptica (1/28 estudios).
Tabla 5. Características de los estudios incluidos en el metaanálisis sobre el RGI
CGIS, complicación del tracto gastrointestinal superior; CIE, clasificación internacional de enfermedades; EGIB, evento del tracto gastrointestinal bajo; EGIS, evento del tracto grastrointestinal alto; GI, gastrointestinal; GPRD, General Practice Research Database; HGIA, hemorragia GI alta; HGIB, hemorragia gastrointestinal baja.
3.2.b. Metaanálisis
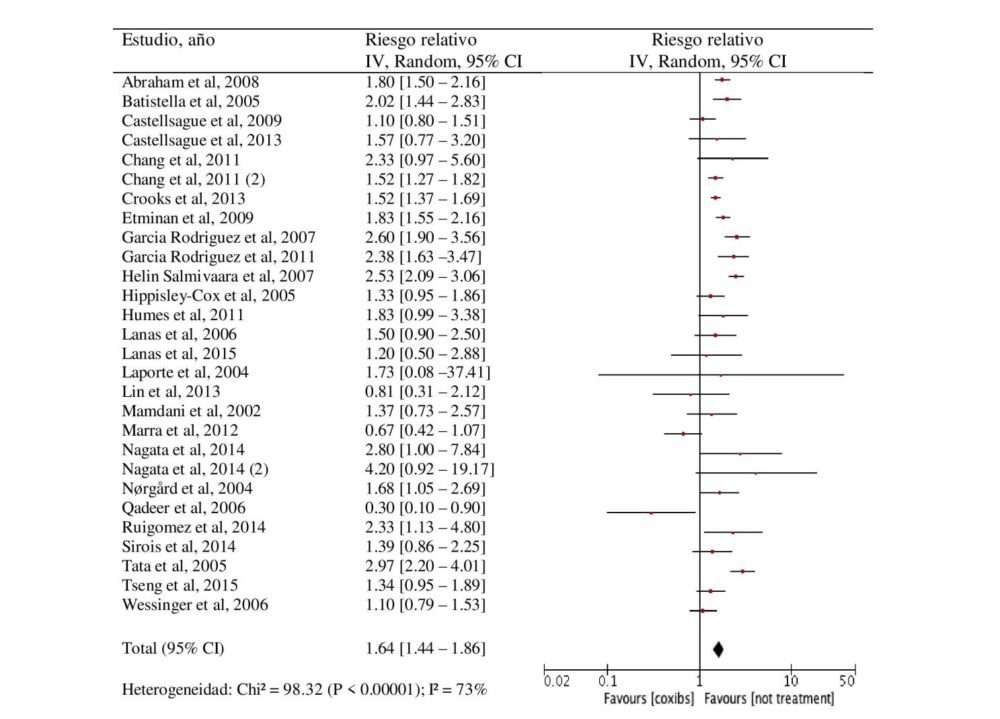
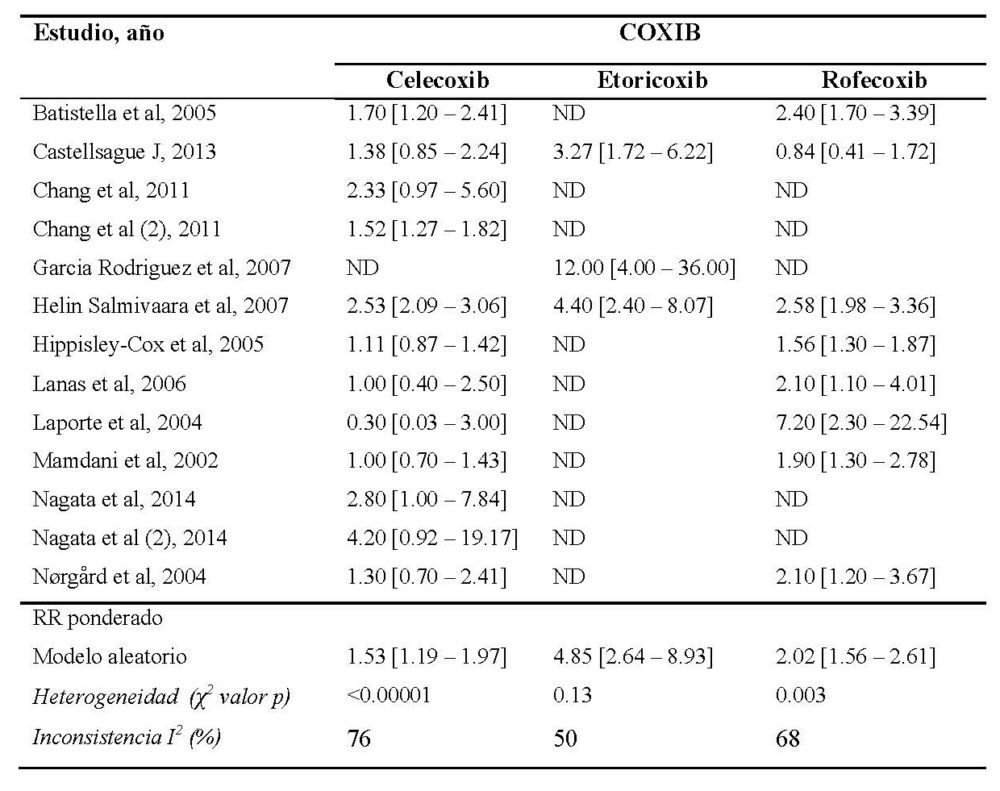
El análisis de los 28 estudios incluidos ha mostrado un riesgo aumentado de AAG asociado a coxibs como grupo farmacológico, como muestra el forest plot de la figura 6. El RR fue de 1.64 [95% CI 1.44-1.86] respecto a los sujetos que no estaban en tratamiento antiinflamatorio. Este riesgo aumentado se observó también para cada uno de los coxibs individualmente excepto para valdecoxib, del cual sólo se identificó un estudio que mostrase resultados de forma individual con un RR= 1.88 [95% CI 0.82-4.31]. El riesgo fue mayor para etoricoxib [RR 4.48 (95% CI 2.98-6.75)], que para rofecoxib [RR 2.02 (95% CI 1.56-2.61)] y celecoxib [RR 1.62 (95% CI 1.46-1.78)] (tabla 6).
Figura 6. Forest plot y riesgo relativo (IC 95%) de los acontecimiento adversos gastrointestinales asociado al uso de coxibs versus no tratamiento.
Tabla 6. Riesgo de acontecimientos adversos gastrointestinales asociados al uso de cada coxib de forma individuala. Los resultados se muestran como riesgo relativo (IC 95%)
a ND, no disponible; χ2, chi cuadrado; RR, riesgo relativo
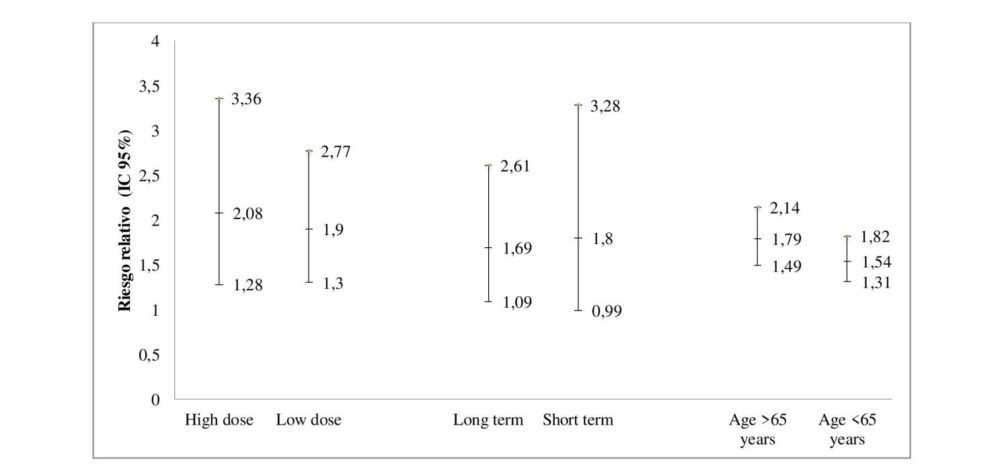
En el análisis de subgrupos se observó una ligera diferencia de riesgo de AAG en función de la dosis y la duración del tratamiento, así como de la edad de los sujetos (figura 7). Se identificó un mayor riesgo para los sujetos que recibieron dosis altas, con duración de tratamiento >30 días y edad >65 años. El análisis de los sujetos con medicación concomitante mostró un RR menor para sujetos en tratamiento gastroprotector [RR 0.99 (95% CI 0.57-1.73)] (20, 31, 41) y un RR mayor para aquellos en tratamiento antiagregante/anticoagulante incluyendo aspirina [RR 2.37 (95% CI 0.96-5.86)] (116, 120, 123, 130), aunque este último no estadísticamente significativo.
Figura 7. Riesgo de acontecimientos adversos gastrointestinales asociados al uso de coxibs como grupo farmacológico entre los subgrupos de dosis, duración del tratamiento y edad de los pacientes. Los resultados se muestran como riesgo relativo (IC 95%).
*Dosis de corte habitual: celecoxib, 200 mg; etoricoxib, 90 mg; rofecoxib, 25 mg.
**Short term: duración del tratamiento < 30 días. Long term: duración del tratamiento > 30 días.
3.2.c. Estudio de la heterogeneidad
Se debe puntualizar la existencia de heterogeneidad estadísticamente significativa entre el efecto medido en los 28 estudios (I2= 73%, P< 0.00001) así como en el análisis individual de celecoxib (I2=76%, P<0.00001) y rofecoxib (I2= 68%, P= 0.003), pero no para etoricoxib (I2= 50%, P= 0.13). La heterogeneidad se vio reducida en los análisis de subgrupos que incluían un menor número de estudios. Para conocer la influencia de esta heterogeneidad en los resultados del estudio, se repitió el análisis incluyendo únicamente los estudios de mayor calidad (NOS >7) resultando un RR de AAG similar al del análisis principal [RR 1.59 (95% CI 1.40-1.80)], con P= 0.18 e I2= 29%.
3.2.d. Análisis de sensibilidad
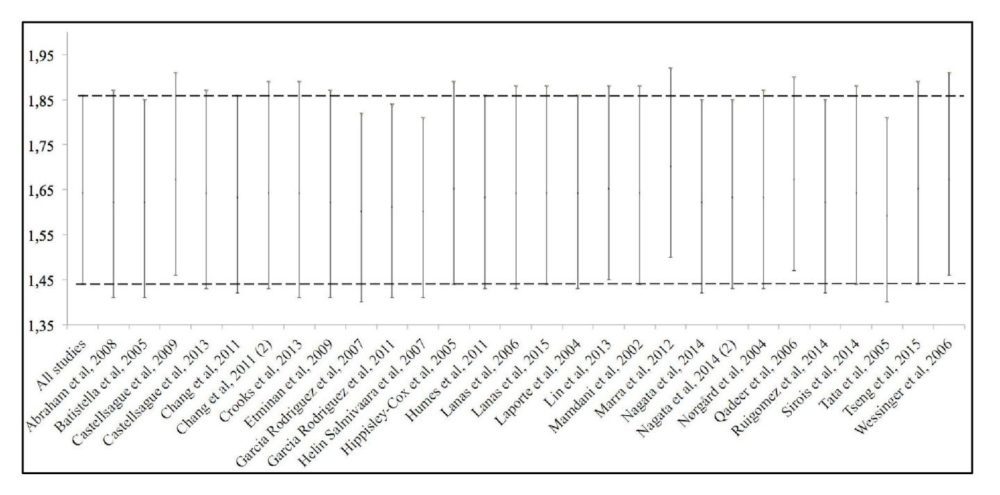
El análisis de sensibilidad reveló que el RR de los coxibs como grupo farmacológico para los AAG era similar independientemente del estudio suprimido en cada momento (figura 8).
El análisis fue repetido sólo con aquellos estudios que mostraron los resultados ajustados por los factores de confusión edad, historia de eventos gastrointestinales, toma de fármacos gastroprotectores y tratamientos concomitantes con medicamentos gastrolesivos. En este caso, el RR para los coxibs como grupo farmacológico fue similar al del análisis principal [RR 1.67 (95% CI 1.47-1.90)] pero con valores de heterogeneidad más bajos [I2= 48% (P< 0.02)].
Figura 8. Análisis de sensibilidad. La primera línea muestra el riesgo relativo para todos los estudios. El resto de líneas muestran el riesgo relativo eliminando el estudio especificado.
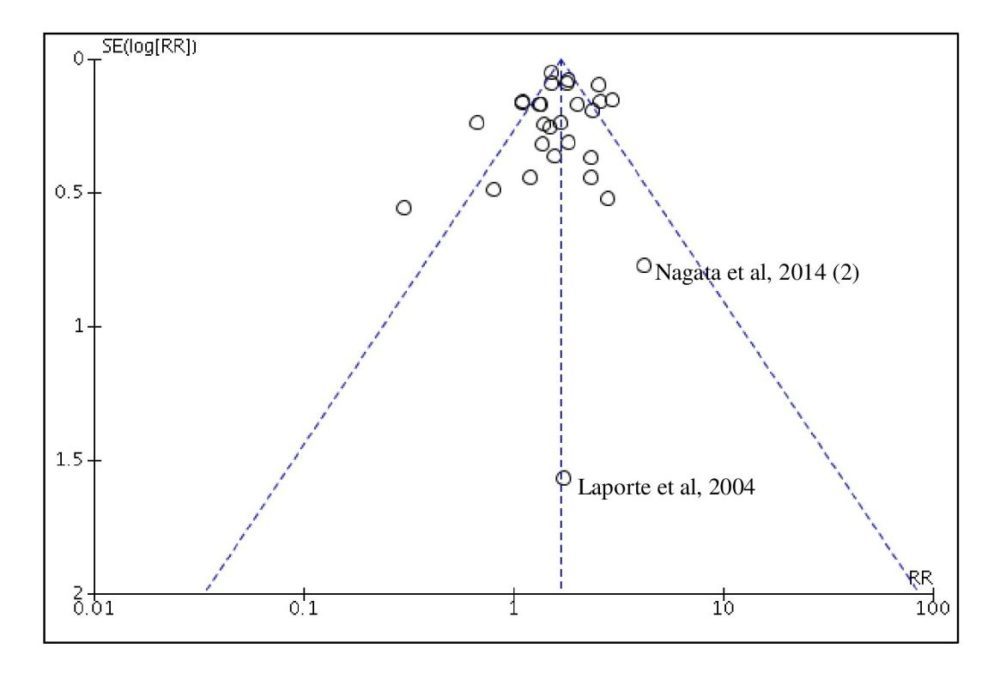
Finalmente fue repetido el metaanálisis excluyendo los estudios de Laporte et al. (122) y de Nagata et al. (127) porque mostraba unos resultados de RR con intervalos de confianza muy amplios no concordantes con el resto de estudios. Su eliminación no modificó el riesgo de AAG de los coxibs como grupo farmacológico [RR 1.62 (95% CI 1.42-1.85)].
3.2.e. Evaluación del sesgo de publicación
El diagrama de embudo utilizado para evaluar el sesgo de publicación se muestra en la figura 9. La visualización del diagrama muestra la mayor parte de los estudios distribuidos alrededor del ápice del embudo. El test de regresión de Egger mostró una pendiente positiva de la recta de regresión y una ordenada en el origen de 0.325 (p<0.339), lo que sugiere la ausencia de sesgo de publicación.
Figura 9. Diagrama de embudo del metaanálisis sobre el RGI
4. DISCUSIÓN
Según nuestro conocimiento, se trata de los dos primeros metaanálisis de estudios observacionales sobre el RCV y el RGI de los AINE versus no tratamiento farmacológico que han incluido un número tan elevado de estudios. En cuanto al RCV, tras el metaanálisis de McGettigan et al. (22) no se ha encontrado otro estudio donde se analice el conjunto de eventos cardiovasculares sin limitación de términos de búsqueda. A diferencia del estudio de McGettigan donde únicamente se muestran los resultados por fármaco individual, en nuestro estudio se presentaron también los RR ponderados para los AINE como grupo farmacológico así como para AINE clásicos y coxibs por separado. En cuanto al RGI, el metaanálisis más reciente identificado incluyó únicamente 6 estudios, todos ellos incorporados también en el nuestro (135). Además, se trataría del primer metaanálisis de coxibs que considera todos los eventos a nivel del tracto gastrointestinal y no sólo del tracto superior. Se reduce así la probabilidad de infra identificación de eventos notificados como “melenas” o “hemorragia gastrointestinal” que podrían estar codificadas en la historia clínica como eventos del tracto gastrointestinal inferior.
Los resultados de nuestros metaanálisis muestran, por un lado, que los AINE como grupo farmacológico presentan un RCV aumentado versus no tratamiento antiinflamatorio [RR= 1.24 (1.18-1.29)] y, por otro lado, confirmarían el riesgo aumentado de AAG de los coxibs versus no tratamiento antiinflamatorio [RR 1.64 (95% CI 1.44-1.86)]. En cuanto al RCV, dicha asociación parece ser tan solo ligeramente superior en el caso de los coxibs [RRcoxibs= 1.24 (1.19-1.31) versus RRAINE clásicos= 1.18 (1.13-1.24)]. En el caso de los coxibs, el resultado coincide con el obtenido por la Coxib and traditional NSAIDS trialists’ (CNT) Collaboration en 2013 (3) donde se observó un mayor riesgo de eventos cardiovasculares mayores [RRcoxibs= 1.37 (1.14-1.66)], y también con el obtenido por Kearney et al. (136) donde se mostró un riesgo elevado de eventos cardiovasculares serios [RRcoxibs= 1.42 (1.13-1.78)]. Sin embargo, en el caso de los AINE clásicos no hemos encontrado la misma concordancia de resultados en la literatura previa, ya que según el estudio de Salpeter et al. no habría un RCV estadísticamente significativo [RR= 1.3 (0.8-2.1)] (23). En cuanto al RGI resaltar que el riesgo de etoricoxib [RR 4.48 (95% CI 2.98-6.75)] duplica al de rofecoxib [RR 2.02 (95% CI 1.56-2.61)] y prácticamente triplica al de celecoxib [RR 1.62 (95% CI 1.46-1.78)]; si bien sólo 3 estudios aportan resultado de riesgo de forma individual para etoricoxib. El resultado coincide con el obtenido por Castellsague et al. (135) donde se identificó un riesgo elevado de complicaciones del tracto gastrointestinal superior para celecoxib y rofecoxib. Sin embargo, es discrepante con el observado por Masso Gonzalez et al. (137), donde se mostró un riesgo de hemorragia del tracto gastrointestinal superior elevado para rofecoxib [RR 2.12 (95% CI 1.59-2.84)] pero no para celecoxib [RR 1.42 (95% CI 0.85-2.37)] ni para los coxibs como grupo farmacológico [RR 1.88 (95% CI 0.96-3.71)]. El escaso número de estudios incluidos (únicamente 6) podría ser la explicación de la diferencia encontrada.
Uno de los puntos a destacar de nuestros metaanálisis es el análisis de subgrupos realizado. Los análisis de subgrupos por dosis y RCV basal de los participantes muestran un RCV mayor en el caso de los coxibs que en los AINE clásicos (tabla 4). El efecto de la dosis ya fue observado para los coxibs en metaanálisis anteriores (138). Por su parte, también ha sido descrito en estudios anteriores un mayor riesgo de eventos cardiovasculares para celecoxib en pacientes con mayor RCV basal (18). Sin embargo, en nuestros resultados sorprende que incluso a dosis bajas y en pacientes con un RCV previo bajo-medio, el riesgo se mantiene estadísticamente significativo. En el análisis por fármaco individual elegimos analizar el RCV de naproxeno dado que la mayor parte de resultados publicados en metaanálisis proponen a éste como el AINE con menor RCV (3, 20, 22, 23, 137). En nuestro caso, aunque es uno de los que presenta un menor RCV, éste es similar al de ibuprofeno y celecoxib. Valdecoxib es el único coxib que no mostró un RCV estadísticamente significativo [RR= 1.14 (0.89-1.46)] y, sin embargo, se encuentra retirado del mercado Europeo y Norteamericano por riesgo de eventos cardiovasculares como accidente cerebrovascular e infarto de miocardio, así como por riesgo de reacciones dermatológicas graves como el síndrome de Stevens Johnson (139). La escasez de estudios que incluyan a valdecoxib en el análisis (34, 45, 88, 89, 97, 98), puede haber sido la explicación de nuestros resultados discrepantes. En cuanto al RGI, el análisis del efecto de la medicación concomitante en el riesgo de AAG es uno de los puntos fuertes de nuestro estudio respecto a los publicados anteriormente. Hemos observado que el uso de protectores gástricos junto con los coxibs, inhibidores de la bomba de protones o antihistamínicos H2, redujo el riesgo de AAG [RR 0.99 (95% CI 0.57-1.73)]. Teniendo en cuenta el riesgo gastrointestinal identificado para los coxibs, esta asociación podría establecerse como estrategia para reducir la toxicidad gastrointestinal del tratamiento antiinflamatorio. Por otro lado, en relación a los pacientes en tratamiento concomitante con antiagregantes/anticoagulantes, se observó un riesgo de AAG mayor que en el análisis principal [RR 2.37 (95% CI 0.96-5.85)], con tendencia a la significación estadística. Es remarcable que el análisis de subgrupos realizado muestra un riesgo de AAG estadísticamente significativo incluso para los sujetos que reciben dosis bajas de coxibs o que tienen menos de 65 años; y con tendencia a la significación en sujetos en tratamiento menor de 30 días (figura 7). No se ha identificado ningún metaanálisis previo que muestre el efecto de la duración del tratamiento y la edad de los pacientes en el riesgo de AAG de los coxibs versus no tratamiento. Además, que nos conste, únicamente Castellsague et al. (136) en su metaanálisis muestran el efecto de la dosis para celecoxib y rofecoxib versus no tratamiento farmacológico, con diferente resultado. Si bien se observó un riesgo elevado para rofecoxib a dosis altas y bajas, no se identificó un aumento del riesgo para dosis altas de celecoxib.
Aunque no fueron incluidos en el metaanálisis sobre el RGI, nos pareció interesante analizar el riesgo de AAG de AINE no selectivos y aspirina a partir de los resultados de los estudios encontrados en la búsqueda. De esta forma, se obtendría un RR de referencia de fármacos con un riesgo ya conocido, obtenido del mismo tipo de poblaciones y analizados estadísticamente de forma similar con el que comparar el resultado de nuestro metaanálisis. En este caso, el RGI para AINE no selectivos fue de 2.54 [95% CI 2.22-2.91] y de 1.81 [95% CI 1.64-2.00] para aspirina. De la misma manera y para corroborar la coherencia del resultado obtenido en el metaanálisis, se obtuvo un valor de RR de los 9 estudios identificados en la búsqueda que comparaban el riesgo de AAG de coxibs versus AINE no selectivos. Se observó un menor riesgo para los coxibs [RR 0.63 [95% CI 0.44-0.89)] concordante con la diferencia de riesgos entre coxibs y AINE no selectivos identificada por separado.
Los metaanálisis realizados presentan varias limitaciones inherentes a los metaanálisis de estudios observacionales, entre ellas la calidad de los estudios incluidos y el posible riesgo exagerado mostrado por los estudios observacionales en comparación con los ensayos clínicos (140). Por otro lado, la calidad del metaanálisis depende de los datos extraídos de los estudios originales, de manera que podríamos haber introducido un potencial riesgo de sesgo en la extracción de la información. Hay que tener en cuenta que es posible que los pacientes con mayor comorbilidad (pacientes con mayor RCV basal y mayor número de factores de riesgo de AAG) sean los que reciben el tratamiento con coxibs, convirtiéndose el propio tratamiento en un factor de confusión. Sin embargo, confiamos en que los resultados no se vean afectados por esta circunstancia puesto que la mayor parte de los estudios incluidos muestran los resultados ajustados por comorbilidad de los participantes. Además, el resultado del análisis de subgrupos según el RCV basal muestra un RCV elevado en todos los casos [RRbajo-medio= 1.09 (1.07-1.12); RRmedio-alto= 1.26 (1.20-1.32)] y la repetición del análisis sobre el RGI incluyendo únicamente los estudios que mostraban los resultados ajustados por las principales variables de confusión (edad, historia de eventos gastrointestinales, toma de fármacos gastroprotectores y tratamientos concomitantes con medicamentos gastrolesivos) dio resultados similares. Hay que considerar que, en el momento de realización de nuestro estudio, rofecoxib se encontraba retirado del mercado mundial y valdecoxib no se comercializaba en Europa ni Estados Unidos, ambos por motivos de inseguridad cardiovascular. Esta circunstancia podría haber influido con una sobreestimación del efecto en nuestros resultados. Para comprobarlo, el análisis se repitió utilizando únicamente los resultados individuales de celecoxib y etoricoxib, observándose una influencia de rofecoxib y valdecoxib pero manteniéndose un RCV estadísticamente significativo [RR=1.16 (1.08-1.24)].
La heterogeneidad entre los estudios incluidos es otra de las limitaciones habituales de los metaanálisis, habiendo resultado alta en el análisis principal del metaanálisis sobre el RCV (I2 >88%) y moderada (I2=73%) en el del RGI. Sin embargo, dada la concordancia entre los resultados obtenidos en el análisis principal y en los diferentes subgrupos, junto con la similitud de los resultados del modelo de efectos aleatorios versus el modelo de efectos fijos y el análisis de sensibilidad, la heterogeneidad encontrada podría estar relacionada con la diversidad clínica de los participantes de los estudios. El elevado número de estudios incluidos, el amplio número de principios activos estudiados y la diferente comorbilidad de los propios participantes podrían haber contribuido a la heterogeneidad encontrada en nuestro análisis. En este mismo sentido, hay que tener en cuenta la elevada potencia estadística de la prueba de X2, capaz de detectar una pequeña heterogeneidad sin que esta sea clínicamente importante en aquellos metaanálisis que incluyen un gran número de estudios (28).
5. CONCLUSIONES
En cuanto al RCV, el uso de todos los AINE (a excepción de aspirina que no se incluyó en nuestro estudio) podría elevar de forma similar y estadísticamente significativa el RCV. A dosis bajas y en pacientes con RCV previo bajo-medio, el RCV resultado de la exposición a los AINE continua siendo estadísticamente significativo.
En cuanto al RGI, el uso de coxibs en la práctica clínica habitual se relacionaría con un incremento del riesgo de AAG estadísticamente significativo, aunque inferior que el de AINE clásicos. El riesgo de AAG sería elevado incluso a dosis bajas y en sujetos con edad <65 años. El RGI de los coxibs podría ser menor si se utilizan junto con un tratamiento gastroprotector. Por otro lado, la administración concomitante de fármacos antiagregantes y/o anticoagulantes podría aumentar el riesgo gastrointestinal. El riesgo para etoricoxib podría ser superior que para celecoxib y rofecoxib.
Conflicto de intereses
Los autores del estudio afirman que no tienen ningún tipo de conflicto de interés.
Lista de abreviaturas
AAG: acontecimiento adverso gastrointestinal
AINE: antiinflamatorio no esteroideo
COXIB: inhibidor selectivo de ciclooxigenasa 2
EC: enfermedad coronaria ECV: eventos cardiovasculares EP: embolismo pulmonar
ETE: evento tromboembólico
FA: fibrilación auricular
GI: gastrointestinal
IAM: infarto agudo de miocardio
IC: insuficiencia cardiaca
IC 95%: intervalo de confianza del 95% N: número de pacientes
RCV: riesgo cardiovascular RGI: riesgo gastrointestinal RR: riesgo relativo
SCA: síndrome coronario agudo TEV: tromboembolismo venoso TVP: trombosis venosa profunda
6. REFERENCIAS
1. Intercontinental Medical Statistics Health. Top 20 global theory areas 2015 [Internet].Disponible en: https://www.iqvia.com/-/media/iqvia/pdfs/institute-reports/global-medicines- use-in-2020. [Accedido el 16 Jul 2021].
2. World Health Organization. World report on Ageing And HeAltH. Disponible en:www.who.int/. [Accedido el 16 Jul 2021]
3. Bhala N, Emberson J, Merhi A, Abramson S, Arber N, et al. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: Meta-analyses of individual participant data from randomised trials. Lancet. 2013;382(9894):769–79.
4. Mallen SR, Essex MN, Zhang R. Gastrointestinal tolerability of NSAIDs in elderly patients: a pooled analysis of 21 randomized clinical trials with celecoxib and nonselective NSAIDs. Curr Med Res Opin. 2011;27(7):1359–66.
5. Laine L, Curtis SP, Cryer B, Kaur A, Cannon CP. Assessment of upper gastrointestinal safety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomised comparison. Lancet. 2007;369(9560):465–73.
6. Kristiansen IS, Kvien TK. Cost-effectiveness of replacing NSAIDs with coxibs: diclofenac and celecoxib in rheumatoid arthritis. Expert Rev Pharmacoecon Outcomes Res.2002;2(3):229-41.
7. Latimer N, Lord J, Grant RL, O’Mahony R, Dickson J, Conaghan PG, et al.. Cost effectiveness of COX 2 selective inhibitors and traditional NSAIDs alone or in combination with a proton pump inhibitor for people with osteoarthritis. BMJ. 2009;339:b2538.
8. Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis B, et al.. Comparison of Upper Gastrointestinal Toxicity of Rofecoxib and Naproxen in Patients with Rheumatoid Arthritis. N Engl J Med. 2000;343(21):1520–8.
9. Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A, et al.. Gastrointestinal Toxicity With Celecoxib vs Nonsteroidal Anti-inflammatory Drugs for Osteoarthritis and Rheumatoid Arthritis The CLASS Study: A Randomized Controlled Trial Fred. JAMA. 2000;284(10):1247–55.
10. Schnitzer TJ, Burmester GR, Mysler E, Hochberg MC, Doherty M, Ehrsam E, et al. Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), reduction in ulcer complications: Randomised controlled trial. Lancet. 2004;364(9435):665–74.
11. Jarupongprapa S, Ussavasodhi P, Katchamart W. Comparison of gastrointestinal adverse effects between cyclooxygenase-2 inhibitors and non-selective, non-steroidal anti- inflammatory drugs plus proton pump inhibitors: A systematic review and meta-analysis. J Gastroenterol. 2013;48(7):830–8.
12. Watson D, Yu Q, Bolognese J, Reicin A, Simon T. The upper gastrointestinal safety of rofecoxib vs. NSAIDs: an updated combined analysis. Curr Med Res Opin. 2004;20(10):1539–48.
13. Ramey DR, Watson DJ, Yu C, Bolognese JA, Curtis SP, Reicin AS. The incidence of upper gastrointestinal adverse events in clinical trials of etoricoxib vs. non-selective NSAIDs: an updated combined analysis. Curr Med Res Opin. 2005;21(5):715–22.
14. Wang X, Tian HJ, Yang HK, Wanyan P, Peng YJ. Meta-analysis: Cyclooxygenase-2 inhibitors are no better than nonselective nonsteroidal anti-inflammatory drugs with proton pump inhibitors in regard to gastrointestinal adverse events in osteoarthritis and rheumatoid arthritis. Eur J Gastroenterol Hepatol. 2011;23(10):876–80.
15. Zeng C, Wei J, Li H, Yang T, Gao SG, Li YS, et al.. Comparison between 200mg QD and 100mg BID oral celecoxib in the treatment of knee or hip osteoarthritis. Sci Rep. 2015;5(January):1–13.
16. Singh G, Wu O, Langhorne P, Madhok R. Risk of acute myocardial infarction with nonselective non-steroidal anti-inflammatory drugs: a meta-analysis. Arthritis Res Ther.2006;8(2):R153.
17. Bresalier RS, Sandler RS, Quan H, Bolognese JA, Oxenius B, Horgan K, et al.. Cardiovascular Events Associated with Rofecoxib in a Colorectal Adenoma Chemoprevention Trial. N Engl J Med.2005;352(11):1092–102.
18. Solomon SD, Wittes J, Finn P V., Fowler R, Viner J, Bertagnolli MM, et al.. Cardiovascular risk of celecoxib in 6 randomized placebo-controlled trials: The cross trial safety analysis. Circulation. 2008;117(16):2104–13.
19. Trelle S, Reichenbach S, Wandel S, Hildebrand P, Tschannen B, Villiger PM, et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis. BMJ. 2011;342(1):c7086.
20. De Vecchis R, Baldi C, Di Biase G, Ariano C, Cioppa C, Giasi A, et al.. Cardiovascular risk associated with celecoxib or etoricoxib: a meta-analysis of randomized controlled trials which adopted comparison with placebo or naproxen. Minerva Cardioangiol. 2014;62:437–8.
21. McGettigan P, Henry D. Cardiovascular Risk and Inhibition of Cyclooxygenase. JAMA. 2006;296(13):1633.
22. Salpeter SR, Gregor P, Ormiston TM, Whitlock R, Raina P, Thabane L, et al.. Meta-Analysis: Cardiovascular Events Associated with Nonsteroidal Anti-inflammatory Drugs. Am J Med. 2006;119(7):552–9.
23. McGettigan P, Henry D. Cardiovascular risk with non-steroidal anti-inflammatory drugs: Systematic review of population-based controlled observational studies. PLoS Med. 2011;8(9):e1001098.
24. European Medicines Agency. European Medicines Agency – News and Events – PRAC recommends updating advice on use of high-dose ibuprofen [Internet]. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2015/04/news_d etail_002306.jsp&mid=WC0b01ac058004d5c1. [Accedido el 16 Jul 2021].
25. Sondergaard KB, Weeke P, Wissenberg M, Schjerning Olsen A-M, Fosbol EL, Lippert FK, et al.. Non-steroidal anti-inflammatory drug use is associated with increased risk of out-of- hospital cardiac arrest: a nationwide case–time–control study. Eur Hear J – Cardiovasc Pharmacother. 2017;3:100-7.
26. Wells G, Shea B, O ’connell D, Robertson J, Peterson J, Welch V, et al. The Newcastle- Ottawa Scale (NOS) for Assessing the Quality of Nonrandomized Studies in Meta- Analysis [Internet]. Disponible en: http://www.evidencebasedpublichealth.de/download/Newcastle_Ottowa_Scale_Pope_Bruce.p df. [Accedido el 16 Jul 2021].
27. DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7(3):177–88.
28. Higgins JPT, Green S. Manual Cochrane de revisiones sistemáticas de intervenciones. Cochrane. 2011; (March):1–639 [Internet]. Disponible en: https://es.cochrane.org/sites/es.cochrane.org/files/public/uploads/manual_cochrane_510_web. pdf. [Accesed 16 Jul 2021].
29. Higgins JPT, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta- analyses. BMJ. 2003;327(7414):557-60.
30. Egger M, Smith GD, Schneider M, Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ. 1997;315(7109):629-34.
31. Varas-Lorenzo C, Castellsague J, Stang MR, Perez-Gutthann S, Aguado J, Garcia Rodriguez LA. The use of selective cyclooxygenase-2 inhibitors and the risk of acute myocardial infarction in Saskatchewan, Canada. Pharmacoepidemiol Drug Saf. 2009;18:1016–25.
32. Abraham NS, EL-Serag HB, Hartman C, Richardson P, Deswal A. Cyclooxygenase-2 cerebrovascular accident. Aliment Pharmacol Ther. 2007;25(8):913–24.
33. Abraham NS, Castillo DL, Hartman C. National mortality following upper gastrointestinal or cardiovascular events in older veterans with recent nonsteroidal anti-inflammatory drug use. Aliment Pharmacol Ther. 2008;28(1):97–106.
34. Andersohn F, Suissa S, Garbe E. Use of first- and second-generation cyclooxygenase-2- selective nonsteroidal antiinflammatory drugs and risk of acute myocardial infarction. Circulation. 2006;113(16):1950–7.
35. Andersohn F, Schade R, Suissa S, Garbe E. Cyclooxygenase-2 selective nonsteroidal anti- inflammatory drugs and the risk of ischemic stroke: A nested case-control study. Stroke. 2006;37(7):1725–30.
36. Bäck M, Yin L, Ingelsson E. Cyclooxygenase-2 inhibitors and cardiovascular risk in a nation- wide cohort study after the withdrawal of rofecoxib. Eur Heart J. 2012;33(15):1928–33.
37. Barthélémy O, Limbourg T, Collet JP, Beygui F, Silvain J, Bellemain-Appaix A, et al.. Impact of non-steroidal anti-inflammatory drugs (NSAIDs) on cardiovascular outcomes in patients with stable atherothrombosis or multiple risk factors. Int J Cardiol. 2013;163(3):266–71.
38. Hippisley-cox J, Coupland C. Risk of myocardial infarction in patients taking cyclo- oxygenase-2 inhibitors or conventional non-steroidal anti-inflammatory drugs: population based nested case-control analysis. BMJ. 2005;330(7504):1336.
39. Battelli D, Riccardi A, Piscaglia A., Stefanelli ML, Mussoni L, Zani A, et al.. Analgesic, antiulcer, antithrombotic drugs and organ damage: a population-based case-control study. MInerva MEd. 2015;106(6):323–31.
40. Bavry AA, Thomas F, Allison M, Johnson KC, Howard B V., Hlatky M, et al.. Nonsteroidal anti-inflammatory drugs and cardiovascular outcomes in women: Results from the women’s health initiative. Circ Cardiovasc Qual Outcomes. 2014;7(4):603–10.
41. Bernatsky S, Hudson M, Suissa S. Anti-rheumatic drug use and risk of hospitalization for congestive heart failure in rheumatoid arthritis. Rheumatology. 2005;44(5):677–80.
42. Biere-Rafi S. Non-steroidal anti-inflammatory drugs and risk of pulmonary embolism. Pharmacoepidemiol Drug Saf. 2011;20:635–42.
43. Brophy JM, Levesque LE, Zhang B. The coronary risk of cyclo-oxygenase-2 inhibitors in patients with a previous myocardial infarction. Heart. 2005;93(2):189–94.
44. Bueno H, Bardají A, Patrignani P, Martín-Merino E, García-Rodríguez LA. Use of Non- Steroidal Antiinflammatory Drugs and Type-Specific Risk of Acute Coronary Syndrome. Am J Cardiol. 2010;105(8):1102–6. Among chronic opioid and cyclooxygenase-2 users compared with a general population cohort. Pharmacoepidemiol Drug Saf. 2011;20:754–62.
46. Caughey GE, Roughead EE, Pratt N, Killer G, Gilbert AL. Stroke risk and NSAIDs: An australian population-based study. Med J Aust. 2011;195(9):525–9.
47. Chan AT, Manson JE, Albert CM, Chae CU, Rexrode KM, Curhan GC, et al.. Nonsteroidal antiinflammatory drugs, acetaminophen, and the risk of cardiovascular events. Circulation. 2006;113(12):1578–87.
48. Chang CH, Shau WY, Kuo CW, Chen ST, Lai MS. Increased risk of stroke associated with nonsteroidal anti-inflammatory drugs: A nationwide case-crossover study. Stroke. 2010;41(9):1884–90.
49. Chao T-F, Liu C-J, Chen S-J, Wang K-L, Lin Y-J, Chang S-L, et al.. The association between the use of non-steroidal anti-inflammatory drugs and atrial fibrillation: A nationwide case– control study. Int J Cardiol. 2013;168(1):312–6.
50. Choi NK, Park BJ, Jeong SW, Yu KH, Yoon BW. Nonaspirin nonsteroidal anti-inflammatory drugs and hemorrhagic stroke risk: The acute brain bleeding analysis study. Stroke. 2008;39(3):845–9.
51. Cunnington M, Webb D, Qizilbash N, MRCP, DPhil, Blum D, et al.. Risk of ischaemic cardiovascular events from selective cyclooxigenase-2 inhibitors in osteoarthritis. Pharmacoepidemiol Drug Saf. 2008;17:601–8.
52. de Abajo FJ, Gil MJ, García Poza P, Bryant V, Oliva B, Timoner J, et al.. Risk of nonfatal acute myocardial infarction associated with nonsteroidal antiinflammatory drugs, non-narcotic analgesics and other drugs used in osteoarthritis: a nested case-control study. Pharmacoepidemiol Drug Saf. 2014;23:1128–38.
53. De Vries F, Setakis E, Van Staa TP. Concomitant use of ibuprofen and paracetamol and the risk of major clinical safety outcomes. Br J Clin Pharmacol. 2010;70(3):429–38.
54. Feenstra J, Heerdink ER, Grobbee DE, Stricker BHC. Association of nonsteroidal anti- inflammatory drugs with first occurrence of heart failure and with relapsing heart failure: the Rotterdam Study. Arch Intern Med. 2002;162(3):265–70.
55. Fischer LM, Schlienger RG, Matter CM, Jick H, Meier CR. Current use of nonsteroidal antiinflammatory drugs and the risk of acute myocardial infarction. Pharmacotherapy. 2005;25(4):503–10.
56. Fosbøl EL, Folke F, Jacobsen S, Rasmussen JN, Sørensen R, Schramm TK, et al.. Cause- specific cardiovascular risk associated with nonsteroidal antiinflammatory drugs among healthy individuals. Circ Cardiovasc Qual Outcomes. 2010;3(4):395–405.
57. García Rodríguez LA, Tacconelli S, Patrignani P. Role of Dose Potency in the Prediction of Risk of Myocardial Infarction Associated With Nonsteroidal Anti-Inflammatory Drugs in the General Population. J Am Coll Cardiol. 2008;52(20):1628–36.
58. García-Poza P, de Abajo FJ, Gil MJ, Chacón A, Bryant V, García-Rodríguez LA. Risk of ischemic stroke associated with non-steroidal anti-inflammatory drugs and paracetamol: A population-based case-control study. J Thromb Haemost. 2015;13(5):708–18.
59. Gislason GH, Rasmussen JN, Abildstrom SZ, Schramm TK, Hansen ML, Fosbol EL, et al. Increased mortality and cardiovascular morbidity associated with use of nonsteroidal anti- inflammatory drugs in chronic heart failure. Arch Intern Med. 2009;169(2):141–9.
60. Goodson NJ, Brookhart AM, Symmons DPM, Silman AJ, Solomon DH. Non-steroidal anti- inflammatory drug use does not appear to be associated with increased cardiovascular mortality in patients with inflammatory polyarthritis: results from a primary care based inception cohort of patients. Ann Rheum Dis. 2009;68(3):367–72.
61. Graham D, Campen D, Hui R, Spence M, Cheetham C, Levy G, et al. Risk of acute myocardial infarction and sudden cardiac death in patients treated with cyclo-oxygenase 2 selective and non-selective non-steroidal anti-inflammatory drugs: nested case-control study. Lancet. 2005;365(9458):475–81.
62. Grimaldi-Bensouda L, Rossignol M, Danchin N, Steg PG, Bessede G, Ovize M, et al.. Risk of ST versus non-ST elevation myocardial infarction associated with non-steroidal anti- inflammatory drugs. Heart. 2011;97(22):1834–40.
63. Haag MDM, Bos MJ, Hofman A, Koudstaal PJ, Breteler MMB, Stricker BHC. Cyclooxygenase selectivity of nonsteroidal anti-inflammatory drugs and risk of stroke. Arch Intern Med. 2008;168(11):1219–24.
64. Helin-Salmivaara A, Virtanen A, Vesalainen R, Grönroos JM, Klaukka T, Idänpään-Heikkilä JE, et al.. NSAID use and the risk of hospitalization for first myocardial infarction in the general population: A nationwide case-control study from Finland. Eur Heart J. 2006;27(14):1657–63.
65. Huerta C, Varas-Lorenzo C, Castellsague J, Garcia Rodriguez LA. Non-steroidal anti- inflammatory drugs and risk of first hospital admission for heart failure in the general population. Heart. 2006;92(11):1610–5.
66. Johnsen SP. Risk of Hospitalization for Myocardial Infarction Among Users of Rofecoxib, Celecoxib, and Other NSAIDs. Arch Intern Med. 2005;165(9):978.
67. Kim J, Lee J, Shin CM, Lee DH, Park B-J. Risk of gastrointestinal bleeding and Res Care. 2015;3(1):e000133.
68. Kimmel SE, Berlin JA, Reilly M, Jaskowiak J, Kishel L, Chittams J, et al.. Exposed to rofecoxib and celecoxib have different odds of nonfatal myocardial infarction. Ann Intern Med. 2005;142(3):157–64.
69. Kohli P, Steg PG, Cannon CP, Smith SC, Eagle KA, Ohman EM, et al.. NSAID use and association with cardiovascular outcomes in outpatients with stable atherothrombotic disease. Am J Med. 2014;127(1).
70. Krijthe BP, Heeringa J, Hofman A, Franco OH, Stricker BH. Non-steroidal anti-inflammatory drugs and the risk of atrial fibrillation: a population-based follow-up study. BMJ Open. 2014;4(4):e004059.
71. Lamberts M, Lip GYH, Hansen ML, Lindhardsen J, Olesen JB, Rauns J, et al.. Relation of nonsteroidal anti-inflammatory drugs to serious bleeding and thromboembolism risk in patients with atrial fibrillation receiving antithrombotic therapy: A nationwide cohort study. Ann Intern Med. 2014;161(10):690–8.
72. Lapi F, Piccinni C, Simonetti M, Levi M, Lora Aprile P, Cricelli I, et al.. Non-steroidal anti- inflammatory drugs and risk of cerebrovascular events in patients with osteoarthritis: a nested case-control study. Intern Emerg Med. 2016;11(1):49–59.
73. Laredo L, Rodríguez Á, Vargas E, Moreno A, Cruz A, Dios García J De. Asociación entre consumo de antiinflamatorios no esteroideos e insuficiencia cardíaca congestiva. Med Clin (Barc). 2003;120(17):658–60.
74. Lee TA, Bartle B, Weiss KB. Impact of NSAIDS on Mortality and the Effect of Preexisting Coronary Artery Disease in US Veterans. Am J Med. 2007;120(1):9–16.
75. Levesque LE, Brophy JM, Zhang B. The risk for myocardial infarction with cyclooxygenase-2 inhibitors: a population study of elderly adults. Ann Intern Med. 2005;142(7):481–9.
76. Lindhardsen J, Gislason GH, Jacobsen S, Ahlehoff O, Olsen A-MS, Ole Rintek Madsen, et al. Non-steroidal anti-inflammatory drugs and risk of cardiovascular disease in patients with rheumatoid arthritis: a nationwide cohort study. Ann Rheum Dis. 2014;73(8):1515–21.
77. Liu SS, Bae JJ, Bieltz M, Ma Y, Memtsoudis S. Association of Perioperative Use of Nonsteroidal Anti-Inflammatory Drugs With Postoperative Myocardial Infarction After Total Joint Replacement. Reg Anesth Pain Med. 2012;37(1):45–50.
78. Mamdani M, Rochon P, Juurlink DN, Anderson GM, Kopp A, Naglie G, et al.. Effect of selective cyclooxygenase 2 inhibitors and naproxen on short-term risk of acute myocardial infarction in the elderly. Arch Intern Med. 2003;163(4):481–6. Inhibitors versus non-selective non-steroidal anti-inflammatory drugs and congestive heart failure outcomes in elderly patients: a population-based cohort study. Lancet. 2004;363(9423):1751–6.
80. Mangoni AA, Woodman RJ, Gaganis P, Gilbert AL, Knights KM. Use of non-steroidal anti- inflammatory drugs and risk of incident myocardial infarction and heart failure, and all-cause mortality in the Australian veteran community. Br J Clin Pharmacol. 2010;69(6):689–700.
81. Mangoni AA, Woodman RJ, Gilbert AL, Knights KM. Use of non-steroidal anti-inflammatory drugs and risk of ischemic and hemorrhagic stroke in the Australian veteran community. Pharmacoepidemiol Drug Saf. 2010;19:490–8.
82. McGettigan P, Han P, Jones L, Whitaker D, Henry D. Selective COX-2 inhibitors, NSAIDs and congestive heart failure: Differences between new and recurrent cases. Br J Clin Pharmacol. 2008;65(6):927–34.
83. Olsen AMS, Fosbøl EL, Lindhardsen J, Folke F, Charlot M, Selmer C, et al.. Long-term cardiovascular risk of nonsteroidal anti-inflammatory drug use according to time passed after first-time myocardial infarction: A nationwide cohort study. Circulation. 2012;126(16):1955–63.
84. Schjerning Olsen A-M, Gislason GH, McGettigan P, Fosbøl E, Sørensen R, Hansen ML, et al. Association of NSAID Use With Risk of Bleeding and Cardiovascular Events in Patients Receiving Antithrombotic Therapy After Myocardial Infarction. JAMA. 2015;313(8):805.
85. Patel TN, Goldberg KC. Use of aspirin and ibuprofen compared with aspirin alone and the risk of myocardial infarction. Arch Intern Med. 2004;164(8):852–6.
86. Ray WA, Stein CM, Daugherty JR, Hall K, Arbogast PG, Griffin MR. COX-2 selective non- steroidal anti-inflammatory drugs and risk of serious coronary heart disease. Lancet. 2002;360(9326):1071–3.
87. Ray WA, Varas-Lorenzo C, Chung CP, Castellsague J, Murray KT, Stein CM, et al. Cardiovascular Risks of Nonsteroidal Antiinflammatory Drugs in Patients After Hospitalization for Serious Coronary Heart Disease. Circ Cardiovasc Qual Outcomes. 2009;2(3):155–63.
88. Roumie CL, Mitchel EF, Kaltenbach L, Arbogast PG, Gideon P, Griffin MR. Nonaspirin NSAIDs, cyclooxygenase 2 inhibitors, and the risk for stroke. Stroke. 2008;39(7):2037–45.
89. Roumie CL, Choma NN, Kaltenbach L, Mitchel EF, Arbogast PG, Griffin MR. Non-aspirin NSAIDs, cyclooxygenase-2 inhibitors and risk for cardiovascular events–stroke, acute myocardial infarction, and death from coronary heart disease. Pharmacoepidemiol Drug Saf. 2009;18:1053–63.
90. Serrano JLS, Burillo JMT, Arias ÁA, Carreras MIM, Gámez JCV. Cardiovascular Risk Associated with the Use of non Steroidal Anti-inflammatory Drugs . Rev Esp Salud Publica. 2015;89(6):607-13.
91. Serrano JLS, Burillo JMT, Arias ÁA, Ferrer EZ, Lluch MTG, Gámez JCV. Cardiovascular risk associated with the use of non steroidal anti-inflammatory drugs, cases and controls study in a health care area in Spain. Int J Pharmacol. 2016;12(6):612–6.
92. Schmidt M, Pedersen L, Maeng M, Lassen JF, Lash TL, Nielsen TT, et al.. Nonsteroidal antiinflammatory drug use and cardiovascular risks after coronary stent implantation. Pharmacotherapy. 2011;31(5):458–68.
93. Schmidt M, Christiansen CF, Mehnert F, Rothman KJ, Sorensen HT. Non-steroidal anti- inflammatory drug use and risk of atrial fibrillation or flutter: population based case-control study. BMJ. 2011;343:d3450.
94. Schmidt M, Christiansen CF, Horváth-Puhó E, Glynn RJ, Rothman KJ, Sørensen HT. Non- steroidal anti-inflammatory drug use and risk of venous thromboembolism. J Thromb Haemost. 2011;9(7):1326–33.
95. Schmidt M, Hováth-Puhó E, Christiansen CF, Petersen KL, Bøtker HE, Sørensen HT. Preadmission use of nonaspirin nonsteroidal anti-inflammatory drugs and 30-day stroke mortality. Neurology. 2014;83(22):2013–22.
96. Shin J-Y, Park M-J, Lee SH, Choi S-H, Kim M-H, Choi N-K, et al. Risk of intracranial haemorrhage in antidepressant users with concurrent use of non-steroidal anti-inflammatory drugs: nationwide propensity score matched study. BMJ. 2015;351:h3517.
97. Solomon DH, Avorn J, Stürmer T, Glynn RJ, Mogun H, Schneeweiss S. Cardiovascular outcomes in new users of coxibs and nonsteroidal antiinflammatory drugs: High-risk subgroups and time course of risk. Arthritis Rheum. 2006;54(5):1378–89.
98. Solomon DH, Glynn RJ, Rothman KJ, Schneeweiss S, Setoguchi S, Mogun H, et al.. Subgroup analyses to determine cardiovascular risk associated with nonsteroidal antiinflammatory drugs and coxibs in specific patient groups. Arthritis Care Res. 2008;59(8):1097–104.
99. Spalding WM, Reeves MJ, Whelton A. Thromboembolic cardiovascular risk among arthritis patients using cyclooxygenase-2-selective inhibitor or nonselective cyclooxygenase inhibitor nonsteroidal anti-inflammatory drugs. Am J Ther. 2007;14(1):3–12.
100. Suissa S, Bernatsky S, Hudson M. Antirheumatic drug use and the risk of acute myocardial infarction. Arthritis Rheum. 2006;55(4):531–6. Diseases: A nationwide case-control study. PLoS One. 2015;10(5):1–13.
102. Van der Linden MW, van der Bij S, Welsing P, Kuipers EJ, Herings RMC. The balance between severe cardiovascular and gastrointestinal events among users of selective and non- selective non-steroidal anti-inflammatory drugs. Ann Rheum Dis. 2009;68(5):668–73.
103. Van Staa TP, Rietbrock S, Setakis E, Leufkens HGM. Does the varied use of NSAIDs explain the differences in the risk of myocardial infarction? J Intern Med. 2008;264(5):481–92.
104. Wade KC, Ellenberg JH, Ph D, Grosser T, Colleen M, Kimmel SE, et al.. Exogenous estrogen does not attenuate the association between rofecoxib and myocardial infarction in perimenopausal women. J Cardiovasc Pharmacol. 2011;57(2):194–200.
105. Wernli KJ, Hampton JM, Trentham-Dietz A, Newcomb PA. Use of antidepressants and NSAIDs in relation to mortality in long-term breast cancer survivors. Pharmacoepidemiol Drug Saf. 2011;20(2):131–7.
106. Wu L-C, Leong P-Y, Yeo K-J, Li T-Y, Wang Y-H, Chiou J-Y, et al. Celecoxib and sulfasalazine had negative association with coronary artery diseases in patients with ankylosing spondylitis: A nation-wide, population-based case-control study. Medicine. 2016;95(36):e4792.
107. Chang C-H, Lin J-W, Chen H-C, Kuo C-W, Shau W-Y, Lai M-S. Non-steroidal anti- inflammatory drugs and risk of lower gastrointestinal adverse events: a nationwide study in Taiwan. Gut. 2011;60(10):1372–8.
108. Abraham NS, Hartman C, Castillo D, Richardson P, Smalley W. Effectiveness of national provider prescription of PPI gastroprotection among elderly NSAID users. Am J Gastroenterol. 2008;103(2):323–32.
109. Chang C-H, Chen H-C, Lin J-W, Kuo C-W, Shau W-Y, Lai M-S. Risk of hospitalization for upper gastrointestinal adverse events associated with nonsteroidal anti-inflammatory drugs: a nationwide case-crossover study in Taiwan. Pharmacoepidemiol Drug Saf. 2011;20:763–71.
110. Castellsague J, Pisa F, Rosolen V, Drigo D, Riera-Guardia N, Giangrego M, et al.. Risk of upper gastrointestinal complications in a cohort of users of nimesulide and other nonsteroidal anti-inflammatory drugs in Friuli Venezia Giulia, Italy. Pharmacoepidemiol Drug Saf. 2013;22:365–75.
111. Castellsague J, Holick CN, Hoffman CC, Gimeno V, Stang MR, Perez-Gutthann S. Risk of upper gastrointestinal complications associated with cyclooxygenase-2 selective and nonselective nonsteroidal antiinflammatory drugs. Pharmacotherapy. 2009;29(12):1397–407.
112. Battistella M, Mamdani M, Juurlink DN, Rabeneck L, Laupacis A. Risk of Upper 2 Inhibitors. Arch Intern Med. 2005;165:189–92.
113. Crooks CJ, West J, Card TR. Comorbidities affect risk of nonvariceal upper gastrointestinal bleeding. Gastroenterology. 2013;144(7):1384–93.
114. Etminan M, LÉvesque L, Fitzgerald JM, Brophy JM. Risk of upper gastrointestinal bleeding with oral bisphosphonates and non steroidal anti-inflammatory drugs: A case-control study. Aliment Pharmacol Ther. 2009;29(11):1188–92.
115. García Rodríguez LA, Barreales Tolosa L. Risk of Upper Gastrointestinal Complications Among Users of Traditional NSAIDs and COXIBs in the General Population. Gastroenterology. 2007;132(2):498–506.
116. García Rodríguez LA, Lin KJ, Hernández-Díaz S, Johansson S. Risk of upper gastrointestinal bleeding with low-dose acetylsalicylic acid alone and in combination with clopidogrel and other medications. Circulation. 2011;123(10):1108–15.
117. Helin-Salmivaara A, Saarelainen S, Grönroos JM, Vesalainen R, Klaukka T, Huupponen R. Risk of upper gastrointestinal events with the use of various NSAIDs: A case-control study in a general population. Scand J Gastroenterol. 2007;42:923–32.
118. Hippisley-cox J, Coupland C, Logan R. Risk of adverse gastrointestinal outcomes in patients taking cyclo-oxygenase-2 inhibitors or conventional non-steroidal anti-inflammatory drugs: population based nested case-control analysis. BMJ. 2005;331:1310–6.
119. Humes DJ, Fleming KM, Spiller RC, West J. Concurrent drug use and the risk of perforated colonic diverticular disease: A population-based case-control study. Gut. 2011;60(2):219–24.
120. Lanas A, García-Rodríguez LA, Arroyo MT, Gomollón F, Feu F, González-Pérez A, et al. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut. 2006;55(12):1731–8.
121. Lanas A, Carrera-Lasfuentes P, Arguedas Y, García S, Bujanda L, Calvet X, et al.. Risk of upper and lower gastrointestinal bleeding in patients taking nonsteroidal anti-inflammatory drugs, antiplatelet agents, or anticoagulants. Clin Gastroenterol Hepatol. 2015;13(5):906–12.
122. Laporte J, Ibañez L, Vidal X, Vendrell L, Leone R. Upper Gastrointestinal Bleeding Associated with the Use of NSAIDs. Drug Saf. 2004;27(6):411–20.
123. Lin CC, Hu HY, Luo JC, Peng YL, Hou MC, Lin HC, et al.. Risk factors of gastrointestinal bleeding in clopidogrel users: A nationwide population-based study. Aliment Pharmacol Ther. 2013;38(9):1119–28. Cyclo-oxygenase-2 inhibitors or conventional non-steroidal anti-inflammatory drugs. Bmj. 2002;325(September):624–30.
125. Marra CA, Lynd LD, Colley L, Harvard SS, Lacaille D, Schwenger E, et al.. Risk of gastrointestinal events in patients with rheumatoid arthritis after withdrawal of rofecoxib. J Rheumatol. 2012;39(5):910–5.
126. Nagata N, Niikura R, Aoki T, Shimbo T, Kishida Y, Sekine K, et al.. Lower GI bleeding risk of nonsteroidal anti-inflammatory drugs and antiplatelet drug use alone and the effect of combined therapy. Gastrointest Endosc. 2014;80(6):1124–31.
127. Nagata N, Niikura R, Aoki T, Shimbo T, Kishida Y, Sekine K, et al.. Colonic diverticular hemorrhage associated with the use of nonsteroidal anti-inflammatory drugs, low-dose aspirin, antiplatelet drugs, and dual therapy. J Gastroenterol Hepatol. 2014;29(10):1786–93.
128. Norgard B, Pedersen L, Johnsen SP, Tarone RE, McLaughlin JK, Friis S, et al.. COX-2- selective inhibitors and the risk of upper gastrointestinal bleeding in high-risk patients with previous gastrointestinal diseases: a population-based case-control study. Aliment Pharmacol Ther. 2004;19(7):817–25.
129. Qadeer MA, Richter JE, Brotman DJ. Hospital-acquired gastrointestinal bleeding outside the critical care unit: risk factors, role of acid suppression, and endoscopy findings. J Hosp Med. 2006;1(1):13–20.
130. Ruigomez A, Johansson S, Nagy P, Martin-Perez M, Garcia Rodriguez LA. Risk of uncomplicated peptic ulcer disease in a cohort of new users of low-dose acetylsalicylic acid for secondary prevention of cardiovascular events. Bmc Gastroenterol. 2014;14:1–10.
131. Sirois C, Moisan J, Poirier P, Grégoire J-P. Myocardial infarction and gastro-intestinal bleeding risks associated with aspirin use among elderly individuals with type 2 diabetes. Ann Med. 2014;46(5):335–40.
132. Tata LJ, Fortun PJ, Hubbard RB, Smeeth L, Hawkey CJ, Smith CJP, et al.. Does concurrent prescription of selective serotonin reuptake inhibitors and non-steroidal anti-inflammatory drugs substantially increase the risk of upper gastrointestinal bleeding? Aliment Pharmacol Ther. 2005;22(3):175–81.
133. Tseng CL, Chen YT, Huang CJ, Luo JC, Peng YL, Huang DF, et al.. Short-term use of glucocorticoids and risk of peptic ulcer bleeding: A nationwide population-based case- crossover study. Aliment Pharmacol Ther. 2015;42(5):599–606.
134. Wessinger S, Kaplan M, Choi L, Williams M, Lau C, Sharp L, et al.. Increased use of selective serotonin reuptake inhibitors in patients admitted with gastrointestinal haemorrhage: A multicentre retrospective analysis. Aliment Pharmacol Ther. 2006;23(7):937–44.
135. Castellsague J, Riera-Guardia N, Calingaert B, Varas-Lorenzo C, Fourrier-Reglat A, Nicotra F, et al. Individual NSAIDs and Upper Gastrointestinal Complications. Drug Saf. 2012;35(12):1127–46.
136. Kearney PM, Baigent C, Godwin J, Halls H, Emberson JR, Patrono C. Do selective cyclo- oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials. BMJ. 2006;332:1302.
137. Massó González EL, Patrignani P, Tacconelli S, García Rodríguez LA. Variability among nonsteroidal antiinflammatory drugs in risk of upper gastrointestinal bleeding. Arthritis Rheum. 2010;62(6):1592–601.
138. Varas-Lorenzo C, Riera-Guardia N, Calingaert B, Castellsague J, Pariente A, Scotti L, et al. Stroke risk and NSAIDs: a systematic review of observational studies. Pharmacoepidemiol Drug Saf. 2011;20:1225–36.
139. U.S. Food and Drug Administration. Postmarket Drug Safety Information for Patients and Providers – Information for Healthcare Professionals: Valdecoxib (marketed as Bextra). Center for Drug Evaluation and Research [Internet]. Disponible en:
https://wayback.archive- it.org/7993/20170112170800/http://www.fda.gov/Safety/MedWatch/SafetyInformation/Safety AlertsforHumanMedicalProducts/ucm150752.htm. [Accedido el 16 Jul 2021]
140. Colditz GA, Miller JN, Mosteller F. How study design affects outcomes in comparisons of therapy. I: Medical. Stat Med. 1989;8(4):441–54.
MATERIAL COMPLEMENTARIO
Resumen de términos relacionados con la búsqueda en el metaanálisis sobre el riesgo cardiovascular
PUBMED
Terms related to therapeutic group
Anti inflammatory agents non steroidal
Non selective non steroidal anti inflammatory drugs
Non steroidal/anti inflammatory drug Non steroidal anti inflammatory drugs Nsaid
Selective non steroidal anti inflammatory drug
Cox 2 inhibitor
Selective cyclo oxygenase 2 inhibitors
Selective cox 2 inhibitor
Terms related to drugs
Celecoxib Lornoxicam Fenoprofen Mefenamic Acid
Rofecoxib
Tenoxicam
Dexibuprofen
Sulindac
Etoricoxib
Diclofenac
Dexketoprofen
Nabumetone
Lumiracoxib
Aceclofenac
Naproxen
Tiaprofenic Acid
Valdecoxib
Ibuprofen
Indomethacin
Propyphenazone
Piroxicam
Flurbiprofen
Etodolac
Meloxicam
Ketoprofen
Ketorolac
Terms related to kind of study
Observational studies as topic
Case Control studies Cohort studies Epidemiologic studies
Terms related to cardiovascular events
Drug Related Side Effects and Adverse Reactions
Cardiovascular diseases
Terms related to risk
Risk Hazard Odd
Complete sintaxis
((((((((((((((((((((((((((((((((((“anti inflammatory agents non steroidal”[Title/Abstract] OR “non selective non steroidal anti inflammatory drugs”[Title/Abstract] OR “non steroidal/anti inflammatory drug”[Title/Abstract]) OR “non steroidal anti inflammatory drugs”[Title/Abstract] OR “nsaid”[Title/Abstract]) OR “selective non steroidal anti inflammatory drugs”[Title/Abstract]) OR “cox 2 inhibitor”[Title/Abstract]) OR “selective cyclo oxygenase 2 inhibitors”[Title/Abstract]) OR “selective cox 2 inhibitor”[Title/Abstract]) OR “celecoxib”[Title/Abstract]) OR “rofecoxib”[Title/Abstract]) OR “etoricoxib”[Title/Abstract]) OR “valdecoxib”[Title/Abstract]) OR “lumiracoxib”[Title/Abstract]) OR “meloxicam”[Title/Abstract]) OR “piroxicam”[Title/Abstract]) OR “lornoxicam”[Title/Abstract]) OR “tenoxicam”[Title/Abstract]) OR “diclofenac”[Title/Abstract]) OR “aceclofenac”[Title/Abstract]) OR “ibuprofen”[Title/Abstract]) OR “flurbipofen”[Title/Abstract]) OR “ketoprofen”[Title/Abstract]) OR “dexibuprofen”[Title/Abstract]) OR “dexketoprofen”[Title/Abstract]) OR “naproxen”[Title/Abstract]) OR “indometacin”[Title/Abstract]) OR “etodolac”[Title/Abstract]) OR “ketorolac”[Title/Abstract]) OR “mefenamic acid”[Title/Abstract]) OR “sulindac”[Title/Abstract]) OR “nabumetone”[Title/Abstract]) OR “tiaprofenic acid”[Title/Abstract]) OR “propyphanozone”[Title/Abstract]) AND ((“risk”[Title/Abstract] OR “hazard”[Title/Abstract]) OR “odd”[Title/Abstract])) AND (((“observational studies as topic”[MeSH Terms] OR “case control studies”[MeSH Terms]) OR “cohort studies”[MeSH Terms]) OR “epidemiologic studies”[MeSH Terms])) AND (“cardiovascular diseases”[MeSH Terms] OR “drug related side effects
and adverse reactions”[MeSHTerms]))AND (“1999/10/01” [PDAT]: “2017/09/01″[PDAT])
EMBASE
Terms related to therapeutic group
Nonsteroid antiinflammatory agent
Cyclooxygenase 2 inhibitor
Terms related to drugs
Celecoxib Lornoxicam Fenoprofen Mefenamic Acid
Rofecoxib
Tenoxicam
Dexibuprofen
Sulindac
Etoricoxib
Diclofenac
Dexketoprofen
Nabumetone
Lumiracoxib
Aceclofenac
Naproxen
Tiaprofenic Acid
Valdecoxib
Ibuprofen
Indomethacin
Propyphenazone
Piroxicam
Flurbiprofen
Etodolac
Meloxicam
Ketoprofen
Ketorolac
Terms related to kind of study
Observational study Case Control study Cohort analysis
Terms related to cardiovascular events
Adverse drug reaction Cardiovascular disease Cardiovascular risk
Complete sintaxis
((((nonsteroid antiinflammatory agent/ or aceclofenac/ or dexibuprofen/ or dexketoprofen/ or diclofenac/ or etodolac/ or flurbiprofen/ or ibuprofen/ or indometacin/
or ketoprofen/ or ketorolac/ or mefenamic acid/ or meloxicam/ or nabumetone/ or naproxen/ or piroxicam/ or sulindac/ or tenoxicam/ or tiaprofenic acid/ OR cyclooxygenase 2 inhibitor/ or celecoxib/ or etoricoxib/ or lumiracoxib/ or rofecoxib/ or valdecoxib/) AND (‘observational study’/exp OR ‘case control study’/exp OR ‘cohort analysis’/exp) AND (‘adverse drug reaction’/exp OR ‘cardiovascular disease’/exp OR ‘cardiovascular risk’/exp) AND [1-10-1999]/sd NOT [1-9-2017]/sd)
Resumen de términos relacionados con la búsqueda en el metaanálisis sobre el riesgo gastrointestinal
PUBMED
Terms related to therapeutic group
Anti inflammatory agents non steroidal
Non selective non steroidal anti inflammatory drugs
Non steroidal/anti inflammatory drug Non steroidal anti inflammatory drugs Nsaid
Selective non steroidal anti inflammatory drug
Cox 2 inhibitor
Selective cyclo oxygenase 2 inhibitors
Selective cox 2 inhibitor
Terms related to drugs
Celecoxib Lornoxicam Fenoprofen Mefenamic Acid
Rofecoxib
Tenoxicam
Dexibuprofen
Sulindac
Etoricoxib
Diclofenac
Dexketoprofen
Nabumetone
Lumiracoxib
Aceclofenac
Naproxen
Tiaprofenic Acid
Valdecoxib
Ibuprofen
Indomethacin
Propyphenazone
Piroxicam
Flurbiprofen
Etodolac
Meloxicam
Ketoprofen
Ketorolac
Terms related to kind of study
Observational studies as topic
Case Control studies Cohort studies Epidemiologic studies
Terms related to adverse reactions
Gastrointestinal diseases
Drug related side effects and adverse reactions
Gastrointestinal risk
Complete sintaxis
((((((((((((((((((((((((((((((((((“anti inflammatory agents non steroidal”[Title/Abstract] OR “non selective non steroidal anti inflammatory drugs”[Title/Abstract] OR “non steroidal/anti inflammatory drug”[Title/Abstract]) OR “non steroidal anti inflammatory drugs”[Title/Abstract] OR “nsaid”[Title/Abstract]) OR “selective non steroidal anti inflammatory drugs”[Title/Abstract]) OR “cox 2 inhibitor”[Title/Abstract]) OR “selective cyclo oxygenase 2 inhibitors”[Title/Abstract]) OR “selective cox 2 inhibitor”[Title/Abstract]) OR “celecoxib”[Title/Abstract]) OR “rofecoxib”[Title/Abstract]) OR “etoricoxib”[Title/Abstract]) OR “valdecoxib”[Title/Abstract]) OR “lumiracoxib”[Title/Abstract]) OR “meloxicam”[Title/Abstract]) OR “piroxicam”[Title/Abstract]) OR “lornoxicam”[Title/Abstract]) OR “tenoxicam”[Title/Abstract]) OR “diclofenac”[Title/Abstract]) OR “aceclofenac”[Title/Abstract]) OR “ibuprofen”[Title/Abstract]) OR “flurbipofen”[Title/Abstract]) OR “ketoprofen”[Title/Abstract]) OR “dexibuprofen”[Title/Abstract]) OR “dexketoprofen”[Title/Abstract]) OR “naproxen”[Title/Abstract]) OR “indometacin”[Title/Abstract]) OR “etodolac”[Title/Abstract]) OR “ketorolac”[Title/Abstract]) OR “mefenamic acid”[Title/Abstract]) OR “sulindac”[Title/Abstract]) OR “nabumetone”[Title/Abstract]) OR “tiaprofenic acid”[Title/Abstract]) OR “propyphanozone”[Title/Abstract]) AND ((“risk”[Title/Abstract] OR “hazard”[Title/Abstract]) OR “odd”[Title/Abstract])) AND (((“observational studies as topic”[MeSH Terms] OR “case control studies”[MeSH Terms]) OR “cohort studies”[MeSH Terms]) OR “epidemiologic studies”[MeSH Terms])) AND (“gastrointestinal diseases”[MeSH Terms] OR “drug related side effects and adverse reactions”[MeSH Terms] OR “gastrointestinal risk”[Title/Abstract]))) AND (“1999/10/01″[PDAT] : “2017/09/01″[PDAT])
EMBASE
Terms related to therapeutic group
Nonsteroid antiinflammatory agent
Cyclooxygenase 2 inhibitor
Terms related to drugs
Celecoxib Lornoxicam Fenoprofen Mefenamic Acid
Rofecoxib
Tenoxicam
Dexibuprofen
Sulindac
Etoricoxib
Diclofenac
Dexketoprofen
Nabumetone
Lumiracoxib
Aceclofenac
Naproxen
Tiaprofenic Acid
Valdecoxib
Ibuprofen
Indomethacin
Propyphenazone
Piroxicam
Flurbiprofen
Etodolac
Meloxicam
Ketoprofen
Ketorolac
Terms related to kind of study
Observational study Case Control study Cohort analysis
Terms related to cardiovascular events
Adverse drug reaction Digestive system disease Gastrointestinal symptom
Complete sintaxis
((((nonsteroid antiinflammatory agent/ or aceclofenac/ or dexibuprofen/ or dexketoprofen/ or diclofenac/ or etodolac/ or flurbiprofen/ or ibuprofen/ or indometacin/ or ketoprofen/ or ketorolac/ or mefenamic acid/ or meloxicam/ or nabumetone/ or naproxen/ or piroxicam/ or sulindac/ or tenoxicam/ or tiaprofenic acid/ OR cyclooxygenase 2 inhibitor/ or celecoxib/ or etoricoxib/ or lumiracoxib/ or rofecoxib/ or valdecoxib/) AND (‘observational study’/exp OR ‘case control study’/exp OR ‘cohort analysis’/exp) AND (‘adverse drug reaction’/exp OR ‘digestive system disease’/exp OR ‘gastrointestinal symptom’/exp) AND [1-10-1999]/sd NOT [1-9-2017]/sd).