RESUMEN:
La enfermedad cerebrovascular es una de las complicaciones de la diabetes mellitus de larga duración. Mientras que la estructura y función de los grandes vasos cerebrales puede ser más fácilmente estudiada, la microcirculación cerebral es difícil de evaluar. Sin embargo, con una simple exploración de fondo de ojo con un oftalmoscopio se pueden visualizar las anomalías microvasculares que caracterizan a la retinopatía diabética, que es la complicación microvascular más frecuente de la diabetes. La similitud anatómica y funcional entre ambas circulaciones justifica la hipótesis de que las alteraciones en la reactividad vascular retiniana podrían considerarse un marcador temprano de disfunción microvascular cerebral en la diabetes.
El factor iniciador de las angiopatías diabéticas es la disfunción endotelial. La disfunción endotelial se traduce en una reducida biodisponibilidad de óxido nítrico (NO), como consecuencia de una disminución en su síntesis o por el incremento en la producción de radicales libres de oxígeno, secuestradores de NO. La diabetes también estimula la producción de factores contráctiles derivados de endotelio. Los aniones superóxido y los radicales hidroxilos producen un efecto contráctil, así como la endotelina y ciertos derivados de la ciclooxigenasa (COX). La activación de la COX está relacionada con un elevado nivel de estrés oxidativo. El estrés oxidativo colabora con la respuesta inflamatoria determinando la disfunción vascular diabética. Estas afirmaciones han sido comprobadas tanto en arterias cerebrales como retinianas, fundamentalmente a través de estudios de reactividad vascular in vitro, sugiriendo que la diabetes induce un profundo cambio en los mecanismos de regulación microvascular. La asociación entre el grado de perfusión retiniana, las lesiones cerebrales y la alteración de la función cognitiva, indican un cierto paralelismo en el grado de afectación de ambas circulaciones. Además, estudios prospectivos concluyen que la retinopatía diabética predice la enfermedad cerebrovascular isquémica independientemente de otros factores de riesgo, avalando la importancia de la enfermedad cerebral microvascular en los diabéticos.
Es necesario seguir investigando las alteraciones vasculares para comprender la fisiopatología subyacente de las retinopatías y de las enfermedades cerebrovasculares en la diabetes. En un futuro cercano el uso de métodos completamente automatizados de detección de signos de retinopatía no sólo facilitará la evaluación eficiente de los cambios vasculares en la retina, sino que también colaborará en la reducción de la morbilidad y mortalidad vascular cerebral.
Palabras Clave: retinopatía diabética; enfermedad microvascular cerebral; disfunción endotelial; estrés oxidativo;
ABSTRACT:
Cerebrovascular disease is one of the complications of long-term diabetes mellitus. While the structure and function of the great cerebral vessels may be more easily studied, the cerebral microcirculation is difficult to assess. However, a simple eye fundus examination with an ophthalmoscope enables to visualize the microvascular abnormalities that characterize diabetic retinopathy, which isth e most common microvascular complication of diabetes. The anatomical and functional similarity between retinal and cerebral microcirculation supports the hypothesis that alterations in retinal vascular reactivity could be considered as an early marker of cerebral microvascular dysfunction in diabetes.
The initiating factor of diabetic angiopathies is endothelial dysfunction. Endothelial dysfunction results in a reduced bioavailability of nitric oxide (NO), as a consequence of decreased NO synthesis and/or increased production of free oxygen radicals that are NO scavengers. Diabetes also stimulates the production of endothelial-derived contractile factors such as superoxide anions and hydroxyl radicals, endothelin and certain cyclooxygenase (COX) derivatives. COX activation is related to a high level of oxidative stress. Oxidative stress participates in the inflammatory response involved in the diabetic vascular dysfunction. These pathogenic mechanisms have been shown in both cerebral and retinal arteries, mainly through in vitro vascular reactivity studies, suggesting that diabetes induces a profound change in microvascular regulatory mechanisms. The association between the degree of retinal perfusion, brain injuries and altered cognitive function indicates a certain parallelism in the degree of impairment of both retinal and brain circulations. In addition, prospective studies conclude that diabetic retinopathy predicts ischemic cerebrovascular disease independently of other risk factors, supporting the importance of cerebral microvascular disease in diabetics.
Further research on the vascular abnormalities is needed to understand the pathogenic mechanisms underlying retinopathies and cerebrovascular disease in diabetes. In the near future, the use of fully automated methods to detect signs of retinopathy will not only facilitate the efficient evaluation of vascular changes in the retina but will also help to reduce cerebral vascular morbidity and mortality.
Keywords: Diabetic retinopathy; cerebral small vessel disease; endothelial dysfunction; oxidative stress
1. LA DIABETES MELLITUS COMO ENFERMEDAD VASCULAR
El término diabetes mellitus, según la O.M.S. describe una enfermedad metabólica de etiología múltiple caracterizada por hiperglucemia crónica y la alteración del metabolismo de los hidratos de carbono, grasas y proteínas, consecuencia de defectos en la secreción de insulina, en su acción o en ambas (1). Es la enfermedad metabólica grave más frecuente en los seres humanos.
Existen diferentes tipos de diabetes: la diabetes mellitus tipo 1 en la que se observa un déficit absoluto en la secreción de insulina, por destrucción autoinmune de las células beta de los islotes de Langerhans del páncreas y que afecta principalmente a niños y jóvenes.
La causa de la diabetes mellitus tipo 2 es una combinación de la resistencia a la acción de la insulina y una inadecuada respuesta compensadora. Esta forma afecta especialmente a los adultos y ancianos. Guarda una estrecha relación con factores como la obesidad y un estilo de vida sedentario, que junto con el envejecimiento se consideran como los principales responsables del aumento constante de la diabetes mellitus tipo 2. Es el tipo de diabetes más común, el 90% de los individuos diagnosticados de diabetes presentan este tipo de diabetes.
En cuanto a la diabetes gestacional, se diagnostica por primera vez durante la gestación y suele desaparecer tras el parto. Sin embargo, las pacientes que la sufren presentan una mayor predisposición a desarrollar diabetes mellitus tipo 2 conforme envejecen, al igual que los bebés nacidos en este entorno.
Aunque la diabetes puede manifestarse con una serie de complicaciones agudas como la cetoacidosis diabética, el síndrome hiperglucémico hiperosmolar y la hipoglucemia grave, nos vamos a referir únicamente a las llamadas complicaciones tardías o crónicas. En una diabetes de larga evolución, sobre todo si no está bien controlada, es habitual el desarrollo de complicaciones micro y macrovasculares, es decir, micro y macroangiopatías, así como lesiones directas del sistema nervioso periférico. Las manifestaciones clínicas de las microangiopatías se deben a la afectación preferente de las microcirculaciones de determinados tejidos, dando lugar a la retinopatía, la nefropatía y la neuropatía diabéticas. Las manifestaciones de las macroangiopatías son las debidas principalmente al desarrollo de placas de ateroma expresándose, dependiendo de la localización de la placa, como una enfermedad arterial periférica, una cardiopatía coronaria o una enfermedad cerebrovascular.
Los mecanismos subyacentes que justifican estas complicaciones tardías son puestos en marcha por la hiperglucemia y los factores genéticos y entre ellos se encuentran (2):
a) La alteración de la vía de los polioles
Que además de ser responsable de la catarata diabética por el efecto osmótico del sorbitol, también es culpable de la alteración funcional de la proteína cinasa C, lo que deriva en múltiples consecuencias, desde la alteración de la bomba Na+-K+asa, la resistencia a la insulina, la liberación de citocinas inflamatorias, además de las alteraciones vasculares por aumento en la proliferación, contractilidad y permeabilidad de las células vasculares. Todo ello es importante porque justifica la alteración de la función celular y de la conducción nerviosa.
b) Alteraciones hemorreológicas
En la diabetes mellitus aumenta la viscosidad plasmática y la agregación plaquetaria, por lo que se produce un estado de hipercoagulabilidad que facilita el desarrollo de macroangiopatías.
c) La glicación no enzimática de proteínas
Las macroangiopatías también son la consecuencia de la glicación no enzimática de proteínas. Se glican muchos tipos de proteínas, entre ellas, las lipoproteínas de baja densidad (LDL), que al ser glicadas, modificadas, se pone en marcha un mecanismo anómalo de captación por parte de los macrófagos transformándose en células espumosas que constituyen la primera etapa en el proceso aterogénico de formación de placas de ateroma. La glicación de la hemoglobina hace que esta molécula aumente su afinidad por el oxígeno, lo que unido a la respuesta alterada del 2-3 difosfoglicerato conduce a una hipoxia por dificultad de la hemoglobina para ceder el oxígeno. La alteración del colágeno tipo IV y otras proteínas de matriz extracelular ocasionan el característico engrosamiento de las membranas basales.
d) El factor de crecimiento endotelial vascular (VEGF) y el factor transformante beta (TGF-β).
El papel patogénico del VEGF y del TGF-β se basa en que son responsables de la formación de nuevos vasos, es decir, son moléculas con propiedades angiogénicas que se ponen de manifiesto especialmente en la nefropatía y retinopatía diabéticas.
Por todo ello, es fácil entender por qué muchos autores consideran a la diabetes mellitus como una verdadera enfermedad vascular. Pero antes de antes de hablar de enfermedad, de la disfunción de los vasos sanguíneos, veamos cómo se lleva a cabo la regulación del tono vascular en condiciones fisiológicas.
2. REGULACIÓN DEL TONO VASCULAR
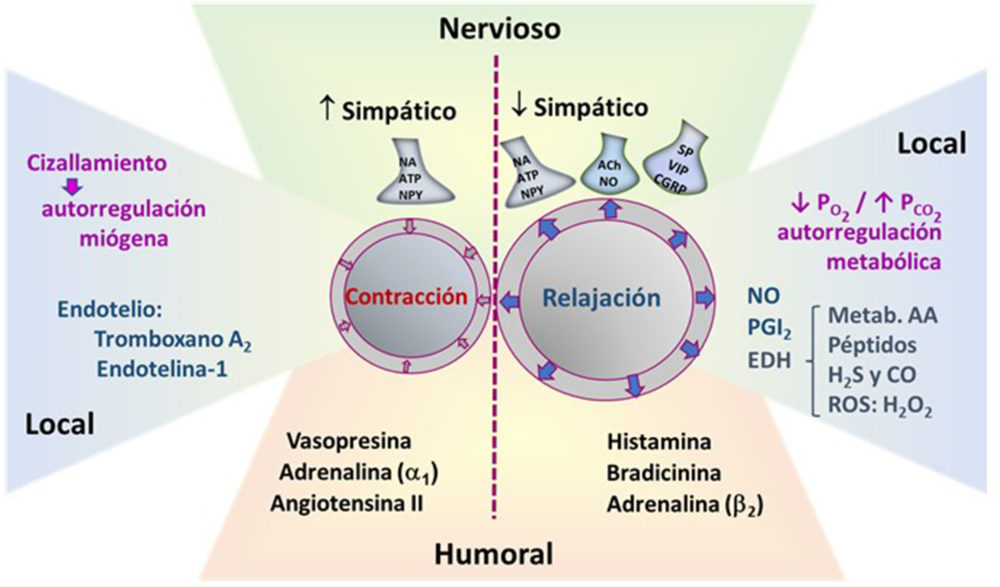
Existen tres tipos de mecanismos de regulación del diámetro vascular; los humorales, los nerviosos y los locales (Fig. 1). Entre los mecanismos locales se encuentran los endoteliales. El endotelio forma parte de la capa más interna de los vasos sanguíneos y va a actuar como una interfase entre la sangre y la pared vascular. Cuando el endotelio se encuentra sano es un órgano paracrino, autocrino y endocrino, que juega un papel clave en la homeostasis secretando moléculas vasoconstrictoras, con acciones proliferativas y proagregantes como el tromboxano A2 (TXA2) y la endotelina (ET-1), pero sobre todo en condiciones fisiológicas, secreta moléculas vasodilatadoras, anticoagulantes y antinflamatorios como el óxido nítrico (NO) y la prostaciclina (PGI2). Además, el endotelio también es capaz de liberar factores que hiperpolarizan el músculo liso vascular activando canales de K+ para producir una vasodilatación, como es el caso de algunos metabolitos del ácido araquidónico, algunos péptidos, gases como el H2S y el CO, y también especies reactivas de oxígeno (ROS) como el H2O2. Actualmente se utiliza un término que indica un concepto más amplio, el de “hiperpolarización derivada del endotelio” (EDH) porque se ha demostrado que este tipo de respuesta puede iniciarse también con la hiperpolarización de las células endoteliales que posteriormente se propaga al músculo liso vascular (MLV) (3).
Figura 1. Regulación local, humoral y nerviosa del tono vascular en condiciones fisiológicas.
Además existen mecanismos locales de autorregulación que ajustan el diámetro vascular con independencia de los mecanismos neurohumorales. La autorregulación puede ser miogénica, activada por señales físicas como el cizallamiento de la pared vascular o puede ser metabólica, que se pone en marcha a partir de señales químicas, como la presión parcial de oxígeno y de dióxido de carbono. Estos mecanismos de autorregulación son fundamentales en algunos lechos vasculares, entre ellos precisamente, el cerebral y el retiniano, que posteriormente describiremos con más de
talle. En cuanto a los mecanismos humorales, existen moléculas que son transportadas por la sangre y producen vasoconstricción como es el caso de la vasopresina, la angiotensina II o la adrenalina al actuar sobre los receptores a1-adrenérgicos, o vasodilatación, como también la adrenalina, pero en este caso actuando a través de receptores β2-adrenérgicos, la histamina o la bradicinina.
En cuanto a los mecanismos de origen nervioso, la inervación simpática perivascular, no es la única, pero si la principal protagonista del control neurógeno, cuya activación se traduce en una vasoconstricción y la vasodilatación se desarrolla por inhibición de la actividad simpática.
3. DISFUNCIÓN VASCULAR DIABETICA
El factor iniciador de las angiopatías diabéticas es la disfunción endotelial. La disfunción endotelial consiste en una reducida biodisponibilidad de NO, regulador vasodilatador esencial en condiciones fisiológicas, como consecuencia de una disminución en la síntesis de NO, demostrada tanto en las células endoteliales retinianas como cerebrales, por diferentes motivos: bien por una reducida expresión proteica de su enzima de síntesis endotelial, la NOSe, por una disminución del cofactor esencial tetrahidrobiopterina (BH4) o del sustrato L-arginina al estar incrementada la actividad de la arginasa, o bien por unos elevados niveles del inhibidor endógeno de la NOSe, la dimetilarginina asimétrica ADMA. Pero también el incremento en la producción de radicales libres de oxígeno, secuestradores de NO, puede desencadenar una reducida biodisponibilidad de NO. Cuando las respuestas mediadas por NO se ven alteradas es habitual que se pongan en marcha mecanismos compensadores por parte de la pared vascular y se incremente la liberación de otros vasodilatadores como la PGI2 y/o se active la EDH (4).
La diabetes también estimula la producción de factores contráctiles derivados de endotelio (EDCF), como los derivados de la ciclooxigenasa (COX): el tromboxano A2 y diversas prostaglandinas activando los receptores TP en el músculo liso vascular (4). La producción incrementada de estos factores está relacionada con un elevado nivel de estrés oxidativo, ya que se ha demostrado que las especies reactivas de oxígeno regulan al alza la expresión de COX en las células endoteliales, mientras que, a su vez, la COX es una de las fuentes más importantes de radicales libres de oxígeno, estableciéndose un círculo vicioso. Los propios aniones superóxido y los radicales hidroxilos producen un efecto contráctil. Además, trabajando junto con estos factores se encuentra la endotelina, que no sólo es una molécula vasoconstrictora por sí misma, sino que también potencia el efecto vasoconstrictor de otras moléculas y cuya liberación se encuentra incrementada en la diabetes (4).
Los radicales libres son moléculas altamente reactivas que pueden reaccionar con macromoléculas orgánicas conduciendo al daño celular. Dentro de los radicales libres, nos encontramos con las especies reactivas de oxígeno (ROS) que son el radical hidroxilo (OH–), el anión superóxido (O2.-) y el peróxido de hidrógeno (H2O2), y con las especies reactivas de nitrógeno, entre las que destaca el NO. Las especies reactivas de oxígeno pueden interactuar con el NO formando peroxinitrito.
Las principales fuentes de generación de ROS en la pared vascular son:
La mitocondria, las NADPH oxidasas, la xantín oxidasa, la NOS desacoplada (en situaciones de estrés oxidativo se oxida la tetrahidrobiopterina, se desacopla la enzima y genera O2.- en vez de NO).
En cuanto a los sistemas antioxidantes, la SOD, la catalasa, o enzimas reductoras como la glutation peroxidasa, eliminan el H2O2.
El estrés oxidativo se va a producir cuando se generan más radicales libres y/o cuando se reducen las defensas anti-oxidantes, resultado del colapso mitocondrial, situación que se produce en la diabetes.
Además, en la diabetes aumentan los niveles de citoquinas y de otros mediadores inflamatorios, como el TNFα y la interleucina 6, y la expresión de moléculas de adhesión entre leucocitos y células endoteliales, como las ICAM-1 o las selectinas E. Por todo ello, se piensa que el estrés oxidativo va a colaborar con la respuesta inflamatoria determinando la disfunción vascular diabética.
En el síndrome metabólico, situación en muchos casos previa a la diabetes y en la que existe una resistencia a la insulina, se producen ya efectos deletéreos sobre la función vascular, como hemos demostrado en los últimos años en diferentes lechos vasculares de un modelo experimental de ratas Zucker obesas con síndrome metabólico (5-13). En estas ratas, que constituyen el modelo animal mejor conocido de obesidad genética, se ha inducido la mutación del gen que codifica el receptor de leptina, afectándose la capacidad de la leptina para suprimir la ingesta de alimentos. En el momento del sacrificio, a las 17-18 semanas de edad, estas ratas Zucker además de obesas son ligeramente hiperglucémicas, hiperinsulinémicas y dislipidémicas.
Como ejemplo de afectación vascular en una situación de prediabetes, me gustaría mostrarles algunos resultados obtenidos en nuestro laboratorio en la arteria femoral de ratas Zucker obesas, segmento que seleccionamos por ser la localización más común de la enfermedad arterial periférica, una de las complicaciones macrovasculares de la diabetes (14).
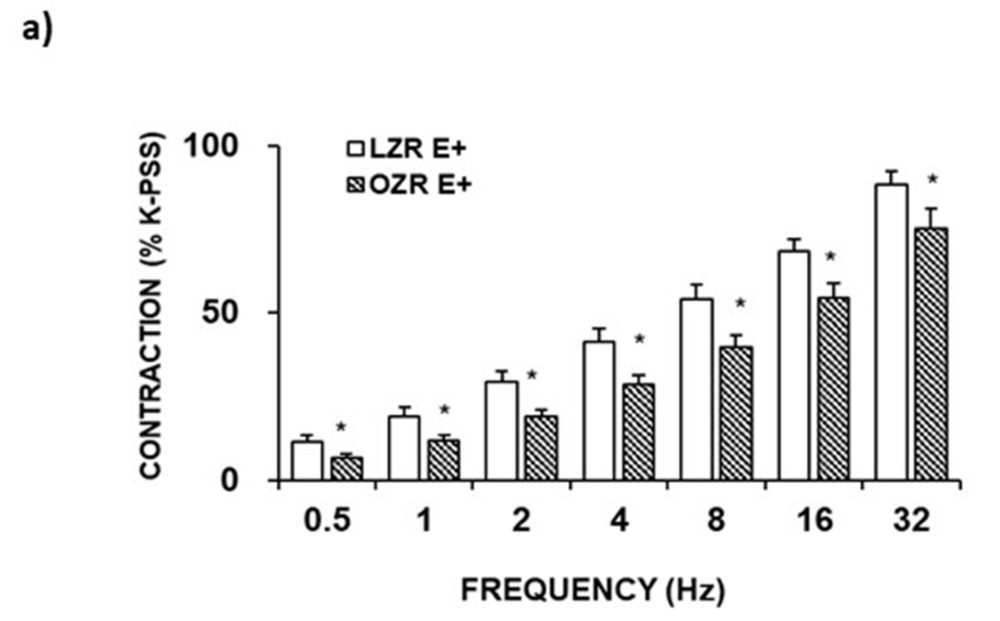
Los estudios funcionales de reactividad vascular se realizaron montando los segmentos de arteria femoral como anillos, de aproximadamente 400 μm de diámetro interno, en miógrafos microvasculares. Los resultados de dichos estudios funcionales nos permitieron demostrar que las respuestas inducidas por estimulación eléctrica sobre el tono basal de las preparaciones, es decir, la vasoconstricción neurogénica de la arteria femoral, era menor en las ratas prediabéticas (OZR) que en las ratas controles (LZR) (Fig. 2a).
Para conocer cuál era la razón de esta reducida respuesta neurogénica, procedimos a analizar la implicación de los principales mecanismos de regulación endotelial. El hecho de que un inhibidor de la síntesis de NO mostrara su efecto en segmentos con el endotelio intacto y no en aquéllos en los que se había eliminado el endotelio, demuestra la participación del NO de origen endotelial en la contracción neurogénica observada en las ratas controles. Sin embargo, en las ratas prediabéticas, este tratamiento mostraba también efecto en arterias en las que se había eliminado el endotelio, lo que sugería que se habían activado fuentes adicionales de NO.
Los estudios de inmunohistoquímica y de expresión proteica de otras enzimas de síntesis de NO, nos permitió desvelar una mayor presencia y expresión tanto de la isoforma neural como de la inducible en estas condiciones de prediabetes (Fig. 2b).
Figura 2. a) Vasoconstricción neurogénica provocada por EFS en segmentos de arteria femoral con endotelio (E+) de LZR y OZR. *p <0.05. b) Imágenes representativas de secciones transversales de la arteria femoral mostrando la inmunorreactividad para NOSn y NOSi, e inmunoblot con la expresión proteica de dichas enzimas de síntesis.
Asimismo, pudimos demostrar, con un inhibidor específico de la COX-2, la implicación de prostanoides vasoconstrictores en la respuesta observada en las ratas prediabéticas. Este resultado funcional fue corroborado con los obtenidos a partir de técnicas inmunohistoquímicas y de Western blott, que desvelaron una localización adicional en la adventicia y unos mayores niveles proteicos de la COX-2 en OZR. La puesta en marcha del estrés oxidativo pudo comprobarse en las ratas prediabéticas al incubar las preparaciones con la molécula antioxidante, la enzima superóxido dismutasa.
El conjunto de estos resultados nos permitió sugerir que el organismo se defiende ante una situación de mayor generación de radicales libres tanto por disfunción de la NOS endotelial como por sobreexpresión de la COX-2, activando como mecanismo de compensación, otras enzimas de síntesis de NO, la NOS neural y la NOS inducible (14). Se piensa que este tipo de mecanismos compensadores son los responsables del amplio período asintomático de la diabetes mellitus y justifica que uno de cada dos diabéticos no sea diagnosticado en fases iniciales.
4. RETINOPATÍA DIABÉTICA
La diabetes afecta a la circulación de la retina dando lugar a la retinopatía diabética que es la complicación microvascular más frecuente de la diabetes mellitus. Además, según la Fundación para la Diabetes, es la causa más frecuente de ceguera en la población en edad laboral activa en los países desarrollados, siendo los varones más propensos a sufrir retinopatía diabética que las mujeres. Su incidencia aumenta con la duración de la enfermedad, de modo que, al cabo de 20 años de evolución, prácticamente la totalidad de los diabéticos tipo 1 y el 60% de los diabéticos tipo 2 presentan algún grado de retinopatía (15).
4.1. Regulación fisiológica del tono vascular retiniano
La retina es una membrana fotosensible cuya misión es transformar la luz en un estímulo nervioso que hace posible la visión. Está constituida por diez capas, de las cuales nueve forman la retina neurosensorial y la décima es el epitelio pigmentario. Los fotorreceptores son capaces de responder al estímulo lumínico, iniciándose una cascada de señales nerviosas que finalmente abandona el globo ocular a través de los axones de las células ganglionares que constituyen el nervio óptico y se dirige hacia la corteza visual para su integración.
Todo este proceso de conversión en la retina requiere energía y presenta un elevado consumo de oxígeno, de hecho, es el más elevado del organismo, siendo incluso superior al del cerebro. Sin embargo, una red vascular excesivamente rica en el lado interno de la retina interferiría con la transmisión de la luz a través de la misma hasta actuar en los fotorreceptores.
Este conflicto se resuelve anatómicamente, con dos suministros de sangre que nutren la retina: la circulación retiniana y la coroidea. La circulación coroidea irriga la parte externa de la retina, mientras que los vasos retinianos, irrigan las capas más internas.
El flujo sanguíneo coroideo está regulado principalmente por la inervación autonómica, mientras que los vasos retinianos carecen de inervación adrenérgica y colinérgica y están regulados fundamentalmente por factores locales liberados por células vecinas o por el endotelio y por mecanismos de autorregulación.
Durante las últimas décadas, se han realizado grandes esfuerzos para dilucidar los mecanismos de regulación del flujo sanguíneo de la retina, bajo el convencimiento de que es esencial conocer la hemodinámica retiniana para comprender las retinopatías, incluida la diabética.
En este sentido pude contribuir con las investigaciones realizadas en la Universidad de Aarhus en Dinamarca, formando parte del grupo del profesor Niels Nyborg, experto en la fisiología de las arterias de resistencia. Estudiamos las pequeñas arterias de la circulación coronaria, cerebral y retiniana (16-23). Concretamente, gracias al estudio de las pequeñas arterias de la retina se demostró por primera vez la capacidad de estas pequeñas arterias para liberar factores endoteliales, tanto relajantes como contráctiles, responsables de la regulación del tono vascular retiniano.
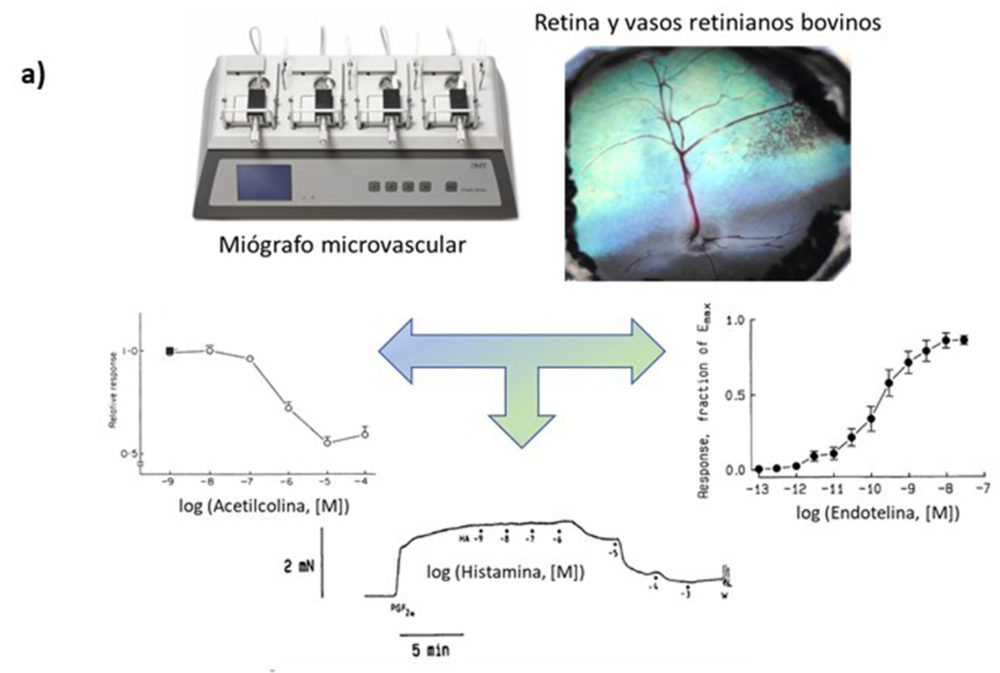
Para ello trabajamos con arterias retinianas de bóvidos de un diámetro normalizado de aproximadamente 200 μm y cuya reactividad estudiamos en miógrafos microvasculares.
Y así pudimos comprobar que el endotelio de estas arterias se activaba al unirse la acetilcolina a su receptor muscarínico (Fig. 3a) liberando un factor relajante endotelial que no era un prostanoide, puesto que la indometacina carecía de efecto, y que dependía del GMPc, como indicaba el efecto bloqueante del azul de metileno, por lo que sugerimos que posiblemente era el NO. Sólo era una sugerencia porque entonces no existían herramientas específicas para identificar al NO, como los actuales inhibidores de las NOS (19).
Como ya hemos mencionado, el endotelio también es capaz de regular el tono vascular a través de la liberación de factores contráctiles, como la endotelina, péptido que en las arterias de la retina demostró un potente efecto vasoconstrictor (Fig. 3a) que dependía prácticamente en su totalidad de la entrada de calcio extracelular a través de la apertura de los canales de calcio dependientes de voltaje, como nos demuestra un bloqueante de estos canales, la nitrendipina (20).
Por otro lado, un mediador inflamatorio como la histamina, producía una importante vasodilatación (Fig. 3a) que requería la activación tanto de los receptores de histamina H1 como de los H2, lo que concluimos tras incubar las arterias con los antagonistas específicos H1 y H2. Este efecto resultó ser dependiente de la presencia de un endotelio intacto, concretamente de la PGI2 endotelial y de otro factor relajante derivado del endotelio, probablemente del NO, en virtud de los resultados obtenidos con indometacina y azul de metileno. Por tanto, sería lógico pensar que la histamina puede jugar un papel significativo en la inflamación de la retina y colaborar en la alteración de la barrera hematorretiniana (21).
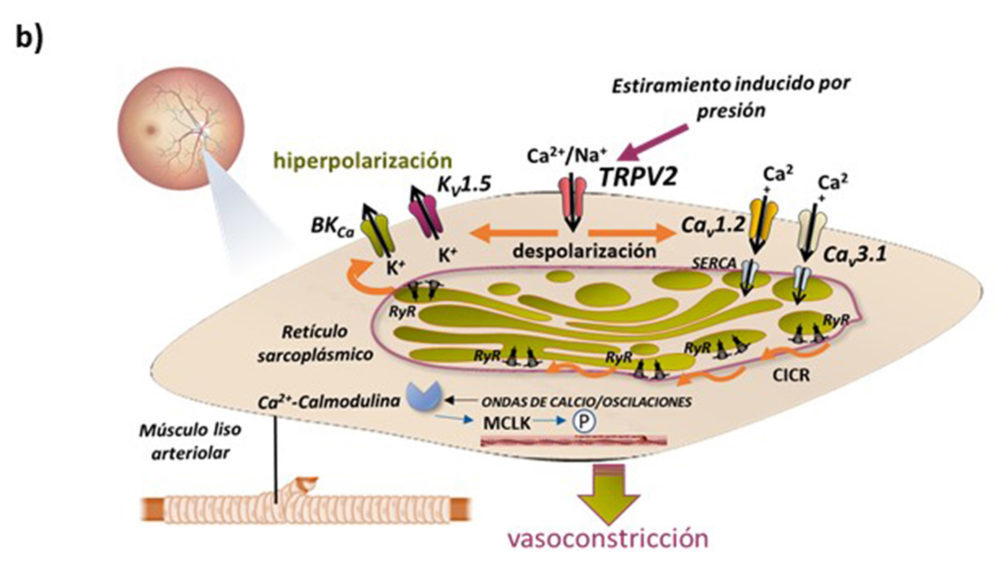
El flujo sanguíneo de la retina no sólo se modula gracias a estos y otros mediadores locales y humorales (22,23), también lo hace a través de mecanismos de autorregulación, como el miogénico, cuyo objetivo es ajustar el diámetro de las arteriolas para mantener constante el flujo sanguíneo, aunque se produzcan cambios en la presión arterial, siempre dentro de unos márgenes fisiológicos.
Como podemos observar en el esquema de la Fig. 3b, el estiramiento del músculo liso de la pared vascular, provocado por el incremento de presión, activa al canal mecanosensible TRPV2, lo que permite la entrada de cationes y la despolarización de la célula, despolarización que abre los canales de calcio operados por voltaje, proporcionando la entrada de calcio para rellenar los depósitos del retículo sarcoplásmico. Los altos niveles de calcio en el retículo sarcoplásmico estimulan la liberación de discretas “chispas” de calcio a través de los receptores de rianodina, lo que se conoce como “liberación de calcio inducida por calcio” generando una onda de calcio que inicia la contracción celular, la vasoconstricción. Al mismo tiempo, se desarrolla un mecanismo de retroalimentación negativa para limitar la extensión del tono miogénico alcanzado, a través de la hiperpolarización por activación de canales de potasio Kv y BKCa (24) (Fig. 3b).
Figura 3. a) Ejemplos representativos del efecto in vitro de distintos moduladores endoteliales y locales/humorales en arterias de la retina de bóvidos. b) Autorregulación miogénica en arteriolas de la retina. Modificado de Barabas y col. (24).
Existe otro tipo de mecanismo autorregulador, el metabólico, que acopla el flujo sanguíneo a la demanda de O2. Cuando aumenta la demanda de O2, porque aumenta la actividad del tejido, por ejemplo, por la incidencia de luz parpadeante en la retina, se producen metabolitos vasodilatadores, como la adenosina. La adenosina procede de la hidrólisis del ATP e induce la vasodilatación al unirse a los receptores A1 y A2 actuando directamente sobre las células de músculo liso o a través de las células endoteliales por liberación de NO en condiciones de hipoxia (25, 26).
Similares mecanismos de autorregulación son llevados a cabo por la circulación cerebral. De hecho, tanto en el cerebro como en la retina, existen las llamadas “unidades neurovasculares” que están constituidas por neuronas, vasos sanguíneos y células gliales, que en la retina serían las células de Müller y en el cerebro los astrocitos. El funcionamiento coordinado de estas estructuras persigue acoplar el flujo sanguíneo a la actividad del tejido, fenómeno conocido como acoplamiento neurovascular, que complementa el control metabólico y describe la respuesta de la hiperemia funcional (27).
En cuanto a los mecanismos que producen el acoplamiento neurovascular en la retina, se ha demostrado, por ejemplo, que el ATP liberado por las neuronas activa la síntesis de derivados del ácido araquidónico en las células de Müller; estos metabolitos pueden ser vasodilatadores, como el ácido epoxieicosatrienoico (EET) y la PGE2 o vasoconstrictores como el 20-HETE (27).
Se han analizado los mecanismos activados por el glutamato como parte del acoplamiento neurovascular en el cerebro. El glutamato liberado por las neuronas actúa sobre los receptores NMDA de otras neuronas poniéndose en marcha dos vías, una consigue la liberación de NO y otra la de prostanoides vasodilatadores. Pero el glutamato puede activar también a sus receptores metabotrópicos en los astrocitos, consiguiendo liberar tanto moléculas vasodilatadoras como vasoconstrictoras (27).
4.2. Fisiopatología de la retinopatía diabética
Son escasos los estudios de reactividad in vitro de arterias aisladas de la retina en modelos animales diabéticos. Entre ellos, se encuentra una reciente investigación en arteriolas de la retina de cerdos diabéticos, en la que Hein y col. (28) han demostrado que, tras sólo dos semanas de hiperglucemia, se altera el componente endotelial de la vasodilatación inducida por histamina, concretamente el componente mediado por NO, mientras que el componente mediado por activación de la COX permanece intacto. El restablecimiento de la vasodilatación observado al inhibir la arginasa en los cerdos diabéticos indica claramente que es el NO la pieza clave de la disfunción endotelial retiniana.
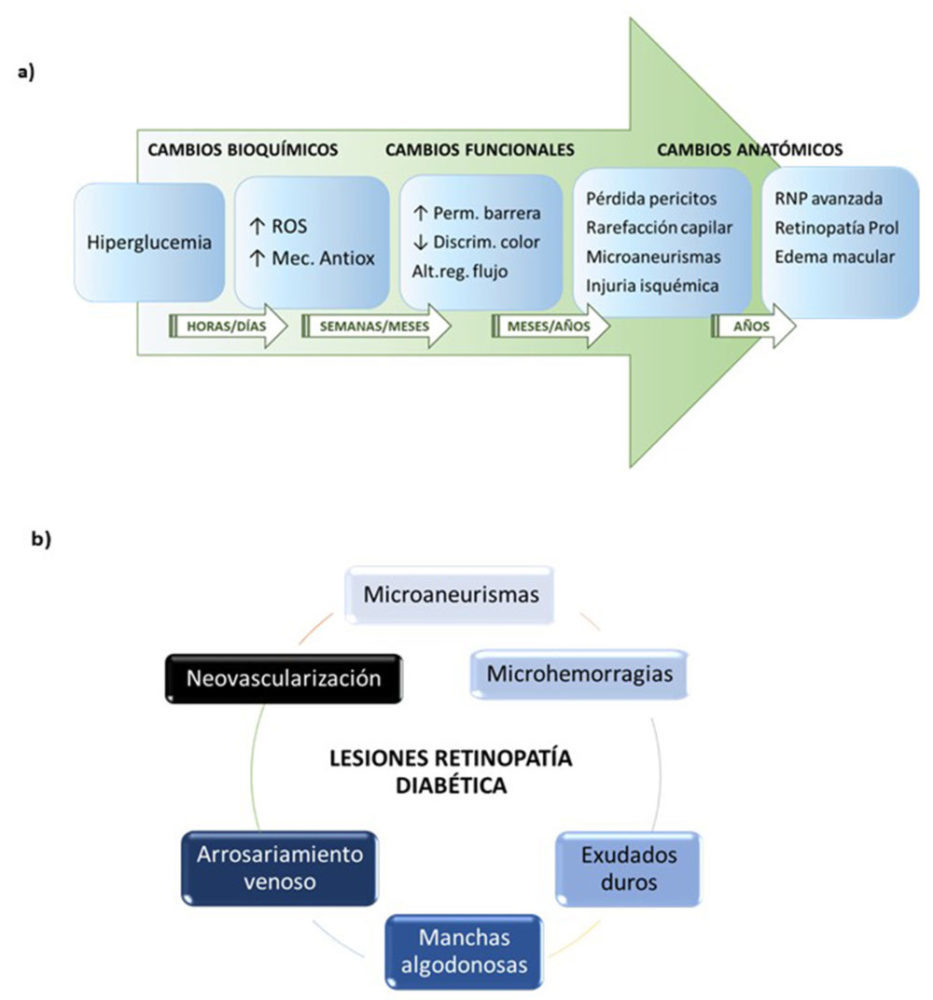
En la Figura 4a podemos observar de forma esquemática cómo la diabetes va afectando progresivamente a los vasos de la retina (29). La hiperglucemia es la fuerza conductora de todos los daños retinianos y como ya hemos mencionado, pueden ser efectos muy tempranos; en cuestión de horas o días se producen los primeros cambios bioquímicos caracterizados por un incremento en la generación de ROS y la activación de los mecanismos de defensa antioxidantes. Con el paso de semanas o meses, aparecen cambios funcionales como la alteración en la regulación del flujo sanguíneo, el incremento de la permeabilidad de la barrera hematorretiniana, e incluso los primeros defectos visuales, como la disminución en la discriminación del color. Estos cambios funcionales frecuentemente preceden meses o años a los primeros cambios anatómicos, entre los que se encuentran diferentes anomalías microvasculares intrarretinianas, que con el curso del tiempo conducen al desarrollo de las formas más avanzadas de retinopatía y edema macular que pueden comprometer la visión del individuo.
Mediante una simple exploración de fondo de ojo con un oftalmoscopio se pueden visualizar las anomalías microvasculares que caracterizan a la retinopatía diabética, de ahí el particular interés que presenta desde un punto de vista clínico, la circulación de la retina. Esas lesiones, de menor a mayor gravedad son: los microaneurismas, las microhemorragias tanto en llama como puntiformes, los exudados duros, las manchas algodonosas y el arrosariamiento venoso, indicando el desarrollo de retinopatía no proliferativa que progresivamente pasa de leve, a moderada y a grave; en el caso de que sea una retinopatía proliferativa, ésta se caracteriza por la aparición adicional de nuevos vasos sanguíneos, acompañados de hemorragia vítrea y edema (Figura 4b). Los casos más graves pueden evolucionar hacia una pérdida total de la visión.
Figura 4. a) Evolución temporal de las lesiones microvasculares diabéticas en la retina. Modificado de Horton y Barrett (29). b) Lesiones intravasculares retinianas que caracterizan a la retinopatía diabética.
5. LA CIRCULACIÓN DE LA RETINA COMO MARCADOR DE ENFERMEDAD CEREBROVASCULAR EN LA DIABETES
La similitud anatómica y funcional existente entre la circulación retiniana y la circulación cerebral ha conducido a considerar que las alteraciones vasculares retinianas pueden tener un valor pronóstico, es decir, servir como marcadores de enfermedad cerebrovascular (30).
La retina y el cerebro comparten un suministro de sangre común a través de la arteria carótida interna. La retina y el cerebro presentan una elevada actividad metabólica, de ahí la riqueza en mitocondrias y su elevado consumo de oxígeno. Si a ello le sumamos la escasa capacidad de almacenamiento de energía por parte de estos tejidos, se entiende que estas circulaciones necesariamente presenten robustos procesos de regulación del flujo sanguíneo, como los que hemos descrito anteriormente. Otro punto en común es que sus capilares forman parte de barreras fisiológicas, la barrera hematoencefálica y la barrera hematorretiniana, que presentan como función esencial regular la composición del medio extracelular del sistema nervioso central y de la retina, respectivamente. Entre estas barreras también existen puntos en común, como el que las células endoteliales de ambas circulaciones estén unidas por los mismos tipos de conexiones intercelulares o que el movimiento de moléculas a través de dichas barreras dependa de transportadores similares. Para mantener las propiedades de barrera son imprescindibles los pericitos de los capilares y las células gliales, astrocitos en cerebro y células de Müller en retina, que establecen relaciones con las neuronas vecinas y los vasos sanguíneos constituyendo las unidades neurovasculares que ya hemos mencionado (30).
En los diabéticos no sólo existe un mayor riesgo de desarrollar enfermedad cerebrovascular (ECV), sino que además su progresión es más severa, la recuperación es más lenta y presentan una mayor mortalidad (31).
La ECV puede ser isquémica o hemorrágica. La isquémica puede cursar como una isquemia cerebral transitoria, cuando se resuelven todos los signos y síntomas neurológicos en 24 h, o como un infarto cerebral, y dentro de esta posibilidad, la incidencia en los diabéticos de los infartos lacunares es mayor que la de los no lacunares, lo que sugiere la importancia de la afectación microvascular.
La ECV hemorrágica, es mucho menos frecuente, y cuando aparece está relacionada con el desarrollo de hipertensión arterial.
En los diabéticos está incrementado el riesgo de desarrollar demencia, no sólo de demencia vascular sino también de enfermedad de Alzheimer. Algunos autores se refieren a esta relación, entre diabetes y deterioro cognitivo, como “diabetes tipo 3”.
En un ensayo multicéntrico realizado entre diversos hospitales de Australia, Estados Unidos y Singapur se realizó un estudio prospectivo partiendo de un grupo de 1.600 diabéticos y haciendo un seguimiento promedio de 8 años (32). Basándose en la menor supervivencia de los diabéticos que presentaban retinopatía en el momento de sufrir un ictus, en este estudio se concluyó que la retinopatía diabética puede predecir los ictus isquémicos independientemente de otros factores de riesgo. Además, estos datos confirman lo que ya se había observado previamente en necropsias, el accidente cerebrovascular en los diabéticos está relacionado más frecuentemente con la enfermedad microvascular cerebral.
Uno de los puntos en común entre la disfunción endotelial de la microcirculación cerebral y la de la retiniana es sin duda, el estrés oxidativo.
El grupo de Frisbee, en la arteria cerebral media de ratas diabéticas, observó una disfunción endotelial a partir de la vasodilatación alterada de la acetilcolina. Estos investigadores indicaron que existía una reducida biodisponibilidad de NO, que podría reflejar un secuestro del NO llevado a cabo por las especies reactivas de oxígeno. Dicha posibilidad quedó confirmada con el efecto del antioxidante tempol, que mejoró la vasodilatación de la arteria cerebral de las ratas diabéticas. Este resultado, unido al efecto de la indometacina, conduce a pensar que la disfunción endotelial cerebral en la diabetes es el resultado de la generación de un estado prooxidante y proinflamatorio, como se había observado en la circulación retiniana (33). Por lo tanto, no es de extrañar que las modificaciones microvasculares de la retina puedan reflejar la patología microvascular cerebral. En este sentido, Bettermann y col. (34), al someter a los individuos objeto de estudio, a una maniobra de hiperventilación para comprobar su capacidad de autorregulación cerebral, observaron que los cambios inducidos en el diámetro de la arteria cerebral media fueron significativamente menores en los diabéticos que en los individuos sanos. Incluso los individuos con prediabetes ya tendían a mostrar una peor reactividad vascular que los sanos pero mejor autorregulación que los diabéticos. Por otro lado, la reactividad vascular retiniana, tanto venosa como arterial, tras realizar en los mismos individuos una estimulación con luz parpadeante, fue menor en los individuos prediabéticos y diabéticos. Los autores, basándose en el paralelismo observado en el grado de afectación vascular retininana y cerebral en los mismos individuos, proponen la utilización de esta simple técnica como exploración de rutina para desvelar tempranamente las complicaciones microvasculares diabéticas.
Recientemente Wang y col. (35), gracias una técnica que ha revolucionado la oftalmología, la angiografía por tomografía de coherencia óptica, han evaluado la densidad vascular retiniana en pacientes con enfermedad cerebral microvascular y así han relacionado la perfusión de la retina con las imágenes cerebrales de resonancia magnética y la función cognitiva.
El estudio reveló una hipoperfusión retiniana en pacientes con ECV por afectación del plexo capilar superficial y de los capilares radiales peripapilares, que estaba relacionada con zonas de una hiperintensidad severa de la sustancia blanca en las imágenes de resonancia magnética. Hiperintensidades que se deben a factores de riesgo cardiovascular. Además, la disminución de la densidad del plexo capilar retiniano superficial estaba estrechamente relacionada con el deterioro de la función cognitiva.
Se han ido acumulando evidencias progresivamente a favor de que las enfermedades cerebrales pueden reflejarse en alteraciones de la retina, sobre todo después del desarrollo de nuevas tecnologías de imagen en oftalmología. Así, las hemorragias cerebrales parecen estar asociadas con las hemorragias retinianas (36); las tortuosidades y la pérdida de ramificaciones vasculares retinianas se asocian con el ictus isquémico (37), mientras que el ensanchamiento de las vénulas y el estrechamiento de las arteriolas de la retina lo hacen con el ictus lacunar (38). El adelgazamiento de las capas de las fibras nerviosas de la retina se ha relacionado con el infarto de la arteria cerebral media y con la oclusión de la carótida interna (39). Además, en un estudio reciente, se han relacionado los diámetros microvasculares retinianos con el incremento de los espacios perivasculares cerebrales, lo que constituye un marcador de daño microvascular cerebral (40).
6. CONCLUSIONES
Las opciones terapéuticas de las ECV son limitadas, por lo que se necesitan estrategias preventivas efectivas y métodos para el diagnóstico precoz. En la diabetes se ha observado que se producen cambios microvasculares retinianos que pueden reflejar procesos similares en la microcirculación cerebral. Se espera que en un futuro cercano el uso de métodos completamente automatizados de detección de signos de retinopatía y de medición, facilite la evaluación eficiente de los cambios en la retina y la enfermedad vascular retiniana, pudiéndose reducir la morbilidad y la mortalidad vascular cerebral. Por todo lo expuesto, parece determinante seguir investigando las alteraciones retinianas para comprender la fisiopatología subyacente no sólo de las retinopatías sino también de las ECV.
7. AGRADECIMIENTOS
Quiero expresar mi más sincero agradecimiento a los miembros de la Real Academia Nacional de Farmacia, en especial a la Sección cuarta, por haber apoyado mi candidatura para formar parte de esta corporación, y a la Junta de Gobierno, por haberlo ratificado. Es un gran honor para mí entrar a formar parte de ella junto a tantos académicos a los que admiro y respeto. Quiero además dar las gracias al excelentísimo señor don Albino García Sacristán por sus generosas y cariñosas palabras de presentación. Él ha sido el mentor de mi trayectoria académica. Bajo su dirección, realicé mi tesis doctoral, que versó sobre la fisiología del músculo liso, tema que ha constituido la base de mi actividad investigadora. Muchas gracias por haberme iniciado en el mundo tan apasionante de la Fisiología.
A los profesores Dolores Prieto, Medardo Hernández, Luis Rivera y Paz Recio, que comenzamos juntos en la Facultad de Veterinaria, compañeros de aventuras y desventuras académicas desde hace ya más de 35 años, muchas gracias por vuestro apoyo y colaboración. A los profesores de la antigua Sección Departamental de Fisiología, Emilia Muñoz, Elvira López-Oliva y Ángel Agis por todos los años compartidos de intensa y extensa docencia, y a la profesora Rafaela Raposo, gracias por tu amistad durante todo este tiempo.
A todos mis compañeros de la actual Sección Departamental, los profesores Belén Climent, Ana Sánchez, Cristina Contreras, Vítor Leite, Mercedes Muñoz, Jorge Navarro y Pilar Montenegro. Cristina, Ana y Vitor, gracias por vuestro cariño y por estar tan pendiente, sobre todo cuando más falta hacía. No quiero olvidarme de la ayuda técnica y administrativa proporcionada por don Manuel Perales, don Francisco Puente, doña Macarena Martín y doña Carmen Bragado.
Tengo que recordar igualmente a las Dras. Susana Novella y Rosa M. Pagán, que realizaron sus tesis doctorales en la Sección bajo mi dirección y que se han convertido en brillantes profesoras de universidad, por lo que me siento muy orgullosa.
Me gustaría hacer una mención muy especial a la memoria de la profesora Ana Cristina Martínez, que ya no está entre nosotros pero ha dejado en todos una huella imborrable, mi amiga del alma, excelente profesora universitaria y mejor persona.
Mi reconocimiento a los diferentes colaboradores que tanto han aportado a nuestra labor de investigación, destacando en orden cronológico, al Dr. Luis Orensanz, Jefe del Departamento de Investigación del Hospital Ramón y Cajal de Madrid, donde realicé mi primera estancia de investigación y donde pude aprender cómo se debía trabajar en un laboratorio de investigación de referencia. Al Prof. Niels Nyborg, de la Universidad de Aarhus en Dinamarca, porque la estancia en su laboratorio marcó un antes y un después en mi actividad investigadora. Al Dr. González Santos y al Dr. Vallejo del Servicio de Cirugía Cardiovascular del Hospital Gregorio Marañón de Madrid, por las valiosísimas muestras de segmentos vasculares humanos que nos permitieron realizar las primeras investigaciones traslacionales. Así como al Dr. Correa que posteriormente nos proporcionó el mismo tipo de segmentos vasculares, pero de cerdos de la Unidad de Cirugía Experimental y Animalario del Hospital Ramón y Cajal de Madrid. A la profesora María Pilar Martínez del Departamento de Anatomía de la Facultad de Veterinaria de la Universidad Complutense de Madrid, que con sus técnicas inmunohistoquímicas enriquecen enormemente nuestras investigaciones. Y la reciente colaboración con la profesora Marisol Fernández del Departamento de Farmacología de mi Facultad para estudiar la influencia de la dieta en la disfunción vascular.
En lo personal, mi gratitud infinita a mi familia, incluida la política, especialmente a los que ya no están, empezando por mis padres, que han sido un ejemplo de cariño, trabajo y superación. A mi cuñado Paulino, que creo que tanto hubiera disfrutado hoy y que siempre me brindó su ayuda en todo lo que estuvo en su mano. A la memoria de mi sobrino Paulino, recientemente fallecido, del que no recibí desde que era pequeño, más que muestras de cariño y respeto. Gracias Tito por el honor y el inmenso privilegio de haber sido tu tía, cuánto te vamos a extrañar. A mis hermanos, cuñados, sobrinos y ya sobrino-nietos, porque siempre estáis ahí, en las duras y en las maduras. A mis amigas, Fátima y Estíbaliz, que os siento siempre cerca aunque estéis lejos, y que tanto me habéis apoyado y arropado. A los compañeros y amigos de la Facultad de Farmacia, por la cariñosa acogida recibida cuando llegué en 1990 y lo que tiene más valor todavía, de los que sigo recibiendo el mismo cariño. Así como el que me demuestran todos los días en los ratos de la comida mis compañeras y amigas galénicas. Y por último, aunque no por ello menos importante, al contrario, a mi marido Felipe, por estar a mi lado y acompañarme en esta nueva andadura.
8. REFERENCIAS
1. World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complications: report of a WHO consultation. Part 1, Diagnosis and classification of diabetes mellitus. Disponible en: https://apps.who.int/iris/handle/10665/66040.
2. Castro del Pozo, S. de; Pérez Arellano JL. Manual de Patología General, 8ª.; Elsevier, 2019.
3. Félétou M, Vanhoutte PM. EDHF: an update. Clin Sci (Lond). 2009;117(4):139-55.
4. Shi Y, Vanhoutte PM. Macro- and microvascular endothelial dysfunction in diabetes. J Diabetes. 2017;9(5):434-449.
5. Villalba N, Martínez P, Briones AM, Sánchez A, Salaíces M, García-Sacristán A, Hernández M, Benedito S, Prieto D. Differential structural and functional changes in penile and coronary arteries from obese Zucker rats. Am J Physiol Heart Circ Physiol. 2009;297(2):H696-707.
6. Contreras C, Sánchez A, Martínez P, Raposo R, Climent B, García-Sacristán A, Benedito S, Prieto D. Insulin resistance in penile arteries from a rat model of metabolic syndrome. Br J Pharmacol. 2010;161(2):350-64.
7. Sánchez A, Contreras C, Martínez P, Villalba N, Benedito S, García-Sacristán A, Salaíces M, Hernández M, Prieto D. Enhanced cyclooxygenase 2-mediated vasorelaxation in coronary arteries from insulin-resistant obese Zucker rats. Atherosclerosis. 2010;213(2):392-9.
8. Sánchez A, Contreras C, Martínez MP, Climent B, Benedito S, García-Sacristán A, Hernández M, Prieto D. Role of neural NO synthase (nNOS) uncoupling in the dysfunctional nitrergic vasorelaxation of penile arteries from insulin-resistant obese Zucker rats. PLoS One. 2012;7(4):e36027.
9. Contreras C, Sánchez A, Martínez P, Climent B, Benedito S, García-Sacristán A, Hernández M, Prieto D. Impaired endothelin calcium signaling coupled to endothelin type B receptors in penile arteries from insulin-resistant obese Zucker rats. J Sex Med. 2013;10(9):2141-53.
10. Sánchez A, Martínez P, Muñoz M, Benedito S, García-Sacristán A, Hernández M, Prieto D. Endothelin-1 contributes to endothelial dysfunction and enhanced vasoconstriction through augmented superoxide production in penile arteries from insulin-resistant obese rats: role of ET(A) and ET(B) receptors. Br J Pharmacol. 2014;171(24):5682-95.
11. Muñoz M, Sánchez A, Pilar Martínez M, Benedito S, López-Oliva ME, García-Sacristán A, Hernández M, Prieto D. COX-2 is involved in vascular oxidative stress and endothelial dysfunction of renal interlobar arteries from obese Zucker rats. Free Radic Biol Med. 2015;84:77-90.
12. Muñoz M, López-Oliva ME, Rodríguez C, Martínez MP, Sáenz-Medina J, Sánchez A, Climent B, Benedito S, García-Sacristán A, Rivera L, Hernández M, Prieto D. Differential contribution of Nox1, Nox2 and Nox4 to kidney vascular oxidative stress and endothelial dysfunction in obesity. Redox Biol. 2020;28:101330.
13. Muñoz M, López-Oliva E, Pinilla E, Rodríguez C, Martínez MP, Contreras C, Gómez A, Benedito S, Sáenz-Medina J, Rivera L, Prieto D. Differential contribution of renal cytochrome P450 enzymes to kidney endothelial dysfunction and vascular oxidative stress in obesity. Biochem Pharmacol. 2022;195:114850.
14. Martínez AC, Hernández M, Novella S, Martínez MP, Pagán RM, Hermenegildo C, García-Sacristán A, Prieto D, Benedito S. Diminished neurogenic femoral artery vasoconstrictor response in a Zucker obese rat model: differential regulation of NOS and COX derivatives. PLoS One. 2014 Sep 12;9(9):e106372.
15. Fundación para la Diabetes. Infografía. Noviembre 2014.
16. Prieto D, Benedito S, Nyborg NC. Heterogeneous involvement of endothelium in calcitonin gene-related peptide-induced relaxation in coronary arteries from rat. Br J Pharmacol. 1991;103(3):1764-8.
17. Prieto D, Benedito S, Simonsen U, Nyborg NC. Regional heterogeneity in the contractile and potentiating effects of neuropeptide Y in rat isolated coronary arteries: modulatory action of the endothelium. Br J Pharmacol. 1991;102(3):754-8.
18. Benedito S, Prieto D, Nyborg NC. Influence of the endothelium on histamine-induced relaxation of rat middle cerebral arteries in vitro. J Cardiovasc Pharmacol. 1991;17(1):90-5.
19. Benedito S, Prieto D, Nielsen PJ, Nyborg NC. Role of the endothelium in acetylcholine-induced relaxation and spontaneous tone of bovine isolated retinal small arteries. Exp Eye Res. 1991;52(5):575-9.
20. Nyborg NC, Prieto D, Benedito S, Nielsen PJ. Endothelin-1-induced contraction of bovine retinal small arteries is reversible and abolished by nitrendipine. Invest Ophthalmol Vis Sci. 1991;32(1):27-31.
21. Benedito S, Prieto D, Nielsen PJ, Nyborg NC. Histamine induces endothelium-dependent relaxation of bovine retinal arteries. Invest Ophthalmol Vis Sci. 1991;32(1):32-8.
22. Nyborg NC, Nielsen PJ, Prieto D, Benedito S. Angiotensin II does not contract bovine retinal resistance arteries in vitro. Exp Eye Res. 1990;50(5):469-74.
23. Prieto D, Benedito S, Nielsen PJ, Nyborg NC. Calcitonin gene-related peptide is a potent vasodilator of bovine retinal arteries in vitro. Exp Eye Res. 1991;53(3):399-405.
24. Barabas P, Augustine J, Fernández JA, McGeown JG, McGahon MK, Curtis TM. Ion channels and myogenic activity in retinal arterioles. Curr Top Membr. 2020;85:187-226.
25. Holmgaard K, Aalkjaer C, Lambert JD, Bek T. ATP-induced relaxation of porcine retinal arterioles depends on the perivascular retinal tissue and acts via an adenosine receptor. Curr Eye Res. 2007;32(4):353-9.
26. Petersen L, Bek T. Preserved Pressure Autoregulation but Disturbed Cyclo-Oxygenase and Nitric Oxide Effects on Retinal Arterioles during Acute Hypoxia in Diabetic Patients without Retinopathy. Ophthalmologica. 2016;235(2):114-20.
27. Nippert AR, Newman EA. Regulation of blood flow in diabetic retinopathy. Vis Neurosci. 2020;37:E004.
28. Hein TW, Omae T, Xu W, Yoshida A, Kuo L. Role of Arginase in Selective Impairment of Endothelium-Dependent Nitric Oxide Synthase-Mediated Dilation of Retinal Arterioles during Early Diabetes. Invest Ophthalmol Vis Sci. 2020;61(5):36.
29. Horton WB, Barrett EJ. Microvascular Dysfunction in Diabetes Mellitus and Cardiometabolic Disease. Endocr Rev. 2021;42(1):29-55.
30. Nguyen CTO, Hui F, Charng J, Velaedan S, van Koeverden AK, Lim JKH, He Z, Wong VHY, Vingrys AJ, Bui BV, Ivarsson M. Retinal biomarkers provide “insight” into cortical pharmacology and disease. Pharmacol Ther. 2017;175:151-177.
31. Zhou H, Zhang X, Lu J. Progress on diabetic cerebrovascular diseases. Bosn J Basic Med Sci. 2014;14(4):185-90.
32. Cheung N, Rogers S, Couper DJ, Klein R, Sharrett AR, Wong TY. Is diabetic retinopathy an independent risk factor for ischemic stroke? Stroke. 2007;38(2):398-401.
33. Halvorson BD, Whitehead SN, McGuire JJ, Wiseman RW, Frisbee JC. Endothelium-dependent impairments to cerebral vascular reactivity with type 2 diabetes mellitus in the Goto-Kakizaki rat. Am J Physiol Regul Integr Comp Physiol. 2019;317(1):R149-R159.
34. Bettermann K, Slocomb J, Shivkumar V, Quillen D, Gardner TW, Lott ME. Impaired Retinal Vasoreactivity: An Early Marker of Stroke Risk in Diabetes. J Neuroimaging. 2017;27(1):78-84.
35. Wang X, Wei Q, Wu X, Cao S, Chen C, Zhang J, Yan Y, Geng Z, Tian Y, Wang K. The vessel density of the superficial retinal capillary plexus as a new biomarker in cerebral small vessel disease: an optical coherence tomography angiography study. Neurol Sci. 2021;42(9):3615-3624.
36. Baker ML, Hand PJ, Liew G, Wong TY, Rochtchina E, Mitchell P, Lindley RI, Hankey GJ, Wang JJ; Multi-Centre Retinal Stroke Study Group. Retinal microvascular signs may provide clues to the underlying vasculopathy in patients with deep intracerebral hemorrhage. Stroke. 2010;41(4):618-23.
37. Wong TY, Klein R, Sharrett AR, Couper DJ, Klein BE, Liao DP, Hubbard LD, Mosley TH; ARIC Investigators. Atheroslerosis Risk in Communities Study. Cerebral white matter lesions, retinopathy, and incident clinical stroke. JAMA. 2002;288(1):67-74.
38. De Silva TM, Miller AA. Cerebral Small Vessel Disease: Targeting Oxidative Stress as a Novel Therapeutic Strategy? Front Pharmacol. 2016;7:61.
39. Gunes A, Demirci S, Umul A. Vision Loss and RNFL Thinning after Internal Carotid Arter Occlusion and Middle Cerebral Artery Infarction. Acta Inform Med. 2014;22(6):413-4.
40. Mutlu U, Adams HH, Hofman A, Lugt Av, Klaver CC, Vernooij MW, Ikram MK, Ikram MA. Retinal Microvascular Calibers Are Associated With Enlarged Perivascular Spaces in the Brain. Stroke.2016;47(5):1374-6.