1. INTRODUCCIÓN
Nuestro sistema esquelético está compuesto de elementos que son los huesos, cuya estructura nos permite permanecer erguidos. Eso ha permitido liberar nuestras manos, un evento al parecer decisivo para desarrollar nuestra creatividad. En este sentido, nuestra especie pensante de Homo Sapiens le debe mucho a nuestro aparato locomotor. Los huesos reflejan nuestra edad cronológica. De hecho, al igual que nuestro tránsito vital se caracteriza por un ciclo de crecimiento, madurez y declive (envejecimiento), nuestra masa ósea evoluciona hacia un pico alcanzado en la tercera década de la vida, seguido de un paulatino descenso posterior. El pico de masa ósea está determinado por factores genéticos no completamente definidos en la actualidad. Sin embargo, en la etapa del crecimiento, diversos factores externos, como la dieta (aportes de Ca, vitamina D y proteínas) y el ejercicio contribuyen a conseguir un buen pico de masa ósea. Esto es importante porque el aumento de solo 10% en dicho pico de masa ósea permite retrasar significativamente la aparición de osteoporosis (1).
El envejecimiento progresivo de la población, especialmente en el mundo desarrollado, conlleva una elevada prevalencia de patologías del aparato locomotor. Entre ellas, la patología ósea más prevalente es la osteoporosis, definida por la pérdida de masa y microarquitectura óseas, con un asociado incremento del riesgo de fracturas. Mientras la masa ósea es fácilmente cuantificable, la calidad ósea se sabe que está determinada por las propiedades materiales del hueso, su microarquitectura y el grado de remodelado (según se describe más adelante). La llamada osteoporosis primaria ocurre asociada a la pérdida estrogénica en la mujer. Según la Organización Mundial de la Salud (OMS) se considera osteoporosis cuando los valores de densidad mineral ósea son inferiores a -2,5 desviaciones estándar (T-score inferior a -2,5) en relación a la media en adultos jóvenes, y osteopenia cuando esos valores oscilan entre -1 y -2,5 DE (T-score entre -1 y -2,5). La osteoporosis involutiva con la edad afecta a ambos sexos. Para su diagnóstico se utiliza como alternativa el Z-score, que expresa la masa ósea en relación a su valor promedio de la misma edad y sexo (2).
Diversos factores endógenos, como la susceptibilidad genética (los genes más estudiados incluyen los del receptor de vitamina D, los de los receptores estrogénicos y el del colágeno tipo 1), el pico de masa ósea y el déficit estrogénico, pero también factores exógenos (dieta, sedentarismo), contribuyen al deterioro óseo durante el envejecimiento. El uso prolongado de glucocorticoides y la diabetes mellitus, asociados a procesos proinflamatorios y a estrés oxidativo, son situaciones que agravan la osteoporosis involutiva (y también la regeneración ósea post fractura). Estos factores contribuyen a la fragilidad de la población senil, lo que constituye un reto socio-económico de primera magnitud para nuestros sistemas sanitarios. Se estima que a los 50 años, un 30% de mujeres y un 20% de varones sufrirán una fractura a lo largo de su vida, y que el riesgo de nuevas fracturas se incrementa exponencialmente después de cada fractura. Más de 200 millones de personas en el mundo sufren de osteoporosis diagnosticada con criterios clínicos; de ellos, alrededor de 30 millones solo en la UE. En 2010 hubo cerca de 4 millones de fracturas relacionadas con la osteoporosis, con un coste de 37 mil millones de €, en la UE (3,4). Estas consideraciones han hecho que la OMS declarara la primera década del siglo XXI como la del Hueso y el Cartílago.
2. ESTRUCTURA ÓSEA Y REMODELADO ÓSEO
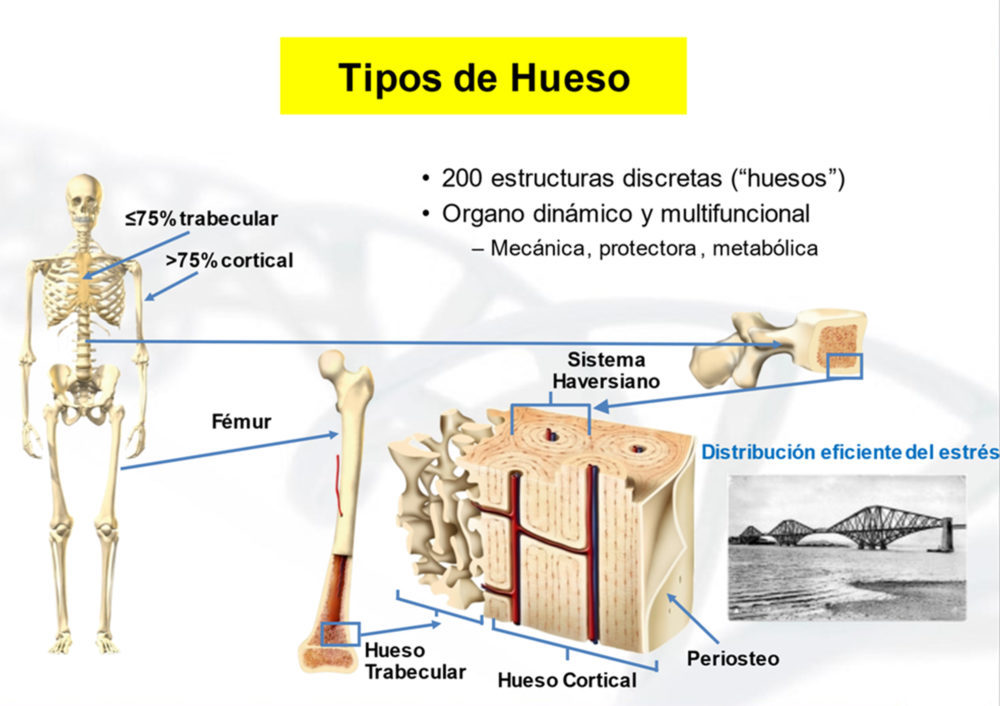
El hueso es un tipo de tejido conectivo constituido por una fase orgánica, formada principalmente por colágeno tipo 1, y una fase inorgánica de nanocristales de hidroxicarbonato apatita, que representan alrededor del 20% y 70%, respectivamente, de la masa ósea. Existen dos tipos fundamentales de hueso: el trabecular, tipificado en las vértebras (>75% es hueso trabecular) y en las epífisis de los huesos largos, formado por una red de fibrillas mineralizadas de aspecto esponjoso (de ahí la denominación con que también se conoce a este tipo de hueso); y el cortical o compacto, predominante en las diáfisis de los huesos largos, configurado en lamelas mineralizadas concéntricas alrededor de un orificio por donde penetran vasos y nervios (sistema Haversiano) (Fig. 1). Esta distribución de ambos tipos de hueso es óptima para distribuir las cargas mecánicas. Así, en un hueso largo como el fémur el estrés mecánico en la epífisis es canalizado hacia la zona cortical de las diáfisis; mientras que en las vertebras las fuerzas de compresión axial son distribuídas a través de la red trabecular.
Figura 1
Como se comentó anteriormente, la pérdida de masa ósea ocurre a partir de la tercera década de la vida y afecta a ambos tipos de hueso, trabecular y cortical. En la deficiencia estrogénica tras la menopausia, tiene lugar una pérdida ósea acelerada, sobre todo en el hueso trabecular que es el metabólicamente más activo. En los varones, esa pérdida es más lineal pero continua y similar en ambos tipos de hueso (el déficit de testosterona reproduce la curva acelerada de pérdida de masa ósea observada en la mujer postmenopáusica) (5,6).
La geometría anatómica y las propiedades biomecánicas del hueso son el resultado de su adaptación a los estímulos mecánicos que recibe, lo que se conoce como ley de Wolff, inicialmente propuesta por este investigador en 1892 (7). El esqueleto se remodela constantemente (renovamos nuestro esqueleto en su totalidad cada 10 años) de acuerdo a las necesidades impuestas por el estrés mecánico, pero también metabólicas (el hueso es reservorio de Ca, P y de otros iones). De hecho, el remodelado óseo es uno de los principales mecanismos que mantienen la homeostasis mineral.
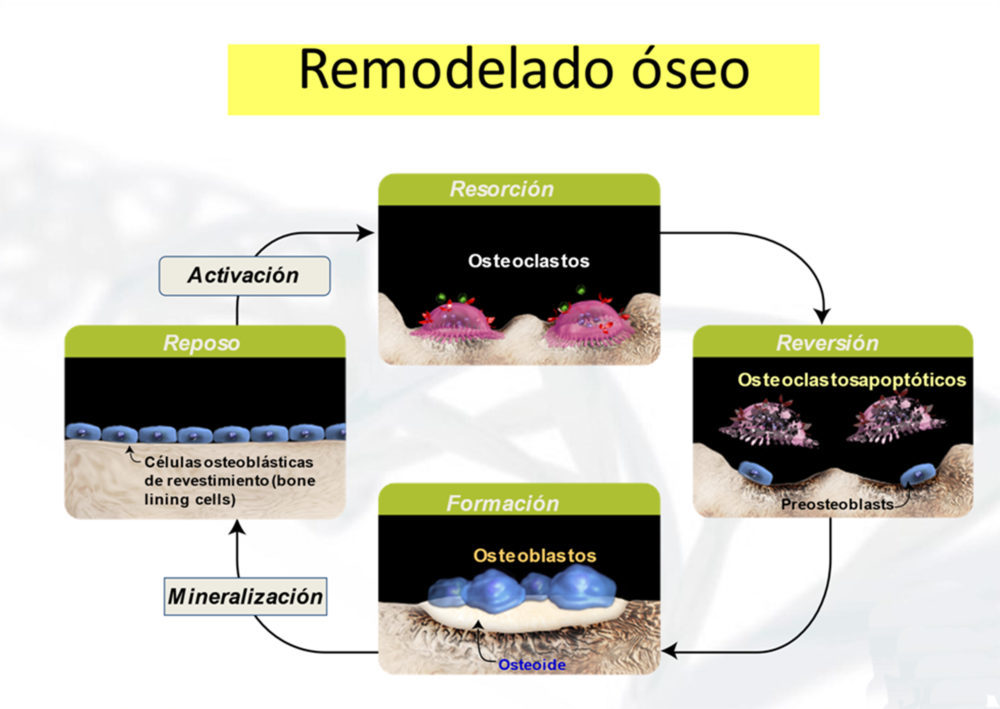
El remodelado óseo tiene lugar a lo largo de la superficie ósea, en las conocidas como Unidades de Remodelado Óseo (BRU, en terminología inglesa). Este es un proceso complejo en el que intervienen varios tipos celulares, que incluyen los osteoblastos (células osteoformadoras de origen mesenquimal), los osteoclastos (células derivadas de precursores de monocitos/macrófagos responsables de la resorción ósea) y los osteocitos (osteoblastos completamente diferenciados embutidos en la matriz ósea mineralizada). Estos últimos tienen una estructura dendrítica con prolongaciones citoplasmáticas y se comunican con el resto de poblaciónes celulares en la BRU a través de canalículos que perforan la matriz mineralizada. En la actualidad los osteocitos se consideran los verdaderos orquestadores del remodelado óseo (8).
El remodelado óseo transcurre en diferentes fases (Fig. 2). La fase de activación comienza por la atracción de células osteoclásticas y sus precursores hacia la BRU promovida por los osteoblastos y sobre todo los osteocitos. Los osteoclastos comienzan la resorción de la matriz mineralizada, un proceso breve que finaliza por la acción del calcio y ciertos factores de crecimiento liberados de la matriz durante la resorción que provocan la apoptosis de los osteoclastos. A continuación, comienza el reclutamiento de células osteoformadoras promovida por factores quimiotácticos, que elaboran una matriz llamada osteoide (básicamente, colágeno tipo 1). La fase siguiente es la mineralización de dicho osteoide y el sellado de la cavidad de resorción inicial generada por los osteoclastos mediante su recubrimiento con una capa de osteoblastos diferenciados como “células alineadas” (lining cells en inglés). Esto constituye la fase quiescente final. Para iniciar un nuevo ciclo de remodelado es necesaria la retracción de las “células alineadas” que sellan la superficie ósea para dar paso a los osteoclastos. Este proceso normalmente dura unos 6 meses en humanos. Al final del ciclo, la mayoría (> 60%) de los osteoblastos mueren por apoptosis y solo una minoría (alrededor de 20%) quedan diferenciados como células alineadas u osteocitos en la superficie mineralizada. La homeostasis ósea depende del balance entre la resorción y la formación ósea, lo que lleva consigo un verdadero ajuste fino del proceso de remodelado óseo.
Figura 2
El remodelado óseo está regulado por estímulos, mecánicos (la actividad física es esencial para mantener un buen balance óseo) y por una variedad de factores sistémicos y locales (citoquinas y factores de crecimiento). Entre estos factores, el ligando del receptor activador del factor NFkappaB (RANKL) se ha identificado como el principal activador de los osteoclastos y sus precursors así como de su supervivencia y función (9). Esta citoquina es una proteína transmembrana pero también secretada por osteoblastos y osteocitos que interacciona con su receptor RANK en las células de estirpe osteoclástica (presente también en condrocitos y células de epitelio mamario) induciendo la formación y activación de osteoclastos maduros multinucleados. Pero además, las células osteoblásticas producen y secretan un receptor señuelo para el RANKL, conocido como osteoprotegerina (OPG), que bloquea al RANKL impidiendo su interacción con RANK, y así la activación osteoclástica y la resorción ósea. De este modo, la coordinación de la expresión del RANKL y la OPG permite la modulación del remodelado óseo en un sentido de favorecer la pérdida de masa ósea o previniendo la osteopenia (deficit de masa ósea) controlando la activación de RANK en los osteoclastos. La alteración de la relación RANKL/OPG -con aumento del RANKL y disminución de OPG promovidos por factores osteoclastogénicos- es crítica en la patogénesis de las enfermedades óseas que cursan con un incremento de la resorción ósea (10).
3. TERAPIAS ANTIRESORTIVAS EN LA OSTEOPOROSIS
La osteoporosis es consecuencia de un remodelado óseo alterado con disminución del balance formación/resorción ósea. En la osteoporosis primaria por déficit estrogénico existe un predominio de BRU activas en la superficie ósea por un incremento de actividad osteoclástica con formación de lagunas de resorción que no llega a ser compensada por la actividad osteoformadora de los osteoblastos. Estas cavidades actúan como verdaderos acumuladores de estrés mecánico aumentando el riesgo de fractura.
La pérdida de masa ósea en situación de elevado remodelado por aumento de resorción ósea tradicionalmente se ha abordado con agentes antiresortivos, siendo los más comunes los bisfosfonatos. Estas sustancias son análogos del pirofosfato, un inhibidor endógeno de la mineralización ósea. Los bisfosfonatos son resistentes a la hidrólisis y tienen una gran afinidad por la hydroxyapatita estabilizándola, lo que les confiere una elevada vida media en el hueso. Los bisfosfonatos son internalizados por los osteoclastos, inhibiendo su supervivencia y función. El que estas sustancias se incorporen preferentemente a las localizaciones donde existe un remodelado óseo acelerado justifica su amplia utilización en esta situación clínica (11).
La modificación de la estructura química de los bisfosfonatos ha permitido favorecer su actividad antiresortiva frente a la de inhibición de la mineralización de la matriz ósea. La estructura de los bisfosfonatos contiene un carbono central flanqueado por grupos fosfato -que les confiere su elevada afinidad por la hidroxiapatita- y un radical hidroxilo (en posición R1), que contribuye a la especificidad por la matriz ósea mineralizada. La presencia de un grupo nitrogenado en el otro radical unido al C central (en posición R2) es el factor determinante para aumentar su potencia antiresortiva (entre 10-10.000 veces superior a la de un bisfosfonato no nitrogenado). Los bisfosfonatos no nitrogenados, como el etidronato y el clodronato, interaccionan con el ATP para interferir con la función osteoclástica; mientras los nitrogenados, como el alendronato, inhiben la farnesil pirofosfato sintetasa, una enzima esencial de la vía de síntesis del colesterol a partir del mevalonato, y así la formación de derivados isoprenilados de moléculas esenciales para la función osteoclástica (12).
A pesar de su uso tradicional y eficaz en la osteoporosis, los bisfosfonatos (especialmente en tratamientos prolongados) presentan ciertos efectos secundarios como la osteonecrosis mandibular, lo que ha determinado la búsqueda de abordajes alternativos en esta situación. En este sentido, hay que tener en cuenta que un desequilibrio entre RANKL/OPG ha demostrado ser un factor común en un amplio espectro de la fisiopatología ósea (desde el déficit estrogénico hasta la artritris reumatoide con activación de linfocitos T y las metástasis óseas). Así pues, se ha diseñado un anticuerpo monoclonal humanizado contra el RANKL (Denosumab, ProliaR, Amgen) que ha demostrado una potente actividad antiresortiva y se está usando en la actualidad en la osteoporosis para prevenir la pérdida de masa ósea y el riesgo de fracturas (vertebrales y no vertebrales) (13). La ventaja del denosumab frente a los clásicos antiresortivos como los bisfosfonatos es su mayor eficacia para aumentar la masa ósea (relacionado con el gran incremento de la mineralización secundaria) asociada a una reducción importante de los marcadores de resorción ósea. Sin embargo, se ha detectado un aumento de fracturas vertebrales en algunos pacientes tras la interrupción del tratamiento con este anticuerpo; lo que se especula podría deberse en parte a la rápida reactivación de las unidades de remodelado óseo tras la retirada del denosumab.
4. PÉPTIDOS ANABÓLICOS EN LA OSTEOPOROSIS INVOLUTIVA (ASOCIADA AL ENVEJECIMIENTO)
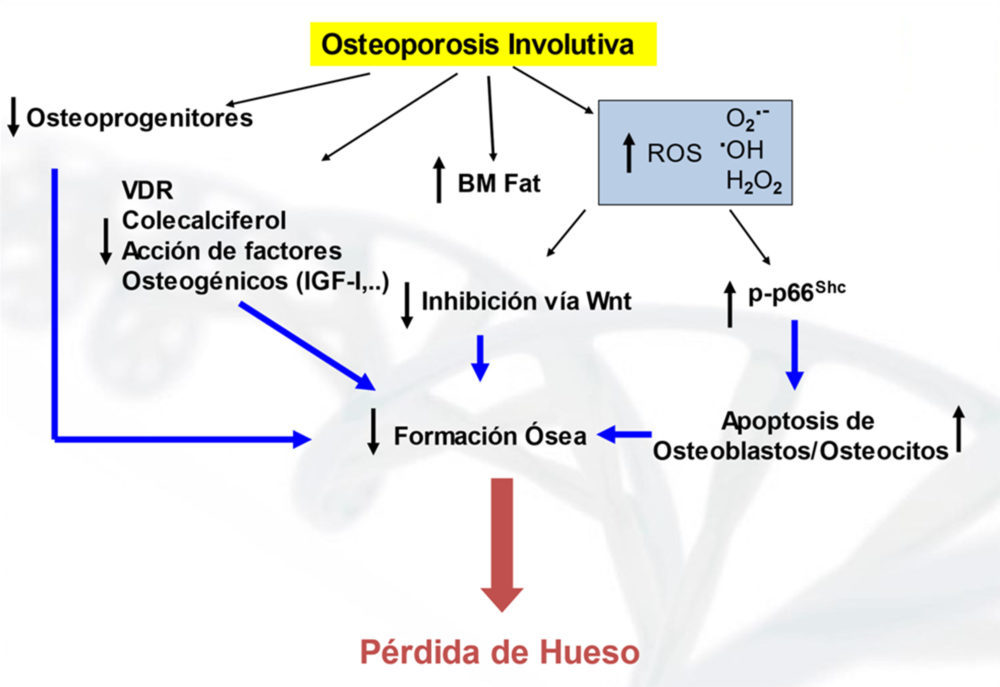
El envejecimiento se considera como una consecuencia del desequilibrio celular entre los agentes oxidantes producidos durante el metabolismo celular y los mecanismos de defensa antioxidante (a favor de los primeros). Este estrés oxidativo conlleva un exceso de producción de especies reactivas de oxígeno (ROS, en inglés), como el anión superóxido (O2.-), los radicales hidroxilo (.OH) y el peróxido de hidrógeno (H2O2) en la mitocondria, que no puede ser equilibrado por enzimas antioxidantes (como la superóxido dismutasa y la glutatión reductasa). Esto conduce a la oxidación de biomoléculas (ADN, proteínas y lípidos) y a la fosforilación de la proteína mitocondrial p66shc con pérdida de función y/o muerte celular (14). En la osteoporosis involutiva, el estrés oxidativo tiene consecuencias deletéreas para las células osteoformadoras y la formación ósea (15) (Fig. 3). En este sentido, en un trabajo realizado en colaboración con uno de los grupos pioneros en establecer cultivos primarios de osteoblastos humanos ex vivo, observamos que estas células perdían capacidad proliferativa con la edad de los donantes (16).
Figura 3
Con estos considerandos, el poder disponer de terapias anabólicas óseas con capacidad para neutralizar los efectos del estrés oxidativo asociados al envejecimiento óseo es de gran interés actual. La primera molécula que ha resultado eficaz en este aspecto es la hormona paratiroidea (PTH) que, a pesar de ser la hormona calciotropa por excelencia, cuando se administra de manera intermitente (p.e., en inyecciones diarias) activa el remodelado óseo con un efecto positivo neto sobre la formación ósea. Este efecto anabólico se debe a acciones complejas, que incluyen su capacidad anti-estrés oxidativo y su acción antiapoptótica sobre osteoblastos y osteocitos, y a su capacidad para prevenir la síntesis de la esclerostina por los osteocitos, un inhibidor de la vía Wnt/beta-catenina, importante en la modulación de la función osteoblástica y de la masa ósea (17,18). De hecho, el romosozumab, un anticuerpo monoclonal humanizado que bloquea a la esclerostina, está aprobado por la Food and Drug Administration (FDA) americana para el tratamiento de la osteoporosis en mujeres postmenopáusicas con elevado riesgo de fracturas (19). Estas acciones descritas para la PTH administrada de modo secuencial han sido la base para el diseño de la teriparatida (Forsteo, Lilly) basada en el fragmento 1-34 de la PTH, ampliamente utilizada en la actualidad para prevenir las fracturas osteoporóticas. Sin embargo, el tratamiento eficaz con teriparatida está limitado a 2 años, por el aumento concomitante de resorción ósea observado a partir de ese periodo temporal, y para evitar el riesgo de osteosarcoma observado en ciertas cepas de ratas (aunque a dosis muy superiores a las usadas en clínica) (20).
La proteína relacionada con la PTH (PTHrP) se identificó inicialmente como el agente causante de la hipercalcemia tumoral, pero posteriormente se detectó su presencia en una variedad de tejidos nomales, incluyendo el riñón y el hueso (en las células osteoblásticas), dos tejidos que son diana fundamental de la PTH. La homología estructural parcial de ambas moléculas, PTH y PTHrP, radica en su secuencia N-terminal, lo que determina su interacción con un receptor común, el llamado receptor de PTH tipo 1 (PTHR1), en las células diana (p.e., osteoblastos) (21). El descubrimiento de la PTHrP es un magnífico ejemplo de la investigación traslacional en biomedicina: la investigación clínica de un síndrome paraneoplásico se saldó con el descubrimiento de una nueva citoquina celular. Es más, como veremos a continuación, la PTHrP “ha vuelto a la clínica” de alguna manera, al contemplarse actualmente como un nuevo agente en el armamentarium farmacológico para aumentar la formación ósea.
Utilizando ratones con haploinsuficiencia de PTHrP, Miao y cols (22) observaron que los neonatos desarrollan una osteoporosis precoz manifestada en los huesos largos por un descenso de volumen óseo y alteración de la estructura trabecular, así como un aumento de apoptosis osteoblástica y un déficit de osteoprogenitores en la médula ósea. Por otro lado, estudios de nuestro grupo han demostrado una disminución de la PTHrP (a nivel de gen y de proteína) en osteoblastos ex vivo con la edad del donante, y en el fémur de ratones viejos (23,24).
Si consideramos la estructura de la PTHrP, su gen en humanos genera por procesamiento alternativo tres especies de ARNm, que dan lugar a tres isoformas proteicas con un extremo N-terminal común. Además, por procesamiento postraduccional, se producen varios fragmentos, de los cuales el N-terminal 1-36 posee homología estructural con la PTH; mientras que el fragmento C-terminal 107-139 tiene propiedades de interés en el tema que nos ocupa, según se describirá más adelante. Así pues, el grupo liderado por Andy F Stewart comparó la eficacia relativa de la PTHrP (1-36) con la PTH (1-34) en situación de déficit estrogénico. La inyección diaria de dosis bioequivalentes (teniendo en cuenta las diferencias farmacocinéticas de ambos péptidos) durante 3 meses a mujeres postmenopáusicas produjo un aumento similar de densidad mineral ósea en la columna lumbar; mientras que este efecto osteogénico en la cadera (un hueso predominantemente cortical) o en el cuello femoral solo se observó con la PTHrP (1-36) (25). Además, mientras la PTH (1-34) indujo aumentos tanto de formación como de resorción ósea, la PTHrP (1-36) solo afectó a la primera, como indica la determinación de telopéptidos N- y C-terminales del procolágeno tipo 1, marcadores de formación y resorción ósea, respectivamente. Más recientemente, se ha aprobado por parte de la FDA la abaloparatida (Tymlos, Radious Health) para el tratamiento de la osteoporosis postmenopáusica, un péptido 1-34 derivado de la PTHrP (1-36) con 10 sustituciones aminoacídicas en su extremo C-terminal. Los ensayos clínicos con la abaloparatida han demostrado su capacidad para incrementar la masa ósea sin apenas modificar los marcadores de resorción ósea y menor riesgo de hipercalcemia que el tratamiento con PTH (1-34) (26). Así, en un ensayo en fase 2 en mujeres posmenopáusicas con osteoporosis severa se observó la mayor eficacia de la abaloparatida frente a la teriparatida para aumentar la densidad mineral ósea en diferentes localizaciones esqueléticas. Además, el ensayo en fase 3 multicéntrico doble ciego y controlado con placebo Abaloparatide Comparator Trial in Vertebral Endpoints (ACTIVE) ha demostrado una mayor eficacia de la abaloparatida (80 microg/d) para reducir el riesgo de fracturas vertebrales y no vertebrales en esta situación, con un mayor incremento en la masa ósea frente a la teriparatida (20 microg/d) tras 18 meses de administración de cada péptido. Las diferencias de acción de ambos péptidos N-terminales de la PTH y PTHrP se atribuyen a su interacción con diferentes conformaciones del PTHR1 común a ambas proteínas. De tal manera que la interacción predominante con una conformación independiente (R0) de su unión a proteínas G da lugar a respuestas prolongadas, como ocurre con la PTH; mientras que la mayor selectividad de la PTHrP para unirse a una conformación del PTHR1 unida a proteínas G (RG) induce respuestas de corta duración. Esto favorecería su acción preferentemente anabólica (26,27).
Por otra parte, las acciones osteogénicas de la PTHrP no parecen estar restringidas a su estructura N-terminal. Así, un equipo de investigadores australianos y de Nueva Zelanda demostraron una potente y eficaz acción antiresortiva del fragmento 107-139 de la PTHrP (observada incluso a dosis <pM) tanto in vitro como in vivo en roedores (28). Además, este fragmento mostró su capacidad para estimular el crecimiento de osteoblastos aislados de calotas fetales de rata (29). Una observación interesante en estos estudios fue que ambas acciones de la PTHrP (107-139) fueron reproducidas por el pentapéptido de secuencia 107-111 (TRSAW), que denominaron osteostatina. Más recientemente, un grupo pionero en la manipulación del gen de la PTHrP en ratones en la Universidad McGill de Montréal, produjo ratones homozigotos que expresan la forma truncada 1-84 de la PTHrP por supresión de su cola C-terminal. Estos animales mostraron un envejecimiento prematuro asociado a senescencia generalizada, con una capacidad proliferativa disminuída y aumento de apoptosis celular en el tejido óseo conducente al desarrollo de osteoporosis por déficit de formación ósea (30). Estos resultados indican la relevancia de la región C-terminal de la PTHrP como un modulador importante del remodelado óseo.
Teniendo en cuenta estos hallazgos, nos propusimos evaluar en nuestro laboratorio la eficacia del fragmento C-terminal PTHrP (107–139) en modelos experimentales de osteoporosis. Encontramos en primer lugar que este fragmento, administrado por inyección subcutánea de manera intermitente en ratones ovariectomizados durante 4-8 semanas, aumentó la masa ósea y mejoró significativamente la estructura trabecular en la metáfisis femoral deteriorada por la ovariectomía; de modo similar o superior a la PTHrP (1-36) administrada de modo similar en estos animales (31). Además, estos efectos de ambos péptidos de la PTHrP se producían sin aumentos del componente resortivo del remodelado óseo (indicado por el análisis de marcadores de remodelado). Los efectos osteogénicos de esta pauta de administración de ambos fragmentos de la PTHrP fueron también puestos en evidencia en un modelo de diabetes tipo 1 por inyección de estreptozotozina en ratones que presentan una osteoporosis similar a la involutiva con bajo remodelado. En este modelo, el tratamiento con ambos péptidos de la PTHrP restableció en parte la capacidad de formar nódulos mineralizados a partir de los osteoprogenitores en la médula ósea de los ratones diabéticos (32, 33). Además, en un estudio más reciente demostramos la capacidad antioxidante de la PTHrP (107-139) -y de la osteostatina- en una línea celular osteoblástica bien caracterizada (MC3T3-E1) y en osteoblastos humanos en cultivo primario (34).
5. PÉPTIDOS ANABÓLICOS DERIVADOS DE LA PTHrP PARA ESTIMULAR LA REGENERACIÓN ÓSEA
Las acciones osteogénicas que confieren a la PTHrP sus regiones N- y C-terminal configuran el interés de explorar su potencial aplicación para aumentar la regeneración ósea. Un modelo experimental bien caracterizado en este sentido lo constituye la ablación medular en roedores (35). Utilizando este modelo en ratones osteoporóticos, por tratamiento con el glucocorticoide metilprednisolona o estreptozotozina para inducir diabetes, demostramos que la administración secuencial (cada 2 días) de PTHrP (1-36) o PTHrP (107-139) durante la fase de reparación ósea tras la ablación medular en la tibia incrementó la regeneración ósea de modo similar (32, 33, 36).
Coherente con estos hallazgos, nuestro grupo en colaboración con el grupo de la Prof. Vallet-Regí ha demostrado que la osteostatina confiere propiedades osteogénicas a distintos biomateriales cerámicos (37). Así, inicialmente observamos in vitro en células MC3T3-E1 en cultivo como su exposición a la biocerámica mesoporosa de sílice SBA-15 impregnada con osteostatina aumentaba la osteogenicidad de la biocerámica (38). Más adelante, utilizando un modelo de defecto cavitario (que no regenera por sí solo) en la epífisis femoral de conejos sanos u osteoporóticos, demostramos que el implante de SBA-15 con osteostatina indujo propiedades osteoconductoras y osteoinductoras, favoreciendo la infiltración de osteoprogenitores y la formación de nuevo hueso, a las 4-8 semanas del implante en los animales sanos (39) y más precozmente (a 2 semanas) en los osteoporóticos (40). Estos hallazgos fueron corroborados posteriormente usando una espuma polimérica de gelatina-glutaraldehído-hidroxiapatita biodegradable como implante en un modelo no cavitario realizado por rotura transcortical en la tibia de rata. En este modelo, la impregnación de osteostatina en el implante aceleró la regeneración ósea, observándose la completa reparación del daño ósea a las 4 semanas (41).
Más recientemente, nos propusimos evaluar y comparar la eficacia del fragmento N-terminal de la PTHrP con la de la osteostatina en esta gelatina polimérica como implante en un defecto similar al descrito en la tibia de ratas viejas (20 meses de edad) con o sin diabetes inducida por inyección de estreptozotozina al nacer. Observamos un incremento del potencial osteoregenerador similar con ambos péptidos de la PTHrP en ambos tipos de animales osteopénicos (42). En estudios aún más recientes, en colaboración con el Dr. A. Salinas, un experto en biovidrios en el grupo de la Prof. Vallet-Regí, hemos añadido la osteostatina a un biovidrio mesoporoso (SiO2 80 %-CaO 15 %-P2O5 5 % + ZnO 4%) configurado en forma de andamio tridimensional. Observamos que la presencia de la osteostatina en el material cerámico aumenta su capacidad para promover el crecimiento de células mesenquimales humanas (obtenidas de Lonza) (43).
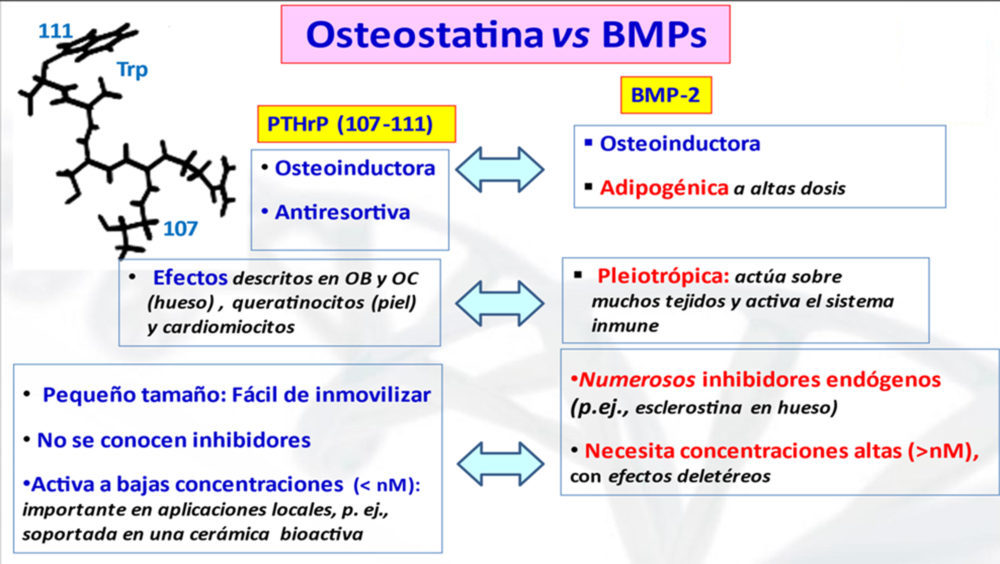
Así pues, los hallazgos actuales sugieren que los biomateriales dopados con el pentapéptido osteostatina constituyen una opción atractiva para su aplicación en ingeniería tisular ósea. Las propiedades de este péptido son claramente favorables frente a las de la proteína morfogenética del hueso 2 (BMP-2), una proteína obtenida de forma recombinante cuyo uso ha demostrado eficacia en Traumatología (p.e., en tratamiento de defectos óseos atróficos que no consolidan), pero con múltiples efectos adversos (inflamación local, resorción de hueso esponjoso, formación ósea ectópica) (44) (Fig. 4).
Figura 4
5. CONCLUSIONES
El aumento de la osteoporosis involutiva asociado a nuestra longevidad supone un desafío para la calidad de vida de una parte significativa de nuestra población y para nuestros sistemas sanitarios, que requiere establecer abordajes eficaces para aumentar la masa y la calidad ósea. Relacionado con esta situación, existe una demanda creciente de moléculas osteoregeneradoras para su uso en cirugía reparadora de las fracturas óseas, especialmente las críticas, que no consolidan por distintas comorbilidades del paciente (edad, diabetes y otros estados metabólicos, déficits nutricionales).
Así, el desarrollo de modelos experimentales es clave para identificar nuevas estrategias terapéuticas que promuevan la formación y la reparación ósea. Un buen ejemplo de ello ha sido el desarrollo de la abaloparatida mencionada anteriormente, cuyas propiedades osteoformadoras sin apenas efectos secundarios (como la hipercalcemia) constituyen una alternativa atractiva para el tratamiento de la osteoporosis. La abaloparatida es consecuencia del conocimiento de las distintas conformaciones del PTHR1 y la interacción con sus ligandos; lo que enfatiza la importancia de la investigación básica en el desarrollo de nuevas terapias. La expansión de su uso para promover la masa ósea en distintas patologías óseas (osteoporosis, fracturas, artrosis) sin duda será favorecida por el diseño de formas de administración alternativas a su inyección hipodérmica (45). Por otra parte, estudios recientes sugieren que las nanopartículas mesoporosas de sílice, convenientemente modificadas en su superficie para evitar su opsonización plasmática, como transportadores de osteostatina y un silenciador génico (siRNA) del gen SOST (codificador de esclerostina) pueden ser vehiculizadas selectivamente al hueso y resultar eficaces para tratar la osteoporosis (46). Esta aproximación basada en la nanotecnología constituye pues una alternativa potencial novedosa para el tratamiento de una patología sistémica como la osteoporosis.
Agradecimientos
En primer lugar, quiero expresar mi agradecimiento a la Junta de Gobierno de esta Corporación y a su presidente, el Excmo. Sr. D. Antonio L. Doadrio, por haberme nombrado Académico correspondiente. Constituye para mí un verdadero honor y satisfacción haber sido elegido para formar parte de esta Real Academia de tradición señera. Muchas gracias especialmente a la Excma. Sra. Dña. María Vallet-Regí por sus amables y sin duda generosas palabras hacia mi persona. Es un verdadero honor y privilegio haber sido propuesto y presentado en este Acto por ti, María, considerando tu excelente categoría científica en primera posición entre los investigadores más citados en su área de investigación (según la mayor base de datos de referencias bibliográficas Scopus). Gracias de todo corazón.
En los últimos años, a través de mi relación científica con diversos miembros del Departamento de Química en Ciencias Farmacéuticas en la Facultad de Farmacia de la UCM, he tenido la grata oportunidad de visitar esta Academia en diversas ocasiones. Como anécdota, quiero señalar que para mí esta Institución me trae tantos recuerdos de infancia y primera juventud, como alumno que fui de uno de los colegios más antiguos de Madrid, las Escuelas Pías de San Antón, colindante con el edificio de la RANF y hoy desgraciadamente desaparecido tras un incendio ocurrido hace más de 2 décadas.
Mi “transición” desde la Facultad de CC Químicas de la UCM a la biomedicina tuvo lugar gracias a una beca de investigación concedida por una Fundación muy querida para mí, la Fundación Conchita Rábago. Esta Fundación, de la que tuve el honor de formar parte de su Comité científico durante varios años, fue creada en la década de los 50 por el mecenazgo inédito de Dña. Conchita Rábago, esposa del Prof. Jiménez Díaz, un médico adelantado en promover lo que hoy se conoce como Biomedicina. Deseo expresar mi agradecimiento a dicha Fundación por haber permitido formarme en diversos aspectos del metabolismo fosfocálcico en la Fundación Jiménez Díaz (FJD). Deseo mencionar aquí a mi director de Tesis, ya desafortunadamente ausente, Dr. Aurelio Rapado, un pionero creador de la primera Unidad Metabólica en España, en la que tuve la oportunidad de desarrollar mis primeras etapas de formación biomédica. Mi gratitud por todo ello al Dr. Rapado. Esta primera etapa en la FJD me inspiró el interés por la fisiopatología de la PTH, que amplié durante mi estancia postdoctoral en la Washington University de St. Louis de la que conservo gratos recuerdos profesionales y personales. Mi contacto posterior con la PTHrP tuvo lugar a través del interés suscitado por la hipercalcemia prevalente en la patología tumoral. Sus características de pseudohiperparatiroidismo hicieron atribuir inicialmente a la PTH o a un factor similar segregado por el tumor la responsabilidad de la hipercalcemia. Mi recuerdo especial para el Prof. Andy Stewart -uno de los primeros investigadores que caracterizaron la PTHrP-, en cuyo laboratorio adquirí conocimientos fundamentales sobre esta proteína, determinantes en mis estudios sobre sus acciones renales y óseas a partir de los años 90. No puedo sino citar aquí a mi gran amigo y colega el Prof. RJ Bosch (U. de Alcalá) y a Arantxa Ortega, con quienes compartimos tantas discusiones científicas y proyectos colaborativos para evaluar las acciones de la PTHrP en modelos experimentales de daño renal. A mis más estrechos colaboradores pre y postdoctorales en el laboratorio: Juan A Ardura, Verónica Alonso, Arancha R de Gortázar, Luis A López de Castro, Daniel Lozano, Sergio Portal, por citar solo aquellos más relacionados con los estudios mostrados en esta revisión, verdaderos protagonistas en tantas reuniones científicas compartidas. Gracias a todos ellos por haber hecho las duras tareas de investigación una aventura tan gratificante. Así mismo, agradecer a investigadores de otras Instituciones Académicas con quienes he tenido el privilegio de colaborar y aprender, comenzando por mis colegas y amigos del Departamento de Química en Ciencias Farmacéuticas en la Facultad de Farmacia de la UCM, muy especialmente al Dr. Antonio Salinas; a las Dras. Teresa Portolés y Mónica de la Fuente, en la Facultad de CC Biológicas de la UCM; a la Dra. M. Luisa Villanueva-Peñacarrillo y al Dr. Jaime Esteban (un “crack” de las bacterias) en el IIS-Fundación Jiménez Díaz; a mis colegas de la Sociedad Española de Investigación Ósea y Metabolismo Mineral (SEIOMM), Dres. Adolfo Díez y Xavi Nogués en el Hospital del Mar de Barcelona; al Dr. Enrique Gómez Barrena y a la Dra. María Eugenia Martínez en el Hospital La Paz (de quien aprendí tanto sobre los osteoblastos); así como a tantos otros colegas foráneos, entre los que quiero destacar aparte de los citados anteriormente, a la Dra. Sara Feldman en la Universidad de Rosario (Argentina) y a las Dras. Teresita Bellido y Lilian Plotkin en la Universidad de Indiana (EEUU) que me descubrieron la “biomecánica” de los osteocitos.
En fin, no puedo terminar sin mencionar y agradecer a mi familia, a mis padres en primer lugar, por todo lo que me aportaron y enseñaron en la aventura de vivir; y a Mark, por ser como eres y estar siempre accesible, por tantas cosas compartidas, y por enseñarme que Wichita es mucho más que una referencia de “pelis” de vaqueros. Y gracias a mis amigos, y sobre todo a mis amigas, por mostrarme una certeza en medio de la incertidumbre: el inmenso valor de la AMISTAD.
Gracias a todos los que me habéis regalado con vuestra presencia en este acto.
6. REFERENCIAS
- Hernández CJ, Beaupré GS, Carter DR. A theoretical analysis of the relative influences of peak BMD, age-related bone loss and menopause on the development of osteoporosis Osteoporos Int 2003;14: 843-847.
- Muñoz-Torres M, Varsavsky M, Avilés Pérez MD. Osteoporosis. Definición. Epidemiología. Rev Osteoporos Metab Miner 2010; 2(Supl 3): S5-S7.
- Reginster J-Y, Burlet N. Osteoporosis: a still increasing prevalence. Bone 2006; 38: 4–9.
- Svedbom A, Hernlund E, Ivergård M, Compston J, Cooper C, Stenmark J, McCloskey EV, Jönsson B, Kanis JA, the EU review panel of the IOF. Osteoporosis in the European Union: a compendium of country-specific reports. Arch Osteoporos 2013; 8: 137.
- Feik SA, Thomas CD, Clement JG. Age-related changes in cortical porosity of the midshaft of the human femur. J Anat 1997;191: 407-416.
- Schaadt O, Bohr H. Different trends of age-related diminution of bone mineral content in the lumbar spine, femoral neck, and femoral shaft in women. Calcif Tissue Int 1988;42: 71-76.
- Frost HM. Wolff’s Law and bone’s structural adaptations to mechanical usage: an overview for clinicians. The Angle Orthodontist 1994; 64: 175–188.
- Robling AG, Bonewald LF. The osteocyte: new insights. Annu Rev Physiol 2020; 82: 485–506.
- Teitelbaum SL. Bone resorption by osteoclasts. Science 2000; 289:1504-1508.
- Boyce BF, Xing L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Arch Biochem Biophys. 2008; 473: 139–146.
- Watts NB, Diab DL Long-term use of bisphosphonates in osteoporosis. J Clin Endocrinol Metab 2010; 95: 1555–1565.
- Drake MT, Clarke BL, Khosla S. Bisphosphonates: mechanism of action and role in clinical practice. Mayo Clin Proc 2008 83: 1032–1045.
- Portal-Núñez S, Mediero A, Esbrit P, Sánchez-Pernaute O, Largo R, Herrero-Beaumont G. Unexpected bone formation produced by RANKL blockade. Trends Endocrinol Metab 2017; 28: 695-704.
- Harman D. Origin and evolution of the free radical theory of aging: a brief personal history, 1954-2009. Biogerontology 2009;10: 773-781.
- Portal-Núñez S, Lozano D, de la Fuente M, Esbrit P. Pathophysiology of aging bone. Rev Esp Geriatr Gerontol 2012;47: 125-131.
- Martínez ME, del Campo MT, Medina S, Sánchez M, Sánchez-Cabezudo MJ, Esbrit P, Martínez P, Moreno I, Rodrigo A, Garcés MV, Munuera L. Influence of skeletal site of origin and donor age on osteoblastic cell growth and differentiation. Calcif Tissue Int 1999; 64: 280-286.
- Jilka RL, Weinstein RS, Bellido T, Roberson P, Parfitt AM, Manolagas SC. Increased bone formation by prevention of osteoblast apoptosis with parathyroid hormone. J Clin Invest 1999; 104: 439-446.
- Jilka RL, Almeida M, Ambrogini E, Han L, Roberson PK, Weinstein RS, manolagas SC. Decreased oxidative stress and greater bone anabolism in the aged, when compared to the young, murine skeleton with parathyroid hormone administration. Aging Cell 2010; 9: 851–867.
- Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med 2017; 377:1417-1427.
- Esbrit P, Alcaraz MJ. Current perspectives on parathyroid hormone (PTH) and PTH-related protein (PTHrP) as bone anabolic therapies. Biochem Pharmacol 2013; 85:1417–1423.
- Datta NS, Abou-Samra AB. PTH and PTHrP signaling in osteoblasts. Cell Signal 2009;21: 245–254.
- Miao D, He B, Jiang Y, Kobayashi T, Sorocéanu MA, Zhao J, Su H, Tong X, Amizuka N, Gupta A, Genant HK, Kronenberg HM, Goltzman D, Karaplis AC. Osteoblast-derived PTHrP is a potent endogenous bone anabolic agent that modifies the therapeutic efficacy of administered PTH 1–34. J Clin Invest. 2005;115: 2402-2411.
- Martínez P, Esbrit P, Rodrigo A, Alvarez-Arroyo MV, Martínez ME. Age-related changes in parathyroid hormone-related protein and vascular endothelial growth factor in human osteoblastic cells. Osteoporosis Int 2002; 13: 874-881.
- Portal-Núñez S, Manassra R, Lozano D, Acitores A, Mulero F, Villanueva-Peñacarrillo ML, De la Fuente M, Esbrit P. Characterization of skeletal alterations in a model of prematurely aging mice. Age 2013; 35: 383-393.
- Horwitz MJ, Augustine M, Kahn L, Martin E, Oakley CC, Carneiro RM, Tedesco MB, Laslavic A, Sereika SM, Bisello A, García-Ocaña A, Gundberg CM, Cauley JA, Stewart AF (2013) A comparison of parathyroid hormone-related protein (1-36) and parathyroid hormone (1-34) on markers of bone turnover and bone density in postmenopausal women: the PrOP study. J Bone Miner Res 28:2266–2276.
- Esbrit P, Portal-Núñez S, Herrera S, Nogués X, Díez-Pérez A. Parathyroid hormone-related protein analogues as osteoporosis therapies. Calcif Tissue Int 2016; 98: 359-369.
- Ardura JA, Portal-Núñez S, Alonso V, Bravo B, Gortázar AR. Handling parathormone receptor type 1 in skeletal diseases: realities and expectations of abaloparatide. Trends Endocrinol Metab 2019; 30: 756-766.
- Cornish J, Callon KE, Nicholson GC, Reid IR. Parathyroid hormone-related protein-(107-139) inhibits bone resorption in vivo. Endocrinology 1997; 138: 1299–1304.
- Cornish J, Callon KE, Lin C, Xiao C, Moseley JM, Reid IR. Stimulation of osteoblast proliferation by C-terminal fragments of parathyroid hormone-related protein. J Bone Miner Res 1999;14: 915–922.
- Miao D, Su H, He B, Gao J, Xia Q, Zhu M, Gu Z, Goltzman D, Karaplis AC. Severe growth retardation and early lethality in mice lacking the nuclear localization sequence and C-terminus of PTH-related protein. Proc Natl Acad Sci USA 2008; 105: 20309-20314.
- de Castro LF, Lozano D, Portal-Núñez S, Maycas M, De la Fuente M, Caeiro JR,et al. Comparison of the skeletal effects induced by daily administration of PTHrP (1-36) and PTHrP (107-139) to ovariectomized mice. J Cell Physiol 2012; 227: 1752–1760.
- Lozano D, de Castro LF, Dapía S, Andrade-Zapata I, Manzarbeitia F, Alvarez-Arroyo MV, et al. Role of parathyroid hormone-related protein in the decreased osteoblast function in diabetes-related osteopenia. Endocrinology 2009;150: 2027–2035.
- Lozano D, Fernández-de-Castro L, Portal-Núñez S, López-Herradón A, Dapía S, Gómez-Barrena E, Esbrit P. The C-terminal fragment of parathyroid hormonerelated peptide promotes bone formation in diabetic mice with low turnover osteopenia. Br J Pharmacol 2011;162: 1424–1438.
- Portal-Núñez S, Ardura JA, Lozano D, Martínez de Toda I, De la Fuente M, Herrero-Beaumont G, Largo R, Esbrit P. Parathyroid hormone-related protein exhibits antioxidant features in osteoblastic cells through its N-terminal and osteostatin domains Bone Joint Res 2018; 7: 58–68.
- Ono N, Nakashima K, Schipani E, Hayata T, Ezura Y, Soma K, et al. Constitutively active PTH/PTHrP receptor specifically expressed in osteoblasts enhances bone formation induced by bone marrow ablation. J Cell Physiol 2012; 227:408–415.
- de Castro LF, Lozano D, Dapía S, Portal-Núñez S, Caeiro JR, Gómez-Barrena E, et al. Role of the N- and C-terminal fragments of parathyroid hormone-related protein as putative therapies to improve bone regeneration under high glucocorticoid treatment. Tissue Eng Part A 2010;16: 1157–1168.
- Salinas AJ, Esbrit P, Vallet-Regí M. A tissue engineering approach based on the use of bioceramics for bone repair. Biomat Sci 2013;1: 40-51.
- Lozano D, Manzano M, Doadrio JC, Salinas AJ, Vallet-Regí M, Gómez-Barrena E, Esbrit P. Osteostatin-loaded bioceramics stimulate osteoblastic growth and differentiation. Acta Biomater 2010; 6: 797-803.
- Trejo CG, Lozano D, Manzano M, Doadrio JC, Salinas AJ, Dapía S, et al. The osteoinductive properties of mesoporous silicate coated with osteostatin in a rabbit femur cavity defect model. Biomaterials 2010;31: 8564–8573.
- Lozano D, Trejo CG, Gómez-Barrena E, Manzano M, Doadrio JC, Salinas AJ, Vallet-Regí M, García-Honduvilla N, Esbrit P, Buján J. Osteostatin-loaded onto mesoporous ceramics improves the early phase of bone regeneration in a rabbit osteopenia model. Acta Biomater 2012; 8: 2317-2323.
- Lozano D, Sánchez-Salcedo S, Portal-Núñez S, Vila M, López-Herradón A, Ardura JA, Mulero F, Gómez-Barrena E, Vallet-Regí M, Esbrit P. Parathyroid hormone-related protein (107-111) improves the bone regeneration potential of gelatin–glutaraldehyde biopolymer-coated hydroxyapatite. Acta Biomater 2014; 10: 3307–3316.
- Ardura JA, Portal-Núñez S, Lozano D, Gutiérrez-Rojas I, Sánchez-Salcedo S, López-Herradón A, Mulero F, Villanueva-Peñacarrillo ML, Vallet-Regí M, Esbrit P. Local delivery of parathyroid hormone-related protein-derived peptides coated onto a hydroxyapatite-based implant enhances bone regeneration in old and diabetic rats. J Biomed Mater Res A 2016; 104: 2060-2070.
- Heras C, Sánchez-Salcedo S, Lozano D, Peña J, Esbrit P, Vallet-Regí M, Salinas AJ. Osteostatin potentiates the bioactivity of mesoporous glass scaffolds containing Zn2+ ions in human mesenchymal stem cells. Acta Biomater 2019; 89:359-371.
- Mumcuoglu D, Siverino C, Tabisz B, Kluijtmans B, Nickel J. How to use BMP-2 for clinical applications? A review on pros and cons of existing delivery strategies. J Transl Sci, 2017; 3:1-11.
- Shirley M. Abaloparatide: first global approval. Drugs 2017; 77: 1363–1368.
- Vallet-Regí M. Our contributions to applications of mesoporous silica nanoparticles Acta Biomater 2022; 137: 44–52.