1. INTRODUCCIÓN
Estructura del escualeno
El escualeno es un hidrocarburo cuya fórmula corresponde al C30H50, posee seis metilos y seis dobles enlaces y su nombre oficial aprobado por la IUPAC es (6E,10E,14E,18E)-2,6,10,15,19,23-hexametil tetracosa- 2,6,10,14,18,22- hexaeno (1). Su biosíntesis en plantas y animales utiliza elementos de carbono de 5 unidades denominados isoprenos y al ser un compuesto que utiliza un múltiplo de seis unidades del mismo, se le considera un isoprenoide, concretamente un triterpeno lineal.
Descubrimiento
Fue en 1916 cuando el químico japonés Mitsumaru Tsujimoto aisló y caracterizó este compuesto. Puso de manifiesto su abundancia en el aceite de hígado de tiburón y formuló que podría utilizarse para identificar aceites y grasas (2). En los años siguientes, prosiguió con sus investigaciones y confirmo el hallazgo en varias especies de tiburones y a raíz de esto, lo denominó escualeno (3).
Destino metabólico
Desde entonces, numerosos trabajos han permitido establecer que el escualeno es un intermediario en la biosíntesis de colesterol. Utilizando la unidad de 5 carbonos de isopreno, antes mencionada y en diversas etapas metabólicas se forma el escualeno, a partir del cual mediante ciclación se originará el colesterol (4).
En plantas, el origen del escualeno es compartido con animales, pero su destino metabólico cambia y origina los fitosteroles y una gama amplísima de terpenos. Solo en el fruto del olivo se han encontrado alcoholes como el uvaol y el eritrodiol y compuestos terpénicos ácidos como el máslínico, el oleanólico y el ursólico (5).
2. NUESTRO INTERÉS
Nuestro grupo de investigación viene trabajando en el estudio de las propiedades antiaterogénicas del aceite de oliva virgen. Este es el zumo oleoso del fruto de la Olea europea separado de los demás componentes del fruto. Esto permite que ciertos componentes presentes en el fruto puedan pasar al aceite en tanto que están ausentes en los procedentes de semillas, que siempre requieren una extracción con disolventes.
Los constituyentes del aceite de oliva virgen pueden clasificarse en dos grandes grupos: uno mayoritario, la fracción saponificable, y otro presente en menor proporción, los componentes minoritarios o fracción insaponificable.
La fracción saponificable representa el 99 %, la mayor parte de la cual son triglicéridos y en menor medida ácidos grasos libres, mono o diglicéridos, fosfátidos, ceras y ésteres de esteroles. El ácido graso más abundante es el ácido oleico (monoinsaturado), con cantidades moderadas de los ácidos palmítico y linoleico y un bajo porcentaje de ácidos esteárico y linolénico, tal como se ilustra en la tabla 1.
Tabla 1. Porcentaje de los diferentes ácidos grasos presentes en el aceite de oliva.
Adaptada de (30)
La fracción insaponificable, también denominada componentes minoritarios del aceite de oliva virgen, contiene una gran variedad de compuestos. En la tabla 2, se recogen los principales grupos químicos junto con su rango de concentraciones. Como se aprecia en la misma, los hidrocarburos son los más abundantes y entre ellos destaca el escualeno y en menor cantidad los carotenos (la luteína y el β-caroteno) (6).
El contenido total de compuestos terpénicos supone una de las fracciones más abundantes y pueden ser de estructura tetracíclica o pentacíclica. De entre estos últimos, destacan dos alcoholes, el uvaol y el eritrodiol, y sus correspondientes ácidos, oleanólico y maslínico.
Los esteroles vegetales más abundantes en el aceite de oliva virgen: son el β-sitosterol, el Δ5-avenasterol y el campesterol (7).
Tabla 2. Componentes minoritarios del aceite de oliva virgen.
Adaptada de (30)
Los compuestos fenólicos forman los constituyentes hidrosolubles y afectan a la estabilidad y sabor del aceite de oliva. El más abundante es el hidroxitirosol (8).
Los alcoholes alifáticos saturados de cadena lineal con número par de átomos de carbono comprendido entre 18 y 28 átomos de carbono, los tocoferoles, clorofilas y feofitinas completan la composición (7).
Tal como hemos comentado el escualeno aparece en una elevada concentración en la fracción insaponificable del aceite de oliva (60-75%). Puede constituir hasta el 90% de los hidrocarburos en el aceite de oliva virgen. El rango de contenido en los aceites de oliva virgen muestra una gran variabilidad desde 1,5 hasta 13 g/ kg en la que influyen diversos factores como variedades vegetales y procedimientos tanto agronómicos como de obtención de los aceites (5). Esta molécula es estable en el aceite de oliva virgen calentado a 180 ºC durante 36 h, además se absorbe y permanece en el organismo. Por estas razones se ha pensado que puede jugar un importante papel en la acción del aceite de oliva virgen (9).
3. EXPLORACIÓN DEL PAPEL BIOLÓGICO
Nuestros estudios preclínicos con ratones humanizados se han encaminado a estudiar el efecto del papel del aceite de oliva virgen y sus componentes en el desarrollo de la ateroesclerosis y los mecanismos implicados.
Para ello hemos utilizado el ratón carente de la apolipoproteína E. La ausencia de la misma impide que las partículas remanentes de los quilomicrones y las VLDL puedan eliminarse por el hígado, por lo que se acumulan en el plasma y finalmente se depositan en el espacio subendotelial de las paredes arteriales. Por ello, este ratón alimentado con la dieta normal desarrolla una extensa aterosclerosis fibroproliferativa espontánea (10), que presenta la misma secuencia de formación de la lesión establecida en otros modelos animales y en humanos. La complejidad de las lesiones y su facilidad de generación de forma espontánea en un corto periodo de tiempo, junto con la semejanza del modelo con la enfermedad humana lo convierten en un sistema atractivo para estudiar los factores predisponentes de la aterosclerosis, tanto ambientales como genéticos. Entre los factores ambientales, hay que destacar la dieta como uno de los más importantes (11). En este campo, el empleo de este ratón nos ha permitido explorar el papel biológico de aceite de oliva virgen y sus componentes sobre el desarrollo de la aterosclerosis.
Utilizamos estos ratones alimentados con dietas con un 10 % (p/p) de dicho aceite y sin colesterol, en un intento de reproducir la clásica dieta mediterránea donde la principal fuente de grasa era ese aceite y el consumo de productos de origen animal con colesterol era muy limitado. Este porcentaje se eligió teniendo en cuenta que un ratón consume unos 3 g/ día de pienso y con el 10 % (p/p) de aceite, nuestros ratones estarían ingiriendo 0,3 g de aceite. Dado que cada animal pesa unos 30 g, la dosis consumida sería de 10 g de aceite/ kg de peso del animal. Extrapolando al peso medio humano (70 kg), los ratones que pesasen como un humano estarían consumiendo 700 g de aceite por día. Si se tiene en cuenta que el tono metabólico en el ratón es 10 veces más elevado (12), esa cantidad ya ajustada equivaldría a 70 g de aceite por día en humanos. Si lo valoramos en términos energéticos, este consumo de 70 g de aceite/ día a razón de 9 kcal/g de grasa supone una ingestión de 630 kcal que representan el 25 % de una dieta de 2.500 kcal para una persona media, cifra inferior a la ingesta de aceite de oliva en la dieta mediterránea clásica donde el 35 % de las calorías totales provenía de dicho aceite (13).
Estas dietas con un 10 % (p/p) de aceite de oliva virgen extra o 30% de las calorías y sin colesterol se administraron a los ratones durante 12 semanas y al cabo de dicho periodo, los animales se sacrificaron y se cuantificó el grado de lesión aterosclerótica presente. En dicho estudio, la administración de este porcentaje de aceite de oliva en la dieta retrasaba el desarrollo de la aterosclerosis (14).
En este mismo estudio, se incluyó un grupo de animales alimentado con un porcentaje similar de aceite de girasol de alto contenido en ácido oleico, lo que hacía que estos animales recibiesen el mismo porcentaje de ácido oleico que los animales alimentados con el aceite de oliva virgen extra. A pesar del similar contenido de este ácido graso en las dietas, los animales que consumieron la dieta de girasol con alto contenido de oleico no presentaron el descenso en la aterosclerosis. Esta observación permitió concluir que los triglicéridos con ácido oleico constituyentes del aceite de oliva virgen extra no eran los únicos responsables de su acción.
Para comprobar la implicación de los componentes minoritarios del aceite de oliva, se diseñó el siguiente experimento: Se prepararon aceites del mismo olivar con dos procedimientos diferentes: uno obtenido por prensado y otro por centrifugación. Ambos tipos de aceites se refinaron para eliminar el componente hidrosoluble. El procedimiento de centrifugado generó un aceite enriquecido en compuestos insolubles en agua de la fracción insaponificable tales como: fitosteroles, tocoferoles, triterpenos y ceras. Los dos tipos de aceites se administraron al 10% a los ratones.
El aceite obtenido por prensado y refinado aumentó la lesión aterosclerótica, en tanto que el aceite de centrifugación, enriquecido en los componentes minoritarios e insolubles en agua y carente de compuestos hidrosolubles, indujo una disminución de la aterosclerosis e indica que los compuestos liposolubles juegan un papel importante en el retraso del desarrollo de la lesión aterosclerótica (15).
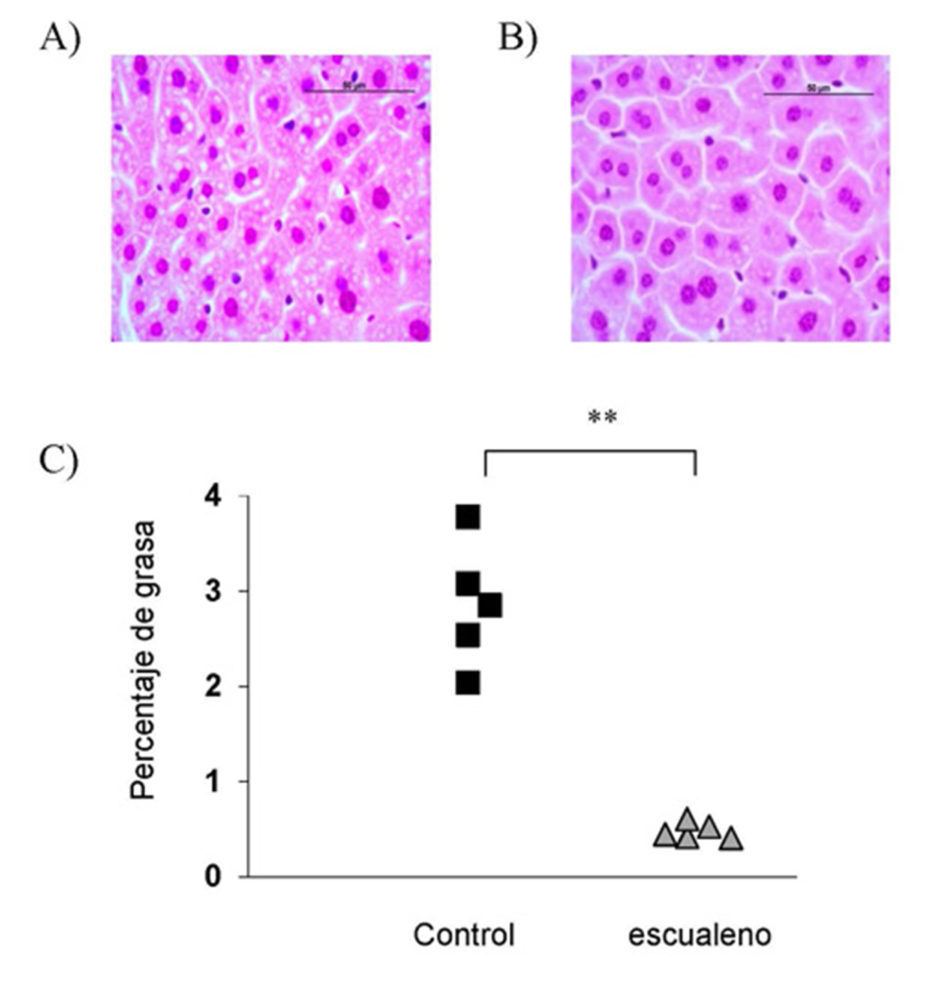
Dado que el escualeno es el compuesto liposoluble más abundante como se mencionó anteriormente, se estudió su efecto. En este sentido, la administración de una dosis farmacológica de 1 g/ kg ratón/día de escualeno al ratón alimentado con la dieta pobre en grasa redujo el desarrollo de la aterosclerosis. En conclusión, este compuesto posee acción ateroprotectora y su administración es segura a dosis altas (16). De todos los parámetros estudiados para explicar este hallazgo, se observó que los cambios en grasa hepática estaban implicados y que el escualeno los disminuía (Figura 1) (17).
Figura 1. Efecto de la administración de escualeno sobre el grado de esteatosis hepática en ratones macho carentes de Apoe alimentados con dieta pobre en grasa. El análisis estadístico se llevó a cabo mediante la U de Mann-Whitney: **, P< 0.001 vs control. Adaptado de Ramírez-Torres et al. J Proteomics 77: 27–39, Copyright (2012), con permiso de Elsevier.
El papel de un correcto funcionamiento hepático y las repercusiones en la ateroesclerosis cuando acumula grasa es un nuevo aspecto de investigación el cual nos ha sorprendido en los últimos años y es motivo de debate en la comunidad científica.
Para explicar dichos hallazgos, se efectuó un análisis proteómico y se observaron las características de las gotas lipídicas intracelulares.
El análisis proteómico reveló que proteínas implicadas en el metabolismo lipídico y lipoproteico, estrés oxidativo y ritmos circadianos están influenciados por la administración de escualeno (18).
Se abordó la distribución del escualeno en los orgánulos subcelulares y se vio que se acumulaba en las gotas lipídicas fundamentalmente (19). Estas gotas lipídicas fueron diferentes entre los dos sexos. En las hembras son más pequeñas ya que presentan menor expresión de la proteína que permite su crecimiento (20).
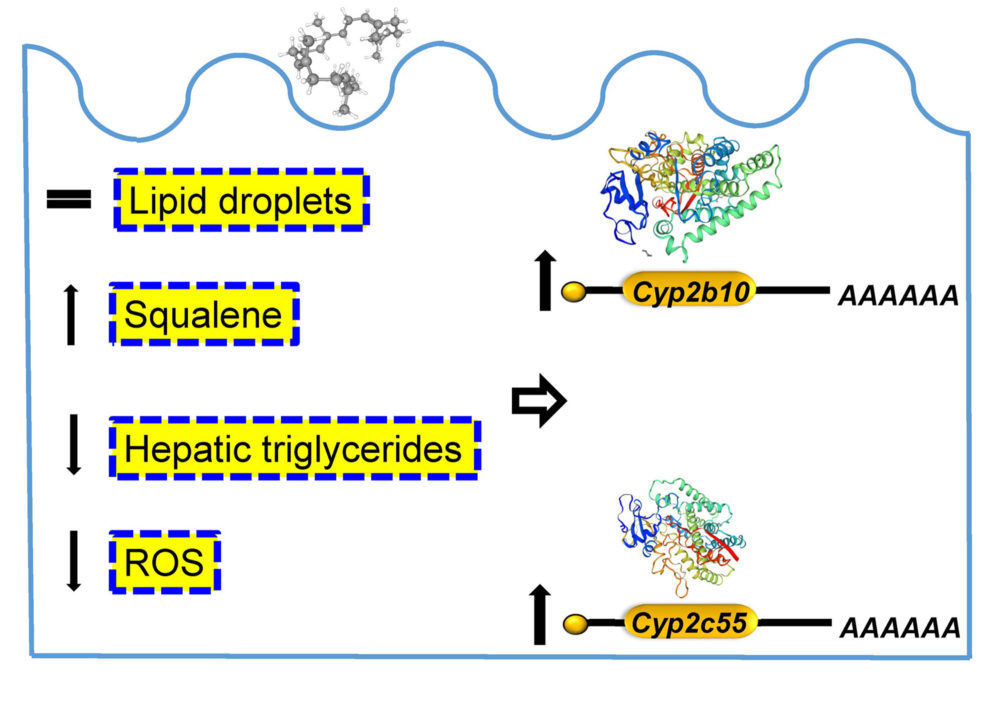
La administración de una dosis farmacológica de 1 g/ kg ratón/ día de escualeno al ratón alimentado con la dieta rica en grasa redujo el contenido hepático de triglicéridos y favoreció su acumuló (21). El acúmulo de escualeno también se tradujo en un descenso del estrés oxidativo (Figura 2). Curiosamente, los animales que lo acumulan en el hígado como los tiburones del ártico viven al menos 272 años (22). Estos experimentos nos indican que las esteatosis hepáticas no son todas iguales y que la producida por el aporte de escualeno no ocasionaría el desarrollo de las complicaciones de esta patología como son la estatohepatitis, la cirrosis y el hepatoma.
Figura 2. Representación esquemática de los efectos de la administración de escualeno en ratones macho carentes de Apoe alimentados con dieta rica en grasa. Adaptado de Gabas-Rivera et al. Mol Nutr Food Res 64: e2000354, Copyright (2020), con permiso de Wiley.
4. OTROS USOS ACTUALES
A parte de este potencial uso como suplemento nutricional, el escualeno es ampliamente usado como adyuvante de vacunas, en cosmética y en usos no biológicos como lubricante.
Como adyuvante para potenciar la respuesta inmune está presente en las vacunas de la gripe, rabia, clamidias, coronavirus (SARS-CoV y MERS-CoV) (23) y en las recientemente desarrolladas frente al coronavirus implicado en la COVID-19 (24).
El escualeno es el tercer componente más importante de la secreción grasa de la piel humana donde supone el 13% por detrás de triglicéridos y ceras (25). Al no taponar la glándula sebácea es un compuesto presente en preparados hidratantes para la piel ya sean cremas o lápices de labios. También se incluye en formulaciones con funciones emolientes y destoxificantes de este órgano ya que contribuye a reparar su daño oxidativo (25).
5. PERSPECTIVAS FUTURAS
En resumen, las necesidades del escualeno para cubrir todas estas aplicaciones suponen un importante reto. Según la organización no gubernamental Sharkallies, para obtener una tonelada del compuesto se han de sacrificar entre 2500 y 3000 tiburones (26). Este mismo organismo estima que para vacunar a toda la población del planeta frente al SARS-CoV2 se precisarán sacrificar alrededor de 500.000 tiburones.
Esta ingente necesidad mundial de escualeno precisa nuevos abordajes que acaben con el sacrificio de los tiburones para obtenerlo de su reservorio hepático. Por ello, son muchas las iniciativas que van surgiendo, ya sea para aislarlo de plantas o protistas, producirlo por ingeniería bioquímica o por biología sintética en nuevos organismos convenientemente modificados.
• Algunas de las plantas que proporcionan gran cantidad de escualeno son el olivo (5) y Artocarpus lakoocha (27). Son varias las compañías que lo preparan a partir del olivo: EKIZ Olive Oil & Soap, EFP Biotech, Jedwards International, Inc. o Wilshire Tech (aceite de oliva) (26).
• Otra segunda fuente natural son los protistas del género Aurantiochytrium sp. 18W-13a que acumulan un 13% de su peso como escualeno (28).
• Nuevos desarrollos tecnológicos a partir de caña de azúcar como el que ha desarrollado la empresa Amyris Biotecnología, (Emeryville, CA, USA) o la generación de nuevas levaduras por biología sintética que lo acumulen (29) y que ya explota la empresa Enepret Inc (Lexington, KY, USA) muestran la importancia de producir este compuesto de la máxima pureza, bajo coste y con el menor impacto ambiental.
6. CONCLUSIONES
- El escualeno es más que un intermediario metabólico en la biosíntesis de colesterol, fitosteroles y terpenos.
- Posee una amplia gama acciones importantes en varios sistemas biológicos.
- Su amplio uso industrial en cosmética y adyuvante de vacunas plantea importantes retos medioambientales.
- Son esos desafíos los que actúan como un motor de desarrollo biotecnológico para una producción más sostenible de este compuesto.
7. REFERENCIAS
- Pubchem. 2021. Accesible: https://pubchem.ncbi.nlm.nih.gov/#query=C30H50.
- Tsujimoto M. A highly unsaturated hydrocarbon in shark liver oil. J Ind Eng Chem 1916;8:889-96.
- Tsujimoto M. Squalene: a highly unsaturated hydrocarbon in shark liver oil. J Ind Eng Chem 1920;12:63-72.
- Lou-Bonafonte JM, Martinez-Beamonte R, Sanclemente T, Surra JC, Herrera-Marcos LV, Sanchez-Marco J, et al. Current Insights into the Biological Action of Squalene. Mol Nutr Food Res. 2018:e1800136.
- Martinez-Beamonte R, Sanclemente T, Surra JC, Osada J. Could squalene be an added value to use olive by-products? J Sci Food Agric. 2020;100(3):915-25.
- Owen RW, Mier W, Giacosa A, Hull WE, Spiegelhalder B, Bartsch H. Phenolic compounds and squalene in olive oils: the concentration and antioxidant potential of total phenols, simple phenols, secoiridoids, lignans and squalene. Food Chem Toxicol. 2000;38(8):647-59.
- Boskou D. Olive oil, Chemistry and Technology. Champaign, IL: AOCS Press; 1996.
- Arbonés-Mainar JM, Navarro MA, Lou-Bonafonte JM, Martínez-Gracia MV, Osada J. Olive oil phenolic compounds as potential therapeutical agents. Vasallo N, editor. La Veletta: Nova; 2008.
- Ramírez-Torres A, Gabás C, Barranquero C, Martínez- Beamonte R, Fernández-Juan M, Navarro MA, et al. Squalene: Current Knowledge and Potential Therapeutical Uses. First edition ed. New York: NOVA; 2010.
- Reddick RL, Zhang SH, Maeda N. Atherosclerosis in mice lacking apo E. Evaluation of lesional development and progression. Arterioscler Thromb. 1994;14:141-7.
- Sarria AJ, Surra JC, Acin S, Carnicer R, Navarro MA, Arbones-Mainar JM, et al. Understanding the role of dietary components on atherosclerosis using genetic engineered mouse models. Front Biosci. 2006;11:955-67.
- Demetrius L. Of mice and men. When it comes to studying ageing and the means to slow it down, mice are not just small humans. EMBO reports. 2005;6:S39-S44.
- Willett WC. Diet and health: what should we eat? Science. 1994;264:532-7.
- Calleja L, Paris MA, Paul A, Vilella E, Joven J, Jimenez A, et al. Low-cholesterol and high-fat diets reduce atherosclerotic lesion development in ApoE-knockout mice. Arterioscler Thromb Vasc Biol. 1999;19:2368-75.
- Acin S, Navarro MA, Perona JS, Arbones-Mainar JM, Surra JC, Guzman MA, et al. Olive oil preparation determines the atherosclerotic protection in apolipoprotein E knockout mice. J Nutr Biochem. 2007;18:418-24.
- Guillen N, Acin S, Navarro MA, Perona JS, Arbones-Mainar JM, Arnal C, et al. Squalene in a sex-dependent manner modulates atherosclerotic lesion which correlates with hepatic fat content in apoE-knockout male mice. Atherosclerosis. 2008;197:72-83.
- Ramirez-Torres A, Barcelo-Batllori S, Martinez-Beamonte R, Navarro MA, Surra JC, Arnal C, et al. Proteomics and gene expression analyses of squalene-supplemented mice identify microsomal thioredoxin domain-containing protein 5 changes associated with hepatic steatosis. J Proteomics. 2012;77:27-39.
- Ramírez-Torres A, Gabás-Rivera C, Osada J. Squalene: A Trove of Metabolic Actions. In: Boskou D, Clodoveo ML, editors. Products from Olive Tree: IntechOpen Limited; 2016.
- Martinez-Beamonte R, Alda O, Sanclemente T, Felices MJ, Escusol S, Arnal C, et al. Hepatic subcellular distribution of squalene changes according to the experimental setting. J Physiol Biochem. 2018;74:531–8.
- Herrera-Marcos LV, Sancho-Knapik S, Gabas-Rivera C, Barranquero C, Gascon S, Romanos E, et al. Pgc1a is responsible for the sex differences in hepatic Cidec/Fsp27beta mRNA expression in hepatic steatosis of mice fed a Western diet. Am J Physiol Endocrinol Metab. 2020;318:E249-E61.
- Gabas-Rivera C, Jurado-Ruiz E, Sanchez-Ortiz A, Romanos E, Martinez-Beamonte R, Navarro MA, et al. Dietary Squalene Induces Cytochromes Cyp2b10 and Cyp2c55 Independently of Sex, Dose, and Diet in Several Mouse Models. Mol Nutr Food Res. 2020;64:e2000354.
- Nielsen J, Hedeholm RB, Heinemeier J, Bushnell PG, Christiansen JS, Olsen J, et al. Eye lens radiocarbon reveals centuries of longevity in the Greenland shark (Somniosus microcephalus). Science. 2016;353:702-4.
- WHO. 2021 Accesible: https://www.who.int/vaccine_safety/committee/topics/adjuvants/squalene/questions_and_answers/es/.
- Arunachalam PS, Walls AC, Golden N, Atyeo C, Fischinger S, Li C, et al. Adjuvanting a subunit SARS-CoV-2 nanoparticle vaccine to induce protective immunity in non-human primates. bioRxiv. 2021:2021.02.10.430696.
- Huang Z-R, Lin Y-K, Fang J-Y. Biological and pharmacological activities of squalene and related compounds: potential uses in cosmetic dermatology. Molecules. 2009;14:540-54.
- Sharkallies. 2021 Accesible: https://www.sharkallies.com/shark-free-products/squalene-adjuvants-in-vaccines.
- Biswas SM, Chakraborty N. Shedded Artocarpus leaves – Good plant sources of natural squalene with potent antioxidant and antimicrobial activity – Alternative to marine animals. J Nat Pharm. 2013;4:21-7.
- Nham Tran TL, Miranda AF, Gupta A, Puri M, Ball AS, Adhikari B, et al. The Nutritional and Pharmacological Potential of New Australian Thraustochytrids Isolated from Mangrove Sediments. Marine Drugs. 2020;18:151.
- Tateno M, Stone BJ, Srodulski SJ, Reedy S, Gawriluk TR, Chambers TM, et al. Synthetic Biology-derived triterpenes as efficacious immunomodulating adjuvants. Scientific Reports. 2020;10:17090.
- Lou-Bonafonte JM, Arnal C, Navarro MA, Osada J. Efficacy of bioactive compounds from extra virgin olive oil to modulate atherosclerosis development. Mol Nutr Food Res. 2012;56:1043-57.
AGRADECIMIENTOS
Los trabajos llevados a cabo por este grupo están financiados por el FEDER-AEI PID2019-104915RB-I00, grupo de referencia de investigación B16_20R del Gobierno de Aragón, Ciberobn y la Fundación Cuenca Villoro.