RESUMEN:
El consumo de analgésicos opioides ha experimentado un vertiginoso ascenso en las últimas décadas a nivel mundial. Este elevado consumo está relacionado con el aumento del número de prescripciones de opioides para el tratamiento del dolor crónico y por el aumento de la dependencia a opioides. Los analgésicos opioides tienen una corta duración de acción, siendo necesarias múltiples administraciones para obtener analgesia prolongada. El empleo de formulaciones de liberación prolongada permite espaciar los intervalos posológicos y estabilizar las concentraciones máximas de fármaco en sangre, favoreciendo el cumplimiento terapéutico y reduciendo el riesgo de desarrollar adicción. Sin embargo, estas formulaciones llevan dosis más altas de analgésicos opioides que las hacen más susceptibles de ser alteradas. Así, los avances en tecnología farmacéutica más recientes se han orientado hacia la aplicación de recursos tecnológicos disuasorios de su utilización por vías de administración alternativas con fines no terapéuticos. A su vez, los sistemas de liberación modificada también juegan un papel esencial en el tratamiento de la adicción a opioides: con el desarrollo de sistemas de administración parenteral capaces de prolongar la liberación de opioides durante meses se consigue superar una de las mayores dificultades para alcanzar el éxito del tratamiento en este tipo de pacientes como es el cumplimiento terapéutico. En este artículo se realiza una revisión bibliográfica de los diferentes sistemas de liberación prolongada de opioides que se encuentran actualmente autorizados en Europa y/o en Estados Unidos para el tratamiento del dolor y de la dependencia a opioides.
Palabras Clave: Opioides; Dolor; Adicción; Formas sólidas orales de liberación prolongada; Tecnología antiabuso; Parches transdérmicos; Implantes; Microesferas
ABSTRACT:
The consumption of opioid analgesics has increased drastically in the last decades worldwide. This high consumption is linked with a surge in the number of opioid prescriptions for the treatment of chronic pain and a surge in opioid misuse and addiction. Opioid analgesics have a short duration of action, making necessary frequent administrations to provide extended analgesia. The use of prolonged-release formulations enables dosing intervals to be spaced out and drug blood levels to be stabilized, improving therapeutic compliance, and reducing the likelihood of developing addiction. However, these formulations contain higher doses of opioid analgesics which make them more susceptible to be manipulated. Hence, the most recent advances in pharmaceutical technology have been oriented towards the application of abuse deterrent technologies aiming to prevent their administration through alternative routes. Moreover, prolonged- release systems also play an essential role in the treatment of opioid addictions with the development of parenteral dosage forms capable of prolonging opioid release for months that help overcome one of the most important drawbacks in achieving treatment success, namely, patient compliance. We review herein the different prolonged-release opioid dosage forms currently approved in Europe and/or the United States for the treatment of pain and opioid dependence.
Keywords: Opioids; Pain; Dependence; Prolonged-release solid oral dosage forms; Abuse deterrent technology; Transdermal patches; Implants; Microspheres
1. INTRODUCCIÓN
El consumo de analgésicos opioides ha experimentado un vertiginoso ascenso en las últimas décadas a nivel mundial. En concreto, se estima que el consumo de opioides en España aumentó un 98,51 % desde el año 2010 hasta el año 2020 (1). Los opioides son los analgésicos más potentes disponibles actualmente y deben su efecto a su acción sobre el sistema opioide endógeno.
El sistema opioide endógeno está formado por una amplia gama de péptidos y receptores presentes en el sistema nervioso central y periférico, el tracto gastrointestinal y el sistema inmunológico.
Por un lado, existen tres principales familias de péptidos opioides endógenos: β-endorfinas, encefalinas, y dinorfinas, expresados ampliamente a través de las vías neuronales y, en particular, las vías del dolor. Por otro lado, se han identificado tres clases principales de receptores opioides: µ, δ y κ. Estos tres receptores pertenecen a la familia de receptores acoplados a proteínas G. Su activación por agonistas opioides tiene como efecto común la atenuación de la percepción del dolor y la inhibición de la transmisión del estímulo nociceptivo mediante un mecanismo de hiperpolarización celular y reducción de los niveles de AMPc intracelular y de la liberación de neurotransmisores (2).
Sin embargo, cada uno de estos receptores tiene otros efectos y distribuciones específicas (3). Los receptores opioides µ, activados principalmente por endorfinas, fueron los primeros en ser descubiertos y se localizan en la corteza cerebral, el tálamo, la médula espinal y el tracto gastrointestinal. Son responsables de procesos específicos como sedación, depresión respiratoria, euforia y enlentecimiento del tránsito gastrointestinal (4). Los receptores opioides κ, unidos principalmente por dinorfinas, se localizan en el hipotálamo y en la sustancia gris del mesencéfalo y participan en la producción de efectos sedantes y disfóricos (5). Por último, los receptores opioides δ, unidos principalmente por encefalinas, están situados en los ganglios basales y su activación produce efectos ansiolíticos (6).
Los opioides son alcaloides derivados del opio (jugo extraído de las cápsulas de Papaver somniferum) y suelen atender a diferentes clasificaciones (7). Los opioides con indicación terapéutica autorizada pueden clasificarse, por un lado, atendiendo a su origen en: naturales (morfina, codeína); semisintéticos (buprenorfina, oxicodona, hidromorfona e hidrocodona) y sintéticos (metadona, fentanilo, tramadol, tapentadol, naloxona y naltrexona) (8). Por otro lado, atendiendo a como sea su interacción con los receptores opioides endógenos pueden clasificarse en: agonistas, (morfina, hidromorfona, tramadol, oxicodona, tapentadol, hidrocodona, codeína, metadona y fentanilo) (9); antagonistas (naloxona y naltrexona) (10) o agonistas parciales, con afinidad por el receptor pero menor capacidad de generar respuesta biológica que los agonistas (buprenorfina) (10).
El uso de analgésicos opioides se considera seguro cuando se consumen durante periodos de tiempo cortos y cuando se sigue la pauta posológica prescrita. Sin embargo, el empleo de opioides a largo plazo conlleva riesgo de adicción, donde el abuso del analgésico opioide prescrito podría suponer el paso previo al consumo de otros opioides no terapéuticos como la heroína, con riesgo de sobredosis potencialmente mortales (2). Las vías de administración más utilizadas para el abuso de los analgésicos opioides son la vía intravenosa o nasal (11). Tal es la magnitud que en 2017 se estima que en Europa 7380 personas murieron por sobredosis de opioides (12). Estos trastornos en la conducta por el uso crónico de opioides están altamente relacionados con los fenómenos de tolerancia, dependencia física y síndrome de abstinencia (13).
Por un lado, la tolerancia se define como la disminución de la respuesta farmacológica de un opioide tras una administración repetida o prolongada, llevando implícito la necesidad de consumir dosis cada vez mayores de fármaco para obtener un mismo efecto farmacológico (14). Por otro lado, la dependencia física es el estado de necesidad imperiosa de continuar el consumo de opioide que se manifiesta por la aparición de un síndrome de abstinencia ante la interrupción abrupta del consumo, la reducción rápida de la dosis, la disminución del nivel del fármaco opioide en sangre y/o la administración de un antagonista opioide. (15).
En este contexto, la formulación de opioides en sistemas de liberación prolongada supone ventajas terapéuticas considerables en la farmacología de opioides. En primer lugar, a nivel de analgésicos opioides, la liberación prolongada de fármacos favorece el cumplimiento terapéutico al aumentar los intervalos posológicos, además de reducir el riesgo de desarrollar adicción por disminuir las concentraciones máximas de opioides y aumentar los tiempos a los que éstas se alcanzan en comparación con formas de liberación inmediata. A tal efecto se han desarrollado sistemas de liberación prolongada por vía oral y transdérmica. En contrapartida, en el caso de sospecha de adicción a opioides, el aumento de dosis que conlleva el desarrollo de sistemas de liberación prolongada supone un mayor riesgo para el uso ilícito de los mismos, por lo que, en segundo lugar y de manera más reciente, los avances en formulación de opioides se han orientado hacia la implementación de recursos tecnológicos disuasorios de su utilización por vías alternativas a las autorizadas (16).
Por último, los sistemas de liberación modificada también juegan un papel esencial en el tratamiento de la dependencia a opioides, con el desarrollo de sistemas de administración parenteral capaces de prolongar la liberación de opioides durante meses, lo que supone sortear una de las mayores dificultades a la hora de alcanzar el éxito terapéutico en la deshabituación a opioides: que el tratamiento de mantenimiento no se vea influenciado por la voluntad del paciente para adherirse al mismo.
En este artículo se realiza una revisión bibliográfica de los diferentes sistemas de liberación prolongada de opioides que se encuentran aprobados en Europa y/o en Estados Unidos y que actualmente están comercializados para el tratamiento del dolor y de la dependencia a opioides.
2. Sistemas de liberación prolongada de opioides para el tratamiento del dolor
La Asociación Internacional para el Estudio del Dolor define dolor como una experiencia sensorial y emocional desagradable asociada con una lesión presente o potencial. El dolor se considera crónico cuando la duración es superior a tres meses, ya sea constante o intermitente (17,18). Las regiones principalmente afectadas son la cervical, la lumbar y la dorsal, además de las extremidades y las articulaciones.
La prevalencia de dolor crónico en Europa se estima en un 21% y en los Estados Unidos un 20,4 % (19,20). Debido al alto impacto que tiene el dolor crónico en nuestra sociedad no es de extrañar el alto número de recursos destinados a mejorar e individualizar el tratamiento de cada paciente. Se estima que los costes económicos directos e indirectos que supone el dolor crónico en España es del 2-2,8% del PIB (21,22).
Entre los factores de riesgo más comunes se encuentran: factores demográficos como la edad y el género, donde los pacientes de mayor edad y las mujeres son más propensas de sufrir dolor crónico (23); factores relacionados con el estilo de vida, observándose que el tabaco y alcohol aumentan la probabilidad de sufrir dolor crónico y que la realización de actividad física la disminuye; y, en último lugar, factores clínicos, ya que la probabilidad de padecer dolor crónico aumenta con la presencia de otras enfermedades como pueden ser depresión, obesidad y trastornos del sueño (24).
Los analgésicos opioides se han convertido en los fármacos de elección para el tratamiento de dolor crónico moderado-severo, dolor oncológico y dolor postoperatorio (25). Estas patologías se caracterizan por la exposición del paciente a largos periodos de dolor, por lo que el empleo de opciones terapéuticas que proporcionen largos periodos de analgesia va a mejorar la calidad de vida del paciente sustancialmente. Sin embargo, debido a que los analgésicos opioides tienen, en general, una vida media corta, su formulación en formas farmacéuticas de liberación inmediata solo permite periodos de analgesia de alrededor de 6 horas, dificultando así el cumplimiento posológico por parte del paciente por las frecuentes administraciones. Además, estas altas frecuencias de administración generan grandes fluctuaciones en las concentraciones de fármaco en sangre que aumentan el riesgo de sufrir efectos adversos (26).
Estos inconvenientes asociados a la dosificación frecuente son superados gracias al desarrollo de formas farmacéuticas de liberación prolongada. El objetivo de estas formulaciones, en las que la velocidad de liberación pasa a ser limitante en el proceso de absorción, es la prolongación de la liberación del principio activo en el tiempo, ofreciendo así varias ventajas frente a la liberación inmediata. Entre estas ventajas cabe destacar la exposición del paciente a periodos de analgesia más prolongados, permitiendo el espaciamiento de los intervalos posológicos, mejorando así el cumplimiento terapéutico por parte del paciente al requerir menor número de administraciones; y la obtención de concentraciones plasmáticas de fármaco más estables, reduciendo la incidencia de aparición de efectos adversos así como la probabilidad de generar adicción (27,28). Para el tratamiento del dolor crónico se han desarrollado formulaciones de liberación prolongada de analgésicos opioides por vía oral y transdérmica.
2.1. Sistemas de liberación prolongada por vía oral
La vía oral se caracteriza por ser una vía de administración cómoda y no invasiva (29). Un inconveniente asociado a esta vía es la biotransformación hepática que sufren ciertos fármacos administrados previa incorporación a circulación sistémica, conocido como efecto de primer paso hepático (30). Por tanto, la vía oral resulta adecuada para fármacos que no sufran un efecto de primer paso hepático muy intenso. La comodidad y no invasividad de la vía oral son aprovechadas para el desarrollo de formas farmacéuticas de liberación prolongada de analgésicos opioides por esta vía. Sin embargo, la principal limitación de los sistemas de liberación prolongada de administración por vía oral es que el tiempo durante el cual es factible prolongar la liberación del principio activo está restringido por factores fisiológicos, fundamentalmente por el tiempo de residencia de la forma farmacéutica en el tracto gastrointestinal (31).
Las formas farmacéuticas de liberación prolongada por vía oral son altamente susceptibles de ser alteradas ya que contienen mayor cantidad de fármaco activo que las formulaciones de liberación inmediata, y además son mucho más fáciles de manipular que otras formas farmacéuticas como pueden ser los parches transdérmicos. Entre las formas de abuso más comunes de opioides prescritos se encuentran: masticación, trituración o disolución de las formulaciones para posterior inhalación o inyección intravenosa. Para evitar que esto suceda se han desarrollado un nuevo tipo de formulaciones conocidas como formulaciones antiabuso (en inglés abuse-deterrent) que incorporan estrategias específicas diseñadas para limitar la capacidad de los usuarios de manipular la formulación del medicamento, evitando su posible abuso (32). Hasta la fecha, dos estrategias antiabuso se han incorporado a formas farmacéuticas orales de liberación prolongada comercialmente disponibles en clínica. La primera estrategia consiste en incorporar barreras físicas o químicas a la formulación que proporcionan resistencia a la alteración mecánica para evitar el masticado/triturado y posterior inhalación o inyección intravenosa. Las barreras físicas están diseñadas para resistir los daños causados por los utensilios domésticos comunes y las barreras químicas están diseñadas para evitar la extracción utilizando agua, alcohol u otros disolventes orgánicos. La segunda estrategia consiste en incorporar a la formulación antagonistas opiáceos que tengan baja biodisponibilidad por vía oral y, por lo tanto, no contrarresten las propiedades analgésicas de la formulación cuando se administren por esta vía, pero reduzcan o contrarresten la euforia inducida por el analgésico opioide cuando se utilicen por inhalación o inyección intravenosa (33).
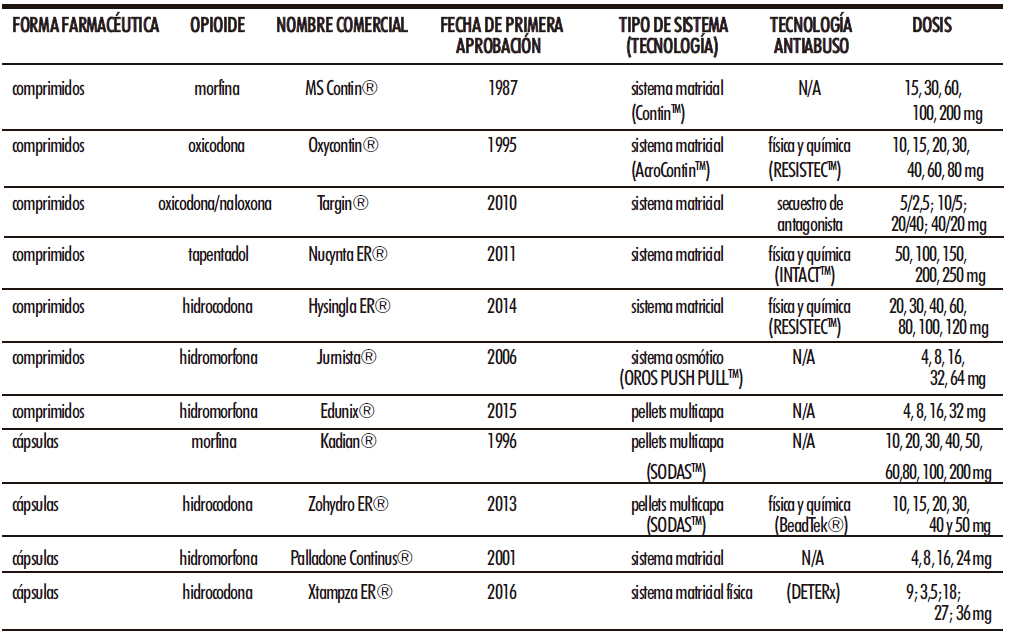
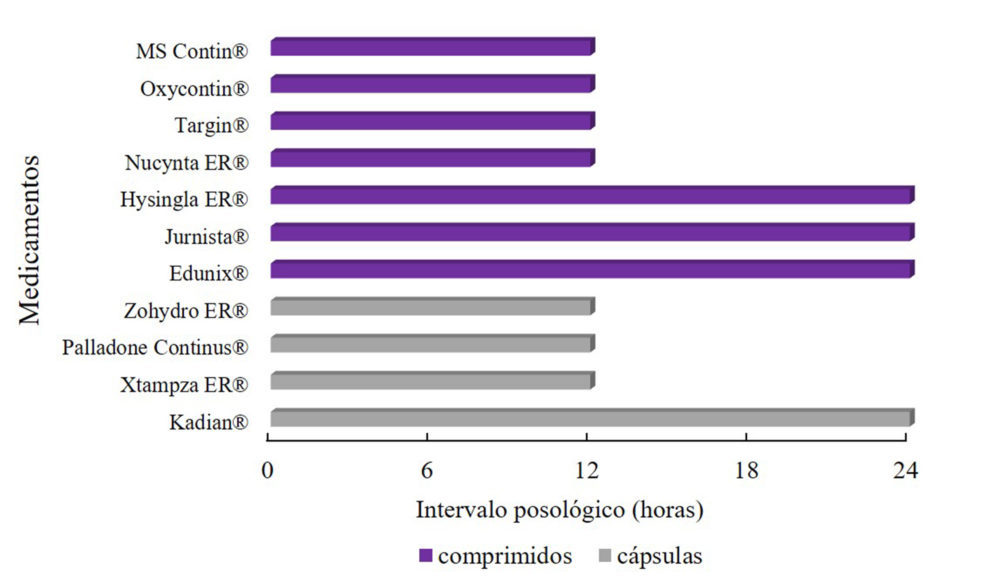
Se han desarrollado comprimidos y cápsulas de liberación prolongada (Tabla 1) capaces de prolongar la liberación de analgésicos opioides en hasta 24 horas (Figura 1).
Tabla 1. Formulaciones de liberación prolongada de opioides para administración por vía oral autorizadas para el tratamiento del dolor
Figura 1. Intervalo posológico de los sistemas de liberación prolongada por vía oral para el tratamiento del dolor que se encuentran actualmente autorizados en Europa y/o Estados Unidos
2.1.1. Comprimidos
Existen varias estrategias tecnológicas que han servido de base para la formulación de opioides en comprimidos de liberación prolongada por vía oral.
En primer lugar, se encuentran los sistemas matriciales. En este tipo de sistemas el fármaco se dispersa uniformemente en una matriz polimérica, que controla el acceso del medio de disolución al interior de la formulación y dificulta por lo tanto la difusión hacia el exterior de las moléculas del principio activo en solución, controlando así la velocidad de liberación (29). La primera formulación comercial basada en los sistemas matriciales para controlar la liberación de los analgésicos opioides fue MS Contin®, aprobada en 1987 por la Food and Drug Administration (FDA). Además, ha sido aprobada para su uso en Europa bajo el nombre de MST Continus® en 1996. Utiliza la plataforma Contin para prolongar la liberación de morfina, permitiendo así pautas de administración cada 12 horas (34). Esta plataforma matricial está constituida en esencia por una mezcla de varios polímeros hidrofílicos, como son la hidroxipropilmetilcelulosa y la hidroxietilcelulosa que contienen el fármaco disperso en su interior, y alcoholes alifáticos de alto peso molecular como es el alcohol cetoestearílico. El proceso tecnológico es el siguiente: primero se dispersa la morfina en los polímeros hidrofílicos, que, tras la mezcla, son sometidos a procesos de granulación, tamización y secado. Después, los gránulos matriciales obtenidos se mezclan con los alcoholes de alto peso molecular previamente granulados y se mezclan formando un masa granulada uniforme. Para terminar, esta mezcla se somete a un proceso de compresión para formar el comprimido final. Cuando se administran estos comprimidos, el medio acuoso del tracto gastrointestinal difunde hasta el interior de la formulación y provoca que los polímeros hidrofílicos se hinchen formando un gel viscoso cuyo grado de hidratación va a estar controlado y limitado por los alcoholes de alto peso molecular hidrofóbicos. La difusión del principio activo va a depender del grado de difusión a través del gel hidratado (35).
Mejoras tecnológicas en el sistema matricial Contin dieron lugar a AcroContin, plataforma utilizada con oxicodona bajo el nombre comercial de Oxycontin®, medicamento aprobado en 1995 por la FDA y en 1998 en varios países europeos como son Austria, España, Irlanda e Italia. Al igual que su predecesor, también está formado por alcoholes alifáticos de elevado peso molecular como componente hidrofóbico; sin embargo, utiliza un copolímero de metacrilato de amonio en lugar de un polímero de celulosa hidrofílico como polímero controlador de la liberación de oxicodona (36). Una ventaja importante de este sistema frente a su predecesor es que cuando los comprimidos entran en contacto con los fluidos gastrointestinales, se produce una liberación inmediata de oxicodona durante la primera hora (30-40% de la dosis) provocada por la disolución y difusión del fármaco que se encuentra en los gránulos de la superficie del comprimido y, a continuación, se produce una liberación sostenida de hasta 12 horas, a medida que el fluido va penetrando a través de la matriz polimérica y va disolviendo el fármaco (35). Debido al incremento en los casos de abuso de formulaciones de opioides, en 2010 se reformuló Oxycontin® utilizando la tecnología RESISTECTM, una estrategia antiabuso basada en el uso de óxido de polietileno de alto peso molecular (PEO) para formar una barrera física que impide la posibilidad de que los comprimidos se puedan triturar. Además, en contacto con un disolvente, el PEO se convierte en un gel viscoso que impide su uso por vías nasal e intravenosa (37,38).
Otras tres formulaciones basadas en sistemas matriciales han sido aprobadas. La primera de ellas es Targin®, comprimidos de oxicodona y naloxona embebidos en una matriz formada por etilcelulosa y alcohol estearílico que recibieron aprobación en varios países de Europa (entre ellos España) en 2010 (39). Targin® fue aprobado por la FDA bajo el nombre de Targiniq® en 2014 pero suspendido un tiempo después. Además, incorpora como medida antiabuso la presencia de un antagonista opioide dentro de la formulación matricial. La naloxona por vía oral sufre un fuerte efecto de primer paso, por lo que su biodisponibilidad tras administración oral es inferior al 3% y no es suficiente para antagonizar los efectos de la oxicodona. Sin embargo, cuando se altera la formulación para posterior administración por otras vías el antagonista reducirá o contrarrestará el efecto del fármaco agonista (40,41). Su pauta posológica es cada 12 horas. El segundo es Nucynta ER®, formulación de tapentadol aprobada en 2011 por la FDA. Está formulado en una matriz basada en la tecnología antiabuso INTACTTM. Esta tecnología consiste en la mezcla de PEO, hipromelosa y polietilenglicol (PEG) formando una matriz, donde el PEO provee de dureza y viscosidad suficiente al comprimido para dificultar su manipulación y administración por vías alternativas a la oral (42). En cuanto a posología se administra cada 12 horas. En Europa, los comprimidos de liberación prolongada de tapentadol han sido autorizados con el nombre de Palexia Retard® y Yantil Retard®. El último medicamento es Hysingla ER®, comprimidos de hidrocodona aprobados por la FDA en 2014. La matriz está compuesta por hidroxipropilcelulosa (HPC) y PEG como polímeros controladores de la liberación (43). Hysingla ER® utiliza la tecnología RESISTECTM, misma tecnología antiabuso que OxyContin®, basada en el uso del polímero PEO, dando dureza y viscosidad al comprimido para que sea de mayor dificultad su administración por vías alternativas (40,44). Hysingla ER® se administra cada 24 horas y no ha sido aprobado en Europa.
Una segunda estrategia tecnológica es la utilización de sistemas osmóticos. La hidromorfona representa el primer opioide en ser comercializado utilizando la plataforma OROS (osmotic-controlled release oral delivery system) Push-PullTM. Esta tecnología consiste en un comprimido bicapa recubierto por una membrana semipermeable y con una perforación en una de sus caras. La capa inferior o capa de empuje contiene un polímero hidrófilo (agente polimérico osmótico) capaz de formar un hidrogel expandible que empuja el compartimento superior o capa del fármaco. Este comprimido osmótico actúa mediante el efecto combinado de la hidratación de sus dos compartimentos de modo que, inicialmente la capa del fármaco absorbe agua suficiente para formar una suspensión o solución que será expulsada a través del orificio de salida tan pronto como se dé la expansión y empuje por parte del compartimento inferior previamente hidratado (45,46). Esta plataforma es adecuada para fármacos con solubilidad intermedia como la hidromorfona y su velocidad de liberación es proporcional al gradiente osmótico formado. El único producto comercializado es Jurnista® cuya frecuencia de administración es cada 24 horas. Este medicamento solo ha sido aprobado para su uso en Europa.
Una última modalidad para la formulación de comprimidos de liberación prolongada de opioides consiste en la formulación de pellets multicapa que, posteriormente, son comprimidos para formar la formulación final. Es el caso de Edunix®, comprimidos de hidromorfona que permite una liberación prolongada de hidromorfona de hasta 24 horas. El proceso tecnológico consiste en añadir diferentes capas de principio activo y polímeros a una esfera inerte de azúcar: la primera capa lleva hidromorfona y PEG, la segunda propilenglicol, HPC y etilcelulosa y la tercera y última lleva hidromorfona, PEG e hidroxipropilmetilcelulosa. Para finalizar, estos pellets multicapa se comprimen para formar los comprimidos de liberación prolongada (47). Edunix® no ha recibido aprobación por la FDA, solo está disponible para su uso en clínica en varios países de la Unión Europea. En concreto, en España se aprobó en 2015.
2.1.2. Cápsulas
Al igual que en el caso de comprimidos, existen varias estrategias tecnológicas a la hora de formular fármacos opioides en cápsulas de liberación prolongada.
En primer lugar, la incorporación de pellets o perlas multicapa dentro de la cápsula. Utilizan la tecnología SODASTM (Spheroidal Oral Drug Absorption System), que consiste en recubrir un núcleo inerte con una capa de principio activo a la que, a su vez, se recubre con posteriores capas de polímeros controladores de la liberación. Dos medicamentos formulados con esta tecnología están disponibles para su uso en clínica. El primero de ellos recibió aprobación por la FDA en 1996 bajo el nombre comercial de Kadian® y consiste en pellets rodeados por una cubierta de morfina que, a su vez, es rodeada por otra cubierta formada por dos agentes solubles controladores de la liberación diferentes, PEG y un copolímero de acrilato de etilo y ácido metacrílico (Eudragit), cuya solubilidad es dependiente del pH. Una vez que la formulación se administra, la cápsula de gelatina dura se disuelve y libera los pellets en el tracto gastrointestinal. En el pH ácido del estómago, el componente PEG del recubrimiento de polímero se disuelve inmediatamente creando poros que permiten una liberación inmediata de morfina. Sin embargo, como sólo el componente PEG puede disolverse en ese punto, los poros son relativamente pequeños, lo que limita la difusión del principio activo. A medida que aumenta el pH, el copolímero comienza a disolverse aumentando el número y el tamaño de los poros, incrementando por tanto la velocidad de liberación del fármaco (48). Kadian® debe ser administrado cada 24 horas. El segundo medicamento es Zohydro ER®, formulación de hidrocodona aprobada por la FDA en 2013. En este caso utiliza como núcleo perlas rodeadas por dos cubiertas, una primera cubierta de hidrocodona, y una segunda cubierta formada por un copolímero de metacrilato de amonio controlador de la liberación, que gracias a su permeabilidad permite que el líquido gastrointestinal entre y vaya solubilizando el principio activo, provocando, al igual que Kadian®, primero una liberación inmediata de principio activo y una posterior liberación prolongada en el tiempo (49). Debido a que la tecnología SODASTM no ofrece protección contra la posible manipulación intencionada de la formulación, la empresa responsable de la formulación de Zohydro ER® decidió añadir la tecnología BeadTek® para evitar posibles manipulaciones. Esta segunda tecnología consiste en la formulación de perlas de PEO con la misma apariencia que las perlas de hidrocodona y su incorporación dentro de la cápsula dura. Así se consigue que ambas perlas sean físicamente indistinguibles y se dote a la formulación de la rigidez suficiente para evitar la manipulación por parte del paciente (50). La frecuencia de administración de Zohydro ER® es cada 12 horas. Kadian® y Zohydro ER® no han sido aprobados en Europa.
La segunda estrategia tecnológica es la incorporación dentro de la cápsula de sistemas matriciales, ya sean gránulos o microesferas de liberación controlada. Existen dos medicamentos disponibles en el mercado dentro de este grupo. Por un lado, Palladone Continus®, formulación de hidromorfona aprobada en 2001 para su uso en varios países europeos, incorpora gránulos matriciales formulados mediante el método de extrusión por fusión. En este método se dispersa la hidromorfona en una matriz compuesta por polímeros hidrofóbicos controladores de la liberación como la etilcelulosa que, a continuación, se funde y se pasa a través de un cilindro extrusor formando largas fibras que posteriormente son cortadas para formar los gránulos matriciales de liberación controlada (31). Este medicamento fue aprobado por la FDA en 2004 bajo el nombre de Palladone®, pero retirado al cabo de un tiempo. Se debe administrar cada 12 horas. Por otro lado, Xtampza ER® fue aprobado en 2016 y consiste en cápsulas que incorporan microesferas de liberación prolongada de hidrocodona. Xtampza ER® está formulado con la tecnología antiabuso DETERx, que se caracteriza porque cada microesfera contiene oxicodona homogéneamente dispersa dentro de una matriz hidrofóbica formada por ácidos grasos y ceras que permiten controlar la liberación de oxicodona y además son capaces de resistir el aplastamiento, la masticación, el calentamiento y la disolución, lo que dificultará la administración por vías alternativas a la oral en caso de abuso (51). Estudios in vitro han demostrado que, tras manipulación de la formulación, Xtampza ER® es capaz de mantener las propiedades de liberación prolongada en mayor medida que otras formulaciones con tecnologías antiabuso como OxyContin® (52). Xtampza ER® no está aprobado en Europa y su frecuencia de administración es cada 12 horas.
2.2. Sistemas de liberación prolongada por vía transdérmica
Los sistemas de liberación prolongada por vía transdérmica están diseñados para la administración de un principio activo a través de la piel de una forma no invasiva, simple, segura y efectiva, con el objetivo de ejercer un efecto sistémico tras su liberación y absorción a través de las membranas cutáneas. Las principales ventajas de la administración de formas farmacéuticas de liberación prolongada por vía transdérmica son la obtención de concentraciones plasmáticas de fármaco más estables, espaciamiento en los intervalos posológicos y reducción de los efectos secundarios en comparación con las formas farmacéuticas de liberación inmediata (53). En concreto, el uso de parches transdérmicos permite alcanzar liberaciones constantes de principio activo siguiendo una cinética de orden cero (54). Por lo tanto, los parches transdérmicos deben ser considerados como sistemas de liberación sostenida donde los intervalos posológicos son mayores que los logrados por vía oral. Además, los fármacos administrados por vía transdérmica no sufren efecto de primer paso hepático, por lo que los analgésicos opioides cuya administración por vía oral sea inviable debido a que sufren una fuerte metabolización hepática, son fármacos idóneos para su incorporación en parches transdérmicos (55).
Una de las mayores limitaciones en el desarrollo de sistemas de liberación prolongada por vía transdérmica es el bajo número de principios activos que cumplen los requerimientos específicos para atravesar el estrato córneo. El grado de difusión del fármaco a través de la piel es directamente proporcional al coeficiente de difusión del fármaco, al coeficiente de reparto octanol:agua y a la concentración del fármaco en la formulación. A su vez, el coeficiente de difusión es inversamente proporcional al peso molecular del fármaco. En general, fármacos con un coeficiente de reparto intermedio, no iónicos, con un peso molecular bajo y con elevada potencia analgésica son adecuados para la incorporación a parches transdérmicos (56). Debido a la dificultad de encontrar
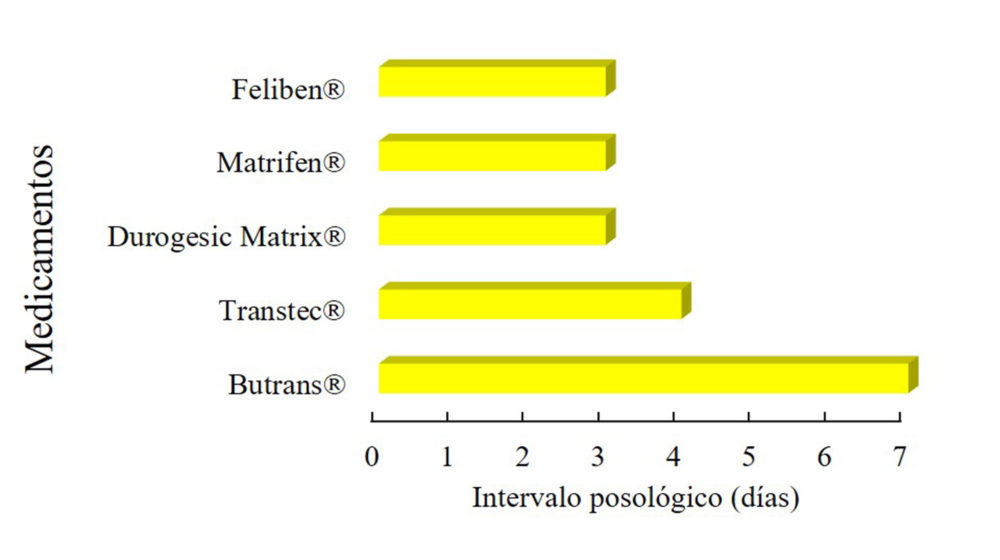
principios activos que reúnan todos estos requisitos, tan solo dos opioides (fentanilo y buprenorfina) se han formulado y comercializado en parches transdérmicos para su uso en clínica como analgésicos (Tabla 2). La razón es que el fentanilo tiene un peso molecular de 336,5 g/mol, un coeficiente de reparto de 813:1 y es unas 100 veces más potente que la morfina (57) y, la buprenorfina, tiene un peso molecular de 467 g/mol, un coeficiente de reparto de 1281:1 y es 30 veces más potente que la morfina (58). Sumado a esto, ambos sufren un gran efecto de primer paso hepático: la biodisponibilidad oral es, en el caso de la buprenorfina, de 10-15% y, en el caso del fentanilo, de 32% (59,60). Se han conseguido diseñar formulaciones de estos dos fármacos capaces de prolongar la liberación entre 3 y 7 días (Figura 2).
Tabla 2. Formulaciones de parches transdérmicos de liberación sostenida de opioides para administración por vía transdérmica autorizadas para el tratamiento del dolor. * En este caso, la dosis se ha calculado según la ecuación: Dosis (mg)=constante de cesión de orden cero (μg/h)*duración del intervalo posológico (horas)*1000
Figura 2: Intervalo posológico de los parches de liberación prolongada para el tratamiento del dolor que se encuentran actualmente autorizados en Europa y/o Estados Unidos
Una estrategia para la formulación de parches transdérmicos de liberación sostenida es la utilización de sistemas reservorio. Poseen una zona o depósito donde se encuentra el principio activo y otra zona que contiene una membrana polimérica, la cual controlará la liberación del fármaco desde el dispositivo. La primera formulación de parches transdérmicos basada en sistemas reservorio conteniendo opioides fue Duragesic®, parches de fentanilo aprobados por la FDA en 1990. Sin embargo, un problema importante asociado a este sistema es la liberación abrupta de fentanilo en caso de que la membrana controladora de la liberación sufra algún tipo daño ya sea accidental o intencionado (61). Esto generó una gran preocupación ante la posibilidad de aumento de intentos de abuso de la formulación y sirvió de precedente para la introducción de mejoras en el sistema que evitasen la liberación repentina de fentanilo en caso de manipulación. Así, Duragesic® fue suspendido, reformulado y reaprobado por la FDA en parches basados en un sistema matricial en vez de reservorio. Esta estrategia consiste en la dispersión de fentanilo en una matriz polimérica adhesiva de poliacrilato controladora de la liberación rodeada por una capa de soporte externa de acetato de etileno vinílico y tereftalato de polietileno. Además, lleva una lámina interior protectora de tereftalato de polietileno que debe ser retirada antes de adherir los parches a la superficie de la piel. Los parches se deben retirar cada 72 horas. Los parches matriciales de fentanilo están comercializados en Europa bajo el nombre de Durogesic Matrix® (conocido también como Durogesic DTrans® y Durogesic SMAT®) (62). Una última formulación de fentanilo recibió autorización para su comercialización en Europa en 2007 bajo el nombre de Matrifen® (conocida también bajo el nombre de Fendivia®). No ha sido aprobado por la FDA. Se diferencia de las formulaciones anteriores en que consiste un sistema mixto, formado por una matriz de silicona con gotas de dipropilenglicol y fentanilo dispersados en su interior rodeada por una membrana controladora de la liberación. Esta membrana de control supone una barrera adicional para evitar el posible efecto de liberación repentina del principio activo contenido en la matriz, por lo que dota de mayor seguridad al parche transdérmico (63,64). Matrifen® se deben retirar también cada 72 horas.
También se han desarrollado parches de buprenorfina utilizando sistemas matriciales (65). Estos se agrupan en dos categorías diferentes en función del valor de sus constantes de liberación de orden cero conseguidas en su desarrollo tecnológico. Por un lado, están los parches con constantes de liberación de orden cero altas (35;52,5;70 µg/hora), que solo han recibido aprobación en Europa. Son conocidos bajo los nombres comerciales de Transtec® y Feliben®, aprobados en 2002 y 2009, respectivamente. Las matrices de estos dos medicamentos están compuestas por copolímeros acrílicos en el caso de Transtec® y por copolímeros de estireno-butadieno en el caso de Feliben® (66). Estas altas constantes de liberación hacen que los parches tengan intervalos posológicos más cortos, por ejemplo, Transtec® debe ser retirado cada 4 días y Feliben® cada 3. Por otro lado, están los parches transdérmicos de buprenorfina de constantes de liberación bajas (5,10 y 20 µg/hora). Destaca Butrans®, aprobado en 2010 por la FDA, cuya matriz adhesiva está compuesta por ácido levulínico, povidona, oleato de oleilo y poliacrilato de aluminio. Estas bajas constantes de liberación permiten intervalos posológicos mayores. En concreto, los parches deben retirarse cada 7 días (67). Además, ha sido aprobado en varios países de Europa bajo el mismo nombre (Butrans®) o con otros nombres comerciales (Norspan®).
3. Sistemas de liberación prolongada de opioides para el tratamiento de la dependencia a opioides
En general, los analgésicos opioides son seguros cuando se toman durante periodos de tiempo cortos y bajo la pauta posológica prescrita. Sin embargo, el consumo regular de este tipo de analgésicos, que, además de calmar el dolor, poseen efectos euforizantes, podría originar en los pacientes conductas adictivas motivadas por una necesidad continua de consumir el fármaco de forma diferente a la indicada, en mayores dosis o sin prescripción médica, generando la dependencia a opioides. La dependencia a opioides, como el resto de los trastornos por abuso de sustancias adictivas, se caracteriza por una serie de síntomas cognitivos, comportamentales y fisiológicos como son la interrupción de la capacidad del individuo para priorizar comportamientos que resultan beneficiosos a largo plazo sobre aquellos que brindan recompensas emocionales a corto plazo, y la creciente dificultad de ejercer control sobre estos comportamientos. Todos estos síntomas llevan a la persona a seguir consumiendo a pesar de los problemas significativos que ocasionan (68).
El uso inapropiado de los opioides, derivado de las conductas adictivas, puede llevar a situaciones de sobredosis e incluso a causar la muerte (69). La mortalidad derivada del consumo ilícito ha supuesto un importante problema de salud pública que afecta principalmente a América del Norte, Asia y Europa. Concretamente, la Organización Mundial de la Salud (OMS) estima que el daño causado por el uso de opioides es de 11,2 millones de años de vida ajustados por discapacidad. De hecho, la OMS en su informe anual sobre drogas, comunicó que el 78% de las muertes por sobredosis de sustancias en Europa son causadas por opioides (11).
Este consumo inapropiado se puede producir con cualquier sustancia opiácea, tanto con analgésicos opioides autorizados, como con drogas que no se encuentran autorizadas como medicamentos, como es el caso de la heroína. Actualmente, respecto a cuáles son las drogas más consumidas, se observa un cambio de tendencia de la heroína a otros opioides como la metadona, la buprenorfina y el fentanilo. De hecho, el 69% de las muertes por opioides son ocasionadas por fentanilo o por análogos de fabricación ilegal (11,70,71).
Los pacientes adictos se administran estas drogas fundamentalmente por vía intravenosa o inhalada, esto se debe a que por estas vías se producen incrementos rápidos de concentraciones plasmáticas, lo que se traduce en una intensificación del efecto euforizante (70). Un problema derivado de este comportamiento radica en el hecho de que las personas que se inyectan drogas generalmente comparten elementos de inyección, lo que favorece la propagación de virus como el virus de la inmunodeficiencia humana y el virus de la hepatitis C (72).
Por lo tanto, el objetivo primordial de la deshabituación a opioides persigue restablecer el estado físico del individuo, así como conseguir que el paciente adicto deje de ser dependiente del fármaco e incluso prevenir que vuelva a usarlo en el futuro, al mismo tiempo que se reducen las conductas de riesgo. Para conseguir estos objetivos, el tratamiento farmacológico empleado debe conseguir regular la actividad del sistema opioide endógeno, que en estos pacientes se encuentra disfuncional. Con este fin se emplean fármacos agonistas (metadona), antagonistas (naltrexona) y agonistas parciales (buprenorfina) de los receptores del sistema opioide endógeno (73).
Uno de los principales inconvenientes de la terapia convencional, basada en la administración de agonistas, antagonistas o agonistas parciales de liberación inmediata de forma diaria, es el riesgo de aparición de los síntomas de un síndrome de abstinencia, lo que contribuiría a incrementar el riesgo de recaída en los pacientes. Por otro lado, para que el paciente pierda el hábito de consumo, es necesario el empleo de un tratamiento de mantenimiento, lo que limita mucho las posibilidades de éxito de la terapia con los sistemas de liberación inmediata (74).
Estas limitaciones, junto con el hecho de que los pacientes dependientes a opioides presentan bajas tasas de adherencia al tratamiento de forma voluntaria, ocasionan una falta de cumplimiento terapéutico, resultando en el fracaso de la terapia convencional, lo que estimuló la búsqueda de nuevas formulaciones alternativas, desarrollándose así los sistemas de liberación prolongada (75). Estos nuevos sistemas para la administración de fármacos opioides ofrecen una serie de ventajas como son la posibilidad de mantener el efecto terapéutico durante largos periodos de tiempo tras una única administración, lo que resulta especialmente importante en aquellos fármacos con una corta semivida plasmática. Esta prolongación del efecto terapéutico permite reducir las frecuencias de administración y con ello conseguir mejorar la adherencia (76).
3.1. Sistemas de liberación prolongada por vía parenteral
Los sistemas de liberación prolongada de administración parenteral alcanzan intervalos de administración mucho mayores a los conseguidos con este tipo de sistemas por vía oral y vía transdérmica. Además, los fármacos que pueden incluirse en los sistemas de liberación prolongada por vía parenteral (antagonistas opioides y agonistas parciales) no presentan riesgo de abuso, lo que permite diseñar sistemas con elevadas dosis de principio activo. Estas dos ventajas que se consiguen con estos sistemas resultan idóneas para conseguir la adherencia al tratamiento y por lo tanto el éxito del mismo (77). Además, el hecho de que sólo se hayan desarrollado sistemas de liberación modificada por vía parenteral para el tratamiento de la dependencia a opioides, a diferencia del tratamiento dolor, para el cual se han desarrollo presentaciones por vía oral y por vía transdérmica, se justifica con el hecho de que el empleo de estas últimas vías está íntimamente relacionado con la voluntad del propio paciente para mantener la adherencia al tratamiento. Sin embargo, en el caso de la vía parenteral, el paciente no puede interrumpir su tratamiento (78).
Uno de los inconvenientes de estos sistemas es que deben estar formulados con polímeros de máximo grado de biocompatibilidad, pudiendo ser estos biodegradables o no (implicando en este último caso la necesidad de una intervención para su retirada). La vía parenteral es la vía de elección para la administración de principios activos de semivida corta como es el caso de naltrexona (4 horas) y buprenorfina (2,2 horas) (79). Asimismo, también son candidatos para este tipo de sistemas fármacos que sufran un intenso efecto de primer paso hepático como es el caso de naltrexona, de la cual el 98% es metabolizado en el hígado (80).
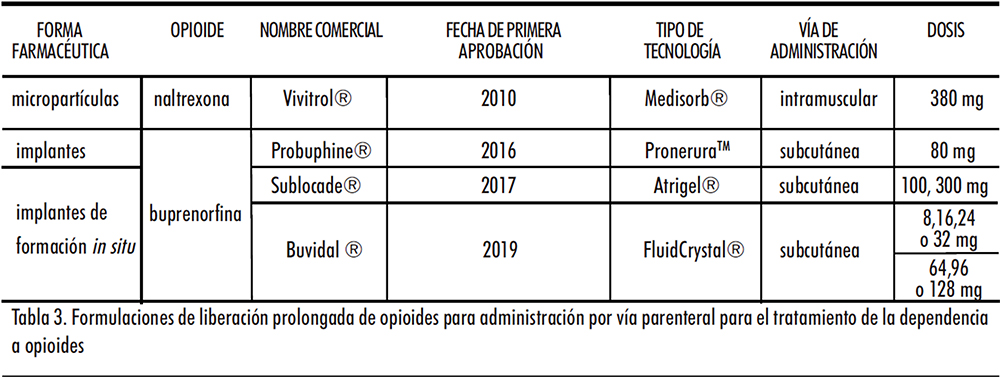
Los únicos dos fármacos para los cuales se han desarrollado sistemas de liberación prolongada de administración parenteral para el tratamiento de la dependencia a opioides son la naltrexona y la buprenorfina (Tabla 3). Estos sistemas consiguen incrementar los intervalos posológicos hasta un máximo de seis meses (Figura 3).
3.1.1. Microesferas
Las microesferas son sistemas coloidales poliméricos que encapsulan el fármaco y lo liberan de manera prolongada mediante mecanismos de difusión y erosión del polímero (81). Vivitrol® emplea microesferas biodegradables como sistema de liberación prolongada de naltrexona. Este sistema fue aprobado por la FDA en 2010 para el tratamiento de la dependencia a opioides, sin embargo, no se encuentra aprobado en Europa. La posología de Vivitrol® corresponde con una dosis de 380 mg administrada cada 4 semanas por vía intramuscular en la región del glúteo (82).
En el desarrollo de Vivitrol® se ha empleado la tecnología Medisorb®, por la cual la naltrexona es encapsulada en una matriz del copolímero poli-(D-L-láctico-co-glicólico) (PLGA) en una proporción 75:25 láctico: glicólico, formando así microesferas de 100 µm (83). La liberación de la naltrexona desde las microesferas sucede en tres fases. En primer lugar, durante las primeras 24 horas se produce la hidratación del polímero, lo que produce que se hinchen las microesferas. Posteriormente, tras 48 horas, tiene lugar la difusión de naltrexona a través del polímero, esta difusión proporciona una liberación sostenida de la naltrexona durante 30 días; esta rapidez en la instauración de la liberación permite que no haya que acudir a la suplementación oral de naltrexona en las etapas iniciales. Finalmente, en la tercera y última fase el polímero se erosiona completamente transformándose en ácido láctico y glicólico, los cuales se metabolizan a compuestos fisiológicos que son eliminados por las vías habituales. De esta forma este sistema permite mantener concentraciones constantes del fármaco evitando así las posibles fluctuaciones que ocurren con las formas orales de liberación inmediata de naltrexona, lo que permite reducir los posibles efectos adversos, aumentar la eficacia, y mejorar el cumplimiento terapéutico (84,85).
3.1.2. Implantes
Los implantes son dispositivos sólidos que permiten una liberación prolongada de fármaco una vez que son insertados en el organismo.
Probuphine® es un implante cilíndrico de unos 26 mm de longitud y 2,5 mm de diámetro que fue aprobado en 2016 por la FDA y en 2019 por la EMA, donde recibe el nombre de Sixmo®. Está aprobado como tratamiento de mantenimiento en la dependencia a opioides en adultos clínicamente estables. La posología de Probuphine® corresponde con una dosis de 80 mg administrada por vía subcutánea en la parte superior del brazo. La liberación de la buprenorfina a partir de este sistema se prolonga durante 6 meses, a lo largo de los cuales el sistema proporciona dosis regulares y constantes del fármaco (86). En situaciones normales este tratamiento no requiere suplementación con buprenorfina sublingual; sin embargo, en determinadas circunstancias, como estrés o síntomas de abstinencia sí que sería necesario (87).
En el desarrollo de Probuphine® se ha empleado la tecnología ProNeuraTM. Este sistema consiste en una matriz polimérica no biodegradable de etil-vinil-acetato (EVA) a partir de la cual el fármaco se va liberando. Las complicaciones más graves relacionadas con el empleo de este sistema están relacionadas con la inserción y la retirada del sistema (88).
3.1.3. Implantes de formación in situ
Los implantes de formación in situ son sistemas de liberación prolongada de fármacos que se administran en forma de suspensiones y forman el implante en el organismo una vez administrados. Existen dos implantes de liberación in situ para la liberación prolongada de buprenorfina: Buvidal® y Sublocade®. Ambos son sistemas biodegradables, por lo que no requieren de ninguna intervención para su retirada (89).
3.1.3.1 Sublocade®
El implante de formación in situ Sublocade® fue aprobado por la FDA en 2017; sin embargo, aún no ha sido aprobado en Europa. En Estados Unidos, está indicado para el tratamiento de la dependencia a opioides moderada-severa en aquellos pacientes que han conseguido ser estabilizados con buprenorfina sublingual durante un periodo de al menos 7 días. Es un medicamento de liberación prolongada de inyección subcutánea en la zona abdominal de la cual existen actualmente dos presentaciones comercializadas: una con 100 mg y otra con 300 mg de buprenorfina. La transición a Sublocade® desde las formas farmacéuticas sublinguales debe hacerse inicialmente con la presentación de 300 mg durante dos meses, seguido de la dosis de 100 mg durante un periodo de mantenimiento. En ambos casos la duración de la liberación de buprenorfina a partir del sistema es de 1 mes (90). Sublocade®, a diferencia de otros sistemas, debe conservarse en refrigeración (2-8 ºC) debido a que su estabilidad no supera los 7 días a temperatura ambiente (87).
Para desarrollar este sistema de buprenorfina se empleó la tecnología Atrigel®, que consiste en la incorporación del fármaco en una solución polimérica que contiene el copolímero biodegradable PLGA, en una proporción 50:50 láctico: glicólico, disuelto en el disolvente N-metil-2 pirrolidona, solvente biocompatible y miscible en agua (91). Después de la inyección subcutánea de esta solución polimérica, la N-metil-2 pirrolidona difunde hacia los fluidos biológicos ocasionando la liberación inicial del principio activo solubilizado en el solvente orgánico y desencadenando la gelificación del polímero, formando así el implante. Sublocade® libera buprenorfina de forma prolongada durante 1 mes a medida que el polímero va degradándose y dado que al mismo tiempo que se forma el implante comienza la liberación de buprenorfina, no sería necesario suplementación sublingual al principio (92).
3.1.3.2 Buvidal®
El implante de formación in situ Buvidal® fue aprobado por la EMA en 2019 para el tratamiento de la dependencia a opioides al inicio del mismo o como alternativa a la buprenorfina sublingual, pero no se encuentra aprobado por la FDA (93). Actualmente existen 2 formas de Buvidal®, ambas precisan una única administración; sin embargo, la duración de la liberación de buprenorfina es diferente en función de la viscosidad del disolvente empleado para formar el sistema. Si el solvente empleado es etanol, la duración del sistema es de una semana (diferentes dosis: 8, 16, 24 o 32 mg), mientras que si el solvente es N-metil-2-pirrolidona se consiguen niveles mantenidos de buprenorfina durante 1 mes (diferentes dosis: 64, 96 o 128 mg) (94).
Este sistema se obtiene mediante una tecnología denominada FluidCrystal®. Esta tecnología está basada en el uso de un solvente junto con dos lípidos naturales: fosfatidilcolina y dioleato de glicerol. Estos dos lípidos encapsulan la buprenorfina en una matriz de cristal, que se transforma en un gel viscoso tras la difusión del solvente al entrar en contacto con el entorno acuoso del lugar de administración y se va degradando lentamente liberando así el fármaco de forma prolongada (95).
4. DISCUSIÓN
El incesante intento de la tecnología farmacéutica por buscar alternativas a la terapia convencional en el tratamiento del dolor y de la dependencia a opioides ha llevado al desarrollo de sistemas de liberación prolongada de fármacos opioides. Aunque muchos de estos sistemas están aprobados tanto por la FDA como por la EMA, algunos solo se encuentran aprobados en Estados Unidos (Kadian®, Vivitrol®, Sublocade®), mientras que otros solo se encuentran aprobados en Europa (Matrifen®, Edunix® y Buvidal®).
Aunque estos sistemas se han desarrollado para la administración de opioides en ambas patologías, los sistemas desarrollados para el tratamiento del dolor aparecieron aproximadamente 30 años antes que los primeros sistemas desarrollados para el tratamiento de la dependencia a opioides. Esto implica que para el tratamiento del dolor hayan aparecido medicamentos genéricos, mientras que para el tratamiento de la dependencia a opioides no (96). Si bien la irrupción de medicamentos genéricos contribuye a la sostenibilidad de los sistemas sanitarios al suponer un ahorro por el hecho de entrar en competencia directa dos tipos de medicamentos que poseen ambos autorización de comercialización para una misma indicación, desde el punto de vista de los laboratorios farmacéuticos de medicamentos innovadores, dicha irrupción ha supuesto en muchos casos la suspensión de la comercialización de determinados medicamentos como es el caso de Avinza®, Oramorph SR® u Opana ER® (97).
Respecto al tratamiento del dolor, estos sistemas de liberación prolongada permiten disminuir la frecuencia de administración y las fluctuaciones de las concentraciones de fármaco en sangre. Por otro lado, las implicaciones farmacocinéticas que estos sistemas conllevan, como son el hecho de que la concentración máxima (Cmáx) alcanzada con estos sistemas sea menor y que además esta no se alcance de forma inmediata (mayor tiempo en alcanzar la concentración máxima (Tmax)) (98), favorecen que, con un uso acorde a la prescripción médica, se reduzca el riesgo de desarrollo de la dependencia a opioides en comparación con las formas farmacéuticas de liberación inmediata. Sin embargo, para conseguir espaciar los intervalos de administración es necesario que los sistemas contengan mayores cantidades de principio activo en comparación con los sistemas de liberación inmediata. Este hecho ha de tenerse en cuenta a la hora de desarrollar sistemas de liberación prolongada de analgésicos opioides, pues las dosis más altas los hacen más susceptibles de abuso con fines no terapéuticos. En este sentido, la industria farmacéutica ha desarrollado formulaciones antiabuso con una serie mecanismos físicos, químicos o farmacológicos (99). Un ejemplo representativo es el caso de la oxicodona, cuyos comprimidos de liberación modificada fueron reformulados con mecanismos físicos antiabuso y posteriormente relanzados al mercado (100). Análogamente, la migración desde sistemas reservorio hacia sistemas matriciales (o incluso sistemas mixtos o matriciales avanzados) en parches transdérmicos consigue disminuir la tendencia hacia el abuso de los mismos por parte de los pacientes. Hasta la fecha, el desarrollo y la reformulación de estos sistemas para disminuir la tendencia hacia un uso ilícito solo ha sido reconocida por la FDA.
La vía por la cual se han desarrollado más sistemas de liberación prolongada con analgésicos opioides es la vía oral: para el 56% de los opioides autorizados para el tratamiento del dolor se han desarrollado sistemas de liberación prolongada de administración por vía oral (Figura 4), dado que es una vía cómoda para el paciente además de no ser invasiva. Por esta vía se han desarrollado medicamentos con morfina, oxicodona, hidromorfona, tapentadol e hidrocodona, fármacos de semivida corta y que no sufren efecto de primer paso. Con estos sistemas se consigue aumentar el intervalo posológico hasta 12-24 horas respecto a los sistemas de liberación inmediata en los que la frecuencia de administración es cada 6-8 horas (figura 1). Sin embargo, la vía oral no es de utilidad en aquellos fármacos que presentan un intenso efecto de primer paso hepático, como es el caso del fentanilo y la buprenorfina. Esta limitación consigue superarse con los sistemas de liberación prolongada por vía transdérmica, que además consiguen espaciar aún más los intervalos posológicos. En concreto el 20% de los parches se deben retirar cada 7 días y el 80% cada 3-4 días (figura 2). Los sistemas de liberación prolongada por esta vía se han desarrollado para una menor proporción de analgésicos opioides que en el caso de la vía oral, concretamente solo el 22,2% del total de los principios activos empleados en los sistemas de liberación inmediata se encuentran desarrollados en formas de parches transdérmicos de liberación prolongada (Figura 4). Sin embargo, son los parches transdérmicos, las formas farmacéuticas más vendidas y las que representan un mayor impacto en el mercado (101).
Para el tratamiento del dolor crónico no se ha desarrollado ningún sistema de liberación prolongada por vía parenteral, ya que el uso de esta vía solo se justifica si se consigue disminuir la frecuencia de administración de forma significativa respecto a otras vías de administración por su invasividad intrínseca, para lo cual sería necesario diseñar sistemas con elevada dosis de principio activo. El diseño de sistemas con mayores cantidades de principio activo incrementaría el riesgo de sobredosis tanto por liberación brusca del analgésico opioide como por la elevada susceptibilidad de abuso de los mismos con fines no terapéuticos.
Atendiendo al tratamiento de las adicciones a opioides, dado que los fármacos empleados en el tratamiento (buprenorfina y naltrexona) no presentan riesgo de abuso, se pueden incorporar mayores cantidades de principio activo al sistema, lo que permite reducir aún más la frecuencia de administración, consiguiendo así aumentar el cumplimiento terapéutico de este tipo de pacientes que, por lo general, no se adhieren de forma voluntaria. No se han desarrollado sistemas de liberación prolongada para el tratamiento de la dependencia a opioides ni por vía oral ni por vía transdérmica (figura 4), ya que, en estos casos es fácil retirar el sistema (en el caso de los parches) o dejar de tomar la forma sólida oral, mientras que sí se ha desarrollado sistemas por vía parenteral, ya que en este caso el paciente no tiene la posibilidad de retirarse el sistema. Los intervalos posológicos conseguidos por vía parenteral son de 1-6 meses, siendo con la tecnología basada en los implantes con la que se consigue reducir en mayor medida la frecuencia de administración (Figura 3).
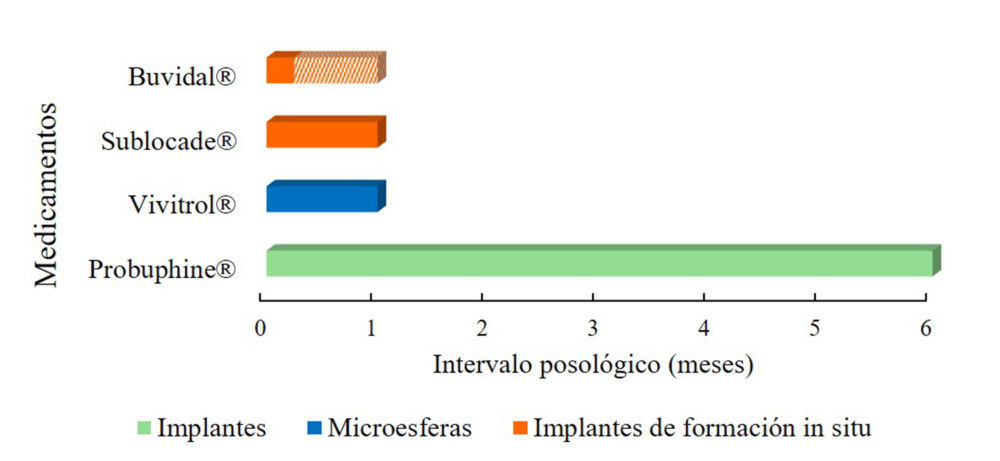 Figura 3: Intervalo posológico de los sistemas de liberación prolongada por vía parenteral para el tratamiento de la dependencia a opioides que se encuentran actualmente autorizados en Europa y/o Estados Unidos
Figura 3: Intervalo posológico de los sistemas de liberación prolongada por vía parenteral para el tratamiento de la dependencia a opioides que se encuentran actualmente autorizados en Europa y/o Estados Unidos
Tabla 3. Formulaciones de liberación prolongada de opioides para administración por vía parenteral para el tratamiento de la dependencia a opioides
Del total de medicamentos opiáceos que pueden ser empleados para el tratamiento de la dependencia a opioides (metadona, buprenorfina y naltrexona), solo se han desarrollado sistemas de liberación prolongada por vía parenteral con dos de estos principios activos: buprenorfina y naltrexona (Figura 4).
Figura 4. Comparación de los distintos sistemas de liberación de opioides autorizados para el tratamiento del dolor y de la dependencia a opioides. SLC: Sistemas de liberación convencional; SLP: Sistemas de liberación prolongada
5. CONCLUSIONES
Los sistemas de liberación prolongada han constituido un soporte fundamental en la farmacología de opioides durante las últimas décadas. En primera instancia, en el marco del tratamiento del dolor crónico, el desarrollo de sistemas de liberación prolongada de agonistas opioides de administración por vía oral y transdérmica ha servido para obtener periodos de analgesia ostensiblemente más duraderos, así como para reducir el riesgo de desarrollar dependencia a opioides, fruto de la reducción del efecto euforizante, al diferir y estabilizar los niveles plasmáticos de fármaco. En segundo lugar, tras observar que las dosis más altas que contienen estos sistemas de liberación prolongada de analgésicos opioides aumentaban la susceptibilidad de abuso de los mismos con fines no terapéuticos, muchos de estos sistemas han sido reformulados para incorporar recursos tecnológicos disuasorios de su utilización por vías de administración alternativas. Por último, los sistemas de liberación prolongada de administración por vía parenteral de agonistas parciales y antagonistas opioides, capaces de prolongar su liberación durante meses, han supuesto, más recientemente, un hito en la mejora del cumplimiento terapéutico del tratamiento de mantenimiento de los pacientes con dependencia a opioides. Esta sinergia entre opioides y el desarrollo de sistemas de liberación prolongada ha ido evolucionando a lo largo de estas décadas y seguirá haciéndolo en el futuro para dar respuesta a los nuevos retos en el campo de la farmacología de opioides que están por venir.
Conflicto de intereses
Los autores del presente estudio declaran que no existe ningún conflicto de interés.
6. REFERENCIAS
1. Agencia Española de Medicamentos y Productos Sanitarios. Utilización de medicamentos opioides en España durante el periodo 2010-2019.
2. Holden JE, Jeong Y, Forrest JM. The endogenous opioid system and clinical pain management. AACN Clin Issues. 2005 Jul;16(3):291–301.
3. Corder G, Castro DC, Bruchas MR, Scherrer G. Endogenous and exogenous opioids in pain. Annu Rev Neurosci. 2018 Jul 8;41(1):453–73.
4. Diego L, Atayee R, Helmons P, Hsiao G, Von Gunten CF. Novel opioid antagonists for opioid-induced bowel dysfunction. Expert Opin Investig Drugs.2011 Aug 12;20(8):1047–56.5. Peciña M, Karp JF, Mathew S, Todtenkopf MS, Ehrich EW, Zubieta JK. Endogenous opioid system dysregulation in depression: implications for new therapeutic approaches. Mol Psychiatry. 2019 Apr 1;24(4):576–87.
6. Wang S. Historical Review: Opiate Addiction and Opioid Receptors. CellTransplant. 2019 Mar 13;28(3):233–8.
7. Khademi H, Kamangar F, Brennan P, Malekzadeh R. Opioid therapy and its side effects: A review. Arch Iran Med. 2016 Dec 1;19(12):870–6.
8. Álvarez Y, Farré M. Farmacología de los opioides. Vol. 17, Adiciones. 2005.
9. Pathan H, Williams J. Basic opioid pharmacology: an update. Br J Pain. 2012 Feb;6(1):11–6.
10. Tornero C, Herrera J, Molà O, Galván J. Buprenorfina transdérmica (Feliben®). Nueva opción terapéutica para pacientes con dolor moderado y severo. Rev Soc Esp Dolor. 2012;19(6):301–9.
11. Acuña JP. Tratamiento del dolor agudo en el paciente dependiente de sustancias. Rev Médica Clínica Las Condes. 2014 Jul 1;25(4):664–73.
12. Alho H, Dematteis M, Lembo D, Maremmani I, Roncero C, Somaini L. Opioid- related deaths in Europe: Strategies for a comprehensive approach to address a major public health concern. Int J Drug Policy. 2020 Feb 1;76.
13. Muriel C SJS-M. Farmacología de los analgésicos opiáceos. In: Máster del Dolor. 2017;
14. Dumas EO, Pollack GM. Opioid tolerance development: A pharmacokinetic/pharmacodynamic perspective. AAPS J. 2008 Dec;10(4):537–51.
15. Harned M, Sloan P. Safety concerns with long-term opioid use [Internet]. Vol. 15, Expert Opinion on Drug Safety. Taylor and Francis Ltd; 2016. p. 955–62.
16. Vallerand AH. The use of long-acting opioids in chronic pain management. Nurs Clin North Am. 2003 Sep 1;38(3):435–45.
17. Steingrímsdóttir ÓA, Landmark T, Macfarlane GJ, Nielsen CS. Defining chronic pain in epidemiological studies: A systematic review and meta-analysis. Vol.158, Pain. Lippincott Williams and Wilkins; 2017. p. 2092–107.
18. Sociedad Española del Dolor. Una Nueva Definición de “Dolor”. Un Imperativo de Nuestros Días.
19. Fayaz A, Croft P, Langford RM, Donaldson LJ, Jones GT. Prevalence of chronic pain in the UK: a systematic review and meta-analysis of population studies. Open. 2016;6:10364.
20. Latina R, De Marinis MG, Giordano F, Osborn JF, Giannarelli D, Di Biagio E, et al. Epidemiology of Chronic Pain in the Latium Region, Italy: A Cross-Sectional Study on the Clinical Characteristics of Patients Attending Pain Clinics. Pain Manag Nurs. 2019 Aug 1;20(4):373–81.21. González-Escalada J. Actualizaciones en los aspectos socioeconómicos del dolor. In: Actualizaciones en el control del dolor: diez años Reunión de expertos. Salamanca: Fundación Grünenthal; 2010. p. 145–69.
22. Álvarez-Caramés MÁ, Navarro-Ribero M. Costes del tratamiento del dolor versus su no tratamiento. Aproximación a la realidad de Portugal y España. Dor. 2016;24:1–9.
23. Damico V, Murano L, Cazzaniga F, Dal Molin A. Pain prevalence, severity, assessment and management in hospitalized adult patients: a result of a multicenter cross sectional study. Ann Ist Super Sanita. 2018;54(3):194–200.
24. Mills SEE, Nicolson KP, Smith BH. Chronic pain: a review of its epidemiology and associated factors in population-based studies. Br J Anaesth. 2019 Aug 1;123(2):e273–83.
25. Jones MR, Carney MJ, Kaye RJ, Prabhakar A, Kaye AD. Drug Formulation Advances in Extended-Release Medications for Pain Control. Curr Pain Headache Rep. 2016 Jun 15;20(6):36.
26. Amabile CM, Bowman BJ. Overview of Oral Modified-Release Opioid Products for the Management of Chronic Pain. Ann Pharmacother. 2006 Jul 4;40(7–8):1327–35.
27. Martín Montaner I. Formas farmacéuticas de liberacion modificada y estereoisómeros ¿Nos aportan algo en la práctica clínica? In: Boletin de informacion Farmacoterapéutica de Navarra. 2005. p. 1–10.
28. Argoff CE, Silvershein DI. A Comparison of Long-and Short-Acting Opioids for the Treatment of Chronic Noncancer Pain: Tailoring Therapy to Meet Patient Needs. Mayo Clin Proc. 2009;84(7):602–12.
29. Smith HS. Enteral controlled-release opioid delivery systems. Pain Med. 2009;10.
30. Varrassi G, Angeletti C, Guetti C, Marinangeli F, Paladini A. Systemic opioid and chronic pain. Eur J Pain Suppl. 2009 Nov;3(2):77–83.
31. Martin C, De Baerdemaeker A, Poelaert J, Madder A, Hoogenboom R, Ballet S. Controlled-release of opioids for improved pain management. Mater Today. 2016 Nov 1;19(9):491–502.
32. Mugabure Bujedo B. Opioid formulations that prevent the recreational use: More questions than answers about their utility. Rev la Soc Esp del Dolor. 2020;27(1):61–2.
33. Cohen JP, Mendoza M, Roland C. Challenges Involved in the Development and Delivery of Abuse-deterrent Formulations of Opioid Analgesics. Clin Ther. 2018 Feb 1;40(2):334–44.
34. Leslie S. The Contin delivery system: Dosing considerations. J Allergy Clin Immunol. 1986;78(4 PART 2):768–73.
35. Miller DA, DiNunzio JC, Williams RO. Advanced formulation design: Improving drug therapies for the management of severe and chronic pain. Drug Dev Ind Pharm. 2008 Feb 11;34(2):117–33.
36. Reder RF. Opioid formulations: tailoring to the needs in chronic pain. Eur J Pain. 2001 Dec;5(SA):109–11.
37. Litman RS, Pagán OH, Cicero TJ. Abuse-deterrent opioid formulations. Anesthesiology. 2018 May;128(5):1015–26.
38. Larance B, Dobbins T, Peacock A, Ali R, Bruno R, Lintzeris N, et al. The effect of a potentially tamper-resistant oxycodone formulation on opioid use and harm: main findings of the National Opioid Medications Abuse Deterrence (NOMAD) study. The Lancet Psychiatry. 2018 Feb 1;5(2):155–66.
39. López S. Sistemas de liberación sostenida de administración oral y parenteral. 2018.
40. Alexander L, Mannion RO, Weingarten B, Fanelli RJ, Stiles GL. Development and impact of prescription opioid abuse deterrent formulation technologies. Drug Alcohol Depend. 2014 May 1;138(1):1–6.
41. Smith K, Hopp M, Mundin G, Bond S, Bailey P, Woodward J, et al. Low absolute bioavailability of oral naloxone in healthy subjects. Int J Clin Pharmacol Ther. 2012 May 1;50(05):360–7.
42. Gudin JA. Assessment of Extended-Release Opioid Analgesics for the Treatment of Chronic Pain. J Pain Palliat Care Pharmacother. 2013 Feb;27(1):49–61.
43. Darwish M, Bond M, Tracewell W, Robertson P, Yang R. Pharmacokinetics of hydrocodone extended-release tablets formulated with different levels of coating to achieve abuse deterrence compared with a hydrocodone immediate- release/acetaminophen tablet in healthy subjects. Clin Drug Investig. 2015 Jan 1;35(1):13–22.
44. Dhillon S. Hydrocodone Bitartrate ER (Hysingla® ER): A Review in Chronic Pain. Clin Drug Investig. 2016 Nov 1;36(11):969–80.
45. Gardner-Nix J, Mercadante S. The role of OROS® hydromorphone in the management of cancer pain. Pain Pract. 2010 Jan 1;10(1):72–7.
46. Wallace MS, Thipphawong J. Clinical Trial Results with OROS® Hydromorphone. J Pain Symptom Manage. 2007 Feb 1;33(2 SUPPL.):S25–32.
47. Zingraff M, Reher M. Sustained release tablets with hydromorphone. 2010.
48. Ross EL, Hahn K. KADIAN® (morphine sulfate extended-release) Capsules for treatment of chronic, moderate-to-severe, nonmalignant pain. Int J Clin Pract. 2008 Feb 1;62(3):471–9.
49. Krashin D, Murinova N, Trescot AM. Extended-release hydrocodone – gift or curse? J Pain Res. 2013;6:53–7.
50. Maincent J, Zhang F. Recent advances in abuse-deterrent technologies for the delivery of opioids. Int J Pharm. 2016 Aug 20;510(1):57–72.
51. Lamb YN, Garnock-Jones KP, Keam SJ. Oxycodone DETERx® ER Capsules: A Review in Severe, Chronic Pain. Drugs. 2016 Dec 1;76(18):1759–69.
52. Mayock SP, Saim S, Fleming AB. In Vitro Drug Release After Crushing: Evaluation of Xtampza® ER and Other ER Opioid Formulations. Clin Drug Investig. 2017 Dec 1;37(12):1117–24.
53. Patel D, Chaudhary SA, Parmar B, Bhura N. Transdermal Drug Delivery System: A Review. Vol. 1. 2012.
54. Gomez Ayala M-E. Manipulación de especialidades farmacéuticas. 2007;44–8.
55. Pastore MN, Kalia YN, Horstmann M, Roberts MS. Transdermal patches: History, development and pharmacology. Br J Pharmacol. 2015 Jan 5;172(9):2179–209.
56. Chandrashekar N, Shobha Rani R. Physicochemical and pharmacokinetic parameters in drug selection and loading for transdermal drug delivery. Indian J Pharm Sci. 2008 Jan 1;70(1):94–6.
57. Delgado-Cortés R, Martínez-Segura RT. Perfil farmacocinético de los opioides aplicado a la anestesia ambulatoria. Supl 1 Abril-Junio. 2011;34:122–4.
58 .Kukanich B, Allen P. Comparative pharmacokinetics of intravenous fentanyl and buprenorphine in healthy Greyhound dogs.
59. Davis MP, Pasternak G, Behm B. Treating Chronic Pain: An Overview of Clinical Studies Centered on the Buprenorphine Option.
60. Lötsch J, Walter C, Parnham MJ, Oertel BG, Geisslinger G. Pharmacokinetics of non-intravenous formulations of fentanyl. Clin Pharmacokinet. 2013 Jan 26;52(1):23–36.
61. Margetts L, Sawyer R. Transdermal drug delivery: Principles and opioid therapy. Contin Educ Anaesthesia, Crit Care Pain. 2007 Oct 1;7(5):171–6.
62. Kress HG, Boss H, Delvin T, Lahu G, Lophaven S, Marx M, et al. Transdermal fentanyl matrix patches Matrifen® and Durogesic® DTrans® are bioequivalent. Eur J Pharm Biopharm. 2010 Jun;75(2):225–31.
63. Hair PI, Keating GM, McKeage K. Transdermal matrix fentanyl membrane patch (Matrifen®): In severe cancer-related chronic pain. Drugs. 2008 Sep 17;68(14):2001–9.
64. Lane ME. The transdermal delivery of fentanyl. Eur J Pharm Biopharm. 2013 Aug 1;84(3):449–55.
65. Likar R. Transdermal buprenorphine in the management of persistent pain – Safety aspects. Ther Clin Risk Manag. 2006;2(1):115–25.
66. Kress HG. Clinical update on the pharmacology, efficacy and safety of transdermal buprenorphine. Eur J Pain. 2009 Mar;13(3):219–30.
67. Plosker GL, Barkin RL, Breivik H, Gordon A, Hernandez JJ, Hess PE. Buprenorphine 5, 10 and 20μgh transdermal patch: A review of its use in the management of chronic non-malignant pain. Drugs. 2011;71(18):2491–509.
68. Segal H, Salgado B, Mínguez F, Quintero J. Trastornos por consumo de sustancias y fármacos. Programa Form Médica Contin Acreditado. 2015.
69. Díaz González LM, Martin Gutiérrez L, Fernández del Pozo M del B. Epilepsia y Dolor Neuropático. Principios Fisiopatol para la Atención Farm Módulo IV. 2009;18–26.
70. Acuña JP. Riesgo de adiccion a analgésicos opioides en el tratamiento del dolor crónico no oncológico. Rev Médica Clínica Las Condes. 2019 Nov 1;30(6):466–79.
71. Soyka M, Mutschler J. Treatment-refractory substance use disorder: Focus on alcohol, opioids, and cocaine. Prog Neuro-Psychopharmacology Biol Psychiatry. 2016 Oct 12;70:148–61.
72. Conrad C, Bradley HM, Broz D. Community Outbreak of HIV Infection Linked to Injection Drug Use of Oxymorphone. 2015.
73. Carmen M, Casero V. Deshabituación de opiáceos ( I ). 2011;21(I).
74. Itzoe ML, Guarnieri M. New developments in managing opioid addiction: Impact of a subdermal buprenorphine implant. Drug Des Devel Ther. 2017 May 10;11:1429–37.
75. Toce MS, Chai PR, Burns MM, Boyer EW. Pharmacologic Treatment of Opioid Use Disorder: a Review of Pharmacotherapy, Adjuncts, and Toxicity. J Med Toxicol. 2018 Dec 1;14(4):306–22.
76. Pérez-López A, Martín-Sabroso C, Torres-Suárez AI, Aparicio-Blanco J. Timeline of translational formulation technologies for cancer therapy: Successes, failures, and lessons learned therefrom. Pharmaceutics. 2020 Nov 1;12(11):1–34.
77. Benéitez MC, Gil-Alegre ME. Opioid Addiction: Social Problems Associated and Implications of Both Current and Possible Future Treatments, including Polymeric Therapeutics for Giving Up the Habit of Opioid Consumption. Biomed Res Int. 2017;2017.
78. Ilmo N, Moreno L, Discurso F, Prof C, Alarc FR. Innovaciones farmacéuticas para la administración de medicamentos. Real Acad Med la Comunidad Val. 2012;46–64.
79. Goonoo N, Bhaw-Luximon A, Ujoodha R, Jhugroo A, Hulse GK, Jhurry D. Naltrexone: A review of existing sustained drug delivery systems and emerging nano-based systems. J Control Release. 2014 Jun 10;183(1):154–66.
80. Krupitsky E, Zvartau E, Woody G. Use of naltrexone to treat opioid addiction in a country in which methadone and buprenorphine are not available. Curr Psychiatry Rep. 2010 Oct;12(5):448–53.
81. Kreuter J. Nanoparticles and microparticles for drug and vaccine delivery. J Anat. 1996 Dec;189 ( Pt 3(Pt 3):503–5.
82. Kjome KL, Gerard Moeller F. Long-acting injectable naltrexone for the management of patients with opioid dependence. Subst Abus Res Treat. 2011;5(1):1–9.
83. Park K, Skidmore S, Hadar J, Garner J, Park H, Otte A, et al. Injectable, long- acting PLGA formulations: Analyzing PLGA and understanding microparticle formation. J Control Release. 2019 Jun 28;304:125–34.
84. Jain A, Kunduru KR, Basu A, Mizrahi B, Domb AJ, Khan W. Injectable formulations of poly(lactic acid) and its copolymers in clinical use. Vol. 107, Advanced Drug Delivery Reviews. Elsevier B.V.; 2016. p. 213–27.
85. Jarvis BP, Holtyn AF, Subramaniam S, Tompkins DA, Oga EA, Bigelow GE, et al. Extended-release injectable naltrexone for opioid use disorder: a systematic review. Addiction. 2018 Jul 1;113(7):1188–209.
86. Elliott W, Chan J. Buprenorphine Implant for Subdermal Administration (Probuphine). Intern Med Alert. 2016;93–4.
87. Chappuy M, Trojak B, Nubukpo P, Bachellier J, Bendimerad P, Brousse G, et al. Prolonged-release buprenorphine formulations: Perspectives for clinical practice. Therapies. 2020 May 1;75(5):397–406.
88. Goodbar NH, Hanlon KE. Implantable Buprenorphine (Probuphine) for Maintenance Treatment of Opioid Use Disorder. Am Fam Physician. 2018;97(10):668–70.
89. Park K, Otte A. Prevention of Opioid Abuse and Treatment of Opioid Addiction: Current Status and Future Possibilities. Annu Rev Biomed Eng. 2019 Jun 4;21(1):61–84.
90. Neale J, Tompkins CNE, Strang J. Prolonged-release opioid agonist therapy: Qualitative study exploring patients’ views of 1-week, 1-month, and 6-month buprenorphine formulations. Harm Reduct J. 2019 Apr 3;16(1):25.
91. Malik K, Singh I, Nagpal M. Atrigel: A potential parenteral controlled drug delivery system. Der Pharm Sin. 2010;1(1):74–81.
92. Heidbreder C. Driving innovation, strengthening our leadership profile.
93 .Lofwall MR, Walsh SL, Nunes E V., Bailey GL, Sigmon SC, Kampman KM, et al. Weekly and monthly subcutaneous buprenorphine depot formulations vs daily sublingual buprenorphine with naloxone for treatment of opioid use disorder a randomized clinical trial. JAMA Intern Med. 2018 Jun 1;178(6):764–73.
94. Vorspan F, Hjelmström P, Simon N, Benyamina A, Dervaux A, Brousse G, et al. What place for prolonged-release buprenorphine depot-formulation Buvidal® in the treatment arsenal of opioid dependence? Insights from the French experience on buprenorphine. Expert Opin Drug Deliv. 2019 Sep 2;16(9):907–14.
95. Lintzeris N, Dunlop A, Masters D. Clinical guidelines for use of depot buprenorphine ( Buvidal ® and Sublocade ® ) in the treatment of opioid dependence. 2019. 1–56 p.
96. López-Muñoz F, García-García P, Alamo González C. Trastornos adictivos. 231–268 p.
97. Chai G, Xu J, Osterhout J, Liberatore MA, Miller KL, Wolff C, et al. New Opioid Analgesic Approvals and Outpatient Utilization of Opioid Analgesics in the United States, 1997 through 2015. Anesthesiology. 2018 May 1;128(5):953–66.
98. Chowdhury BA. Summary Review Of Regulatory Action-Incruse Ellipta. 2014.
99. Ahmad R, Alaei S, Omidian H. Safety and performance of current abuse- deterrent formulations. Expert Opin Drug Metab Toxicol. 2018 Dec 2;14(12):1255–71.
100. Kopecky EA, Fleming AB, Levy-Cooperman N, O’Connor M, M. Sellers E. Oral Human Abuse Potential of Oxycodone DETERx® (Xtampza® ER). J Clin Pharmacol. 2017;57(4):500–12. 101.Divins M. Información de mercado. Analgésicos opiáceos. 2012;26.
101. Divins M. Información de mercado. Analgésicos opiáceos. 2012;26.