RESUMEN:
Introducción. En el agua de los ecosistemas acuáticos considerados extremos, debido a los valores de sus parámetros fisicoquímicos y químicos, tales como altas concentraciones de sales, ambientes oligotróficos, pH extremos, alta radiación y temperaturas extremas, existe una población bacteriana que se ha adaptado a esas condiciones y que pueden ser un reservorio importante de resistomas naturales.
Objetivo. Conocer los perfiles de susceptibilidad a diversos antibióticos en cepas del género Bacillus aisladas de balnearios de aguas mineromedicinales y de agua de un lago cratérico volcánico del Ecuador.
Materiales y métodos. Se analizaron un total de 16 muestras de agua mineromedicinal y 32 muestras de agua de lago cratérico volcánico. El aislamiento de Bacillus se realizó por la técnica de filtración en membrana, utilizando filtros Millipore de 0,45 μm de poro, un volumen de muestra de 100 mL y el agar R2A. Las cepas aisladas se identificaron siguiendo los esquemas de MacFaddin (2004), complementadas con las pruebas bioquímicas de las galerías Microgen para Bacillus. El perfil de resistencia a los antibióticos se determinó por el método de difusión en placas de Kirby y Bauer (1966) interpretándose según el CLSI (2019).
Resultados. Se identificaron 19 cepas de Bacillus. La mayoría de las cepas fueron resistentes y multiresistentes a los antibióticos clindamicina, eritromicina, gentamicina, oxacilina y penicilina.
Conclusiones. Los resultados señalan la presencia de especies de Bacillus y de resistomas asociados a este género en el agua de ambientes naturales extremos en el Ecuador, lo cual sugiere que estos ambientes pueden ser un reservorio importante de bacterias resistentes a los antibióticos.
Palabras Clave: Agua mineromedicinal, Ambientes extremos; Bacillus; Lagos cratéricos; Resistencia a antibioticos
ABSTRACT:
Introduction. The water of aquatic ecosystems considered extreme, given the values of its physicochemical and chemical parameters, such as high concentrations of salts, oligotrophic environments, extreme pH, high radiation and extreme temperatures, there is a bacterial population that has adapted to these conditions and that they can be an important reservoir of natural resistomes.
Objective. The objective of the present work was to know the profiles of susceptibility to various antibiotics in strains of the Bacillus genus isolated from mineromedicinal water spas and water from a volcanic crater lake in Ecuador.
Materials and methods. A total of 16 mineromedicinal water samples and 32 samples of crater volcanic lake water were analyzed. The isolation of the Bacillus colonies was carried out by the membrane filtration technique, using Millipore filters of 0.45 μm pore, a sample volume of 100 mL and R2A agar. The isolated strains were identified following the schemes of MacFaddin (2004), complemented with the biochemical tests of the Microgen galleries for Bacillus. The antibiotic resistance profile was determined by the plate diffusion method of Kirby and Bauer (1966), interpreted according to the CLSI (2019).
Results. 19 Bacillus strains were identified. Most of the strains were resistant and multi-resistant to the antibiotic clindamycin, erythromycin, gentamicin, oxacillin, and penicillin. Conclusions. The results indicate the presence of Bacillus species and resistomes associated with this genus in the water of extreme natural environments in Ecuador, which suggests that these environments may be an important reservoir of bacteria resistant to antibiotics.
Keywords: Mineromedicinal water; Extreme environments; Bacillus; Crater lakes; Antibiotic resistance
1. INTRODUCCIÓN
Los ecosistemas acuáticos considerados como extremos no son estériles y poseen una población bacteriana escasa que depende básicamente de las condiciones ambientales, ecológicas, fisicoquímicas y químicas de estos sistemas generalmente de naturaleza oligotrófica (1,2).
Según Schmidt-Lorenz (3), la microbiota de un agua natural está constituida por dos tipos de microorganismos, muy diferentes en origen y en propiedades, que coexisten: los llamados autóctonos que son los propios del hábitat y que constituyen la microbiota natural y los alóctonos procedentes de otro hábitat (aire, animales, peces, suelo y vegetales) y que se consideran contaminantes ocasionales.
Dentro de los microorganismos que se han detectado en los ambientes acuáticos extremos, se encuentran diferentes especies del género Bacillus (2, 4, 5).
El género Bacillus fue descrito por primera vez por Ferdinand Julius Cohn entre 1870 y 1880, su heterogeneidad en la fisiología ecológica ha dificultado su clasificación taxonómica (6, 7).
Bacillus es un género de interés, dado que aporta un amplio perfil de diversidad fisiológica (acidofilia, alcalofilia, psicrofilia y termofilia), virtud que es otorgada por la variedad de enzimas que posee, lo cual le permite desarrollarse en diferentes hábitats tanto acuáticos como terrestres, además de permitirle la producción de diferentes tipos de metabolitos que les confieren una alta adaptabilidad a distintas condiciones ambientales (7).
Algunas de las especies de Bacillus son consideradas como patógenas para animales y el hombre, causando una diversidad de enfermedades tanto agudas como crónicas, algunas de ellas con una alta tasa de mortalidad, como es el caso del Bacillus anthracis, causante del ántrax (8).
Para tratar las infecciones causadas por las especies patógenas de Bacillus se han aplicado diversos tipos de antibióticos. Sin embargo, en los últimos años se han venido observando los fenómenos de resistencia y multiresistencia a los antibióticos utilizados, lo cual ha venido causando problemas de salud pública (9).
El rápido incremento de la resistencia a los antibióticos en las comunidades bacterianas es un fenómeno ecológico, pero también es un fenómeno biológico, genético, epidemiológico y social (10).
Se ha postulado que la resistencia bacteriana a los antimicrobianos es el resultado del uso indiscriminado de estas sustancias, que ejercen presión selectiva, promoviendo la supervivencia de bacterias mejor dotadas para evitar su efecto letal (11).
Por otro lado, la resistencia bacteriana a los antibióticos sustenta la existencia ambiental de genes de resistencia a estos antimicrobianos en un sistema acuático y terrestre, lo que se ha denominado resistomas ambientales en los que están presentes bacterias de distintos géneros y especies (12).
Diversos autores han demostrado la presencia de diferentes tipos de cepas bacterianas, entre ellas de Bacillus, resistentes y multiresistentes a los antibióticos en ecosistemas acuáticos extremos de diferentes partes del mundo (13, 14) lo que es de gran interés desde el punto de vista de la epidemiología, y sobre todo de la salud pública, dado que estas aguas son utilizadas de diferentes maneras por personas que viven cercanas a estos ambientes o por personas que las utilizan ocasionalmente en forma recreacional.
Tomando en consideración lo antes señalado, se planteó el presente trabajo de investigación cuyo objetivo principal fue determinar los perfiles de susceptibilidad a los antibióticos en especies bacterianas del género Bacillus aisladas de ambientes acuáticos extremos, tales como manantiales de aguas termales y agua de lagos cratéricos volcánicos del Ecuador.
2. MATERIALES Y MÉTODOS
2.1 Materiales
2.1.1 Sitios de muestreos
Se analizaron un total de 16 muestras de agua mineromedicinal provenientes de los sitios de emergencia del agua, como de las piscinas utilizadas por los bañistas, de cada uno de los siguientes balnearios:
1.- Balneario Cununyacu. Provincia de Pichincha. Ecuador (Figura 1).
2.- Balneario La Merced. Provincia de Pichincha. Ecuador (Figura 2).
3.- Balneario Rumiloma. Provincia de Pichincha. Ecuador (Figura 3).
4.- Balneario Urauco. Provincia de Pichincha. Ecuador (Figura 4).
Figura 1. Piscina termal del balneario “Cununyacu”. Provincia de Pichincha. Ecuador
Figura 2. Piscina Balneario “La Merced”. Provincia de Pichincha. Ecuador
Figura 3. Vista del balneario “Rumiloma”. Provincia de Pichincha. Ecuador
Figura 4. Manantial del balneario mineromedicinal “Urauco”. Provincia de Pichincha. Ecuador
De igual forma, se realizaron dos campañas de muestreos en el lago cratérico volcánico Quilotoa (Figura 5), ubicado a 3914 m.s.n.m en la Provincia de Cotopaxi, a 32 km oeste-noroeste de la ciudad de Latacunga y a 83 km al suroeste de Quito, en una zona montañosa entre las parroquias de Zumbahua (12.5 Km. Al Sur del cráter) y Sigchos (17 Km. Al Norte del cráter), ecosistema que forma parte de la reserva ecológica “Los Ilinizas”.
Figura 5. Vista del lago craterico volcánico “Quilotoa”. Provincia de Cotopaxi. Ecuador.
2.1.2 Muestras
En cada uno de los balneario de agua mineromedicinal estudiados, se tomaron de manera aséptica, 2 muestras de 500 mL de agua, recolectadas en recipientes estériles, durante 2 ocasiones del año 2019. Las muestras se mantuvieron a temperatura ambiente hasta su procesamiento en el laboratorio, lo cual se realizó dentro de las 24 horas luego de su recolección.
En el caso de las muestras del agua del lago cratérico Quilotoa, se tomaron un total de 32 muestras. Las muestras de agua se recolectaron en 8 sitios seleccionados a lo largo y ancho de la laguna a nivel de la superficie. Se identificaron las coordenadas geográficas de los sitios de recolección mediante un GPS (Garmin eTrex20).
En cada ocasión de muestreo, se recolectaron dos muestras de agua de 1 litro en cada uno de los sitios de muestreos seleccionados. Para la recolección de las muestras se utilizaron frascos esterilizados y un muestreador de agua Van Dorn (Wildco Instruments y modelo: 3-1120-G45).
Las muestras se cubrieron con papel aluminio para evitar el paso de luz solar, trasladándose bajo refrigeración en una cava refrigerada con hielo hasta el laboratorio, realizándose los análisis microbiológicos dentro de las 24 horas luego de la toma.
2.2 Métodos
2.2.1 Aislamiento de cepas bacterianas de Bacillus presentes en muestras de aguas de ambientes extremos de Ecuador
Se utilizó la técnica de filtración en membrana, filtrando un volumen de 100 mL de muestra de agua y utilizando filtros de 0,45 μm los cuales se colocaron sobre la superficie del Agar R2A y se incubaron a 30 °C durante un tiempo máximo de 7 días. Se aislaron y purificaron las colonias crecidas en Agar Soja Tripticasa para su posterior identificación (15).
2.2.2 Identificaciones taxonómicas de las colonias de Bacillus aisladas
Se realizaron tinciones de Gram y pruebas bioquímicas de acuerdo con los esquemas de MacFaddin (16) complementadas con las contenidas en el kit comercial de identificación bacteriana Microgen para Bacillus (17). Se consideró una buena identificación cuando los porcentajes de probabilidad de identificación arrojados por el software de Microgen (Microgren ID, versión 1.2.5.26) fueron superiores al 75%.
Las cepas bacterianas aisladas se clasificaron siguiendo los criterios taxonómicos del Manual de Bergey (18) y la nomenclatura del Comité Internacional de Sistemática Bacteriana (ICSB) y publicadas en el Internacional Journal of Systematic Bacteriology.
2.2.3 Determinación del perfil de susceptibilidad a los antibióticos de las cepas de Bacillus aisladas e identificadas
Se utilizó el método de difusión en agar de acuerdo con la técnica Kirby y Bauer (19). Se tomaron 200 μL de una suspensión de bacterias equivalente al McFarland 0,5 y se mezclaron con 100 mL de agar antibiótico. Se depositaron 25 mL en placas de Petri estériles con agar Mueller Hinton y una vez solidificado se colocaron sobre su superficie discos de ampicilina (AMP 10 μg), ciprofloxacina (CIP 5 μg), clindamicina (CLI 2 μg), eritromicina (ERI 15 μg), gentamicina (GEN 10 μg), oxacilina (OXA 1 μg) y penicilina (PEN 10 U). La selección de antibióticos se realizó de acuerdo con lo recomendado por el CLSI (2019). Se incubaron durante 24 a 48 horas a 37 °C. Se utilizaron como cepas de control positivo y negativo, las cepas de referencia de Escherichia coli ATCC 25922 y de Staphylococcus aureus ATCC 25923. La prueba se interpretó de acuerdo con las recomendaciones del CLSI (20).
3. RESULTADOS
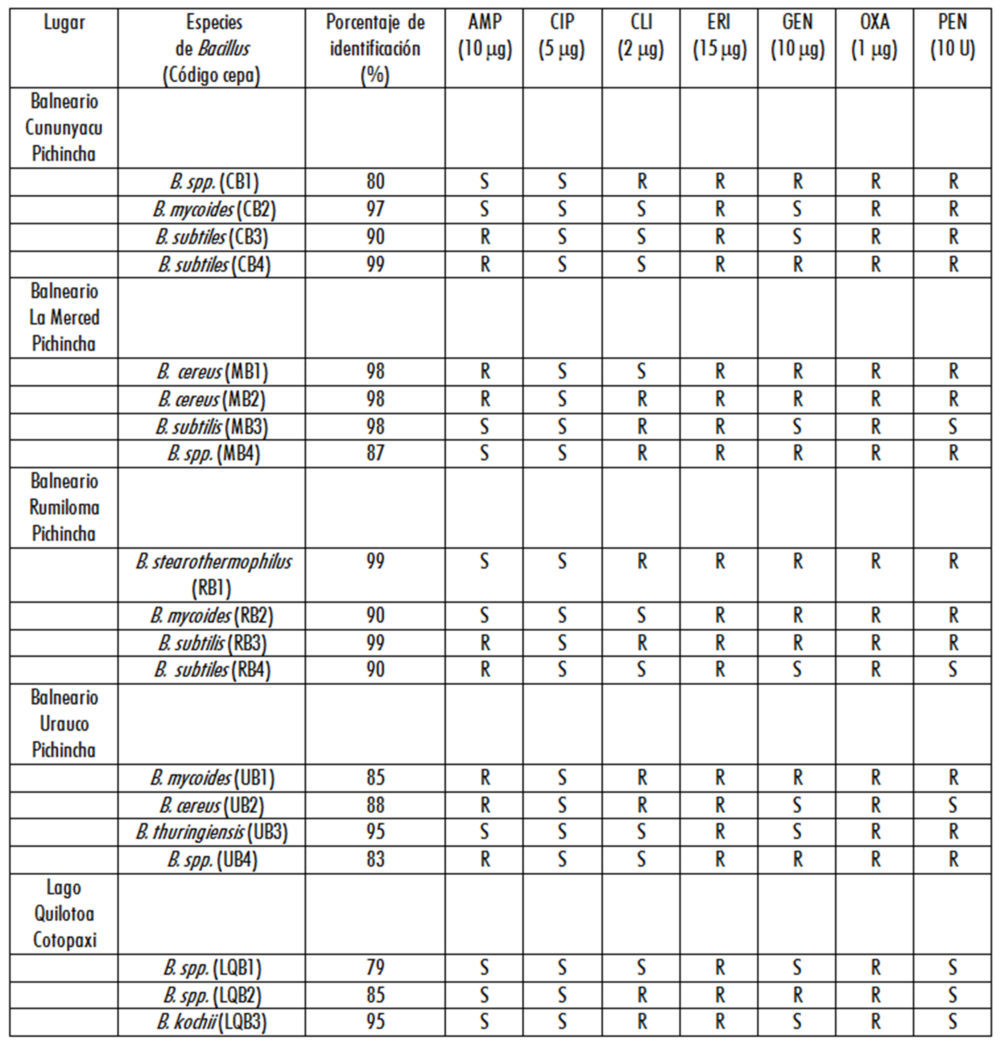
Se aislaron e identificaron de cada uno de los balnearios de aguas mineromedicinales investigados un total de 16 cepas de bacterias del género Bacillus y 3 cepas de esta bacteria en el agua del lago cratérico Quilotoa, siendo la especie Bacillus subtiles la de mayor frecuencia de aislamiento, seguida de las especies Bacillus cereus y Bacillus mycoides (Tabla 1).
Los antibiogramas realizados a las cepas de Bacillus identificadas, indican resistencias y multiresistencias de las cepas bacteriana a una diversidad de antibióticos (Tabla 1). Todas las cepas de Bacillus analizadas resultaron sensibles al antibiótico ciprofloxacina, así como resistentes a los antibióticos eritromicina y oxacilina.
De las 19 cepas de Bacillus evaluadas, 47,37 % (9) resultaron resistentes al antibiótico ampicilina, 52,63 % (10) resistentes a clindamicina, 57,89 % (11) a gentamicina y 68,42 % (13) a penicilina (Tabla 1).
Con respecto a la multiresistencia de las cepas de Bacillus estudiadas, el 5,26 % (1) resultaron resistentes dos antibióticos, 26,32 % (5) a tres antibióticos, 21,05 % (4) a cuatro antibióticos, 31,58 (6) a cinco antibióticos y el 15,79 % (3) a seis antibióticos, siendo el patrón más común la resistencia a cinco antibióticos (Tabla 1).
Entre las cepas de Bacillus multiresistentes detectadas destacan la cepa de Bacillus cereus MB2 aislada del balneario La Merced, la cepa de Bacillus subtilis RB3 aislada del agua del balneario Rumiloma y la cepa de Bacillus mycoides UB1 aislada del balneario Urauco, las cuales resultaron resistentes a 6 de los siete antibióticos ensayados (Tabla 1).
4. DISCUSIÓN
En todos los balnearios de aguas mineromedicinales investigados y en el agua de la laguna cratérica, fue posible aislar e identificar cepas del género Bacillus.
Las especies bacterianas del género Bacillus, provienen principalmente del suelo de donde pasan al agua, en el caso de las aguas mineromedicinales se ha observado que son más comunes en aguas hipertermales, aunque crecen también en aguas meso termales (21).
Los bacilos Gram positivo esporulados del género Bacillus han sido detectados en el agua de numerosos manantiales mineromedicinales de España (21, 22) como de Ecuador (5), además se trata de un género cosmopolita distribuido en el suelo y otros ambientes en diferentes partes del planeta (23).
De igual forma, se han podido detectar cepas del género Bacillus en aguas de lagos y ambientes volcánicos (4, 24) resultado similar al obtenido en este trabajo y que constituye el primer aislamiento de especies de este género en aguas de lagos cratéricos del Ecuador.
Tabla 1. Perfiles de susceptibilidad a los antibióticos de cepas bacterianas del género Bacillus aisladas de muestras de aguas de diferentes ecosistemas acuáticos extremos de Ecuador.
Nota: AMP: Ampicilina, CIP: ciprofloxacina, CLI: clindamicina, ERI: Eritromicina, GEN: Gentamicina, OXA: Oxacilina, PEN: Penicilina. R: Resistente. S: Sensible.
En el presente estudio las cepas del género Bacillus resultaron resistentes a la mayoría de los antibióticos evaluados. Estos resultados difieren con la investigación llevada a cabo por Samanta y colaboradores (25) quienes aislaron de ambientes acuáticos, bacterias pertenecientes al género Bacillus, resistentes a níquel, cobalto, cromo y cadmio, a los que les evaluaron la resistencia frente a once antibióticos (cloranfenicol, estreptomicina, tetraciclina, norfloxacina, rifampicina, kanamicina, meticilina, cotrimoxazol, neomicina, ampicilina y ácido nalidíxico). Estos aislados mostraron un predominio de la sensibilidad, aunque fueron resistentes a kanamicina, ampicilina, eritromicina y meticilina.
Así mismo, otros investigadores han detectado diversas cepas de bacterias del género Bacillus en el agua y sedimento de lagos volcánicos, resultado similar al obtenido en el agua del lago Quilotoa (4, 24).
La resistencia a los betalactámicos observada en la mayoría de las cepas aisladas, puede deberse a la presencia en el ecosistema de otras bacterias que presenten los genes de resistencias a estos antibióticos y pudieran ocurrir mecanismos de transferencia genética horizontal entre ellas. La presión ejercida por microorganismos productores de antibióticos podría conducir a la dispersión de genes de resistencia localizados en plásmidos y transposones, los cuales contienen no solo determinantes genéticos de resistencia a antibióticos, sino también otros marcadores de selección, como la resistencia a metales pesados muy común en estos ambientes (26).
Los datos del presente trabajo evidencian que bacterias resistentes a antibióticos no se circunscriben al ámbito hospitalario, ya que se encuentran circulando en el ambiente, donde sería posible su diseminación a través de los diferentes usos que tiene el agua. Estos resultados están en correspondencia con los obtenido por otros autores en diferentes tipos de ecosistemas acuáticos del mundo (25, 26, 27).
Otros investigadores, han planteado que bacterias filogenéticamente diversas, ámpliamente distribuidas en el ambiente, muestran capacidades de subsistir frente a antibióticos naturales y sintéticos. De esta manera, constituyen reservorios naturales de genes codificadores de resistencia, denominados resistomas ambientales que pueden ser transferidos horizontalmente a microorganismos patógenos, que comparten el mismo hábitat (27, 28).
El intercambio genético entre bacterias entéricas y la comunidad bacteriana autóctona, confiriendo resistencia a antibióticos, ha sido sugerido por otros investigadores (29).
Lo planteado anteriormente, así como la multirresistencia natural que pueden presentar diferentes especies microbianas, pudieran explicar los porcentajes de multirresistencia a los distintos antibióticos, superiores al 60%, detectado en las cepas de Bacillus estudiadas.
Es importante destacar que existe una resistencia natural contra los antibióticos en muchas especies bacterianas, las cuales han tenido que desarrollar mecanismos de resistencia a los antibióticos de manera de poder competir, en sus hábitat, contra otros microorganismos, muchos de los cuales son productores de estas sustancias antimicrobianas. Este fenómeno de competencia y adaptación se ha observado en cepas de bacterianas que se han podido aislar y revivir de ambientes extremos, sobre todo de sitios a bajas temperatura donde se han conservado por miles de año y que al revivirlas y poder determinar sus perfiles de susceptibilidad a los antibióticos han resultado resistentes y multirresistentes a una gran diversidad de antibióticos, inclusive a los de nueva generación (30).
5. CONCLUSIONES
Los resultados obtenidos indican que los ambientes extremos como los balnearios de aguas mineromedicinales y el agua del lago cratéricos volcánicos no son ambientes estériles, en el agua oligotrófica de estos ecosistemas se han adaptado diversos tipos de microorganismos, como es el caso de especies del género Bacillus. En el agua mineromedicinal de balnearios de la provincia de Pichincha del Ecuador y en el agua del lago cratérico volcánico Quilotoa, se han aislado cepas de Bacillus multirresistentes a diversos antibióticos, lo cual indica que estos ecosistemas albergan resistomas muy importantes, los cuales deben ser estudiados y caracterizados.
Agradecimiento
El agradecimiento a la Dirección de Investigaciones de la Universidad Central del Ecuador por facilitar los fondos económicos para el desarrollo del presente trabajo a través de los proyecto senior 011 y 045.
Conflicto de intereses
Los autores manifiestan que no tienen ningún tipo de conflicto de intereses con los datos y la realización del trabajo realizado.
6. BIBLIOGRAFÍA
1. Mapelli F., Marasco R., Rolli E., Daffonchio D., Donachie S., Borin S. Microbial Life in Volcanic Lakes. In: Rouwet D., Christenson B., Tassi F., Vandemeulebrouck J. (eds) Volcanic Lakes. Advances in Volcanology. Springer, Berlín, Heidelberg. 2015.
2. Farias M. Microbial ecosystems in central Andes, extreme environments. Springer. Switzerland. 2020.3. Schmidt-Lorenz W. Microbiological characteristics of natural mineral waters. Ann Ist Super Sanita. 1976; 12: 93-112.
4. Dib J, Motok J, Fernández Zenoff V, Ordoñez O, Farías M. Occurrence of resistance to antibiotics, UV-B and arsenic in bacteria isolated from extreme environments in high altitude (above 4,400 m) Andean Lakes. Curr Microbiol. 2008; 56(5): 510-7.
5. Andueza F, Araque J, Parra Y, Arciniegas S, Guailla R, Escobar S, Medina G. Diversidad bacteriana en aguas mineromedicinales del balneario “Urauco”. Pichincha. Ecuador. An. Real Acad. Farm. 2020; 90 (1): 9 – 18.
6. Liu Y, Lai Q, Göker M, Meier-kolthoff JP, Wang M, Sun Y and Shao Z. Genomic insights into the taxonomic status of the Bacillus cereus group. Scientific Reports. 2015; 5:1-11. http://dx.doi.org/10.1038/srep14082.
7. Corrales-Ramírez L, Caycedo-Lozano L, Gómez Méndez M, Ramos-Rojas S, Rodríguez-Torres J. Bacillus spp: una alternativa para la promoción vegetal por dos caminos enzimáticos. Nova. 2017; 15 (27): 45-65.
8. Hoffmaster AR, Hill KK, Gee JE, Marston CK, De B K, Popovic T, Sue D, Wilkins PP, Avashia SB, Drumgoole R, Helma CH, Ticknor LO, Okinaka RT and Jackson PJ. Characterization of Bacillus cereus isolates associated with fatal pneumonias: strains are closely related to Bacillus anthracis and harbor B. anthracis virulence genes. Journal of Clinical Microbiology. 2006; 44:3352-3360. https://dx.doi.org/10.1128/jcm.00561-06.
9. Mohamed N. Alanber, Naiyf S. Alharbi, Jamal M. Khaled. Evaluation of multidrug-resistant Bacillus strains causing public health risks in powdered infant milk formulas, Journal of Infection and Public Health. 2020; 13(10): 1462-1468. https://doi.org/10.1016/j.jiph.2019.11.013.
10. Baquero F, Martínez J, Cantón R. Antibiotics, and antibiotic resistance in water environments. Current Opinion in Biotechnology. 2008; 19 (3): 260-265.
11. Alonso A, Sánchez P, Martínez J. Environmetal selection of antibiotic resistance genes, Environ Microbiol. 2001; 3: 1-9.
12. Dante G, Sommer M. Genética de la resistencia microbiana. Investigación y Ciencias. 2014; Agosto: 28-34.
13. Falcone-Dias MF, Vaz-Moreira I, Manaia CM. Bottled mineral water as a potential source of antibiotic resistant bacteria. Water Res. 2012; 46(11):3612-3622.
14. Berić T, Biočanin M, Stanković S, Dimkić I, Janakiev T, Fira D, Lozo J. Identification, and antibiotic resistance of Bacillus spp. isolates from natural samples. Archives of Biological Sciences. 2017; 70:19-19.
15. Andueza, Félix. Diversidad Microbiana de las aguas mineromedicinales de los balnearios de Jaraba. [Tesis Doctoral]. Universidad Complutense de Madrid, España. 2007.
16. MacFaddin J. Pruebas bioquímicas para la identificación de bacterias de importancia clínica. Tercera edición. Editorial médica Panamericana. Buenos Aires. Argentina; pp. 1-850. 2004.
17. Microgen. Microgen Bacillus-ID system. Microgen Bioproducts. Camberley. UK. 2007.
18. Logan NA, De Vos P. Genus I. Bacillus. En: Brenner et al. (Eds) Bergey´s Manual of Systematic Bacteriology. 2da ed. Vol. 3. NY: Springer. 2007.
19. Bauer AW, Kirby MM, Sherris JC, Truck M. Antibiotic susceptibility testing by a standardized single disk method. Am. J. Clin. Pathol. 1966; 45(4): 493-496.
20. Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing Clinical and Laboratory Standards Institute Wayne, PA. 2019.
21. De la Rosa MC, Andueza F, Sánchez MC, Rodríguez C, Mosso MA. Microbiologia de las aguas mineromedicinales de los Balnearios de Jaraba. An R Acad Nac Farm 2004; 70:521-542.
22. De la Rosa C, Fernández V, Pintado C, Rodríguez C. Microbiología del agua mineromedicinal del Balneario de Paracuellos de Jiloca. An. Real. Acad. Farm. 2018; 84, (Special Issue): 68‐80.
23. Priest F. Systematics and Ecology of Bacillus, p 3-16. In Sonenshein A, Hoch J, Losick R (ed), Bacillus subtilis and Other Gram-Positive Bacteria. ASM Press, Washington DC. USA. 1993.
24. Dib J, Weiss A, Neumann A, Ordonez O, Estevez Maria, and Farias Maria. Isolation of Bacteria from Remote High Altitude Andean Lakes Able to Grow in the Presence of Antibiotics, Recent Patents on Anti-Infective Drug Discovery 2009; 4: 66. https://doi.org/10.2174/157489109787236300.
25. Samanta A, Bera P, Khatun M, Sinha C, Pal P, Lalee A, Mandal A. An investigation on heavy metal tolerance and antibiotic resistance properties of bacterial strain Bacillus sp. isolated from municipal waste. Journal of Microbiology and Biotechnology Research. 2012; 2(1): 178-189.
26. López DP, Torres-Caycedo MI, Prada-Quiroga CF. Genes de resistencia en bacilos Gram negativos: Impacto en la salud pública en Colombia. Rev. Univ. Salud. 2015; 18(1): 190-202.
27. Martínez A, Cruz M, Veranes O, Carballo M, Salgado I, Olivares S, Lima L, Rodríguez D. Resistencia a antibióticos y a metales pesados en bacterias aisladas del río Almendares. Revista CENIC. Ciencias Biológicas. 2010; 41: 1-10.
28. Dantas G, Sommer MOA, Oluwasegun RD, Church GM. Bacteria Subsisting on Antibiotics. Science. 2008; 320: 100-103.
29. Moroga R, Merino C, Mondaca MA. Resistencia a metales pesados en bacterias aisladas de la bahía de Iquique. Investigaciones Marinas. 2003; 31: 1-7.
30. Perry J, Waglechner N, Wright G. The Prehistory of Antibiotic Resistance. Cold Spring Harb Perspect Med. 2016; 6(6): 1-8.