RESUMEN:
Se conocen principalmente algunas peculiaridades funcionales, muy importantes, de los ácidos siálicos denominados N-acetilneuramínico (NeuAc) y N-glicolilneuramínico (NeuGc), por ser agentes que participan en actividades fisiológicas o en procesos patológicos cada vez más investigados en seres humanos. Dichos ácidos forman parte de los glicoconjugados. Los glicoconjugados son moléculas resultantes de la unión fuerte, covalente, entre glúcidos y proteínas o entre glúcidos y lípidos. La desregulación de la actividad de enzimas que catalizan procesos metabólicos vinculados a los glicoconjugados produce anomalías en la estructura química de estos compuestos que impiden el desarrollo normal de la correspondiente función biológica. Tales anomalías pueden afectar a las rutas biosintéticas (desórdenes congénitos de glicosilación) o a las rutas catabólicas (anomalías por almacenamiento causadas por enzimas lisosómicas). Por fortuna, actualmente se dispone de agentes que son glicoconjugados o están relacionados con ellos que facilitan la prevención o la curación de enfermedades como la gripe, el SIDA, el cáncer, etc. Últimamente se ha intensificado la investigación con finalidad terapéutica mediante nuevos enfoques inmunológicos o genéticos relativos a los glicoconjugados, según se indica en este artículo.
ABSTRACT:
Mainly N-acetylneuraminic acid (NeuAc) and N-glycolylneuraminic acid (NeuGc) exhibit very important peculiarities in certain biological (both physiological and pathological) processes. These acids are components of the glycoconjugates. Glycoconjugates are molecules resulting of the covalent link between carbohydrates and proteins or between carbohydrates and lipids. The disregulation of enzymes which catalyse the metabolic processess related to glycoconjugates produces anomalies in the chemical structure of these compounds which preclude their normal biological function, by abnormalities in the biosynthetic route (Congenital Disorders of Glycosylation) or abnormalities in the catabolic way (Lysosomal Storage Disorders). Fortunately, several agents related to glycoconjugates are now available to prevent or heal illness such as influenza, AIDS, cancer, etc. In this wiew, the research on immunological and genetic features of glycoconjugates with a therapeutic finality has been recently increased, as shown in this paper.
Palabras clave:
Glicoconjugados; Ácidos siálicos; Ácido N-acetilneuramínico; Ácido N-glicolilneuramínico; Gangliósidos; Glicosilación; Glicopatología; Glicoterapéutica; Sistemas CRISPR; Siglects
Sesión científica del 21 de marzo de 2019
1. ANTECEDENTES
A partir de la década de 1970 se han intensificado enormemente las investigaciones sobre la estructura química, las funciones fisiológicas y la actividad patológica de los compuestos que en esa época denominó por primera vez “glycoconjugués” el Prof. Jean Montreuil, Catedrático de Bioquímica de la Facultad de Farmacia de la Universidad de Lille (Francia). Los glicoconjugados (o “glycocojugates” en la nomenclatura anglosajona) resultan de la unión fuerte (covalente) de una fracción glucídica (denominada “glicano”) y otro componente que puede ser protídico o lipídico.
Constituida la “International Organization on Glycoconjugates”, desde el Simposio II celebrado en Villeneuve d’Ascq-Lille, en 1973, –con asistencia de 144 participantes (franceses, alemanes, italianos y quien suscribe)–, cada 2 años han tenido lugar otros simposios sobre glicoconjugados en muy diversos países, con tendencia al aumento de participantes (solo condicionado por la lejanía o proximidad geográfica del lugar del encuentro); aumento que ha sido paralelo al número y variedad de los temas de las comunicaciones.
Así, limitando un somero análisis al intervalo de los años 1973 a 1993, se observa que en el simposio III (Brighton, año 1975), siguiente al primero europeo, que fue el II, celebrado en Lille (ya que el I, desarrollado en Houston, tuvo escasa repercusión en Europa, cuna de la inicial investigación sobre este tema), fueron 268 los participantes. En el IV (Woods Hole, 1977), 373; en el V (Kiel, 1979), 536; en el VI (Tokio, 1981), 460; en el VII (Lund, 1983), 561; en el VIII (Houston, 1985), 458; en el IX (Lille, 1987), 788; en el X (Jerusalén, 1989), 411; en el XI (Toronto, 1991), 750; en el XII (Cracovia, 1993), 482… Otros simposios se han celebrado posteriormente, como se comentará después.
En lo que concierne a aspectos estructurales, metabólicos y de localización celular de los glicoconjugados, recuérdese que las glicoproteínas se clasifican en dos grupos: las de enlace O-glicosídico, que se establece entre la N-acetilgalactosamina y el aminoácido serina (o con la treonina); y las de enlace N-glicosídico, en las que es la N-acetilglucosamina la que se une con la asparragina, originándose tres tipos de glicoproteínas. Estas son: las de tipo manosídico (en cuya composición predomina el monosacárido manosa); las de tipo híbrido (en las que además de manosa hay Nacetilglucosamina); y las de tipo complejo (en las que se incorpora como componente terminal el ácido siálico, predominantemente el N-acetilneuramínico en la especie humana).
Además de las glicoproteínas, otros grupos de glicoconjugados son: el de los proteoglicanos (en cuyo comentario no procede aquí entrar), y el de los glicoesfingolípidos, constituido por los gangliósidos (caracterizados por tener en su composición algún o algunos restos de ácidos siálicos, siempre en posición terminal), y los cerebrósidos (que carecen de tal residuo).
Otros datos relativos a estructura y biosíntesis y degradación de los glicoconjugados se detallan en algunas publicaciones (1-7), así como en los tratados o monografías bioquímicos.
Respecto a la influencia del componente glicánico en la función o en la actividad biológica del glicoconjugado; o, lo que es equivalente, la influencia de la glicosilación en dichos aspectos, téngase en cuenta, por ejemplo, que ese componente determina comportamientos tan importantes como el plegamiento de la proteína, el reconocimiento de ligandos, la estabilidad y la propia vida media del glicoconjugado o la inmunogenicidad, etc.
2. EJEMPLOS DE GLICOCONJUGADOS: SUS ACTIVIDADES FISIOLÓGICA Y PATOLÓGICA Y SUS APLICACIONES TERAPÉUTICAS
La simple mención de nombres como los siguientes permite deducir la importancia biológica de numerosos glicoconjugados como agentes dotados de interesantísimas actividades fisiológicas. He aquí algunos ejemplos:
- Colágeno
- Fibrinógeno
- Inmunoglobulinas
- Hormonas (tirotropina, gonadotropina, etc.)
- Enzimas (glicosidasas, proteasas, etc.)
- Lectinas
- Factores anticongelantes (en peces de la Antártida)
- Promotores de la liberación de linfocitos (interleucina 2)
- Con actividad transportadora de Fe (transferrina)
- Reguladores de la vida media de proteínas circulantes
- Agentes de protección y lubrificación (mucinas)
- Agentes favorecedores del funcionamiento del sistema nervioso (gangliósidos)
- Agentes que participan en procesos inmunitarios
- Agentes favorecedores de actividad antiinfecciosa
Pero, al ser agentes receptores localizados en las membranas celulares, así como antígenos, pueden desempeñar actividad perjudicial. (Véase más adelante).
Como ejemplos de fármacos (o agentes relacionados con la función terapéutica), que son glicoconjugados, se hallan, entre otros, los siguientes:
- Heparina
- Antibióticos aminoglicosídicos:
- Estreptomicina
- Neomicina
- Gentamicina
- Kanamicina
- Tobramicina
- Agentes antigripales (inhibidores de la neuraminidasa vírica)
- Antiadhesinas (antiinflamatorios no esteroideos)
- Ciertas citocinas
- Sulfato de glucosamina
- Manosa.
3. PECULIARIDADES Y FUNCIONES BIOLÓGICAS DEL ÁCIDO NACETILNEURAMÍNICO Y DEL ÁCIDO NGLICOLILNEURAMÍNICO
Así como las hexosas y hexosaminas, que forman la porción glicánica de glicoconjugados como las glicoproteínas y los esfingolípidos (cuya composición se indicó anteriormente), tienen una función esencialmente estructural –mientras que la fructosa es molécula no integrante de los glicoconjugados y se caracteriza por su papel eninentemente enegético– se caracterizan por su papel eminentemente energético, los ácidos siálicos actúan como componentes estructurales de los glicoconjugados, además de desempeñar también funciones biológicas muy especiales.
Cabe atribuir esas características de estos ácidos a la singularidad de su estructura, cuyo esqueleto (el ácido neuramínico) no es el las hexosas y hexosaminas (formado por seis átomos de carbono) sino que se halla formado por nueve carbonos. (Estos nueve átomos proceden de la unión de los seis procedentes de la N-acetilmanosamina-6-P con los tres del ácido pirúvico, activado como fosfoenolpiruvato, PEP, en su biosíntesis). Añádase a esta singularidad la diversidad y número de grupos que se unen a dichos nueve carbonos: un carboxilo, un cetónico, un desoxiosa, un amino y cinco hidroxilos. Tal singularidad podría explicar la tardanza en el establecimiento definitivo de la estructura química, logrado principalmente por E. Klenk y su discípulo H. Faillard, en Colonia (Alemania), en 1954, para el derivado acetilado de dicho ácido neuráminico que es el N-acetilneuramínico (Figura 1):
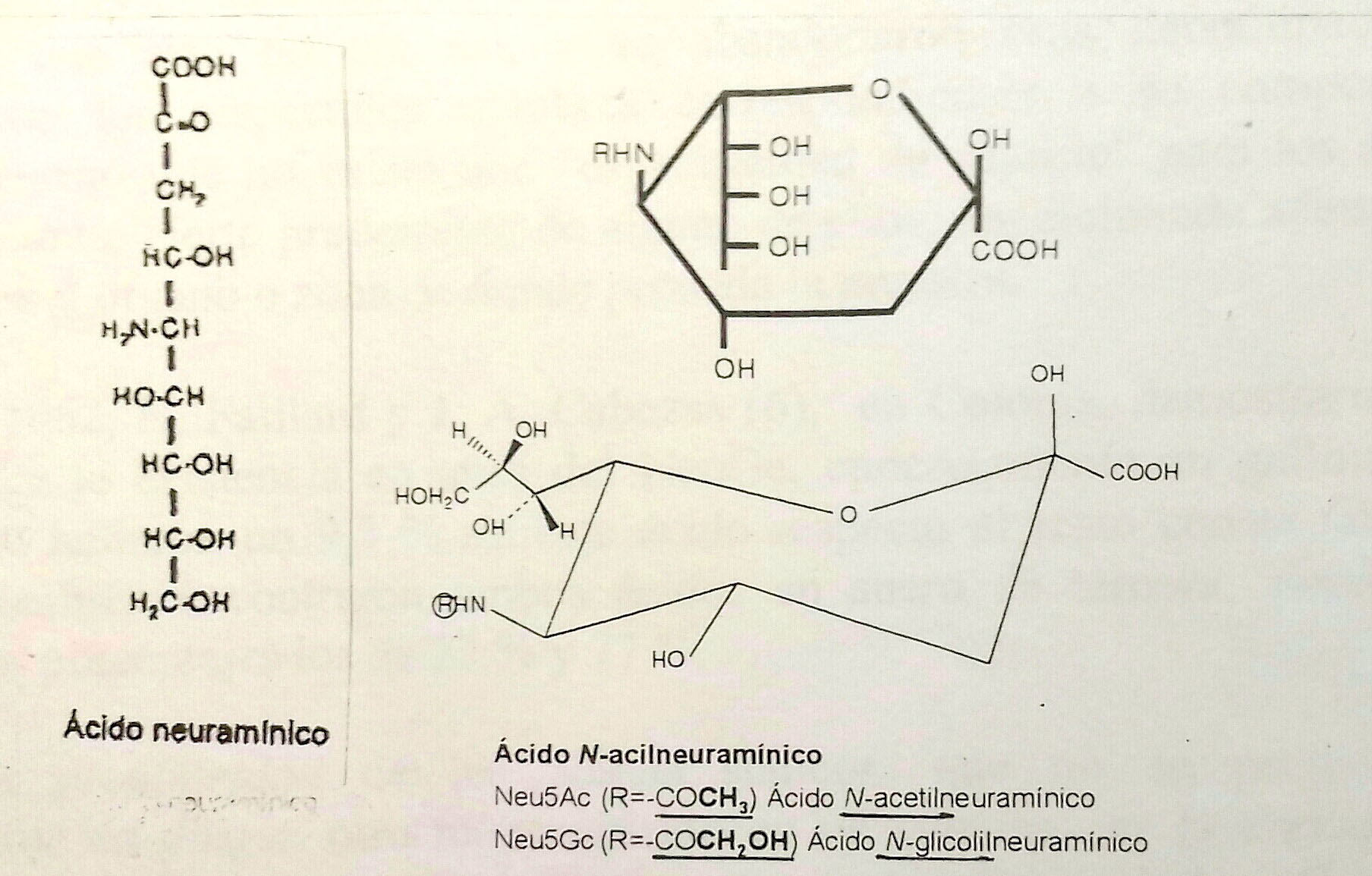
Entre los años 1954 y 1958 se identificaron en materiales procedentes de especies distintas de la humana ácidos siálicos que diferían en algunos casos del recién identificado N-acetilneuramínico; entre ellos uno que, en lugar de tener un resto de acetilo (COCH3), llevaba un resto de glicolilo (COCH2OH). Al primero se le llamó abreviadamente en un principio NANA (de “N-AcetylNeuraminic Acid”). Más tarde se ha eliminado esta abreviatura, reemplazándola oficialmente por las de “NeuAc” o “Neu5Ac”. Al glicolilneuramínico se le asignó la de NGNA; que se modificó después por las de “NeuGc” o “Neu5Gc”.
En los seres humanos, el NeuAc es el ácido siálico predominante, encontrándose también en menor proporción ácido diacetilneuramínico (DANA). Asimismo se halla, muy escasa y temporalmente, solo por aporte foráneo, el NeuGc; mientras que en los primates y otras especies como la porcina es este el más abundante. Dicho NeuGc procede de la reacción catalizada por una hidroxilasa (EC 1.14.13.45), con la colaboración de oxígeno y del citocromo b5. De esta enzima se carece en la especie humana. La aparentemente pequeña diferencia en la composición entre NeuAc y NeuGc –un átomo más de oxigeno en la del segundo– tiene sin embargo una gran importancia, según se comentará seguidamente.
El ácido siálico aislado por F. Zilliken et al., en 1958, de leche humana, inicialmente denominado “ginamínico” (1), se comprobó que es el NeuAc. Otros investigadores, F. Blix et al., en 1956, de materiales de ganado ovino y porcino obtuvieron los ácidos a los que se llamó, respectivamente, “O-siálico” y “P-siálico” (1), pensando que eran peculiares de dichas especies. Pronto se comprobó que esto no era así, y se abandonaron esas denominaciones, empleándose los respectivos nombres correspondientes a su composición química, puesto que no existe una “especificidad de especie” para los ácidos siálicos, sino un cierto predominio de alguno de ellos, condicionado además tal predominio al órgano o zona de donde proceda la muestra.
En 1962, H. Faillard y J. A. Cabezas (6), en Colonia, demostraron por primera vez la existencia en aves del NeuGc, concretamente en gallinas, en cuyo suero hallaron un 9,5 % de este ácido respecto al resto constituido por NeuAc; también encontraron ambos ácidos en suero de ternera, siendo los respectivos porcentajes los de 23 % y 77 %.
Una peculiaridad de los ácidos siálicos, que no se presenta ni remotamente en ningún otro monosacárido en tal cuantía, es la elevadísima diversidad de análogos estructurales, cuya estructura definitiva de los mismos se ha ido estableciendo en los últimos años. Así, R. Schauer, que había señalado en 2011 la existencia de ¡55!, en 2018 considera (7) que son ¡80!
Tal peculiaridad debe atribuirse principalmente a la posibilidad de enlace con el esqueleto del ácido neuramínico de grupos variados, y en numerosas posiciones, como son sus carbonos 4, 7, 8 o 9 para los grupos acetilo (CH3-CO), que incluso pueden ser también los diacetilo –exactamente: 7,8-di-O-acetilo, 7,9-di-Oacetilo, 8,9-di-O-acetilo–, y hasta un 7,8,9-tri-O-acetilo. Otros grupos susceptibles de tales uniones son: el hidroxilo (HO-), el fosfato (-PO3H2), el sulfato (-SO3H), el metilo (CH3-), el lactilo [CH3-C(OH)-CO], etc., si bien sus sitios de enlace quedan limitados a sólo un carbono determinado.
Otra peculiaridad es la de no haberse encontrado ácidos siálicos como constituyentes del reino vegetal, como demostró por primera vez J.A. Cabezas (6) en 1964; aunque sí se han hallado por numerosos investigadores en algunos invertebrados, y en algunos tipos de bacterias y virus.
En 1962 este autor (6) detectó, identificó y cuantificó por primera vez al ácido siálico existente en las lágrimas humanas, que resultó ser, únicamente, el Nacetilneuramínico. También en orina de adultos humanos encontró otro ácido siálico: el N-acetil-4-O-acetilneuramínico (6). Asimismo, se ha investigado por J. A. Cabezas et al., entre 1960 y 2004, la existencia, naturaleza y concentración de NeuAc, NeuGc y N, O, diacetilneuramínico en muestras obtenidas de las siguientes procedencias (6): humana (además de lágrimas y orina, calostro, leche y bilis); bovina (calostro y leche, así como leches maternizadas elaboradas con leche de vaca en España y Francia); equina (cerebro, cerebelo y bulbo); ovina y porcina (estroma de eritrocitos, plaquetas y bilis vesicular); caprina (suero, calostro, leche, hígado, estroma de eritrocitos y cerebro de adultos y jóvenes); rata (suero, hígado y bilis vesicular); gallina (suero). Excepto en los materiales humanos (con sólo NeuAc), en todos los demás se hallaron NeuAc y NeuGc, en proporciones variables, y en alguno también un N,O,diacetilneuramínico. Y en huevas de caballa (pez teleósteo) y del ciclóstomo lamprea, se ha encontrado triple porcentaje de NeuAc respecto a N,O,diacetilneuramínico, pero no NeuGc (6).
Esta ausencia de NeuGc sería otra peculiaridad, coincidente con la detectada (en los animales jóvenes) o su escaso porcentaje (inferior al 3 % en los adultos) en el cerebro de cabras, asnos, caballos y mulos (6); presentándose así un paralelismo con lo que ocurre en la especie humana.
Actualmente se conocen con cierto detalle algunas de las importantísimas funciones biológicas desarrolladas mediante la participación de los ácidos NeuAc y NeuGc. Sin intentar establecer generalizaciones, quizá sí se pueda anticipar que tales funciones son mayoritariamente de tipo fisiológico, pero que algunas pueden derivar en trastornos patológicos, dependiendo de qué ácido o de su concentración, según se indicará seguidamente.
Tales funciones son debidas principalmente a:
- Su carga negativa, que influye poderosamente al hallarse estos ácidos en posición periférica de las moléculas de glicoproteínas y gangliósidos.
- Ser antígenos muy específicos.
- Ser sitios de reconocimiento celular; o factores de anti-reconocimiento, por enmascaramiento (alargando la vida media de glicoproteínas).
- Ser protectores frente a ataques enzimáticos, modulando funciones de su entorno celular
- Cada uno de estos dos ácidos participa en procesos biológicos:
- Fisiológicos: El NeuAc de la zona pelúcida del óvulo facilitando la unión y la penetración en él del espermatozoide.
- Inmunitarios: El NeuGc ocasiona la “enfermedad del suero”, frecuente en épocas anteriores a la de los antibióticos, que solían sufrir las personas a las que se aplicaba una segunda inyección de suero antitetánico procedente de caballos para combatir el tétanos y otras enfermedades. Actualmente se sabe que el agente responsable de esa dolorosísima respuesta anafiláctica es un antígeno heterófilo de naturaleza glicoesfingolipídica (conteniendo NeuGc) existente en los équidos y otros mamíferos, pero no en los humanos, que actúa produciendo anticuerpos en éstos después de la primera inyección de ese suero
Asimismo, el riesgo de rechazo a los xenotransplantes o heterotransplantes puede ser ocasionado por el NeuGc. Se intenta evitarlo enmascarándolo mediante la incorporación de fucosa en las moléculas de los glicocojugados.
- Infecciosos: Ambos ácidos se comportan en relación con la malaria de forma muy diferente. Con la gripe, tiene el virus de ésta mayor facilidad para fijarse en glicoconjugados conteniendo NeuGc respecto a los de NeuAc. También ambos tienen relación con otras enfermedades.
- Dietéticos: El NeuAc del calostro y leche de mujer actúa favorablemente como agente antiinfeccioso, mientras que el NeuGc se considera como potencialmente tóxico para el cerebro. El aporte de éste (procedente de carnes rojas u otros alimentos) se elimina normalmente por los seres humanos.
- Cancerígenos y otros: El NeuGc es un “antígeno oncofetal” que se expresa en tejidos fetales y desaparece en la vida adulta, pero que puede re-expresarse durante la transformación maligna, coincidente con una hipersialilación en la superficie celular e incremento de NeuGc que favorece la inflamación.
Con el NeuGc se hallan relacionadas también otras enfermedades como la sialuria, la esquizofrenia, la diabetes tipo II y la de Alzheimer.
- Terapéuticos: Últimamente casi la mitad de las proteínas de uso terapéutico son glicosiladas (véase en “Ejemplos de glicoconjugados… con aplicaciones terapéuticas”). La hipersialilación de la molécula de sialoglicoproteínas como la eritropoyetina, la hormona luteinizante, etc., aumenta su vida media
4. RECIENTES ENFOQUES TERAPÉUTICOS RELACIONADOS CON GLICOCONJUGADOS
Como era previsible, los más destacados enfoques relacionados con la inmunoterapia contra el cáncer (tema por el que se ha concedido en 2018 el Premio Nobel a James P. Allison y a Tasuku Honjo), así como otros enfoques terapéuticos como los relativos al sistema CRISPR –acrónimo de “Clustered Regularly Interspaced Palindromic Repeats” (= “repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas”)–, que permite modificar el ADN de cualquier organismo con relativa facilidad y economía, eliminando fragmentos de ADN o situándolos en otros cromosomas, con lo que se pueden anular defectos genéticos y puede lograrse que un gen determine la producción de las proteínas adecuadas para el funcionamiento normal de un organismo), investigaciones en las que ha sido pionero el alicantino Francisco Martínez Mojica, han sido tomados en consideración por numerosos investigadores que trabajan en el área de la Glicoterapéutica, con resultados muy prometedores.
En efecto, ya en el “2013 International Symposium on Chemical Glycobiology”, celebrado en China en 2013, se presentó una comunicación (por Y. Gao et al.) sobre el uso de una asociación de un glicopéptido y un lipopéptido como vacuna contra el cáncer, buscando la respuesta inmune.
También en ese simposio, otra comunicación (de J. Francis et al.) es relativa a la detección de cáncer de ovario mediante anticuerpos que se corresponden con glicoesfingolípidos.
Asimismo, otro trabajo allí expuesto confirma que la glicosilación de las proteínas regula procesos patológicos como el cáncer. Concretamente, los niveles de Nacetilglucosamina se hallan elevados en múltiples tipos de tumores; causando la disminución de tales niveles la inhibición del aumento del tumor (Y. Wen).
Por otro lado, la cada vez más intensa interrelación entre GLICOCONJUGADOS Y GENÉTICA se ha mostrado en un amplio artículo (de J. Lauc et al.) publicado por la revista Frontiers in Genetics el 23-V2014, cuyo título y epígrafes de capítulos expresan claramente sus interesantes contenidos. Estos son:
- Glycans – the third revolution in evolution.
- Glycans are One of Four Major Groups of Macromolecules.
- Glycans Perform Numerous Functions in Complex Organisms.
- Glycans Provide Higher Eukaryotes with Unique Advantages.
- Glycans Enable Dynamic Epigenetic Adaptation.
Además, la importancia de la investigación sobre los ácidos siálicos dentro del campo de los glicoconjugados se ha ido incrementando a tal ritmo, desde sus relativamente recientes comienzos en la década de 1950, que ha determinado la celebración de simposios dedicados exclusivamente a variadas cuestiones sobre dichos ácidos, con una periodicidad de 2 o 3 años, en muy diferentes países de todo el mundo. El último de ellos ha sido el “Canadian Glycomics Symposium”, que ha tenido lugar en Banff, Alberta, Canadá, entre el 10 y el 14 de mayo de 2018, con el nombre de “Sialoglyco 2018”.
En el volumen de RESÚMENES de dicho simposio, por la novedad de su tema, cabe destacar algunos como los relativos a aspectos genéticos. Entre ellos el de A. Everest-Dass et al., que usan el sistema CRISPR-Cas9 para suprimir ciertos genes que codifican transferasas implicadas en el aumento de la sialilación que ocasiona metástasis en cáncer de ovario.
También en la comunicación presentada por S. Wisnovsky et al. se utiliza para el cribado genético un sistema CRISPR que identifica genes cuya ablación reduce la unión (“binding”) de las “Siglecs” (= “Sialic acid-binding immunoglobulin-type lectins”), lectinas que se enlazan con los ácidos siálicos de la superficie celular.
Análogamente, el título de otra comunicación (la de E. Rodrigues et al.) es el siguiente: “A New Generation of Soluble Siglecs to Explore the Role of Glycans in Controlling Immune Cell Function”.
Igualmente relacionada con las Siglects (en este caso con inhibidores de ellas) es la comunicación de C. M. Nycholat et al.)
Y, asimismo, lo es la relativa a la vectorización de la Siglect CD22 (descrita por J. Ereño Orbea et al.).
Otro tipo de lectinas, las galectinas, se hallan predominantemente en el citosol. Son “capaces de detectar alteraciones de la sialilación de la superficie celular y modulan la respuesta celular” (según M.-H. Hong et al.).
Por otro lado, se ha ampliado el conocimiento de las funciones de los gangliósidos, como se deduce del trabajo de R. K. Yu, titulado: “Glycobiology of neural stem cells: Roles of gangliosides in cell fate determination”
Y la regulación de la biosíntesis de gangliósidos y su expresión en cáncer de mama es el objeto de la comunicación de J. H. Dewald et al.
Que los ácidos siálicos se hallan muy relacionados con la patología de enfermedades infecciosas es un aspecto de los mismos bien conocido desde tiempo atrás, confirmado en la comunicación de S. Srivastava et al.
En relación con la gripe y los inhibidores de sus virus destaca el trabajo de C.W. Cairo, así como el de C. Colombo et al., titulado: ”Desing and synthesis of candidate inhibitors of influenza A neuraminidase based on contrained bicyclic molecules”.
También la comunicación de T. Guo et al. tiene una orientación similar, referida en este caso a compuestos análogos al ácido 2,3-dideshidro-N-acetilneuramínico (DANA) como potentes inhibidores de esta enzima.
Asimismo, un enfoque novedoso sobre este tema es el expuesto por M A. Gray et al. cuyo título es: “Generating antibody-sialidase conjugates to modulate cell surface sialylation”, en que se estudia la faceta inmune.
Muy peculiar y diferente del papel tradicionalmente asignado al ácido N-glicolilneuramínico (NGNA) es el que se le da en la comunicación de T. Takashashi et al. con el largo y expresivo título siguiente: “N-glycolylneuraminic acid on human epithelial cells prevents entry of influenza A viruses that possess N-glycolylneuraminic acid binding ability”.
Para el ácido polisiálico, Thiesler et al. indican conflictivos resultados (como agente beneficioso o perjudicial) en tumores cerebrales.
El desarrollo de nuevos inhibidores de la polisialiltransferasa (que cataliza la biosíntesis de dicho ácido polisiálico) se orienta a su potencial uso terapéutico, según la investigación de X. Guo et al.
K. C. Willians et al. consideran al ácido polisiálico como marcador del cáncer de próstata preferible al PSA (“prostatic-specific antigen”).
Además de todo lo anterior, acerca de “Sialic Acids in Tumors”, “The Role of Sialic Acids in Immunology”, “Siglecs” and “Hereditary Sialic Acids Diseases”, así como sobre otros temas relacionados, dos prestigiosos investigadores, los Profesores Roland Schauer (alemán) y Johannis P. Kamerling (holandés), han escrito conjuntamente el amplio capítulo (de 213 páginas conteniendo 1171 referencias) titulado “Exploration of the Sialic Acid World”, para el volumen 75 de “Advances in Carbohydrate Chemistry and Biochemistry”, año 2018, “Elsevier Inc.” Su consulta es muy interesante.
5. REFERENCIAS
- Cabezas JA. Acides sialiques: Leur signification biochimique. Le Pharmacien Biologiste, II, Numero Special, Biarritz, XI-XIX (Conférence de l’APDILA) 1961.
- Cabezas JA. Glicobiología: Antecedentes y evolución de su contenido. Discurso de apertura del curso 1993-94. Universidad de Salamanca 1993; pp. 1-102.
(Existe versión en inglés: Glycobiology: Background and Development. University of Salamanca. Legal Deposit: S. 692-1993. 1-81). - Cabezas JA. Glicoconjugados: Algunos aspectos bioquímicos y farmacéuticos. An R Acad Farm 1995; 61: 177-188.
- Cabezas JA. Glicoconjugados: Su participación en funciones de los seres vivos. Mundo Científico 1995; 159: 634-659
- Cabezas JA. Glicociencia: Glicobiología, Glicopatología, Glicoterapéutica, Glico(bio)tecnología. Madrid: Instituto de España 2000; pp. 1-54.
- Cabezas JA. El ácido siálico N-glicolilneuramínico: Su relación con la biodiversidad y con procesos inmunitarios e infecciosos. An R Acad Nac Farm 2011; 77: 72-86.
- Schauer R., Kamerling JP. Exploration of the Sialic Acid World. Advances in Cabohydrate Chemistry and Biochemistry. Elsevier Inc. 2018; Vol. 75, pp. 1-213.
