1. VACUNAS
1.1. Historia de las vacunas
Según la Organización Mundial de la Salud (OMS) se entiende por vacunación a una forma sencilla, inocua y eficaz de protegernos contra enfermedades dañinas antes de entrar en contacto con ellas. Las vacunas activan las defensas naturales del organismo para que aprendan a resistir a infecciones específicas, y fortalecen el sistema inmunitario. En consecuencia se trata de un medicamento con carácter preventivo. El método más habitual para administrar las vacunas es por la vía parenteral (intramuscular); existen, además, otras vías como la oral, intranasal, etc.
Las vacunas son la forma más eficaz de prevenir millones de casos de enfermedad, discapacidad o muerte. Gracias a ellas, además de erradicar la viruela en 1980, se han podido controlar otras enfermedades infecciosas como la rabia, cólera, tétanos, difteria, peste, tuberculosis, tifus, poliomielitis, sarampión, paperas, rubéola, meningitis, hepatitis A y B, gripe, etc (1).
En los últimos años, coincidiendo con la presente pandemia COVID-19 (2020) se ha manifestado el movimiento antivacuna, esto es, personas que se oponen a la vacunación. En el año 2019 y coincidiendo con el lamentable resurgir del sarampión en todo el mundo (se han notificado más de 140.000 muertes), la OMS catalogó esta actitud negativista como una de las diez principales amenazas para la salud del mundo (2).
Las vacunas, cuya historia comenzó hace algo más de 200 años con el descubrimiento de Edward Jenner (1796) es uno de los mayores logros de la sanidad, junto con la incorporación de medidas higiénicas (antisépticos) y de los antibióticos, de forma que han permitido prolongar, tan solo y lamentablemente en los países más desarrollados, la esperanza de vida de la población.
Los programas de inmunización son indispensables, aunque desgraciadamente no llegan siempre a los más necesitados. Son evidentes las dificultades que a veces suceden, como en este tiempo con la vacuna para la COVID-19; es necesario mantener una cadena de frío para su distribución, especialmente para las vacunas de ARNm (Pfizer/BioNTech y Moderna), que permita entregar el medicamento estable (alcance intacto del organismo), seguro (no provoque toxicidad) y eficaz (produzca el efecto deseado).
Desde que Jenner descubriera ese método de inmunización, se han obtenido numerosas vacunas entre las que destacan la de la rabia, desarrollada por Louis Pasteur en 1885 y contra el cólera, también ese mismo año por el español Jaime Ferrán; algunas más actuales como la vacuna frente el meningococo C (1968) y meningococo A (1976) por Gotschlic. Asimismo, en 1976 por Maupas y Hilleman, contra la hepatitis B. Evidentemente, las políticas sanitarias sobre la vacunación son necesarias, de este modo la viruela ha podido ser erradicada en 1980 (Informe OMS, 2020).
En 1857 Louis Pasteur (Fig. 1) demuestra que las infecciones están relacionadas con los microorganismos que se pueden cultivar y, por lo tanto, estudiar. En 1880 comprueba que es posible protegerse de las enfermedades infecciosas mediante la inyección de gérmenes atenuados, después de ensayos con resultados favorables tratando enfermedades en animales, como el cólera de las gallinas. En 1885 aplica su tratamiento al joven Joseph Meister, quien había estado expuesto al virus de la rabia y lo salva. En los 15 meses siguientes más de 2.500 víctimas de mordeduras de perros rabiosos fueron inmunizadas con éxito de la misma manera.
Figura 1. Foto de archivo de Edward Jenner (izquierda) y Louis Pasteur (derecha). Edward Jenner vacunando a su hijo de la viruela [3]. Louis Pasteur sosteniendo unos conejos utilizados para el desarrollo de la vacuna de la rabia [4].
Sin embargo, la denominación de “vacuna” no se introdujo hasta unos años posteriores, habría que esperar al Congreso Internacional de Medicina de Londres en 1881, cuando el término fue acuñado por Louis Pasteur (5), en honor a los experimentos realizados con las vacas por Jenner. A finales del siglo XIX, la incidencia de la viruela había disminuido notablemente pese a los problemas importantes con los que se encontró: reticencias de sectores de la población a vacunarse, problemas de producción, conservación y distribución de la linfa vacunal, desigual impulso de las campañas de vacunación, así como la constatación de algunos efectos adversos que generaron intensos debates científicos.
Otro ejemplo relevante es el de la vacuna frente la polio. Las epidemias de esta enfermedad impactaban socialmente por las graves secuelas de su forma paralítica presentes en sus víctimas, sobre todo en la población infantil. El desarrollo de dos vacunas efectivas, la inyectable de Salk en 1955 y la oral de Sabin en 1961, supuso un avance sustancial en la prevención de esta enfermedad.
Entre los descubrimientos de las vacunas de la viruela y la de la polio tuvieron lugar otros de gran importancia como la antirrábica, anticolérica, antidiftérica, antituberculosa, etc. Posteriormente, desde la década de 1960 la disponibilidad de las vacunas aumentó con las del sarampión, paperas, rubeola (triple vírica), hepatitis A y B, etc. (Fig. 2).
Figura 2. Principales vacunas aprobadas entre el Siglo XX y el XXI [6].
1.2. Tipos de vacunas
Las vacunas actúan induciendo al sistema inmunitario a reconocer ciertos virus, bacterias o toxoides. Tras recibir una vacuna, el organismo estará más preparado para defenderse cuando contacte de nuevo con el patógeno. Estos medicamentos ayudan a evitar o reducir la gravedad de una enfermedad si se está expuesto al virus, bacteria o toxina que la provoca.
Se emplean diversas técnicas diferentes para su fabricación; cada una de ellas la desarrollará de una forma específica:
- Vacunas vivas atenuadas: utilizan una forma debilitada del virus que causa la enfermedad. Crean una respuesta inmunitaria fuerte y de larga duración. Una o dos dosis pueden proteger durante toda la vida contra un patógeno y así de la enfermedad que causa, por ejemplo: sarampión, paperas, rubéola, viruela, varicela, fiebre amarilla, etc.
- Vacunas inactivadas: se parte de un microorganismo muerto que causa la enfermedad. No suelen proporcionar una inmunidad tan fuerte como la de las vacunas vivas. Normalmente, requieren varias dosis con el tiempo (vacunas de refuerzo) para alcanzar una inmunidad continua. Protegen contra la hepatitis A, gripe, polio o rabia, entre otras enfermedades. Es el caso de la recientemente vacuna Valneva, la sexta aprobada por la Agencia Europea del Medicamento (EMA), para prevenir la COVID-19.
- Vacunas de vector viral: este tipo de vacuna se basa en un virus inofensivo denominado “vector”. Es un vehículo que lleva instrucciones a las células sobre cómo crear defensas para combatir una determinada enfermedad. Se han realizado y publicado numerosos estudios científicos acerca de las vacunas vectoriales víricas existentes. Algunas utilizadas recientemente para tratar los brotes de Ébola contienen vectores víricos. Actualmente, se llevan a cabo ensayos para comprobar su utilidad para prevenir enfermedades infecciosas como la fiebre Zika, gripe o infección por VIH. Es el caso de las actuales vacunas para prevenir la COVID -19 desarrolladas por AstraZeneca y Janssen.
- Vacunas con toxoides: emplean una toxina (producto nocivo) fabricada a partir del germen que causa la enfermedad. Crean inmunidad a ciertas fracciones del germen en lugar de a su totalidad; la respuesta inmunitaria va dirigida a la toxina. Es posible que necesiten dosis de refuerzo para mantener la eficacia, es el caso de las utilizadas para proteger la difteria o el tétanos.
- Vacunas de subunidades proteicas: consideran únicamente pequeños fragmentos de las mismas, las cuales no pueden contagiar la enfermedad puesto que se tratan de una parte específica del germen, como una proteína, azúcar o cápsula (una carcasa que rodea al germen). Ofrecen una respuesta inmunitaria muy fuerte. Pueden emplearse en prácticamente cualquier persona incluso en aquellas con sistemas inmunitarios debilitados o patologías crónicas. En la década de 1980 se ofrece, por primera vez, una vacuna de estas características para prevenir la hepatitis B. Esta tecnología se ha utilizado en la preparación de otras vacunas, como la del herpes zóster y virus del papiloma humano (VPH). Novavax se basa en esta tecnología, para desarrollar su vacuna frente a la COVID-19. La principal limitación es que requiere dosis de refuerzo.
- Vacunas de ARN mensajero (ARNm): son un tipo nuevo de vacuna. La misma enseña a nuestras células a fabricar una proteína que imita a la que hay en la superficie del virus que utiliza para infectar. Una vez que nuestro organismo ha creado la proteína, el sistema inmunitario aprende a reconocerla como un blanco y se prepara para combatir el virus real cuando éste aparezca. Es el caso de las actuales vacunas de ARNm, Pfizer/BioNTech y Moderna, vacunas contra la COVID-19. Asimismo, se ha estudiado su utilidad contra otras enfermedades como el ébola y la fiebre de Zika.
2.VIRUS
Son unos microorganismos infecciosos que constan de un segmento de ácido nucleico: ácido desoxirribonucleico (ADN) o ácido ribonucleico (ARN), envuelto por una cubierta proteica. La palabra virus proviene del latín “virus”, en griego ἰός “toxina”o “veneno”. Sin embargo, los antiguos griegos no fueron los descubridores de estos pequeños agentes infecciosos. La primera aproximación de los médicos a los virus fue en el siglo XIX, gracias a la “Teoría Germinal de las Enfermedades” de Louis Pasteur, quien había estado trabajando con la enfermedad de la rabia y sabía que se transmitía a humanos por la mordedura de un perro infectado. Sin embargo, Pasteur fue incapaz de observar el agente infeccioso. Elaboró una teoría en la que defendía que las enfermedades estaban causadas por “pequeños agentes infecciosos” que se reproducían en el interior de un organismo y se propagaban a otras personas haciéndolas enfermar. No estaba muy equivocado, aunque su definición de germen incluía otros elementos además de virus, bacterias, hongos, etc.
El primer virus que se describió como tal fue el del mosaico del tabaco en 1899. El biólogo ruso Dimitri Ivanovski experimentando con plantas del tabaco había filtrado extractos de hojas infectadas del mismo a través de un filtro Chamberland, capaz de separar agentes infecciosos bacterianos. El científico ruso observó que, tras dicho proceso, los extractos seguían siendo infecciosos, vinculándolo a algún tipo de toxina liberada por bacterias patógenas. Sin embargo, el microbiólogo Martinus Beijerinck al repetir los experimentos, demostró que se trataba de un nuevo tipo de agente infeccioso que denominó “virus” o “germen viviente soluble”.
De igual manera que existen virus cuyo material genético está organizado en forma de ADN, otros utilizan el ARN para ello. Entre los virus de ARN (según la clasificación de Baltimore) se incluyen: los ARN bicatenario (Grupo III), ARN monocatenario positivo (Grupo IV), ARN monocatenario negativo (Grupo V) y ARN monocatenario retrotranscrito (Grupo VI) (7).
En el tipo de virus grupo IV, las moléculas de ARN monocatenaria son de polaridad positiva, propiedad importante ya que la polaridad del ARNm celular también lo es. De esta forma llegan con ventaja a la célula y pueden ser traducidos directamente. Ejemplos son los virus del mosaico del tabaco, hepatitis A, fiebre amarilla, resfriado común y el coronavirus, el actual SARS-CoV-2 causante de la enfermedad COVID-19.
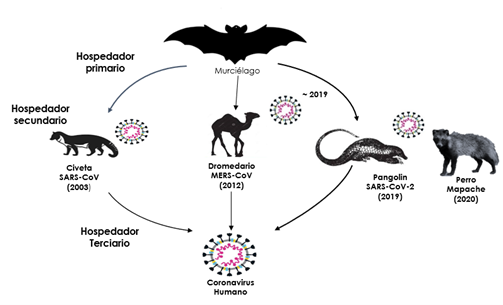
Recientemente se ha sugerido, en ese sentido, que en lugar del Pangolín puede haber sido un perro Mapache el hospedador intermediario.
Los Coronavirus pertenecen al orden de los Nidovirales, familia Coronaviridae y subfamilia Coronavirinae. Los cuatro primeros son estacionales y causan el frecuente resfriado común. Los dos siguientes, el SARS-CoV-1 y el MERS, provocaron enfermedades respiratorias cada vez más graves y causaron cientos de fallecimientos antes de desaparecer y también antes de disponer de la vacuna frente a ellos. El último es el nuevo coronavirus, el denominado SARS-CoV-2, así definido por presentar un conjunto de espículas en su superficie. Las mismas pueden unirse a un receptor específico (Enzima convertidora de angiotensina 2 (ECA2)), proceso especialmente grave cuando tiene lugar a nivel de las células pulmonares sanas e infectarlas.
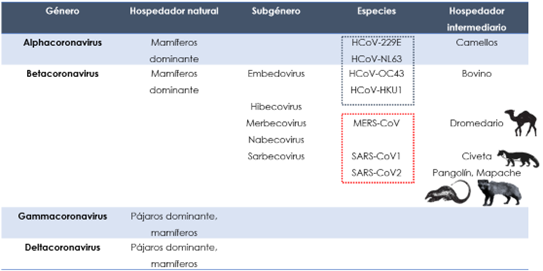
En la Tabla 1 se indican los diferentes tipos de coronavirus humanos y el hospedador natural e intermediario. Los siete coronavirus que infectan a los humanos se denominan HCoV (coronavirus humano); pertenecen a los géneros Alfacoronavirus (HCoV-229E y HCoVNL63) y Betacoronavirus (HCoV-OC43, HCoV-HKU1, SARS-CoV-1, MERS-CoV y SARS-CoV-2). Tanto los alfacoronavirus como los betacoronavirus infectan principalmente a los mamíferos, mientras que los virus de los géneros Gammacoronavirus y Deltacoronavirus infectan a las aves y mamíferos (8). El género Betacoronavirus se divide, en varios subgéneros incluyendo Sarbecovirus, Hibecovirus, Nobecovirus, Merbecovirus y Embecovirus (9). De los cinco HCoV, los betacoronavirus MERS-CoV es un merbecovirus, mientras que tanto HCoV-OC43 como HCoV-HKU1 son embecovirus. Se deduce de la secuenciación del genoma completo que tanto el SARS-CoV-1 como el SARS-CoV-2 están en el subgénero Sarbecovirus y comparten el 79% de similitud genética a nivel de nucleótidos (10).
Tabla 1. Clasificación de los coronavirus humanos (6)
La similitud genética es alta (96 %) entre el SARS-CoV-2 y un coronavirus de murciélago (Fig. 3) relacionado con el SARS lo que indica que el SARS-CoV-2 podría haberse originado en los murciélagos. No obstante, existen dudas de que el hospedador intermediario sea el Pangolín (11).
Figura 3. Transmisión del coronavirus. Diferentes hospedadores en la trasmisión del SARS-CoV-2. de Zhou et al. (11).
El primer coronavirus en animales se descubrió en 1930. Hubo que esperar hasta el año 1965 para que se detectase en un ser humano. Desde entonces han aparecido tres tipos de coronavirus especialmente patógenos (Fig. 4).
Figura 4. Historia sobre la propagación de los coronavirus (12).
2.1. SARS-CoV-2
A principios del 2020, tras el incremento de contagios por SARS-CoV-2 procedentes del continente asiático, la OMS dio a conocer el nombre de la enfermedad que comenzó a propagarse en la ciudad de Wuhan, China, y que provocó cierto desconcierto a los expertos en salud: “Tenemos un nombre para la enfermedad: es la COVID-19”, dijo el director de la OMS, Tedros Adhanom. De acuerdo a la explicación de la OMS, el nuevo nombre se toma de las palabras “corona” (co), “virus” (vi) y disease (enfermedad en inglés) (d), mientras que 19 representa el año en que surgió (el brote se notificó a la OMS el 31 de diciembre de 2019).
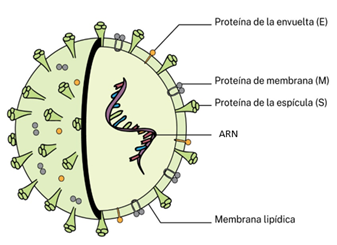
Al virus, el Comité Internacional de Taxonomía de Virus (ICTV) lo denominó SARS-CoV-2, un miembro de la familia de los Coronaviridae, como se indica en el apartado anterior. El SARS-CoV-2 tiene un tamaño de unos 100 nanómetros y su material genético o genoma consiste en una cadena simple de ARN. La cápside que protege está envuelta por una membrana de lípidos con diversas proteínas insertadas en ella, entre las que se encuentra la proteína espícula o “spike”, también conocida como proteína “S”, que forma las espículas tan características de este virus y le servirá para poder infectar a las células humanas y de otros animales (Fig. 5).
Figura 5. Estructura del SARS-CoV-2 con ARN como material genético (13).
El genoma de los coronavirus es el más grande de los virus ARN conocidos. El ARN tiene un alfabeto de solo cuatro letras: A, C, G, U, que combina para producir las diferentes proteínas estructurales que formarán la cápside y la envoltura lipídica. Además, los coronavirus codifican dos tipos de enzimas: las polimerasas y las proteasas. La polimerasa viral es la responsable de replicar el mensaje genético haciendo miles de copias de las 30.000 letras de su genoma y las proteasas participan en la construcción estructural de las partículas víricas.
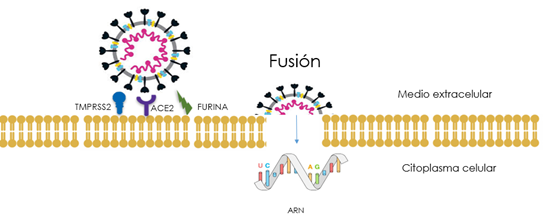
Los virus son microorganismos obligados a vivir dentro de las células, no pueden replicarse por sí mismos. Utilizan la maquinaria enzimática de las mismas para dividirse y formar más virus. Por ello tienen que entrar en el interior de la célula a través de ciertos receptores o puertas situados en la membrana celular.
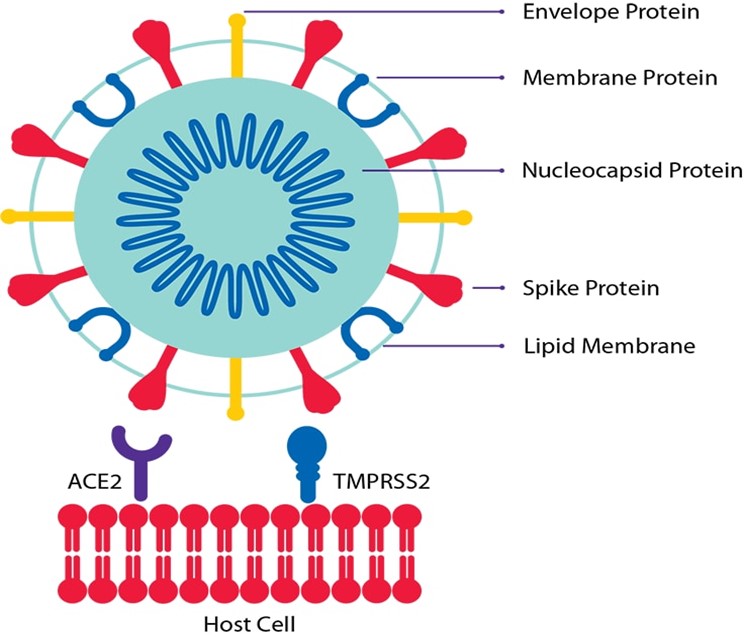
De esta forma, SARS-CoV-2, como el anterior SARS-CoV-1, mediante la proteína de espícula (S), interaccionan con el receptor enzima convertidora de la angiotensina 2 (ECA2) que se encuentra ampliamente distribuida en el organismo humano: mucosa respiratoria, digestiva, vasos sanguíneos, etc., comenzando así la infección. A mayor número de receptores, en principio, mayor riesgo de infección grave, lo que podría explicar que la obesidad (exceso de grasa abdominal) actúa como factor de riesgo en esta población (Fig. 6).
Figura 6. Especificidad unión ligando-receptor (A). Unión del SARS-CoV-2 a ECA2 (B). Proteínas estructurales Spike (S) de color rosado, Membrana (M) de color turquesa, Envoltura (E) de color azul y Nucleocápside (N) de color rojo. Estructura tridimensional de la proteína Spike (PDB: 6VXX) y su unión a ECA2 (color amarillo) en la membrana de la célula huésped (14, 15).
Además, la presencia en la membrana celular de la proteasa Serina Proteasa Transmembrana 2 (TMPRSS2) contribuye a una mayor infección por Sars-CoV-1 (Fig. 7).
Figura 7. Importancia de la TMPRSS2. En la infección. ACE2: Enzima Convertidora de Angiotensina 2
Tanto SARS-CoV-1 como SARS-CoV-2 se fijan al receptor ECA2. Sin embargo, el MERS-Cov tiene afinidad por el DPP4. En la Figura 8 se muestra la diferencia en el tipo de receptor: ECA2 para el SARS-CoV-1, SARS-CoV-2 y DPP4 en el caso del MERS-CoV. En cualquier caso, la proteasa que permite la entrada es la TMPRSS2.
Figura 8. Representación del mecanismo de entrada (endocitosis y fusión) en la célula para los Coronavirus MERS-CoV, SARS-CoV-1 y SARS-Cov-2.
Se ha propuesto la participación de otra proteasa, la furina, cuya presencia facilitaría la penetración celular y con ello la propagación de la infección junto con la colaboración adicional con el receptor ECA2 y con la TMPRSS2. La furina, que se encuentra en todo el organismo humano, participa en varias funciones celulares. Es una proteasa que puede descomponer las proteínas en componentes más pequeños, cortando o escindiendo los enlaces peptídicos polibásicos dentro de las proteínas. El virus necesita usar la furina de la célula huésped para cortar la proteína de la espícula en dos partes, S1 y S2, lo que hace que esté activa en las partículas virales para una transmisibilidad eficiente en el momento de la liberación (Fig.9). “El virus aprovecha la furina del huésped para transmitirse de una célula a otra. Este paso de activación adicional es lo que hace que el virus sea altamente transmisible” según Tanmoy Mondal, primer autor del estudio (16).
Figura 9. Mecanismo de entrada del SARS-CoV 2 en las células infectadas. Destaca la importancia del receptor ACE2 (Enzima Convertidora de Angiotensina 2) y de las proteasas: TMPRS22 y furina, a nivel de la membrana celular (6).
El nuevo virus, SARS-CoV-2, se propaga mucho más fácilmente que el que causó el síndrome respiratorio agudo grave responsable de la epidemia de 2002, SARS-CoV-1, (también un coronavirus) y ha infectado a muchas más personas que por entonces contrajeron este SARS. En definitiva, en el caso del SARS-CoV-2, después de la unión al receptor ECA2 es necesaria la participación de la TMPRSS2, así como de la furina que permiten que la puerta de la membrana celular abra el paso al virus (Fig. 9). Cuando actúa la furina, la proteína S del SARS-CoV-2 se vuelve más infectiva y aumenta su virulencia. Este receptor (ECA2) se expresa en numerosos tejidos humanos, incluidos los pulmones, el hígado y el intestino delgado, lo que significa que el virus tiene el potencial de atacar múltiples órganos y probablemente esto permite al SARS-CoV-2 infectar con mucha más facilidad tipos celulares que su predecesor SARS-CoV-1. Mediante estos mecanismos el coronavirus se introduce en la célula huésped por fusión y/o endocitosis con la membrana celular. La inhibición de la furina impediría la activación de la proteína S del SARS-CoV-2, suprimiendo la formación y liberación del péptido de fusión, por lo que evitaría la unión al receptor ECA2.
En este sentido actúa el nelfinavir, fármaco en uso para la infección por el VIH que inhibe a la furina. Algunos investigadores cuestionan que una combinación de un inhibidor de la furina con un inhibidor de la TMPRSS2 podría ser de interés terapéutico. Un ejemplo de ello es la combinación de nelfinavir y mesilato de camostat. No obstante, dicho ejemplo presenta ciertas limitaciones ya que la entrada del virus a la célula por endocitosis sigue activa. En el mismo sentido se está investigando la utilización de anticuerpos monoclonales como tratamiento para inhibir la actividad de la furina y por lo tanto limitar la infectividad del coronavirus. En cualquier caso, los investigadores se muestran cautelosos sobre la exagerada importancia que se atribuye al sitio de fijación en la rápida propagación del coronavirus.
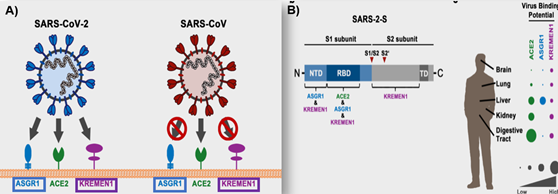
La amplia propagación de este virus se entiende dada la presencia de otros receptores celulares como ASGR1 y KREMEN 1, ampliamente presentes en diferentes órganos del cuerpo humano (Fig. 10).
Figura 10. Nuevos receptores (A). Afinidad del virus en diferentes órganos del cuerpo humano (B). S1 a través de RBD (dominio de unión al receptor) se une a ECA2, ASGR1 y KREMEN1; una región N terminal se fija a ASGR1 y KREMEN1. La fracción S2 se une a KREMEN1 (17).
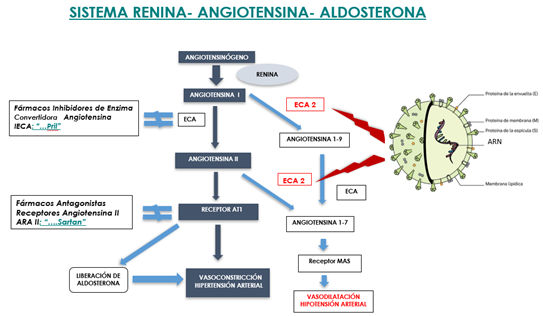
El receptor ECA2 según se ha comentado lo utiliza el virus para infectar, pero este receptor es por otra parte fundamental para mantener estable el sistema Renina-Angiotensina-Aldosterona implicado en la regulación de la tensión arterial. En consecuencia, surge la duda sobre la conveniencia de prescindir de medicamentos que actúan a este nivel (antihipertensivos) para de ese modo limitar la infección por el virus. La medicación antihipertensiva (medicamentos finalizados en -pril y -sartán, ejemplo captopril y valsartán, entre otros) ampliamente utilizados para tratar la hipertensión arterial, expresan un aumento de ECA2, con lo cual, tal como ya se ha comentado, esto implicaría una mayor infección vírica (Fig. 11 y 12).
Figura 11. Influencia de la medicación antihipertensiva en la infección por Sars-CoV2 (18).
Figura 12. Relación entre el SARS-CoV-2 y el SRAA: Medicación antihipertensiva. Modificada de Caravaca Pérez at al. (19).
3. ENSAYOS CLÍNICOS
Antes de iniciar un ensayo clínico en humanos, se lleva a cabo una amplia experimentación en animales para asegurar que las vacunas no producen reacciones adversas inesperadas, más o menos graves, e inducen protección, en este caso, contra el SARS-CoV-2. Esta fase, denominada preclínica, comienza con los estudios in vitro, realizados en un laboratorio y los estudios in vivo realizados en animales. En ellos se comprueban aspectos fundamentales como la toxicidad (seguridad) y la respuesta inmune (eficacia) que producen estos medicamentos. A continuación, de ser favorables estos resultados comienzan los ensayos clínicos; las vacunas se ensayan en voluntarios. Estas pruebas ayudan a conocer cómo funcionan y lo que es más importante, a evaluar su seguridad (no toxicidad) y eficacia protectora (generación anticuerpos).
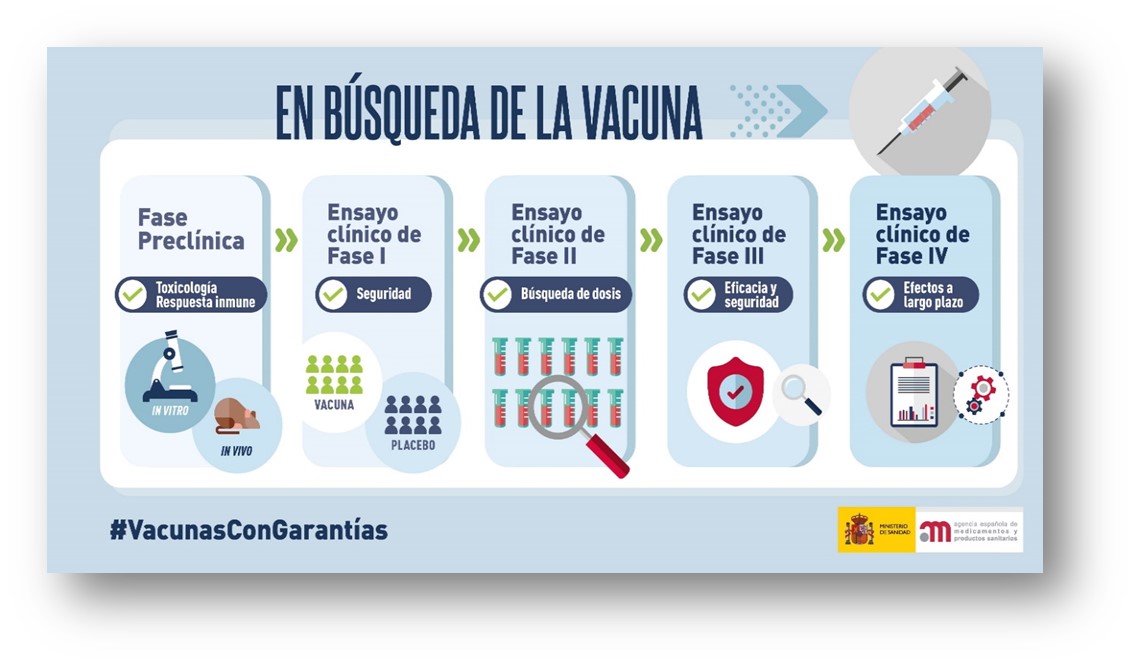
Los ensayos clínicos, estandarizados en las principales agencias reguladoras, se clasifican en cuatro fases (Fig. 13) que son a modo de resumen:
- Fase I: comprobación inicial acerca de la seguridad del fármaco.
- Fase II: obtención de datos a fin de verificar si el fármaco actúa tal como se espera; asimismo se realiza una búsqueda de la dosis más adecuada y del intervalo entre dosis.
- Fase III: se corroboran con mayor número de participantes los aspectos de seguridad y eficacia del fármaco.
- Fase IV: estudios de seguimiento; evaluación de los diferentes efectos a largo plazo tras la comercialización del medicamento.
Figura 13. Fases de los Ensayos Clínicos. (Agencia Española de Medicamentos y Productos Sanitarios, AEMPS, Ministerio de Sanidad, España.).
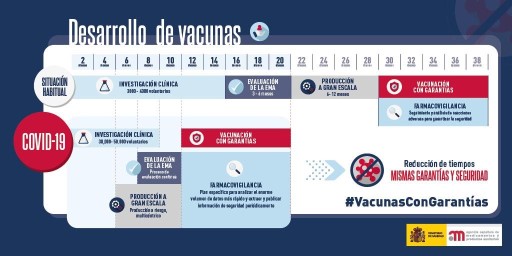
El desarrollo estándar de una vacuna es un proceso largo y los estudios se realizan en pasos secuenciales que suponen una media de entre cuatro y siete años. Pero la fabricación de las vacunas frente a la COVID-19 se ha acelerado enormemente, consiguiéndose su comercialización en algo menos de un año.
Desde el comienzo de la crisis, la Agencia Europea de Medicamentos (EMA), de la que forma parte la Agencia Española del Medicamento y Productos Sanitarios (AEMPS), presta asesoramiento científico a los fabricantes de vacunas frente a la COVID-19, ofreciendo orientación sobre cuáles son los mejores procedimientos y diseños de estudios para generar datos sólidos y requisitos legales a fin de ayudar a garantizar que los estándares de calidad, seguridad y eficacia se incorporen desde el inicio del proceso y no se encuentren comprometidos por acelerar el mismo.
Algunas vacunas frente a la COVID-19 se han obtenido utilizando métodos novedosos, como la tecnología de ARN mensajero, que aumenta el rendimiento de producción en comparación con otros tipos de vacunas, a la vez que han permitido mejorar la estabilidad del producto y genera importantes respuestas inmunes.
En las fases de los diferentes ensayos de las vacunas frente a la COVID-19, en ocasiones se han solapado aspectos que normalmente se producen de manera secuencial como la fase preclínica, los ensayos clínicos en fase I, II, III, y el escalado industrial y clínico, fase IV.
La seguridad, en principio, se ha evaluado en más de 20.000 participantes en las fases clínicas que recibieron al menos una dosis. Al igual que todas las vacunas, pueden producir efectos adversos leves, aunque no todas las personas los sufran. La mayoría de estos efectos leves, en general, son debidos a que la vacuna funciona y estimula el sistema inmune.
De acuerdo con la frecuencia de aparición, los efectos adversos se clasifican como:
- Efectos leves muy frecuentes (más de 1 de cada 10 personas): dolor e hinchazón en el lugar de inyección, cansancio, dolor de cabeza, muscular, en las articulaciones, escalofríos y fiebre.
- Efectos frecuentes (hasta 1 de cada 10 personas): enrojecimiento en el lugar de inyección y náuseas.
- Efectos poco frecuentes (hasta 1 de cada 100 personas): aumento de tamaño de los ganglios linfáticos, malestar, dolor en la extremidad, insomnio, picor en el lugar de inyección.
- Efectos raros (hasta 1 de cada 1.000 personas): parálisis temporal de un lado de la cara.
- Frecuencia no conocida: reacción alérgica grave.
4. FORMULACIÓN Y PREPARACIÓN DE VACUNAS COVID-19
4.1. Inyectables
La utilización de inyectables no comienza realmente a desarrollarse hasta mediados del siglo XIX. Hay tres hechos fundamentales que permitieron la generalización de esta vía de administración de principios activos: el desarrollo de la aguja y la jeringa por Charles Pravaz (1853), la puesta a punto, en esa época, de las ampollas de vidrio por Stanislas Limousin y especialmente, los descubrimientos de Louis Pasteur (1866) sobre la esterilización y utilización de agentes conservantes como medio para eliminar microorganismos.
Los primeros ensayos para administrar medicamentos a través de una vía parenteral fueron realizados por Wood (1853), pero no es hasta 1874 cuando tiene lugar el reconocimiento oficial de los inyectables administrados a través de esta vía. En efecto, en ese año, el addendum a la British Pharmacopeia (1867) recoge el inyectable de clorhidrato de morfina. Este medicamento es descrito también en 1888 en la primera edición del National Formulary de EE.UU.
Figura 14. Inicio de los inyectables (6).
En 1884 se incorpora la autoclave como medio para esterilizar y los filtros de porcelana porosa con el mismo objetivo, fruto del trabajo de Chamberland; la esterilización en autoclave se oficializa poco después mediante su definición por el Codex francés (1908).
Actualmente, el término “inyectable” se refiere a una serie de formas farmacéuticas diferentes que tienen en común su aplicación por vía parenteral. Estos medicamentos pueden necesitar el empleo de sustancias auxiliares, esto es un excipiente para asegurar la isotonía con la sangre, ajustar el pH al fisiológico, aumentar la solubilidad del fármaco, evitar la degradación de los principios activos o aportar a la preparación propiedades antimicrobianas. Estos aditivos no deben afectar a la acción terapéutica deseada ni provocar fenómenos de toxicidad o excesiva irritación local a las concentraciones utilizadas.
Los inyectables son formas farmacéuticas que responden desde un punto de vista físico-químico a soluciones, emulsiones o suspensiones estériles. Permiten la incorporación del principio activo, así como de las sustancias auxiliares añadidas en el disolvente, normalmente agua para preparación inyectable (agua p.p.i.); en un líquido no acuoso apropiado o bien en una mezcla de estos dos vehículos.
Las preparaciones inyectables pueden presentarse como formas unidosis y multidosis:
- Preparaciones unidosis: el volumen del inyectable contenido en un recipiente corresponde a una cantidad de preparación suficiente para permitir la retirada y administración de la totalidad de la dosis establecida mediante una técnica habitual. No deberán contener conservantes antimicrobianos.
- Preparaciones multidosis: caso de las vacunas Pfizer/ BioNTech, Moderna, AstraZenaca y Janssen contienen múltiples porciones de una dosis determinada.
4.2. Vías de administración
En principio, la vía de administración ideal sería la vía oral. Esto no es posible, en este caso, dadas las características del material genético utilizado. La vía nasal presenta importantes ventajas y actualmente está en estudio su utilización (Fig. 15).
Figura 15. Posibles vías de administración de medicamentos: oral y nasal (6).
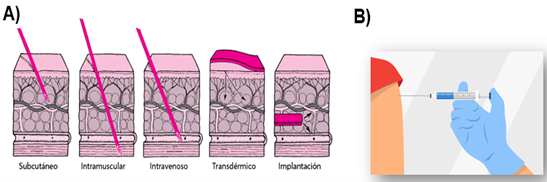
En consecuencia, es necesario recurrir a la previamente descrita vía parenteral. Las principales vías de administración parenteral son la intravenosa (iv), la intramuscular (im) y la subcutánea (sc). Cuando se recurre a la vía intravenosa, el principio activo alcanza directamente al torrente circulatorio, siendo el efecto sistémico muy rápido.
En caso de la inyección intramuscular o subcutánea el efecto sistémico es relativamente rápido. Una vez administrado el preparado, se forma un denominado depósito de principio activo en el lugar de la inyección antes de alcanzar al torrente circulatorio. El período de absorción es más lento desde la vía subcutánea que a partir de la vía intramuscular (Fig. 16).
Figura 16. Vías de administración más comúnmente utilizadas para los preparados destinados a la vía parenteral. Vía de administración intramuscular en el músculo deltoides con un ángulo de 90 º (B) (20).
Actualmente para las vacunas Covid-19, la inyección intramuscular es la vía utilizada. El lugar de inyección debe estar lo más alejado posible de los nervios y de los vasos sanguíneos. El volumen máximo recomendado es inferior a 2 mL. Se inyecta en el músculo deltoides del brazo formando un ángulo de 90 º (Fig. 17).
4.3. Requisitos de los inyectables
Estos medicamentos están destinados para atravesar las barreras protectoras, defensivas, que constituyen la piel y las mucosas, por lo que deben responder a un cierto número de exigencias específicas. Han de adaptarse a las condiciones fisiológicas de la sangre y de los tejidos con los que va a contactar. A mayor aproximación, mejor tolerados serán por el organismo. Por ello, las diferentes preparaciones destinadas para su inyección deben cumplir los siguientes requisitos:
- Limpidez (transparencia)
- pH
- Isotonía
- Esterilidad
- Apirogenicidad.
La limpidez es la ausencia de partículas en suspensión detectables por control óptico. Este concepto sólo se aplica, lógicamente, a los preparados inyectables tipo solución.
El pH desempeña un papel importante en el proceso de fabricación de los inyectables, ya que puede condicionar la tolerancia biológica de la preparación, así como la estabilidad y actividad del principio activo. El pH de la sangre, de la linfa y del líquido cefalorraquídeo está comprendido entre 7,35 y 7,40.
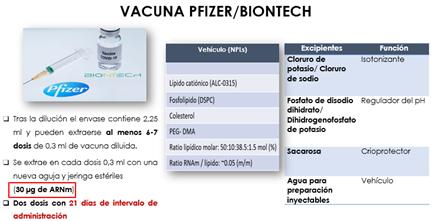
Las soluciones reguladoras más empleadas son las mezclas de fosfatos monosódico y disódico (vacuna Pfizer/BioNTech). Estas mezclas permiten tamponar, en función de las proporciones de las dos sales, zonas de pH comprendidas entre 5,4 y 8,0; el poder regulador es máximo a pH 6,8 (Fig. 17).
Figura 17. Regulación del pH para la vacuna COVID-19 (6).
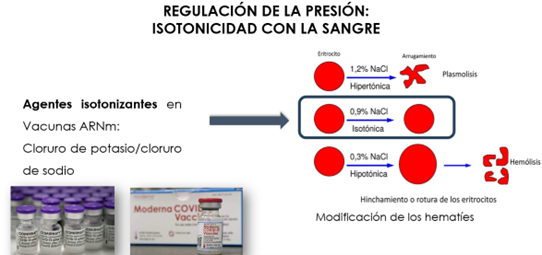
Asimismo, las preparaciones inyectables deben poseer, en la medida de lo posible, la misma presión osmótica que los fluidos tisulares (Isotonía). Esta característica es particularmente importante para las soluciones intravenosas. Si se trata de una solución de cloruro sódico, su presión osmótica será similar a la fisiológica cuando su concentración sea de 9 gramos de sal por litro de agua (0,9%, p/V). Al poner en contacto glóbulos rojos con una solución acuosa de cloruro sódico de concentración 0,9% p/V, al presentar los dos sistemas la misma presión osmótica, no hay modificación aparente en las células plasmáticas. Este tipo de solución, que presenta igual presión osmótica que el plasma sanguíneo, se conoce como “solución isotónica”.
Por ello, incorporan agentes isotonizantes, como el cloruro sódico y el cloruro potásico, frecuentes en la mayoría de las vacunas COVID-19 consideradas (Fig. 18).
Figura 18. Regulación de la isotonicidad para la vacuna COVID-19 (6).
Como agente crioprotector, la sacarosa incorporada en las vacunas de AstraZeneca, Pfizer/BioNTech y Moderna, que, junto con la histidina, ejerce una función crioprotectora, porque aun conservándose la vacuna a una temperatura de refrigeración, en el proceso de fabricación el principio activo necesita ser trasladado de una planta de producción a otra y en ese trayecto el material genético es congelado. Por tanto, este componente es imprescindible para mantener la integridad del mismo durante ese proceso de congelación.
Para las formulaciones destinadas a la administración por vía parenteral hay cinco métodos de esterilización posibles: mediante calor húmedo, calor seco, óxido de etileno, radiaciones o filtración esterilizante.
En ocasiones es necesario añadir conservantes, cuando la preparación ha sido esterilizada antes de su acondicionamiento en el envase definitivo, si ha sido elaborada en condiciones asépticas sin posterior esterilización y en el caso de inyectables multidosis.
Ninguna de las dos vacunas de ARNm, Pfizer/BioNTech y Moderna, contienen trazas de huevo, antibióticos ni conservantes (timerosal), que sí suelen estar presentes en otras vacunas y pueden generar reacciones alérgicas.
Es preferible siempre esterilizar el producto fabricado en el recipiente definitivo. Cuando el medicamento no pudiese ser sometido al correspondiente tratamiento en dicho acondicionamiento, como en el caso de las vacunas COVID-19, cada componente de la formulación se esterilizará por separado y la elaboración se hará en condiciones que eviten la contaminación por microorganismos (filtración esterilizante y salas blancas).
Además de recurrir a una filtración esterilizante, caso de las vacunas para la COVID-19, la elaboración se lleva a cabo en un medio aséptico (salas blancas con filtración de aire por flujo laminar) y con los viales previamente esterilizados.
5. FABRICACIÓN DE LA VACUNA COVID-19
En la fabricación de estas vacunas hay que resolver dos problemas fundamentales: evitar la toxicidad del ARN y encontrar un vehículo para su administración. El objetivo de la formulación, esto es, el recubrimiento del ARN por las nanopartículas lipídicas se muestra en la Figura 19.
Figura 19. Formulación de la vacuna COVID-19 (6)
La modificación química del ARN reduce así el riesgo de efectos secundarios no deseados, disminuyendo la toxicidad favoreciendo la administración segura del ARNm. Además, confiere protección frente a la degradación, mejora la estabilidad y la especificidad (Fig. 20 y 21).
Figura 20. Modificaciones realizadas en el ARNm para la vacuna COVID-19 (21).
Figura 21. Consecuencias favorables del ARNm modificado.
Además de la modificación química del ARNm es necesario disponer de vehículos apropiados para su administración, ya que protegen el ARN frente a la degradación y facilitan el transporte del medicamento a la ubicación deseada.
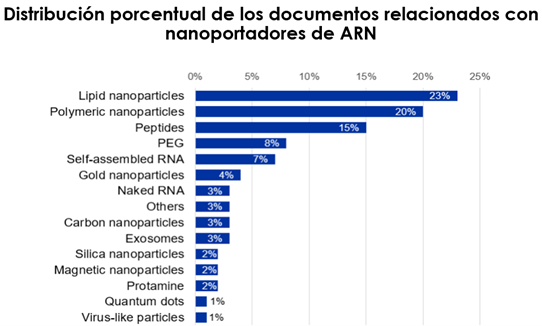
Desde la década de los 90, se han empleado diversas formulaciones para elaborar nanopartículas lipídicas que permiten incorporar material genético en cultivos celulares (Fig. 22 y 23). Hasta entonces, nunca se habían utilizado en los seres humanos.
Figura 22. Posibles vehículos para administrar material genético en forma de inyectable (22).
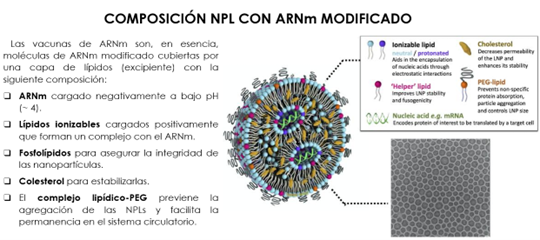
Figura 23. Composición de las nanopartículas lipídicas (NPL). Imagen obtenida mediante el microscopio electrónico de transmisión (crio-TEM) de las mismas. Modificado de CAS Insights (23).
Tanto la administración como los componentes de la vacuna ARNm para la COVID-19 de Pfizer/BioNTech y Moderna difieren tal como se observa en las Figuras 24 y 25.
Figura 24. Administración y composición de la vacuna COVID-19 Pfizer/BioNtech (24).
Figura 25. Administración y composición de la vacuna COVID-19 MODERNA (25).
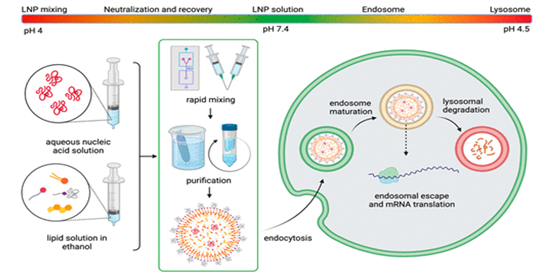
Las vacunas consideradas de ARNm (Pfizer/BioNtech y Moderna) utilizan un vehículo acuoso que dispersa las nanopartículas lipídicas (Fig. 26). La preparación de este tipo de inyectables, de forma resumida, requiere de las siguientes etapas:
- Síntesis del ARNm modificado y dispersión en un medio acuoso (pH = 4).
- Preparación de la fase oleosa con etanol y los diferentes lípidos seleccionados.
- Elaboración de las nanopartículas lipídicas (NPL) con la incorporación del ARNm modificado en un medio líquido (fase acuosa) sobre los lípidos en solución etanólica (fase oleosa) de acuerdo con el diseño indicado.
- Rápido mezclado y posterior purificación.
Figura 26. Fabricación de la vacuna COVID-19. Se realiza una mezcla de una fase acuosa con otra lipídica (26).
5.1. Fabricación del ARNm
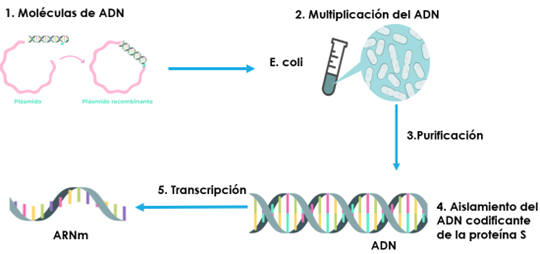
Independientemente es necesario disponer de ARNm, para lo cual se parten de plásmidos a los que se inserta un fragmento de ADN que codifique a la proteína espícula (Fig. 27). El complejo proceso de fabricación de las vacunas de ARNm comienza a partir de moléculas circulares de ADN (plásmidos) a las que se incorporan un fragmento que contiene la información para producir la proteína S.
Figura 27. Esquema del proceso de fabricación de ARNm a partir de un plásmido (27).
5.2. Modificación del ARNm
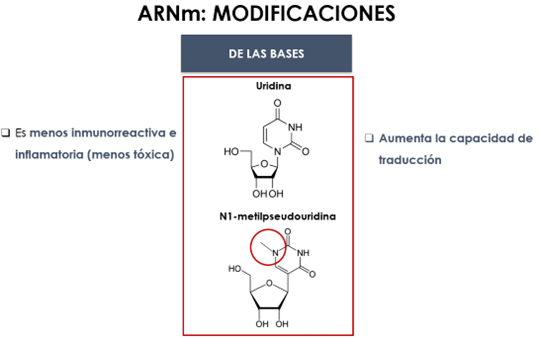
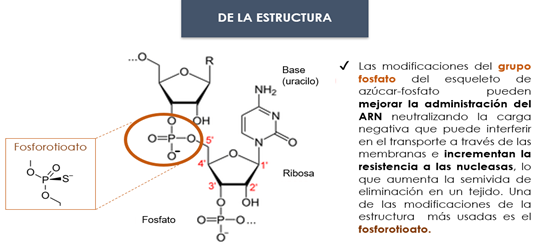
Se realizan una serie de modificaciones en el ARNm concretamente a nivel de bases, azúcar y esqueleto (Fig. 28).
Figura 28. modificaciones en el ARNm: bases, azúcar y estructura (28, 29, 30).
La vacuna está contraindicada en personas que hayan presentado una reacción de hipersensibilidad grave (de tipo anafiláctico) o una reacción alérgica inmediata de cualquier gravedad a una dosis previa de vacuna de ARNm frente a la Covid-19 o a alguno de los componentes de la misma.
Las vacunas para prevenir la Covid-19 basadas en la plataforma de ARN que se están comercializando no contienen trazas del virus, sino que funcionan mediante el ARNm modificado (ARN “sintético”).
Puede haber personas alérgicas a algunos de los componentes de las vacunas. En general los casos de alergia grave han sido escasos, después de millones de personas vacunadas en el mundo. Como precaución, aquellos con antecedentes de alergia grave (anafilaxia) a otras vacunas o terapias administradas por vía intramuscular, deben recibir información sobre la posibilidad del riesgo de reacción alérgica grave tras recibir la vacuna.
Se recomienda a las personas alérgicas a algunos de los componentes de la misma que no la reciban y que todas las personas esperen 15 minutos tras la inyección, para detectar si hay algún síntoma de alergia grave. Las personas alérgicas con patologías leves y bien controladas esperan 30 minutos y las graves lo harán 45 minutos.
Los excipientes que pueden provocar una reacción alérgica son:
- Polietinelglicol (PEG) frecuentes en geles de baños y ciertos medicamentos, y presente en las vacunas de Pfizer/BioNTech y Moderna.
- Trometamol, incorporado en la vacuna de Moderna y en medicamentos de uso externo como colirios. En ambos casos, los pacientes han mostrado, generalmente, algún tipo de dermatitis por contacto, previo a la vacunación.
Ninguna de las dos vacunas de ARN contiene trazas de huevo, antibióticos ni conservantes (timerosal) que sí suelen estar presentes en otras vacunas y que pueden generar reacciones adversas.
7. Consideraciones finales
Recientemente se ha autorizado, por parte de las Agencias Reguladoras de Medicamentos, la vacuna para la COVID-19 a través de un desarrollo que puede suponer el inicio de una nueva plataforma terapéutica, esto es, la utilización del ARN como medicamento. Sin duda la grave situación global atravesada desde el inicio del estado de pandemia (OMS 11 de marzo de 2020) con el creciente número de contagios, fallecimientos, colapso hospitalario y alarmantes consecuencias sociales, condicionó la rápida aprobación de la misma.
Es razonable que se hayan generado dudas desde el primer momento que se anunció su disponibilidad, dudas que a fecha de hoy siguen algunas sin una respuesta clara. Ha habido excesiva información; actualmente la divulgación masiva de noticias, en este caso acerca de la salud, permite la fácil accesibilidad y adquisición de conocimientos a través de las redes sociales cada vez más numerosas e influyentes. Cuando la información es abundante es lógico que no responda en parte a criterios objetivos, sino que se muestra parcial, errónea y en ocasiones contradictoria.
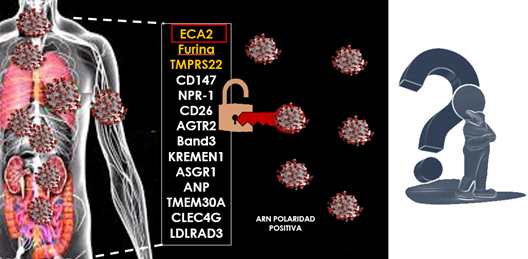
En algo que hay acuerdo en la comunidad científica es en la complejidad, agresividad y en definitiva virulencia del nuevo patógeno. Reúne todas las características óptimas para propagar una amplia infección en un corto periodo de tiempo, como así ha ocurrido. El virus denominado SARS-CoV-2, responde a una cadena de ARN de polaridad positiva lo cual ya es una buena forma de presentación para su fácil infección. Conocida la presencia en su superficie de diversas proteínas, concretamente una, la denominada proteína espícula (proteína S), es la “llave” para penetrar en el organismo de un ser humano. La amplia disponibilidad de “cerraduras” o receptores por la que esta proteína S muestra especificidad justifica la facilidad de infección prácticamente en todo el organismo, pues los mismos están ampliamente extendidos. En este sentido destaca el denominado receptor ECA2 (enzima convertidora de la angiotensina 2) que ejerce un papel fundamental en la penetración y posterior infección del virus (Fig. 29).
Figura 29. Diversos receptores y proteínas de membrana implicados en la infección por SARS-CoV-2.
El diseño de un nuevo fármaco implica la ejecución de una seria de pruebas previas que responden a ensayos preclínicos (en el laboratorio, con animales de experimentación) que, de ser favorables, se reproducen y amplían en seres humanos; incluyen cuatro fases bien definidas: I, II, III y IV, a fin de constatar la eficacia, seguridad y estabilidad del medicamento.
Es cierto que se ha desarrollado en un año si bien existía una experiencia previa de décadas en los dos fabricantes sobre la preparación y utilización del ARNm con fines terapéuticos, aunque los resultados obtenidos no pasaron más allá de tratarse de unos ensayos clínicos.
Figura 30. Desarrollo de la vacuna de ARN. Imagen que muestra las diferentes etapas por la que transcurre la elaboración de una nueva vacuna y el tiempo transcurrido para la autorización de las novedosas vacunas de ARN para la COVID-19. Procedimientos que requieren 28 meses se han reducido a un periodo de tiempo de 10 meses (Agencia Española de Medicamentos y Productos Sanitarios, AEMPS, Ministerio de Sanidad, España).
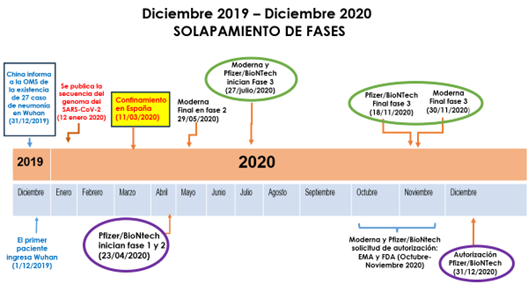
Ha sido fundamental el solapamiento de las fases propias de un ensayo clínico, esto es, iniciar simultáneamente las fases I y II y, tras poco más de tres meses de experimentación, finalizar la fase III (fundamental para establecer eficacia y seguridad) con la aprobación por parte de las Agencias Reguladoras de Medicamentos y la consiguiente vacunación masiva de la población (Fig. 31).
En consecuencia, es razonable que se planteen ciertas dudas; hasta el momento desconocemos los efectos adversos del nuevo medicamento a corto o medio plazo. Es necesario que transcurra el tiempo y observar las posibles reacciones adversas que se puedan derivar de su uso. Con la actual presencia del post-COVID quedará, entre otras, la duda si a partir de los datos clínicos obtenidos en un ensayo clínico en Fase III llevado a cabo en poco más de tres meses existían argumentos suficientes para la autorización y posterior obligatoriedad de llevar a cabo la vacunación masiva de la población con acceso a la misma.
Figura 31. Cronología en el desarrollo de la vacuna de ARN para la COVID-19 (6)
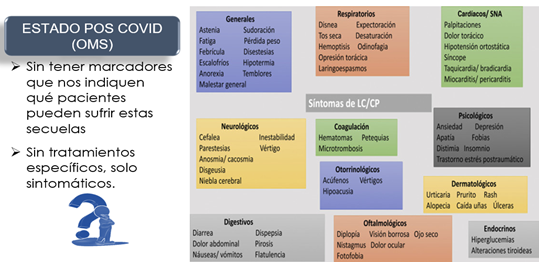
Efectivamente, tras cuatro años desde la declaración por parte de la OMS de la pandemia y tras tres años de la correspondiente vacunación, se ha pasado a la actualmente denominada COVID persistente o long-COVID, esto es un síndrome caracterizado por la persistencia de síntomas de COVID-19 semanas o meses tras la infección inicial, o por la aparición de los síntomas tras un tiempo sin ellos. Su aparición no está relacionada con la gravedad de la infección inicial, por lo que puede perjudicar tanto a pacientes leves como a graves hospitalizados (periodo post-COVID según la OMS).
Figura 32. Diferentes síntomas característicos del periodo pos COVID (31).
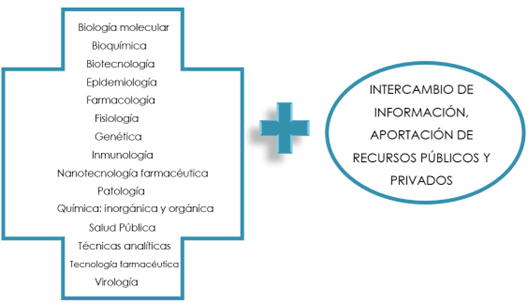
Por otra parte, se ha puesto de manifiesto la necesidad de aunar disciplinas y de la información compartida desde empresas públicas y privadas, así como la disponibilidad de unos recursos económicos hasta el momento sin precedentes (Fig. 33). Las Agencias Reguladoras han facilitado el proceso de desarrollo de la vacuna.
Figura 33. Aunar disciplinas con participación pública y privada.
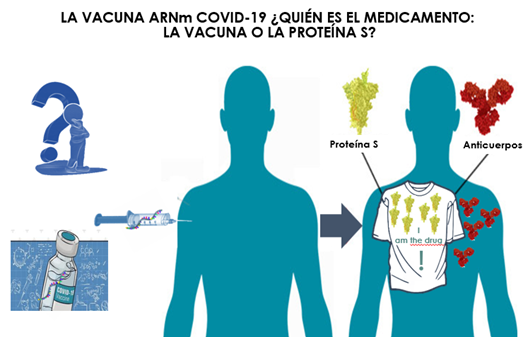
Figura 34. Formación de anticuerpos neutralizantes después de la administración i.m. de la vacuna COVID-19, con el material genético ARNm protegido por nanopartículas lipídicas. Modificado de de López-Sampalo et al. (32).
La formación de anticuerpos neutralizantes del virus se debe a la formación de la proteína espícula, ¿sería en consecuencia esta proteína entonces el medicamento? En ese caso, ¿sería la vacuna un precursor del fármaco?
8. REFERENCIAS
- World Health Organization. Vaccines and immunization: what is vaccination? World Health Organization (Internet). Geneva: World Health Organization; 2021 (citado el 6 de enero de 2024); (aprox. 1 página). Disponible en: https://www.who.int/news-room/questions-and-answers/item/vaccines-and-immunization-what-is-vaccination
- Federación Argentina de Sociedades de Ginecología y Obstetricia (FASGO). La OMS considera al movimiento antivacunas en la lista de mayores amenazas a la salud junto al Ébola, el dengue o el SIDA. FASGO (Internet). (citado el 20 de febrero de 2024); (aprox. 1 página). Disponible en: https://www.fasgo.org.ar/index.php/informacion-a-la-comunidad/1623-la-oms-considera-al-movimiento-antivacunas-en-la-lista-de-mayores-amenazas-a-la-salud-junto-al-ebola-el-dengue-o-el-sida#:~:text=La%20OMS%20considera%20al%20movimiento,el%20dengue%20o%20el%20SIDA.
- Clínica Mayo. Historia de los brotes de enfermedades: cronología de las vacunas contra la viruela. Clínica Mayo (Internet). Rochester (MN): Fundación Mayo para la Educación e Investigación Médica; 2021 (citado el 8 de enero de 2024); (aprox. 1 página). Disponible en: https://www.mayoclinic.org/es/diseases-conditions/history-disease-outbreaks-vaccine-timeline/smallpox.
- Jackson AC. Rabies: Scientific Basis of the Disease and Its Management. Academic Press; 2013.
- Tuells J, Duro Torrijos JL. El proceso de creación del Instituto Pasteur (1886–1888) según la prensa española de la época. Vacunas. 2011;12(4):154-9.
- Rius F, Diez O. COVID-19: Fármacos y excipientes de las vacunas. 2ª Edición. Oviedo: El sastre de los libros; 2023.
- Koonin EV, Krupovic M, Agol VI. The Baltimore Classification of Viruses 50 Years Later: How Does It Stand in the Light of Virus Evolution? Microbiol Mol Biol Rev. 2021;85(3):e0005321. doi: 10.1128/MMBR.00053-21.
- Woo PCY, Lau SKP, Lam CSF, Lau CCY, Tsang AKL, Lau JHN, et al.Discovery of seven novel mammalian and avian coronaviruses in the genus Deltacoronavirus supports bat coronaviruses as the gene source of Alphacoronavirus and Betacoronavirus and avian coronaviruses as the gene source of Gammacoronavirus and Deltacoronavirus. J Virol. 2012;86:3995-4008.https://doi.org/10.1128/ JVI.06540-11.
- Hu B, Guo H, Zhou P, Shi ZL. Characteristics of SARSCoV-2 and Covid-19. Nat Rev Microbiol. 2021; 19:141-154. https:// doi.org/10.1038/s41579020-00459-7.
- Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020;579(7798):270-273. https:// doi.org/10.1038/s41586-020-2012-7.
- Kirtipal N, Bharadwaj S, Kang SG. From SARS to SARS-CoV-2, insights on structure, pathogenicity and immunity aspects of pandemic human coronaviruses. Infect Genet Evol. 2020;85:104502. https:// doi.org/10.1016/j.meegid.2020.104502.
- Vacunas AEP. Coronavirus: breve historia. Vacunas AEP (Internet). (citado el 7 de enerode 2024); (aprox. 1 página). Disponible en: https://vacunasaep.org/profesionales/noticias/coronavirus-breve-historia.
- ADN Institut. ¿Qué es el coronavirus N-19 es? ADN Institut (Internet). (citado el 3 de febrero de 2024); (aprox. 1 página). Disponible en: https://www.adninstitut.com/que-es-el-coronavirus-n-19-es.
- Farinde A. Selectividad del lugar de acción. Manual MSD (Internet). Columbia Southern University, Orange Beach, AL; 2021 (citado el 30 de enero de 2024). Disponible en: https://www.msdmanuals.com/es/hogar/f%C3%A1rmacos-o-sustancias/farmacodin%C3%A1mica/selectividad-del-lugar-de-acci%C3%B3n#Receptores-celulares_v715596_es.
- Gardner A, Autin L, Barbaro BA, Olson AJ, Goodsell DS. CellPAINT: Interactive Illustration of Dynamic Mesoscale Cellular Environments. IEEE Comput Graph Appl. 2018;38(6):51-66.
- Jano. Un nuevo anticuerpo bloquea la transmisión. Jano (Internet). (fecha de publicación 11 de febrero de 2022); (citado el 1 de mayo de 2024); (aprox. 1 página). Disponible en: https://www.jano.es/noticia-un-nuevo-anticuerpo-bloquea-transmision-32694.
- Hoffmann M, Pöhlmann S. Nuevos receptores del SARS-CoV-2: ASGR1 y KREMEN1. Cell Res. 2021; 32(1):1-2. https://doi.org/10.1038/s41422-021-00603-9.
- Caravaca Pérez C, Morán Fernández L, García-Cosio MD, Delgado JF. Sistema renina-angiotensina-aldosterona y COVID19. Implicaciones clínicas. Revista Española de Cardiología Suplementos. 2020; 20: 27-32. https://doi.org/ 10.1016/S1131-3587(20)30032-7
- Lamas-Barreiro JM, Alonso-Suárez M, Fernández-Martín JJ, Saavedra-Alonso JA. Angiotensin II suppression in SARS-CoV-2 infection: a therapeutic approach. Nefrologia (Engl Ed). 2020;40(3):213-6. English, Spanish. https:// doi.org/ 10.1016/j.nefro.2020.04.006.
- Elsevier. Vía parenteral: 4 formas de administración de inyectables (Internet). Elsevier; (citado el 3 de febrero de 2024). Disponible en: https://www.elsevier.com/es-es/connect/via-parenteral-4-formas-de-administracion-de-inyectables.
- Schoenmaker L, Witzigmann D, Kulkarni JA, Verbeke R, Kersten G, Jiskoot W, et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. Int J Pharm. 2021;601:120586. https:// doi.org/10.1016/j.ijpharm.2021.120586.
- CAS Insights. RNA therapeutics: The revolution (Internet). American Chemical Society; (citado el 3 de febrero de 2024). Disponible en: https://www.cas.org/es-es/resources/cas-insights/biotechnology/rna-therapeutics-revolution.
- Pilkington EH, Suys EJA, Trevaskis NL, Wheatley AK, Zukancic D, Algarni A, et al. From influenza to COVID-19: Lipid nanoparticle mRNA vaccines at the frontiers of infectious diseases. Acta Biomater. 2021;131:16-40. https:// doi.org/10.1016/j.actbio.2021.06.023.
- Ficha Técnica Pfizer/BioNTech vacuna covid-19. Agencia Española de Medicamentos y Productos Sanitarios (Internet). Madrid: Agencia Española de Medicamentos y Productos Sanitarios; (citado el 1 de febrero de 2024). Disponible en: https://www.aemps.gob.es/la-aemps/ultimainformacion-de-la-aemps-acerca-del-covid%E2%80%9119/vacunas-contra-la-covid%E2%80%9119/comirnaty/.
- Ficha Técnica Moderna vacuna Covid-19. Agencia Española de Medicamentos y Productos Sanitarios (Internet). Madrid: Agencia Española de Medicamentos y Productos Sanitarios; (citado el 1 de febrero de 2024). Disponible en: https://www.aemps.gob.es/la-aemps/ultima-informacion-de-la-aemps-acer-ca-del-covid%E2%80%9119/vacunas-contra-la-covid%E2%80%9119/covid-19-vaccine-moderna/.
- Eygeris Y, Gupta M, Kim J, Sahay G. Chemistry of Lipid Nanoparticles for RNA Delivery. Acc Chem Res. 2022;55(1):2-12. https://doi.org/10.1021/acs.accounts.1c00544.
- Genotipia. Pfizer vacuna covid (Internet). Genotipia; (citado el 3 de enero de 2024). Disponible en: https://genotipia.com/pfizer-vacuna-covid/.
- Karikó K, Muramatsu H, Welsh FA, Ludwig J, Kato H, Akira S, et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 2008;16(11):1833-40. https://doi.org/10.1038/mt.2008.200.
- Durbin AF, Wang C, Marcotrigiano J, Gehrke L. RNAs Containing Modified Nucleotides Fail To Trigger RIG-I Conformational Changes for Innate Immune Signaling. mBio. 2016;7(5):e00833-16. https://doi.org/ 10.1128/mBio.00833-16.
- Svitkin YV, Cheng YN, Chakraborty T, Presnyak V, John M, Sonenberg N et al. N1-methyl-pseudouridine in mRNA enhances translation through eIF2α-dependent and independent mechanisms by increasing ribosome density. Nucleic Acids Res. 2017;45(10):6023-36. https://doi.org/10.1093/nar/gkx135.
- López-Sampalo A, Bernal-López MR, Gómez-Huelgasa R. Síndrome de COVID-19 persistente. Una revisión narrative. Rev Clin Esp. 2022; 222(4): 241-50. https://doi.org/10.1016/j.rce.2021.10.003.
- Quo, El Diario (Internet). El Diario; (citado el 2 de febrero de 2024). Disponible en: https://quo.eldiario.es/salud/coronavirus.