Artículo premiado con el Premio ASISA en el concurso científico RANF 2024
1. INTRODUCCIÓN
Las metaloproteinasas de matriz (MMP) son una familia de metaloenzimas proteolíticas, dependientes de zinc, presentes intracelularmente y unidas a membrana. Estas proteínas están implicadas en la degradación de la matriz extracelular (ECM), tanto en procesos fisiológicos, como en el desarrollo embrionario, la reproducción y la remodelación tisular, además de en procesos patológicos, como las enfermedades inflamatorias, el crecimiento tumoral y la metástasis (1,2).
En particular, la MMP-9 es una de las principales integrantes de esta familia de proteínas. Mayoritariamente, se sintetiza en forma de zimógeno, de unos 92 kDa y, tras su hidrólisis, la MMP-9 se activa adquiriendo la capacidad de escindir proteínas de la superficie celular y del ambiente extracelular, degradar componentes de la ECM y, por consiguiente, alterar las interacciones célula-célula y célula-ECM (3,4).
Todos estos procesos mencionados están estrechamente relacionados con las diferentes etapas de la progresión del cáncer, incluyendo la migración e invasión de las células tumorales, la metástasis, la angiogénesis y la inflamación. Además, en diversos estudios se ha observado un aumento de su sobreexpresión y activación en tumores malignos. (5) El rango de concentración fisiológico de MMP-9 en suero humano, varía según la literatura revisada, encontrándose entre 10 y 150 ng/mL aproximadamente y, en situaciones patológicas, puede elevarse a 500 ng/mL (6–9). Todo esto lo convierte en un biomarcador potencial en el contexto del cáncer (10).
Considerando lo anteriormente mencionado, explorar esta proteína como un prometedor biomarcador y sus métodos de detección, podría convertirse en una valiosa herramienta para el diagnóstico clínico.
Actualmente, existen numerosos métodos bioanalíticos para la detección de proteasas como MMP9, incluyendo el ensayo por inmunoadsorción ligado a enzimas (ELISA), el Western Blot y la zimografía. Estos métodos se caracterizan por requerir un tiempo de análisis elevado, ser costosos y difíciles de operar, requiriendo personal capacitado (11,12). Considerando estas desventajas, se plantea el uso de nuevos métodos de análisis, siendo los biosensores métodos analíticos prometedores para este fin como consecuencia de sus excelentes propiedades analíticas.
Los biosensores son dispositivos analíticos compactos que se componen de un elemento de reconocimiento biológico asociado a un transductor físico-químico. Este último se encarga de procesar la señal biológica generada al interaccionar el elemento de reconocimiento y el analito, transformarla en una señal eléctrica fácil de cuantificar y relacionarla con la concentración de analito (13,14).
En la literatura se han propuesto diferentes biosensores electroquímicos para la determinación de MMP9, mediante el uso de etapa de marcaje (15, 16) y en ausencia de marcaje (17, 9). El uso de esta última metodología presenta claras ventajas, como son, la reducción de las etapas del bioensayo, así como de reactivos utilizados, lo que disminuye el tiempo de análisis y coste del dispositivo analítico (18,19).
Por todo ello, en el presente trabajo se propone el diseño y desarrollo de un inmunosensor electroquímico libre de marcaje para la determinación de MMP-9, aportando una metodología más sencilla y un tiempo de fabricación del biosensor más corto. Se utilizará la técnica de espectroscopia de impedancia electroquímica para confirmar la modificación de la superficie electródica en las sucesivas etapas de preparación del biosensor. La cuantificación del analito se realizará mediante voltamperometría de onda cuadrada. El desarrollo de este dispositivo presenta múltiples ventajas frente a los métodos analíticos tradicionales, destacándose, su alta sensibilidad y especificidad, posibilidad de automatización y miniaturización, pequeño volumen de muestra requerido, medidas en tiempo real, facilidad de uso, bajo coste y corto tiempo de ensayo. Al abordar las limitaciones de las técnicas analíticas tradicionales, este estudio se alinea con la vanguardia de la investigación biomédica y abre nuevas perspectivas en el diagnóstico clínico.
2. MATERIAL Y MÉTODOS
2.1 Equipos instrumentales
Las medidas electroquímicas se llevaron a cabo en un potenciostato PGSTAT 12 con módulo FRA para medidas de impedancia, controlado por el software NOVA 2.1 (Metrohm Autolab). El transductor está formado por una celda electroquímica plana sobre un soporte de alúmina. Los electrodos de carbono serigrafiados (SPCE) empleados constan de un electrodo de trabajo de carbono de 4 mm de diámetro, un electrodo auxiliar de carbono y un electrodo de referencia de Ag (DRP-110 DropSens). El potenciostato y el electrodo serigrafiado se unen mediante un cable conector específico (DRP-CAC, DropSens). Los electrodos se someten a múltiples lavados y secados con un sistema de nitrógeno comprimido ALPHAGAZ 1, para asegurar la retirada de todo el líquido de la superficie sin producir ningún tipo de deterioro en el electrodo.
Las pesadas se realizaron con la balanza Sartorius Handy H110. Para las medidas de pH se utilizó con un pH-metro Crison micropH 2001 (España). El agua ultrapura utilizada en las disoluciones se obtuvo a través del dispositivo Milli Q, Millipore asegurando un agua ultrapura libre de ADN y ARNasas. Además, para homogeneizar las disoluciones se utilizó un vórtex Heidolph REAX 2000. Todas las medidas se realizaron a temperatura ambiente.
2.2 Reactivos y disoluciones
El grafting electroquímico se llevó a cabo a partir de ácido p-aminobenzoico (p-ABA), nitrato de sodio (NaNO3) y ácido clorhídrico (HCl) (Acros). Los anticuerpos de captura empleados junto con el analito MMP9 pertenecen al kit comercial DuoSet®ELISA de R&D Systems (DY911). Para la inmovilización covalente del anticuerpo de captura se utilizó 1-etil-3-(3-dimetilaminopropil) carbodiimida (EDC) y N- hidroxisulfosuccinimida sódica (NHSS) (Acros). Como agentes bloqueantes se emplearon albúmina de suero bovino (BSA) (Gerbu), caseína (CAS) (Sigma), blocking buffer (BB) (Thermo Scientific), blocking buffer libre de proteínas (Thermo Scientific), etanolamida (ETA) (Sigma) y alcohol polivinílico (PVA) (Panreac). Los compuestos empleados para realizar el estudio de interferencias fueron IgG (Merck), seroalbúmina humana (HSA) (Sigma), Hemoglobina (Hb) (Sigma) y MMP13 (R&D). Para el estudio de recuperación se utilizó suero sintético (Sigma). Las distintas disoluciones tampón empleadas durante la experimentación fueron una disolución tampón fosfato (PBS) a pH 7,4 preparada a partir de 137 mM NaCl (Labkem), KCl 2,7 mM (Probus), Na2HPO4 8,1 mM (Scharlau) y KH2PO4 1,5 mM (Merck), y una disolución tampón 2-(N-morfolino)etanosulfónico) (MES) 25 mM a pH 5,0 (Merck). Todas las medidas electroquímicas se llevaron a cabo empleando como sonda redox 5 mM Fe(CN) 4−/3−, KCl 0,1 M en una disolución tampón fosfato 0,1 M, pH 7,4. Para su preparación se utilizó potasio ferricianuro de potasio (K3Fe(CN)6), potasio hexacianoferrato (II) 3-hidrato K4Fe(CN)6·3H2O (Panreac), y cloruro de potasio (KCl) (Merck).
2.3 Medidas electroquímicas
La caracterización de las diferentes etapas involucradas en la preparación del inmunosensor se realizó mediante espectroscopia de impedancia electroquímica y voltamperometría cíclica. Para la determinación de la concentración de MMP9 se empleó voltamperometría de onda cuadrada.
La espectroscopia de impedancia electroquímica (EIS) es un método que no requiere marcaje, basado en la generación de una señal eléctrica dependiente de las propiedades interfaciales entre el electrodo y el electrolito. La velocidad de la transferencia de carga entre el electrodo modificado y un indicador redox se mide como la resistencia a la transferencia de carga (Rct), que se ve modificada en función de los cambios que se producen en la superficie electródica (20). Los datos obtenidos se evalúan, frecuentemente, mediante el gráfico de Nyquist, donde se representa la impedancia imaginaria frente a la impedancia real. La forma de la curva y el valor de Rct aportan importante información sobre los cambios producidos en la interfaz debido a la adsorción de especies.
La voltamperometría cíclica (CV) es una técnica versátil basada en la aplicación de un potencial de variación lineal, de forma triangular y la monitorización simultánea de la corriente resultante. El voltaje aplicado varía de manera continua y se invierte para dar lugar a un ciclo repetitivo que se ve reflejado en un voltamperograma, donde se representa la intensidad de corriente en función del voltaje aplicado.
La voltamperometría de onda cuadrada (SWV) es una técnica altamente sensible que consiste en la aplicación de dos impulsos cuadrados de la misma amplitud y duración, de signos opuestos, sobre una variación continua de potencial en forma de rampa. La corriente diferencial resultante se calcula restando las dos corrientes sucesivas medidas al final de cada impulso. Por lo tanto, las corrientes capacitivas y residual se eliminan, aumentando la sensibilidad de la técnica.
2.4 Diseño del inmunosensor electroquímico
2.4.1 Grafting electroquímico y activación de grupos carboxílicos
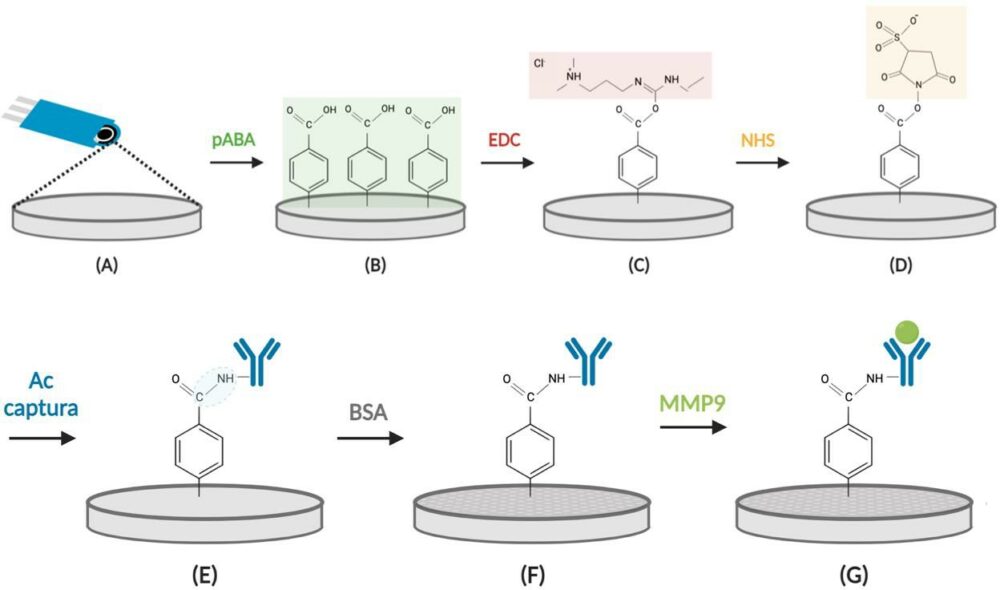
El método de inmovilización empleado para la modificación de la superficie del electrodo serigrafiado se basa en la generación de una sal de aril diazonio a partir del ácido 4-aminobenzoico en presencia de nitrito de sodio en medio HCl, que se ancla electroquímicamente a la superficie electródica mediante un proceso de “electrografting” en una sola etapa, realizando barridos sucesivos mediante voltamperometría cíclica de 0 a -1 V.
Para que se produzca la diazotación del ácido p-aminobenzoico (pABA) con NaNO2 en medio HCl, se disuelven 20 mg de pABA en 2 mL de HCl 1 M, enfriando en un baño de hielo. Seguidamente, se prepara la sal de diazonio adicionando gota a gota 380 μL de NaNO2, 2 mM por cada 2 mL de la disolución de pABA, con agitación constante en un baño de hielo. A continuación, se depositan 40 μL de esta disolución sobre la superficie de un electrodo de carbono serigrafiado y se realizan 10 ciclos mediante CV entre 0 y –1 V, a una velocidad de barrido de 200 mV/s. Finalmente se lava el electrodo abundantemente con agua y se seca con nitrógeno (Figura 1.A y 1.B).
Posteriormente, se lleva a cabo la activación de los grupos carboxílicos de la superficie del electrodo de trabajo. Para ello, se depositan 10 μL de una disolución mezcla de EDC y NHSS, 100 mM de cada uno de ellos en medio regulador MES 25 mM de pH 5,0 y se incuba durante 30 minutos. Transcurrido ese tiempo, se lava el electrodo con disolución reguladora MES 25 mM de pH 5,0 (Figura 1.C y 1.D).
Figura 1.Esquema de las reacciones producidas durante el proceso de grafting (A: electrodo desnudo y B: unión covalente de radicales arilos), activación de los grupos carboxílicos (C: éster reactivo inestable y D: éster reactivo de amino semi-estable), adición del Ac de captura (E), BSA (F) y MMP9 (G).
2.4.2 Unión Ac Captura-MMP9
Para la inmovilización del anticuerpo de captura (anti-MMP9), se depositan 5 µL de una disolución de 10 µg/mL en disolución reguladora MES de pH 5,0 y se incuba durante 30 minutos (Figura 1.E). Transcurrido ese tiempo, se bloquean las posiciones libres del electrodo de trabajo, depositando 10 µL de una disolución de BSA al 1% (p/v) en disolución reguladora PBS de pH 7,4, durante 30 minutos (Figura 1.F). Tras la etapa de bloqueo, se lava nuevamente el electrodo con disolución reguladora PBS de pH 7,4 y se añaden 5 µL de la disolución de analito (MMP9), incubando 60 minutos (Figura 1.G).
2.4.3 Detección electroquímica
Todas las medidas electroquímicas se llevaron a cabo utilizando como sonda redox una mezcla de Fe(CN)64−/3− 5 mM de cada uno de ellos en KCl 0,1 M en disolución tampón fosfato 0,1 M pH 7,4. Para las medidas por voltametría cíclica (CV) se realizó un barrido de potencial de -0,4 a 0,7 V a una velocidad de 100 mV/s. Las medidas de impedancia (EIS) se realizaron a potencial de circuito abierto (OCP) utilizando una amplitud de 5 mV en un intervalo de frecuencia de 109 Hz a 0,1 Hz. Las medidas por voltametría de onda cuadrada (SWV) se realizaron a una velocidad de barrido de 25 mV/s con una amplitud de modulación de 50 mV y una frecuencia de 25 Hz.
3. RESULTADOS
En este apartado se detallan los estudios realizados en este trabajo, realizándose la discusión de los mismos en el apartado 4.
3.1 Caracterización electroquímica de las diferentes etapas de preparación del inmunosensor
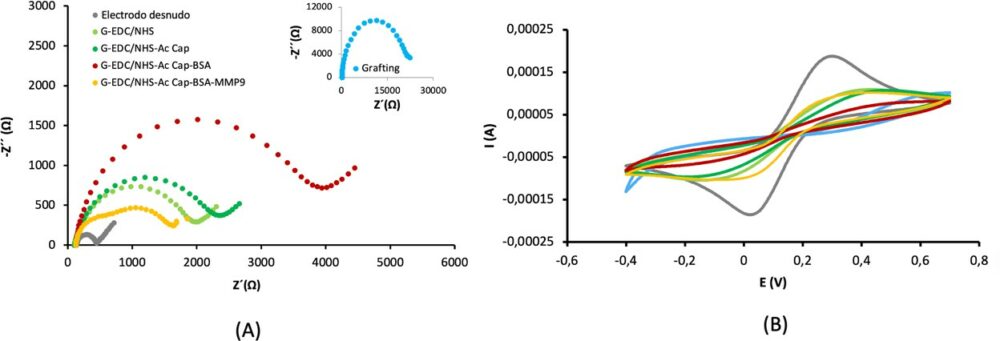
Con la finalidad de estudiar la modificación de la superficie electródica tras las sucesivas etapas de preparación del biosensor se realizó un estudio electroquímico mediante EIS y CV. Los datos obtenidos se representan en la Figura 2.A y Figura 2.B respectivamente.
Figura 2. (A) Diagrama Nyquist y (B) Voltamogramas cíclicos de 5 mM de Fe(CN) 4−/3− en 0,1 M de disolución tampón fosfato pH 7,4 en las diferentes etapas de formación del inmunosensor.
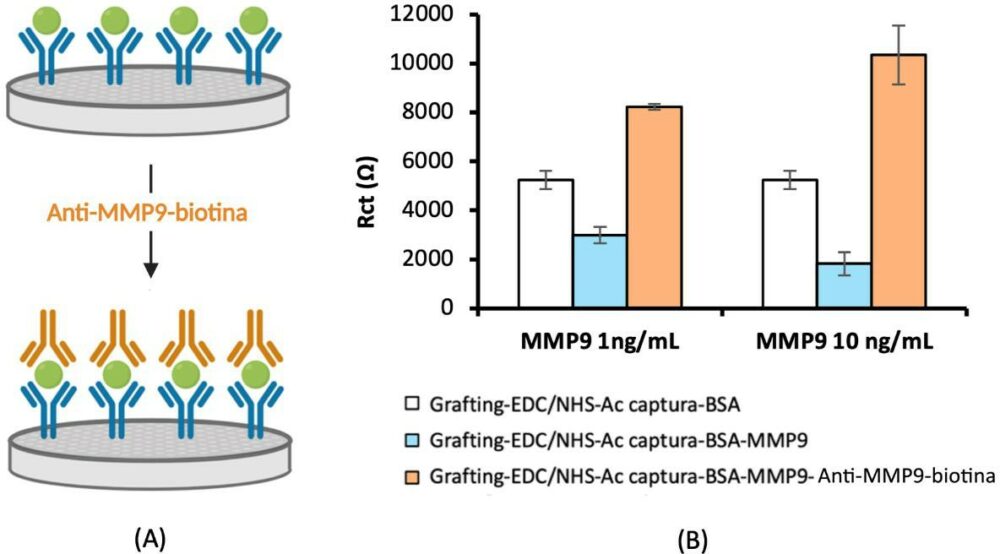
Para confirmar que la unión del anticuerpo de captura antiMMP9 se produce satisfactoriamente, se realiza una etapa posterior a la inmovilización del analito, mediante la adición de un anticuerpo de detección biotinilado (Ac-MMP9-biotin) que denominamos Ac secundario (Figura 3.A). Los resultados obtenidos se muestran en la Figura 3.B.
Figura 3. (A) Esquema de la etapa de adición del Anti-MMP9-biotina. (B) Resultados de la comprobación de la correcta unión de Ac captura-MMP9. Condiciones experimentales: EDC/NHSS, 100 mM, 10µl, 30 min; Ac captura, 10 µg/ml, 5 µl, 30 min; BSA 1%, 5 µl, 30 min; MMP9 0 o 10ng/ml, 5 µl, 60 min; Ac detección, 10 µg/ml, 5 µl, 30 min.
3.2 Estudio previo de adsorciones inespecíficas
Con el fin de estudiar la posible unión inespecífica del analito a la superficie electródica en lugar de al anticuerpo de captura, se prepararon electrodos en presencia y en ausencia del anticuerpo de captura antiMMP9 y en presencia de una misma concentración de MMP9 (1 o 10 ng/mL) y se compararon las señales obtenidas. En ausencia de Ac de captura inmovilizado, las señales de impedancia en presencia y en ausencia de MMP9 son muy ssimilares, obteniéndose una S/B cercana a 1 (S1/B=0,96; S10/B=0,90). Sin embargo, en presencia del anticuerpo de captura aantiMMP9, el diámetro del semicírculo disminuye en presencia del analito en concentración de 1 ng/mL, siendo mayor esta disminución para una concentración de analito de 10 ng/mL (S1/B=0,57; S10/B=0,35). Si el estudio se realiza mediante SSWV, se obtienen resultados concordantes, es decir, sin Ac de ccaptura,la relación S/B es próxima a la unidad en ausencia de anticuerpo de captura para ambas concentraciones de MMP9 (S1/B=1,0; S10/B=1,23) y en presencia del Ac de captura iinmovilizado,esta relación es muy superior, siendo de S1/B=4,34; S10/B=8,21 para concentraciones de MMP9 de 1 y 10 ng/mL, respectivamente.
3.3 Selección de la técnica de medida de cuantificación
Para llevar a cabo la cuantificación de MMP9, se comparan los resultados obtenidos mediante EIS y SWV, seleccionando como técnica óptima aquella que ofrezca un mayor valor de señal relativa (aumento de señal entre dos concentraciones de analito). Para ello, se realizaron medidas de concentraciones de 0; 0,1; 1 y 10 ng/mL de MMP9, obteniendo señales relativas entre las concentraciones 0,1 y 1 ng/mL de MMP9 de 48% y 74% para EIS y SWV, respectivamente.
3.4 Optimización de las variables experimentales
Con el fin de obtener la máxima sensibilidad y especificidad del inmunosensor desarrollado, se llevó a cabo la optimización de las variables experimentales que implicadas en su preparación. Para ello, se estudiaron mediante SWV diferentes parámetros experimentales, como las concentraciones de los biorreactivos, tiempos de incubación y tipos de disoluciones bloqueantes empleados, siendo el valor óptimo aquel que ofreciese una mayor relación señal/blanco (S/B).
3.4.1 Influencia de la concentración y tiempo de incubación del Ac de captura
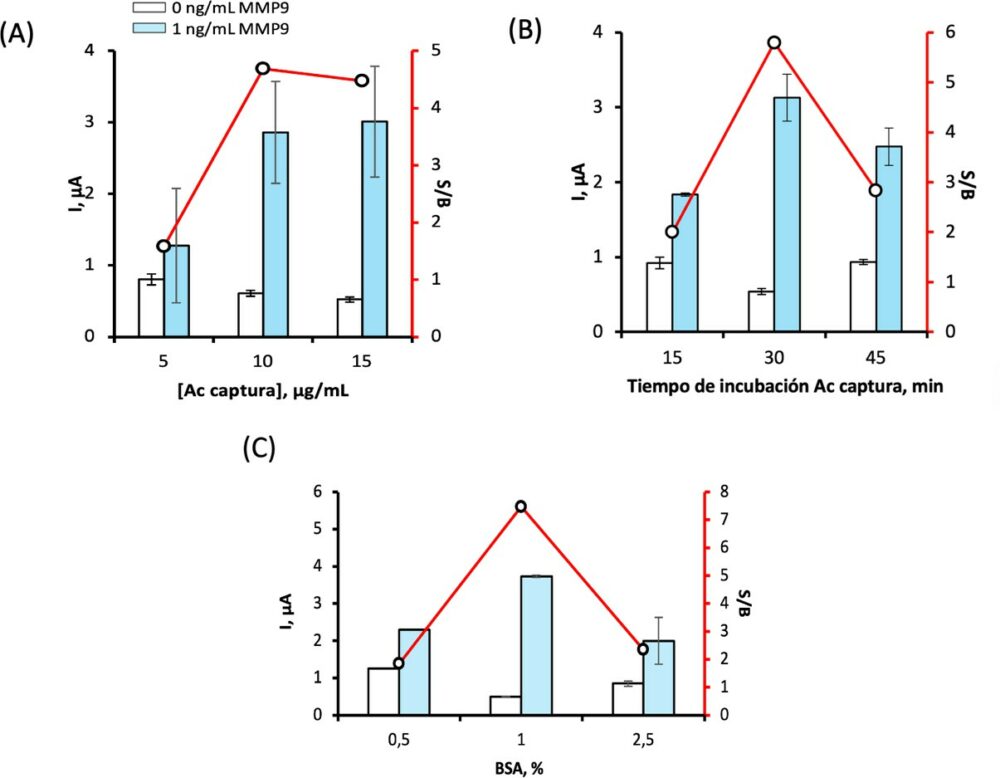
Tanto la concentración como el tiempo de incubación del Ac de captura son parámetros que juegan un papel esencial en la sensibilidad y el intervalo lineal del método analítico. Por ello, se estudió la influencia de la concentración de Ac de captura para valores de 5, 10 y 15 µg/mL y el tiempo de incubación de 15, 30 y 45 min. Los resultados obtenidos con SWV se representan en las Figuras 4.A y 4.B, respectivamente.
3.4.2 Influencia de la etapa de bloqueo: tipo y concentración de bloqueante
Con el objetivo de prevenir y disminuir en lo posible las adsorciones inespecíficas en la superficie del electrodo tras fijar el Ac de captura, se probaron distintos bloqueantes se evaluaron seis posibles agentes bloqueantes: etanolamina (ETA) al 10% en PB de pH 8, alcohol polivinílico (PVA) al 1% en PBS de pH 7,4, caseína al 2% en PBS de pH 7,4, blocking buffer (BB), BB libre de proteínas (PFBB) y albúmina de suero bovino (BSA) al 1% en PBS de pH 7,4. Para ello, se valoraron estos bloqueantes en ausencia y presencia de diferentes concentraciones de MMP9 depositando 5 μL de bloqueante sobre el electrodo previamente modificado con el Ac de captura y realizando la medida electroquímica. La mayor S/B se obtuvo al utilizar como agente bloqueante BSA obteniéndose valores de S/B semejantes y muy inferiores con el resto de los bloqueantes estudiados.
Por otro lado, para conocer el valor óptimo de la concentración de BSA se estudiaron diferentes concentraciones de BSA entre 0,5 y 2,5 %. obteniéndose mediante SWV, los valores representados en la Figura 4.C.
Figura 4. (A) Efecto de la concentración de Ac captura en la respuesta del inmunosensor. Ac captura, 5 µl, 30 min; BSA 1%, 5 µl, 30 min. (B) Efecto del tiempo de incubación del Ac captura en la respuesta del inmunonsensor. Ac captura, 10 µg/ml, 5 µl; BSA 1%, 5 µl, 30 min. (C) Influencia de la concentración de BSA en la respuesta del inmunonsensor: 0.5, 1, 2.5, 5%.En todos los casos: EDC/NHSS, 100 mM, 10µl, 30 min y MMP9 0 y 1 ng/ml, 5 µl, 60 min.
3.4.3 Influencia del tiempo de incubación de MMP9
El tiempo de incubación de la MMP9 es determinante para la respuesta del inmunosensor, por lo que se evaluaron tiempos entre 30 y 75 minutos de la unión MMP9 -Ac captura. Se obtuvo una relación señal/blanco aproximadamente 3 veces superior con un tiempo de 60 min.
3.5 Calibrado y características analíticas
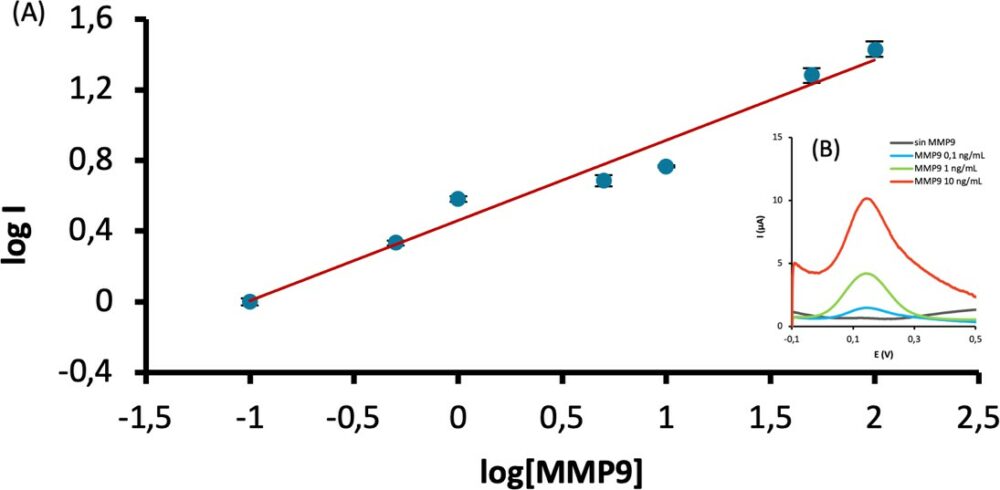
Una vez optimizadas las condiciones experimentales, se obtuvo la recta de calibrado representada en la Figura 5.
Figura 5. (A) Recta de calibrado para la determinación de MMP9. Condiciones experimentales: EDC/NHSS, 100 mM, 10ul, 30 min; Ac captura, 10 µg/ml, 5 µl; BSA 1%, 5 µl, 30 min; MMP9, 5 µl, 60 min. (B) En el inset se muestran los voltamperogramas de onda cuadrada (SWV) para distintas concentraciones de MMP9.
Para la determinación del límite de detección (LOD) y cuantificación (LOQ) se realizaron 10 medidas por SWV del blanco y utilizando el criterio x̅B+3·σ y x̅B+10·σ respectivamente. Los resultados obtenidos fueron un LOD de 0,301 ng/ml y un LOQ de 0,662 ng/ml.
La precisión se evaluó midiendo la respuesta de diferentes inmunosensores preparados con 1 y 50 ng/mL de MMP9 en el mismo día (precisión intraensayo) y en días distintos (precisión intermedia). Para la precisión intraensayo se obtuvieron valores de CV de 10% y 1% para las concentraciones de 1 y 50 ng/mL, respectivamente. Para la precisión intermedia, se obtuvieron valores de CV de 10% y 5% para las concentraciones de 1 y 50 ng/mL, respectivamente.
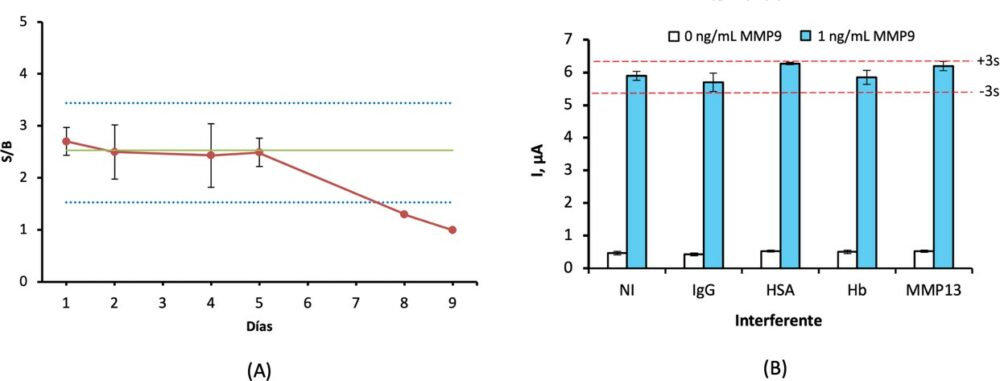
En cuanto a la estabilidad del inmunosensor desarrollado, fue evaluada mediante la preparación de diferentes electrodos gSCPE-AntiMMP9-BSA, y se almacenaron a 4 °C en condiciones de humedad. Cada día de estudio se utilizaron 4 electrodos para la medida voltamétrica en ausencia (blanco, B) y presencia de 1 ng/mL de MMP9 (señal, S), obteniéndose los resultados que se muestran en la Figura 6.A.
Figura 6. (A) Estudio de la estabilidad del inmunosensor. (B) Efecto de la ausencia de interferentes (NI) y presencia de 1 mg/mL anti-human IgG (IgG), 50 mg/mL HSA, 5 mg/mL HB y 2 ng/mL de MMP13 en la señal voltamperométrica obtenida con el inmunosensor para 0 y 1 ng/mL de MMP9. Condiciones experimentales: EDC/NHSS, 100 mM, 10µl, 30 min; Ac captura, 10 µg/ml, 5 µl; BSA, 5 µl, 30 min 1%; MMP9, 0 y 1 ng/mL, 5 µl, 60 min.
3.6 Estudio de selectividad
La selectividad del inmunosensor desarrollado se evaluó por comparación de las señales voltamétricas para 0 y 10 ng/mL de MMP9, y en ausencia y presencia de MMP13, así como otros compuestos comúnmente encontrados en el suero, tales como IgG, hemoglobina (Hb) y seroalbúmina humana (HSA), ver Figura 6.B.
3.7 Estudio de recuperación
Para estudiar la aplicabilidad del inmunosensor desarrollado al análisis de muestras reales, se realizó un estudio de recuperación utilizando suero sintético. Para ello se midió la corriente generada por el biosensor tras su incubación en la disolución de suero sintético, y luego se realizó una nueva medida en la misma muestra a la que previamente se adicionó una cantidad fija de MMP9. La diferencia entre las concentraciones de ambas mediciones se puede relacionar con la concentración de MMP9 añadida. De esta forma, para una concentración de MMP9 añadida de 1 ng/mL, se obtuvo una concentración de 0,95± 0,11 ng/mL, correspondiente a una recuperación del 95%, siendo de 10,92 ± 1,25 ng/mL cuando la concentración de MMP9 fue de 10 ng/mL, lo que se corresponde con una recuperación del 109,2%. Finalmente, si la concentración es de 100 ng/mL, el valor obtenido fue de 96,50 ± 7,56 ng/mL, con una recuperación del 96,5%.
4. DISCUSIÓN
Como era de esperar, tal y como muestra la Figura 2.A, el electrodo desnudo presentó un bajo valor de Rct, igual a 315 Ω. Tras el grafting electroquímico, adicionando pABA (pKa 4,65) y NaNO2, se produce un incremento muy acusado de la resistencia a la transferencia de carga (Rct = 24227 Ω). Este aumento se debe fundamentalmente a la repulsión electrostática entre la superficie electródica cargada negativamente debido a la presencia de los grupos carboxílicos del pABA y la sonda redox Fe(CN)64−/3−, también con carga negativa. La activación de los grupos carboxílicos con EDC/NHS provoca un descenso brusco de Rct igual a 2143 Ω debido a la neutralización parcial de la carga negativa por activación de los grupos carboxílicos. La unión del Ac de captura produce un aumento de Rct a 2581 Ω debido al bloqueo de la superficie electródica por la capa de proteína inmovilizada. Como era de esperar, la adicción de BSA produce un aumento de Rct hasta 3880 Ω. como consecuencia del mayor bloqueo de su superficie electródica y de la repulsión entre la sonda Fe(CN)4−/3− y el BSA (punto isoeléctrico 4,7), ambos cargados negativamente al pH de trabajo (pH 7,4). Sorprendentemente, tras la unión de MMP9 al Ac de captura, la resistencia a la transferencia de carga disminuye (Rct = 1650 Ω para MMP9 de 1 ng/mL) y esta disminución es tanto mayor conforme aumenta la concentración de la metaloproteinasa. Estos resultados concuerdan con los observados mediante SWV, es decir, la corriente aumenta a medida que lo hace la concentración de MMP9. Aunque hasta el momento no se ha encontrado una explicación satisfactoria a este hecho, ya que según la bibliografía consultada el punto isoeléctrico de la MMP9 es de 5.7 y cabría esperar una repulsión electrostática de la sonda redox en disolución por parte de la superficie electródica cargada negativamente al pH de trabajo, actualmente se están realizando estudios encaminados a esclarecer este punto. Se piensa que puede haber una reorganización de la capa tras la unión del antígeno-anticuerpo, favoreciéndose de esta manera el acceso de la sonda redox Fe(CN)4−/3−.
Con la finalidad de verificar la unión del analito MMP9 al anticuerpo de captura inmovilizado sobre la superficie electródica, se realizaron medidas tras incubar la superficie anterior en un anticuerpo de detección anti-MMP9 biotinilado. Como puede observarse en la figura 3.B, la incorporación de este anticuerpo biotinilado produjo un aumento de la Rct, lo que se atribuye a la mayor dificultad del acceso de la sonda Fe(CN)4−/3− a la superficie electródica, verificándose de esta forma que la unión de la MMP9 al anticuerpo de captura primero y al anticuerpo de detección biotinilado después ha tenido lugar.
Los resultados obtenidos por voltametría cíclica (Figura 2.B) concuerdan con los obtenidos mediante EIS Así, la intensidad de corriente sobre el electrodo desnudo (SPCE) mostró un pico anódico y uno catódico, siendo Ipa de 0,19 mA, y la separación entre ellos ΔEp de 230 mV. Tras el grafting electroquímico se produjo un drástico descenso de la intensidad del pico anódico (Ipa = 0,02 mA) y un aumento de la separación entre los potenciales de pico (ΔEp = 800 mV), mostrando un proceso irreversible, debido, probablemente, a la gran dificultad de acceso de la sonda Fe(CN)6 / al electrodo ya explicado. Como era de esperar, la adición de EDC/NHS da lugar a un incremento de Ipa (0,07 mA) y a una disminución de la separación de picos (ΔEp 420 mV), que concuerda con el descenso observado en Rct. Tras la adición del anticuerpo de captura anti- MMP9, se produce un descenso de la corriente Ipa (0,057 mA) y un incremento de ΔEp (490 mmV), ya que la capa sensora formada dificulta en mayor medida el acceso de Fe(CN)64−/3− a la superficie electródica. La adición del bloqueante produce un descenso de la intensidad de corriente (Ipa = 0,04 mA) y una mayor separación entre los potenciales de pico (540 mV). Finalmente, la unión de la proteinasa MMP9 al anticuerpo de captura produce un descenso de ΔEp a 350 mV y un aumento de Ipa a 0,077 mA, lo que concuerda con los resultados obtenidos mediante EIS.
Los resultados de las medidas obtenidas en presencia y en ausencia de anticuerpo de captura inmovilizado para concentraciones de MMP9 de 1 y 10 ng/mL por CV y EIS (apartado 3.2) sugieren que la adsorción inespecífica de MMP9 al electrodo es despreciable, uniéndose al electrodo sólo en presencia de anticuerpo de captura.
Con base en los resultados mostrados en el apartado 3.3, se seleccionó la técnica de SWV para la optimización de las variables experimentales relacionadas con la preparación del inmunosensor y la cuantificación de MMP9, ya que, además de tratarse de una técnica muy rápida, la relación de señales para 1 y 0,1 ng/mL de MMP9 es superior.
En cuanto a la elección de las variables experimentales, se observó una S/B máxima para 10 µg/mL de Ac de captura y para un tiempo de incubación de 30 min, valores que, por tanto, fueron los seleccionados para estudios posteriores (Figuras 4.A y 4.B). En cuanto al agente bloqueante, el BSA es el único que disminuye la señal inespecífica. En la Figura 4.C se estudia la concentración de BSA, obteniéndose la mayor relación S/B para BSA al 1 %. El tiempo de incubación óptimo de MMP9 fue de 60 min.
Como puede apreciarse en la Figura 5, se observó una relación lineal entre el logaritmo de la intensidad de corriente registrada mediante SWV y el logaritmo de la concentración de MMP9 en el rango de 0,3 a 150 ng/mL (R2= 0,983), obteniéndose la siguiente ecuación de calibrado: log i = (0,454 Ω 0,112) log[MMP9]+(0,459 Ω 0,080). Se obtuvo un valor de LOD de 0,301 ng/mL, y un valor de LOQ de 0,662 ng/mL. El intervalo lineal obtenido es adecuado para la cuantificación de MMP9 en muestras de suero humano en condiciones fisiológicas. Para situaciones patológicas, donde las concentraciones de MMP9 superan los 150 ng/mL, solo sería necesario un paso previo de dilución de muestras.
En el estudio de precisión, para una concentración de 50 ng/mL de MMP-9, que es representativa de niveles fisiológicos, se obtuvieron coeficientes de variación (CV) inferiores al 5%, lo que se considera dentro de los valores aceptables para esta metodología. Al reducir la concentración de MMP-9 a 1 ng/mL, como era de esperarse, el valor de CV aumentó, pero sin superar el límite del 10%. Estos resultados indican que el proceso de medición con el inmunosensor presenta una alta precisión.
En cuanto a la estabilidad, la relación S/B del inmunosensor se mantuvo dentro de los límites control establecidos en ±3σ durante 5 días, demostrando la estabilidad del dispositivo desarrollado en ese periodo (Figura 6.A).
En la Figura 6.B se muestra la influencia de la presencia de diversos compuestos que pueden considerarse como potenciales interferentes sobre la señal del inmunosensor. En ningún caso la corriente obtenida en presencia y ausencia de MMP9 presentaba diferencias significativas, manteniéndose en todos los casos dentro de los límites establecidos de ±3s, por lo que puede considerarse que el inmunosensor es altamente selectivo.
Finalmente, se llevó a cabo la determinación de MMP9 en muestras de suero sintéticas. Los estudios de recuperación proporcionaron valores próximos al 100% (entre 95 y 109,2%), lo que pone de manifiesto la validez del método analítico propuesto para la determinación de MMP9.
Realizando una comparación con otros biosensores electroquímicos para la detección de MMP9 encontrados en la bibliografía, el biosensor propuesto en este trabajo presenta propiedades analíticas similares en cuanto a intervalo lineal y límite de detección (9, 15 y 16). Además, la metodología propuesta presenta ventajas adicionales, como un menor tiempo de preparación del bioensayo en comparación con otros dispositivos, dada la sencilla metodología de una configuración label-free que no requiere el empleo de un anticuerpo de detección marcado, lo que redunda en un menor gasto de reactivos, disminuyendo el coste del análisis (9,21).
5. CONCLUSIONES
El presente trabajo describe el desarrollo de un inmunosensor electroquímico para la determinación de MMP9 y su aplicación en muestras clínicas. Esta metodología presenta una alta aplicabilidad en el entorno de la atención farmacéutica, contribuyendo a la optimización de procesos de cribado y monitoreo de biomarcadores de interés clínico.
El método propuesto ofrece un amplio intervalo lineal, límites de detección y cuantificación bajos y un porcentaje de recuperación en muestras de suero sintéticas cercano al 100%. Todo ello evidencia la viabilidad y efectividad de la bioplataforma electroquímica en el análisis de muestras reales.
La metodología propuesta no requiere un pretratamiento de la muestra; solo en el caso de pacientes con patologías donde la concentración de MMP9 puede verse aumentada, será necesaria una dilución previa del suero para su análisis.
Además, la naturaleza libre de marcaje del dispositivo permite eliminar la necesidad de anticuerpos de detección y marcaje enzimático, lo que no solo reduce el coste de los reactivos, sino que también simplifica el proceso, eliminando pasos adicionales, mejorando la eficiencia y el tiempo del análisis.
Por sus características de automatización y miniaturización, el inmunosensor se presenta como una herramienta altamente prometedora para su integración en dispositivos de punto de atención (point-of-care) en el ámbito clínico. Esta accesibilidad podría facilitar la implementación del dispositivo en programas de seguimiento farmacoterapéutico, permitiendo al personal de farmacia monitorizar de manera rápida y eficiente biomarcadores como MMP9. Esto, a su vez, contribuiría a mejorar la adherencia al tratamiento y optimizar el control de enfermedades relacionadas.
En conclusión, este inmunosensor tiene un gran potencial para integrarse en la práctica de atención farmacéutica, ofreciendo una solución innovadora que puede mejorar tanto la seguridad como la efectividad del proceso asistencial. A largo plazo, esta herramienta podría tener un impacto positivo en la calidad de vida de los pacientes, promoviendo un enfoque más personalizado y eficiente en el manejo de su salud.
Agradecimientos
Agradecemos el apoyo financiero del proyecto Explorando el microbioma: dispositivos electroquímicos de biosensado para biomarcadores del microbioma humano (PID2021-122457OB-I00) financiado por la Dirección General de Investigación Científica y Técnica. Subdirección General de Proyectos de Investigación. Ministerio de Ciencia, Innovación y Universidades. Extendemos nuestro agradecimiento a Claudia Ramos-López y Lorena García-Rodrigo por su orientación y apoyo.
6. REFERENCIAS
- Cabral-Pacheco GA, Garza-Veloz I, Rosa CCD La, Ramirez-Acuña JM, Perez-Romero BA, Guerrero-Rodriguez JF, et al. The roles of matrix metalloproteinases and their inhibitors in human diseases. Int. J. Mol. Sci. 2020 Dec 2;21(24):1–53. doi:10.3390/ijms21249739
- Lee HS, Kim WJ. The Role of Matrix Metalloproteinase in Inflammation with a Focus on Infectious Diseases. Int. J. Mol. Sci. 2022;23(18). doi:10.3390/ijms231810546
- Rashid ZA, Bardaweel SK. Novel Matrix Metalloproteinase-9 (MMP-9) Inhibitors in Cancer Treatment. Int. J. Mol. Sci. 2023;24(15). doi:10.3390/ijms241512133.
- Huang H. Matrix Metalloproteinase-9 (MMP-9) as a Cancer Biomarker and MMP-9 Biosensors: Recent Advances. Sensors. 2018;18(10). doi:10.3390/s18103249
- Lee J, Yun JY, Lee WC, Choi S, Lim J, Jeong H, et al. A reference electrode-free electrochemical biosensor for detecting MMP-9 using a concentric electrode device. Sens. Actuators B Chem. 2017; 240:735–41. doi: 10.1016/j.snb.2016.09.026
- Lv C, Zhang Q, Tang P, Guo L, Ding Q. Serum MMP-9, SP-D, and VEGF levels reflect the severity of connective tissue disease-associated interstitial lung diseases. Adv. Rheumatol.. 2022;62(1):37. doi.:10.1186/s42358-022-00269-w
- Blanco-Prieto S, Barcia-Castro L, Páez de la Cadena M, Rodríguez-Berrocal FJ, Vázquez-Iglesias L, Botana-Rial MI, et al. Relevance of matrix metalloproteases in non-small cell lung cancer diagnosis. BMC Cancer. 2017;17(1):823. doi:10.1186/s12885-017-3842-z
- Valente FM, de Andrade DO, Cosenso-Martin LN, Cesarino CB, Guimarães SM, Guimarães VB, et al. Plasma levels of matrix metalloproteinase-9 are elevated in individuals with hypertensive crisis. BMC Cardiovasc. Disord. 2020;20(1):132. doi:10.1186/s12872-020-01412-5
- Shabani E, Abdekhodaie MJ, Mousavi SA, Taghipour F. ZnO nanoparticle/nanorod-based label-free electrochemical immunoassay for rapid detection of MMP-9 biomarker. Biochem. Eng. J. 2020; 164:107772. doi: 10.1016/j.bej.2020.107772
- Kalali D. The Role of the Matrix Metalloproteinase-9 Gene in Tumor Development and Metastasis: A Narrative Review. Glob. Med. Genet. 2023;10(02):48–53. doi: 10.1055/s-0043-1768166
- Rai P, Hoba SN, Buchmann C, Subirana-Slotos RJ, Kersten C, Schirmeister T, et al. Protease detection in the biosensor era: A review. Biosens. Bioelectron. 2024;244:115788. doi:10.1016/j.bios.2023.115788
- Ong ILH, Yang KL. Recent developments in protease activity assays and sensors. Analyst. 2017;142(11):1867–81. doi:10.1039/C6AN02647H
- Bhalla N, Jolly P, Formisano N, Estrela P. Introduction to biosensors. Estrela P, editor. Essays Biochem. 2016 jun 30;60(1):1–8. doi:10.1042/EBC20150001
- Singh A, Sharma A, Ahmed A, Sundramoorthy AK, Furukawa H, Arya S, et al. Recent Advances in Electrochemical Biosensors: Applications, Challenges, and Future Scope. Biosensors (Basel). 2021;11(9). doi:10.3390/bios11090336
- Arévalo B, ben Hassine A, Valverde A, Serafín V, Montero-Calle A, Raouafi N, et al. Electrochemical immunoplatform to assist in the diagnosis and classification of breast cancer through the determination of matrix-metalloproteinase-9. Talanta. 2021;225:122054. doi:10.1016/j.talanta.2020.122054
- Ruiz-Vega G, García-Robaina A, Ben Ismail M, Pasamar H, García-Berrocoso T, Montaner J, et al. Detection of plasma MMP-9 within minutes. Unveiling some of the clues to develop fast and simple electrochemical magneto-immunosensors. Biosens. Bioelectron. 2018; 115:45–52. doi: 10.1016/j.bios.2018.05.020
- Biela A, Watkinson M, Meier UC, Baker D, Giovannoni G, Becer CR, et al. Disposable MMP-9 sensor based on the degradation of peptide cross-linked hydrogel films using electrochemical impedance spectroscopy. Biosens. Bioelectron. 2015;68:660–7. doi:10.1016/j.bios.2015.01.060
- Sanko V, Kuralay F. Label-Free Electrochemical Biosensor Platforms for Cancer Diagnosis: Recent Achievements and Challenges. Biosensors (Basel). 2023;13(3). doi:10.3390/bios13030333
- Yunus G, Singh R, Raveendran S, Kuddus M. Electrochemical biosensors in healthcare services: bibliometric analysis and recent developments. Peer J. 2023;11: e15566. doi: 10.7717/peerj.15566
- Grossi M, Riccò B. Electrical impedance spectroscopy (EIS) for biological analysis and food characterization: A review. J. Sens. Sens. Syst. 2017 28; 6:303–25. doi:10.5194/jsss-6-303-2017
- Ruiz-Vega, G., Garcia-Rabaina, A., Ben Ismaeil, M., Pasamar, H., Garcia-berracosa, T., Montaner, J., Zourob, M., Othmane, A., del Campo, FJ., Baldrich, E. Detection of plasma MMP-9 within minutes. Unveiling some of the clues to develop fast and simple electrochemical magneto- immunosensors. Biosens. Bioelectron. 2018:115:45-52. doi: 10.1016/j.bios.2018.05.020