1. INTRODUCCIÓN
El dolor crónico no oncológico (DCNO) es una de las principales razones por las que los pacientes acuden a los servicios de salud en todo el mundo. En España, el dolor es un gran problema de salud general que afecta a cerca del 20% según diferentes estudios (1–3). Además, en cuanto al análisis por sexos la prevalencia del dolor se ve más acentuada en mujeres, con cifras cercanas al 30% (1,4,5). El problema, a su vez se incrementa con una mayor dificultad de diagnóstico de esta sintomatología sumada al sesgo que afecta a las pacientes femeninas. La consecuencia es un retraso en su diagnóstico y un perfil de seguridad analgésica diferente (6).
Globalmente la afección de DCNO es una de las principales razones por la que los pacientes acuden al sistema sanitario para ser tratados (7). En función de su naturaleza y gravedad del dolor, pueden ser atendidos en diferentes centros y unidades como son atención primaria, servicio de urgencia en Hospitales y Unidad del dolor (tras la derivación de atención primaria) (8,9).
Muchos son los tratamientos posibles para poder tratar tanto dolor agudo (DA) como DCNO y se han intentado armonizar en su prescripción por parte de la OMS mediante la escalera analgésica desde 1986. Uno de los principales tratamientos que se indican para el DCNO es el uso de opioides y sus derivados (6,10,11). Respecto al dolor agudo, el principal arsenal terapéutico radica en el uso de Antiinflamatorios No Esteroideos (AINES), siendo el primer escalón terapéutico el uso de Paracetamol en dolores leves y otros AINES (como Ibuprofeno o dexketoprofeno) asociados a opioides menores en dolores moderados e intensos (8,9).
La relación entre dolor y sueño ha sido objeto de estudio durante un largo periodo de tiempo, destacando además una sinergia negativa con efectos adversos más frecuentes de los opioides: el insomnio, la depresión respiratoria y somnolencia diurna (11,12). Es por esto que existe controversia de si un opioide como tratamiento crónico es el mejor tratamiento para el DCNO (10,13).
Tanto el dolor como los problemas de sueño, son conceptos muy estudiados por la literatura demostrando que existe una fuerte relación e interacción entre ellas dos (13–15). El dolor además, puede llegar a representar una carga significativa en el propio paciente sobre todo en situaciones cotidianas como el descanso (12). El dolor puede afectar negativamente al sueño y a su vez, la falta de sueño puede aumentar la percepción de dolor (13–16). Tal es este vínculo, que estas condiciones coexisten en más del 50% de los pacientes, teniendo en su mayoría dificultades para dormir o algún otro tipo de Trastorno de Sueño (TS) (15,17).
Por otro lado, se han observado comorbilidades importantes asociadas a sufrir DCNO como son la ansiedad y la depresión (acentuado además los TS) (18,19). Siendo la primera un estado emocional más frecuente asociado al DA y la segunda al DCNO (8,20), pero ambas (estando relacionadas) son superiores a la población general.
A nivel nacional, poca es la información existente sobre pacientes con DCNO, DA y sus comorbilidades en Oficina de Farmacia (OF). Nos vemos con la necesidad de realizar este estudio con el fin de abrir un campo de investigación sobre un tema de importancia general que afecta a tantas personas. Creemos importante también, estudiar cómo afecta el género a la hora de prescribir el tratamiento y observar la evolución de este en función de su sexo.
2. OBJETIVOS
El objetivo general de esta investigación es analizar y describir la relación entre problemas de sueño y dolor en pacientes que acuden a servicios especializados y atención primaria incorporando el análisis considerando la variable sexo.
Los objetivos específicos son:
- Relacionar el nivel de dolor declarado por el paciente y su prescripción y compararlo con criterios establecidos en la en la Escalera analgésica de la Organización Mundial de la Salud (OMS).
- Comparar cómo se prescriben analgésicos (grupo farmacológico) en función de la especialidad médica.
- Estudiar si existe alguna relación entre los efectos adversos de los fármacos utilizados para tratar el dolor.
- Describir qué comorbilidades están asociadas al dolor, falta de sueño y/o pérdida de calidad de este, como depresión/ansiedad.
- Analizar cómo duermen los pacientes que están en tratamiento con analgésicos, desde antiinflamatorios no esteroideos, antiepilépticos o derivados de la morfina.
- Relacionar los valores EVA de dolor y alivio con el tratamiento prescrito por los profesionales sanitarios.
3. MATERIAL Y MÉTODO
3.1. Diseño del estudio
Estudio transversal y prospectivo que trata de explicar la relación entre los TS que son derivados tanto del DCNO, como de la medicación que recibe para tratarlo. El presente proyecto ha sido aprobado por el comité de ética de la UCAM (CE 032307).
3.2. Sujetos a estudio
Este estudio se realizó en una muestra de pacientes reclutados bajo 3 premisas. En primer lugar, pacientes con DCNO atendidos en la unidad del dolor (UDO) del Hospital General Universitario de Alicante (HGUA), con un tratamiento opioide desde hace 6 meses o más. Además, se incluye un grupo control con un tamaño muestral similar a los pacientes con DCNO, de pacientes con DCNO pero sin problemas de sueño auto declarados. Ambos grupos de pacientes son de la misma área geográfica, ya que los datos han sido recogidos en el HGUA.
Por otro lado tenemos a pacientes con DCNO y DA, que han sido atendidos en OF. Estos grupos de pacientes ambulatorios de pertenecen al área geográfica mediterránea, comprendida entre Murcia y Alicante.
Los candidatos y finalmente participantes de este estudio lo fueron después de haber revisado y cumplido los siguientes criterios:
Criterios de inclusión:
Todos tuvieron una edad comprendida entre 18 y 80 años
Estaban experimentando un estado de DA o DCNO
Recibían un tratamiento estable con analgesia de cualquier tipo, siendo necesario que el grupo de casos del HGUA tomasen opioides durante al menos 6 meses
Todos han firmado un consentimiento informado.
El grupo control no tenía ningún problema de sueño asociado auto reportado y pertenece a la misma zona geográfica que los casos
Criterios de exclusión:
Se excluirán los pacientes que hayan rechazado firmar el consentimiento informado por escrito para la participación en el estudio.
Aquellos pacientes que estén en tratamiento farmacológico específico para el sueño (melatonina).
Quienes su estado de salud les incapacitará para la participación.
Usuarios que pese a tener recetado un medicamento analgésico, no hacen uso de él o no tienen dolor.
Finalmente, un motivo de exclusión en el análisis es la pérdida de seguimiento de aquellos sujetos que hayan decidido por decisión propia no seguir en el estudio. Pacientes que por motivos ajenos al estudio se ha perdido el seguimiento o no han cumplimentado el cuestionario de recogida de datos (CDR, Anexo 1).
3.3 Variables
Para poder recoger toda información que comprenda datos sobre calidad de vida, dolor y sueño se ha diseñado un cuestionario de recogida de datos (CRD) (Anexo 1).
El CRD se ha realizado en 13 farmacias de las cuales 9 estaban localizadas en la Región de Murcia y 3 en la Comunidad Valenciana y 1 en Castilla la Mancha. El periodo de recogida de datos se inició el 6 de marzo hasta el 27 de abril de 2023.
Todos los pacientes incluidos en los tres grupos van a cumplimentar el CRD. Estas variables corresponden a la variabilidad subjetiva de sueño y dolor:
3.3. a. Variables subjetivas de dolor y alivio
Escala visual analógica (EVA) de dolor: Se trata de una herramienta cuya utilidad es ayudar a medir la intensidad del dolor que siente un paciente en el momento que está realizando la encuesta. Está caracterizada por ser una línea recta de unos 10 cm representando el cm 0 la sensación de inocuidad frente al dolor mientras que el extremo 10 significa el dolor máximo que puede llegar a sentir en cualquier momento (21). Una de sus principales utilidades es la correcta prescripción y dosificación de un analgésico de acuerdo a la escala analgésica de la OMS (22).
EVA de alivio de dolor: Su funcionamiento es el mismo que la EVA de dolor. La principal diferencia es que el paciente marque cual es el grado de mejora frente al dolor una vez a consumido su medicación analgésica. Una de sus principales indicaciones es evaluar si la indicación farmacológica es la correcta (23,24).
3.3. b. Variables subjetivas de calidad de vida y estado de salud
EuroQol-5D (EQ-5D): Herramienta sencilla para la medición de la calidad de vida relacionada con atención primaria. Se trata de otra escala EVA, esta vez en sentido vertical y cuya longitud es de 0-100mm. Divide el mejor estado de salud imaginable (parte superior de la recta) frente al peor estado de salud posible (parte inferior de esta) (25). El paciente deberá marcar cuál es su estado actual frente a estas dos dualidades.
Además, el EuroQol se completa respondiendo a otras preguntas cerradas sobre movilidad, cuidado personal etc. (25). Las opciones de menor gravedad se codifican con “1” siendo la respuesta “no tengo problema”, “2” en las valoraciones intermedias cuando el usuario responde “Tengo algunos problemas” y “3” en las opciones más graves.
Tras responder a las cinco preguntas, se crea un código por ejemplo: 11123 que clasificaría al paciente en función de su perfil.
3.3. c. Variables relacionadas con las comorbilidades:
Escala de Ansiedad y Depresión del Hospital (HADS): Es una de las mejores herramientas para conocer estas dos patologías y otros estados de salud que podrían ser derivador del dolor (26,27). Este instrumente es ampliamente utilizado a nivel ambulatorio y se caracteriza por tener 7 preguntas de múltiple respuesta (28). Estas preguntas califican entre 0 y 3. El rango total varía de 0 a 21. De 0 a 7 correspondería a un estado normal del paciente, 8-10 sería la puntuación límite y de 11 a 21 correspondería a una situación de angustia psicológica.
3.3. d. Variables relacionadas con el tratamiento y los eventos adversos:
Tratamiento del paciente. Se recoge en dos tablas el tratamiento prescrito al paciente. La primera tabla recoge el número total de opioides prescritos y dosis total de opioides convertida a equivalente de morfina(29). La segunda tabla comprende cualquier medicamente analgésico prescrito y consumido por parte del paciente. También hace referencia a fármacos cuyo uso se vea derivado del propio dolor, véase benzodiacepinas, neurolépticos, antipsicóticos etc.
Eventos adversos más frecuentes asociados a los analgésicos según sus fichas técnicas, véase (Anexo 1).
Lugar de diagnóstico y prescripción. Se trata de un cuestionario semi-cerrado. Eso quiere decir que las dos primeras opciones correspondían a Urgencias y Atención primaria (AP). Si el lugar de prescripción del analgésico no correspondía a ninguna de estas opciones y fue por parte del especialista, se solicitaba escribir cual fue.
3.3. e. Variables subjetivas de Sueño:
Cuestionario del Sueño MOS-S: (del inglés Medical Outcomes Study Sleep). Se trata del mejor instrumento para medir la calidad del sueño en estudios clínicos sobre el dolor (30). Pese a que se trate de una encuesta con puntajes interpretables, sus propiedades psicométricas (confiabilidad y validez) son altas (31). Está compuesta por 12 preguntas que abarca diferentes cuestiones sobre la calidad del sueño con un promedio de 6 respuestas posibles en la mayoría de cuestiones (32). Este cuestionario evalúa alteraciones del sueño, ronquitos, somnolencia, sensación térmica y diferentes dolores. Los resultados se dividen en 7 clasificaciones: Alteración (SLPD), Ronquidos (SLPSNR), Falta de aliento (SLPSOB), Cantidad (SLPQ), Sueño óptimo (SLOP), Suficiencia (SLPA), Somnolencia (SLPS), Índice 6 (SLP6) y Índice 9 (SLP9). El rango varía entre 0-100 (33).
Índice de calidad del sueño de Pittsburgh (PSQI): se trata de una herramienta útil para medir la calidad subjetiva del sueño (34) además de ser el instrumento más utilizado en la literatura científica (30,35). Está compuesto habitualmente por 19 ítems sobre hábitos de sueño en el último mes. Abarca diferentes cuestiones como calidad subjetiva del sueño, latencia del sueño, duración del sueño, eficiencia habitual del sueño, trastornos del sueño, uso de medicamentos para dormir y disfunción diurna. Además, divide a los participantes en “buenos dormidores” y “pobres dormidores” (36), siendo 5 la división correspondiente entre ambos grupos (36).
Para facilitar una correcta comprensión del test por parte del paciente, se ha reducido a 10 cuestiones, siendo la pregunta 5 la que abarca los 9 restantes. Cada ítem tiene una puntuación que oscila entre 0 a 3 puntos.
Este cuestionario tiene un puntaje máximo de 21, siendo 0 una calidad de sueño perfecta y 21 la peor calidad de sueño posible.
3.4 Búsqueda bibliográfica
A la hora de recoger referencias se ha realizado una búsqueda de artículos en el buscador de ciencias de la salud PubMed entre los años 2013 y 2023, utilizando palabras clave como: “PAIN”, “CRONIC PAIN”, “SLEEP”,”TREATMENT”, “OPIOID”. Se utilizaron en todas las búsquedas el operador booleano AND con el fin de encontrar los artículos más específicos.
Un ejemplo de búsqueda sería: ((( (((chronic pain) AND (pharmacological treatment)) AND (sleep measures)) AND (sleep)) AND (questionnaires)) AND (effect)) AND (opioids).
3.5 Análisis estadístico
En el presente estudio, las variables cuantitativas se expresaron como media y desviación estándar. Las variables cualitativas se presentaron como porcentajes. La normalidad de las variables cuantitativas se evaluó por medio de la prueba Shapiro-Wilk. Se consideran variables no normales aquellas en las que el valor de la p en la prueba es igual o inferior a 0.05. Para el estudio de significación de las variables cuantitativas en parejas se empleó la prueba t de Student o la prueba U de Mann-Whitney. Cuando se establecieron comparaciones entre 3 grupos o más, se empleó una prueba ANOVA o un Kruskal Wallis. Se ha empleado la prueba Chi cuadrado con la corrección de Yates para las variables cualitativas. Se ha empleado el software informático GraphPad Prism Versión 9.5.1 (733) para estos análisis y se ha marcado como umbral de significación un p valor inferior o igual a 0.05.
4. RESULTADOS Y DISCUSIÓN
A continuación se presentan el número total de pacientes que se han incluido en el presente estudio por grupo. Por un lado, se encuentran los pacientes con DCNO atendidos en la unidad del dolor del HGUA (46 con problemas de sueño, y 91 sin quejas de problemas de sueño aparentes) y los 55 pacientes entrevistados en las Oficinas de farmacia (OF) con DCNO y DA.
Tras realizar una búsqueda, podemos afirmar que el presente estudio es pionero a nivel nacional a la hora de analizar el sueño en pacientes con DCNO y DA en la OF. En este estudio que ha analizado el sueño de 55 pacientes de oficina de farmacia, y lo ha comparado con 137 pacientes que acuden al HGUA se ha visto que en general esta población presenta elevados problemas de sueño, así como una serie de efectos adversos y comorbilidades que se encuentran claramente determinados por el sexo. Tras realizar esta investigación se atisban diferentes cuestiones respecto a la relación entre el dolor y el sueño.
Figura 1. Diagrama de flujo reclutamiento de participantes
4.1 Análisis de variables sociodemográficas
Debido a que el tamaño muestral de los tres grupos fue diferente, se analizó la distribución por sexo y edad entre los tres grupos del estudio (OF, casos y controles) y también intragrupo. En ninguna de las comparaciones se vieron diferencias significativas por lo que la composición de los grupos, a pesar de que las n fueron diferentes fue homogénea y comparable.
La mayor parte de los participantes reclutados en las OF estaban jubilados (44%), seguido de pacientes en activo (Tabla 1). Estos datos no se pudieron recoger de la muestra de pacientes de la Unidad de dolor del HGUA.
Tabla 1. Datos descriptivos demográficos Oficina de Farmacia
Respecto a los datos descriptivos demográficos recogidos en el HGUA, se obtuvo una muestra total de 137 pacientes de los cuales 46 correspondían al grupo “Caso”. Las restantes 92 muestras corresponden al grupo control, de los cuales se conoce el sexo de 84 de ellos.
El tiempo de evolución del dolor en pacientes entrevistados en OF es superior a 6 meses en el 80%, considerándose DC, un 11% con la duración del dolor era inferior a 3 meses, y el 9% una duración entre 3 y 6 meses.
El principal dato que se destaca es que más de la mitad de las indicaciones de analgésicos fueron indicadas en AP (médico de cabecera) con un 50,1%, siendo este dato especialmente marcado en las mujeres (59,4%). Por el contrario, las indicaciones realizadas en Urgencias abarcan el 1,82% (un único paciente).
A lo largo de los años, diferentes autores en diferentes países llegan a la conclusión de que las mujeres sufrían más por dolor crónico y visitan más al médico que los hombres (37,38), dato que iría en la línea de los resultados obtenidos en este estudio. Uno de estos autores además, con un tamaño muestral (y proporción hombres/mujeres) similar a este caso encontró que las mujeres percibían un dolor diurno más alto en promedio que los hombres, incluyendo la prevalencia de otras patologías asociadas como estrés y ansiedad (37).
Tabla 2. Datos descriptivos demográficos Unidad de Dolor
Tabla 3. Lugar de prescripción
4.2 Análisis Clínico
Al comparar los valores totales por grupo de intensidad de dolor, se apreció una diferencia significativa (p valor 0,003), siendo valores más elevados para el grupo de la UDO (Tabla 4 y 5). Al hacer el análisis por sexo, intergrupal, se apreció que los hombres presentaron un valor de EVA significativamente inferior al de las mujeres (p valor 0,0039), pero no hubo diferencias intragrupo. La intensidad de dolor estuvo condicionada por el sexo, y por el sitio de reclutamiento. No se apreciaron diferencias significativas en el caso del alivio, por lo que ninguno de los tratamientos farmacológicos del estudio presentó una tasa de éxito destacable. Los resultados obtenidos en la OF podemos encontrarlos en la tabla 4 y el HGUA en la Tabla 5.
Tabla 4. Intensidad dolor y alivio. Oficina de Farmacia
Tabla 5. Intensidad dolor y alivio. Unidad del Dolor
En primer lugar, cabe destacar como la propia percepción del dolor es superior en mujeres de los pacientes entrevistados en OF. Esto está en la línea con lo descrito por Andrews et al. en su estudio donde dedica un apartado a las diferencias entre percepción del dolor entre sexos(37).
A su vez ellas acuden más a AP que los hombres ya que la indicación es superior en este nivel asistencial este dato es similar a lo descrito por Calsina-Berna et. Al. donde describen que el 56% de las mujeres que acudían a servicios de atención primaria era por esta sintomatología(39). Stevans et al., en realizó un estudio en 2021 con una muestra de 5233 pacientes que acudieron a AP por dolores lumbares agudos siendo en este estudio el 58% mujeres(40). La posibilidad de que se recete y atienda más a mujeres en atención primaria puede deberse también a que la derivación hacia el médico especialista se realice menos en pacientes del sexo femenino aunque faltan estudios para determinar dicha causa.
De acuerdo con los objetivos propuestos, se realizaron contrastes entre los valores medios de las escalas de EVA dolor y alivio entre los pacientes que tomaban opiáceos y no tomaban opiáceos. Así como los valores de los pacientes con analgesia mediante AINEs, comparados con la analgesia de opiáceos. En ninguno de estos dos contrastes se encontraron diferencias significativas, esto significa que la analgesia no se está pautando en relación a lo propuesto en la escalera de analgesia de dolor de la OMS en la que dolores más intensos (más valor de EVA dolor) están relacionados con prescripción de opiáceos.
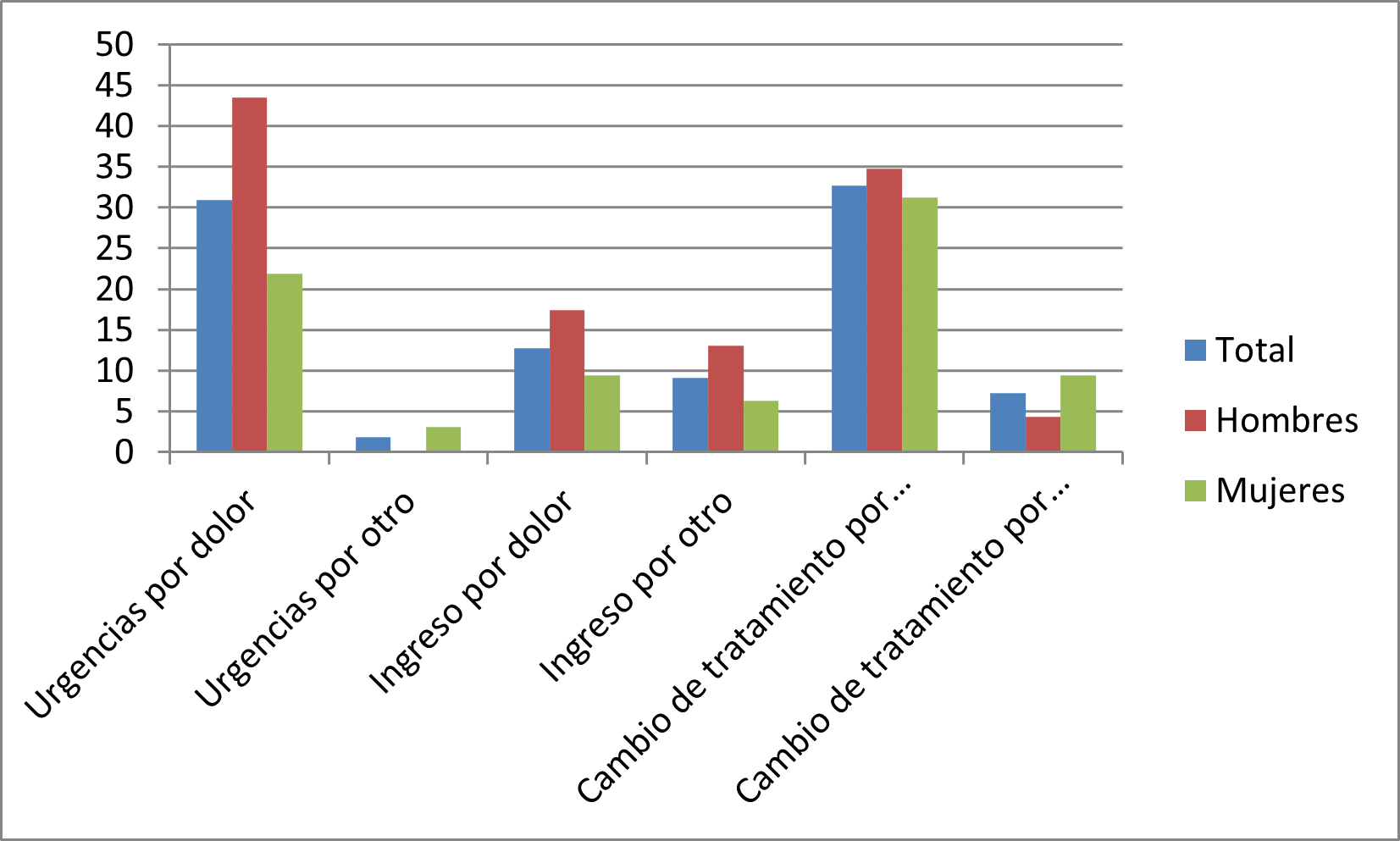
Otro dato interesante a destacar es que ellas sienten menos alivio con el tratamiento farmacológico indicado, por lo que puede ser que no se esté haciendo un correcto diagnóstico y/o indicación del grupo farmacológico adecuado. Este dato se ve contrapuesto al cambio de medicación para el dolor, en el que los datos son muy similares, siendo ligeramente inferior en el caso de las mujeres (ver gráfico 1).
Los datos en cuanto a dolor y alivio se equilibran más en los pacientes que llegan a la UDO siendo muy similares en cuanto a los dos sexos.
4.3 Variables subjetivas de calidad de vida y estado de salud
Al comparar los valores totales por grupo de EuroQol y Estado de salud se encontraron diferencias significativas (p valor 0,0096 y p valor 0,0428, respectivamente). Haciendo un análisis entre grupos considerando la variable sexo, encontramos que sólo la variable EuroQol en hombres seguía siendo diferente de una manera estadísticamente significativa (p valor 0,0267). Finalmente, cuando se analizaron estas variables intragrupo, los pacientes de la OF presentaron diferencias significativas en el valor medio de calidad de vida al contrastar los hombres y las mujeres (p valor 0,0252). Esto apunta la posibilidad de mejoras por parte del farmacéutico de OF.
Otro de los datos que se recogió en el CDR fue la evolución de su estado de salud durante el pasado año. Los datos arrojaron que respecto al total de pacientes casi el 50% afirmaba que se encontraba igual que hace 1 año mientras que el 25% de ellos se encontraban peor o igual.
Los resultados respecto al sexo masculino eran similares mientras que en el sexo femenino la tendencia era encontrarse peor con un 31% de las encuestadas.
Tabla 6. EuroQol y estado de salud global
4.4 Variables relacionadas con las comorbilidades
Al comparar los valores totales por grupo HAD ansiedad (p valor 0,0062) y HAD depresión (p valor 0,0009) se encontraron diferencias significativas entre casos, controles y pacientes de la OF. Haciendo un análisis entre grupos considerando la variable sexo, encontramos que las variables HAD ansiedad (p valor 0,0221) y HAD depresión (p valor 0,0200) seguían siendo diferentes de una manera estadísticamente significativas.
En cuanto a las dos principales comorbilidades estudiadas en este estudios, ansiedad y depresión, pese a no haber diferencias significativas, se observa como en ambas los datos son más acentuados en pacientes del sexo femenino (tabla 7) en OF. Este problema puede estar también relacionado con el incorrecto diagnóstico en servicios médicos y/o tratamiento farmacológico y relacionando con ese mayor empeoramiento del estado de salud del pasado año.
Tabla 7. HAD ansiedad y depresión
4.5 Variables relacionadas con el tratamiento y los eventos adversos
Al comparar los porcentajes de prescripción de los participantes de la oficina de farmacia (tabla 8) considerando el sexo, se vieron diferencias significativas en el grupo de los AINEs (p valor <0,0001) y relajantes musculares (p valor 0,0160), sin embargo, no se apreciaron diferencias en EVA intensidad, y alivio en este grupo. Por otro lado, en el grupo de los casos sólo hubo un patrón de prescripción diferente el grupo de los AINEs,a pesar de que la intensidad del dolor se manifestó de forma similar en este grupo. No se apreciaron diferencias significativas en el caso del grupo control.
Tabla 8. Medicación Prescrita
Como podemos comprobar en los datos recogidos en la Tabla 9, el efecto adverso más numeroso en OF fue insomnio (40%), en hombres nerviosismo y en mujeres estreñimiento. Esto fue diferente a lo descrito para el grupo de casos, siendo la reacción adversa (RA) boca seca la más frecuente con un 24%. Sí que hubo similitudes respecto al grupo control mujeres donde la RA más frecuente, fue estreñimiento con un 24% de las encuestadas. En el total del grupo esta misma RA fue la más frecuente. Estos datos están en la línea de las prescripciones típicas en estos grupos ya que el 42% de los pacientes de oficina de farmacia llevaba opiáceos e Insomnio y estreñimiento son efectos adversos típicos.
Tabla 9. Efectos adversos medicación
Las reacciones adversas manifestadas fuera de las recogidas en el CDR en los pacientes de OF fueron diarrea por parte de un paciente y dolor de espalda y piernas por parte de otro. En el grupo casos un paciente manifestó sudoración excesiva, otra acidez de boca y otro no especificó cuál era esta RA sufrida.
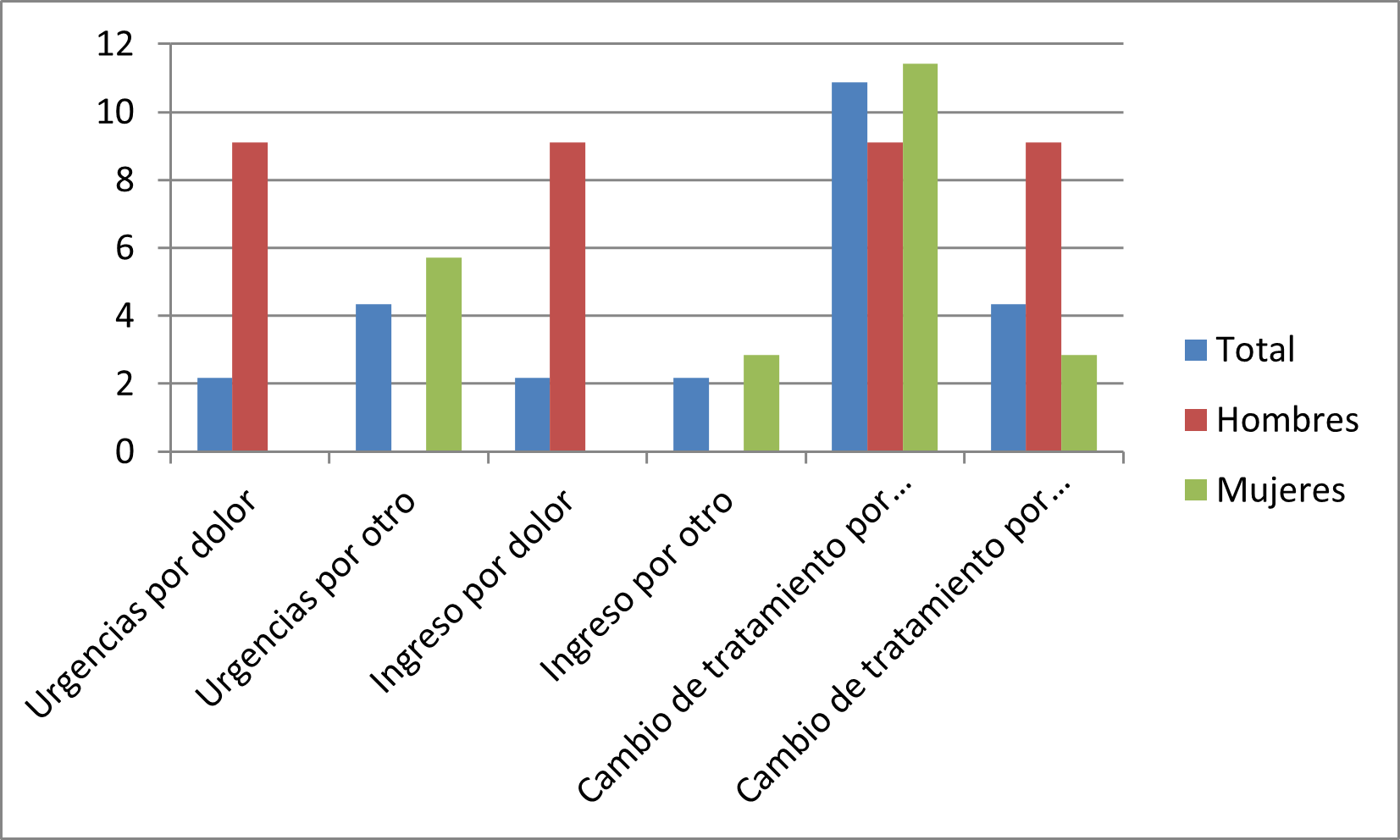
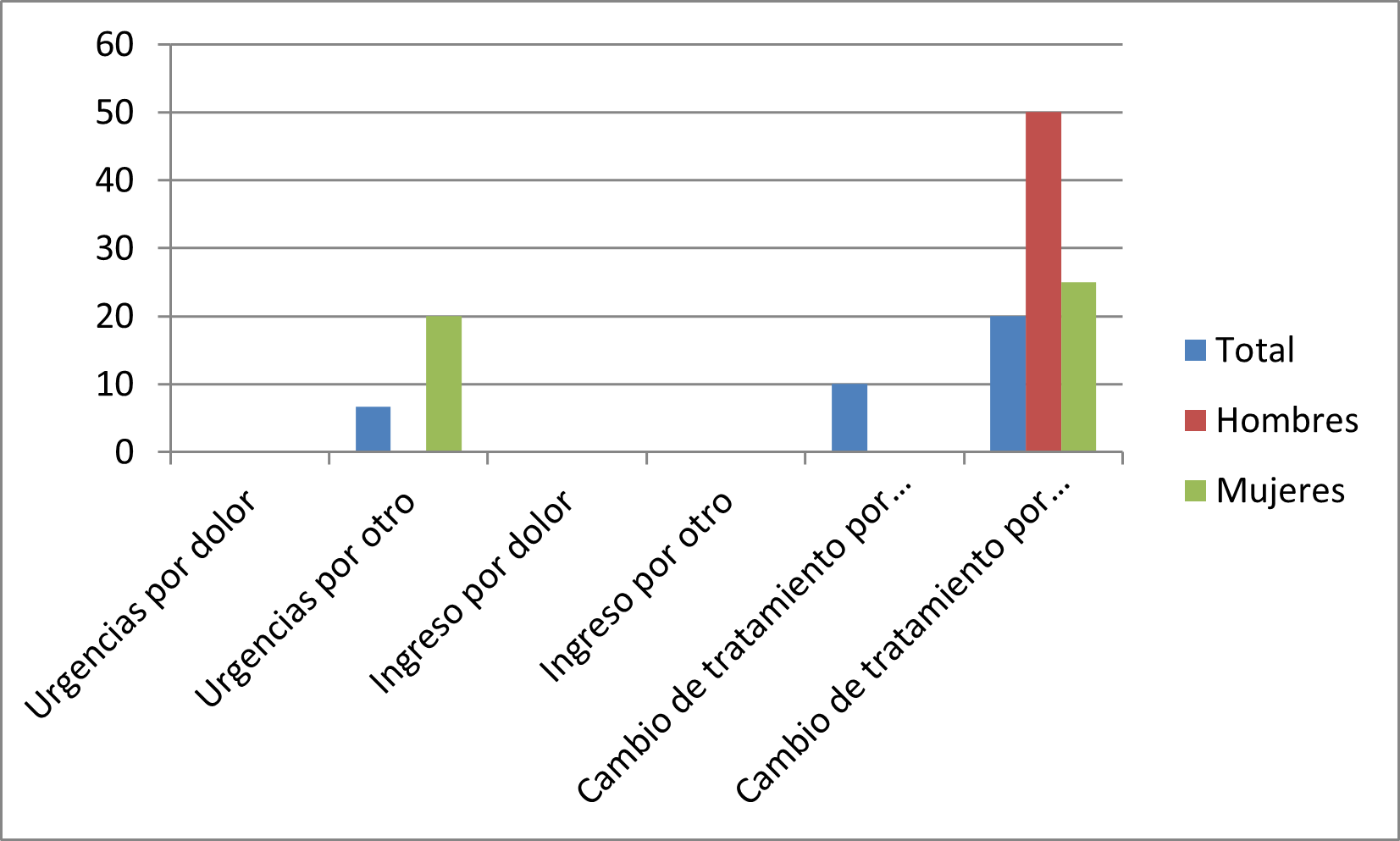
A raíz de las reacciones adversas acontecidas por el consumo de estos fármacos, se recogió cierta información relativa a las veces que acudieron los encuestados a Urgencias (tabla 2), fueron ingresados en hospitalarios (tabla 3) y/o cambio de medicación (tabla 4).
Se han realizado contrastes mediante la prueba Chi cuadrado de la frecuencia de aparición de las reacciones adversas asociadas a opioides (sequedad de boca y piel, náuseas, vómitos, estreñimiento) que además se entiende que pueden afectar al sueño. No se han visto diferencias significativas de la frecuencia de apariencia de estos eventos, en comparación con los pacientes que tomaban AINEs.
Figura 2. Asistencia sanitaria por RA. OF
Figura 3. Asistencia sanitaria por RA. HGUA Casos
Figura 4. Asistencia sanitaria por RA. HGUA Controles
4.6 Variables subjetivas de sueño
Al comparar los valores medios de la Escala de sueño Medical Outcomes Study Sleep (MOS-S) se vieron diferencias entre el valor total por grupo sin considerar el sexo en los dominios Alteración (SLPD p valor <0,0001), Ronquidos (SLPSNR p valor 0,0005), Cantidad de sueño (SLPQ p valor <0,0001), suficiente sueño (SLPA, p valor 0,0266), índice 6 (SLP6 p valor 0,0296), índice 9 (SLP9 p valor 0,0229) y PSQI total (p valor 0,0070). Al comparar los valores medios de la MOS-S se vieron diferencias entre el valor total por grupo considerando diferencias de sexo en los dominios Alteración (SLPD p valor 0,0008), Ronquidos (SLPSNR p valor 0,0045), y Cantidad de sueño (SLPQ p valor 0,0002). No hubo diferencias intragrupo en ninguno de los valores de MOS-S.
En general, como podemos ver en la tabla 10 (OF) y tabla 11 (HGUA), los valores medios en cuanto al índice SLP9 de MOS-S son para OF 66,8± 10,7, para casos 61,3± 11,6 y para controles 66,9± 11,4. El índice SLP9 se puede ver una mayor afectación al grupo OF respecto al grupo control y este a su vez ligeramente superior al grupo caso. Respecto al índice SLP6, reflejan datos muy similares. Este valor puede oscilar entre 0 y 100, siendo datos de mayor gravedad aquellos que se acerquen al rango superior. Ambos índices proporcionan una medida aplicable a la calidad general del sueño.
Si comparamos los datos con un grupo control estudiado entre 2015 y 2016 en este mismo hospital y con criterios de admisión muy similares a este estudio (11) se puede observar que los pacientes de los tres grupos son superiores en casi un tercio tanto del índice SLP6 como el SLP9(27 ± 18 y 27 ± 17, respectivamente).
También es interesante resaltar que el índice Ronquidos fue un 41% superior a los pacientes del grupo caso respecto a los otros dos grupos. Esto puede deberse a uno de las principales reacciones adversas de los fármacos opioides como es la depresión respiratoria.
Los valores medios de PSQI se encuentran también en las tablas 10 y 11. Estos son 10,6± 4,4 en OF, 12,7± 3,8 en casos y 8,8± 4,4 en controles. Según la interpretación de este índice los tres datos corresponden a la tercera categoría (rango entre 8 y 14). Estos valores se consideran elevados por lo que merecen especial atención médica y tratamiento. La principal valoración es que su sueño no es el ideal en relación con los rangos de esta escala aunque no llegan a ser un problema grave e inminente para la salud del paciente (valores superiores a 15 puntos). Al ser una puntuación superior a 5, los 3 grupos estarían clasificados como “pobres dormidores”.
Tabla 10. MOS-S y PSQI. OF
Tabla 11. MOS-S y PSQI. HGUA
Pese a no haber diferencias significativas intragrupo, se observa una tendencia en este índice es superior en pacientes de sexo femenino, sobre todo en el grupo caso. Es difícil la comparativa con el grupo caso (n=44) puesto los datos recogidos son muy inferiores respecto al grupo control (n=14). Esto se acentúa porque solo se conocía el sexo de 6 encuestados en el grupo control.
Otro dato interesante a destacar es la baja presencia de sueño óptimo en los 3 grupos. Este dato se obtiene mediante la calificación ”duración de sueño” en valores comprendidos entre 7 y 9 horas, siendo únicamente 6 los pacientes del grupo de OF (10,9%) en este rango. La comparación entre casos y controles fue de 1 único paciente del grupo caso (2,4%) y 3 (6%) del grupo control.
En la misma puesta en marcha del encuestado al paciente se encontró la larga duración que requería completar todo el cuestionario. Dicha duración suponía también un rechazo para muchas personas que acusaban la falta de tiempo para poder contestarlas. Este problema se acentuaba en situaciones en las que la OF se encontraba con un gran volumen de pacientes lo que requería una única persona con el encuestado para rellenar el CDR. Muchos fueron los problemas derivados de la duración de este mismo, siendo el tamaño muestral inferior al pronosticado en un principio del estudio.
La segunda limitación que encontramos es la dificultad para reconocer ciertos tecnicismos plasmados en el CDR. Personas de avanzada edad requerían de más ayuda para responder ciertas preguntas que carecían de significado para ellas. Un ejemplo sería el término cefalea en “síntomas tras la última consulta”.
Otro de los principales problemas encontrados es el hecho de poder implicar al encuestador en trabajos ajenos a su motivación. Las personas encargadas de hacer encuestas en las farmacias recibieron indicaciones por parte del autor para facilitar el desempeño del trabajo.
Respecto al propio CDR, algunos de los encuestados afirman cierto sesgo a la hora de responder preguntas relacionadas con su estado de salud emocional como son las preguntas del HAD. Otros encuestados prefirieron no contestar preguntas del EuroQol. A todas se les informó desde un primer momento que la encuesta estaba filtrada por código por lo que sería completamente anónimo.
5. CONCLUSIONES
En función de la intensidad de dolor declarado podemos decir que estuvo condicionada por el sexo siendo superior en mujeres ya que hubo diferencias significativas en el análisis intergrupos. Respecto al alivio percibido, y los patrones de prescripción no existieron diferencias significativas entre sexos por lo que no se cumplen los estándares analgésicos de la OMS ya que no se presentó una tasa de éxito o fracaso sustancial. Relativo a la prescripción de analgésicos, estos se hacen principalmente en AP, sobre todo en el caso de mujeres (59%). Ellas acuden más a este nivel asistencial y/o son menos derivadas a servicios especializados. La prescripción de AINE (primer escalón terapéutico) está prescrita en un 87% de los pacientes mientras que el grupo de opioides se prescribe en un 42% de casos. Pese a que las mujeres sienten una mayor intensidad de dolor, solo se les indicó en un 41% de casos opioides (segundo y tercer escalón terapéutico) frente a 43% en hombres. El insomnio fue el evento adverso más recogido en el cuestionario en un 40% de los participantes, seguido de otras reacciones típicas de opioides como son boca seca, estreñimiento etc. Al realizar contrastes entre RA asociadas a opioides que pudiesen entorpecer la práctica habitual del sueño no se encontraron diferencias significativas con relación al consumo de opioides sin analgésicos y al contrario. Tanto ansiedad como depresión fueron estudiados mediante el cuestionario HAD dando lugar a diferencias significativas entre estas dos patologías con valores altos tanto en OF como en los dos grupos del HGUA. Relativo a los pacientes estudiados en OF, las mujeres fueron más proclives que los hombres en padecer dichas comorbilidades siendo también superior la prescripción de antidepresivos y ansiolíticos (25 y 31% respectivamente de las encuestadas). Los tres grupos estudiados en esta investigación tuvieron unos resultados bastante altos respecto a trastornos en el sueño. En el test PSQI, tanto hombres como mujeres en los tres grupos superaron los 10 puntos en este test, calificándose como “malos dormidores”, haciendo especial mención al grupo casos con un 12,7± 3,8. Respecto al cuestionario MOS-S, las principales diferencias significativas estuvieron en Alteración, Ronquidos, cantidad de sueño, suficiencia de sueño e índices 6 y 9 sin considerar el sexo. Ronquidos supuso la mayor diferencia en casos respecto a controles, posiblemente una reacción adversa habitual en opioides la depresión respiratoria. No se encontraron diferencias significativas tras realizar contrastes entre valores medios en escalas de EVA dolor y alivio y entre pacientes que tomaban opioides y los que no los consumían. Tampoco se recogieron diferencias significativas en los valores de pacientes con analgésicos AINEs en comparación con pacientes con analgesia opioide. Esto quiere decir que no se recetaba adecuadamente según lo propuesto por la escalera analgésica de la OMS donde los dolores EVA más fuertes deben estar tratados con opioides suponiendo esto por lo tanto, una diferenciación en el alivio.
6. REFERENCIAS
- Dueñas M, Salazar A, Ojeda B, Fernández-Palacín F, Micó JA, Torres LM, et al. A Nationwide Study of Chronic Pain Prevalence in the General Spanish Population: Identifying Clinical Subgroups Through Cluster Analysis. Pain Med. abril de 2015;16(4):811-22.
- Torralba A, Miquel A, Darba J. Situación actual del dolor crónico en España: iniciativa «Pain Proposal». Rev Soc Esp Dolor. febrero de 2014;21(1):16-22.
- Català E, Reig E, Artés M, Aliaga L, López JS, Segú JL. Prevalence of pain in the Spanish population telephone survey in 5000 homes. Eur J Pain. abril de 2002;6(2):133-40.
- Casals M, Samper D. Epidemiología, prevalencia y calidad de vida del dolor crónico no oncológico: Estudio ITACA. Rev Soc Esp Dolor. 2004;11(5):260-9.
- Barómetro del dolor crónico en España 2022 [Internet]. Fundación Grünenthal; 2022 [citado 16 de mayo de 2023]. Disponible en: www.fundaciongrunenthal.es/fundacion/pdfs/barometro-dolor-cronico-espana-2022.pdf
- Margarit C, Roca R, Inda M del M, Muriel J, Ballester P, Flor A, et al. Sex Bias and Genotype Influence on Opioid Safety Profile in Chronic Low Back Pain. Clin J Pain. junio de 2020;36(6):420-9.
- Singh D, Agusti A, Anzueto A, Barnes PJ, Bourbeau J, Celli BR, et al. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Lung Disease: the GOLD science committee report 2019. Eur Respir J. mayo de 2019;53(5):1900164.
- Blanco-Tarrío E. Tratamiento del dolor agudo. SEMERGEN – Med Fam. agosto de 2010;36(7):392-8.
- Aguilar JL, Montes Pérez A, Benito Alcalá C, Caba Barrientos F, Margarit Ferri C. Manejo farmacológico del dolor agudo postoperatorio en España. Datos de la encuesta nacional de la Sociedad Española del Dolor (SED). Rev Soc Esp Dolor [Internet]. 2017 [citado 11 de mayo de 2023]; Disponible en: http://gestoreditorial.resed.es/DOI/PDF/ArticuloDOI_3593.pdf
- Ajo R, Segura A, Inda MM, Planelles B, Martínez L, Ferrández G, et al. Opioids Increase Sexual Dysfunction in Patients With Non-Cancer Pain. J Sex Med. septiembre de 2016;13(9):1377-86.
- Margarit C, Ballester P, Inda MDM, Roca R, Gomez L, Planelles B, et al. OPRM1 Gene Interaction with Sleep in Chronic Pain Patients Treated with Opioids. Pain Physician. enero de 2019;22(1):97-107.
- Okifuji A, Hare BD. Do sleep disorders contribute to pain sensitivity? Curr Rheumatol Rep. 2011;13:528-34.
- Marshansky S, Mayer P, Rizzo D, Baltzan M, Denis R, Lavigne GJ. Sleep, chronic pain, and opioid risk for apnea. Prog Neuropsychopharmacol Biol Psychiatry. diciembre de 2018;87:234-44.
- Finan PH, Goodin BR, Smith MT. The Association of Sleep and Pain: An Update and a Path Forward. J Pain. diciembre de 2013;14(12):1539-52.
- Smith MT, Haythornthwaite JA. How do sleep disturbance and chronic pain inter-relate? Insights from the longitudinal and cognitive-behavioral clinical trials literature. Sleep Med Rev. abril de 2004;8(2):119-32.
- O’Brien EM, Waxenberg LB, Atchison JW, Gremillion HA, Staud RM, McCrae CS, et al. Negative Mood Mediates the Effect of Poor Sleep on Pain Among Chronic Pain Patients. Clin J Pain. mayo de 2010;26(4):310-9.
- Shmagel A, Foley R, Ibrahim H. Epidemiology of Chronic Low Back Pain in US Adults: Data From the 2009-2010 National Health and Nutrition Examination Survey: Chronic Low Back Pain in US Adults. Arthritis Care Res. noviembre de 2016;68(11):1688-94.
- Bisby MA, Karin E, Scott AJ, Dudeney J, Fisher A, Gandy M, et al. Examining the psychometric properties of brief screening measures of depression and anxiety in chronic pain: The Patient Health Questionnaire 2‐item and Generalized Anxiety Disorder 2‐item. Pain Pract. abril de 2022;22(4):478-86.
- Gore M, Brandenburg NA, Dukes E, Hoffman DL, Tai KS, Stacey B. Pain Severity in Diabetic Peripheral Neuropathy is Associated with Patient Functioning, Symptom Levels of Anxiety and Depression, and Sleep. J Pain Symptom Manage. octubre de 2005;30(4):374-85.
- Truyols Taberner M, Pérez Pareja J, Medinas Amorós M, Palmer Pol A, Sesé Abad A. Aspectos psicológicos relevantes en el estudio y el tratamiento del dolor crónico. Clínica Salud. 2008;19(3):295-320.
- Vicente Herrero MT, Delgado Bueno S, Bandrés Moyá F, Ramírez Iñiguez de la Torre MV, Capdevila García L. Valoración del dolor. Revisión Comparativa de Escalas y Cuestionarios. Rev Soc Esp Dolor [Internet]. 2018 [citado 12 de marzo de 2023]; Disponible en: http://gestoreditorial.resed.es/DOI/PDF/ArticuloDOI_3632.pdf
- Gobierno de Estados Unidos. Instituto Nacional del Cancer. En: Diccionario de cáncer [Internet]. Disponible en: https://www.cancer.gov/espanol/publicaciones/diccionarios/diccionario-cancer/def/escala-visual-analogica
- Williamson A, Hoggart B. Pain: a review of three commonly used pain rating scales: Pain rating scales. J Clin Nurs. agosto de 2005;14(7):798-804.
- Ohnhaus EE, Adler R. Methodological problems in the measurement of pain: A comparison between the verbal rating scale and the visual analogue scale: Pain. diciembre de 1975;1(4):379-84.
- Herdman M, Badia X, Berra S. El EuroQol-5D: una alternativa sencilla para la medición de la calidad de vida relacionada con la salud en atención primaria. Aten Primaria. 2001;28(6):425-9.
- Yue T, Li Q, Wang R, Liu Z, Guo M, Bai F, et al. Comparison of Hospital Anxiety and Depression Scale (HADS) and Zung Self-Rating Anxiety/Depression Scale (SAS/SDS) in Evaluating Anxiety and Depression in Patients with Psoriatic Arthritis. Dermatology. 2020;236(2):170-8.
- Vallejo MA, Rivera J, Esteve-Vives J, Rodríguez-Muñoz MF. Uso del cuestionario Hospital Anxiety and Depression Scale (HADS) para evaluar la ansiedad y la depresión en pacientes con fibromialgia. Rev Psiquiatr Salud Ment. abril de 2012;5(2):107-14.
- Zigmond AS, Snaith RP. The Hospital Anxiety and Depression Scale. Acta Psychiatr Scand. junio de 1983;67(6):361-70.
- Dosis equivalente de opiáceos [Internet]. Semergen Cantabria. [citado 19 de mayo de 2023]. Disponible en: http://www.semergencantabria.org/calc/bocalc.html
- Cole JC, Dubois D, Kosinski M. Use of patient-reported sleep measures in clinical trials of pain treatment: a literature review and synthesis of current sleep measures and a conceptual model of sleep disturbance in pain. Clin Ther. enero de 2007;29(11):2580-8.
- Yarlas A, White MK, St. Pierre DG, Bjorner JB. The development and validation of a revised version of the Medical Outcomes Study Sleep Scale (MOS Sleep-R). J Patient-Rep Outcomes. diciembre de 2021;5(1):40.
- Zagalaz-Anula N, Hita-Contreras F, Martínez-Amat A, Cruz-Díaz D, Lomas-Vega R. Psychometric properties of the medical outcomes study sleep scale in Spanish postmenopausal women. Menopause. julio de 2017;24(7):824-31.
- Stewart AL, Ware JE, Ware Jr JE. Measuring functioning and well-being: the medical outcomes study approach. duke university Press; 1992.
- Mollayeva T, Thurairajah P, Burton K, Mollayeva S, Shapiro CM, Colantonio A. The Pittsburgh sleep quality index as a screening tool for sleep dysfunction in clinical and non-clinical samples: A systematic review and meta-analysis. Sleep Med Rev. febrero de 2016;25:52-73.
- Pilz LK, Keller LK, Lenssen D, Roenneberg T. Time to rethink sleep quality: PSQI scores reflect sleep quality on workdays. Sleep. 1 de mayo de 2018;41(5).
- Buysse DJ, Reynolds CF, Monk TH, Berman SR, Kupfer DJ. The Pittsburgh sleep quality index: A new instrument for psychiatric practice and research. Psychiatry Res. mayo de 1989;28(2):193-213.
- Andrews NE, Strong J, Meredith PJ, D’Arrigo RG. Association Between Physical Activity and Sleep in Adults With Chronic Pain: A Momentary, Within-Person Perspective. Phys Ther. 1 de abril de 2014;94(4):499-510.
- Fielding R, Wong WS. Prevalence of chronic pain, insomnia, and fatigue in Hong Kong. Hong Kong Med J Xianggang Yi Xue Za Zhi. agosto de 2012;18 Suppl 3:9-12.
- Calsina-Berna A, Moreno Millán N, González-Barboteo J, Solsona Díaz L, Porta Sales J. Prevalencia de dolor como motivo de consulta y su influencia en el sueño: experiencia en un centro de atención primaria. Aten Primaria. noviembre de 2011;43(11):568-75.
- Stevans JM, Delitto A, Khoja SS, Patterson CG, Smith CN, Schneider MJ, et al. Risk Factors Associated With Transition From Acute to Chronic Low Back Pain in US Patients Seeking Primary Care. JAMA Netw Open. 1 de febrero de 2021;4(2):e2037371.