1. ANTECEDENTES
1.1. El Valle de los Pedroches
Este viaje personal empieza en esta comarca norte de la provincia de Córdoba, que a modo de punta de lanza, se introduce entre las provincias de Badajoz y Ciudad Real. Viniendo desde la capital, y una vez pasada la Sierra Morena y el puerto del Calatraveño, ─al cual dio fama el marqués de Santillana─, se extiende una zona en la que abunda el granito, y está formada por 17 pueblos. Una característica importante de la historia del valle ha sido su aislamiento de la Meseta, hecho que se certificó cuando en tiempos de Carlos III se eligió Despeñaperros como el camino de la conexión de Madrid con Córdoba y Sevilla.
Debido a la presencia de grandes dehesas, el jamón ibérico de Los Pedroches es una de las 4 denominaciones de origen que tenemos en España.
1.2. Pozoblanco
Este trayecto personal comienza en el pueblo de Pozoblanco, de 18.000 habitantes, el mismo número que hace un siglo. Fundado hace 7 siglos, en el siglo XVIII la Corona lo declara capital de la comarca de Los Pedroches. Es un pueblo agricultor-ganadero, a pesar de las difíciles condiciones climáticas para estas actividades; estas dificultades han marcado impronta en el modo de ser de sus habitantes. Durante dos siglos simultaneó con una floreciente industria textil (paños y bayetas), hasta que ésta desapareció en el siglo pasado. Pozoalbense ilustre es Juan Ginés de Sepúlveda, cronista del Emperador Carlos. Pozoblanco es un pueblo de hondo espíritu cristiano; fue una suerte que hace 90 años los Salesianos de Don Bosco decidieran fundar un Colegio.
1.3. Mis Raíces
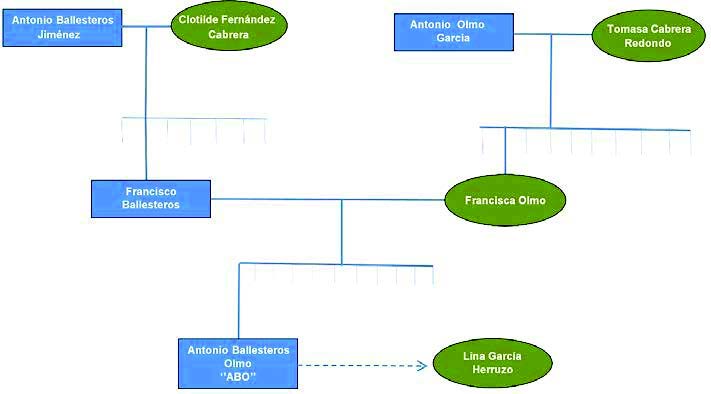
Estoy muy orgulloso de toda mi familia y de su trayectoria. Empezando por mis abuelos Ballesteros Jiménez y Fernández Cabrera, y Olmo García y Cabrera Redondo. Y después, mis padres: Francisco y Francisca. Todos con sus familias muy numerosas, y muy religiosas. Deseo agradecer el ejemplo y esfuerzo de mis padres. Mi familia supo prever la importancia de permitir a los hijos realizar estudios secundarios, que luego podrían conducir a la Universidad, y así, ─siguiendo las sugerencias y posterior ayuda de 2 dos curas salesianos, a quienes estoy muy agradecido,─ empecé el Bachillerato. Y, posteriormente, cursé Química en la Universidad de Sevilla.
Siempre recibí amor y seguridad por parte de toda mi familia. Por otra parte, tuve unos excelentes profesores. Pasando los años, a mis padres les concederían en Córdoba el Primer Premio a la Promoción Familiar, por haber posibilitado que sus once hijos, ─con la ayuda de muchísimas becas,─ alcanzaran niveles de enseñanza muy superiores a los suyos.
Con el tiempo vendría nuestro emparentamiento con la familia García Herruzo.
Figura 1. Mis raíces
2. CATALIZADORES
Ya Berzelius en 1835 describió procesos catalíticos en plantas y animales, y también usando platino metal y ácidos. La palabra catálisis viene del griego (katalysis, que sigifica disolución; acabamiento). Según la Real Academia Española “un catalizador es una sustancia que en pequeña cantidad incrementa la velocidad de una reacción química y se recupera sin cambios esenciales al final de la reacción”. Además, en los últimos años la RAE le ha añadido una nueva acepción “dicho de una persona o cosa que estimula el desarrollo de un proceso”.
Esta es la gráfica que compara una reacción no catalizada con la misma reacción catalizada (Figura 2). Al pasar de los sustratos a productos, vemos, ─ en un esquema muy simplificado,─ la representación de los cambios de energía libre de la reacción al progresar la transformación. La energía libre de Gibbs es aquella que puede transformarse en trabajo; la energía calorífica no es energía libre. La menor energía de una reacción en presencia de un catalizador hace que la transformación sea infinitamente más rápida: en algún caso se ha demostrado que es más de un trillón de veces. Pero un valor más normal podría ser alrededor de mil millones de veces más rápida (─diez elevado a nueve─) que la reacción sin catalizador.
Como farmacéutico, me voy a permitir esta tarde dispensarles unas cuantas recetas:
Receta Primera
Tradicionalmente, la catálisis se ha dividido en homogénea y heterogénea. La catálisis puede realizarse empleando bien catalizadores inorgánicos (p.ej. metales en el catalizador de un coche, o las zeolitas), bien catalizadores orgánicos. En química, casi todas las reacciones son catalíticas.
De los catalizadores orgánicos, desde hace un siglo se conoce que son un tipo de proteínas, “proteínas catalíticas” llamadas fermentos o enzimas. Sin la acción de los enzimas, no es posible la vida.
Las proteínas son polímeros lineales de aminoácidos, que se enlazan, ─con pérdida de una molécula de agua─, formando enlaces amida (peptídicos). Se cree que un mal plegamiento posterior de esta estructura primaria podría ser responsable del Alzheimer y del Parkinson.
3. MI FORMACIÓN
Estudié Química en la Universidad de Sevilla, de la que tengo buenos recuerdos de profesores y compañeros. Y de mi trabajo de laboratorio para la Tesina de Licenciatura. Al año siguiente el Jefe del Estado entregaría los premios Fin de carrera a las diversas titulaciones, en mi caso representando obviamente a Ciencias Químicas.
Pronto me di cuenta de que la parte que más me atraía era la Bioquímica; cosa que tuve ocasión de ratificar cuando marché a Granada para cursar estudios de Farmacia.
Dos años más tarde me vine a Madrid, al Instituto Rocasolano, del CSIC, para hacer el doctorado en Química. Elegí el tema “catálisis”, por lo que pasé al grupo del Prof. García Banda. Mi tema de trabajo fue continuar los estudios sobre catalizadores de sílice-alúmina empleados comúnmente a 400º Celsius en el craqueo de petróleo; mi Tesis fue dirigida por los Dres. Hermana y Banda. Conseguimos demostrar que la formación de agua en la reacción iba cambiando las propiedades ácidas del catalizador, noción que hoy es fundamental en catálisis.
Es importante que el soporte sólido sobre el que se va a inmovilizar el catalizador tenga una gran cantidad de microporos, para que así su área específica sea muy alta (centenares de m2 por gramo), lo que se traduce para la catálisis en una mayor concentración de centros activos. También es crucial la mayor o menor hidrofilia o hidrofobia del soporte.
Durante el Doctorado me di cuenta de que mi vocación era la investigación.
4. LLEGÓ EL AMOR
Estando aún con la Tesis, Lina, ─que no ha podido llegar a este acto, pero que está presente─, cambió mi vida. Ella, una esposa corcho, ha sido amante, compañera, apoyo, maestra, motor, empuje… Y es a quien dedico este parlamento. Y también a nuestros maravillosos 4 hijos, + 3 hijos políticos (por cierto, los siete, muy buenas personas). Y también a nuestros 12 nietos. Y, nuevamente a mis hermanos; y también a mi familia política. Y en todas las épocas, fundamentales los amigos, “la familia que uno elige”.
Sigamos.
El Dr. Banda ya nos decía que le gustaría iniciar una nueva línea de investigación usando catalizadores biológicos. La idea de dedicarme a investigar en biocatálisis me fascinó, por eso en el momento oportuno le comuniqué que a mí me gustaría en el futuro desarrollar esa nueva línea de catálisis biológica.
Una vez planteado este abordaje, tuve que pensar en elegir un científico de prestigio: se trataba de hacer una larga estancia postdoctoral conducente a aprender el máximo de enzimología/catálisis enzimática, con la idea de a mi vuelta montar un buen grupo de biocatálisis. Entonces, consultando el Chemical Abstracts, elegí al Prof. Christian Anfinsen, ─de un sitio de excelencia, los National Institutes of Health , junto a Washington DC─. Tuve la suerte de conseguir una de las pocas becas del Public Health Service de EE. UU., y permanecí en USA 24 fructíferos meses. Poco después de mi regreso, a Anfinsen le concederían el Premio Nobel en Química por sus investigaciones sobre un enzima. (Durante mi estancia, Cuatrecasas, Wilchek y Anfinsen publicarían el famoso método de la affinity chromatography, por el que aún podrían conceder el Nobel a Wilchek).
Y después de estos antecedentes, ahora empiezo el núcleo de lo que hoy quiero tratar:
La fundación del Departamento de Biocatálisis en el Instituto de Catálisis y Petroquímica del C.S.I.C.
Mi estrategia fue entonces ir reclutando sucesivamente a los mejores, para poner en marcha y desarrollar lo que en el futuro debería ser un prestigioso Departamento de Biocatálisis; para ello periódicamente enviaba a las diversas Facultades españolas ofertas para hacer la Tesis doctoral. A lo largo de muchos años puse el listón muy alto para integrarse en mi grupo, y así fueron llegando excelentes colaboradores especializados en Química, Farmacia, Biología, Medicina, Bioquímica o Biotecnología. Después, procuré ayudarles a todos para que hicieran estancias posdoctorales en los mejores laboratorios extranjeros.
Prueba de lo buenos que eran es que, de ellos, siete obtuvieron plaza de investigador en plantilla en el Departamento de Biocatálisis: los Dres. Víctor Fernández, José Manuel Guisán, Eitel Pastor, Cristina Otero, Francisco Plou, Miguel Alcalde, y Manuel Ferrer, quienes han formado los cimientos y estructura del Departamento. Casi todos han ascendido ya a Profesor de investigación y continúan actualmente dándole relevancia internacional y nacional. Fue decisivo el apoyo del Dr. Banda.
El resto de los que han trabajado en mi laboratorio (Figura 4) engloba también a magníficos investigadores, desde profesores de universidad e instituciones españolas y extranjeras a otros procedentes de empresas. Los que aún eran Licenciados cuando llegaron, hicieron su Doctorado. Así, hace meses estaban realizando su Tesis doctoral en nuestro Grupo: Noa Míguez, Fadia Cervantes, José Luis González Alfonso y David Fernández Polo.
Estas listas son muy incompletas, refiriéndonos al Departamento, ya que, a lo largo de los años, muchos otros investigadores fueron llegando a trabajar directamente con mis colaboradores, que ya se iban independizando científicamente. Todos han ido aumentando el potencial del Departamento, que en la actualidad cuenta con un bien ganado prestigio dentro y fuera de España, de lo que me siento orgulloso.
Hay en la actualidad un gran interés en conocer más sobre los enzimas; así no es de extrañar que, de un libro de divulgación, “La enzima prodigiosa” (2013), escrito por el doctor Shinya, un conocido cirujano colonoscopista en Estados Unidos, haya sido un best- seller, aunque su definición y concepto de los enzimas es muy raro y totalmente heterodoxo. Por el contrario, en 2016 el CSIC publicó una aproximación ortodoxa al tema “Las enzimas”, por el Dr. Francisco Plou.
Los enzimas suelen llamarse con el nombre del sustrato, seguido del sufijo “asa” (ejemplo, de lípidos: lipasas; de lactosa, lactasas…). Por ser un campo multidisciplinar, la biocatálisis requiere un gran esfuerzo del investigador; en biocatálisis tratamos de encontrar soluciones biológicas para problemas químicos, y también sintetizar productos químicos novedosos. Puede realizarse de varias maneras: Utilizar células enteras como reservorio de enzimas, las cuales se ponen en contacto con los sustratos; o bien romper el material vivo, y usar la proteína que efectuará luego la catálisis (en este segundo caso, se puede utilizar bien un extracto celular conteniendo todas las proteínas, o bien purificar nuestro enzima en cuestión). Como los enzimas son caros, para poder re-utilizarlos hay que inmovilizarlos, por ejemplo fijándolos a un soporte: así queda en fase heterogénea y se recupera fácilmente para ser usado sucesivamente durante periodos largos.
Mi primer tema de trabajo fue –continuando mis investigaciones en USA– sobre los enzimas que perteneciendo al operón de la histidina forman parte de la ruta de biosíntesis de este aminoácido en las enterobacterias Escherichia coli y Salmonella typhimurium, tanto desde el punto de vista microbiológico-genético como de la aplicación de muy diversas técnicas físicas.
El siguiente tema de investigación fue la Inmovilización y estabilización de diversas nucleasas en soportes porosos muy variados; en ellos se eliminó primeramente la difusión externa y luego se trató el papel que la difusión interna en los poros podía tener en la velocidad de reacción. El objetivo de estas investigaciones era –para poder utilizar las proteínas de organismos unicelulares para paliar el hambre en el mundo–, hidrolizar y eliminar los ácidos nucleicos para que al comerlas no provocasen la enfermedad de la gota.
El Investigador se la juega al elegir sus temas a estudiar
A título de ejemplo, me referiré a dos de los míos: 1º Hidrogenasas; 2º Lipasas. (en los que se sigue investigando en el Instituto).
1) La guerra árabe-israelí de 1973 hizo subir 4 veces el precio del petróleo. El Prof. Kaplan, de la Universidad de California, había conseguido la producción de hidrógeno acoplando in vitro hidrogenasa bacteriana y cloroplastos de espinaca: siguiendo el esquema zeta de la fotosíntesis en los dos fotosistemas de los cloroplastos, los electrones procedentes de la rotura del agua, si se desviaban in vitro con una hidrogenasa, originaban hidrógeno (en vez de producir hidratos de carbono, lo normal en la fotosíntesis). Las hidrogenasas son los enzimas necesarios para conseguir la (bio)fotólisis del agua para obtener hidrógeno, que podría ser uno de los combustibles del futuro, ya que al quemarse no se forman subproductos indeseados (sólo se forma agua). Rápidamente preparé un sabático con Kaplan, con el que aprendí a manejar hidrogenasas en condiciones de anaerobiosis total. A mi vuelta, incorporé a mi laboratorio este tema (para el que conseguí una enorme financiación por los Acuerdos de Cooperación España- EE.UU.).
Por supuesto que el abordaje biológico para la fotoproducción de hidrógeno sigue compitiendo con el abordaje químico, que utiliza catalizadores de metales nobles inmovilizados sobre óxidos semiconductores como el dióxido de titanio.
2) Lipasas. Después de estudiar la bibliografía y consultar después a colegas científicos de universidades y empresas extranjeras, elegí este grupo de enzimas –poco estudiados entonces: sólo en un grupo universitario francés, en algunos grupos universitarios en Japón y en alguna empresa europea (Unilever, UK)–, por la mala reproducibilidad de su actividad catalítica sobre sustratos insolubles en agua. Decidí trabajar con estos enzimas inmovilizados, tan interesantes para la industria. Fue un tema que posteriormente fue marcado por la Unión Europea como prioritario para ser financiado.
3) Uno de mis abordajes estrellla en biocatálisis es la modificación química: para mejorar el enzima; y/o para mejorar el sustrato, es decir, bien para preparar biocatalizadores mejores y/o más estables –como cuando la proteína se PEGuila–bien para conseguir biotransformaciones novedosas y/o más eficientes. Estos abordajes los incorporó el Dr Francisco Plou después de sus investigaciones postdoctorales. Hemos estabilizado enzimas con PEG polietilenglicol, con lo que obteníamos enzimas artificiales.
Este abordaje general de la modificación de moléculas sustrato (bien sea enzimática o químicamente) lo hemos usado en el laboratorio principalmente para la modificación enzimática (concretamente: acilación con lipasas; y glicosilación con carbohidratasas) de antioxidantes y otros compuestos. Otra modificación interesante (presente en muchos medicamentos) es la acetilación —p.ej. N-acetil salicílico, y la N-acetil cisteína. (Además, recuérdese lo importante que es el porcentaje de hemoglobina glicada, y su relevancia en la diabetes 2).
Dentro de otros temas, tenemos:
4) La evolución dirigida, con el objetivo de obtener enzimas con propiedades mejores o inéditas: los cientos de miles de años que puede tardar una mejora de un enzima en la evolución, se acelera in vitro a una escala de meses sometiendo el enzima a condiciones específicas (ej. estables en disolventes orgánicos o capaces de catalizar una reacción nueva). Esta tecnología fue incorporada por el Dr. Miguel Alcalde tras su postdoctorado en California sobre evolución molecular dirigida.
5) Metagenómica para biocatálisis. Se trata de explotar –para obtener enzimas novedosos, inéditos– aquellos hábitats extremos en temperatura, pH… como son fondos marinos, glaciares, fuentes termales, etc. Los enzimas de esta procedencia se tienen que producir por técnicas de ingeniería genética ya que sólo sabemos cultivar y crecer el 2% de todos los microorganismos existentes en el mundo. En esta línea tan novedosa se formó el Dr. Manuel Ferrer durante su largo y fructífero postdoctorado en el GBF, el Instituto Alemán de Biotecnología.
En la sucesión temporal de estos (y otros) temas de investigación propia puede verse claramente cómo ha ido avanzando la biocatálisis en más de cuarenta años, desde la inmovilización en soportes –tema básico y casi único en los años 70– a los temas hoy nueva-frontera, que incluyen, por ejemplo, la evolución dirigida, la modificación química o la metagenómica.
En los últimos años estoy muy agradecido a mis Colegas colegas Drs. Plou y Alcalde (Figura 5), con los que colaboro dentro de sus respectivos grupos de investigación.
El Dr. Plou es experto en modificación química, en mecanismos enzimáticos (estudios postdoctorales en la Universidad de Londres), en biotransformaciones, en modificación enzimática de productos naturales (p.ej. resveratrol) y en prebióticos. El Dr. Alcalde empezó trabajando en enzimas para la síntesis de ciclodextrinas y de dextranos; y hace más de 15 años hizo su postdoctorado sobre Evolución evolución dirigida con la Profª Frances Arnold, en California, Premio Nobel de Química 2018.
En el apartado de colaboraciones, fundamentales en mi trayectoria:
Colegas de la Universidad de Córdoba (Drs. Marinas y Sinisterra, y la Dra. Heras) querían iniciar investigaciones en biocatálisis, para lo que contactaron conmigo; con el mismo motivo lo hizo el Dr. Cepeda, de la Facultad de Farmacia de Vitoria. Y muchos años más tarde, la Dra. Fernández Lobato, del Centro Severo Ochoa, UAM-CSIC. Todos estos contactos, y también con los Dras. Reyes y Martínez, y los Dres. Martín-Lomas, Bernabé y Jiménez-Barbero –todos del CSIC– dieron lugar a muy buenas y largas colaboraciones durante muchos años; muchas continúan en la actualidad.
Bien, llegados a este punto, retrocedamos, ampliemos y recapitulemos:
Catálisis con proteínas catalíticas o enzimas (término que viene de “en zymos” = en la levadura). Los enzimas son sustancias que producen las levaduras y todos los seres vivos, y que actúan en todas las reacciones bioquímicas de los organismos. No se entiende la vida sin ellos. En biocatálisis se trata de investigar sobre enzimas con potencial para convertirse en catalizadores que podrán ser usados en situaciones distintas de las que se dan en el ser vivo (así: enzimas para su uso en la industria, en sanidad, en alimentación, etc.). Otro objetivo es aumentar la estabilidad de las proteínas enzimáticas en las condiciones del proceso.
Los sustratos (o reactantes) de los enzimas suelen ser moléculas mucho más pequeñas que ellas. Algunos ejemplos de tamaños moleculares pueden verse y compararse en la Figura 6.
Tenemos el tamaño de una célula humana, y el de una bacteria intestinal (Escherichia coli). Todas en el rango de los micrómetros o micras. Cuando hace siglos se inventó el microscopio, se vio que existían microbios… y nació la Microbiología. Desde hace décadas, la tecnología nos ha permitido detectar magnitudes en el rango de los nanómetros (diez elevado a menos nueve: tamaño de los virus o dimensiones de los enzimas (ej. una lipasa de la levadura Candida, y una ciclodextrina glucosil transferasa de una bacteria). Con estos tamaños estamos de lleno en la Nanotecnología, que está teniendo unos desarrollos impresionantes: Podemos pensar en los enzimas como en unas nano-máquinas (para dimensiones aún más pequeñas, como las de los enlaces, se usa la décima parte del nanómetro: el Angström).
Me referiré ahora brevemente a una serie de temas en los que también he trabajado:
6) Enzimas activos en medios no convencionales.
Antiguamente era un axioma que los enzimas eran únicamente activos en medios acuosos. Sin embargo, Klibanov, ya en los años 70s, desarrolló y demostró que los enzimas también son activos en medios orgánicos, aunque con menor eficiencia catalítica (el polaco Sym en los años 30s ya había descrito esa acción en medios orgánicos, pero no había tenido financiación para difundir sus hallazgos). Además, disponemos de muchos más medios no convencionales para que los enzimas actúen (por ejemplo, CO2 supercrítico o líquidos iónicos). Lo importante es cómo sea la actividad de agua en ellos.
7) Ácidos grasos
La margarina se fabrica por hidrogenación catalítica (con paladio como catalizador) de aceites vegetales insaturados de bajo precio; esta operación origina ácidos grasos saturados trans, que no son saludables –en la naturaleza, los enlaces dobles de los ácidos grasos insaturados son de tipo cis–. También se usa la interesterificación química.
Los ácidos grasos saturados originan colesterol LDL o no según la longitud de su cadena. El esteárico C18:0, presente en el jamón, no, porque el cuerpo humano tiene enzimas desaturasa, que lo convierten en ácido oleico C18:1, muy saludable. En cambio, sí aumentan el colesterol los ácidos grasos de cadena más corta: ácidos láurico C12:0, mirístico C14:0 y palmítico C16:0.
8) Jarabes de fructosa
Es el caso más exitoso –por su volumen total– del empleo de la biocatálisis. Se trata de producir jarabes con mucha fructosa, partiendo de hidratos de carbono (maíz, celulosa, etc.). Este proceso pudo despegar económicamente porque en el bloqueo de Cuba subió mucho el precio del azúcar de caña. y entonces aparecieron los jarabes de fructosa, que entonces ya sí eran competitivos. La producción de glucosa a partir de maíz se hacía antes en medio ácido, a altas temperaturas y presiones: ahora se hace con enzimas que rompen el glúcido, dando finalmente glucosa. El enzima más importante en el proceso es la glucosa isomerasa, que convierte la glucosa en fructosa, originando –debido a la constante de equilibrio de la reacción– una mezcla de glucosa y fructosa en cantidades similares. Se han utilizado procesos en gran escala que utilizaban, bien este enzima inmovilizado en distintos soportes, bien las células microbianas enteras.
La facilidad de dispensación de estos jarabes en bebidas, ha hecho que su uso se haya generalizado, …con lo que una botella de dos litros puede contener enormes cantidades de fructosa. Hace años que los bioquímicos llevan pidiendo mesura en el consumo del azúcar de frutas, fructosa, pues no hay experiencia de cómo se comportaría el cuerpo humano con consumos grandes de la misma y por tiempos largos. Además, no se conoce todavía el papel que puede tener en el aumento de la obesidad en muchos países.….
9) Enzimas que actúan sobre hidratos de carbono (también llamados glúcidos o sacáridos).
Hace 25 años y siguiendo los temas que periódicamente la Unión Europea iba financiando, comencé estas investigaciones con un enzima muy versátil e interesante: la ciclodextrina glucosil transferasa o CGTasa, y cuyo sustrato es almidón soluble; su producto normal es formar ciclodextrinas, una especie de donuts formados por la unión de 6 a 8 moléculas de glucosa formando un ciclo (Figura 7); Las ciclodextrinas son muy útiles para solubilizar —en su parte interna— sustancias de por sí insolubles en agua: p.ej. quitarle la cafeína al café; o quitarle moléculas tóxicas al agua contaminada.
En la Figura 8 vemos la representación de la estructura de este enzima, en la que se aprecia las hélices-alfa (en morado), las láminas beta (en azul), y los trozos de cadena al azar (en gris).
En la Figura 9 vemos, a la izquierda, una representación de todo el enzima mostrando cada enlace; se trata de una proteína monomérica, compuesta de 5 dominios. A la derecha vemos los tres aminoácidos –y su posición en la cadena– Aspártico230, Glutámico258 y Aspártico329, que quedan .
Además de enzimas como ésta que transfieren grupos glicosilo, también estudiamos enzimas hidrolasa, que hidrolizan, enlaces entre dos restos monosacárido, por ejemplo, los disacáridos sacarosa o lactosa (Figura 10). El enlace entre los monosacáridos fructosa y glucosa (caso de la sacarosa) es del tipo beta 21; y el enlace entre glucosa y galactosa (caso de la lactosa) es beta 14. Ambos son fáciles de hidrolizar por los enzimas correspondientes presentes en humanos.
Dentro de los alimentos funcionales (es decir, beneficiosos para la salud), los prebióticos (Figura 11) son hidratos de carbono cuyos enlaces glicosídicos son uniones inusuales, por lo que no pueden ser rotos (hidrolizados) por los enzimas humanos, pero sí pueden serlo por carbohidratasas de la microbiota intestinal beneficiosa, la cual crece alimentándose con los monosacáridos resultantes.
Después de intensas investigaciones sobre probióticos en los últimos 15 años, se admite hoy que existe un eje cerebro–microbioma. Se considera que la toma de prebióticos y probióticos es la panacea de la mejor salud, siendo remedios beneficiosos, por ejemplo, en biodispepsias del aparato digestivo, contra la hipertensión arterial, en el cáncer de colon, en la mejora de las defensas inmunitarias etc. La microbiota se está convirtiendo en un nuevo paradigma para mejorar nuestra salud en el futuro. Algunas publicaciones recientes señalan que una buena microbiota mejora algunas enfermedades neurodegenerativas, como el Alzheimer y la ELA. Una hipótesis reciente culpa a algunos componentes del microbioma de llegar al cerebro y originar así un tipo de esclerosis (la ELA). (En el microbioma tenemos un próximo Premio Nobel).
Receta Segunda
Además de tomar prebióticos, es importantísimo reforzarse con probióticos, sobre todo, después de tratamiento con antibióticos. Los probióticos más usados hoy día son los lactobacillus y las bifidobacterias. Lo más novedoso hoy es añadir posbióticos, es decir, metabolitos secundarios.
11) Transformaciones de antioxidantes.
Los antioxidantes son compuestos con electrones desapareados. Protegen a otros compuestos de que se oxiden: para ello, se oxidan ellos antes, actuando como reductores fuertes; de esta manera bloquean la propagación en cadena de los radicales. El principal causante del envejecimiento son los radicales oxigenados (en inglés ROS, o especies de oxígeno reactivas). (Una hipótesis mía es que la modificación química de proteínas por la reacción de Maillard entre proteínas e hidratos de carbono reductores, también interviene).
Introduciendo grupos acilo (con lipasas), o grupos glicosilo (con carbohidratasas) se consigue alterar el balance hidrófilo-lipófilo del nuevo compuesto, lo que puede redundar en que mejore su accesibilidad, su disponibilidad en los tejidos del cuerpo humano. Por ejemplo, la glicosilación del resveratrol del vino tinto.
En la obtención de medicamentos, además de utilizar las herramientas de la síntesis orgánica, deberíamos conocer y aprovechar las ventajas de la Medicina Ayurvédica oriental.
Tenemos constituido el consorcio GlicoEnzimas, colaboración con dos grupos del CSIC (Dra. Julia Sanz del Instituto Rocasolano (Madrid), y Dr. Julio Polaina del IATA (Valencia)) y uno de la Univ. Autónoma de Madrid (Dra. María Fernandez Lobato). Es como un laboratorio europeo sin paredes. El éxito se debe a que la pericia de los grupos individuales se complementa muy bien.
Agradecimientos
- A muchísimos colegas: del Instituto…; a españoles; y a extranjeros. En España he tenido la suerte de colaborar con excelentes científicos del CSIC y de otras Instituciones, incluyendo; las
- Universidades de Alcalá, Complutense, Córdoba, Murcia, País Vasco, Politécnica de Madrid, Salamanca y la UNED.
- A los Directores del Instituto de Catálisis: Dres. Banda, Krèmenic, Cortés, Soria, Pérez Pariente, Conesa y Sastre.
- Y a los sucesivos Presidentes del Consejo, y a la actual Presidenta.
He recibido financiación de:
- Public Health Service EE UU. Y acuerdos culturales España- EEUU.
- Becas (Fulbright, March, y otras)
- Proyectos:
- De la Unión Europea
- De los Ministerios respectivos
- De la Comunidad de Madrid
- De Empresas
- De Fundaciones
Hablemos ahora sobre otros temas:
12) Sostenibilidad y medio ambiente.
A finales del siglo XIX había crecido tanto la población en Londres que los transportes se hacían fundamentalmente con carros tirados por caballerías. Los excrementos constituían un verdadero problema medioambiental en las calles, por lo que se prohibió el tráfico en las calles importantes. El problema se resolvió cuando décadas más tarde, y gracias a la investigación y a la tecnología, estos transportes pasaron a ser hechos con automóviles.
Los problemas actuales del cambio climático deben resolverse con más ciencia. Pero también los humanos debemos ser hoy más austeros, más frugales: nada de consumismo salvaje.
13) Alimentación/nutrición.
En España tenemos que potenciar la dieta mediterránea, pero sin cambios que realmente la anulan. Es fundamental que en nuestra sociedad aumente el conocimiento de esta dieta, en otras palabras, que sepamos mucho más de ortonutrición en esta época que nos ha tocado vivir, que incluye comida rápida, comida muy elaborada. Hay que luchar contra el sobrepeso y la obesidad, a ello ayuda la dieta paleolítica. Hay que procurar que, en los carbohidratos consumidos, menos del 5% de las calorías sean “azúcares libres”. Lo saludable son los hidratos de carbono contenidos en alimentos naturales intactos, en los cuales la liberación de glucosa y similares es lenta (o sea, alimentos con índice glicémico bajo, entre 0 y 50%).
Ya lo dijo Hipócrates. “Que la alimentación sea tu mejor medicina, y la medicina tu alimentación”. Y en este campo los enzimas tienen mucho que decir.
Como químico, aconsejo no tener miedo a la química: a veces es necesario tomar ciertos suplementos.
14) Nuevos biocatalizadores.
Además de las tradicionales proteínas catalíticas como base de los biocatalizadores, en los últimos cuarenta años se ha demostrado actividad catalítica en otras dos clases de sustancias:
I.- En algunos ácidos nucleicos (RNAs), y II.- también anticuerpos especialmente preparados con un análogo del estado de transición de la reacción (llamados abzimas o anticuerpos catalíticos).
En ambos casos se cumplen todos los requerimientos para ser considerados como verdaderos catalizadores. A las investigaciones sobre ácidos nucleicos catalíticos (ribozimas) hace años les fue concedido el Premio Nobel; podría decirse que en la historia de la evolución primero aparecieron los ácidos nucleicos –que actuaban a la vez como portadores de información y como catalizadores. Por otra parte, se demostró que los abzimas podían acelerar reacciones, pero mucho más lentamente que los enzimas: los anticuerpos catalíticos sí eran muy eficaces en su función principal, la reacción con su hapteno.
Hace años consideré empezar a trabajar con anticuerpos catalíticos pero, después de consultar con muchos colegas, incluidos dos investigadores Premio Nobel, decidí no hacerlo.
15) El Método científico
En Ciencias (y en Letras) el hacer una Tesis doctoral siempre se ha considerado como un periodo de iniciación a la investigación, en el que se aprende la metodología de la ciencia: …Se aprende a ser crítico, a perfeccionarse en las herramientas técnicas, a tener buenos cuadernos de laboratorio. Newton y Marie Curie tenían unos cuadernos impresionantemente buenos (por cierto, también tenían un diario personal, muy detallado). Y siguiendo el ejemplo de estos científicos, les dejo mi tercera receta.
Tercera Receta
Los científicos, cuidemos los cuadernos de laboratorio. Y todos, tengamos un diario personal (Y y los mayores, además, un diario de salud/enfermedad).
Pero hoy también querría hablar –dentro del método científico y como novedad/contribución mía– de un segundo aspecto que considero que debemos aprender, que debemos cuidar los investigadores: Las herramientas mentales. Se trata de –al avanzar en nuestra carrera buscando la verdad y el saber– ser constantes, optimistas, e ir desarrollando la inteligencia emocional, el gran poder de la mente, el aprender a luchar contra el estrés, el aplicar la resiliencia etc., cualidades muy importantes siempre.
“Cuantas más personas conozcan el método científico, mejor le irá a un país”.
16) La ciencia
Los descubrimientos científicos deben ser la base de las decisiones del curso que sigue un país. EE.UU. o Reino Unido llevan siglos aplicando esta norma, de ahí la pujanza de su ciencia y la importancia que le dan a la hora de invertir en investigación. La ciencia y la sociedad no deben permitir que instituciones o asociaciones tuerzan el curso del avance de la misma, y estoy pensando en un ejemplo: cómo algunos movimientos ecologistas en el mundo pueden impedir o retrasar el empleo de los organismos genéticamente modificados (después de que los científicos creyentes y no creyentes hayamos dado el visto bueno, y se haya comprobado su inocuidad…). Es algo que ya se daba en la naturaleza, pero a un ritmo ultra- súper-lento; y en el laboratorio se acorta drásticamente la duración.
Hay veces que la ciencia inventa una nueva herramienta, o soluciona un problema que hay, pero a medio o largo plazo pueden aparecer nuevos desajustes en forma de problemas más pequeños, pero aunque importantes (por ej. emplo lo ocurrido con los plásticos, con los que -por su uso excesivo e inapropiado- nos hemos pasado de frenada). El nuevo ajuste se debe arreglar siempre con más ciencia, y los enzimas tienen mucho que aportar a solucionar este problema.
La financiación que hizo España al proyecto de Colón de encontrar un camino más corto a las Indias, es el paradigma de lo que España tiene que hacer en la actualidad.
LOS CIENTIFICOS SOLEMOS SOÑAR
CON NUESTRO TRABAJO….
Y ahora paso a la 3ª y última parte de mi disertación citando algunas investigaciones futuras en biocatálisis.
En biocatálisis tratamos de dar soluciones biológicas a problemas químicos; y también sintetizar productos químicos novedosos. Como botones de muestra podemos citar algunos:
a) La inmovilización por enlace covalente de proteínas catalíticas en un soporte, que empezó en los años 60 siendo al azar, ahora se trabaja mucho en que sea una inmovilización orientada: de esta manera en muchos casos se consigue una mejor transferencia de los electrones, o el centro activo del enzima queda mejor situado para que la catálisis sea óptima.
b) Usando como inspiración la estructura y mecanismo catalítico de enzimas, se está avanzando mucho en el diseño de materiales biomiméticos, en la fotosíntesis artificial etc., muy prometedores en temas de energía y sostenibilidad. Por cierto, y hablando de energía, como científico conocedor de cómo aciertan o no algunos pronósticos de lo que ocurrirá en qué momentos del futuro, las energías renovables serán competitivas mucho más tarde de lo que deseamos y creemos. Por tanto, durante la etapa de transición energética, España debería mantener y ampliar el porcentaje de la energía nuclear dentro de nuestro mix energético. Es lo que vienen haciendo algunos países de nuestro entorno y nivel, como Francia y otros.
c) Además de la producción de hidrógeno por el enzima hidrogenasa, también la nitrogenasa –la responsable de la fijación simbiótica de nitrógeno por los nódulos de las leguminosas– produce H2 porque un 25% de los electrones implicados se pierden reduciendo a los protones.
Un tema pendiente desde hace años es transferir genes nif desde el genoma de los rhizobium al genoma de cereales, con lo que se podría aumentar enormemente la cantidad de nitrógeno fijada por los cultivos. Apenas se avanza, porque es muy complicado.
d) En la situación actual de este cambio climático presente, se tiende a disminuir la emisión de gases de efecto invernadero (CO2 y metano, principalmente), y están cobrando cada vez más protagonismo los biocarburantes avanzados. Se está investigando mucho en la captura y transformación del CO2.
e) Con el enorme problema surgido por excesivo y mal uso de muchos polímeros (plásticos y microplásticos que no se degradan en los océanos), en el sector químico se abre un importante tema de trabajo para ser abordado con enzimas…, pero con la mente puesta en el cambio climático. Los enzimas líticos de hongos son muy eficientes como comedores/limpiadores de plástico. Además, los bioplásticos serán una buena solución para el futuro.
f) Una estrategia de los últimos años para sintetizar productos nuevos es combinar un catalizador inorgánico y otro enzimático; o emplear una cascada sucesiva de 2 o más enzimas. Y todo ello hacerlo en un único reactor.
g) Como hoy en día se está investigando cada vez más en temas de salud humana, se está descubriendo que algunos procesos cancerígenos están relacionados con el envejecimiento y la longevidad. En ambos casos, la actuación del enzima telomerasa es el paso determinante (estudios con este enzima ya recibieron el Premio Nobel hace 10 años). Recordemos que tenemos una edad cronológica, pero la importante para una persona es su edad biológica.
Y en este campo de la biotecnología roja, tengo otra receta:
Receta Cuarta
Usar “pe pe emes” (Personas por Millón). Al hablar de la prevalencia de una enfermedad por defecto de un enzima (p.ej. de cerebrosidasa en la enfermedad de Gaucher) o de otra enfermedad rara en general, se puede decir “se da en 1 persona por cada 4000”. Propongo –siempre que los números no sean ni muy pequeños ni muy grandes– hacer siempre la referencia a un millón, relación que se usa mucho en catálisis. Es decir, sería mejor decir 250 PPMs, personas por millón.
h) Los humanos hemos descubierto que, además del genoma (los cromosomas), tenemos el epigenoma: son las marcas o etiquetas que adquieren algunos genes mediante modificación química o enzimática, p.ej. la metilación de la citosina, una base pirimidínica del DNA (o también llamado ADN, según usemos las siglas en inglés o en español). Genes con grupos metilo significan genes silenciosos, que no se expresan, que no sintetizan proteínas. La ratio relación entre metil-citosina y citosina es influenciable por la alimentación y por el medio ambiente. Con el envejecimiento esta ratio va disminuyendo, lo que abre la puerta para futuras terapias que proporcionen más citosinas metiladas (por ejemplo, la alimentación con productos que sean buenos “carrriers” de grupos CH3).
i) Transfusiones de sangre de los distintos tipos 0, A, B, y AB: El tipo A tiene un azúcar inmunodominante (N-acetil-glucosamina), que se puede quitar de estos glóbulos rojos con un enzima que lo hidroliza, eliminándose; igualmente el B (el azúcar es la galactosa), que se elimina con galactosidasa. De esta forma, se está investigando para que en un futuro todos los tipos de sangre se puedan convertir en sangre tipo cero. En el microbioma se han descrito enzimas carbohidratasas muy interesantes para avanzar en este tema.
j) La técnica CRISPeR (así conocida por las siglas en inglés, son “repeticiones palindrómicas agrupadas, cortas y regularmente espaciadas”); necesita “enzimas nucleasa asociados a CRISPeR”). Es la segunda revolución en ingeniería genética. Es una poderosa técnica de inmunidad adquirida que permite editar, cortar y modificar el DNA, con lo cual las bacterias se protegen frente a los virus mediante un solo cambio de base en regiones no codificantes. Y ya sabemos que si se cambia una base en un DNA o en un RNA, esto originará cambios en sus interacciones, o en la posibilidad de que se introduzcan o no modificaciones epigenéticas.
La investigación básica en la que se basa la técnica CRISPeR fue descubierta por el científico español Francisco Mojica, de la Universidad de Alicante, quien también acuñó su nombre. Por sus investigaciones con CRISPeR, a Charpentier y Doudna le han concedido el Premio Nobel de Química 2020. Se ha postulado que esta técnica podría ser la panacea para luchar contra las enfermedades más diversas y terribles que sufrimos los humanos.
k) La mejor patente, por el enorme ingreso de divisas que generó a las arcas del Estado, es la de un enzima –son investigaciones de Margarita Salas en el CSIC–, una DNA polimerasa vírica muy resistente a las altas temperaturas. Este enzima multiplica fragmentos de DNA millones de veces por lo que presta grandes servicios en la investigación criminológica. Esta metodología (reacción PCR –por sus siglas en inglés– o Reacción en Cadena de la Polimerasa) se ha revelado fundamental en la lucha contra la pandemia por SARS-CoV-2.
En general, y como conclusión, tenemos que hacer que el coste de producir proteínas (enzimáticas o no) sea aún mucho menor que los bajos precios ya conseguidos. Y además, modificarlas o inmovilizarlas de forma que mantengan su actividad por tiempos cada vez más largos.
Miscelánea
Cuando fundé el Departamento de biocatálisis en un instituto que se dedicaba sólo a la catálisis química, era una iniciativa que no se entendía por muchos investigadores en catálisis heterogénea u homogénea. Por eso fue muy inesperada recibir en los años 90 la estancia del Manager de I+D de la Mobile Oil (EE.UU.) en el Instituto de Catálisis y Petroquímica: su empresa quería iniciar investigaciones en biocatálisis…, por lo que venía a conocer de primera mano cómo lo habíamos hecho nosotros, que habíamos empezado 20 años antes.
En los últimos años ha ido apareciendo un movimiento consistente en englobar en un mismo congreso investigaciones en catálisis heterogénea, homogénea, y biocatálisis. Y otro tanto ha ocurrido con la aparición de revistas en las que es normal se publiquen papers artículos de los tres tipos de catálisis. Ahora estamos en condiciones –gracias a las nuevas “tecnologías” y a los nuevos abordajes, como ingeniería metabolómica, biología de sistemas, resucitación de paleoenzimas, etc.– de progresar enormemente en la biocatálisis/biotecnología aplicadas a la salud humana, a la industria, la biocatálisis vegetal etc. (las que se denominan –respectivamente– biotecnología roja, biotecnología blanca, biotecnología verde…).
Para concluir, este parlamento sobre biocatálisis, reitero nuevamente mi agradecimiento a todos los que de una forma u otra me han ayudado en mi trabajo.
Y, para terminar, un deseo, Otra Receta, la Quinta.
Quinta Receta
“Que en esta vida todos seamos buenos catalizadores”.
He dicho.