La biodiversidad bacteriana en las aguas mineromedicinales y sus perfiles de resistencia a los antibióticos es un tema en desarrollo en Ecuador. El objetivo del trabajo fue conocer la microbiota bacteriana y la resistencia a los antibióticos en aguas del balneario “Termas de Santagua Chachimbiro”, Provincia de Imbabura-Ecuador. Se recolectaron 16 muestras de agua. El aislamiento de las colonias bacterianas se obtuvo por la técnica de filtración en membrana, utilizando diferentes medios de cultivos. La identificación se realizó de acuerdo con los esquemas propuestos por MacFaddin (2003), complementados con las pruebas de las galerías Microgen. El perfil de resistencia a los antibióticos se determinó por el método de difusión en placas de Kirby y Bauer (1966). Se aislaron e identificaron 85 cepas bacterianas de las cuales el 61 % resultaron Gram negativas y 39 % Gram positivas. Las especies identificadas fueron Aeromonas caviae, Aeromonas eucrenophila, Aeromonas hydróphila, Aeromonas media, Aeromonas salmonicida, Aeromonas schubertii, Bacillus subtilis, Bacillus mycoides, Bacillus spp, Burkholderia cepacia, Citrobacter freundii, Comamonas spp, Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas putida, Pseudomonas stutzeri, Ralstonia pickettii, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus lugdenensis, Staphylococcus saprophyticus, Staphylococcus spp, Staphylococcus warneri y Staphylococcus xylosus. En cuanto a la resistencia antimicrobiana la mayoría de las Gram negativas fueron resistentes a las penicilinas y cefalosporinas. Las Gram positivas a la oxacilina y penicilinas. El 66,67 % resultaron multirresistentes a más de tres antibióticos. El balneario “Termas de Santagua de Chachimbiro” presenta diversidad de especies bacteriana y la presencia de resistomas ambientales.
Palabras clave: aguas mineromedicinales; biodiversidad bacteriana; resistencia a los antibióticos; balneario “Termas de Santagua Chachimbiro
ABSTRACT:
Bacterial biodiversity in mineral medicinal waters and the antibiotic resistance profiles, is a developing topic in Ecuador. The objective of the work was to know the bacterial microbiota and its resistance profiles to antibiotics of the mineral medicinal waters of the Santagua Chachimbiro spa, located in the Province of Imbabura-Ecuador. 16 water samples were collected. The isolation of the bacterial species was carried out by the membrane filtration technique, using different types of culture media. The identification was carried out according to the schemes proposed by MacFaddin (2003), complemented with the tests of the Microgen galleries. The antibiotic resistance profile was determined by the Kirby and Bauer (1966) plate diffusion method. 85 strains were isolate of which 61% were Gram negative and 39% Gram positive. The main species identified were Aeromonas caviae, Aeromonas eucrenophila, Aeromonas hydrophila, Aeromonas media, Aeromonas salmonicida, Aeromonas schubertii, Bacillus subtilis, Bacillus mycoides, Bacillus spp, Burkholderia cepacia, Citrobacter freundii, Comamonas spp, Pseudomonas aeruginosa, Pseudomonas fluorescenscens, Pseudomonas putida, Pseudomonas stutzeri, Ralstonia pickettii, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus lugdenensis, Staphylococcus saprophyticus, Staphylococcus spp, Staphylococcus warneri and Staphylococcus xylosus. Regarding antimicrobial resistance, most of the Gram negative strains were resistant to penicillin and cephalosporins. Gram positive to oxacillin and penicillin 66,67% were multiresistant to more than three antibiotics. The “Termas de Santagua de Chachimbiro” spa presents a diversity of bacterial species and the presence of environmental resistomes.
Keywords: mineral medicinal waters; bacterial biodiversity; resistance to antibiotics; Santagua Chachimbiro Spa
1. INTRODUCCIÓN
Las aguas mineromedicinales termales son ecosistemas que se distinguen por sus extremas temperatura, pH y altas concentraciones de sales, tales como bicarbonatos, carbonatos, cloruros, nitratos, sulfatos, sulfuros, entre otras, y que además presentan propiedades medicinales y una serie de microorganismos, entre ellos bacterias (1,2).
Por otra parte, el papel del ambiente, entre ellos los ecosistemas acuáticos, en la diseminación de las bacterias resistentes a los antibióticos es un hecho establecido desde hace varias décadas (3,4). Se ha observado que los ecosistemas acuáticos pueden albergar una gran variedad de bacterias autóctonas y alóctonas portadoras de genes de resistencia a diversos antimicrobiano, lo cual ha recibido el nombre de resistomas ambientales (4,5,6).
Conocer la composición y características de la microbiota bacteriana presente en las aguas mineromedicinales es importante, no solo por sus implicaciones ecológicas en relación a su función, nicho y biodiversidad, sino también porque las mismas pueden tener repercusiones en la salud de las personas, ello desde dos puntos de vistas, por un lado, la microbiota bacteriana pueden estar conformada por bacterias patógenas o oportunistas, así como bacterias resistentes y multirresistentes a los antibioticos que pueden causar infecciones y problemas de resistencia a los tratamientos entre los usuarios de estas aguas, y por el otro lado, también puede contener bacterias beneficiosas para la salud o que produzcan metabolitos con propiedades medicinales importantes (7).
En Latinoamérica, son escasos los estudios microbiológicos de las aguas mineromedicinales, aunque se han realizado algunos donde se ha investigado la microbiota y sus características (8).
En Ecuador, las investigaciones que se han venido realizando en los últimos años han tenido como objetivo conocer la biodiversidad y las principales características biológicas de la microbiota de las aguas mineromedicinales, entre ellas los perfiles de resistencia y multirresistencia a los antibióticos (2,5,9), entendiendo que es importante considerar a la salud desde un punto de vista más holístico, tal y como lo sugiere las aproximaciones de “Una Salud“ (One Health), propiciada por la Organización Mundial de la Salud (10,11).
2. MATERIALES Y MÉTODOS
2.1. Sitios de muestreos
El sitio donde se realizó la investigación fue el balneario de aguas mineromedicinales “Termas Santagua de Chachimbiro” ubicadas en el suroeste de la parroquia Tumbabiro, en el cantón Urcuqui, provincia Imbabura, en la Cordillera Occidental Andina ecuatoriana (Figura 1) a una altitud de 2672 m.s.n.m. y con una temperatura ambiente que varía entre los 16 y 22 °C. Las aguas mineromedicinales de Chachimbiro en el complejo Santagua, provienen de un acuífero hidrotermal profundo. El agua termal es de tipo clorurada sódica e hipertermal ya que la temperatura media del agua es de 55 °C (12).
Figura 1. Ubicación geográfica del Balneario “Santagua de Chachimbiro. Imbabura. Ecuador (Google Map, 2023).
2.2. Muestras
En el balneario de aguas mineromedicinales “Termas de Santagua de Chachimbiro” los puntos de la toma de muestra fueron cuatro. El primero, fue en el punto de emergencia del agua. El segundo, en el tanque de almacenamiento. El tercer y cuarto punto fueron del agua de las piscinas. En todos los casos se tomó un volumen de 1 litro de muestras de agua, por duplicado en cada ocasión de manera aseptica.
Se realizaron 4 muestreos en cada uno de los sitios antes señalados durante un periodo de cuatro meses en el año 2022 y 2023. En cada ocasión y en cada uno de los sitios de muestreo, se tomaron 3 muestras de agua de 1 litro, recogidas en recipientes estériles, los cuales se trasladaron a temperatura ambiente y en la oscuridad al laboratorio, realizándose los análisis microbiológicos antes de las 48 horas.
2.3. Medios de cultivo y reactivos
Los medios de cultivo utilizados se prepararon a partir de las formas deshidratadas suministradas por las casas comerciales o mezclando los constituyentes del medio, de acuerdo con la formula correspondiente. Se reconstituyeron con agua destilada y posteriormente se esterilizaron en autoclave 120 °C durante 20 minutos a 15 PSI de presión.
3. MÉTODOS
3.1.Siembra y aislamiento de bacterias heterótrofas viables
La siembra y aislamiento de bacterias heterótrofas viables se realizó tanto, por la técnica de filtración por membrana de 0,45 mm de poro y 0,45 mm de diámetro, así como por la técnica de dilución en placa (13). Se utilizaron los medios, agar almidón ampicilina, agar Baird Parker, agar cetrimide, agar eosina azul de metileno, agar MacConkey, agar manitol salado, agar R2A, y placas Compact Dry, incubando en todos los casos a 30 °C durante 2 a 5 días. El volumen de muestra de agua filtrada fue de 100 mL y el volumen utilizado en el caso de la dilución en placa fue de 1 mL.
Los resultados se expresaron como medias aritméticas de las unidades formadoras de colonias por mililitro (ufc/mL). Las colonias más representativas y con morfología diferente se aislaron en agar soya tripticasa para su posterior identificación.
3.2. Identificación de bacterias heterótrofas viables
Las colonias aisladas de bacterias se identificaron por características morfológicas, fisiológicas y bioquímicas según lo indicado por MacFaddin (14), complementadas con las pruebas bioquímicas contenidas en los kit de identificación bacteriana de las galerías Microgen.
Entre las pruebas realizadas estuvieron: Tinción de Gram, morfología de la colonia y producción de pigmento, producción de oxidasa, producción de la catalasa, oxidación-fermentación de la glucosa, observación de la movilidad, crecimiento en medio Kligler, producción de indol, producción de acetil-metil carbinol (Voges-Proskauer), prueba del rojo de metilo, utilización del citrato, producción de ureasa, desaminación de la fenilalanina, reducción de nitratos, producción de gas de la lactosa, hidrólisis de la esculina, crecimiento en agar MacConkey, producción de pigmentos, crecimiento a 42° C, observación de la morfología y posición de la espora, hidrólisis del almidón, hidrólisis de la gelatina y crecimiento en agar sangre (14).
3.3. Perfiles de resistencia a los antibióticos
La susceptibilidad a los antibióticos fue determinada a cada una de las cepas bacterianas identificadas, a través del método de difusión en discos de Kirby-Bauer (15). Se utilizaron como cepa control, la cepa ATCC 25922 de Escherichia coli y la cepa ATCC 25923 de Staphylococcus aureus. Los antibióticos se seleccionaron de acuerdo con la especie bacteriana analizada y en base a lo indicado en el manual del CLSI (16). Se chequearon los siguientes antibióticos: amoxicilina (AMX; 10 mg), amoxicilina/ácido clavulánico (AMC; 30 mg), ampicilina (AMP; 30 mg) aztreonam (ATM; 30 mg), cefalotina (CEF; 30 mg), ceftazidima (CAZ; 30 mg), cefepima (CEP; 30 mg), ciprofloxacina (CIP; 5 mg) eritromicina (ERY; 15 mg), gentamicina (GEN; 10 mg), imipenem (IPM; 10 mg), Oxacilina (OXA; 1 mg), Penicilina (PEN; 10 U), tetraciclina (TET; 30 mg), tobramicina (TOB; 10 µg) y trimetoprim/sulfametoxazol (SxT; 25 mg).
Para la interpretación de los resultados de los antibiogramas se utilizó el manual del CLSI (16).
4. Resultados y discusión
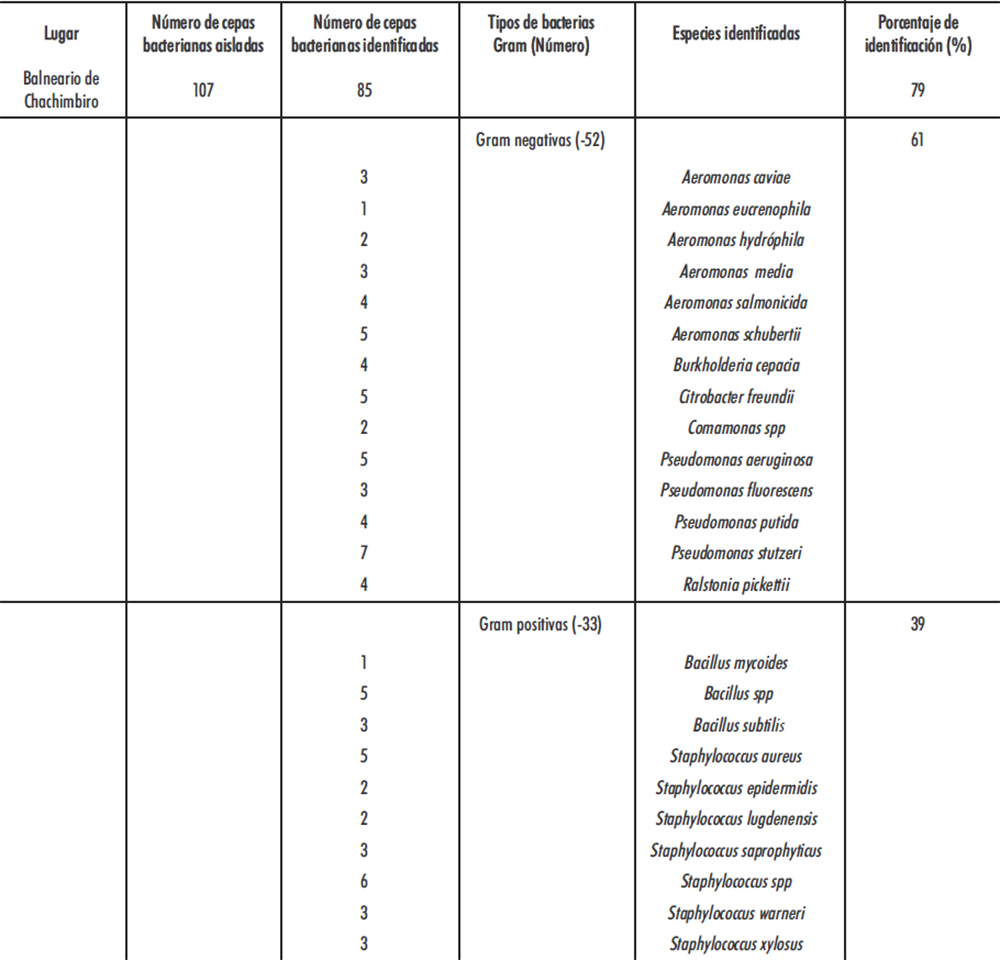
Los resultados obtenidos en la identificación de las colonias bacterianas aisladas de las muestras de aguas mineromedicinales del balneario “Santagua de Chachimbiro”, se resumen en la tabla 1.
A partir de las muestras de agua termal recolectadas en el balneario de aguas mineromedicinales “Santagua de Chachimbiro”, se logró aislar un total de 107 colonias de bacterias, de las cuales 85 (79 %) fueron identificadas, correspondiendo 52 (61 %) a bacterias Gram negativas y 33 (39 %) a bacterias Gram positivas (Ver tabla 1).
Las bacterias identificadas pertenecen a la clase de las proteobacterias pertenecientes a 21 especies de los géneros Aeromonas, Burkholderia, Citrobacter, Comamonas, Pseudomonas, Ralstonia, Bacillus y Staphylococcus (Ver tabla 1).
El mayor número de especies bacterianas identificadas fue del género Aeromonas y del género Staphylococcus, seguido de los géneros, Pseudomonas y Bacillus (Ver tabla 1).
Tabla 1. Especies de bacterias identificadas en el agua mineromedicinales del balneario de Chachimbiro, ubicada en la Provincia de Imbabura Ecuador
Del análisis de los resultados que se detallan en la tabla 1, se puede señalar que existe una gran diversidad de especies bacterianas en el balneario investigado, principalmente de los géneros Aeromonas, Bacillus, Pseudomonas y Staphylococcus.
En estudios realizados sobre la población microbiana de las aguas mineromedicinales se ha encontrado que las bacterias Gram negativas representan un alto porcentaje dentro de la microbiota de estos ecosistemas (17,18), resultado similar al obtenido en el presente trabajo, donde la población de bacterias Gram negativas aisladas es significativamente mayor al de las bacterias Gram positivas.
Se ha señalado que la microbiota bacteriana de cada manantial de agua mineromedicinal es específica y se corresponde con las características fisicoquímicas y químicas propias de cada manantial de agua mineromedicinal, razón por la cual los resultados obtenidos son diferentes, en relación con el número, tipos de géneros y especies encontradas por otros autores en aguas termales del Ecuador y otras partes del mundo (8).
La mayor diversidad de especies presentes en el agua del balneario de aguas mineromedicinales “Santagua de Chachimbiro”, se encontró dentro de los géneros Aeromonas y Staphylococcus, bacterias Gram negativas y Gram positivas muy ubicuas en la naturaleza sobre todo en ecosistemas acuáticos (7,19).
Diferentes especies del género Aeromonas se han aislado en una gran variedad de ecosistemas acuáticos, entre ellos los manantiales de aguas mineromedicinales, en varias partes del mundo, ya que se ha indicado pueden vivir en ecosistemas con bajas concentraciones de substratos (7,18,20). De igual forma, en trabajos realizados en balnearios de aguas mineromedicinales de España se ha puesto en evidencia la presencia de especies de Aeromonas en los manantiales de aguas mineromedicinales (21).
Las especies del género Aeromonas son capaces de causar enfermedades en diferentes especies de animales, incluidos los humanos, siendo en estos últimos, responsables de infecciones intestinales y extra intestinales tales como gastroenteritis, bacteriemia, infecciones de piel y tejidos blandos y sepsis con curso letal. La infección ocurre a menudo después del contacto o consumo de aguas o alimentos contaminados lo que aumenta el riesgo para la salud humana. Por estas razones, algunos países han establecido normas para detectar Aeromonas spp. en aguas (22).
En varias partes del mundo, así como en Ecuador se han realizado estudios que han puesto en evidencia la presencia de especies de Aeromonas en ecosistemas acuáticos de manantiales mineromedicinales termales (8,18,21). En este sentido, los resultados del presente trabajo son similares respecto a la presencia de especies de este género en las aguas estudiadas, aunque se difiere en el aspecto de las especies identificadas y sus porcentajes de aislamientos.
En la mayoría de los estudios realizados en ecosistemas acuáticos (8,21), las especies prevalente han sido Aeromonas hydrophila y Aeromonas veronii, resultados diferentes a los obtenidos en la presente investigación donde la especie con mayor prevalencia ha sido Aeromonas schubertii.
El segundo género con mayor número de especies aisladas e identificadas fue Staphylococcus, cuyos resultados se resumen en la tabla 1.
Las bacterias del género Staphylococcus son células Gram positivas capaces de crecer en altas concentraciones de sales. La mayoría de los miembros de las especies de Staphylococcus pueden sobrevivir en condiciones desfavorables. Son capaces de tolerar un amplio rango de temperaturas de 7 a 40 °C y baja actividad de agua, razón por la cual se encuentran ampliamente distribuidos y persisten en el medio ambiente, sobre todo ecosistemas como las aguas termales (23).
Varias especies del género Staphylococcus son considerados patógenos de animales y humanos en donde pueden causar diversos tipos de infecciones y toxiinfecciones. La infección ocurre a menudo después del contacto con superficies contaminadas o por el consumo de alimentos y aguas contaminadas (23).
El agua de los manantiales mineromedicinales contiene, en general, un número bajo de cocos Gram positivos probablemente provenientes del suelo, aire o de las personas que utilizan estos balnearios. Además, muchas especies pueden vivir en concentraciones más o menos elevadas de cloruro sódico, lo que hace posibles que se encuentren en el manantial estudiado, resultados similar a los obtenidos por otros investigadores en varias partes del mundo y en Ecuador (8,17,18,21).
El tercer género con un mayor número de especies aisladas fue Pseudomonas, pudiéndose identificar las especies, Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas putida y Pseudomonas stutzeri (Ver tabla 1).
Uno de los géneros que se han detectado con mayor frecuencia en las aguas mineromedicinales de diferentes partes del mundo han sido Pseudomonas. La presencia de diversas especie de este género bacteriano en ecosistemas oligotróficos como las aguas mineromedicinales es posible gracias a la amplia capacidad enzimática y metabólica que exhiben estas bacterias, propiedades que le permiten sobrevivir y desarrollarse, así como cumplir diversas funciones ecológicas en estos ecosistemas oligotróficos, en este sentido los resultados obtenidos son similares a los obtenidos por otros investigadores (18, 21,24,25).
Las especies de Pseudomonas incluyen bacterias quimiorganotrofas y oligotróficas que pueden vivir en ambientes como las aguas mineromedicinales termales con altos contenidos de sales. Por otra parte, estas bacterias requieren muy poca cantidad de carbono por lo que pueden crecer a bajas concentraciones de carbono orgánico por litro. Los requerimientos de nitrógeno también son mínimos, siendo por ello oligonitrofílicas y además pueden utilizar hidrógeno o CO2 como fuente de energía (7).
En la presente investigación también fue posible aislar e identificar especies del género Bacillus en el agua mineromedicinal del balneario “Termas de Santagua de Chachimbiro”, los resultados se expresan en la tabla 1.
Las especies de bacilos Gram positivos se han encontrado en una baja diversidad y en un número escaso. Se ha señalado que en los manantiales mesotermales existe un predominio de los bacilos Gram negativos y los cocos Gram positivos, y en este sentido, los resultados de este trabajo reflejan ese comportamiento (17).
El género Bacillus ha sido aislado en manantiales mineromedicinales de diversas partes del mundo y del Ecuador (8,18,26).
Las especies bacterianas del género Bacillus, provienen principalmente del suelo de donde pasan al agua, en el caso de las aguas mineromedicinales se ha observado que son más comunes en aguas hipertermales, aunque crecen también en aguas mesotermales (21).
En un menor número y proporción, también se aislaron e identificaron en el agua mineromedicinal del balneario de “Termas de Santagua de Chachimbiro”, las especies bacterianas de Burkholderia cepacia, Comamonas spp, Citrobacter freundii y Ralstonia pickettii (Ver tabla 1).
El género Citrobacter incluye bacterias Gram negativas pertenecientes a la familia de las Enterobacteriaceae, de amplia distribución en ambientes acuáticos (19).
Cepas de las especies Burkholderia cepacia, Citrobacter freundii, Comamonas spp y Ralstonia pickettii se han aislados en aguas de manantiales mineromedicinales de diferentes partes del mundo, y son especies que poseen una variedad de enzimas que le permiten adaptarse a las condiciones que se encuentran en la mayoría de aguas mineromedicinales, lo cual las hace sean parte de la microbiota autóctona de estos ecosistemas, como se observa en el presente trabajo (18,21).
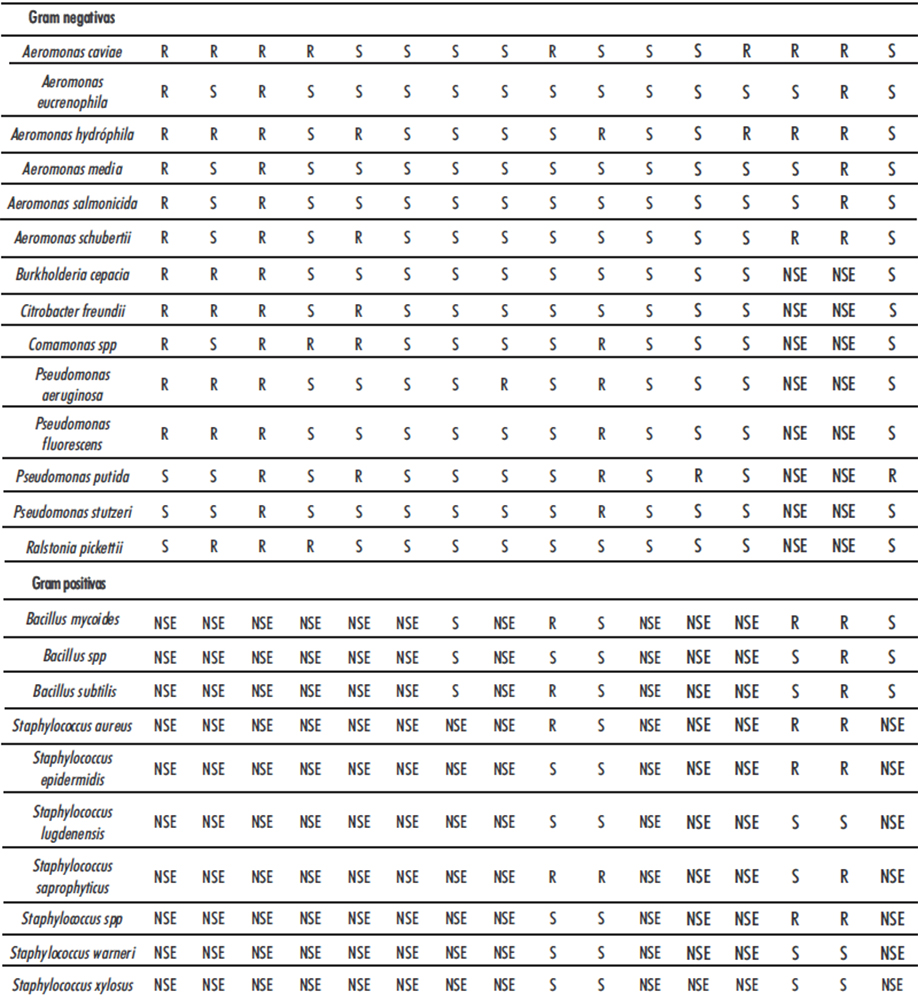
En lo que respecta a los perfiles de resistencia y multiresistencias a los antibióticos de las especies bacterianas identificadas, en la tabla 2 se resumen los resultados obtenidos.
En la investigación se observaron diferentes patrones de resistencia/sensibilidad dentro de las diferentes especies Gram negativas, aunque resalta la multirresistencia de las especies Aeromonas caviae y Aeromonas hydróphila, resistentes a 8 antibióticos, Aeromonas schubertii, Comamonas spp y Pseudomonas aeruginosa, resistentes a 5 antibióticos, así como la mayor resistencia por parte de las bacterias Gram negativas a los antibióticos amoxicilina, amoxicilina/ácido clavulánico, ampicilina y penicilina (Ver tabla 2).
En relación con las bacterias Gram positivas, de igual forma se observo diferentes patrones de resistencia/sensibilidad a los antibióticos ensayados, desatacando la multirresistencia a 3 antibióticos en las especies Bacillus mycoides, Staphylococcus aureus y Staphylococcus saprophyticus (Ver tabla 2).
Tabla 2. Perfiles de resistencia a los antibióticos de las especies bacterianas aisladas en el agua mineromedicinales del balneario de Chachimbiro, ubicada en la Provincia de Imbabura Ecuador.
El desarrollo y la propagación de la resistencia a los antibióticos entre las bacterias se considera una amenaza universal para la salud humana, animal y ambiental. Numerosos estudios han demostrado la importancia del agua y la tierra en el ciclo de la resistencia a los antibióticos en la naturaleza, ya sea porque los mecanismos de resistencia a los antibióticos pueden originarse en bacterias ambientales o porque las bacterias comensales y patógenos humanos y animales pueden contaminar el medio ambiente y de esta manera diseminar los genes de resistencia (3,10).
Los perfiles de resistencia a los antibióticos indicados en la Tabla 2, señalan que las especies de Aeromonas presentaron los perfiles típicos de susceptibilidad a los antibióticos para este género (22), aunque los perfiles de resistencia variaron entre las especies, resultando las especies Aeromonas caviae y Aeromonas hydróphila resistentes a 8 antibióticos (Ver tabla 2).
La resistencia a diversos grupos de antibióticos es una de las características resaltante de las especies de Aeromonas. Se han descrito altas tasas de resistencia contra penicilinas y cefalosporinas de primera generación y están asociadas con la producción de betalactamasas codificadas cromosómicamente. También, los genes cphA/imiS metalo-beta-lactamasa y tet, han sido implicados en la resistencia a los carbapenemes y las tetraciclinas, resultados semejantes a los obtenidos en el presente trabajo (22).
Recientemente se ha señalado que las especies del género Aeromonas se encuentra en la interfaz de lo que se ha denominado “One Health”, concepto que integra la salud ambiental, animal y humana bajo una misma premisa y representa una prueba solida de este enfoque sanitario. Los miembros del género Aeromonas no solo son bacterias ambientales ubicuas, capaces de colonizar rápidamente y causar infecciones oportunistas en humanos y animales, sino que también son capaces de promover el intercambios de genes de resistencia a los antibióticos en los ambientes naturales, tales como los ecosistemas acuáticos (27).
Otro de los géneros con perfiles de resistencia significativos fue Pseudomonas, en especial la especie Pseudomonas aeruginosa, la cual observo el mayor perfil de resistencias a los antimicrobiano dentro de este género (Ver tabla 2).
La cepa de Pseudomonas aeruginosa aislada en el agua del balneario mineromedicinal “Termas de Santagua de Chachimbiro” solo resulto sensibles a los antibióticos aztreonam, cefalotina, ceftazidime, ciprofloxacina, eritromicina, imipenem, tetraciclina, trimetroprim/sulfametoxazol y tobramicina. Por otra parte, la cepa de Pseudomonas aeruginosa fue resistente a 5 antibióticos (Ver tabla 2).
La presencia de cepas de Pseudomonas aeruginosa resistentes y multirresistentes a una variedad de antibióticos, en diferentes tipos de ecosistemas acuáticos, ha sido indicado por otros investigadores (9,25).
Diversos autores han demostrado la presencia de cepas bacterianas resistentes y multirresistentes a los antibióticos en las aguas mineromedicinales y minerales naturales, destacando entre ellas los miembros del género Pseudomonas (8,9), lo que es de gran interés desde el punto de vista ecológico y evolutivo, dado a que se ha postulado que estos ecosistemas pudieran ser un reservorio de resistomas ambientales. De igual manera, su presencia tiene un interés sanitario, dado a que las agua mineromedicinales son utilizadas por personas enfermas o con su sistema inmunológico comprometidos pudiendo ello ser un factor de predisposición para infecciones resistente a los tratamientos de estas personas.
Entre los microorganismos Gram negativos, con amplia distribución en el ambiente, se encuentran las especies de Pseudomonas. Estas especies han demostrado poseer la capacidad de adaptarse rápidamente a condiciones desfavorables tales como altas concentraciones de sales, alta radiaciones UV, oligotrofias, valores extremos en el pH y la temperatura, además a la presión ejercida por la presencia de diversos tipos de microorganismos productores de sustancias antimicrobianas, adquiriendo en este último caso, determinantes de resistencia que permite inactivarlos, alterar el sitio blanco de acción de los antibióticos, modificar su pared celular o sobre expresar sistemas de eflujo (9,28). En especial y desde hace algunos años, el surgimiento de cepas resistentes de Pseudomonas a los ß-lactámicos por producción de ß-lactamasas de espectro extendido (BLEE) y luego de carbapenemasas serino y metalo-ß-lactamasas, MBL, tanto en aislamientos de origen humano, veterinario y ambiental, ha dado como resultado una alerta mundial acerca del grave problema que representa su difusión, así como la necesidad de la búsqueda de reservorios humanos, animales y ambientales de estas resistencias (28).
Los perfiles de resistencia/sensibilidad a los antibióticos también se les realizo a las especies de bacterias Gram positivas aisladas (Ver tabla 2)
Los perfiles realizados a las cepas de Bacillus identificadas, indican resistencias al antibiótico penicilina de todas las cepas analizadas y multirresistencia de la cepa de la especie Bacillus mycoides a los antibióticos eritromicina, oxacilina y penicilina (Ver tabla 2).
Todas las cepas de Bacillus analizadas resultaron sensibles a los antibiótico ciprofloxacina, gentamicina y tobramicina (Ver tabla 2).
Los resultados obtenidos en la presente investigación son similares con el estudio llevado a cabo por Samanta y colaboradores en el año 2012 (29), donde las cepas evaluadas fueron resistentes a kanamicina, ampicilina, eritromicina y meticilina.
Estudios han demostrado la presencia de diferentes tipos de cepas de Bacillus, resistentes y multirresistentes a los antibióticos en ecosistemas acuáticos de diferentes partes del mundo, incluidos Ecuador (5,29), con resultados similares a los obtenidos en el presente trabajo y alertan de la necesidad de realizar una vigilancia epidemiológica que incluya los diversos tipos de ecosistemas acuáticos, ya que el agua de ellos es utilizada por una gran parte de la población de diferentes maneras.
En referencia a las especies de Staphylococcus aisladas e identificadas de las muestras de agua mineromedicinal, las mismas mostraron patrones de resistencia/sensibilidad diferentes, aunque se observó una prevalencia de resistencia a los antibióticos oxacilina y penicilina. Las mayores sensibilidades se observaron con los antibióticos gentamicina y eritromicina (Ver tabla 2).
Es importante indicar que son muy escasos los trabajos donde se determinen los patrones de sensibilidad/resistencia de especies de Staphylococcus aisladas de aguas mineromedicinales, sin embargo, la relevancia epidemiológica de las resistencia de estas bacteria a un gran número de antibióticos, tanto en la parte clínica como veterinaria, hace necesario que se incluyan en los estudios microbiológicos de las aguas mineromedicinales, sobre todo entendiendo que muchas de estas aguas se utilizan parar tratar distintos tipos de patologías de la piel, en donde se encuentran implicadas varias especies de Staphylococcus.
Por otra parte, se debe tener en cuenta al tratar de explicar la presencia de distintas especies de bacterias resistentes y multiresistentes a diversos tipos de antibióticos en el agua de los manantiales termales mineromedicinales, que en base a estudios realizados en los últimos años en diferentes tipos de ecosistemas acuáticos, se ha dejado al descubierto que en estos ambientes existe una diversidad de microorganismos con resistencias naturales a los antibióticos que han sobrevivido y se han adaptado a las condiciones extremas reinantes en esos ambientes, constituyendo un reservorio natural de bacterias y de genes asociados con la resistencia a los antibióticos denominados resistomas ambientales, los cuales han sido poco estudiados y que colocan el problema de la resistencia a los antibióticos en un contexto más amplio, en donde se debe tener en cuenta la parte ambiental, ecológica y evolutiva, además del sanitario (5,30).
Es decir, mucho antes de que surgiera la era de los antibióticos, las comunidades bacterianas naturales han interactuado con los microorganismos productores de antibióticos y desarrollados mecanismos de resistencia que le han permitido su adaptación y proliferación en distintos ambientes acuáticos y terrestres (30).
Los resultados obtenidos en la presente investigación pueden reflejar la existencia de diversos tipos de presiones selectivas en los ecosistemas investigados que puedan haber influido para el surgimiento de mecanismos de resistencia a los antibióticos, entre ellas la presencia de microorganismos productores de antimicrobianos, altas concentraciones de diversos tipos de metales y sales en las aguas mineromedicinales, así como a la presencia de especies de bacterias patógenas proveniente de fuentes externas productos del uso de estas aguas por un gran volumen de personas.
5. CONCLUSIONES
Se evidencia que en el agua mineromedicinal del balneario “Termas de Santagua de Chachimbiro”. están presentes una gran variedad de especies de bacterias
Los resultados obtenidos en los perfiles de resistencia a los antibióticos de las distintas especies encontradas indican la presencia de especies resistentes y multiresistentes a una variedad de antimicrobianos, lo que evidencia un posible riesgo para que estas especies bacterianas intervengan en la diseminación de los genes de resistencias a los antibióticos en el ambiente y su posible papel en el establecimiento de resistomas ambientales en los ecosistemas acuáticos como los balnearios de aguas mineromedicinales.
Este trabajo señala la necesidad de estudiar y comprender la importancia de las aguas minerales naturales, como lo son las aguas mineromedicinales de uso público, como reservorios de la diversidad bacteriana y de resistomas ambientales.
Conflicto de intereses
Los autores dejan constancias que no existe ningún tipo de conflicto de intereses con la investigación realizada y los resultados expresados en el presente artículo.
Agradecimientos
A la Dirección de Investigación de la Universidad Central del Ecuador por el financiamiento otorgado a través del proyectos avanzados senior DI-2022-045 que han permitido el desarrollo de una línea de investigación a la cual pertenece la presente investigación, así como a la Universidad Nacional del Chimborazo, la Universidad UNIANDES y la Universidad de los Andes de Venezuela por la ayuda, colaboración y asesoramiento prestado.
6. REFERENCIAS
1. Armijo M & San Martin J. Curas balnearias y climáticas: talasoterapia y helioterapia. Editorial Complutense. Madrid. España. 1994.
2. Medina Ramírez G, Naranjo C, Escobar S, Araque J, Djabayan P, & Andueza F. Microbiota extremófila y resistomas ambientales de la fuente termal “Termas La Merced” Quito-Ecuador. FIGEMPA: Investigación Y Desarrollo. 2016: 2(2): 33-37.
3. Baquero F, Martínez J, & Cantón R. Antibiotics, and antibiotic resistance in water environments. Current Opinion in Biotechnology. 2008; 19 (3): 260-265.
4. Hanna N, Tamhankar AJ, & Lundborg CS. Antibiotic concentrations and antibiotic resistance in aquatic environments of the WHO Western Pacific and South-East Asia regions: a systematic review and probabilistic environmental hazard assessment. The Lancet Planetary Health. 2023; 7(1): e45-e54.
5. González Marco, Viteri Francisco, Villacis Luis, Escobar Sandra, Araujo Liliana, González Ana, Medina Gerado, Araque Judith, & Andueza Felix. Perfiles de susceptibilidad a los antibioticos en cepas del género Bacillus aisladas de ambientes acuáticos extremos del Ecuador. An. Real Acad. Farm. 2021; 87 (1): 21-28.
6. Gros M, Mas-Pla J, Sànchez-Melsió A, Čelić M, Castaño M, Rodríguez-Mozaz S, & Petrović M. Antibiotics, antibiotic resistance, and associated risk in natural springs from an agroecosystem environment. Science of The Total Environment. 2023; 857: 159202.
7. Andueza F. Diversidad Microbiana de las Aguas Mineromedicinales de los Balnearios de Jaraba. Tesis Doctoral. Universidad Complutense de Madrid, España. 2007.
8. Gutiérrez MG, Andueza F, Araque J, Lugo A, & Chacón Z. Caracterización microbiológica y potencial biotecnológico de microorganismos aislados de las aguas termales de la Musuy, Municipio Rangel del Estado Mérida. Venezuela. Revista de la Sociedad Venezolana de Microbiología. 2018; 38 (1): 27-32.
9. Andueza F, Acuña J, Escobar J, González-Escudero M, Araque J, Escobar-Arrieta S, González-Romero AC, & Medina-Ramírez G. (2023). Pseudomonas species and their profiles of resistance to antibiotic in aquatic ecosystems of Ecuador. Revista de la Facultad de Farmacia. Vol. 65(1): 9-17.
10. World Health Organization (WHO). A health perspective on the role of the environment in One Health Copenhagen: World Health Organization Regional Office for Europe. 2022.
11. Elnaiem A, Mohamed-Ahmed O, Zumla A, Mecaskey J, Charron N, Abakar MF & Dar O. Global and regional governance of One Health and implications for global health security. The Lancet; 2023; 401(10377): 688-704.
12. Carrera Villacrés D & Guevara García P. Fuentes termales del Ecuador. Escuela Superior Politecnica del Ejercito (ESPE). Quito. Ecuador. 2017. http://repositorio.espe.edu.ec/xmlui/handle/21000/11739.
13. Rice EW, Baird RB, & Eaton AD. Standard methods for the examination of water and wastewater. 23 Edition. American Public Health Association. American Water Works Association. Water Environment Federation. Washington. USA. 2017.
14. MacFaddin, J. Pruebas Bioquímica individuales. Pruebas bioquímicas para la identificación de bacterias de importancia clínica. 3a ed. Buenos Aires-Argentina. Médica Panamericana. 2003.
15. Bauer AW, Kirby MM, Sherris JC, & Truck M. Antibiotic susceptibility testing by a standardized single disk method. Am. J. Clin. Pathol. 1966; 45(4): 493-496.
16. Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing Clinical and Laboratory Standards Institute Wayne PA. 32 edition. USA 2022.
17. De La Rosa MC & Mosso MA. Diversidad microbiana de las aguas minerales termales. En: Panorama actual de las aguas minerales y minero-medicinales de España, pp. 153-158. Ed. A. López y J.L. Pinuaga. Instituto Tecnológico Geominero de España. Madrid. España. 2000.
18. Andueza Leal FD, Araque Rangel J, González Escudero M, Sacoto D, León Leal † A, Gutiérrez MG, Flores S, Escobar Arrieta S, & Medina Ramírez G. Biodiversidad bacteriana en aguas de balnearios mineromedicinales de Ecuador y Venezuela. FIGEMPA: Investigación Y Desarrollo. 2023; 15(1): 56–77.
19. Nicoletti G, Corbella M, Jaber O, Marone P, Scevola D, & Faga A. Non‑pathogenic microflora of a spring water with regenerative properties. Biomedical Reports. 2015; 3(6): 758-762.
20. Figueira V, Vaz-Moreira I, Silva M. & Manaia CM. Diversity and antibiotic resistance of Aeromonas spp. in drinking and wastewater treatment plants. Water Res. 2011; 45: 5599-5611.
21. De la Rosa MC, Andueza F, Sánchez Beltrán MC, Rodríguez Fernández MC, & Mosso Romeo MA. Microbiología de las aguas mineromedicinales de los Balnearios de Jaraba. Anales de la Real Academia Nacional de Farmacia. 2004, 7 (extraordinario): 51-74.
22. Janda JM & Abbott SL. The genus Aeromonas: taxonomy, pathogenicity, and infection. Clin Microbiol Rev. 2010; 23: 35–73.
23. Götz F, Bannerman T, & Schleifer KH. The Genera Staphylococcus and Macrococcus. The Prokaryotes. 2006:5–75. doi: 10.1007/0-387-30744-3_1
24. Kumar R, Kirti V, & Sharma RC. Thermophilic microbial diversity and physicochemical attributes of thermal springs in the Garhwal Himalaya. Environmental and Experimental Biology. 2020; 18: 143–152.
25. Santana Ramos M, Rueda Furlan JP, Lage Gallo IF, Rodríguez dos Santos LD, Amabile de Campos T. & Savazzi Guedes SE. High Level of Resistance to Antimicrobials and Heavy Metals in Multidrug-Resistant Pseudomonas sp. Isolated from Water Sources. Current Microbiology. 2020; 77, 2694-2701.
26. Arab M, Bakour S, Lalaoui R, Aissaoui N, Nas F, Hoceini A, Klouche-Khelil N. Diversity of aerobic bacilli analysis using molecular and culture-based approaches in debagh hot spring. Geomicrobiology Journal. 2019; 36(2): 137-147.
27. Lamy B, Baron S, & Barraud O. Aeromonas: the multifaceted middleman in the One Health world. Current Opinion in Microbiology. 2022; 65: 24-32. https://doi.org/10.1016/j.mib.2021.09.012
28. Camiade M, Bodilis J, Chaftar N, Riah-Anglet W, Buquet J, Flores Ribeiro A, & Pawlak B. Antibiotic resistance patterns of Pseudomonas spp. isolated from faecal wastes in the environment and contaminated surface water. FEMS Microbiology Ecology. 2020; 96(2), 1-21.
29. Samanta A, Bera P, Khatun M, Sinha C, Pal P, Lalee A, & Mandal A. An investigation on heavy metal tolerance and antibiotic resistance properties of bacterial strain Bacillus sp. isolated from municipal waste. Journal of Microbiology and Biotechnology Research. 2012; 2(1): 178-189.
30. Letten AD, Hall AR, & Levine JM. Using ecological coexistence theory to understand antibiotic resistance and microbial competition. Nat. Ecol. Evol. 2021; 5: 431–441.