Introducción: La medición de los anticuerpos frente a tiroglobulina (ATG) y peroxidasa tiroidea (ATPO) es de interés para identificar pacientes con tiroiditis autoinmune.
Este estudio pretende evaluar un inmunoensayo comercial de electroquimioluminiscencia para ATG y ATPO, estudiando la imprecisión, la linealidad, sensibilidad analítica, evaluación del arrastre, e influencia de interferentes endógenos.
Material y métodos: La imprecisión se evaluó usando tres soluciones con diferentes concentraciones de analitos, analizándose 20 veces en la misma serie analítica y durante 20 días consecutivos, calculando el coeficiente de variación. Para el estudio de linealidad se combinaron una muestra con elevada concentración de analitos y un diluyente, obteniéndose concentraciones intermedias que se analizaron por triplicado. El límite de detección se calculó haciendo 20 determinaciones de una muestra de diluyente. El arrastre se evaluó analizando una muestra con alta concentración de anticuerpos seguida por otra con concentraciones muy bajas. El estudio de interferencias se realizó añadiendo a mezclas de suero hemolizado, Intralipid 30% y bilirrubina.
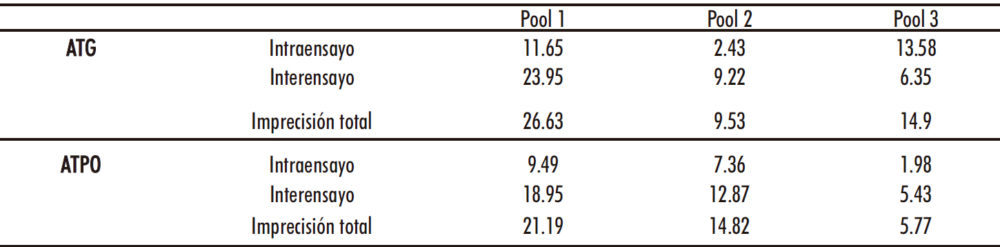
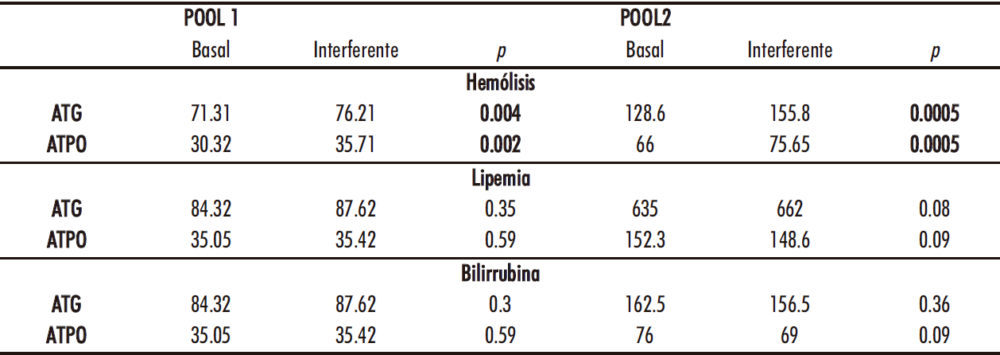
Resultados: Las imprecisiones totales obtenidas (%) fueron 26,63, 9,53, y 14,9 para ATG y 21,19, 14,82 y 5,77 para ATPO. La linealidad queda definida por las ecuaciones de regresión: Y=6.61+1.01X(ATG) y Y=16.37+0.97X(ATPO). El límite de detección fue 17,17 para ATG y 5 para ATPO. El arrastre no fue significativo. La hemólisis produjo interferencia significativa en ambos ensayos.
Conclusiones: Las imprecisiones obtenidas son comparables a las declaradas por el fabricante. La sensibilidad analítica cumple las especificaciones del fabricante. El comportamiento de ambos ensayos es lineal y no se halla arrastre significativo. La hemólisis interfiere ambos ensayos.
Palabras Clave: inmunoensayo; electroquimioluminiscencia; antitiroglobulina; antitiroperoxidasa; cobas e411; interferencias endógenas
ABSTRACT:
Introduction: The measuring of antibodies against thyroglobulin (ATG) and thyroperoxydase (ATPO) is useful for identifying patients with autoimmunethyroiditis. This study tries to assess an electrochemiluminescent immunoassay for ATG and ATPO, evaluating imprecision, linearity, analytic sensitivity, carry-over and the influence of endogenous interferents.
Material and methods: Imprecision was assessed using three pools with different analytes concentrations, performing within run and between run 20 times. Fort the linearity study a sample containing high analyte concentration and a solvent devoid of analyte were combined, obtaining intermediates concentrations, which were analyzed by triplicate. The limit of detection was calculated analyzing 20 times a sample devoid of analyte. Carry-over was evaluated analyzing a sample with a high antibody concentration followed by other one containing low antibody concentration. The interference study was carried-out adding hemolyzed, Intralipid 30% and bilirubin into sera pool.
Results: Total imprecision obtained (%) were 26.63, 9.53, and 14.9 for ATG and 21.19, 14.82, and 5.77 for ATPO. Linearity was defined for the following regression equations: Y=6.61+1.01X (ATG) and, Y=16.37+0.97X (ATPO). The limit of detection was 17.17 for ATG and 5 for ATPO. Carry-over was not significant. Hemolysis caused significant interference in both assays.
Conclusions: Imprecision obtained were similar to the manufacturer declared ones. Analytic sensibility complies the manufacturer’s specifications. The behavior of both assays was linear and significant carry-over was not found. Hemolysis interferes in both assays.
Keywords: immunoassay; electrochemilumescence; antithyroglobulin; antithyroperoxidase; cobas e411; endogenous interferences
1. INTRODUCCIÓN
La tiroiditis de Hashimoto es la primera causa de hipotiroidismo en las áreas no deficientes en yodo. La medición de los anticuerpos frente a la tiroglobulina (ATG) y la peroxidasa tiroidea (ATPO) es de interés para identificar pacientes con enfermedad tiroidea autoinmune (1), así como para predecir el riesgo de disfunción tiroidea en pacientes tratados con ciertos fármacos (amiodarona, litio), en el embarazo o en las tiroiditis asociadas a ciertas condiciones clínicas (diabetes, síndrome de Down). Por otro lado la titulación de ATG es recomendada en los pacientes en los que se va a medir tiroglobulina para el diagnóstico y seguimiento del cáncer diferenciado de tiroides, debido a la interferencia que producen estos anticuerpos en el análisis de tiroglobulina (1, 2). Los ATG, además, pueden ayudar a monitorizar el tratamiento con yodo en pacientes con bocio en áreas deficientes de yodo.
Debido a la gran variabilidad de entre los ensayos para ATG y ATPO y falta de estandarización entre métodos (3, 4) la National Academy of Clinical Biochemistry (NACB) ha subrayado la necesidad de evaluar los ensayos comercialmente disponibles (1-3). Nuestro estudio pretende evaluar las características operativas de los métodos de electroquimioluminiscencia para ATG y ATPO en la plataforma cobas e411 (ROCHE DIAGNOSTICS®) utilizada en nuestro laboratorio, estudiando la imprecisión, la linealidad, el límite de detección y el límite de blanco,definido como el triple de la desviación estándar de una serie de muestras sin analito, así como la evaluación del arrastre. Finalmente se evaluó la especificidad analítica mediante un estudio de interferencias frente a los tres interferentes endógenos clásicos (hemólisis, lipemia, y bilirrubina)
2. MATERIAL Y MÉTODOS
El método evaluado fue el inmunoensayoelectroquimioluminiscente (ECLIA) para la medida de ATG y ATPO en el analizador cobas e411. (ROCHE DIAGNOSTICS®, Manheim, Alemania).Este analizador consta de una celda de detección de electroquimioluminiscencia (ECL) que permite la medida en flujo al aplicar un voltaje constante en la celda de detección durante el paso de las muestras a analizar. Como consecuencia de la aplicación del voltaje se producen una serie de reacciones químicas que finalmente dan lugar a la emisión quimioluminiscente. La emisión de quimioluminiscencia se cuantifica como el área bajo la curva entorno al pico de máxima intensidad. La reacción ECL se acopla a un inmunoensayo de alta especificidad y sensibilidad. En el caso que nos ocupa, se trata de un inmunoensayo competitivo que usa un antígeno (tiroglobulina o tiroperoxidasa) biotinilado, que se une a micropartículas magnéticas recubiertas de estreptavidina y un anticuerpo monoclonal trazador marcado con un quelato de rutenio, el cual compite con los anticuerpos contenidos en la muestra problema. El complejo formado por el analito y el antígeno biotinilado se fija a un electrodo gracias al magnetismo de las partículas, y se aplica una diferencia de potencial, provocando la emisión de una radiación luminiscente que es detectada por un fotomultiplicador.
El estudio evaluó las principales características analíticas del método, como precisión, sensibilidad analítica (límite de blanco, límite de detección), linealidad, estudio de arrastre y evaluación de interferencias endógenas.
2.1. Imprecisión
Para el estudio de imprecisión se ha seguido el protocolo EP15-A2 del CLSI (ClinicalLaboratory Standard Institute), preparándose tres mezclas de especímenes con diferentes concentraciones de ATG y ATPO que se analizaron 20 veces en la misma serie analítica para calcular la precisión intraensayo y durante 20 días consecutivos para la precisión interensayo (4). Se calcularón los coeficientes de variación intra e interensayos, usando la fórmula en donde Sd es la desviación estándar y la media aritmética de la serie.
2.2. Linealidad
Para el estudio de linealidad se siguió el protocolo EP6-A del CLSI, combinando una muestra con elevada concentración de ambos anticuerpos y el diluyente adecuado para obtener 7 concentraciones intermedias que se analizaron por triplicado, calculándose la ecuación de regresión (5).
2.3. Sensibilidad analítica
La sensibilidad analítica se evaluó según el protocolo EP17-A del CLSI (6). El límite de blanco (LoB) se calculó a partir del análisis de una serie de 20 determinaciones de una muestra desprovista de los analitos, mientras que el límite de detección (LoD) se dedujo mediante la ecuación LoD=LoB+1.645 Sd, siendo Sd la desviación estándar de la serie.
2.4. Arrastre (Carry-over)
La posibilidad de arrastre se evaluó según el protocolo EP10-A3 (7) del CLSI, analizando una muestra con alta concentración de anticuerpos por duplicado seguida por otra con concentraciones próximas al límite de detección por triplicado, comparando los resultados obtenidos mediante un test de comparación de medias. Se calculo el porcentaje de arrastre mediante la constante k de Broughton (8, 9).
B1m — B3m
K(%)=100*
A2m — B3m
En donde B1m es la media de las muestras de baja concentración procesadas en primer lugar, B3m, la media de las procesadas en tercer lugar, siendo A2m la media de las muestras de alta concentración procesadas en segundo lugar.
2.5. Interferencias endógenas
El estudio de interferencias endógenas se llevó a cabo con dos mezclas de suero de diferente concentración de analitos (baja y alta), a las que se añadieron las soluciones primarias de interferente (hemolizado, bilirrubina o Intralipid®) según el método original propuesto por Glick (10) ligeramente modificado en la guía CLSI EP7A2 (11). La máxima concentración evaluada para cada interferente fue 1000 mg/dL de hemoglobina, 30 mg/dL de bilirrubina (Sigma Aldrich®, grado de pureza >95%) y 1625 mg de triglicéridos (Intralipid®).
Las soluciones primarias de interferente fueron preparadas como se describe a continuación. El hemolizado se preparó usando una versión ligeramente modificada del método descrito por Jay et Provasek (12). Se tomaron 2 mL de una mezcla de especímenes de sangre total obtenida con EDTA, lavando los eritrocitos tres veces con 10 mL de solución salina isotónica (NaCl 154 mM) después de descartar el plasma y se produjo el hemolizado mediante choque hipotónico, con adicción de 1 mL de agua desionizada, completándose con un ciclo de congelación/descongelación (-25ºC) durante al menos 12 h. La solución stock de bilirrubina se preparó por disolución de 30 mg de bilirrubina no conjugada en 5 mL de NaOH 0,1 M (en oscuridad). Como solución primaria de triglicéridos se usó Intralipid® 20%, emulsión comercial de triglicéridos de cadena larga derivada de aceite de soja y yema de huevo.
Se añadieron 0,5 mL de solución primaria de interferente (mezcla problema) o el mismo volumen de agua desionizada (mezcla control) a 9,5 mL de la mezcla de sueros para dos concentraciones diferentes de analitos, dentro de los rangos de decisión clínica. Estas mezclas con y sin interferente se analizaron usando ambos imunoensayos con 15 repeticiones, comparándose las medias obtenidas en cada mezcla mediante un test no paramétrico de Wilcoxon, usando como nivel de significación estadística p<0,05.Se estudió el efecto de concentraciones crecientes de interferente, siendo la concentración final en cada dilución 0, 50, 100, 200, 400, 600, 800 y 1000 mg/dL para hemoglobina, 0, 1,5, 3, 6, 12, 18, 24 y 30 mg/dL para bilirrubina y 0, 81, 165, 325, 650, 975, 1300 y 1625 mg/dL para triglicéridos. Se midió la concentración de ATG y ATPO en cada dilución por triplicado, calculándose el error relativo respecto al especímen libre de interferente usando la fórmula 100*(Ci-C0/C0), siendo Ci la media de las concentraciones obtenidas en las diluciones con interferente y C0 la media de las concentraciones en la mezcla sin interferente, obteniéndose así los correspondientes interferogramas (10)
2.6. Estudio estadístico
La precisión intraserial, interserial, interdiaria, y la propia del laboratorio se calcularon con arreglo a las recomendaciones contenidas en el documento citado del CLSI (4). Se obtuvieron las medias, desviaciones estándar y coeficientes de variación para cada caso. Para el estudio de linealidad se realizó un análisis de regresión lineal entre las concentraciones obtenidas y las teóricas para deducir la ecuación de la recta a la que se ajustaron los datos.
En el estudio de arrastre se consideró la existencia de arrastre significativo cuando la constante de Broughton, K es mayor del 1% (8).
En el estudio de interferencias se realizó una comparación de medias entre la mezcla sin interferente aplicando el test no paramétrico de Wilcoxon. Se consideró que existía interferencia cuando hay diferencia significativa entre las medias de las distribuciones con y sin interferente (p<0,05). Para cada concentración de interferente, se consideró la existencia de interferencia significativa, cuando la desviación del resultado de la mezcla con interferente respecto a la mezcla de referencia es mayor del 10%, usando el criterio del CLSI (11), ampliamente usado por otros autores en estudios similares (13, 14).
Para los cálculos se realizaron con el apoyo de los programas EXCEL analyse.it y MEDCALC 11.3.
3. RESULTADOS
Las precisiones que se obtuvieron expresadas como coeficiente de variación (%) se recogen en la tabla 1.
Tabla 1. Imprecisión intraensayo, interensayo y total para ATG y ATPO
En el estudio de linealidad el rango de valores obtenidos fueron 10,14-452,3 para ATG y 5-577,4 para ATPO. El estudio de linealidad produjo las siguientes ecuaciones de regresión: ATG: Y=6,61+1,01X ; ATPO: Y=16,37+0,97X, estando incluidos en ambos casos en los intervalos de confianza el cero para la intersección y el uno para la pendiente, lo que indica un comportamiento lineal. En la tabla 2 se resumen los parámetros estadísticos de la regresión para el estudio de linealidad.
Tabla 2.Parámetros estadísticos del estudio de regresión para los ensayos de ATG y ATPO
El límite de blanco fue 14,13 para ATG y 5 para ATPO y el límite de detección 17,17 para ATG y 5 para ATPO. La constante de Broughton fue de -0,048% para ATG y 0,071% para ATPO.
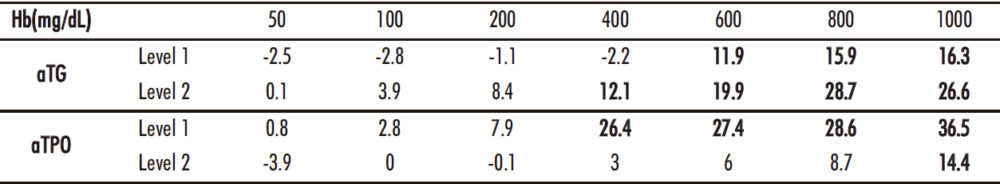
El estudio de interferencias puso en evidencia diferencias significativas en las medianas para hemólisis en ambos parámetros, no hallándose desviaciones significativas para lipemia ni bilirrubina en ninguno de los dos analitos estudiados. La tabla 3 recoge la información del test de Wilcoxon para las tres interferencias estudiadas. Las desviaciones (errores relativos) obtenidos con el gradiente de hemólisis para ambos analitos se recogen en la tabla 4. En negrita aparece el punto de la curva, a partir del cual hay un efecto significativo de la interferencia.
Tabla 3. Test de Wilcoxon para las interferencias endógenas en los ensayos de ATG y ATPO
Tabla 4. Desviaciones en las medidas de ATG y ATPO producidas por el gradiente de hemólisis
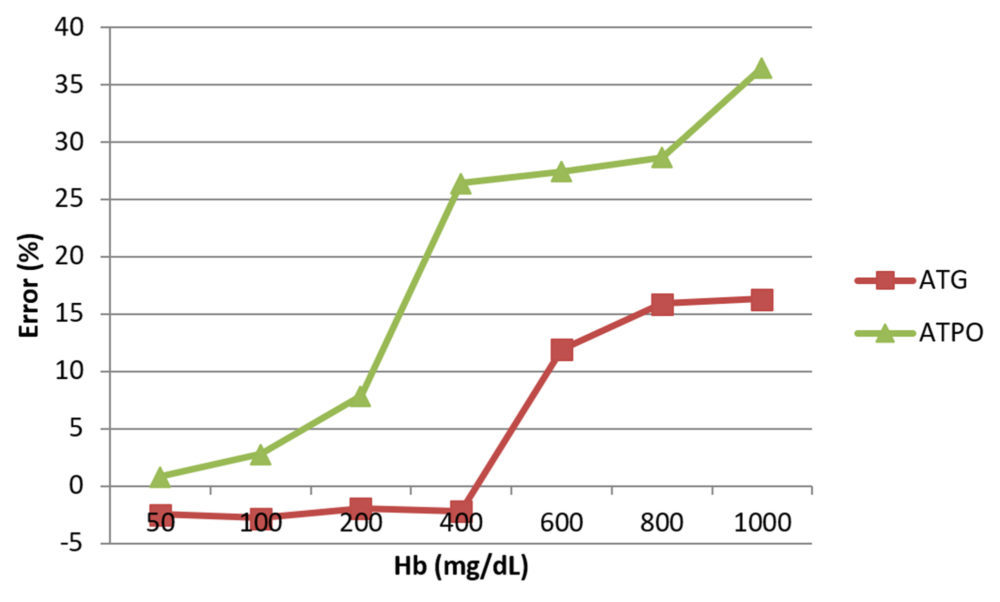
En la figura 1 se representa el interferograma que muestra el efecto de la hemólisis en ambas magnitudes bioquímicas.
Figura 1. Interferograma que visualiza el efecto del gradiente de hemólisis en la medida de ATG y ATPO
4. DISCUSIÓN
La medida de anticuerpos primero definidos frente al antígeno microsomal tiroideo (15), posteriormente identificado como peroxidasa tiroidea (TPO) y frente a tiroglobulina (TG) ha sido fundamental en el diagnóstico de la enfermedad tiroidea autoinmune, principalmente la tiroiditis de Hashimoto, el mixedema primario y la tiroiditis postparto. Aunque la sensibilidad y especificidad analítica y clínica de estos métodos ha ido mejorando en los últimos años, la diversidad de ensayos y su falta de estandarización han llevado a las sociedades científicas a insistir en la necesidad de evaluar las prestaciones analíticas de los inmunoensayos comerciales (1-3). Tozzoli et al (3) y Feldt-Rasmussen (15) estudiaron las prestaciones analíticas y clínicas de varios inmunoensayos comerciales para ATG y ATPO, evidenciando una elevada variabilidad entre métodos, en lo que se refiere a imprecisión analítica y a los puntos de corte considerados como valor discriminante. Más recientemente La,ulu et al (16) compararon 5 inmunoensayos comerciales automatizados, encontrando diferencias en imprecisión analítica total entre 2,6 y 14,9% para ATG y entre 2,1 y 15,8% para ATPO, con concordancias entre métodos que variaron entre 68,5% 84,7% (ATG) y 77,5 y 84,7% (ATPO). Estas diferencias se traducen también en el punto de corte usado como discriminante, por lo que tiene influencia en la clasificación de los pacientes (16-18).
En nuestro estudio las imprecisiones obtenidas son similares a las declaradas por el fabricante y a las obtenidas por otros autores (16), si bien son superiores a las deseables. Las sensibilidades analíticas estuvieron dentro del rango declarado por el fabricante. El comportamiento de ambos métodos fue lineal en el rango analítico, ya que el cero está contenido en el intervalo de confianza de la ordenada en el origen y la unidad en el de la pendiente. En cuanto a las interferencias endógenas sólo la hemólisis afectó de modo significativo a las determinaciones, lo que debe ser tenido en cuenta cuando llegan al laboratorio muestras hemolizadas, algo habitual en la rutina asistencial (19).
Las sociedades científicas deberían hacer un esfuerzo hacia la armonización y estandarización de los métodos de medida de anticuerpos antitiroideos dada la repercusión de la variabilidad metodológica en el diagnóstico de la enfermedad tiroidea autoinmune. Entretanto es recomendable que los laboratorios clínicos evalúen las prestaciones analíticas de estos inmunoensayos.
5. CONCLUSIONES
Las imprecisiones obtenidas son comparables a las declaradas por el fabricante, pero están por encima de las deseables según variabilidad biológica. La sensibilidad analítica es adecuada según las especificaciones del fabricante. El comportamiento de ambos ensayos es lineal en el rango estudiado y no se halla arrastre significativo.
Conflicto de Interés
El autor declara la ausencia de cualquier tipo de conflicto de intereses.
6. REFERENCIAS
1. Baloch Z, Carayon P, Conte-Devoix D, Demers LM, Feldt-Rasmussen U, Henry JF, et al. Laboratory medicine practice guidelines: laboratory support for the diagnosis and monitoring of thyroid disease. Thyroid 2003; 13: 3-126.
2. Rinaldi S, Plummer M, Biessy C, Tsilidis KK, Østergard JN, Overvad K, et al. Thyroid-stimulating hormone, thyroglobulin and thyroid hormones and risk of differentiated thyroid carcinoma: the EPIC study. J Natl Cancer Inst 2014; 106 (6): dju097.
3. Tozzoli R, Bizzaro N, Tonutti E, Pradella M, Manoni F, Vilalta D et al. Immunoassay of anti-thyroid autoantibodies: high analytical variability in second generation methods. ClinChem Lab Med 2002; 40 (6): 568-573.
4. National Committee for Clinical Laboratory Standard Institute (CLSI). Evaluation of precision performance of quantitative measurement methods. Approved guideline-Second edition. EP5-A2. Wayne: NCCLS; 2004.
5. Clinical and Laboratory Standard Institute. Evaluation of the linearity of quantitative measurement procedures: a statistical approach: approved guideline. NCCLS guideline EP6-A. Wayne. PA: NCCLS; April 2003
6. Clinical and Laboratory Standards Institute Protocols for determination of limits of detection and limits of quantitation: approved guideline. NCCLS guideline EP-17-A. Wayne PA: NCCLS. April 2003
7. Preliminary evaluation of quantitative clinical laboratory measurement procedures approved guideline-Third edition. May 2014.
8. Broughton P, Gowenlock A H, Mc Cormack JJ and Neil D. a revised scheme for the evaluation of automatic instrument for use in clinical chemistry. AnClinBiochem. 1974; 11: 207-12
9. Aluma A, Alsina MJ, Armenter C, Bertrán C, Biosca C, Doladé M. et al. Protocolo de evaluación de analizadores automáticos por el ususario. En: Selección y evaluación de sistemas analíticos. Martínez M, editor. Barcelona. Sociedad Española de Bioquímica Clínica y Patología Molecular. ISBN: 84-920967-7-2. 1994
10. Glick MR, Ryder KW, Jackson SA. Graphical comparison in interferences in clinical chemistry instrumentation. ClinChem 1986; 32: 470-5.
11. Clinical and Laboratory Standards Institute. Interference Testing in Clinical Chemistry. Approved Guideline-Second Edition. EP7-A2. USA 2010.
12. Jay DW, Provasek D. Characterization and mathematical correction of hemolysis interference in selected Hitachi 717 assays. Clin Chem. 1993; 39 (9): 1804-1810.
13. Marques-Garcia F, Heredero Jung D H, Perez S E. Impact of individualized hemolysis management based on biological variation cut-offs in a Clinical Laboratory. Ann Lab Med. 2022; 42: 169-177
14. Zhang JI J, Meng QH. Evaluation of the interference of hemoglobin, bilirubin, and lipids on Roche Cobas 6000 assays. ClinChim Acta. 2011;412: 1150-3.
15. Feldt-Rasmussen U. Analytical and clinical performance goals for testing autoantibodies to thyroperoxidase, thyroglobulin, and thyrotropin receptor. Clin Chem. 1996; 42 (1): 160-163.
16. La,ulu SL, Slev PR, Roberts WL. Performance characteristics of 5 automated thyroglobulin autoantibody and thyroid peoxidase autoantibody assays. ClinChim Acta. 2007; 376: 88-95.
17. Tozzoli R, D´Aurizio F, Ferrari A, Castello R, Metus P, Caruso B, et al. ClinChim Acta. 2016; 452: 61-65.
18. Ma C, Li D, Yin Y, Wu J, Guo X, Zhang R, Clin Biochem. 2019; 74: 36-41.
19. Lippi G, Blanckaert N, Bonini P, Green S, Kitchen S, Palicka V et al. Haemolysis: an overview of the leading cause of unsuitable specimens in clinical laboratories. ClinChem Lab Med. 2008; 46 (6): 764-772.