RESUMEN:
Trichomonas vaginalis es el protozoo parásito responsable de una de las infecciones de transmisión sexual curables que presenta mayor incidencia anual en todo el mundo. Sin embargo, los métodos de diagnóstico empleados con mayor frecuencia no son lo suficientemente sensibles, siendo incapaces de detectar un elevado porcentaje de los casos, principalmente en individuos asintomáticos. Estas técnicas tradicionales tampoco son lo suficientemente rápidas, y la mayoría no son adecuadas para el diagnóstico de la infección en el varón, agravándose aún más la situación. En las últimas décadas, se han desarrollado nuevas pruebas para el diagnóstico de la tricomonosis, que muestran valores de sensibilidad, especificidad y rapidez mucho más aceptables, permitiendo además reducir el tiempo de diagnóstico. De esta manera, su puesta en práctica conduciría a la obtención de un resultado en pocas horas, facilitando el inicio del tratamiento en aquellos casos en los que este sea necesario. Ante esta situación, en el presente trabajo se lleva a cabo una revisión bibliográfica de las técnicas más relevantes, incluyendo pruebas disponibles para el diagnóstico en el varón, así como las que permiten detectar la presencia de coinfecciones, indicándose la utilidad y las ventajas e inconvenientes de cada una.Palabras clave:
Trichomonas vaginalis; infección de transmisión sexual; diagnóstico; sensibilidad; especificidad; asintomático;
point-of-care
ABSTRACT:
Trichomonas vaginalis is the protozoan parasite causative of one of the curable sexually transmitted infections that shows the highest annual incidence worldwide. However, the diagnostic methods most frequently used, are not sensitive enough and therefore, a large percentage of cases are not detected, especially in asymptomatic people. These traditional tests are not fast enough, and most of them are not suitable for carrying out diagnosis in men, with the consequent aggravation of the situation. In the last decades, new diagnostic techniques for trichomoniasis have been developed, which show much more acceptable sensitivity and specificity values, making it possible to reduce the time to diagnosis. Accordingly, their implementation could lead to a result in a few hours and thus, facilitate the start of treatment in those cases in which it is needed. In this framework, a bibliographic review of the most relevant techniques is carried out in the present work, including tests that are available for diagnosis in men, as well as for the detection of co-infections, highlighting their usefulness and both the advantages and disadvantages of each one.
Keywords: Trichomonas vaginalis; sexually transmitted infection; diagnosis; sensitivity; specificity; asymptomatic; point-of-care
1. INTRODUCCIÓN
Cada día, más de un millón de personas contraen una infección de transmisión sexual (ITS) curable en el mundo. La Organización Mundial de la Salud (OMS) estima que, anualmente, cerca de 376 millones de individuos adquieren alguna de las siguientes ITS curables de origen no viral: clamidiosis, gonorrea, sífilis y tricomonosis (1). Esta última, está causada por el protozoo parásito Trichomonas vaginalis, siendo responsable de casi la mitad de los casos de infección antes mencionados (2). Dicho microorganismo, es la única especie de protozoo que produce una infección de tipo genitourinario en el ser humano. La tricomonosis se trata de una enfermedad difícil de diagnosticar, ya que una gran parte de la población infectada no presenta ningún síntoma (3), y en caso de que se manifiesten, estos son muy variables e inespecíficos. Tanto la ausencia de pruebas realizadas en estos pacientes asintomáticos, como los errores cometidos en el diagnóstico, son los responsables de que, muy probablemente, se estén infraestimando los datos epidemiológicos (3, 4). Todos estos motivos remarcan la necesidad urgente de adoptar estrategias de diagnóstico dirigidas a la población de riesgo, que sean lo suficientemente eficaces y adecuadas como para detectar tanto los casos sintomáticos como los portadores sanos.
T. vaginalis posee un ciclo de vida muy sencillo. Este parásito no presenta ninguna forma de resistencia tipo quiste en su ciclo biológico, sino únicamente la de trofozoíto, la cual se reproduce asexualmente por fisión binaria longitudinal en el aparato genitourinario del hospedador, en un proceso denominado criptopleuromitosis. La infección se transmite principalmente a través del coito y constituye una parasitosis de tipo antroponótico teniendo, por tanto, como único hospedador al ser humano (5).
El trofozoíto de T. vaginalis debe su motilidad a la presencia de cuatro flagelos libres en posición anterior, junto a un quinto flagelo recurrente que se encuentra asociado a una membrana ondulante. Mediante examen microscópico directo, se distinguen fácilmente dichos flagelos, y una estructura de naturaleza microtubular denominada axostilo. Esta se origina desde los cinetosomas y recorre el cuerpo del trofozoíto, llegando a sobresalir en forma de proyección por la parte posterior del cuerpo celular del protozoo (5). La realización de técnicas de tinción permite observar con claridad los trofozoítos, que pueden encontrarse en la muestra en forma ameboidea o con aspecto piriforme, tal y como se observa en la Figura 1. En ella, se puede apreciar con claridad la presencia de estructuras características de T. vaginalis, como el núcleo, la proyección axostilar o los flagelos.
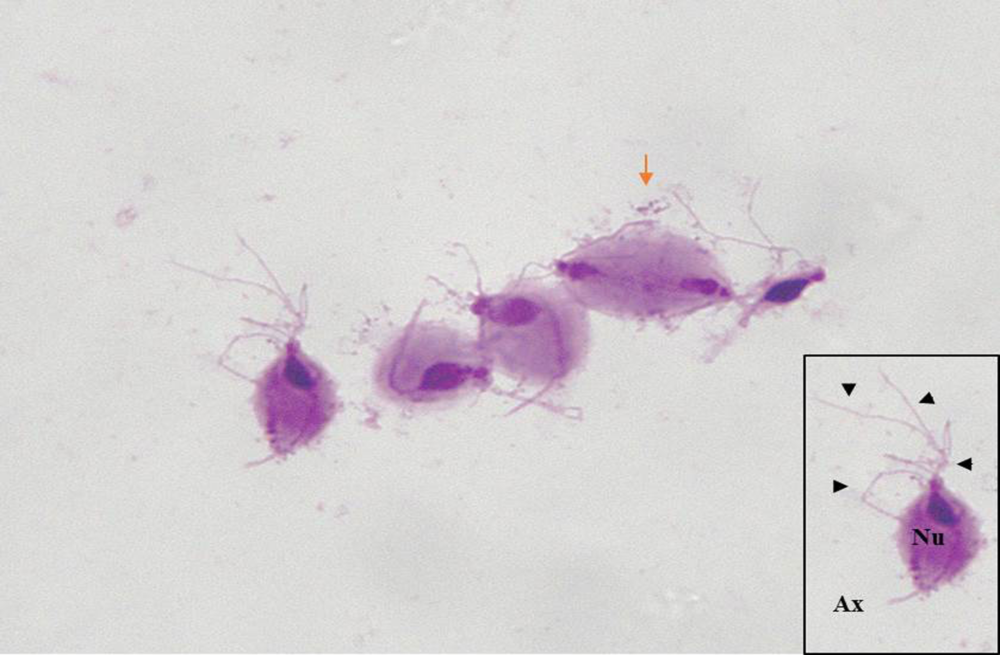
Figura 1. Tinción Giemsa de un cultivo de Trichomonas vaginalis (1000X). Los trofozoitos teñidos pueden ser identificados gracias a la observación de los cuatro flagelos anteriores (flechas), la presencia del núcleo (Nu) en la región anterior y el axostilo, que atraviesa el cuerpo del trofozoíto sobresaliendo por la parte posterior en forma de proyección axostilar (Ax). Se observa la división del parásito por criptopleuromitosis de uno de los trofozoítos teñidos (flecha naranja).
Una característica especial en cuanto a los orgánulos de T. vaginalis se refiere, es la ausencia de mitocondrias y peroxisomas (5). Su metabolismo energético recae principalmente sobre los hidrogenosomas, relacionados evolutivamente con las mitocondrias, los cuales llevan a cabo la fermentación de los carbohidratos (6). En concreto, la principal actividad bioquímica que desempeñan consiste en una oxidación anaerobia del piruvato dependiente de coenzima A, gracias a la actividad de sistemas enzimáticos como en los que intervienen la piruvato ferredoxin oxidorreductasa (PFOR) y la hidrogenasa. Dicha reacción permite la síntesis de una molécula de ATP por cada molécula de piruvato mediante una fosforilación a nivel de sustrato, además de producir hidrógeno gaseoso, dióxido de carbono y acetato (7).
A nivel genético, este parásito es uno de los seres unicelulares más complejos que se conocen: sus más de 60.000 genes codificantes hacen que T. vaginalis sea capaz de colonizar y sobrevivir en un hábitat tan complejo y hostil, en cuanto a fluctuaciones de pH, hormonas, presión osmótica y nutrientes se refiere, como es el aparato genitourinario (5, 8). Estos genes, codifican una serie de moléculas que le confieren una gran capacidad de evasión del sistema inmune del hospedador. De esta manera, es capaz de lisar neutrófilos por activación de la vía de las caspasas, degradar células epiteliales mediante la acción de proteasas, evadir el sistema del complemento por la lisis de C3b, degradar inmunoglobulinas o fagocitar células del sistema inmune, eritrocitos, células del epitelio vaginal o microorganismos de la propia microbiota del paciente, entre otras estrategias (5, 9). Por otra parte, los anticuerpos que genera el hospedador para protegerse de la infección son anti-proteasas o anti-fosfolipasas, moléculas que presenta T. vaginalis para llevar a cabo su colonización y supervivencia en el mismo (6).
La sintomatología que produce la infección por T. vaginalis es bastante variable, mostrando distintos grados de gravedad. Así, la patogenia no solo va a estar condicionada por aspectos intrínsecos del parásito, sino también por las condiciones del ambiente que coloniza. Por ejemplo, los síntomas son habitualmente más intensos cuando el entorno es rico en hierro y los niveles de estrógenos en la mujer son bajos (5). Ambos (hierro y estrógenos) parecen condicionar la expresión de determinados factores de virulencia del parásito (9, 10). De otra manera, alrededor del 50−85% de los pacientes varones y entre el 25−50% de las mujeres infectadas no experimenta ningún signo o síntoma, y el tiempo en el que estos se presentan tras la exposición al parásito es bastante variable, siendo normalmente de 4−28 días y alargándose en algunos casos hasta los 6 meses (3, 6).
Los síntomas más comunes, tanto en el hombre como en la mujer, son el prurito en la zona genital y molestias al orinar, debido a que la uretra de estos individuos se encuentra colonizada por el parásito. La secreción vaginal suele presentar mal olor y adquirir un color amarillo-verdoso, pudiendo mostrar un aspecto espumoso (3). Además, tanto la vagina como la zona cervical pueden exhibir una apariencia edematosa y/o eritematosa (6). En algunos casos, la infección puede conducir al desarrollo de una patología más grave, como uretritis no gonocócica o prostatitis en el hombre (5), mientras que en la mujer se ha relacionado con vaginitis o cervicitis. Con respecto a esta última, puede llegar a producirse el característico “cérvix de fresa” (strawberry cervix) (11); sin embargo, este signo se observa únicamente en un 5% de las pacientes (12). Asimismo, la infección puede ocasionar secuelas de mayor importancia y gravedad, como es el desarrollo de la enfermedad inflamatoria pélvica (12) y, en el caso de mujeres embarazadas, la tricomonosis puede afectar al feto, aumentando el riesgo de desencadenar partos prematuros, bajo peso al nacer, rotura prematura de membranas o abortos (6, 11).
En los procesos de colonización e infección, la adhesión del trofozoíto a la superficie de las células del aparato genitourinario es una fase crucial. Para este contacto parásito-célula, T. vaginalis no solo se sirve de un citoesqueleto con numerosas estructuras microtubulares, sino también de receptores capaces de reconocer moléculas que se expresan en la superficie de las células del hospedador, además de poseer unas proteínas de superficie que reciben el nombre de adhesinas (5, 9). Los anticuerpos que produce el hospedador frenan la extensión de la infección y le proporcionan cierta protección; sin embargo, no consiguen destruir al patógeno y eliminarlo por completo, por lo que dicha respuesta es limitada (3). De esta manera, parece que la inmunidad innata, que incluye la acción de los neutrófilos, resulta clave para el control de la enfermedad, no interviniendo tanto la respuesta inmune adquirida (13). Como se ha comentado anteriormente, el parásito es capaz de degradar las inmunoglobulinas producidas por el hospedador, de manera que, transcurridos 6−12 meses desde la eliminación de la infección, no se encuentran anticuerpos ni células B de memoria en la circulación, quedando así el hospedador expuesto a una posible reinfección (14). Además, algunos estudios realizados con ratones inoculados con suero aislado de pacientes con y sin síntomas, señalan que el título de IgG en los animales que recibieron suero de individuos asintomáticos, tanto de mujeres, como de hombres, fue menor (15, 16). Más concretamente, parece que las inmunoglobulinas predominantes en varones sintomáticos son las de tipo IgG1 e IgM (16).
La tricomonosis también se ha relacionado con un mayor riesgo de padecer otras ITS, como SIDA, sífilis, gonorrea, herpes genital, clamidiosis o papiloma humano (17, 18). Entre otras razones, la inflamación local y la rotura de las barreras mucosas, junto con la existencia de factores de riesgo comunes, favorecen tales coinfecciones (19). T. vaginalis tiene la capacidad de fagocitar bacterias del género Lactobacillus, ocasionando una alteración de la microbiota vaginal y el consiguiente aumento del pH, lo que también favorece la colonización de otros patógenos (5). Esto parece explicar por qué entre un 40 y un 60% de las mujeres con tricomonosis muestran, al mismo tiempo, vaginosis bacteriana. Curiosamente, las pacientes con esta patología también manifiestan una mayor predisposición para infectarse con T. vaginalis, lo que podría deberse a que la disbiosis vaginal es otro de los numerosos factores que se encuentran asociados a un aumento de la patogenicidad de este parásito (12).
El tratamiento por excelencia para la tricomonosis recae en el fármaco metronidazol, aunque también se utilizan en menor medida otros 5-nitroimidazoles, como el tinidazol. Como primera línea de tratamiento, tanto la OMS como el CDC recomiendan la administración en dosis única de uno de los dos fármacos mencionados, mientras que tratar con dosis diarias de metronidazol durante 7 días se propone como segunda línea (20). En el caso de pacientes embarazadas, la OMS no recomienda el tratamiento con metronidazol en el primer trimestre a pesar de ser este un fármaco de categoría B, salvo que se indique expresamente con el fin de prevenir ciertos riesgos (21, 22). Asimismo, la resistencia al metronidazol es un problema preocupante (20); sin embargo, en ocasiones resulta difícil distinguir un fallo en el tratamiento de una reinfección temprana (23). Por ello, la resistencia clínica al metronidazol se describe como un fallo en la curación junto con la detección de T. vaginalis tras la administración de al menos dos ciclos de tratamiento consecutivos, sin posibilidad de reinfección (23). En estos casos, se recomienda no investigar la presencia de trofozoítos en el paciente hasta pasadas tres semanas desde el inicio del tratamiento, ya que puede dar lugar a falsos positivos (21). Para ser farmacológicamente activos, los 5-nitroimidazoles necesitan sufrir la reducción del grupo nitro, de modo que una disminución en la actividad de las enzimas implicadas en su activación, como la PFOR o la tiorredoxin reductasa, entre otras, podría considerarse causante de resistencia (6, 24). Asimismo, es importante tener en cuenta el carácter microaerófilo de este parásito, es decir, su capacidad para sobrevivir en ausencia de oxígeno, pero también en presencia de una cierta presión del mismo, tal y como puede suceder a nivel genitourinario (5, 9). De esta manera, un aumento en la concentración de oxígeno intracelular podría conducir a la reoxidación del correspondiente nitroimidazol activado, dando lugar, de nuevo, al profármaco. Dicho fenómeno se conoce como “ciclo fútil”, habiéndose contemplado como otro posible mecanismo de resistencia al fármaco de primera línea (24). Análisis proteómicos más recientes han puesto de manifiesto que, en aislados resistentes del parásito, algunas enzimas involucradas en la glucólisis y en el metabolismo del hidrogenosoma, como las relacionadas con el complejo ATP sintasa, se encuentran reguladas a la baja (25). Todos estos nuevos datos parecen indicar que la resistencia a estos fármacos va a estar condicionada por el ambiente genitourinario, el cual, va a ser determinante para que el parásito modifique la expresión de unas u otras enzimas metabólicas, confiriéndole finalmente resistencia al metronidazol (25). No obstante, todavía quedan muchas dudas por resolver en lo que respecta a las rutas y vías de señalización involucradas, a fin de poder buscar nuevas alternativas farmacológicas que sean eficaces para tratar el creciente aumento de casos de tricomonosis resistente (5).
2. MÉTODOS DE DIAGNÓSTICO CLÁSICOS
Las razones anteriormente expuestas señalan la importancia de realizar cribados en población en riesgo de padecer ITS. Entre los factores que predisponen a la infección por T. vaginalis, se incluyen la existencia de múltiples parejas sexuales, el intercambio de sexo por dinero o drogas, y la presencia de antecedentes de otras enfermedades venéreas (26).
El método tradicional de diagnóstico consiste en tomar una muestra del paciente y examinarla inmediatamente al microscopio, con el fin de identificar la morfología y motilidad características del trofozoíto. En el caso de las mujeres, T. vaginalis puede detectarse en muestras de exudado vaginal; mientras que, en el hombre, se suele solicitar una muestra de exudado uretral (27). Este método puede llegar a tener una especificidad del 100%, aunque hay que llevarlo a cabo de forma suficientemente rápida y a una temperatura que no perjudique la viabilidad del trofozoíto, ya que sus valores de sensibilidad pueden decaer durante el tiempo que transcurre desde la toma de la muestra hasta su examinación al microscopio (11). Con respecto a las tinciones, la coloración de la muestra con Giemsa o Papanicolaou (Pap) no se considera lo suficientemente fiable, aunque el empleo de la tecnología Pap líquida aumenta la sensibilidad hasta un 60-96% y la especificidad al 98-100% (11). El cultivo de la muestra en medio TYM, Diamond o Roiron es una metodología sencilla y barata, pero requiere de la observación mediante examen microscópico directo durante un periodo comprendido entre los 2 a 7 días (27). Una buena manera de proceder es la denominada “inoculación retrasada”, método en el cual se combinan ambas técnicas: en primer lugar, se observa la muestra en examen en fresco y, si resulta negativa, se procede a su incubación en el medio de cultivo, observándolo durante 2-5 días (6).
La metodología tradicional de diagnóstico es de fácil realización y económica. Sin embargo, estas técnicas no son demasiado sensibles, ya que se estima que dicho valor se encuentra entre un 44 y un 68%. En el caso del cultivo, la sensibilidad puede elevarse hasta un 81-94% dependiendo del medio empleado. Sin embargo, la contaminación de la muestra con bacterias puede llegar a ser muy frecuente (28). Recientemente, se han desarrollado algunos medios de cultivo especiales para mejorar la viabilidad de los trofozoítos, como es el InPouch® TV test; sin embargo, sigue siendo un procedimiento que requiere observar la muestra durante bastantes días, no siendo un método de diagnóstico rápido (11, 27).
En el caso del paciente varón, el número de individuos asintomáticos es mayor que entre las mujeres, y la carga parasitaria en los mismos es menor (29). En este contexto, un estudio multicéntrico estadounidense señaló que, en torno al 76,8% de los varones infectados por T. vaginalis eran asintomáticos, frente al 26,8% de las mujeres (30). Por esta razón, el diagnóstico se suele realizar cuando el paciente presenta síntomas compatibles con uretritis, confirmando que esta no sea de etiología gonocócica (29). Los métodos de diagnóstico más comúnmente utilizados en el hombre son, de nuevo, el examen en fresco y el cultivo a partir de una muestra de orina del paciente. Algunos estudios realizados en mujeres exponen que este tipo de muestra no ofrece buenos valores de sensibilidad (31), y en otros, se afirma que el examen en fresco falla en la detección del 50-90% de varones infectados por T. vaginalis (29).
Como alternativa, existen técnicas más rápidas que presentan buenos valores de sensibilidad y especificidad, como las denominadas POC (point of care), que actualmente se están implantando en algunos servicios de diagnóstico. Se trata de pruebas que ofrecen resultados en minutos, más asequibles, y sencillas de realizar (32), por lo que no necesitan equipamiento sofisticado ni ser llevadas a cabo por profesionales, ya que siguen procedimientos simples que se pueden ejecutar recibiendo un entrenamiento mínimo (33). En su mayoría, las pruebas POC son de tipo inmunocromatografía, ensayos moleculares rápidos o basadas en reacciones de aglutinación (32).
Ante esta situación, es necesario desarrollar y poner en práctica pruebas que sean más sensibles y específicas, a la vez que rápidas, las cuales permitan realizar un diagnóstico precoz en la población de riesgo e incluso la identificación de los casos que cursan sin signos ni síntomas. De esta manera, se favorecería un inicio temprano en la administración de los tratamientos, así como la interrupción de la transmisión de T. vaginalis entre la población.
3. MÉTODOS DE INMUNODIAGNÓSTICO
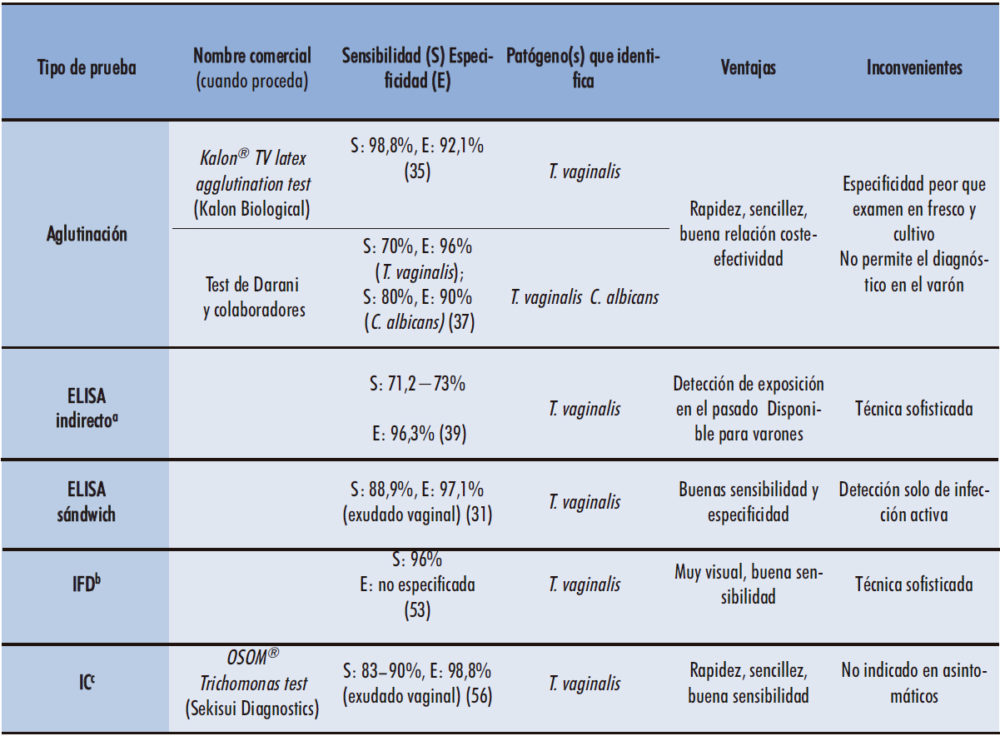
3.1. Técnicas de aglutinación en látex
Una de las técnicas empleadas para el serodiagnóstico de la tricomonosis es la aglutinación en látex. Algunas casas comerciales han desarrollado pruebas de este tipo para la detección de T. vaginalis, entre las que destaca Kalon TV latex® agglutination test. El kit incluye una suspensión que contiene partículas de látex sensibilizadas con anticuerpos IgG de conejo anti-T. vaginalis (5), que se debe poner en contacto con una gota de muestra diluida de exudado vaginal de la paciente (34). De esta manera, si la muestra es positiva y contiene antígenos de T. vaginalis, se produce una reacción de aglutinación entre el anticuerpo y el antígeno (inmunocomplejo), detectable de forma directa y visualizándose en forma de agregados (34).
Se trata de una prueba muy rápida, ya que tarda menos de tres minutos en ofrecer los resultados, por lo que permite comenzar el tratamiento el mismo día de su realización en caso de obtener un resultado positivo (35). Por otro lado, es una técnica muy sencilla de llevar a cabo, y no requiere de microscopio o cualquier otro tipo de equipo especial, ni tampoco de personal especializado. Únicamente hay que dispensar dos gotas sobre un portaobjetos: una de la muestra diluida en PBS y otra de la suspensión de látex. El resultado se visualiza tras remover manualmente durante un par de minutos (35).
Los métodos de aglutinación en látex ofrecen una sensibilidad mejor que la del examen en fresco y comparable a la del cultivo de la muestra, siendo esta del 98,8% (35), llegando hasta el 100% en estudios más recientes y siendo también una técnica con una relación coste-efectividad bastante aceptable (34). Además, algunos laboratorios, como el de Darani y colaboradores, han desarrollado kits de aglutinación que permiten detectar en la muestra la presencia de T. vaginalis (36), y también una prueba capaz de detectar otros microorganismos que causan infecciones vaginales, como Candida spp., pudiéndose llevar a cabo un diagnóstico diferencial (37). Para ello, dichas pruebas emplean dos sueros distintos, uno sensibilizado con anticuerpos anti-T. vaginalis, y otro con anticuerpos anti-Candida spp. (37).
Por tanto, las pruebas de aglutinación presentan bastantes ventajas, debido principalmente a su rapidez y su facilidad de realización. Su especificidad es totalmente comparable a la del cultivo, con la diferencia de que permiten obtener un resultado en el mismo día (35). Sin embargo, en los casos negativos que presentan síntomas, es necesario la repetición de la prueba aplicando otro tipo de metodología, como son las técnicas de diagnóstico molecular, con el objetivo de (i) evitar pasar por alto posibles infecciones por T. vaginalis ante un falso negativo y (ii) confirmar los verdaderos positivos (34, 35). Esto se debe a su bajo valor predictivo positivo, siendo de sólo un 60% (34). Cabe mencionar que estos test no pueden emplearse para el diagnóstico en varones, debido a que únicamente se pueden realizar con muestras de exudado vaginal (34, 35).
3.2. ELISA
La técnica de ELISA (enzyme-linked immuno-sorbent assay) indirecto, es una prueba de serodiagnóstico que permite la detección de anticuerpos específicos que ponen de manifiesto la exposición del paciente al parásito. Es un ensayo que utiliza antígenos inmovilizados en una microplaca multipocillo de poliestireno, los cuales son reconocidos de forma específica por los anticuerpos del hospedador (38). En este caso, para poder observar la formación del inmunocomplejo debido a la presencia de anticuerpos específicos anti-Trichomonas en el suero del paciente, se utiliza un segundo anticuerpo marcado con una enzima, llamado conjugado. Este conjugado suele ser IgG de cabra anti-IgG humana (39), y habitualmente se encuentra marcado con peroxidasa o fosfatasa alcalina. De esta manera, al añadir el sustrato cromógeno, tiene lugar una reacción enzimática que produce color. La absorbancia registrada es directamente proporcional a la cantidad de anticuerpo presente en la muestra (38), permitiendo de esta manera determinar el título del suero.
Los epítopos que los anticuerpos reconocen deben ser específicos de T. vaginalis, y no presentar homología con los de otros microorganismos, ni con los de las propias células del hospedador, evitando así la aparición de reacciones cruzadas y falsos positivos (40, 41). Con relación a los antígenos, algunas de las proteínas más inmunogénicas de T. vaginalis son la α-actinina, la α-enolasa, la aldolasa y la gliceraldehído-3-fosfato deshidrogenasa (41).
Existe la posibilidad de obtener, de manera recombinante, péptidos sintéticos que contengan la mayor cantidad posible de epítopos, de modo que sean reconocidos por diferentes anticuerpos específicos del hospedador. Normalmente, estos se sintetizan en plásmidos bacterianos, como los de Escherichia coli (41). Se busca que los péptidos diseñados sean sintetizados por la bacteria en altas cantidades y fáciles de purificar, evaluando que durante este proceso no se produzcan fenómenos de desnaturalización, ya que podrían llegar a alterar la integridad de la proteína (42). Con el paso del tiempo, estas proteínas quiméricas recombinantes se han ido perfeccionando, con el objetivo de incluir epítopos adicionales y eliminar aquellos que comparten cierta homología con proteínas de otros organismos, aumentando así la sensibilidad de esta técnica para cribar sueros de pacientes (41, 43). La síntesis de proteínas quiméricas recombinantes utilizando plásmidos de bacterias resulta mucho más ventajosa y eficaz que la utilización de células completas o lisados de las mismas: a menudo, las segundas incluyen epítopos comunes a los de otros microorganismos, pudiéndose desencadenar una reacción cruzada (41). Sin embargo, cuando no se dispone de una tecnología tan sofisticada de fabricación de antígenos recombinantes, es común utilizar un lisado de distintas cepas del parásito para realizar el ELISA indirecto y cuantificar la seropositividad de los pacientes. Algunos estudios llevados a cabo a partir de muestras de varones, han mostrado valores de sensibilidad y especificidad del 71,2 y 96,3% respectivamente (39).
Tabla 1. Ventajas e inconvenientes de las diferentes técnicas de inmunodiagnóstico diseñadas para el diagnóstico de la tricomonosis en muestras humanas.
a Empleando como antígeno lisado celular. b Inmunofluorescencia directa. c Inmunocromatografía.
La muestra más adecuada para la detección de anticuerpos de exposición a T. vaginalis es el suero, ya que las IgG se encuentran en mayor porcentaje que en el exudado vaginal, donde según algunos estudios, las IgM ni siquiera se detectan (44). Además, el empleo del suero como muestra permite que esta metodología sea apta para el diagnóstico de la infección en ambos sexos (42). Sin embargo, si lo que se pretende es detectar anticuerpos de tipo IgA, isotipo predominante en secreciones seromucosas, el exudado vaginal y endocervical son muestras más apropiadas (45).
Así, el ELISA indirecto es una de las pruebas más específicas y además permite detectar, tanto casos de infección activa, como una exposición a la misma en el pasado. La obtención de péptidos quiméricos en el laboratorio ofrece ventajas adicionales a esta técnica, debido a que evita el riesgo de que se produzcan reacciones cruzadas cuando se emplean lisados del parásito, aumentando así la especificidad (41). Sin embargo, esta metodología sólo es capaz de detectar una infección pasada relativamente reciente, puesto que los niveles de anticuerpos se vuelven indetectables en torno a los 6-12 meses de la infección (14). Asimismo, se trata de una técnica sofisticada que requiere de personal especializado para su realización, además de un equipamiento de laboratorio especial que puede no estar disponible en algunos ámbitos.
Por otro lado, la técnica de ELISA sándwich utiliza anticuerpos específicos de captura inmovilizados sobre la placa de microtitulación, para la detección de antígenos de T. vaginalis. Una vez que esta unión se ha producido, se añade un anticuerpo específico conjugado con una enzima o con biotina (46). Con la adición del sustrato cromógeno, se produce una reacción colorimétrica que es cuantificable, de modo que la absorbancia obtenida es proporcional a la concentración de antígeno en la muestra (38).
Estudios recientes han constatado que este tipo de ELISA posee un 88,9% de sensibilidad y un 97,1% de especificidad en la detección del antígeno de T. vaginalis, usando el cultivo como método de referencia (31). Estos valores ya habían sido definidos en estudios previos, en los que se utilizaron anticuerpos monoclonales para detectar un antígeno de superficie del parásito en muestras de exudado vaginal (47). Sin embargo, es necesario considerar que existe una tasa de falsos positivos del 2,9% al comparar esta prueba con el cultivo de dicho tipo de muestra. Este hecho podría deberse a la detección de trofozoítos no viables en la misma, algo que ocurre con menos frecuencia en el cultivo, por centrarse este fundamentalmente en la identificación de organismos viables con motilidad (31).
3.3. Técnicas de inmunofluorescencia
Las técnicas de inmunofluorescencia se usan preferiblemente para llevar a cabo estudios de investigación, más que como prueba diagnóstica. En los últimos años, se ha utilizado con frecuencia la inmunofluorescencia directa (IFD), empleando como conjugado, anticuerpos monoclonales marcados con fluoróforos para detectar antígenos de T. vaginalis, como la proteína de adhesión AP33 (48). Además, se recurre habitualmente a la IFD para el estudio de las características morfológicas y metabólicas del parásito, tales como, la organización de los microtúbulos utilizando como conjugado anticuerpos anti-tubulina (49). Recientemente, la aplicación de dicha técnica ha permitido evaluar la presencia de Trichomonas vaginalis virus (TVV) en el interior del trofozoíto, mediante la utilización del anticuerpo monoclonal C20A3 dirigido hacia la proteína P270 (50) (Figura 2). Dicha molécula sufre un cambio fenotípico, siendo expresada en la superficie del parásito cuando este presenta TVV (51).
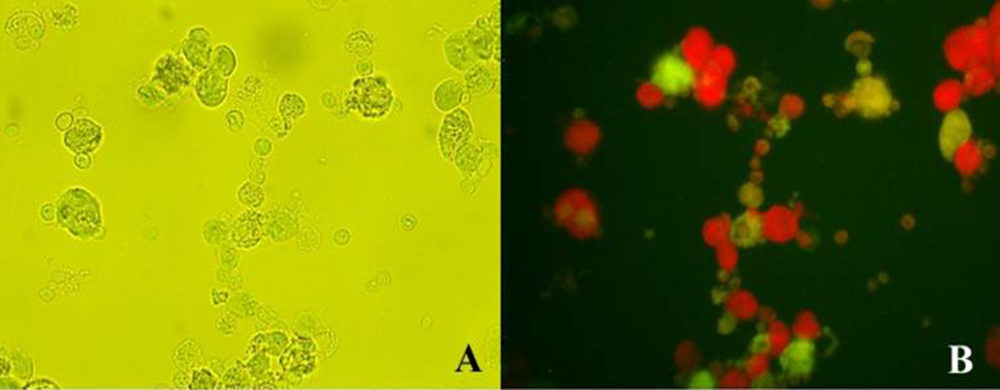
Figura 2. Inmunofluorescencia indirecta de un aislado clínico de Trichomonas vaginalis con presencia de virus. Trofozoítos observados mediante microscopía óptica, 400X (A). Misma muestra observada en el microscopio de fluorescencia, 400X (B). Los trofozoítos TVV+ aparecen de color verde tras ser marcados con el anticuerpo monoclonal C20A3 anti-P270, molécula que se expresa en su superficie. Los parásitos que no contienen TVV aparecen de color rojo, al ser teñidos con Azul de Evans
En el diagnóstico de la tricomonosis, se pueden utilizar también técnicas de tinción fluorescente, empleando por ejemplo el naranja de acridina, que pueden alcanzar valores de sensibilidad del 73,5% según algunos estudios (52). En cuanto a la IFD, se trata de una prueba con una sensibilidad superior a la del examen en fresco, alcanzando valores del 96%. Cabe destacar que estas cifras se alcanzan cuando se utiliza como muestra el exudado vaginal de mujeres infectadas únicamente con este parásito, mientras que si la paciente padece de otras ITS este valor decae hasta el 67% (53).
El uso de técnicas de inmunofluorescencia para el diagnóstico de T. vaginalis puede ofrecer ciertas ventajas, al ser una prueba muy específica y precisa, proporcionando resultados de fácil interpretación. No obstante, disponer de ella como primera opción para el diagnóstico de rutina puede resultar complicado, por ser bastante sofisticada y requerir de un microscopio de fluorescencia, así como de personal capacitado para su manejo. De esta manera, sería más útil para la confirmación de resultados negativos tras un examen microscópico directo de la muestra o la realización de un cultivo, por ejemplo (54).
3.4. Inmunocromatografía
Como se ha mencionado anteriormente, la mayoría de las pruebas POC que se han desarrollado hasta la fecha son de tipo inmunocromatografía. Este es el caso del OSOM® Trichomonas test, un inmunoensayo de flujo lateral capaz de detectar una adhesina de T. vaginalis (55). La sensibilidad de este test es del 83-90%, comparable a la de los NAAT (nucleic acid amplification test), y su especificidad en muestras de exudado vaginal es excelente, siendo esta superior al 98,8% (Tabla 2). Además, se trata de una prueba sencilla de realizar, siendo posible incluso llevarla a cabo en el propio domicilio del paciente (56).
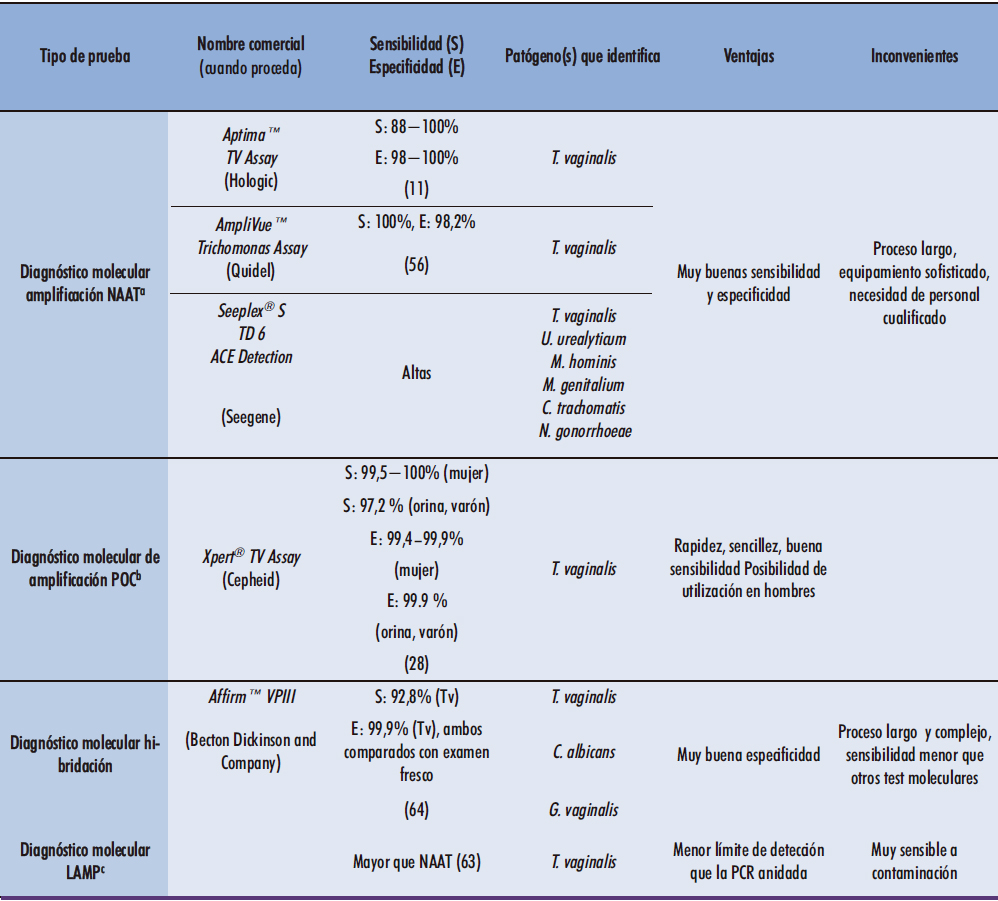
Tabla 2. Ventajas e inconvenientes de las diferentes técnicas de diagnóstico molecular diseñadas para el diagnóstico de Trichomonas vaginalis.
a Nucleic acid amplification test. b Point of care. c Loop mediated isothermal amplification.
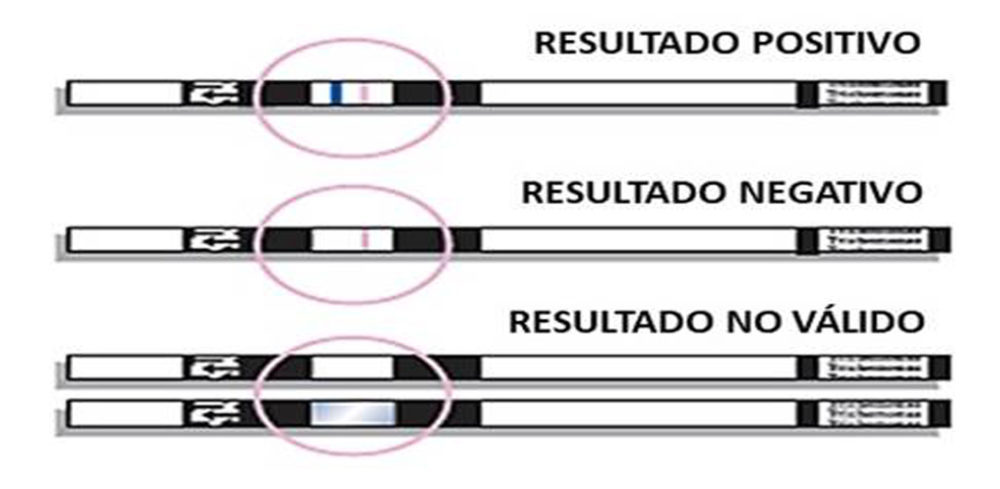
OSOM® Trichomonas test utiliza anticuerpos monoclonales inmovilizados sobre la membrana de nitrocelulosa, que se unen de forma específica al antígeno en cuestión. Esta prueba emplea además otro anticuerpo, conjugado con partículas de color azul, de manera que al formarse el inmunocomplejo, aparece una línea de este color que manifiesta un resultado positivo (Figura 3). Como en cualquier inmunocromatografía, para considerar la prueba válida siempre debe aparecer la línea control, en este caso, de color rojo (57).
Figura 3. Posibles resultados obtenidos con el test de inmunocromatografía OSOM® Trichomonas test (Sekisui Diagnostics) para la detección de antígenos de Trichomonas vaginalis. Fuente: adaptación de la figura propuesta en el Testing Handbook provisto con la prueba diagnóstica.
4. TÉCNICAS DE DIAGNÓSTICO MOLECULAR
Las técnicas moleculares resultan útiles para la detección de aquellos microorganismos que son difíciles de aislar y/o cultivar, y una alternativa esperanzadora para el diagnóstico de aquellos casos en los que la muestra exhibe un escaso número de patógenos (32). Por ello, hoy en día están convirtiéndose en una buena alternativa diagnóstica, debido al aumento de su rapidez y exactitud, así como a su mayor sensibilidad y especificidad (56).
Existen tres tipos de técnicas moleculares: amplificación, hibridación y secuenciación. La última es más empleada en laboratorios de investigación, para identificar y tipificar, mientras que las dos primeras son frecuentemente utilizadas en el diagnóstico de rutina (32). De las tres, la amplificación resulta la mejor opción para el diagnóstico de pacientes asintomáticos, debido a que, en estos casos, las pruebas de hibridación no ofrecen resultados tan satisfactorios (56).
Entre las pruebas diagnósticas que detectan el material genético mediante amplificación, se encuentran los NAAT. Estos muestran una sensibilidad muy alta y, además, no precisan de una etapa de incubación o de conservación del material genético, debido a que no requieren que el microorganismo esté vivo (11). Un ejemplo es Aptima™ TV Assay, prueba que en la actualidad se encuentra aprobada tanto por la FDA (Food Drug Administration), como por la Unión Europea (11). Este ensayo captura el ARNr de T. vaginalis mediante un oligómero específico, para después amplificarlo mediante AMT (amplificación mediada por transcripción). Los amplicones obtenidos se detectan por hibridación con una sonda de ADN marcada por quimioluminiscencia (58). Se trata de una prueba que requiere de personal muy especializado para su realización. No obstante, es muy sensible y específica, con valores del 88-100% y 98-100%, respectivamente (11). Otro ejemplo es AmpliVue™ Trichomonas Assay, prueba que en tan solo 45 minutos obtiene resultados de sensibilidad y especificidad del 100 y 98,2%, respectivamente. En este caso, la técnica de detección es bastante compleja, basada en una amplificación isotérmica dependiente de helicasa, por lo que requiere lisar la preparación e incubarla antes de llevar a cabo la amplificación. La detección es colorimétrica, mediante una técnica de flujo lateral (56).
Existen algunas técnicas de PCR múltiple, como el ensayo Seeplex® Kit PCR assay, capaz de detectar T. vaginalis junto con otros cinco agentes causales de enfermedades genitourinarias: Ureaplasma urealyticum, Mycoplasma hominis, Chlamydia trachomatis y Neisseria gonorrhoeae. En cuanto a lo que se refiere a T. vaginalis, la sensibilidad es bastante alta si se utiliza junto con un método de extracción previo adecuado (59). En numerosas ocasiones, el paciente padece coinfecciones de estos patógenos, por lo que detectar su presencia de forma conjunta puede suponer una reducción en el gasto de reactivos (59).
Volviendo a los test POC, muchos de ellos son pruebas de diagnóstico molecular. Por ejemplo, Xpert® TV Assay se basa en la amplificación del material genético de T. vaginalis. En tan solo 90 minutos y de manera automatizada, este ensayo ofrece resultados con una sensibilidad superior al 99% en el caso de muestras de exudado vaginal y endocervical, y del 97,2-99% para muestras de orina en el hombre (28).
Recientemente, se han desarrollado algunas pruebas de hibridación de ácidos nucleicos (NAH) para el diagnóstico de T. vaginalis. Este tipo de tecnología detecta una secuencia específica del material genético (ADN o ARN) del parásito, utilizando una sonda complementaria a dicha región, la cual se encuentra marcada radiactivamente, con fluoróforos o de manera química, permitiendo así visualizar la hibridación en caso de que se produzca (32). Entre estas pruebas se encuentra Affirm™ VPIII, que permite detectar en un único ensayo el material genético de T. vaginalis, Gardnerella vaginalis y C. albicans, mediante hibridación por sonda (Figura 4). Sin embargo, no es la opción más rápida para el diagnóstico, y tampoco muestra una sensibilidad tan alta como la de otras pruebas moleculares (56).

Figura 4. Resultados y controles del test AffirmTM VPIII (Beckton Dickinson and Company). Fuente: adaptación de la figura propuesta en el Testing Handbook provisto con la prueba diagnóstica.
En resumen, las pruebas NAAT presentan muchas ventajas, sobre todo aquellas que son POC, al combinar la excelente sensibilidad de los métodos de diagnóstico molecular, con la rapidez y facilidad de llevarlos a cabo en cualquier ámbito. Los test de amplificación no requieren conservar la muestra previamente para mantener el parásito viable, por lo que su implantación es una muy buena elección para realizar un diagnóstico rápido y sensible (11). Además, este tipo de técnicas son la mejor opción para el diagnóstico de la tricomonosis en el hombre y permiten incluso la detección de casos asintomáticos. De hecho, ambos grupos engloban a un alto porcentaje de la población afectada y suelen pasar desapercibidos, mostrando dichas pruebas valores de sensibilidad muy buenos (29, 56). Cabe destacar que se obtiene un resultado con mayor rapidez que con las técnicas tradicionales, como es el cultivo y, además, permite utilizar no solamente la orina como muestra, sino también semen y otras secreciones del tracto genital (60). De hecho, se ha demostrado que la combinación de varios tipos de muestra obtenidas en el varón, puede ofrecer mejores valores de sensibilidad (27). Sin embargo, si se decide apostar por una prueba de diagnóstico molecular no POC, la mejor opción es la PCR a tiempo real, la cual no requiere de un procesado post-amplificación, y posee un 90,1% de sensibilidad y hasta un 100% de especificidad (27).
Una metodología de detección molecular más reciente y que ofrece buenos resultados es la técnica LAMP (loop-mediated isothermal amplification). Esta prueba consiste en la amplificación de la región diana deseada, utilizando una ADN polimerasa que trabaja en condiciones isotérmicas, junto con dos parejas distintas de cebadores. La primera pareja señala el sitio de comienzo de la amplificación. La polimerasa desplaza las cadenas a medida que inserta los nuevos nucleótidos en la síntesis, de forma que la cadena molde original queda por encima formando un “loop” o estructura circular de ADN. Este “loop” sirve a su vez como molde para la síntesis, que se inicia gracias a la segunda pareja de cebadores, originando múltiples copias. Dicha reacción cíclica continúa, consiguiéndose un alto número de copias en un corto periodo de tiempo y una excelente selectividad, gracias a la utilización de los dos pares de cebadores que reconocen la región diana en secuencias distintas (61).
La tecnología LAMP puede utilizarse como método de detección del material genético de T. vaginalis. En este caso, la región diana escogida corresponde a la proteína AP65, la cual desempeña una función dual: como adhesina en la unión a las células del hospedador cuando se expresa en la superficie del parásito, o actuando como enzima málica cuando se localiza en el interior de los hidrogenosomas del trofozoíto (62). Este método presenta una especificidad muy buena debido al uso de los cuatro cebadores que reconocen seis secuencias distintas (61), no existiendo reacciones cruzadas con otros microorganismos como C. albicans, Staphylococcus aureus, E. coli o Toxoplasma gondii, al ser la molécula AP65 una proteína específica de este parásito. Su sensibilidad ha sido comparada también con la de otras técnicas moleculares como la PCR anidada, y autores como Li y colaboradores (63) afirman que es incluso superior, aunque sin especificar valores concretos. Por todos estos motivos, el empleo de la tecnología LAMP puede ofrecer muchas ventajas, ya que no es necesario el uso de un termociclador, los resultados pueden revelarse mediante electroforesis, como en una PCR habitual y no se demora más de una hora en presentarlos (61). Sin embargo, esta tecnología también muestra inconvenientes como, por ejemplo, una extrema sensibilidad a la contaminación con otro material genético. Además, algunos componentes como el SYBR-green -utilizado para la cuantificación del producto amplificado-, así como la presencia de restos de sangre, orina o PBS, pueden ejercer un efecto inhibitorio sobre la amplificación (63).
5. CONCLUSIONES
La infección causada por Trichomonas vaginalis es una de las enfermedades de transmisión sexual curables de mayor incidencia en el mundo; sin embargo, las metodologías tradicionales que se usan para su diagnóstico (examen en fresco y cultivo), no son lo suficientemente sensibles y prácticas. Como alternativa, han surgido las pruebas point of care, más adecuadas para llevar a cabo cribados en poblaciones de riesgo, mostrando valores de sensibilidad y especificidad excelentes, siendo además sencillas de realizar. En cuanto a las técnicas inmunoenzimáticas disponibles, el ELISA sándwich posee una sensibilidad y especificidad muy buenas para la detección de antígenos, mientras que el ELISA indirecto resulta excelente para identificar exposiciones previas al parásito y diferenciar una infección activa de una pasada que haya ocurrido recientemente. Con respecto al diagnóstico de la tricomonosis en el varón, la mejor opción son las pruebas moleculares, las cuales permiten detectar casos asintomáticos y son compatibles con el tipo de muestra requerida. En concreto, los test POC de amplificación del material genético son la mejor alternativa para el diagnóstico de la tricomonosis en el hombre. Estos ensayos ofrecen diversas ventajas, como es la utilización de distintos tipos de muestra para poder llevarlos a cabo. Cabe destacar la importancia de aquellas pruebas que son capaces de detectar la presencia de varios patógenos, puesto que es frecuente la existencia de coinfecciones en la población parasitada con T. vaginalis. Si se dispone de un método de extracción adecuado, la mejor elección es el kit de PCR múltiple, capaz de identificar hasta cinco microorganismos distintos, con una buena sensibilidad. Sin embargo, si lo que se requiere es una prueba más rápida y menos laboriosa, conviene apostar por las técnicas de aglutinación, algunas de las cuales permiten además detectar simultáneamente antígenos de Candida spp. junto con los de T. vaginalis.
En definitiva, las nuevas técnicas actualmente disponibles para el diagnóstico de infecciones causadas por T. vaginalis han demostrado ser mejores, tanto en términos de sensibilidad como de rapidez, en comparación con los métodos tradicionales de examen en fresco y cultivo de la muestra. Por esta razón, deberían implementarse en los protocolos para el diagnóstico de esta infección de transmisión sexual, con el objetivo de (i) detectar el mayor número de casos posible de manera precoz, incluyendo a los pacientes asintomáticos y varones, (ii) favorecer un comienzo inmediato en la administración de los tratamientos y, en consecuencia, (iii) evitar el riesgo de sufrir complicaciones derivadas de dicha parasitosis.
Abreviaturas
ADN, ácido desoxirribonucleico; AMT, amplificación mediada por transcripción; ARN, ácido ribonucleico; ARNr, ARN ribosómico; CDC, del inglés, Center for Disease Control and Prevention; ELISA, del inglés, enzyme-linked immunosorbent assay; FDA, del inglés, Federal Drug Administration; IFD, inmunofluorescencia directa; IgA, inmunoglobulina A; IgG, inmunoglobulina G; IgM, inmunoglobulina M; ITS, infección de transmisión sexual; LAMP, del inglés, loop mediated isothermal amplification; NAAT, del inglés, nucleic acid amplification test; NAH, del inglés, nucleic acid hybridization; OMS, Organización Mundial de la Salud; Pap, Papanicolaou; PBS, tampón fosfato salino; PCR, reacción en cadena de la polimerasa; PFOR, piruvato ferredoxin oxidorreductasa; POC, del inglés, point of care; SIDA, síndrome de la inmunodeficiencia adquirida; Tv, Trichomonas vaginalis; TVV, Trichomonas vaginalis virus; TYM, del inglés, tripticase yeast maltose.
Conflicto de intereses
Los autores declaran no tener ningún tipo de relación comercial o haber recibido financiación alguna para la realización del presente artículo de revisión, que pudiera ocasionar un posible conflicto de interés.
6. REFERENCIAS
1. WHO. More than 1 million new curable sexually transmitted infections every day. Geneva (Switzerland): News release; 6 Jun 2019. Acceso: mayo de 2022. Disponible en: https://www.who.int/news/item/06-06-2019-more-than-1-million-new-curable-sexually-transmitted-infections-every-day.
2. Rowley J, Vander Hoorn S, Korenromp E, Low N, Unemo M, Abu-Raddad LJ, Chico RM, Smolak A, Newman L, Gottlieb S, Thwin SS, Broutet N, Taylor MM. Chlamydia, gonorrhoea, trichomoniasis and syphilis: global prevalence and incidence estimates, 2016. Bull World Health Organ. 2019;97:548−562.
3. Menezes CB, Frasson AP, Tasca T. Trichomoniasis – are we giving the deserved attention to the most common non-viral sexually transmitted disease worldwide? Microb Cell. 2016;3:404−419.
4. Wiringa AE, Ness RB, Darville T, Beigi RH, Haggerty CL. Trichomonas vaginalis, endometritis and sequelae among women with clinically suspected pelvic inflammatory disease. Sex Transm Infect. 2020;96:436−438.
5. Ibáñez-Escribano A, Gómez-Barrio A. Trichomonas vaginalis: la versatilidad de un parásito tenaz. An Real Acad Farm. 2017;83:10−47.
6. Schwebke JR, Burgess D. Trichomoniasis. Clin Microbiol Rev. 2004;17:794−803.
7. Tachezy J, Makki A, Hrdý I. The hydrogenosome of Trichomonas vaginalis. J Eukaryot Microbiol. 2022;e12922.
8. Carlton JM, Hirt RP, Silva JC, Delcher AL, Schatz M, Zhao Q, Wortman JR, Bidwell SL, Alsmark UC, Besteiro S, Sicheritz-Ponten T, Noel CJ, Dacks JB, Foster PG, Simillion C, Van de Peer Y, Miranda-Saavedra D, Barton GJ, Westrop GD, Müller S, Johnson PJ. Draft genome sequence of the sexually transmitted pathogen Trichomonas vaginalis. Science. 2007;315:207-212.
9. Figueroa-Angulo EE, Rendón-Gandarilla FJ, Puente-Rivera J, Calla-Choque JS, Cárdenas-Guerra RE, Ortega-López J, Quintas-Granados LI, Alvarez-Sánchez ME, Arroyo R. The effects of environmental factors on the virulence of Trichomonas vaginalis. Microbes Infect. 2012;14:1411−1427.
10. Garber GE, Lemchuk-Favel LT, Rousseau G. Effect of beta-estradiol on production of the cell-detaching factor of Trichomonas vaginalis. J Clin Microbiol. 1991;29:1847−1849.
11. Hobbs MM, Seña AC. Modern diagnosis of Trichomonas vaginalis infection. Sex Transm Infect. 2013;89:434−438.
12. Kissinger PJ, Gaydos CA, Seña AC, Scott-McClelland R, Soper D, Secor WE, Legendre D, Workowski KA, Muzny CA. Diagnosis and management of Trichomonas vaginalis: summary of evidence reviewed for the 2021 centers for disease control and prevention sexually transmitted infections treatment guidelines. Clin Infect Dis. 2022;74(Suppl_2):152−161.
13. Fichorova RN. Impact of T. vaginalis infection on innate immune responses and reproductive outcome. J Reprod Immunol. 2009;83:185−189.
14. Cudmore SL, Delgaty KL, Hayward-McClelland SF, Petrin DP, Garber GE. Treatment of infections caused by metronidazole-resistant Trichomonas vaginalis. Clin Microbiol Rev. 2004;17:783−793.
15. Yadav M, Gupta I, Malla N. Kinetics of immunoglobulin G, M, A and IgG subclass responses in experimental intravaginal trichomoniasis: prominence of IgG1 response. Parasite Immunol. 2005;27:461−467.
16. Imam NF, Eassa AH, Shoeib EY, Abo-Raia GY. Antibody isotypes in urethral swabs of symptomatic and asymptomatic men infected with Trichomonas vaginalis. J Egypt Soc Parasitol. 2007;37:977−988.
17. Allsworth JE, Ratner JA, Peipert JF. Trichomoniasis and other sexually transmitted infections: results from the 2001−2004 National Health and Nutrition Examination Surveys. Sex Transm Dis. 2009;36:738−744.
18. Belfort I, Cunha A, Mendes F, Galvão-Moreira LV, Lemos RG, de Lima Costa LH, Monteiro P, Ferreira MB, Dos Santos G, Costa JL, de Sá Ferreira A, Brito L, Brito L, Vidal F, Monteiro S. Trichomonas vaginalis as a risk factor for human papillomavirus: a study with women undergoing cervical cancer screening in a northeast region of Brazil. BMC Womens Health. 2021;21:174.
19. Sorvillo F, Kerndt P. Trichomonas vaginalis and amplification of HIV-1 transmission. Lancet. 1998;351:213−214.
20. Ngobese B, Singh R, Han KSS, Tinarwo P, Mabaso N, Abbai NS. Detection of metronidazole resistance in Trichomonas vaginalis using uncultured vaginal swabs. Parasitol Res. 2022;121:2421−2432.
21. Kissinger P. Trichomonas vaginalis: a review of epidemiologic, clinical and treatment issues. BMC Infect Dis. 2015;15:307.
22. Koss CA, Baras DC, Lane SD, Aubry L, Marcus M, Markowitz LE, Koumans EH. Investigation of metronidazole use during pregnancy and adverse birth outcomes. Antimicrob Agents Chemother. 2012;56:4800−4805.
23. Marques-Silva M, Lisboa C, Gomes N, Rodrigues AG. Trichomonas vaginalis and growing concern over drug resistance: a systematic review. J Eur Acad Dermatol Venereol. 2021;35:2007−2021.
24. Leitsch D, Janssen BD, Kolarich D, Johnson PJ, Duchêne M. Trichomonas vaginalis flavin reductase 1 and its role in metronidazole resistance. Mol Microbiol. 2014:91:198−208.
25. Lin HC, Chu LJ, Huang PJ, Cheng WH, Zheng YH, Huang CY, Hong SW, Chen LC, Lin HA, Wang JY, Chen RM, Lin WN, Tang P, Huang KY. Proteomic signatures of metronidazole-resistant Trichomonas vaginalis reveal novel proteins associated with drug resistance. Parasit Vectors. 2020;13:274.
26. Muzny CA. Why does Trichomonas vaginalis continue to be a “neglected” sexually transmitted infection?. Clin Infect Dis. 2018;67:218−220.
27. Galán Montemayor JC, Lepe Jiménez JA, Otero Guerra L, Serra Pladevall J, Vázquez Valdés F. Procedimientos en Microbiología Clínica. 24a. Diagnóstico micro¬biológico de las infecciones de transmisión sexual y otras infecciones genitales. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). 2018.
28. Van Gerwen OT, Muzny CA. Recent advances in the epidemiology, diagnosis, and management of Trichomonas vaginalis infection. F1000 Res. 2019;8:1666.
29. Krieger JN. Trichomoniasis in men: old issues and new data. Sex Transm Dis. 1995;22:83−96.
30. Seña AC, Miller WC, Hobbs MM, Schwebke JR, Leone PA, Swygard H, Atashili J, Cohen MS. Trichomonas vaginalis infection in male sexual partners: implications for diagnosis, treatment, and prevention. Clin Infect Dis. 2007;44:13−22.
31. Adjei C, Boateng R, Dompreh A, Okyere B, Owiredu EW. Prevalence and the evaluation of culture, wet mount, and ELISA methods for the diagnosis of Trichomonas vaginalis infection among Ghanaian women using urine and vaginal specimens. Trop Med Health. 2019;47:33.
32. Muralidhar S. Molecular methods in the laboratory diagnosis of sexually transmitted infections. Indian J Sex Transm Dis AIDS. 2015;36:9−17.
33. Adamson PC, Loeffelholz MJ, Klausner JD. Point-of-Care Testing for Sexually Transmitted Infections: A Review of Recent Developments. Arch Pathol Lab Med. 2020;144:1344-1351.
34. Mahmoud A, Sherif NA, Abdella R, El-Genedy AR, El Kateb AY, Askalani AN. Prevalence of Trichomonas vaginalis infection among Egyptian women using culture and latex agglutination: cross-sectional study. BMC Womens Health. 2015;15:7.
35. Adu-Sarkodie Y, Opoku BK, Danso KA, Weiss HA, Mabey D. Comparison of latex agglutination, wet preparation and culture for the detection of Trichomonas vaginalis. Sex Transm Infect. 2004;80:201−203.
36. Darani HY, Ahmadi F, Zabardast N, Yousefi HA, Shirzad H. Development of a latex agglutination test as a simple and rapid method for diagnosis of Trichomonas vaginalis infection. Avicenna J Med Biotechnol. 2010;2:63−66.
37. Yousofi-Darani H, Sharafi S, Heidari M, Poor S, Jafari R, Hosseini S. Diagnosis of vaginal candidiasis and Trichomonas vaginalis infection by antibody coated latex particles. J Adv Med Med Res. 2017;24:1−5.
38. Gan SD, Patel KR. Enzyme immunoassay and enzyme-linked immunosorbent assay. J Invest Dermatol. 2013;133:e12.
39. Kim JH, Moon HS, Kim KS, Hwang HS, Ryu JS, Park SY. Comparison of seropositivity to Trichomonas vaginalis between men with prostatic tumor and normal men. Korean J Parasitol. 2019;57:21−25.
40. Alderete JF, Neace CJ. Identification, characterization, and synthesis of peptide epitopes and a recombinant six-epitope protein for Trichomonas vaginalis serodiagnosis. Immunotargets Ther. 2013;2:91−103.
41. Alderete JF. Advancing prevention of STIs by developing specific serodiagnostic targets: Trichomonas vaginalis as a model. Int J Environ Res Public Health. 2020;17:5783.
42. Alderete JF. Epitopes within recombinant α-actinin protein is serodiagnostic target for Trichomonas vaginalis sexually transmitted infections. Heliyon. 2017;3:e00237.
43. Alderete JF. Recombinant protein of immunogenic metabolic enzyme epitopes of Trichomonas vaginalis are common to humans and microorganisms. Am J Biomed Sci & Res. 2021;13:630−638.
44. Bedair NH, Ali HZ. Comparison of trichomoniasis diagnosis by microscopic methods and indirect ELISA technique in a sample of Iraqi women. Iraqi J Sci. 2020;61:742−748.
45. Street DA, Taylor-Robinson D, Ackers JP, Hanna NF, McMillan A. Evaluation of an enzyme-linked immunosorbent assay for the detection of antibody to Trichomonas vaginalis in sera and vaginal secretions. Br J Vener Dis. 1982;58:330−333.
46. Watt RM, Philip A, Wos SM, Sam GJ. Rapid assay for immunological detection of Trichomonas vaginalis. J Clin Microbiol. 1986;24:551−555.
47. Lisi PJ, Dondero RS, Kwiatkoski D, Spence MR, Rein MF, Alderete JF. Monoclonal-antibody-based enzyme-linked immunosorbent assay for Trichomonas vaginalis. J Clin Microbiol. 1988;26:1684−1686.
48. Zhang Z, Li Y, Wang S, Hao L, Zhu Y, Li H, Song X, Duan Y, Sang Y, Wu P, Li X. The molecular characterization and immunity identification of Trichomonas vaginalis adhesion protein 33 (AP33). Front Microbiol. 2020;11:1433.
49. Juliano C, Rubino S, Zicconi D, Cappuccinelli P. An immunofluorescent study of the microtubule organization in Trichomonas vaginalis using antitubulin antibodies. J Protozool. 1986;33:56−59.
50. Bolumburu C, Zamora V, Muñoz-Algarra M, Portero-Azorín F, Escario JA, Ibáñez-Escribano A. Trichomoniasis in a tertiary hospital of Madrid, Spain (2013−2017): prevalence and pregnancy rate, coinfections, metronidazole resistance, and endosymbiosis. Parasitol Res. 2020;119:1915−1923.
51. Khoshnan A, Alderete JF. Trichomonas vaginalis with a double-stranded RNA virus has upregulated levels of phenotypically variable immunogen mRNA. J Virol. 1994:68:4035-4038.
52. Khatoon R, Jahan N, Ahmad S, Khan HM, Rabbani T. Comparison of four diagnostic techniques for detection of Trichomonas vaginalis infection in females attending tertiary care hospital of North India. Indian J Pathol Microbiol. 2015;58:36−39.
53. Bickley LS, Krisher KK, Punsalang A Jr, Trupei MA, Reichman RC, Menegus MA. Comparison of direct fluorescent antibody, acridine orange, wet mount, and culture for detection of Trichomonas vaginalis in women attending a public sexually transmitted diseases clinic. Sex Transm Dis. 1989;16:127−131.
54. Smith RF. Detection of Trichomonas vaginalis in vaginal specimens by direct immunofluorescence assay. J Clin Microbiol. 1986;24:1107−1108.
55. Alderete JF. Trichomonas vaginalis, reproductive health, and a minority scientist’s experiences. Biol Reprod. 2011;85(Suppl_1):96.
56. Gaydos CA, Klausner JD, Pai NP, Kelly H, Coltart C, Peeling RW. Rapid and point-of-care tests for the diagnosis of Trichomonas vaginalis in women and men. Sex Transm Infect. 2017;93:31−35.
57. Sekisui Diagnostics. Training lesson of OSOM® Trichomonas IFU. Sekisui Diagnostics; 2023. Acceso: mayo de 2023. Disponible en: https://sekisuidiagnostics.com/wp-content/uploads/2023/01/3084-2_OSOM-Trich-181_IFU.pdf.
58. Hologic. Aptima™ Trichomonas vaginalis assay. Hologic; 2017. Acceso: mayo de 2022. Disponible en: https://www.hologic.com/sites/default/files/package-insert/503684-IFU-PI_002_01.pdf.
59. Noh CS, Kim SS, Park SY, Moon HS, Kong Y, Ryu JS. Comparison of two PCR assays for Trichomonas vaginalis. Korean J Parasitol. 2019;57:27−31.
60. Dalimi A, Payameni S. Trichomonas vaginalis infection in men with high-risk sexual behaviors. Iran J Parasitol. 2021;16:411−417.
61. Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, Hase T. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 2000;28:E63.
62. Garcia AF, Alderete J. Characterization of the Trichomonas vaginalis surface-associated AP65 and binding domain interacting with trichomonads and host cells. BMC Microbiol. 2007;7:116.
63. Li Y, Wang S, Li H, Song X, Zhang H, Duan Y, Luo C, Wang B, Ji S, Xie Q, Zhang Z. Development of a convenient detection method for Trichomonas vaginalis based on loop-mediated isothermal amplification targeting adhesion protein 65. BMC Infect Dis. 2020;20:319.
64. Becton Dickinson and Company. Affirm™ VPIII Microbial identification test. Sparks, MD, USA; 2017. Acceso: octubre de 2022. Disponible en: https://www.bd.com/resource.aspx?IDX=14055.