En la Unión Europea (UE) se aplican procedimientos de autorización para incorporar los nuevos medicamentos y sus sucesivas modificaciones en las mismas condiciones en todos los Estados miembros. Sin embargo, la comercialización efectiva de medicamentos presenta diferencias y la armonización pretendida basada en una autorización única y válida para toda la UE, queda, en la práctica, fragmentada por la intervención posterior de los Estados miembros, competentes en materia de precio y reembolso.
La diferencia en la disponibilidad de medicamentos repercute en los pacientes cuando el producto no está comercializado de manera efectiva. España se encontraba en una posición intermedia en la UE, sin embargo, los últimos datos publicados, señalan un claro deterioro en la disponibilidad de nuevos medicamentos, alejándola de países como Alemania, Francia o Italia.
Por otra parte, además de las innovaciones, existe otra tipología de medicamentos con problemas de disponibilidad. Son medicamentos considerados esenciales en terapéutica y que vienen comercializándose desde hace años con una erosión continuada de sus precios, reduciéndose su viabilidad de comercialización. La AEMPS ha calificado en mayo de 2022 como medicamentos estratégicos algunos de estos medicamentos, esenciales desde un punto de vista terapéutico y, a la vez, vulnerables con relación a su suministro.
La intención de este artículo es revisar en las causas que más influyen en la disponibilidad de medicamentos en España y en los cambios que podrían favorecer su mejor acceso, tanto respecto a nuevos medicamentos cómo a medicamentos estratégicos.
Palabras clave: disponibilidad de medicamentos; acceso a medicamentos; medicamentos estratégicos; medicamentos críticos
ABSTRACT:
In the European Union (EU) procedures for the authorization of medicinal products are applied to incorporate new medicinal products and their successive amendments under the same conditions in all Member States. However, the effective marketing of medicinal products differs, and the intended harmonization based on a single authorization valid for the whole EU is fragmented by the subsequent intervention of the Member States responsible for price and reimbursement.
The difference in the availability of medicines affects patients when the product is not effectively marketed. Spain was in an intermediate position in the EU, however, the latest published data indicate a clear deterioration in the availability of new medicines, moving it away from countries such as Germany, France or Italy.
On the other hand, apart from innovations, there is another group of medicines with availability problems. They are medicines considered essential in therapeutics and that have been marketed for years with a continuous erosion of their prices, reducing their marketing viability. The AEMPS has qualified in May 2022 as strategic medicines some of these medicines, essential from a therapeutic point of view and, at the same time, vulnerable in relation to their supply.
The intention of this paper is to revise the causes that most influence the availability of medicines in Spain and the changes that could favor their better access, both with respect to new medicines and strategic medicines.
Keywords: availability of medicine; access to medicines; strategic medicine; critical medicines
1. LOS PROBLEMAS DE ENTRADA. ACCESO A LOS NUEVOS MEDICAMENTOS
1. 1. Una sola autorización de comercialización en la UE
Aunque en la Unión Europea (UE) existen diversos procedimientos para la obtención de la autorización de comercialización de un medicamento, hoy en día la gran mayoría de los medicamentos nuevos e innovadores pasan por el procedimiento de autorización centralizado para ser comercializados, según señala la Agencia Europea de Medicamentos (EMA) (1).
A través del procedimiento centralizado se obtiene una autorización de comercialización válida para toda la UE. De esta manera, los nuevos medicamentos se autorizan a partir de un dictamen (técnico) favorable del Comité de Medicamentos de Uso Humano (CHMP) que se convierte en una decisión (política) de la Comisión Europea, dando así validez a una autorización de comercialización única para todos los estados del Espacio Económico Europeo (2).
Aunque la autorización de comercialización de los medicamentos que constituyen una innovación y que son autorizados a través del procedimiento centralizado empieza a contar a partir de un determinado día (la fecha de notificación que se señala en el Diario Oficial de la UE), la disponibilidad de estos medicamentos dista mucho de ser igual en toda la UE.
1.2. Diferentes velocidades de acceso entre países
El análisis de la disponibilidad de medicamentos en la UE se viene realizando desde 2004 por la consultora IQVIA para la Federación Europea de Asociaciones de la Industria Farmacéutica (EFPIA). Desde hace cuatro años se conoce como W.A.I.T. indicator por sus siglas en inglés (Waiting to Access Innovative Therapies) y es el mayor estudio europeo sobre disponibilidad y tiempo de acceso de los pacientes a medicamentos innovadores. Este informe permite estimar la evolución en la disponibilidad y tiempo de acceso en nuestro país de los nuevos medicamentos autorizados en Europa en los años previos y comparar con los indicadores de los países de nuestro entorno.
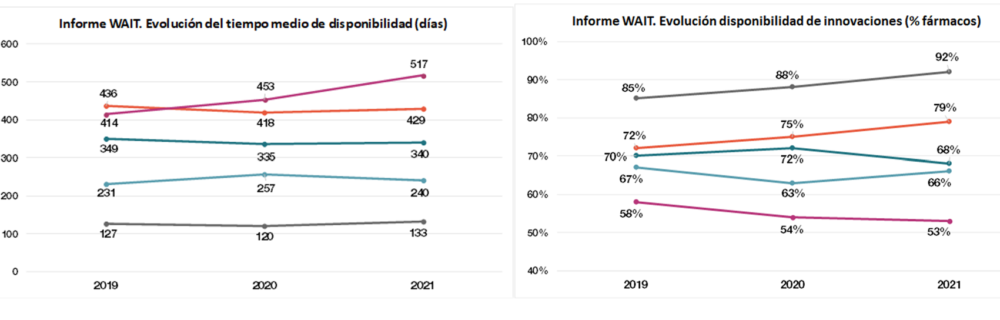
El informe WAIT del 2021 (que analiza los nuevos medicamentos autorizados en Europa en el cuatrienio 2017-2020) (3) confirma el empeoramiento en estos indicadores, que ya fueron negativos para nuestro país en el informe de 2020 (Figura 1). Algunos datos relevantes del informe son los siguientes:
- La disponibilidad en España de los 160 nuevos medicamentos es de un 53% (un punto inferior al informe de 2020 y 5 puntos inferior al de 2019).
- El tiempo medio de acceso se incrementa hasta los 517 días (17 meses), que supone 64 días más respecto a 2020 y 103 respecto a 2019.
- Comparado con los países de nuestro entorno económico (Alemania, Francia, Italia e Inglaterra), en los que el porcentaje de disponibilidad oscila entre el 66% y el 92%, en España se observa un nivel inferior y un empeoramiento en los últimos dos años. El tiempo de acceso en España es también muy superior al de estos cuatro países, que oscila entre los 133 días en Alemania y los 429 en Italia, y la brecha ha aumentado.
- A esta peor disponibilidad y alargamiento de los tiempos se añade el elevado porcentaje de medicamentos que están financiados con restricción en la población candidata a los tratamientos (41% en España) más allá de lo recogido en la ficha técnica autorizada.
- Estos indicadores de acceso también son especialmente negativos en el caso de los medicamentos oncológicos y los medicamentos huérfanos, en los que España está bastante lejos de los países de su entorno e incluso por detrás de Portugal y Grecia.
Figura 1. Evolución de tiempo medio y disponibilidad de innovaciones (% de medicamentos) Fuente: IQVIA, EFPIA Patients WAIT Indicator. Surveys 2019, 2020 y 2021. Nota: Para los tiempos en Francia se ha considerado que muchos de los medicamentos tienen disponibilidad inmediata por acceso temprano (ATU).
Los datos muestran que en comparación con el resto de los países de la UE-5, España empeora en los últimos años tanto en términos de disponibilidad como de tiempo de acceso, a pesar de ser un mercado muy atractivo por su organización y dimensiones.
1.3. Margen de mejora
La situación de entrada y disponibilidad de medicamentos en España, junto con otros aspectos relativos a la financiación de medicamentos y acceso, se han señalado asimismo en una serie de informes de relevancia emitidos por la Autoridad Independiente de Responsabilidad Fiscal (AIReF) (4), la Comisión Nacional de los Mercados y la Competencia (CNMC) (5) o la propia Dirección General de Cartera Común de Servicios del Sistema Nacional de Salud y Farmacia (DGCyF) (6). Como es natural, el foco o las recomendaciones de estos informes es distinto según su autoría, pero no parece estar en discusión la correlación entre las medidas regulatorias que se adopten y la disponibilidad efectiva de medicamentos.
El más reciente de los informes ha sido suscrito por el Comité Asesor para la Financiación de la Prestación Farmacéutica del SNS (CAPF) (7), que hace público un documento de consenso en junio de 2022 titulado: Recomendaciones sobre los criterios y procedimiento para orientar la fijación de precios y la inclusión y exclusión, a la entrada en el mercado o con posterioridad, de un medicamento en la cobertura pública.
Se trata de una relación de criterios que quieren promover un cambio en la forma de establecer la financiación pública y la intervención del precio en los medicamentos que se encuentran en periodo de exclusividad. El informe reconoce que el contenido de algunas de las recomendaciones ya está en marcha en menor o mayor medida, con algunos importantes progresos en algunas de ellas, pero en otras se requiere cambiar y mejorar la situación actual. En todo caso, aboga por un refuerzo de forma progresiva de los equipos técnicos actuales mientras se alcanza el pleno despliegue organizativo (plazo estimado de 2-3 años).
1.4. El pagador hace de regulador
En España, la decisión de financiar un medicamento y, en caso positivo, intervenir su precio requiere del dictamen favorable de la Comisión Interministerial de Precios de los Medicamentos (CIPM).
Aunque al principio esta Comisión estaba exclusivamente constituida por representantes de los distintos ministerios encargados de la sanidad, economía, hacienda e industria, en 2012 se amplió su composición dando acceso a las CCAA (8). Actualmente todas las CCAA están presentes en la CIPM y las decisiones se adoptan en general por consenso. En caso de votación, tres de ellas, rotatoriamente, tienen voto, estando las restantes presentes en calidad de oyentes.
La presencia masiva del principal pagador en la CIPM, es decir, de todas las CCAA, introduce un elemento que podría afectar negativamente a la disponibilidad de las novedades terapéuticas, no tanto porque el pagador proteja un impacto presupuestario derivado de la entrada de un nuevo medicamento -aspecto contemplado entre los criterios previstos en la Ley (Figura 2)-, sino por la dificultad que supone al pagador autonómico actuar como auténtico regulador (que debe mantenerse ajeno a la influencia tanto del productor como del consumidor) abstrayéndose de circunstancias presupuestarias autonómicas y tomando decisiones en un plano superior, para el beneficio del conjunto del país y de los pacientes.
Figura 2. Criterios para la inclusión de medicamentos en la financiación del SNS. Fuente: Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios.
Las propuestas de inclusión/inclusión de los nuevos medicamentos en la prestación farmacéutica del SNS de la CIPM, que son elevadas a la Dirección General de Cartera Común de Servicios del Sistema Nacional de Salud y Farmacia, se publican regularmente en un documento de Acuerdos, disponible en la web del Ministerio de Sanidad (9).
Las razones para proponer la no inclusión de los nuevos medicamentos tienen un redactado que se repite para muchas solicitudes: criterios de racionalización del gasto público destinado a prestación farmacéutica e impacto presupuestario, incertidumbre del valor terapéutico, existencia de alternativas a menor coste de tratamiento.
Aunque cada nuevo medicamento puede ser un caso en sí mismo, el repetitivo uso por la CIPM de los criterios para la no inclusión del medicamento en la prestación pública como la incertidumbre, la existencia de alternativas o la racionalización del gasto público, llevan, en la práctica y sin paliativos, a prolongar el proceso de financiación y precio en España retrasando el acceso y reduciendo la disponibilidad efectiva de medicamentos que sí están al alcance de los profesionales sanitarios y financiados en otros países de nuestro entorno.
2. LOS PROBLEMAS POR LA SALIDA DE MEDICAMENTOS DEL MERCADO
Un medicamento comercializado no está completamente exento de presentar a lo largo de su ciclo de vida un problema de suministro, habida cuenta de las abundantes e impredecibles causas que pueden motivarlo (10), como se indica en la Figura 3.
Figura 3. Principales causas que pueden generar un problema de suministro. Fuente: Elaboración propia a partir del documento: EMA/195884/2022. Guidance for Marketing Authorisation Holders on reporting the set of information for medicinal products included on the lists of critical medicines under the Regulation (EU) 2022/123 (15 JuIio de 2022).
En muchas ocasiones, estos problemas son coyunturales y se subsanan por el laboratorio farmacéutico al cabo de un determinado lapso de tiempo, de manera que la la falta de disponibilidad es meramente temporal.
Sin embargo, existe un grupo de medicamentos que requieren otro tipo de acciones para garantizar su mantenimiento en el mercado. En estos casos, el problema de disponibilidad tiene un componente estructural, muy probablemente relacionado con el precio o las condiciones de reembolso que, entre otras razones, llevan a las empresas a abandonar la comercialización de un medicamento en determinados mercados o en todos ellos.
La viabilidad comercial de un medicamento determina su permanencia en el mercado. Las compañías farmacéuticas, como todas las empresas, deben garantizar la rentabilidad de sus operaciones. Aunque la decisión dependerá de muchos factores, la lógica parece apoyar que, si el precio del producto es bajo y es escaso el volumen de sus ventas, será más complejo mantener su comercialización.
Las consecuencias de la salida del mercado de un medicamento pueden ser poco relevantes para pacientes, profesionales sanitarios y administraciones públicas si el lugar que ocupa dicho medicamento en terapéutica es escasamente relevante o cuenta con alternativas terapéuticas satisfactorias.
Sin embargo, si el medicamento se considera crítico, sin alternativas terapéuticas, la cesación en la comercialización puede suponer un importante problema sanitario.
Aunque el escenario ideal es que los medicamentos originales tengan seguidores genéricos o biosimilares que reduzcan la vulnerabilidad a los problemas de suministro, esto no siempre sucede. Para algunas presentaciones, el medicamento original es el único comercializado puesto que ninguna compañía está interesada en registrar su genérico o biosimilar. Son presentaciones altamente vulnerables puesto que si falla el suministro por el titular de la autorización de comercialización que las comercializa, el medicamento puede dejar de estar disponible en nuestro mercado (11).
2.1. La respuesta de la AEMPS. Los medicamentos estratégicos
Dado que el problema está identificado, está también justificado que la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) adopte iniciativas que frenen la salida de medicamentos de interés sanitario del mercado. La AEMPS ha establecido una nueva calificación de determinados medicamentos, que se denominan medicamentos estratégicos.
La definición de medicamento estratégico, a la espera de ser incorporada en nuestra legislación, se encuentra en la página web de la AEMPS (12) y se reproduce en la Figura 4.
Figura 4. Definiciones de medicamento estratégico. Fuente: AEMPS (mayo de 2022)
Los medicamentos estratégicos son un grupo de medicamentos que cumplen simultáneamente los criterios de criticidad y de vulnerabilidad. El criterio de criticidad deriva de la importancia de la indicación terapéutica objeto del tratamiento. La vulnerabilidad se refiere al riesgo de que se produzca un problema de suministro de una presentación concreta que responda a una determinada descripción clínica de producto, es decir, los casos en que únicamente existan uno o dos medicamentos que tengan el mismo principio activo, dosis, unidad de dosis y forma farmacéutica.
Cuando la Agencia Española de Medicamentos y Productos Sanitarios detalla los criterios de inclusión en el listado de medicamentos estratégicos señala que se han excluido de la relación aquellos medicamentos que, aun cumpliendo los criterios para ser considerados estratégicos, todavía se encuentran en periodo de protección y, por lo tanto, cuentan con otros mecanismos que garantizan su disponibilidad en el mercado.
Para la Agencia Española de Medicamentos y Productos Sanitarios la necesidad de adopción de medidas adicionales regulatorias, económicas o de otra índole se centran en medicamentos en medicamentos clásicos, que han perdido la protección de la exclusividad.
Algunas de estas medidas ya se han materializado. Por ejemplo, en el programa PROFARMA, a la fabricación de principios activos y medicamentos estratégicos o esenciales en España se le otorga una valoración adicional con una horquilla entre 1 y 3 puntos en función del número de principios activos y medicamentos estratégicos o esenciales que fabrique la empresa en España, según listado elaborado o criterios establecidos por la AEMPS (13).
Otras medidas se han anunciado por la AEMPS en algunos foros especializados1 siendo destacables la siguientes: i) facilidades para la presentación de solicitudes de registro para los medicamentos estratégicos asesorando a los laboratorios interesados durante todo el proceso ii) resolución rápida de variaciones para los medicamentos estratégicos autorizados iii) reducción de tasas en la presentación del dossier de registro y sus variaciones y iv) publicación en la página web de la AEMPS de un listado de medicamentos para los que se considere que existe una clara necesidad y para los que sería deseable disponer de nuevas autorizaciones de comercialización, bien por tratarse de medicamentos con problemas de suministro recurrentes o bien por posible suspensión o revocación de las autorizaciones existentes.
La relación de medicamentos estratégicos en su primera actualización, de 21 de julio, comprende 475 descripciones clínicas de producto (principio activo, dosis, unidad de dosis y forma farmacéutica) que contienen 254 principios activos y que se corresponden con 1321 presentaciones autorizadas de medicamentos. El acceso a la información sobre medicamentos estratégicos está disponible en la web de la AEMPS (12) y la Agencia indica que se actualizará regularmente.
2. 2. Medicamentos estratégicos. Mucha relevancia sanitaria y poco peso económico
Aunque no se han implantado todavía propuestas económicas expresas en relación con los medicamentos estratégicos que están incluidos en el Sistema de precios de referencia y quedan impactados por la erosión de los precios que se aplica en la revisión anual, desde la Orden de precios de referencia de 2018 (14), se ha venido aplicando una congelación de precios de terminados medicamentos considerados esenciales en respuesta a “../.. una indeseable situación de desabastecimiento de medicamentos esenciales, no sustituibles por ningún otro de los actualmente financiados por el Sistema ../..”.
Según un análisis de estas presentaciones realizado por Farmaindustria realizado sobre la primera relación de medicamentos estratégicos publicada en mayo de 2022 y con el nomenclátor de dicho mes, de las 1305 presentaciones autorizadas, 419 estarían en el SPR (32%). Pero si consideramos únicamente las presentaciones financiadas (908), el porcentaje en SPR sería del 46%. En otras palabras, menos de la mitad de los medicamentos estratégicos están incluidos en el SPR.
Respecto al peso económico que tienen estos medicamentos, según el análisis efectuado por Farmaindustria de las presentaciones de medicamentos estratégicos sujetas a precios de referencia, éstas suponen aproximadamente un 1% del gasto (0,6% en Oficina de Farmacia; 1,8% en Hospitales).
3. PROPUESTAS PARA INCREMENTAR LA DISPONIBILIDAD DE MEDICAMENTOS
Para evitar un progresivo deterioro del arsenal terapéutico española deberían adoptarse una serie de medidas tendentes, por un lado, a acelerar la entrada de nuevos medicamentos y, por otro, a reducir la salida de medicamentos estratégicos (15).
Algunas organizaciones representativas de profesionales sanitarios, como la Federación de Asociaciones Científico Médicas de España (FACME), han anunciaron en julio de 2022 la constitución de un Grupo de Trabajo sobre Evaluación y Financiación Selectiva de Medicamentos cuyo objetivo es proponer mejoras al sistema de evaluación y toma de decisiones sobre la financiación pública de los fármacos (16).
También diversas organizaciones de pacientes han mostrado su preocupación por el mismo asunto. Por ejemplo, la Federación Española de Enfermedades Raras (FEDER) ha identificado tres necesidades clave: garantizar el acceso, garantizar la equidad y garantizar el acceso en tiempo. FEDER considera que el anteproyecto de Ley sobre garantías y uso de medicamentos constituye, «una oportunidad para garantizar el derecho a tratamiento en Enfermedades Raras» y en este sentido ha presentado sus aportaciones (17).
En relación con el acceso de nuevos medicamentos, Farmaindustria ha propuesto una serie de recomendaciones orientadas a mejorar la situación actual (Figura 5). Estas recomendaciones (15) recogen el sentir de la industria farmacéutica innovadora y además parecen alineadas con las declaraciones de representantes de profesionales sanitarios y pacientes (16, 17).
Figura 5. Principales reformas recomendadas para mejorar el acceso a nuevos medicamentos. Fuente. Farmaindustria.
4. CONCLUSIONES
España es un país atractivo para que las compañías farmacéuticas comercialicen sus novedades terapéuticas y también para que mantengan la comercialización de medicamentos estratégicos. La más amplia disponibilidad de medicamentos autorizados y financiados en nuestro país supone una ventaja para sus profesionales sanitarios al ampliar el espectro de prescripción. También es provechoso para los pacientes, que pueden beneficiarse de estos medicamentos.
Por ello, es imperativo mejorar los actuales procedimientos reglamentarios de acceso de estas novedades terapéuticas. No parece justificado que el acceso a nuevos tratamientos necesarios para los pacientes quede condicionado por diseños burocráticos poco operativos que conllevan retrasos objetivables. Estos retrasos en el acceso son difícilmente justificables en el ámbito sanitario puesto que pueden ser muy perjudiciales en el tratamiento de pacientes concretos.
Igualmente, es necesario adoptar una normativa nacional que proteja la comercialización de los medicamentos estratégicos por su condición de esenciales y vulnerables a los problemas de suministro. Esta regulación debe orientarse a la actualización del precio de financiación, considerando su condición de estratégico de manera que se favorezca la disponibilidad en nuestro país de este tipo de medicamentos.
La anunciada modificación del anteproyecto que modificará la Ley de garantías de medicamentos y productos sanitarios constituye una oportunidad para lograr un necesario cambio de tendencia que contribuya a aumentar la disponibilidad de medicamentos nuevos y de medicamentos estratégicos.
1 Reunión del Grupo de Trabajo de Farmaindustria sobre Regulación Técnica del Medicamento celebrada el 7 de julio de 2022.
5 . REFERENCIAS
1. European Medicines Agency. Authorisation of medicines. Disponible en: (https://www.ema.europa.eu/en/about-us/what-we-do/authorisation-medicines).
2. Unión Europea. Reglamento (CE) n° 726/2004 del Parlamento Europeo y del Consejo de 31 de marzo de 2004 por el que se establecen procedimientos comunitarios para la autorización y el control de los medicamentos de uso humano y veterinario y por el que se crea la Agencia Europea de Medicamentos (Texto pertinente a efectos del EEE). Disponible en: (https://eur-lex.europa.eu/eli/reg/2004/726/oj/spa).
3. IQVIA, EFPIA. Patients WAIT indicator. 2021 Survey. Disponible en: (https://www.efpia.eu/media/636821/efpia-patients-wait-indicator-final.pdf).
4 AIReF. Estudio medicamentos dispensados a través de receta médica. 2019. Disponible en: (https://www.airef.es/wp-content/uploads/2019/06/Estudio2-SR/2019-07-02-P2-corregido.pdf ).
5 CNMC. Estudio sobre el Mercado de Distribución Mayorista de Medicamentos en España. 2022 Disponible en: ( https://www.cnmc.es/sites/default/files/4171318.pdf )
6 Dirección General de Cartera Común de Servicios del Sistema Nacional de Salud y Farmacia. Documento informativo sobre la financiación y fijación de precio de los medicamentos en España. 2022 Disponible en:(https://www.sanidad.gob.es/profesionales/farmacia/pdf/20220526_Doc_Infor_Financiacion_Med_Esp.pdf ).
7 Comité Asesor para la Financiación de la Prestación Farmacéutica del SNS. Recomendaciones sobre los criterios y procedimiento para orientar la fijación de precios y la inclusión y exclusión, a la entrada en el mercado o con posterioridad, de un medicamento en la cobertura pública. 2022 Disponible en:(https://www.sanidad.gob.es/profesionales/farmacia/pdf/20220615_Recoms_Finales_LE2_1LE2_2_CAPF_v15.pdf ).
8 España. Real Decreto 200/2012, de 23 de enero, por el que se desarrolla la estructura orgánica básica del Ministerio de Sanidad, Servicios Sociales e Igualdad y se modifica el Real Decreto 1887/2011, de 30 de diciembre, por el que se establece la estructura orgánica básica de los departamentos ministeriales. BOE núm. 20, de 24 de enero de 2012. Disponible en: (https://www.boe.es/buscar/doc.php?id=BOE-A-2012-1034 ).
9 Ministerio de Sanidad (página de inicio en internet) Comisión Interministerial de precios de medicamentos y productos sanitarios. Disponible en: (https://www.sanidad.gob.es/profesionales/farmacia/CIPMyPS.htm ).
10 European Medicines Agency. Guidance for Marketing Authorisation Holders on reporting the set of information for medicinal products included on the lists of critical medicines under the Regulation (EU) 2022/123. EMA/195884/2022. Pendiente de publicar.
11 Esteve Sala E, Montes Barroso F, Bel Prieto E, et al. Cross-sectional study on medicinal products without commercial interest (MPWCI) in the Spanish market. BMJ Open 2019;9:e023054. doi:10.1136/ bmjopen-2018-023054. Disponible en: (https://bmjopen.bmj.com/content/9/1/e023054 ).
12 AEMPS (página de inicio en internet). Medicamentos estratégicos. 2022. Disponible en: (https://www.aemps.gob.es/medicamentos-de-uso-humano/medicamentos-estrategicos/ ).
13 Secretaría General de Industria y de la PYME (página de inicio en internet), PROFARMA edición 2021 – 2022. Guía de evaluación. Disponible en:(https://www.mincotur.gob.es/PortalAyudas/profarma/Descripcion/Documents/guia-evaluacion-aprobada.pdf ).
14 España. Orden SCB/1244/2018, de 23 de noviembre, por la que se procede a la actualización en 2018 del sistema de precios de referencia de medicamentos en el Sistema Nacional de Salud. Disponible en: (https://www.boe.es/diario_boe/txt.php?id=BOE-A-2018-16150 )
15 Farmaindustria (página de inicio en internet). El acceso a los medicamentos en España: diagnóstico y recomendaciones. 2022. Disponible en: (https://www.farmaindustria.es/web/documento/el-acceso-a-los-medicamentos-en-espana-diagnostico-y-recomendaciones/ )
16 FACME. Nota de prensa. Constituido el Grupo de Trabajo de FACME sobre Evaluación y Financiación Selectiva de Medicamentos. Disponible en: (https://facme.es/wp-content/uploads/2022/07/1-07-2022NdP-Grupo-de-Trabajo-FACME-Medicamentos.pdf)
17 FEDER. Posicionamiento sobre el anteproyecto de Ley sobre garantías y uso de medicamentos. Disponible en: (https://www.enfermedades-raras.org/actualidad/posicionamientos/el-anteproyecto-de-ley-sobre-garantias-y-uso-de-medicamentos-una-oportunidad-para-garantizar-el-derecho-tratamiento-en-enfermedades-raras-segun-feder ).