1. INTRODUCCIÓN
Todas las fases de la vida de los medicamentos se encuentran sujetas a una estrecha regulación normativa debido a la peligrosidad que éstos pueden presentar en caso de derivar de ellos un uso fraudulento o inadecuado. Tanto la investigación, el desarrollo, la autorización, la comercialización que incluye la prescripción y la dispensación y la fase de post-autorización, esto es, la farmacovigilancia de los mismos, se encuentran sujetas a la regulación y a un estrecho control por parte de la Unión Europea, mediante la Agencia Europea del Medicamento y, en el ámbito nacional, mediante la Agencia Española de Medicamentos y Productos Sanitarios.
El presente trabajo se centrará en la post-autorización, puesto que, es en este momento en el cuál se inicia la evaluación de las cuestiones de índole económica y política, como la decisión de la financiación pública -es decir, inclusión de medicamento en la prestación farmacéutica de la Seguridad Social-, y fijación del precio de financiación del medicamento con cargo a fondos estatales afectos a sanidad o de la Seguridad Social, que son realizadas en cada uno de los Estados miembros -tal y como se analizará sucintamente en el apartado 14 del presente trabajo-, y en España corresponden al Ministerio con competencias en sanidad.
El presente trabajo de investigación se centrará en la fase previa a la comercialización, en la cuál se fija el precio del medicamento y la relevancia de esta intervención administrativa y cómo afecta al acto de dispensación de medicamentos industriales.
El acto de dispensación es la acción llevada a cabo por el farmacéutico durante la cuál éste transmite al usuario información sobre la forma de administración de la medicación, los riesgos del incumplimiento de las pautas, su forma de conservación, además de las precauciones especiales a adoptar en casos especiales (v.gr. pacientes polimedicados o embarazadas). En definitiva, el farmacéutico deberá velar por el cumplimiento de las pautas establecidas por el médico y el correcto uso del medicamento. Este profesional garantiza una accesibilidad al medicamento informada, segura y de calidad.
Es preciso destacar que no se trata de una mera entrega de medicamentos, sino que el farmacéutico proporciona información destinada al uso racional de los medicamentos, a través de la dispensación informada. Siguiendo a Sánchez-Caro y Abellán es preciso destacar que la dispensación es un «acto sanitario complejo», que debe ir acompañado de los calificativos de activa e informada, en el que el farmacéutico es el facultativo responsable del proceso, bien ejerciendo un papel activo, o bien, como supervisor del mismo (1). Así pues, en el presente trabajo se pretende analizar la relevancia de la intervención administrativa sobre el precio de los medicamentos industriales en la dispensación de los mismos.
En España, la mayor parte de los medicamentos se encuentran financiados total o parcialmente por el Sistema Nacional de Salud, el cuál se encuentra cubriendo las prestaciones farmacéuticas garantizando el derecho a la salud y el derecho a los medicamentos de los ciudadanos, tal y como se analizará normativamente a continuación.
2. DERECHO A LA SALUD Y A LOS MEDICAMENTOS
Según la Organización Mundial de la Salud, el acceso a los medicamentos esta reconocido como un derecho fundamental de todo ser humano. A pesar de que no existe ningún acuerdo ni declaración política de carácter internacional que reconozca expresamente el derecho de toda persona a acceder a los medicamentos, cabe entender que este derecho se infiere del derecho a la vida y del derecho a la salud, puesto que, el medicamento constituye un aspecto esencial de ambos derechos. Tal y como afirma Bombillar Sáenz, «el medicamento se configura como un instrumento de la política sanitaria de los Estados, a través del cual se hace efectivo el derecho a la protección de la salud, pues contribuye a prevenir, curar o aliviar enfermedades y a corregir o reparar las secuelas provocadas por éstas» (2).
Tomando como referencia el derecho a la salud, debe señalarse que este último es objeto de reconocimiento explícito en el preámbulo del Tratado Constitutivo de la OMS, en vigor desde el 7 de abril de 1948, establece el derecho de toda persona a «disfrutar el nivel más elevado posible de salud» (3). Un principio rector que, resulta acorde con todas las Declaraciones Internacionales que directa o indirectamente también se refieren a la protección del derecho a la salud: la Declaración Internacional de Derechos Humanos, la Declaración de los Derechos del Niño, el Pacto Internacional de Derechos Civiles y Políticos.
En el ordenamiento jurídico de la Unión Europea, el derecho a la salud se encuentra regulado en el artículo 1 del Tratado de Funcionamiento de la Unión Europea establece que
«se garantizará un alto nivel de protección de la salud humana». Esta misma redacción se encuentra en el artículo 152.1 del Tratado por el que se establece una Constitución para Europa (2004), aunque esta nunca llegó a entrar en vigor. Asimismo, la Carta Social Europea, establecida en Turín el 18 de octubre de 1961, dispone que «todas las personas tienen el derecho a beneficiarse de todas las medidas que permitan disfrutar mejor estado de salud que puedan obtener» (4).
Además, la Unión Europea firma, en Estrasburgo el 12 de diciembre de 2007, la Carta de los Derechos Fundamentales de la Unión Europea, cuyo artículo 35, afirma que: «toda persona tiene derecho a acceder a la prevención sanitaria y a beneficiarse de la atención sanitaria en las condiciones establecidas por las legislaciones y prácticas nacionales. Al definirse y ejecutarse todas las políticas y acciones de la Unión se garantizará un nivel elevado de protección de la salud humana» (5).
Siguiendo a Aparicio y Barceló, el reconocimiento del derecho a la protección de la salud en la esfera internacional «pone de relieve la importancia que ha adquirido la protección de la salud en los sistemas occidentales» (6). No obstante, tal y como afirma el Tribunal Europeo de Derechos Humanos en el asunto «Vo c. Francia de 8 de julio de 2004», «resulta evidente que los intereses generales y públicos, vinculados a la promoción y garantía del derecho a la salud, son intereses asociados a la defensa de bienes constitucionales» (7).
Así pues, en el ordenamiento jurídico nacional, la Constitución Española (en adelante, CE) garantiza el derecho a la salud en su artículo 43 (8). Además, en la CE, se establece que es competencia de los poderes públicos organizar y tutelar la salud pública a través de medidas preventivas y de las prestaciones y servicios necesarios (8). De dicho precepto se ha derivado, tal y como ha sido puesto de relieve por la doctrina, la consideración de la sanidad como servicio público que supone, en palabras de Bemejo Latre, «garantizar la observancia de determinados derechos individuales, en concreto, de todos aquellos que hacen nacer una obligación de prestación para la Administración pública» (9), entre las garantías que se incluyen se encuentra el acceso a medicamentos seguros, eficaces y de calidad dispensados y prescritos por profesionales sanitarios debidamente cualificados para ello.
Siguiendo a Escribano Collado el derecho a la salud comprende «el derecho individual que se ostenta frente al Estado, a fin de obtener una acción positiva de éste dirigida a la efectiva satisfacción de la salud individual por encima de las posibilidades personales del sujeto» (10).
Para Pemán Gavín afirma que «el derecho a la salud se proyecta en tres direcciones (…): a) Como derecho de todo ciudadano a las prestaciones sanitarias del Estado; (…) b) Como posición subjetiva en relación con la actividad desarrollada por los poderes públicos para proteger la salubridad pública; c) Como derecho de cada persona a que su propia salud no se vea amenazada ni dañada por acciones externas realizadas por cualquier sujeto público o privado. El derecho a la salud se comporta aquí como un derecho absoluto o de exclusión, oponible erga omnes: un derecho de la persona sobre un aspecto o cualidad propio defendible frente a todos» (11).
En esta misma línea, Loperena Rota afirma que «se habla de derecho subjetivo a la protección de la salud y de salud pública como sistema prestacional y resultado de la actividad administrativa. La expresión salud pública atañe tanto a las medidas preventivas como a las asistenciales» (12).
El desarrollo reglamentario del derecho a la protección de la salud en España, ha sido llevado a cabo, entre otras, por las siguientes normas: Ley 14/ 1986, de 25 de abril, General de Sanidad; Ley 33/2011, de 4 de octubre, General de Salud Pública; Ley 25/1990, de 20 de diciembre, del Medicamento, derogado por la Ley de Garantías y Uso Racional de Medicamentos y Productos Sanitarios, a su vez, derogada por el Texto Refundido por el que se aprueba la Ley de Garantías y Uso Racional de Medicamentos y Productos Sanitarios; Ley 15/1997, de 25 de abril, sobre habilitación de nuevas formas de gestión del Sistema Nacional de Salud; Ley 16/2003, de cohesión y calidad del Sistema Nacional de Salud; Real Decreto 1030/2006, de 15 de septiembre, sobre la cartera de servicios comunes de SNS y el procedimiento para su actualización; Real Decreto-ley 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad de Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones; Real Decreto 1192/2012, de 3 de agosto, por el que se regula la condición de asegurado y de beneficiario a efectos de la asistencia sanitaria en España, con cargo a fondos públicos, a través del Sistema Nacional de Salud.
Así pues, en todas las normas que desarrollan el derecho constitucional a la salud ut supra citadas, encontramos un denominador común, puesto que, en ellas se hace referencia a la intervención administrativa del medicamento con respecto al tema que nos ocupa: la financiación y la prestación farmacéutica de los mismos. Este hecho se debe a que, la esfera económica que rodea al medicamento afecta directa o indirectamente en el denominado «derecho a la salud» que venimos describiendo.
En conclusión, el derecho a los medicamentos se engloba dentro del principio constitucional de «derecho a la salud», que se hace efectivo a través del Sistema Nacional de Salud.
3. SISTEMA NACIONAL DE SALUD EN ESPAÑA COMO GARANTÍA DE LA PROTECCIÓN DE LA SALUD
El Sistema Nacional de Salud (en adelante SNS) es el modelo sanitario implantado en España para la garantía de la protección de la salud. Este se caracteriza como universal, gratuito y financiado a través de los impuestos. Su política se orienta a la garantía de atención a todas las personas y persigue la superación de los desequilibrios territoriales y sociales (13).
El SNS se organiza funcionalmente en dos niveles asistenciales, complementarios y corresponsables de la atención al ciudadano, tanto sano como si padece alguna enfermedad (14). Está formado por el conjunto coordinado de los Servicios de Salud de la Administración del Estado y los Servicios de Salud de las Comunidades Autónomas (en adelante CC.AA.) que integra todas las funciones y prestaciones sanitarias que, de acuerdo con la ley, son responsabilidad de los poderes públicos.
La Ley 14/1986, de 25 de abril, General de Sanidad en su artículo 50 establece que «en cada Comunidad Autónoma se constituirá un servicio de salud integrado por todos los centros, servicios y establecimientos de la propia Comunidad, Diputaciones, Ayuntamientos y cualesquiera otras Administraciones territoriales intracomunitarias, que estará gestionado, (…), bajo la responsabilidad de la respectiva Comunidad Autónoma» (15). Este precepto se basa en el artículo 148.1.21ª CE, el cuál permite asumir a las comunidades autónomas competencias en materia de sanidad e higiene.
Además, siguiendo al profesor Pérez Gálvez, «no sólo se asumen competencias por transferencia o delegación, sino también por ausencia expresa de reserva legal en relación con determinadas decisiones o actuaciones públicas» (16).
Si bien es cierto que, puede parecer contradictorio el hecho de que se permita asumir a las CCAA todas las competencias sobre la materia sanitaria, ya que, el Estado – tal y como se ha analizado en el segundo apartado del presente trabajo-, ostenta títulos competenciales que le permiten incidir sobre esta de manera significativa. Por ello, es preciso destacar que, como afirma la Sentencia del Tribunal Constitucional 98/2004, la legislación estatal debe garantizar: « [una] uniformidad mínima en las condiciones de acceso a los medicamentos con independencia del lugar en el que dentro del territorio nacional se resida y se evita la introducción de factores de desigualdad en la protección básica de la salud. Sin embargo, esa necesaria uniformidad mínima, que corresponde establecer al Estado, asegurando así un nivel mínimo homogéneo o nivel de suficiencia de las prestaciones sanitarias públicas, puede ser susceptible de mejora, en su caso, por parte de las Comunidades Autónomas, en virtud de su competencia sustantiva y de su autonomía financiera Partiendo del carácter básico de la materia en cuestión dentro del marco normativo que regula la sanidad, forzosamente se ha de afirmar que es al Estado al que corresponde su regulación, en tanto que el art. 149.1.16 le otorga la competencia exclusiva sobre las “bases y coordinación general de la sanidad”» (17).
Es decir, corresponde al Estado garantizar una «uniformidad necesaria», asegurando así un nivel mínimo homogéneo o nivel de suficiencia de las prestaciones sanitarias públicas, pero este puede ser susceptible de mejora, en su caso, por parte de las Comunidades Autónomas, en virtud de su competencia sustantiva y de su autonomía financiera (8).
En virtud de la colaboración entre las competencias estatales y las autonómicas, el SNS ha desarrollado una estructura experta, cercana al ciudadano, que actúa como gestor de sus intereses en el complejo mundo de la salud y la enfermedad y que pone un gran énfasis en preservar la primera (18). Por ello, se observa que, informes como el de la compañía de software financiero, Bloomberg en 2019 sitúa al SNS como el más eficiente de Europa y el tercero del mundo, (por detrás de los sistemas sanitarios de Hong Kong y Singapur) (19).
La gran mayoría de personas residentes en España son beneficiarios de las prestaciones del SNS. Existen tres tipos de beneficiarios del SNS de acuerdo con el Real Decreto 1192/2012, de 3 de agosto, por el que se regula la condición de asegurado y de beneficiario a efectos de la asistencia sanitaria en España, con cargo a fondos públicos, a través del SNS. En primer lugar, aquellos que adquieren tal condición por derecho propio: trabajadores por cuenta ajena afiliados y en alta o situación asimilada; los pensionistas y los que sin tal carácter estén en goce de prestaciones periódicas incluidos los preceptores de prestaciones complementarias por terminación del subsidio de desempleo.
En segundo lugar, los que adquieren la condición de beneficiario de la asistencia sanitaria pública por derecho derivado: los familiares a cargo de los anteriores (cónyuge, la persona que conviva habitualmente con el titular, al menos con un año de antelación a la fecha de la solicitud, así como los hijos de ésta, descendientes, hijos adoptivos y hermanos del titular o de su cónyuge, excepcionalmente los acogidos de hecho, los ascendientes del titular y de su cónyuge así como los cónyuges de tales ascendientes por ulteriores nupcias). Todos ellos han de convivir con el titular y estar a su cargo, no percibir ingresos superiores al doble del salario mínimo interprofesional y no tener derecho a esa prestación por título distinto.
Por último, otros beneficiarios, como son: los emigrantes españoles que, en sus estancias temporales en España o al retornar definitivamente, suscriban un convenio de asistencia sanitaria, por no tener derecho a la misma por otro concepto; los separados/as y divorciados/as que, en la fecha de efectos de la separación o del divorcio, figuren en la cartilla de su cónyuge, siempre que no tengan derecho a la prestación de asistencia sanitaria por otro concepto; los huérfanos absolutos y los descendientes y hermanos de trabajadores o pensionistas; y, a las personas sin recursos suficientes (20).
Las cifras ofrecidas por el Instituto Nacional de Estadística, a 1 de enero de 2019, afirman que residen en España 46.937.060 personas. Los datos de población cuya asistencia sanitaria está financiada con dinero público según la Comunidad Autónoma del mismo año son: Andalucía (8.067.641), Aragón (1.302.536), Principado de Asturias (1.009.405), Islas Baleares (1.124.434), Canarias (2.022.990), Cantabria (564.578), Castilla y León (2.310.326), Castilla-La Mancha (1.928.409), Cataluña (7.209.969), Comunidad Valenciana (4.683.417), Extremadura (1.030.348) Galicia (2.618.133), Comunidad de Madrid (6.572.538), Región de Murcia (1.460.767), Comunidad Foral de Navarra (635.999), País Vasco (2.206.928), La Rioja (309.648), Ceuta (75.172), Melilla (73.958). En total en España, la suma de los últimos datos disponibles de 2019, España posee 46.281.909 personas beneficiarias del SNS, en este dato se incluye el colectivo de MUFACE (Mutualidad General de Funcionarios Civiles del Estado) y los mutualistas de ISFAS (Instituto Social de las Fuerzas Armadas) y MUGEJU (Mutualidad General Judicial) (20). En base a estos datos, la tasa de beneficiarios del SNS es de un 98,60% del total de residentes en España.
Siguiendo a Basante Pol y Del Castillo Rodríguez, la creación del SNS «tal vez ha sido uno de los [grandes] logros de nuestro Estado de Bienestar» (21) , ya que, el SNS desarrolla actividades preventivas, diagnósticas, terapéuticas, y rehabilitadoras tanto de promoción como de mantenimiento de la salud. Para la realización de tales actividades, el Real Decreto-ley 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones, regula las cuatro carteras de servicios del SNS.
La primera es, la «cartera común básica de servicios asistenciales», que comprende todas las actividades asistenciales de prevención, diagnóstico, tratamiento y rehabilitación que se realicen en centros sanitarios o sociosanitarios, así como el transporte sanitario urgente, cubiertos de forma completa por financiación pública.
La segunda es la «cartera común suplementaria», que incluye todas aquellas prestaciones cuya provisión se realiza mediante dispensación ambulatoria y están sujetas a aportación del usuario, es decir, la prestación farmacéutica, ortoprotésica y de productos dietéticos.
La tercera es la denominada «cartera común de servicios accesorios», que incluye todas aquellas actividades, servicios o técnicas, sin carácter de prestación, que no se consideran esenciales y/o que son coadyuvantes o de apoyo para la mejora de una patología de carácter crónico, estando sujetas a aportación y/o reembolso por parte del usuario.
Por último, se encuentra la «cartera de servicios complementaria de las CCAA», puesto que, éstas en el ámbito de sus competencias, podrán aprobar sus respectivas carteras de servicios que incluirán, cuando menos, la cartera común de servicios del SNS en sus modalidades básica de servicios asistenciales, suplementaria y de servicios accesorios, garantizándose a todos los usuarios del mismo.
Así pues, es de especial relevancia para el objeto del presente trabajo la «cartera común suplementaria», concretamente la prestación farmacéutica. Puesto que, de conformidad con el artículo 91.1 del Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios «se reconoce el derecho de todos los ciudadanos a obtener medicamentos en condiciones de igualdad en todo el Sistema Nacional de Salud, sin perjuicio de las medidas tendentes a racionalizar la prescripción y la utilización de medicamentos y productos sanitarios que puedan adoptar las comunidades autónomas en ejercicio de sus competencias» (22). Este derecho se hace efectivo, entre otros establecimientos, por las oficinas de farmacia. En España hay de media una farmacia por cada 2.118 habitantes. Melilla y Ceuta son las comunidades que por farmacia tienen mayor número de habitantes (3.599 y 3.548 respectivamente), mientras que en Navarra y Castilla y León la población por farmacia es menor (1.072 y 1.251) (23). Mediante estas se presta un servicio continuado de atención a los pacientes por profesionales sanitarios, así como se garantiza un abastecimiento adecuado de medicamentos a la población.
4. FINANCIACIÓN DEL SISTEMA SANITARIO PÚBLICO ESPAÑOL
El acceso universal a los servicios sanitarios públicos se encuentra establecido como una prestación no contributiva en especie del Régimen de la Seguridad social de acuerdo con el artículo 109.3 b) del Real Decreto Legislativo 8/2015, de 30 de octubre, por el que se aprueba el texto refundido de la Ley General de la Seguridad Social (24).
La ausencia del pago de cotizaciones, cuotas o primas sanitarias aboca a una necesaria financiación del sistema sanitario público español mediante ingresos de naturaleza tributaria, fundamentalmente impuestos. Los impuestos, en el artículo 2.2 c), de la Ley 58/2003, de 17 de diciembre, General Tributaria, se definen como «los tributos exigidos sin contraprestación cuyo hecho imponible está constituido por negocios, actos o hechos que ponen de manifiesto la capacidad económica del contribuyente» (25).
En el caso del SNS se considera que el acceso y la promoción de la salud es lo que en términos económicos se entiende como un «servicio preferente para la sociedad» y, por tanto, la financiación de tales prestaciones debe de ir vinculada al principio de capacidad de pago en lugar de al principio del beneficio (26).
El principio de capacidad de pago se encuentra regulado en el artículo 31.1 de la Constitución, «todos contribuirán al sostenimiento de los gastos públicos de acuerdo con su capacidad económica mediante un sistema tributario justo inspirado en los principios de igualdad y progresividad que, en ningún caso, tendrá alcance confiscatorio», mientras que su apartado segundo dispone que «el gasto público realizará una asignación equitativa de los recursos públicos, y su programación y ejecución responderán a los criterios de eficiencia y economía» (8).
Por ello, la financiación gestionar el SNS en su territorio se encuentra regulado por el presupuesto que cada una de las CCAA tenga asignado para su territorio. Además, las CCAA poseen la capacidad de recaudar ciertos impuestos con los que pueden financiar los gastos en sanidad. Es preciso mencionar que, el Estado cuenta con un fondo que sirve para compensar a las autonomías que no disponen de suficiente presupuesto para hacerse cargo del gasto sanitario, tal y como se analizará en el apartado nueve, para el caso de la crisis sanitaria provocada por el nuevo virus SARS-CoV-2.
Frente a este sistema de financiación del SNS mediante el recurso a los ingresos del Estado de naturaleza tributaria con carácter de impuesto, surge el copago, como doble vía de la financiación del gasto en medicamentos, pues a la misma vez que la Administración paga parte del gasto, el usuario paga otra parte del medicamento. El copago se analizará en el apartado seis y tiene dos finalidades principales: disminuir el gasto público y reducir el consumo innecesario de medicamentos.
Los medicamentos constituyen el segundo componente del gasto público en concepto de sanidad. La industria farmacéutica agrupa un número de empresas importante que ha conseguido mantener su capacidad de empleo, nivel de competitividad y altas cifras de exportación. La financiación de la investigación representa una partida muy importante de los presupuestos del Estado.
Por ello, en España, al igual que en la mayor parte de países de la Unión Europea, se produce la intervención por parte de las autoridades nacionales directamente por la fijación del precio mediante la introducción de listas selectivas o negativas que excluyen del sistema a algunos productos, o, finalmente, efectúan un control directo o indirecto de las ganancias de los fabricantes.
El antecedente histórico de la regulación de los precios de medicamentos se encuentra en las Ordenanzas de Farmacia de 1860, que establecieron tarifas para los medicamentos, que procuren la satisfacción y motivación del farmacéutico y el reconocimiento a su trabajo y, simultáneamente, no se produjese un lucro excesivo sobre los medicamentos.
En España fue confirmado el principio de intervención administrativa en materia de precios de las especialidades farmacéuticas en la Ley de Bases de Sanidad Nacional de 25 de noviembre de 1944; posteriormente, el Decreto 2464/1963, de 10 de agosto, ordena el procedimiento para la fijación inicial de los precios en el momento del registro o en las modificaciones siguientes, y el Decreto 1416/1973, de 10 de mayo, que regula el Registro Farmacéutico. Actualmente se utiliza en el sistema de fijación del precio del medicamento tal y como se analizará en el próximo apartado del presente trabajo (27).
5. INTERVENCIÓN ADMINISTRATIVA SOBRE LOS PRECIOS DE LOS MEDICAMENTOS INDUSTRIALES
El régimen general de fijación de precios industriales de los medicamentos industriales se incluye dentro de las competencias exclusivas del Estado recogidas en el artículo 149.1.16ª CE (8).
Siguiendo a Rovira Forns, J., Gómez Pajuelo, P. y del Llano Señarís afirman evidente que las razones que han motivado a lo largo de los últimos años que España ejerza un control administrativo sobre los precios de los medicamentos son: la incapacidad o inadecuación del mecanismo de mercado para garantizar los objetivos últimos de eficiencia y equidad; los diversos fallos de mercado que caracterizan este sector, así como el carácter inelástico de la demanda (limitada sensibilidad al precio) y sus características oligopolísticas; la clasificación de sus productos como de primera necesidad; y, su elevada incidencia en el gasto público (28).
5.1. Intervención administrativa sobre los precios de los medicamentos industriales
Los precios de los medicamentos autorizados en España pueden clasificarse en función de si se encuentran financiados por el SNS o no. Asimismo, también pueden clasificarse en función del procedimiento de fijación del precio tres categorías. En primer lugar, aquellos que se encuentra intervenidos por el órgano competente. En segundo lugar, aquellos que únicamente se encuentran notificados. Estos son los que el titular de la autorización de comercialización propone al ministerio con competencias en sanidad el precio mediante una notificación y lo puede aplicar siempre que haya sido autorizado. Por último, aquellos que tienen un precio libre, los cuales el titular de la autorización de comercialización los establece y modifica según su criterio, es decir, medicamentos no financiables por el SNS.
A continuación, se explicará el procedimiento de fijación del precio en función de si se encuentran financiados o no.
5.1.1 Medicamentos financiados
El régimen general de fijación de precios de medicamentos de fabricación industrial, financiados con cargo a los fondos de la seguridad social o a fondos estatales afectos a la sanidad es establecido por el gobierno.
De acuerdo con el artículo 94, del Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, corresponde al Gobierno establecer los criterios y procedimiento para la fijación de precios de medicamentos y productos sanitarios financiables por el Sistema Nacional de Salud, tanto para los medicamentos de dispensación por oficina de farmacia a través de receta oficial, como para los medicamentos de ámbito hospitalario, incluidos los envases clínicos, o dispensados por servicios de farmacia a pacientes no ingresados (22).
La inclusión de medicamentos en la financiación del Sistema Nacional de Salud se posibilita mediante la financiación selectiva y no indiscriminada teniendo en cuenta criterios generales, objetivos y publicados y, concretamente que se analizarán a continuación(22).
Dentro de esta categoría existe un subgrupo que se constituye por aquellos medicamentos que únicamente son financiados para determinados colectivos (v. gr., las personas afectadas por el síndrome tóxico), o bien, en determinadas indicaciones terapéuticas.
5.1.2. Medicamentos no financiados
Dentro de esta categoría distinguiremos tres tipos: aquellos medicamentos financiables no financiados; aquellos medicamentos excluidos de la financiación; y, aquellos de precio libre.
5.1.2.1. Medicamentos financiables no financiados
De acuerdo con el artículo 92.1, del Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, Para la financiación pública de los medicamentos y productos sanitarios será necesaria su inclusión en la prestación farmacéutica mediante la correspondiente resolución expresa de la unidad responsable del Ministerio de Sanidad, Servicios Sociales e Igualdad, estableciendo las condiciones de financiación y precio en el ámbito del Sistema Nacional de Salud (22).
Del mismo modo se procederá cuando se produzca una modificación de la autorización que afecte al contenido de la prestación farmacéutica, con carácter previo a la puesta en el mercado del producto modificado, bien por afectar la modificación a las indicaciones del medicamento, bien porque, sin afectarlas, la Agencia Española de Medicamentos y Productos Sanitarios así lo acuerde por razones de interés público o defensa de la salud o seguridad de las personas. Asimismo, también se requiere la notificación a las Administraciones sanitarias pertinentes de las variaciones en el PVP de los medicamentos.
5.1.2.2. Medicamentos excluidos de la financiación
El artículo 93.2 del Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, establece que los responsables de los productos excluidos de la financiación comunicarán al órgano competente los precios a los que van a comercializar dichos medicamentos. La misma obligación se extiende a las variaciones en los precios.
Así pues, en el mes siguiente a la entrada en el registro del órgano competente de las comunicaciones a las que se refiere el apartado anterior, éste resolverá sobre su conformidad o no a los precios propuestos. En caso de disconformidad, dicho órgano elevará la discrepancia a la CIMP, la cual resolverá sobre dicha cuestión y en tanto en cuanto se mantenga la disconformidad mencionada en el apartado anterior, se mantendrá la vigencia del precio industrial máximo.
La resolución final será notificada al laboratorio titular de la administración, a través de resolución motivada de la CIPM. La motivación debe estar fundamentada en a) la protección de la salud pública; b) la igualdad de acceso a los medicamentos por parte de los pacientes; o bien, c) en una lesión real o potencial de los intereses de colectivos desfavorecidos (22).
5.1.2.3. Medicamentos de precio libre
La disposición transitoria tercera del Real Decreto-ley 16/2012, de 20 de abril de medidas urgentes para garantizar la sostenibilidad del SNS y mejorar la calidad y seguridad sus prestaciones afirma que «salvo decisión en contrario de la Comisión Delegada del Gobierno para Asuntos Económicos, por razones de interés general, en tanto no se regulen los mecanismos de fijación de los precios de venta al público de los medicamentos y productos sanitarios, los precios industriales serán libres en aquellos medicamentos que no se financien con cargo a fondos públicos» (29).
5.2. Procedimiento de fijación de precio y financiación en España por el SNS
Una vez autorizado un medicamento en España, con independencia del procedimiento la Agencia Española de Medicamentos y Productos Sanitarios, se comunica al órgano competente (Dirección General de Farmacia y Productos Sanitarios) la resolución en la que se otorgue la autorización de comercialización o la resolución de la modificación de la autorización, de conformidad con el apartado tercero de la Instrucción de 13 de diciembre de 2002, de la Subsecretaría, por la que se coordinan los procedimientos administrativos relativos a la autorización y financiación con fondos públicos de las especialidades farmacéuticas (30).
Para iniciar el procedimiento de financiación de medicamentos por el SNS y fijación de precios, el Informe del Tribunal de Cuentas señala que, en su fase inicial, el sistema separa de forma automática los medicamentos que se encuentran excluidos de la financiación pública (aquellos incluidos en los grupos del anexo II del Real Decreto 13/2003). Con el resto de los medicamentos abre un expediente al cuál se incorporan los datos del medicamento en GESFARMA, que se trata de la herramienta para la gestión informatizada para la tramitación de procedimientos de financiación y fijación de precios por el SNS (31).
Una vez abierto el expediente en GESFARMA, a cada medicamento se le asigna un cupón precinto que deberá llevar el medicamento de forma provisional mientras que se efectúa la petición de la documentación al interesado, para que manifieste su interés respecto a que el medicamento sea financiado por el SNS, y le informe tanto del precio industrial al que pretende comercializar como de las estimaciones de ventas para los tres primeros años (32).
Con estos datos, los técnicos evaluadores inician el proceso de negociación con el titular de la autorización de comercialización para determinar el precio que finalmente será propuesto a la CIMP.
La siguiente fase es la de la fijación del precio.
El procedimiento para la fijación de precios se encuentra regulado, tal y como se ha mencionado en el Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios.
El Gobierno, realiza la fijación de precios de medicamentos mediante la «Comisión Interministerial de Precios de los medicamentos», el órgano colegiado encargado de fijar el precio industrial máximo para cada presentación de medicamento a incluir, o ya incluida en la prestación farmacéutica del SNS. Para realizar dicha acción tendrá en consideración los análisis coste-efectividad y de impacto presupuestario en base a la información facilitada por las empresas fabricantes en los aspectos técnicos, económicos y financieros.
La Comisión Interministerial de Precios de los medicamentos, se encuentra adscrita a la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia. De acuerdo con el Reglamento interno de la CIMP, este organismo se encuentra formado por (33):
a) Presidencia: La persona titular de la Secretaría General de Sanidad y Consumo.
b) Vicepresidencia: La persona titular de la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia.
c) Vocalías: 1º.- Dos personas en representación del Ministerio de Economía, Industria y Competitividad, con rango de director general.
En la actualidad Ministerio de Economía y Empresa y Ministerio de Industria, Comercio y Turismo. 2º.- Dos personas en representación del Ministerio de Hacienda y Función Pública, en la actualidad Ministerio de Hacienda, con rango de director general, una de ellas en representación de la Secretaría de Estado de Presupuestos y Gastos y otra en representación de la Secretaría de Estado de Hacienda. 3º.- Tres representantes de las CCAA, a propuesta del Consejo Interterritorial del SNS, elegidos entre sus miembros. 4º.- La persona titular de la Subdirección General de Calidad de Medicamentos y Productos Sanitarios, de la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, que actuará como Secretario. 5º.- Un funcionario de la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia.
Por parte de las CCAA se convoca a seis miembros para formar parte del CIMP, tres titulares y tres oyentes, que van rotando cada seis meses conforme al orden de precedencia que determina la antigüedad de la publicación oficial de los estatutos de autonomía de las distintas CCAA. Los vocales oyentes serán los que corresponda ser nombrados vocales titulares en el siguiente periodo de representación conforme al orden rotatorio aprobado por el Consejo Interterritorial del SNS (33).
Una vez la CIMP emite la respuesta sobre la inclusión o no en el sistema de financiación de un determinado precio, así como el precio del mismo. Es la Subdirección General de Calidad de los Medicamentos y Productos Sanitarios la que emite un proyecto de resolución para que el interesado titular de la autorización de comercialización formule las alegaciones que podrán ser de nuevo consideradas por la CIMP. Una vez emitida la resolución definitiva, se firma por el titular de la Dirección General de Cartera Básica de Servicios para el SNS (34).
Posteriormente, es el ministerio con competencias en sanidad quien establece el precio de venta al público de las especialidades farmacéuticas mediante la agregación del precio industrial y de los conceptos correspondientes a la comercialización.
5.3. Revisión de los precios de los medicamentos
De acuerdo con el Real Decreto 177/2014, de 21 de marzo, por el que se regula el sistema de precios de referencia y de agrupaciones homogéneas de medicamentos en el Sistema Nacional de Salud, y determinados sistemas de información en materia de financiación y precios de los medicamentos y productos sanitarios (35), el precio fijado será revisable de oficio o a instancia de parte de acuerdo con lo previsto en los artículos 106 y siguientes de la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas (36).
El precio de un medicamento podrá ser modificado cuando lo exijan cambios en las circunstancias económicas, técnicas, sanitarias o en la valoración de su utilidad terapéutica.
Además, el Consejo de Ministros, previo acuerdo de la Comisión Delegada del Gobierno para Asuntos Económicos, podrá revisar globalmente o fijar las condiciones de revisión periódica de los precios industriales o, en su caso, de los precios de venta al público, para todos o una parte de los medicamentos y productos sanitarios incluidos en la prestación farmacéutica del Sistema Nacional de Salud.
5.4. Los distintos regímenes de los precios industriales actuales en España
5.4.1. Precios de referencia
El precio de referencia de cada conjunto de referencia de medicamentos se calculará tomando como base el coste/tratamiento/día (CTD) de las presentaciones de medicamentos en él integradas, lo que permitirá determinar el coste/tratamiento/día menor que será el precio de referencia del conjunto.
A estos efectos, el coste/tratamiento/día de cada presentación de medicamento será el resultado de dividir el precio industrial al que se estuviera comercializando (PVL com) entre el número de dosis diarias definidas (DDD) que contiene, conforme a la siguiente fórmula: CTD = PVL com / n.º DDD de la presentación
Las dosis diarias definidas serán las asignadas oficialmente por el Centro Colaborador de la Organización Mundial de la Salud en Metodología Estadística de los Medicamentos o, en su defecto, las calculadas de oficio por el órgano competente en materia de financiación pública y de fijación del precio de los medicamentos y productos sanitarios del Ministerio de Sanidad, Servicios Sociales e
Igualdad, conforme a la metodología utilizada por el citado Centro.
El precio industrial de referencia de cada una de las presentaciones de medicamentos integradas en un conjunto de referencia será el resultado de multiplicar el coste/tratamiento/día menor de las presentaciones en él agrupadas o precio de referencia del conjunto (PRC), por el número de DDD contenidas en cada presentación, conforme a la siguiente fórmula: PVLRef = PRC × n.º DDD de la presentación.
En los casos en los que el precio industrial de referencia para una presentación de medicamento, determinado conforme a la regla general de cálculo establecida sea inferior a 1,60 euros, se fijará dicha cantidad como precio industrial de referencia para esa presentación.
No obstante, cuando el precio industrial al que se estuviera comercializando una presentación de medicamento sea inferior al precio industrial de referencia que le corresponda en aplicación de este criterio, se fijará como precio industrial de referencia el precio industrial al que se estuviera comercializando.
Este sistema da lugar a los denominados «conjuntos de referencia de medicamentos», que son la unidad básica del sistema de precios de referencia y estará formado por dos o más presentaciones de medicamentos. En cada conjunto de referencia de medicamentos se integrarán todas las presentaciones de medicamentos incluidas en la prestación farmacéutica del Sistema Nacional de Salud que tengan el mismo principio activo e idéntica vía de administración.
En cada conjunto de referencia deberá existir, al menos, una presentación de medicamento genérico o biosimilar. No obstante, en caso de no existir una presentación de medicamento genérico o biosimilar, también se formará conjunto siempre que el medicamento o su ingrediente activo principal hubiese sido autorizado con una antelación mínima de diez años en España o en cualquier otro Estado miembro de la Unión Europea, y además exista un medicamento distinto del original y sus licencias.
Se constituirán conjuntos de referencia independientes en los siguientes supuestos: a) Presentaciones de medicamentos de ámbito hospitalario, entendiendo por tales las presentaciones, en envase normal, de medicamentos calificados de uso hospitalario y de medicamentos que sin tener la calificación de uso hospitalario tienen establecidas reservas singulares en el ámbito del Sistema Nacional de Salud consistentes en limitar su dispensación a los pacientes no hospitalizados en los servicios de farmacia de los hospitales; b) Presentaciones de medicamentos en envase clínico; c) Presentaciones de medicamentos indicadas para tratamientos en pediatría.
La última noma que tiene por objeto establecer los conjuntos de referencia y los precios de referencia incluidos en los anteriores es la Orden SND/1121/2020, de 27 de noviembre, por la que se procede a la actualización en 2020 del sistema de precios de referencia de medicamentos en el Sistema Nacional de Salud (37).
5.4.2. Agrupaciones homogéneas
El sistema de agrupaciones homogéneas de medicamentos permite la aplicación de los supuestos de dispensación y sustitución previstos en los artículos 87 y 89 del mencionado Real Decreto-Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios.
El sistema de agrupaciones homogéneas de medicamentos requiere la integración de las presentaciones de medicamentos, incluidas en la prestación farmacéutica del Sistema Nacional de Salud que sean dispensables mediante receta u orden de dispensación oficiales en oficina de farmacia, en una agrupación homogénea siempre que reúnan los requisitos establecidos. Asimismo, determina el precio menor y precio más bajo de las presentaciones de medicamentos integradas en cada agrupación homogénea.
Corresponde a la persona titular de la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia del Ministerio de Sanidad, Servicios Sociales e Igualdad establecer, de oficio, las agrupaciones homogéneas de medicamentos y determinar las presentaciones de medicamentos que deben integrarse en cada una de ellas, así como fijar y revisar, de oficio, los precios menores y precios más bajos de cada agrupación homogénea.
En cada agrupación homogénea de medicamentos se integrarán las presentaciones de los medicamentos financiadas con el/los mismo/s principio/s activo/s en cuanto a dosis, contenido, forma farmacéutica o agrupación de forma farmacéutica, y vía de administración, que puedan ser objeto de intercambio en su dispensación.
Se diferenciarán las agrupaciones homogéneas de medicamentos integradas exclusivamente por un medicamento y sus licencias con el mismo precio industrial.
Se fijará un precio menor para cada agrupación homogénea de medicamentos que se corresponderá con el precio de la presentación de medicamento de precio más bajo en el momento de su formación, y será fijado automáticamente en el Nomenclátor oficial, esto es, el listado de medicamentos incluidos en la prestación farmacéutica del Sistema Nacional de Salud del mes correspondiente.
El precio más bajo de cada agrupación homogénea de medicamentos se corresponderá con el precio de la presentación de medicamento de precio más bajo en el Nomenclátor oficial de la prestación farmacéutica del Sistema Nacional de Salud del mes correspondiente.
Los precios menores de las agrupaciones homogéneas de medicamentos serán revisados con carácter trimestral dentro del año natural. El nuevo precio menor revisado de cada agrupación homogénea se corresponderá con el precio de la presentación de precio más bajo en el momento de cada actualización trimestral, y se fijará automáticamente en el Nomenclátor oficial correspondiente a los meses de enero, abril, julio y octubre.
5.4.3. Régimen de precios seleccionados
El sistema de precios seleccionados podrá aplicarse a medicamentos y productos sanitarios que, no estando financiados, se consideren de interés para la salud pública en los términos expresados en la Ley 33/2011, de 4 de octubre, General de Salud Pública.
A tales efectos, el Ministerio de Sanidad, Servicios Sociales e Igualdad elaborará una propuesta motivada, de acuerdo con los criterios recogidos en este artículo, que contendrá el precio máximo seleccionado aplicable en cada caso.
Una vez autorizado por la Comisión Interministerial de Precios de los Medicamentos, el Ministerio de Sanidad, Servicios Sociales e Igualdad publicará la decisión por Resolución de la unidad responsable de la prestación farmacéutica.
También podrá aplicarse a los medicamentos financiados, teniendo en cuenta: el consumo del conjunto; el impacto presupuestario; la existencia de, al menos, tres medicamentos en el conjunto; y, que no se produzca riesgo de desabastecimiento.
Valorados los criterios anteriores, el Ministerio de Sanidad, Servicios Sociales e Igualdad, a través de la unidad con responsabilidad en prestación farmacéutica, procederá a comunicar a los proveedores el inicio de un procedimiento de precio seleccionado, con comunicación del precio máximo de financiación que se propone para que manifiesten sus intenciones. Así pues, aquellos medicamentos y/o productos sanitarios que superen el precio máximo financiable quedarán excluidos de la financiación por el Sistema Nacional de Salud.
El precio seleccionado tendrá una vigencia de dos años durante los cuales no podrá ser modificado.
El sistema de precios seleccionados se actualizará, para los casos en los que no haya sido aplicado con anterioridad, con periodicidad anual, de forma simultánea a la actualización del sistema de precios de referencia.
La aplicación de este sistema supondrá la exclusión de la financiación pública de aquellas presentaciones que no resulten seleccionadas, por el tiempo de vigencia del precio seleccionado.
6. SOBRE EL COPAGO FARMACÉUTICO
Como se ha mencionado anteriormente, el sector publico puede financiarse mediante ingresos al Estado de carácter tributario (como son los impuestos) o mediante una financiación directa. Esta última se encuentra basada en el principio del beneficio, cuyo objetivo es que se relacione el ingreso con el uso del servicio publico en el caso de los medicamentos, mediante el copago. Este mecanismo se introdujo en vigor en julio de 2012, a través del Real Decreto-ley 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones. El copago tiene dos objetivos principales: disminuir el gasto farmacéutico de las prestaciones del SNS y evitar el consumo de medicamentos sin necesidad.
El copago se introduce estableciendo un porcentaje del precio del medicamento a pagar en función de la renta del usuario para las prestaciones farmacéuticas ambulatorias. Estos porcentajes se regulan en el artículo 13 de la mencionada norma, que añade el artículo 94 bis, que modifica .
Se entiende por prestación farmacéutica ambulatoria la que se dispensa al paciente, a través de receta médica, en oficina o servicio de farmacia. La prestación farmacéutica ambulatoria estará sujeta a aportación del usuario y se efectuará en el momento de la dispensación del medicamento o producto sanitario. Esta aportación del usuario será proporcional al nivel de renta que se actualizará, como máximo, anualmente.
Con carácter general, el porcentaje de aportación del usuario seguirá el siguiente esquema:
a) Un 60 % del PVP para los usuarios y sus beneficiarios cuya renta sea igual o superior a 100.000 euros consignada en la casilla de base liquidable general y del ahorro de la declaración del Impuesto sobre la Renta de las Personas Físicas.
b) Un 50 % del PVP para las personas que ostenten la condición de asegurado activo y sus beneficiarios cuya renta sea igual o superior a 18.000 euros e inferior a
100.000 euros consignada en la casilla de base liquidable general y del ahorro de la declaración del Impuesto sobre la Renta de las Personas Físicas.
c) Un 40 % del PVP para las personas que ostenten la condición de asegurado activo y sus beneficiarios y no se encuentren incluidos en los apartados a) o b) anteriores.
d) Un 10 % del PVP para las personas que ostenten la condición de asegurado como pensionistas de la Seguridad Social y sus beneficiarios, con excepción de las personas incluidas en el apartado a).
Con el fin de garantizar la continuidad de los tratamientos de carácter crónico y asegurar un alto nivel de equidad a los pacientes pensionistas con tratamientos de larga duración, los porcentajes generales estarán sujetos a topes máximos de aportación en los siguientes supuestos:
a) Un 10 % del PVP en los medicamentos pertenecientes a los grupos de aportación reducida, con una aportación máxima para el 2012, expresada en euros, resultante de la aplicación de la actualización del IPC a la aportación máxima vigente. Dicha aportación máxima se actualizará, de forma automática, cada mes de enero de acuerdo con la evolución del IPC. La actualización se formalizará por resolución de la unidad responsable de farmacia del Ministerio de Sanidad, Servicios Sociales e Igualdad.
b) Para las personas que ostenten la condición de asegurado como pensionistas de la Seguridad Social y sus beneficiarios cuya renta sea inferior a 18.000 euros consignada en la casilla de base liquidable general y del ahorro de la declaración del Impuesto sobre la Renta de las Personas Físicas o que no estén incluidos en los siguientes apartados c) o d), hasta un límite máximo de aportación mensual de 8 euros.
c) Para las personas que ostenten la condición de asegurado como pensionistas de la Seguridad Social y sus beneficiarios cuya renta sea igual o superior a 18.000 euros e inferior a 100.000 euros consignada en la casilla de base liquidable general y del ahorro de la declaración del Impuesto sobre la Renta de las Personas Físicas, hasta un límite máximo de aportación mensual de 18 euros.
d) Para las personas que ostenten la condición de asegurado como pensionista de la Seguridad Social y sus beneficiarios cuya renta sea superior a 100.000 euros consignada en la casilla de base liquidable general y del ahorro de la declaración del Impuesto sobre la Renta de las Personas Físicas, hasta un límite máximo de aportación mensual de 60 euros.
El importe de las aportaciones que excedan de las cuantías mencionadas en el apartado anterior será objeto de reintegro por la comunidad autónoma correspondiente, con una periodicidad máxima semestral.
Asimismo, estarán exentos de aportación los usuarios y sus beneficiarios que pertenezcan a una de las siguientes categorías:
a) Afectados de síndrome tóxico y personas con discapacidad en los supuestos contemplados en su normativa específica.
b) Personas perceptoras de rentas de integración social.
c) Personas perceptoras de pensiones no contributivas.
d) Parados que han perdido el derecho a percibir el subsidio de desempleo en tanto subsista su situación.
e) Personas con tratamientos derivados de accidente de trabajo y enfermedad profesional.
El nivel de aportación de los mutualistas y clases pasivas de la Mutualidad General de Funcionarios Civiles del Estado, del Instituto Social de las Fuerzas Armadas y la Mutualidad General Judicial será del 30 %.
7. PROCEDIMIENTO PARA LA SELECCIÓN DE MEDICAMENTOS FINANCIADOS
Para la financiación pública de los medicamentos, se requiere la pertinente Resolución de la Dirección General de Cartera de Servicios del Sistema Nacional de Salud y Farmacia (en adelante, DGCSSNSF), del Ministerio con competencias en sanidad para la formalización de la inclusión de la citada presentación en la prestación farmacéutica del SNS. En otras palabras, la DGCSSNSF adoptará una decisión acerca la financiación pública de cada medicamento y de sus indicaciones, que se dispense a través de receta oficial (22). Como bien afirma Vida, este requisito constituye «una de las manifestaciones más evidentes de la intensidad de la intervención pública sobre los medicamentos» (38) en tanto que no podrán ser comercializados legalmente sin que el Estado haya acordado una decisión sobre su adquisición, y añade que «se trata de una importante limitación tanto de la libertad de empresa como a la discrecionalidad de la Administración que solamente se explica por el derecho a la protección de la salud por el que deben velar los poderes públicos» (38).
Para la realización del estudio de financiación pública se han utilizado los denominados Informes de Posicionamiento Terapéutico (IPT), los cuáles han marcado un antes y un después en el posicionamiento corporativo de los medicamentos en el Sistema Nacional de Salud (SNS), fortaleciendo las tomas de decisión en la selección de los medicamentos y facilitando información rigurosa e imprescindible a todos los agentes del sistema sanitario.
Los IPT se crearon en el año 2013, cuando la Comisión Permanente de Farmacia ( en adelante CPF) del SNS aprobó, el 21 de mayo de 2013, la propuesta de colaboración para la elaboración de los IPT. Este documento fue consensuado entre la Agencia Española de Medicamentos y Productos Sanitarios, la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, y los representantes de las CCAA, siendo la gobernanza de los IPT en el SNS de la CPF. Dada la relevancia de los IPT para la política farmacéutica, sin perjuicio de las competencias de las CCAA, se ha realizado el diagnóstico de situación actual, con objeto de identificar los aspectos a mejorar para que satisfagan, completamente, las necesidades del SNS (39).
En ellos se valoran los criterios que se exigen para la financiación de un medicamento regulados en el artículo 92 Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, según el cuál, la inclusión de medicamentos en la financiación del Sistema Nacional de Salud se posibilita mediante la financiación selectiva y no indiscriminada teniendo en cuenta criterios generales, objetivos y publicados y, concretamente, los siguientes:
a) Gravedad, duración y secuelas de las distintas patologías para las que resulten indicados.
b) Necesidades específicas de ciertos colectivos.
c) Valor terapéutico y social del medicamento y beneficio clínico incremental del mismo teniendo en cuenta su relación coste-efectividad.
d) Racionalización del gasto público destinado a prestación farmacéutica e impacto presupuestario en el Sistema Nacional de Salud.
e) Existencia de medicamentos u otras alternativas terapéuticas para las mismas afecciones a menor precio o inferior coste de tratamiento.
f) Grado de innovación del medicamento.
Tras la evaluación de los criterios ut supra establecidos, la COIPM mediante la adopción de acuerdos se determina si el medicamento se incluye en la financiación del SNS. Los acuerdos se adoptarán por consenso. Cuando esto no sea posible, o bien cuando alguno de los miembros así lo requiera, se procederá a votación. Para que los acuerdos sean válidos, deberán ser adoptados por mayoría simple de los miembros presentes (40). Es preciso destacar que el estudio de la financiación pública de los medicamentos implica el análisis conjunto de los anteriores criterios. Así se ha afirmado en la STSJ de Madrid 387/2017, que acuerda que las decisiones de exclusión de medicamentos de la prestación farmacéutica no pueden justificarse exclusivamente por la similitud de los medicamentos objeto de estudio con respecto a otros medicamentos evaluados previamente por el Ministerio con competencias en sanidad (41).
El Gobierno revisará periódicamente y actualizará la relación de los medicamentos y productos sanitarios incluidos en la prestación farmacéutica del SNS de acuerdo con los siguientes criterios (22): a) el progreso de los criterios de uso racional; los avances científicos; la aparición de nuevos medicamentos con utilidad terapéutica superior; y, b) la aparición de efectos adversos que modifiquen el balance beneficio/riesgo y los criterios anteriores. De esta forma, las Autoridades sanitarias podrán acordar la exclusión, total o parcial, de la financiación pública de los medicamentos, así como la posibilidad de restringir los criterios de financiación de éstos (22).
La motivación de la exclusión de un medicamento en la prestación farmacéutica deberá responder a uno de los siguientes criterios, establecidos reglamentariamente (22): el establecimiento de precios seleccionados; la convivencia con un medicamento no sujeto a prescripción médica con la que comparte principio activo y dosis; la autorización del medicamento como publicitario; que el principio activo cuente con un perfil de seguridad y eficacia favorable y suficientemente documentado a través de una amplia experiencia de uso a lo largo del tiempo; la otorgación de la calificación de medicamentos destinados al tratamiento de síntomas menores; y, la inclusión en las categorías de productos excluidos reglamentariamente de la financiación pública por su inclusión en el artículo 92.2 Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, como por ejemplo, cosméticos, dietéticos, aguas minerales, elixires, dentífricos y otros productos similares, medicamentos no utilizados para tratar una patología claramente determinada, medicamentos con un balance beneficio/riesgo desfavorable en las indicaciones terapéuticas autorizadas.
Asimismo, el párrafo 2.º del artículo 92.2 «tampoco se financiarán los medicamentos (…) que, aun habiendo sido autorizados de acuerdo con la normativa vigente en su momento, no respondan a las necesidades terapéuticas actuales, entendiendo por tal un balance beneficio/riesgo desfavorable en las enfermedades para las que estén indicados».
Por último, es preciso destacar que, algunas CC.AA. han adoptado medidas adicionales de selección de los medicamentos que son financiados con cargos públicos en el territorio de su competencia. Por ejemplo, Comunidad Valenciana, Galicia, Islas Canarias, y Andalucía. Las subastas de medicamentos acontecidas en esta última son especial relevancia (42).
7.1. Concursos y subastas: procedimiento de subasta de medicamentos andaluz
El sistema de selección de medicamentos de la subasta de medicamentos se viene aplicando en Andalucía desde el año 2012, a partir de la entrada en vigor del Decreto-Ley 3/2011, por el que se aprueban medidas urgentes sobre prestación farmacéutica del Sistema Sanitario Público de Andalucía (43).
El Decreto-ley se dictó en base a los títulos competenciales previstos en el apartado 1 del artículo 55 del Estatuto de Autonomía para Andalucía, sobre la competencia exclusiva de la Comunidad Autónoma en materia de ordenación farmacéutica, sin perjuicio de lo establecido en el artículo 149.1.16.a de la Constitución; y en el apartado 2 del mismo, sobre la competencia compartida en materia de sanidad interior y, en especial, sobre ordenación, planificación, determinación, regulación y ejecución de los servicios y prestaciones sanitarias.
La finalidad del Decreto-Ley 3/2011, tal y como señala su exposición de motivos radicaba en la adopción de medidas que coadyuvasen en la consecución de los objetivos de reducción del déficit público, a los que la coyuntura económica obligaba, junto a la necesidad de “reforzar y profundizar sobre prescripción y dispensación de medicamentos por principio activo y de productos sanitarios por denominación genérica, para mejorar el margen de eficiencia en la prestación farmacéutica de la Junta de Andalucía.
En virtud de dicho decreto, la Dirección Gerencia del SAS quedaba autorizada para realizar convocatorias públicas en las que podrían participar todos los laboratorios farmacéuticos interesados, para seleccionar, de entre los medicamentos comercializados que tuviesen un precio autorizado igual o inferior al precio menor correspondiente, establecido en el SNS y vigente en el momento de la convocatoria, aquel que debería ser dispensado, de manera obligatoria por las oficinas de farmacia cuando se les presentase una receta médica u orden de dispensación en las que el medicamento correspondiente se identificase exclusivamente por la denominación oficial de sus principios activos.
Se establece a través de este procedimiento una diferenciación con el resto de las CCAA, donde los medicamentos ofertados a los pacientes de las oficinas de farmacia, se deciden por parte de las mismas oficinas de farmacia, de entre todos los que permite la base de datos de medicamentos financiables por el Sistema Nacional de Salud, conforme al sistema de precios de referencia establecido por el Estado. Esto es que, mientras que en el resto de España, los pacientes tienen derecho a que se les dispense un medicamento de «marca comercial», en Andalucía, se opta por el llamado medicamento genérico. Esto ha generado diversos problemas, entre los que destacaremos el desabastecimiento de medicamentos seleccionados por el Sistema Andaluz de Salud, puesto que estos son de dispensación obligatoria. Diariamente las oficinas farmacias, sufren desabastecimientos, lo cual conlleva que deban ser sustituidos, por el farmacéutico bajo los criterios de desabastecimiento o urgente necesidad. En este caso la oficina se enfrenta al riesgo de que la parte, o el todo, del medicamento o producto sanitario, que debe abonar el SAS, en la facturación mensual, no sea abonado por la Administración. Pero ese no es el mayor de los inconvenientes para la oficina de farmacia, puesto que en múltiples ocasiones se expide el producto con la concienciación de que se está vendiendo a pérdidas. El mayor de los problemas es que en este caso el paciente se ve privado de un medicamento que forma parte de un tratamiento para su salud, lo cual puede conllevar incluso riesgo vital para este (44).
Un sector doctrinal se ha opuesto al empleo de este tipo sistema que tiene la finalidad de reducir el gasto público afecto a sanidad. Siguiendo a Gimeno Feliu «falsear la competencia y obstaculizar la inversión privada en un sector estratégico, fomentando una indeseada deslocalización». Para el mencionado autor puede «pone[r] en riesgo la calidad asistencial al “excluir” de la opción terapéutica a ciertos medicamentos» y, además, también «puede romper el principio de equidad social al excluir del sistema medicamentos que solo se podrán adquirir por centros privados o particulares que podrán pagar el precio libre que fije la empresa farmacéutica» (45). Este tipo de sistemas ha sido debatido por el Tribunal Constitucional en las Sentencias de 15 de diciembre de 2016, de 19 de enero de 2017, y de 2 de febrero de 2017 la constitucionalidad de este sistema. No obstante, en todas ella se ha llegado a la conclusión de que no se vulnera la exclusividad de competencias del Estado que hemos analizado anteriormente en el presente trabajo (46).
8. MÁRGENES COMERCIALES DE LA DISTRIBUCIÓN Y OFICINAS DE FARMACIA EN LA DISPENSACIÓN
De acuerdo con el artículo 94, del TRLGURMPS, las cuantías económicas correspondientes a los conceptos de la distribución y dispensación de los medicamentos y de los productos sanitarios y, en su caso, de las deducciones aplicables a la facturación de los mismos al Sistema Nacional de Salud serán fijados por el Gobierno, previo acuerdo de la Comisión Delegada del Gobierno para Asuntos Económicos, de forma general o por grupos o sectores, tomando en consideración criterios de carácter técnico-económico y sanitario.
Corresponde igualmente al Consejo de Ministros, previo acuerdo de la Comisión Delegada del Gobierno para Asuntos Económicos, la revisión de las cuantías económicas correspondientes a la distribución y dispensación de los medicamentos y productos sanitarios.
Es por eso por lo que se revisan los márgenes correspondientes a los almacenes farmacéuticos y oficinas de farmacia, de modo que el Real Decreto 823/2008, de 16 de mayo, por el que se establecen los márgenes, deducciones y descuentos correspondientes a la distribución y dispensación de medicamentos de uso humano, y su modificación a través del Real Decreto-ley 4/2010, Real Decreto-ley 8/2010 y Real Decreto Legislativo 16/2012, de 20 de abril, por el que se adoptan medidas extraordinarias para la reducción del déficit público (capitulo V), que establece la reducción del precio de los medicamentos genéricos así como los márgenes correspondientes a la distribución y a la dispensación de medicamentos.
8.1. Reducción del precio de los medicamentos genéricos
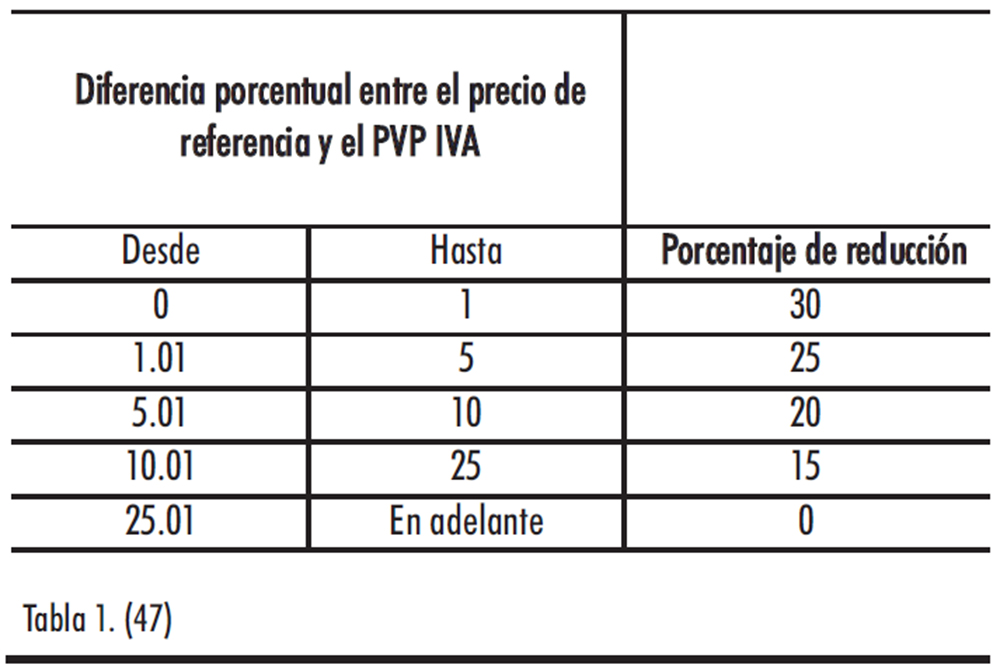
El precio industrial de los medicamentos genéricos de uso humano fabricados industrialmente financiados con fondos públicos por el Sistema Nacional de Salud, que esté incluidos en el sistema de precios de referencia, se reducirá según la diferencia porcentual existente entre el precio de referencia y el precio de venta al público correspondiente, impuestos incluidos, de acuerdo con la siguiente escala:
Tabla 1.
El precio industrial de los medicamentos genéricos de uso humano fabricados industrialmente financiados con fondos públicos por el Sistema Nacional de Salud, no incluidos en el sistema de precios de referencia, se reducirá en un 30 %, y el de aquellos otros que, existiendo el conjunto, no estuvieran incorporados al mismo, se reducirá según la diferencia porcentual existente entre el precio de referencia y el precio de venta al público correspondiente, impuestos incluidos, de acuerdo con la escala del apartado anterior.
8.2. Márgenes correspondientes a la distribución de medicamentos de uso humano fabricados industrialmente
El margen correspondiente a la distribución de medicamentos de uso humano fabricados industrialmente para las presentaciones de medicamentos cuyo precio de venta de laboratorio sea igual o inferior a 91,63 euros se fija en el 7,6 por ciento del precio de venta del distribuidor sin impuestos; para aquellos cuyo precio de venta de laboratorio sea superior a 91,63 euros se fija en 7,54 euros por envase. Por último, para aquellos de medicamentos de uso humano fabricados industrialmente acondicionados en envase clínico será del 5 por ciento del precio de venta del almacén sin impuestos.
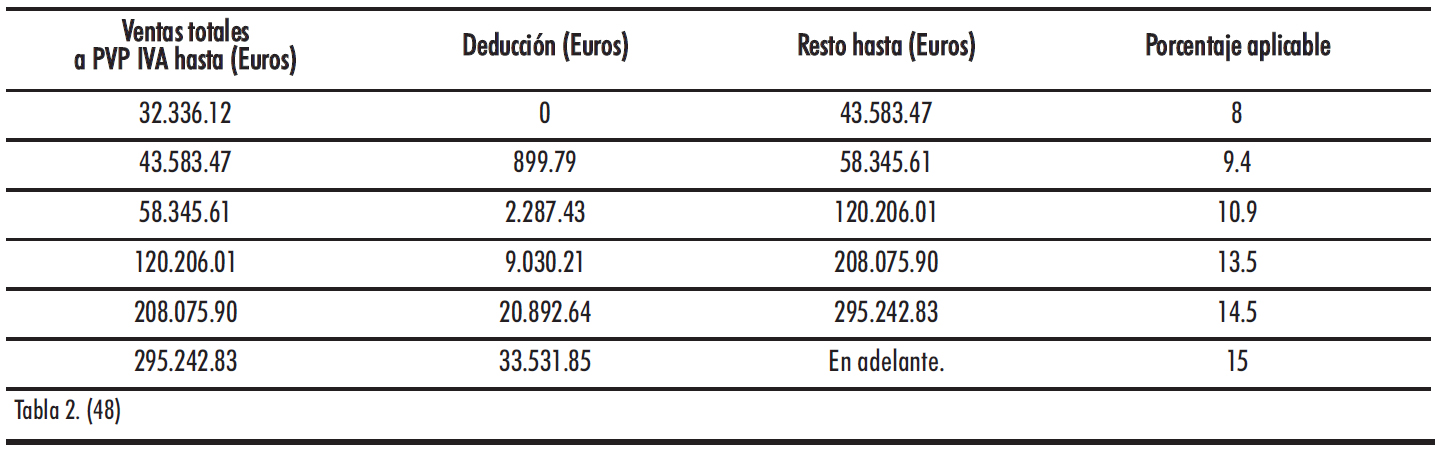
Tabla 2.
8.3. Márgenes y deducciones correspondientes a la dispensación al público de medicamentos de uso humano fabricados industrialmente
El margen de las oficinas de farmacia por dispensación y venta al público de medicamentos de uso humano fabricados industrialmente, para aquellos medicamentos cuyo precio industrial sea igual o inferior a 91,63 euros, se fija en el 27,9 % del precio de venta al público sin impuestos; para aquellos medicamentos cuyo precio industrial sea superior a 91,63 euros e igual o inferior a 200 euros, se fija en 38,37 euros por envase; para aquellos medicamentos cuyo precio industrial sea superior a 200 euros e igual o inferior a 500 euros se fija en 43,37 euros por envase; y, para aquellos medicamentos cuyo precio industrial sea superior a 500 euros se fija en 48,37 euros por envase.
En cuanto a las deducciones de las oficinas de farmacia, los márgenes de las oficinas de farmacia correspondientes a las recetas de medicamentos de uso humano fabricados industrialmente dispensados con cargo a fondos públicos se establecerán aplicando a la factura mensual de cada oficina de farmacia por dichas recetas la siguiente escala de deducciones:
9. MEDIDAS ADOPTADAS EN EL ÁMBITO ECONÓMICO QUE AFECTAN A LA PRESTACIÓN FARMACÉUTICA DE MEDICAMENTOS DURANTE LA CRISIS OCASIONADA POR EL NUEVO VIRUS SARS-COV-2
El nuevo coronavirus SARS-CoV-2, notificado por primera vez en noviembre de 2019 en la población china de Wuhan, es el causante de la enfermedad infecciosa denominada COVID-19, cuyos síntomas más comunes, según la Organización Mundial de la Salud, son fiebre, cansancio y tos seca.
La rapidez de la diseminación de este virus ha generado una crisis de índole sanitaria a nivel mundial, y por tanto España no ha sido una excepción, de hecho, el 11 de marzo de 2020 la Organización Mundial de la Salud eleva la situación sanitaria a pandemia internacional.
El Gobierno de nuestro país, debido al elevado número de personas infectadas, a la alta tasa de infectabilidad, y al gran porcentaje de enfermos que requieren, en ciertos casos, cuidados sanitarios ha tenido que decretar el denominado estado de alarma mediante la promulgación del Real Decreto 463/2020, de 14 de marzo, por el que se declara el estado de alarma para la gestión de la situación de crisis sanitaria ocasionada por el COVID-19 (49).
El denominado «estado de alarma» se define como una situación excepcional prevista en el en el artículo 116 de la Constitución Española de 1978 (8). Ésta refiere la regulación del mismo a la Ley Orgánica 4/1981, de 1 de junio, de los estados de alarma, excepción y sitio, la que, en su artículo cuarto, apartado b), dispone que el Gobierno podrá declarar estado de alarma en el caso de crisis sanitarias (50). Posada de la Paz ha definido el contexto de crisis sanitaria «una situación que cumple tres características principales: punto de cambio o tendencia de una situación preestablecida; situación aguda (…); necesidad de actuación urgente» (51), tal y como es el caso de la pandemia generada por el virus SARS-CoV-2. Sobre las medidas adoptadas en el ámbito económico que afectan a la prestación farmacéutica y a los precios de los medicamentos se han orientado en dos sentidos.
Por una parte, el Real Decreto-ley 6/2020, de 10 de marzo, por el que se adoptan determinadas medidas urgentes en el ámbito económico y para la protección de la salud pública cuyo artículo 4 modificó la redacción del artículo 4 de la a Ley Orgánica 3/1986, de 14 de abril, de Medidas Especiales en Materia de Salud Pública, para ampliar el ámbito de aplicación de las medidas que podrían ser adoptadas por las Administraciones Públicas competentes, de forma que (52):
«Cuando un medicamento, un producto sanitario o cualquier producto necesario para la protección de la salud se vea afectado por excepcionales dificultades de abastecimiento y para garantizar su mejor distribución, la Administración Sanitaria del Estado, temporalmente, podrá: a) Establecer el suministro centralizado por la Administración. b) Condicionar su prescripción a la identificación de grupos de riesgo, realización de pruebas analíticas y diagnósticas, cumplimentación de protocolos, envío a la autoridad sanitaria de información sobre el curso de los tratamientos o a otras particularidades semejantes.»
El legislador ha adoptado medidas en materia de regulación suministro y limitación prestación farmacéutica para determinados medicamentos anticipándose a la situación sobrevenida que pudiese acaecer ante la pandemia en la que se vio inmersa el país (53). Además, también se regularon los productos sanitarios, entre otros, las soluciones -o geles- hidroalcohólicos -así como sus materias primas-, determinados equipos de protección individual (mascarillas de protección FFP1, FFP2 y FFP3), productos sanitarios (guantes de nitrilo -con o sin polvo-), etc. (54).
Por otra parte, a través del artículo 7 del Real Decreto-ley 7/2020, de 12 de marzo, por el que se adoptan medidas urgentes para responder al impacto económico del COVID-19 (55), convalidado por Resolución de 25 de marzo de 2020, del Congreso de los Diputados (56), se modificó el artículo 94.3 Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, para ampliar las medidas indicadas en al párrafo anterior a todo producto que resulte esencial para la protección de la salud de los administrados. El párrafo 2.º de este artículo volvería a modificarse por la Disposición final tercera del Real Decreto-ley 21/2020, de 9 de junio, de medidas urgentes de prevención, contención y coordinación para hacer frente a la crisis sanitaria ocasionada por el COVID-19, que establece que:
«el Gobierno podrá regular el mecanismo de fijación de los precios de los medicamentos y productos sanitarios no sujetos a prescripción médica, así como de otros productos necesarios para la protección de la salud poblacional que se dispensen en el territorio español, siguiendo un régimen general objetivo y transparente. Cuando exista una situación excepcional sanitaria, con el fin de proteger la salud pública, la Comisión Interministerial de Precios de los Medicamentos podrá fijar el importe máximo de venta al público de los medicamentos y productos a que se refiere el párrafo anterior por el tiempo que dure dicha situación excepcional. El procedimiento para la fijación del importe máximo de venta al público será acordado en el seno de la citada Comisión»
Además, es preciso destacar que, durante esta crisis sanitaria para la financiación del SNS se ha recurrido a obtener los denominados «ingresos por donaciones al Estado» en este caso en concepto de la crisis sanitaria por el COVID-19 –medida que también han adoptado algunas Comunidades Autónomas–. Desde una perspectiva jurídica, este tipo de donaciones a la sanidad pública no se encuentran expresamente recogidas en ninguna de las alternativas de financiación del Sistema Nacional de Salud, pero apela al principio de solidaridad recogido en el artículo 2º de la Constitución Española y que debe entenderse como un principio rector que rige no solamente entre regiones, sino que es extensible al comportamiento de la ciudadanía en su conjunto. Este ingreso de naturaleza extraordinaria se encuentra expresamente afectado a la financiación de los gastos derivados de la crisis sanitaria por COVID-19, y se estima que durante los tres primeros meses de pandemia recaudó aproximada- mente 17 millones de euros –lo que supone aproximadamente el 25% del gasto sanitario público anual del conjunto de las Comunidades Autónomas en nuestro país–, siendo el número de donaciones realizadas de 4.000 aproximadamente, tanto de empresas como de particulares (58).
10. BREVE REFERENCIA A LA SITUACIÓN DE LA INTERVENCIÓN ADMINISTRATIVA SOBRE LOS PRECIOS DE LOS MEDICAMENTOS EN LA UNIÓN EUROPEA
La Comisión Europea ha establecido una Estrategia Farmacéutica Europea para garantizar que los pacientes tengan acceso a medicamentos innovadores y asequibles. Esta estrategia tiene cuatro objetivos principales: garantizar el acceso de los pacientes a medicamentos asequibles y abordar necesidades médicas no satisfechas (por ejemplo, en los ámbitos de la resistencia a los antimicrobianos, el cáncer y las enfermedades raras); fomentar la competitividad, la innovación y la sostenibilidad de la industria farmacéutica de la UE y el desarrollo de medicamentos de alta calidad, seguros, eficaces y más ecológicos; mejorar los mecanismos de preparación y respuesta ante las crisis y abordar la seguridad del suministro; y, velar por una voz firme de la UE en el mundo promoviendo unos altos estándares de calidad, eficacia y seguridad.
En el entramado normativo de la Unión Europea que concierne al régimen económico de los medicamentos hay diferentes sistemas que a continuación se expondrán (59). Asimismo, se analizará el comercio paralelo intracomunitario por su especial relevancia en el abastecimiento y en el cual se ven claras diferencias en los precios de los medicamentos entre los diferentes Estados miembros.
10.1. Sistemas de fijación de precios de medicamentos y la prestación farmacéutica en la Unión Europea
De acuerdo con la Directiva 2001/83/CE del Parlamento Europeo y del Consejo, de 6 de noviembre de 2001, por la que se establece un código comunitario sobre medicamentos para uso humano, la fijación de los precios de los medicamentos es competencia de los Estados miembros (60). Así pues, la Directiva 89/105/CEE, del Consejo de 21 de diciembre de 1988 relativa a la transparencia de las medidas que regulan la fijación de precios de los medicamentos para uso humano y su inclusión en el ámbito de los sistemas nacionales del seguro por enfermedad, determina las medidas de garantía y los procedimientos establecidos para dicha fijación de precios por cada Estado miembro. Por ello, a continuación, se analizarán sucintamente los modelos tanto de financiación como de copago farmacéutico en los distintos Estados miembros (61).
Por un lado, podemos diferenciar dos modelos de financiación de los medicamentos en Europa: el modelo Bismark, aquel en el cuál el Estado garantiza las prestaciones sanitarias mediante cuotas obligatorias, es decir, basado principalmente en las contribuciones a la Seguridad social en función del volumen de ingresos; y, el modelo Beveridge, en el cuál la financiación de la sanidad pública procede de los presupuestos generales del Estado y es prestada, asimismo, en condiciones de universalidad, equidad y gratuidad (62). Actualmente, componen el modelo Bismarck los países como Francia, Alemania, Austria, Bélgica, Luxemburgo y Holanda, mientras que se incluyen en el modelo Beveridge, los países como Suecia, Finlandia, Noruega, Dinamarca, Italia, España y Portugal (63).
Por otro lado, con respecto al «copago» se establece en todos los países miembros de la UE para los medicamentos usados en la atención ambulatoria (64). Existen diferentes modelos de copago. En primer lugar, en países como Austria, Irlanda, e Italia, poseen un copago fijo por receta o artículo. En segundo lugar, otros países como Alemania se establecen una «tasa de coseguro», siempre la misma para todos los medicamentos (v.gr. en Alemania la aportación se encuentra en un 10% con un mínimo de cinco euros y un máximo de diez euros por artículo). En tercer lugar, el «copago variable», este es el modelo más utilizando; se utiliza en países como Bélgica, España, Francia, Grecia y Portugal. Las diferentes tasas varían en función de los ingresos de paciente y si se encuentra en situación activo laboralmente o sea pensionista. En cuarto lugar, encontramos otros países en los cuáles, para la fijación de la aportación por copago, se ha realizado una mezcla de los modelos explicados anteriormente. Este es el caso de Francia, donde se establece un copago fijo de cincuenta céntimos por medicamento a lo cuál se le añade un copago variable en función de la situación de paciente. Por último, aquellos países en los cuales se paga el coste total del medicamento hasta llegar a un umbral (v.gr. Dinamarca, o Suecia).
Espín Balbino, afirma que, a pesar de que existen perspectivas de armonización de la fijación de precios, el principio de subsidiariedad sigue siendo el principio rector que permite que cada Estado miembro pueda fijar los precios puesto que, este se invoca para la protección de los intereses de los nacionales (65).
En este sentido, es preciso destacar que, uno de los problemas principales derivados de que cada uno de los Estados miembros establezca el precio de los medicamentos es, la venta de medicamentos por internet y la problemática resultante del comercio intracomunitario.
Así pues, es de especial relevancia citar la Sentencia del Tribunal de Justicia de la Unión Europea de 19 de octubre de 2016, Asunto C-148/15, Deutsche Parkinson Vereinigung eV (66), se cuestiona si ofrecer ventajas económicas en la venta de medicamentos vía online, infringe la normativa nacional que impone un precio uniforme y unos márgenes fijos a los medicamentos de prescripción dispensados en farmacias, normativa se aplica también a los medicamentos que las farmacias establecidas en otro Estado miembro de la Unión Europea envíen a consumidores finales residentes en Alemania cuando los compran por internet.
El Tribunal de Düsseldorf centró el debate en determinar si un régimen de precios fijos para medicamentos sujetos a prescripción médica constituye una medida de efecto equivalente a una restricción cuantitativa al comercio intracomunitario; y, en caso afirmativo, si dicha medida podía estar justificada por razones de protección de la salud y vida de las personas.
La posición del gobierno alemán afirma que el régimen de precios fijos es la única forma de garantizar un suministro uniforme de medicamentos a la población en toda Alemania, especialmente en las áreas rurales, el Tribunal de Düsseldorf solicitó la opinión del TJUE sobre qué debería exigirse para poder concluir que la medida estaría justificada.
El TJUE afirma que la normativa alemana no afecta de la misma manera a la venta de medicamentos nacionales y a la venta de medicamentos procedentes de otros Estados miembros, porque para las farmacias que operan vía internet la competencia en precio es mucho más importante que para las farmacias tradicionales. Por ello, las medidas que se adopten para proteger la salud, si suponen una restricción al comercio intracomunitario o comercio paralelo, sólo son aceptables si son adecuadas para conseguir su objetivo y si no van más allá de lo necesario para alcanzarlo.
Por un lado, en la sentencia se concluye que, la prueba de que concurren ambas circunstancias (adecuación y proporcionalidad) corresponde al Estado, y los tribunales sólo deben admitir las restricciones a la libre circulación si el Estado aporta datos precisos en los que sustente su posición. Al valorar la cuestión, los tribunales deberán actuar objetivamente, con ayuda de datos estadísticos, puntuales o por otros medios, y no deben permitir que el Estado se apoye en una simple alegación genérica relativa a la protección de la salud no será suficiente (67).
Por otro lado, el TJUE considera que estimular la competencia en precio no es per se contrario al objetivo de protección de la salud, porque según el TJUE la protección eficaz de la salud exige, en particular, que los medicamentos se vendan a precios razonables. Por ello, el régimen de precios fijos es una medida de efecto equivalente cuyo mantenimiento sólo podría justificarse si fuera necesaria para proteger la salud pública y en este caso, entiende que el régimen alemán de precios fijos no puede considerarse justificado por razones de protección de la salud pública (67).
10.2 Regulación del comercio paralelo. Especial referencia a la situación de España
La Unión Europea, con la finalidad de establecer un mercado farmacéutico único de productos, tiene como objetivo preservar la libre circulación de mercancías entre países a través de la introducción de competencia en el mercado de los medicamentos (68). En este sentido, un medicamento legalmente comercializado en un Estado miembro puede ser comercializado en otro Estado miembro independientemente del titular de la autorización de comercialización (69). El importante desarrollo del que ha sido objeto esta práctica comercial en los últimos años, como consecuencia de las diferencias de precios de los medicamentos en los Estados miembros de la Unión Europea, hace necesaria su específica regulación mediante la presente norma. Por ello, se regula en el Real Decreto 1785/2000 , de 27 de octubre, sobre la circulación intracomunitaria de medicamentos de uso humano establece que para comercializar un medicamento en otro países de la Unión Europea deberá solicitarse una autorización a la Agencia Española de Medicamentos y Productos Sanitarios. Esta autorización será necesaria, puesto que, en España los precios de los medicamentos se encuentran por debajo de la media de la Unión Europea (70).
En consecuencia, la actividad predominante son las «exportaciones paralelas», en las cuales medicamentos inicialmente destinados al mercado español son enviados a otros países de la Unión Europea, no existiendo para ello regulación específica, ni en la normativa nacional ni en la europea. Esta situación lleva a que las autoridades sanitarias españolas no dispongan de información alguna sobre estas operaciones de comercio paralelo que, en ocasiones, han provocado problemas de suministro de medicamentos, produciéndose, por ejemplo, en los casos en que no existe alternativa terapéutica, un problema de salud pública.
Por ello, para evitar la salida de España de medicamentos cuya falta de disponibilidad pueda causar un problema a los pacientes, se pone en marcha este sistema de notificación para los envíos de determinados medicamentos cuya falta puede ocasionar un problema asistencial, al no quedar cubiertas las necesidades de los pacientes españoles.
Estas notificaciones, que se deberán realizar para cada envío de los medicamentos incluidos en el listado publicado en la web de la AEMPS, se realizarán de forma telemática, de acuerdo con las instrucciones disponibles en la mencionada página web. Tras la recepción de las notificaciones por parte de la AEMPS se comprobará la disponibilidad de los medicamentos y en el caso de que se detecte que la exportación puede generar o agravar un problema de suministro se le comunicará al notificante en un plazo de 3 días hábiles contados desde la recepción de la notificación, para que no realice el envío.
Mediante este sistema se pretende conciliar los intereses legítimos de las empresas españolas que desarrollan actividades de comercio paralelo con la protección de la salud pública que desarrollan las autoridades sanitarias, de ahí la agilidad, en la respuesta a los notificantes, del sistema diseñado.
En definitiva, se trata de una nueva actuación de la AEMPS encaminada a reforzar las garantías de abastecimiento de medicamentos que constituyen un elemento básico para lograr una asistencia sanitaria de calidad (71).
11. RELEVANCIA DE LA INTERVENCIÓN ADMINISTRATIVA DE LOS PRECIOS DE LOS MEDICAMENTOS EN LA DISPENSACIÓN EN ESPAÑA
11.1. Problemas de desabastecimiento de medicamentos
La OCDE señala que el precio de venta en las farmacias españoles está un 16% por debajo de la media europea. Si en diciembre de 2009 el gasto medio por receta era de 13,39 euros, actualmente esto ha descendido a 10,81 euros, casi un 20% menos que hace 10 años. Desde Farmaindustria señalan factores decisivos como la eficacia y efectividad de los medicamentos actuales. El gasto farmacéutico por persona en nuestro país también ha disminuido debido a las medidas de contención del gasto instauradas tras la crisis, siendo un 25% más bajo que el de la media europea. En la otra cara de la moneda encontramos a los países con los fármacos más caros, entre los que están Alemania, Luxemburgo, Irlanda, Bélgica y Finlandia (72).
Por ello, es preciso destacar que, a pesar de que en España se encuentra regulado el comercio exterior de medicamentos y la Agencia Española de Medicamentos y Productos Sanitarios no autorizará una exportación que ponga en riesgo el abastecimiento de la población española. En el caso de las importaciones de medicamentos, los titulares de la autorización de comercialización prefieren vender sus medicamentos a Estados miembros donde van a recibir una cuantía económica mayor por el medicamento, que la que recibirán en España. Este hecho pone en riesgo el adecuado abastecimiento de medicamentos que se importan de otros países.
11.2. Errores en la dispensación de medicamentos
Al haber aumentado el consumo de medicamentos genéricos que, son aquellos cuyo precio se ajusta al precio de referencia financiado por el SNS. Es preciso mencionar que, los medicamentos genéricos son aquellos que presentan mayores problemas de identificación, puesto que, el acondicionamiento secundario con el que están diseñados es muy similares difiriendo entre ellos únicamente el nombre del principio activo, así como la dosis y la forma farmacéutica. Este problema se denomina «isoapariencia» y ha sido muy debatido por la jurisprudencia, puesto que puede provocar errores en la dispensación, así como en la medicación por el propio paciente (73).
11.3. Dificultades en el acceso a los medicamentos en determinadas zonas
En España, las oficinas de farmacia constituyen una garantía de acceso a los medicamentos, actualmente el 98,9% de la población gracias al sistema de guardias llevado a cabo por la red oficinas de farmacia.
Desde «las bajadas de precios de los medicamentos», la disminución de los márgenes de ganancia en la dispensación, y las cuotas de deducción ut supra analizadas, la ganancia de las farmacias se ven disminuidas. Si bien es cierto que cuanto mayor sea el porcentaje de medicamentos u otros productos de venta libre se comercializados en la farmacia, menos afectada se verá la oficina de farmacia por las iniciativas sanitarias públicas».
A pesar de que en 2018 respecto a 2012, se ha incrementado el número global de oficinas de farmacia en un 2,9%, en zonas donde la población rural es más elevada con respecto al total de habitantes censados como son: Extremadura (50%), Castilla-La Mancha (45 %), o Castilla y León (36 %) (porcentajes de población rural en 2018) (74), las oficinas de farmacia han disminuido a nivel local en estas. Los datos indican que en Castilla y León se han cerrado dieciocho farmacias desde 2012, en Castilla-La Mancha se han cerrado doce, Extremadura cinco y, Cantabria y Asturias una (75).
Además, según los datos del Observatorio del Medicamento de FEFE del año 2015, existían en España 2.836 farmacias con una facturación inferior a 300.000 euros, pero tan solo 903 fueron declaradas como «Farmacias de Viabilidad Económica Comprometida». En este mismo estudio se concluye que estas farmacias obtienen un beneficio medio anual de 5.000 euros al año (76).
Así pues, al producirse cierres de oficinas de farmacia debido al régimen económico que rodea al medicamento, se pone en compromiso el acceso a los medicamentos por parte de la población.
12. CONCLUSIONES
Uno.- El derecho a la salud, incluye el derecho al medicamento, ya que se trata de un instrumento de la política sanitaria de los Estados. Así pues, el desarrollo reglamentario del derecho a la protección de la salud en España tiene un denominador común que es la intervención administrativa del medicamento en la esfera económica del medicamento: la financiación y la prestación farmacéutica de los mismos. Esta esfera económica que rodea al medicamento afecta directa o indirectamente en la protección del derecho constitucional recogido en el artículo 43 CE denominado «derecho a la salud».
Dos.- El Sistema Nacional de Salud (en adelante SNS) es el modelo sanitario implantado en España para la garantía de la protección de la salud. Este se caracteriza como universal, gratuito y financiado a través de los impuestos. Su política se orienta a la garantía de atención a todas las personas y persigue la superación de los desequilibrios territoriales y sociales. La «cartera común suplementaria», que incluye todas aquellas prestaciones cuya provisión se realiza mediante dispensación ambulatoria y están sujetas a aportación del usuario, es decir, la prestación farmacéutica».
Tres.- El acceso universal a los servicios sanitarios públicos se encuentra establecido como una prestación no contributiva en especie del Régimen de la Seguridad social. Además, para disminuir la carga económica que generan las prestaciones farmacéuticas al SNS así como reducir el consumo inadecuado de medicamentos se ha impuesto el copago.
Cuatro.- La CIMP es la encargada de fijar los precios de los medicamentos industriales en función del coste de investigación y desarrollo, del beneficio empresarial y de los costes de promoción y publicidad. Por otro lado, es el Ministerio de Sanidad el encargado de determinar los PVP al regular el PVL y los márgenes de distribución y dispensación. Los Informes de Posicionamiento Terapéutico IPT) han facilitado la toma de decisiones sobre la inclusión o exclusión de medicamentos en el sistema de prestación farmacéutica español.
Cinco.- Existen tres regímenes de los precios industriales en la actualidad en España. Estos son: el sistema de precios de referencia, el sistema de precios seleccionados y el de agrupaciones homogéneas.
Seis.- Durante la crisis sanitaria por el nuevo coronavirus, el Estado ha regulado el abastecimiento y la dispensación de determinados productos, así como aumentado mediante donaciones el presupuesto de las prestaciones farmacéuticas. También se ha encargado de legislar la capacidad de este para regular los precios de medicamentos afectados en situaciones especiales como lo es la pandemia en la que nos encontramos inmersos.
Siete.- A pesar de que en España se encuentra regulado el comercio exterior de medicamentos, la Agencia Española de Medicamentos y Productos Sanitarios no autorizará una exportación que ponga en riesgo el abastecimiento de la población española. En el caso de las importaciones de medicamentos, los titulares de la autorización de comercialización prefieren vender sus medicamentos a Estados miembros donde van a recibir una cuantía económica mayor por el medicamento, que la que recibirán en España. Este hecho pone en riesgo el adecuado abastecimiento de medicamentos que se importan de otros países.
Ocho.-Los bajos precios de los medicamentos, así como los márgenes de dispensación y las deducciones en función del número de prescripciones médicas dispensadas, ponen en riesgo la viabilidad económica de algunas oficinas de farmacia, sobre todo de aquellas que se encuentren en un territorio menos urbano o rural.
Índice de locuciones latinas y abreviaturas utilizadas
CE: Constitución Española
CCAA: Comunidades Autónomas.
DOUE: Diario Oficial de la Unión Europea. PVL: Precio de venta laboratorio
PVP: Precio de venta al público
ITP: Informes de Posicionamiento Terapéutico
SNS: Sistema Nacional de Salud.
STJCE: Sentencia del Tribunal de Justicia de las Comunidades Europeas. STJUE: Sentencia del Tribunal de Justicia de la Unión Europea.
TJUE: Tribunal de Justicia la Unión Europea. v. gr.: Verbi gratia (por ejemplo).
UE: Unión Europea
Up supra: Referido a una frase o cláusula escrita mas arriba, y evitar su repetición.
13. REFERENCIAS
- Sánchez-Caro J. y Abellán, F, La relación clínica farmacéutico-paciente, La relación clínica farmacéutico-paciente: cuestiones prácticas de Derecho sanitario y bioética, Comares, Granada, 2007. p. 51.
- Bombillar Sáenz, F. M., “Intervención administrativa y régimen jurídico del medicamento en la Unión Europea”, 2010, Universidad de Granada, Granada.
- Tratado Constitutivo de la OMS, en vigor desde el 7 de abril de 1948. Disponible en: https://www.who.int/governance/eb/who_constitution_sp.pdf. Consultado el 9 de septiembre de 2021.
- Carta Social Europea. (Boletín Oficial del Estado 153, de 26 de junio de 1980). Disponible en: https://rm.coe.int/168047e013. Consultado el 9 de septiembre de 2021
- Carta de los Derechos Fundamentales de la Unión Europea. (DOCE C 364/1, de 18 de diciembre de 2000).
- Aparicio Pérez M. A. Y Barceló i Serramalera, M. Manual de Derecho Constitucional, 2ª ed., Atelier, Madrid, 2016, p. 740.
- European Court Of Human Rights. (2004). Grand Chamber Judgment In The Case Of Vo V. France. Número 350. 8.7.2004. 3p.
- Constitución Española de 1978 (Boletín Oficial del Estado 311, de 27 de diciembre de 1978).
- Bermejo Latre, J.L. “Sanidad y Administración sanitaria», en Bermejo Vera, J., Derecho Administrativo. Parte especial, Thomson-Civitas, Madrid 2009, p. 189.
- Escribano Collado, P., El derecho a la salud, Cuadernos del Instituto García Oviedo. Universidad de Sevilla, 1976, pp. 44-45.
- Pemán Gavín, J., Derecho a la salud y administración sanitaria (Bolonia, Publicaciones del Real Colegio de España, 1989), pp. 79 y 80.
- Loperena Rota, D., La protección de la salud y el medio ambiente adecuado para el desarrollo de la persona en la Constitución, en Estudios sobre la Constitución española. Libro homenaje el profesor Eduardo García de Enterría (Madrid, Civitas, 1991), ii, pp.1464-1465
- Ministerio de Sanidad y Consumo. Sistema de Informa de Atención Primaria (SIAP). Sistema Nacional de Salud. Disponible en: https://www.mscbs.gob.es/estadEstudios/estadisticas/docs/siap/SIAP0405.pdf Consultado el 14 de septiembre de 2021.
- Ministerio de Sanidad y Consumo. Sistema de Informa de Atención Primaria (SIAP). Sistema Nacional de Salud. Disponible en: https://www.mscbs.gob.es/estadEstudios/estadisticas/docs/siap/SIAP0405.pdf. Consultado el 13 de septiembre de 2021
- Ley 14/1986, de 25 de abril, General de Sanidad
- Pérez Gálvez, J.F., “Salud, sanidad y farmacia en el nuevo Estatuto de Autonomía de Andalucía” Revista de Derecho de la Pontificia Universidad Católica de Valparaíso XXIX, n.29, 2007. Disponible en: https://scielo.conicyt.cl/scielo.php?script=sci_arttext&pid=S0718-68512007000100010 Consultado el 1 de octubre de 2021
- Sentencia del Tribunal Constitucional 98/2004.
- Ministerio de Sanidad y Consumo. Sistema de Informa de Atención Primaria (SIAP). Sistema Nacional de Salud. Disponible en: https://www.mscbs.gob.es/estadEstudios/estadisticas/docs/siap/SIAP0405.pdf Consultado el 22 de septiembre de 2021.
- Bloomberg Healthiest Country. Bloomberg Finance L.P., 2019, (disponible en https://www.bloomberg.com; ultima consulta 03/05/2020). En esta misma línea, el informe Informe Euro Health Consumer Index sitúa el SNS, como el 19th. Vid. “Euro Health Consumer Index”. Health Consumer Powerhouse, 2018, (disponible en https://healthpowerhouse.com/media/EHCI-2018/EHCI-2018-report.pdf; última consulta 03/09/2021).
- Ministerio de Sanidad y Consumo. Sistema de Informa de Atención Primaria (SIAP). Sistema Nacional de Salud. Disponible en: https://www.mscbs.gob.es/estadEstudios/estadisticas/docs/siap/SIAP0405.pdf Consultado el 2 de octubre de 2021.
- Basante Pol, R.; Del Castillo Rodríguez, C., “Financiación de medicamentos: los aspectos jurídicos”, Anales Real Academia Nacional de Farmacia, vol. 79, n.º 2, 2013, pp. 293-307.
- Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios. (Boletín Oficial del Estado núm. 177, de 25 de julio de 2015).
- Ministerio de Sanidad Consumo y Bienestar Social. 2019. Informe anual del Sistema Nacional de Salud. Disponible en: https://www.mscbs.gob.es/estadEstudios/estadisticas/sisInfSanSNS/tablasEstadisticas/InfAnualSNS2019/Informe_SNS_2019.pdf Consultado el 8 de septiembre de 2021
- Real Decreto Legislativo 8/2015, de 30 de octubre, por el que se aprueba el texto refundido de la Ley General de la Seguridad Social. (Boletín Oficial del Estado núm. 261, de 31 de octubre de 2015).
- Ley 58/2003, de 17 de diciembre, General Tributaria. (Boletín Oficial del Estado núm. ,302, de 18/12/2003).
- Benítez-Llamazares, N. 2020. «La financiación de la sanidad pública española. Especial referencia a la crisis sanitaria generada por COVID-19». E-Revista Internacional de la protección Social. Vol V. nº 2, pp. 356-372.
- Real Decreto 271/1990, de 23 de febrero, sobre la reorganización de la intervención de precios de las especialidades farmacéuticas de uso humano. («Boletín Oficial del Estado» núm. 53, de 2 de marzo de 1990).
- Rovira Forns, J., Gómez Pajuelo, P. y Del Llano Señarís, J. La regulación del precio de los medicamentos en base al valor. L. 2012. Madrid: Fundación Gaspar Casal.
- Real Decreto-ley 16/2012, de 20 de abril de medidas urgentes para garantizar la sostenibilidad del SNS y mejorar la calidad y seguridad sus prestaciones. (Boletín Oficial del Estado núm. 98, de 24 de abril 2012).
- Instrucción de 13 de diciembre de 2002, de la Subsecretaría, por la que se coordinan los procedimientos administrativos relativos a la autorización y financiación con fondos públicos de las especialidades farmacéuticas. (Boletín Oficial del Estado núm. 304, de 20 de diciembre de 2002).
- Ministerio de Sanidad, Consumo y Bienestar Social. GESFARMA: Administración electrónica para la tramitación de procedimientos de financiación y fijación de precios de medicamentos por el SNS. Disponible en: https://www.mscbs.gob.es/profesionales/farmacia/gesfarma/pdf/Manual_de_usuario_La boratorios_19032018.pdf Consultado el 21 de septiembre de 2021.
- Resolución de 23 de noviembre de 2017, aprobada por la Comisión Mixta por las Relaciones con el Tribunal de Cuentas, en relación con el Informe de fiscalización de la actividad económica desarrollada por el Ministerio de Sanidad, Servicios Sociales e Igualdad, en relación con el área farmacéutica, ejercicios 2014 y 2015. ( Boletín Oficial del Estado, núm. 48, de 23 de febrero de 2018).
- Ministerio de Sanidad, Consumo y Bienestar Social. Reglamento interno de la Comisión Interministerial de Precios de los Medicamentos (CIMP). Disponible en: https://www.mscbs.gob.es/profesionales/farmacia/pdf/REGLAMENTO_CIMP_30_09_2019.pdf Consultado el 21 de septiembre de 2021
- Esteve Sala. E. Estudio de la comercialización efectiva de medicamentos en España y la influencia de la regulación del Sistema de Precios de Referencia y otras disposiciones del ámbito farmacéutico. Tesis Doctoral. 2018. Universitat de Barcelona.
- Real Decreto 177/2014, de 21 de marzo, por el que se regula el sistema de precios de referencia y de agrupaciones homogéneas de medicamentos en el Sistema Nacional de Salud, y determinados sistemas de información en materia de financiación y precios de los medicamentos y productos sanitarios. (Boletín Oficial del Estado núm. 73, de 25 de marzo de 2014).
- Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas. (Boletín Oficial del Estado núm. 236, de 02/10/2015).
- Orden SND/1121/2020, de 27 de noviembre, por la que se procede a la actualización en 2020 del sistema de precios de referencia de medicamentos en el Sistema Nacional de Salud. (Boletín Oficial del Estado 312, de 28 de noviembre de 2020).
- Vida Fernández, . J. “Financiación pública y fijación del precio de los medicamentos”, cit., p. 963.
- Ministerio de Sanidad. Dirección general de Cartera común de servicios del SNS y Farmacia. Plan para la consolidación de los informes de posicionamiento terapéutico de los medicamentos en el Sistema Nacional de Salud. Disponible en: https://www.mscbs.gob.es/profesionales/farmacia/IPT/docs/20200708.Plan_de_accion_ para_la_consolidacion_de_los_IPT.actCPF8Julio.pdf Consultado el 5 de septiembre de 2021
- Ministerio de Sanidad, Consumo y Bienestar Social. Reglamento interno de la Comisión Interministerial de Precios de los Medicamentos (CIMP). Disponible en: https://www.mscbs.gob.es/profesionales/farmacia/pdf/REGLAMENTO_CIMP_30_09_2019.pdf. Consultado el 5 de septiembre de 2021.
- Briera Dalmau, C. “Consideraciones sobre la Sentencia 387/17 del Tribunal Superior de Justicia de Madrid que condena a la Administración a refinanciar un medicamento excluido de la prestación farmacéutica”, Cuadernos de Derecho Farmacéutico, vol. 65, 2018, pp. 27-34.
- Lobato García-Miján, M. “Los precios de referencia autonómicos y la Sentencia del Tribunal Constitucional de 25 de mayo de 2004. Una victoria pírrica de las Comunidades Autónomas”, Cuadernos de Derecho Farmacéutico, vol. 9, 2004, pp. 27-30.
- Decreto-Ley 3/2011, por el que se aprueban medidas urgentes sobre prestación farmacéutica del Sistema Sanitario Público de Andalucía (Boletín Oficial de la Junta de Andalucía nº 245 de 16/12/2011).
- Batlles Ibález. Las subastas públicas de medicamentos en Andalucía.
- Gimeno Fleui, J.M. “La compra pública de medicamentos: hacia el necesario equilibrio entre calidad de la prestación asistencial y sostenibilidad financiera del sistema”, Revista Española de Derecho Administrativo, vol. 202, 2019.
- Dorrego de Carlos, A. “La selección competitiva de medicamentos dispensables en las oficinas de farmacia y la Sentencia 210/2016 del Tribunal Constitucional”, cit., pp. 6-23.
- Real Decreto-ley 4/2010, de 26 de marzo, de racionalización del gasto farmacéutico con cargo al Sistema Nacional de Salud. (Boletín Oficial del Estado núm. 75, de 27/03/2010).
- Real Decreto 823/2008, de 16 de mayo, por el que se establecen los márgenes, deducciones y descuentos correspondientes a la distribución y dispensación de medicamentos de uso humano. Boletín Oficial del Estado» núm. 131, de 30 de mayo de 2008.
- Real Decreto 463/2020, de 14 de marzo, por el que se declara el estado de alarma para la gestión de la situación de crisis sanitaria ocasionada por el COVID-19. (BOE núm. 67, de 14 de marzo de 2020).
- Ley Orgánica 4/1981, de 1 de junio, de los estados de alarma, excepción y sitio. (BOE núm. 134, de 5 de junio de 1981).
- Posada De La Paz, M. Vid. Artículo ¿Cómo enfrentarse a una crisis en Salud Pública?, MEDIFAM, nº1, vol. 12, enero de 2002. Pág. 1.
- Real Decreto-ley 6/2020, de 10 de marzo, por el que se adoptan determinadas medidas urgentes en el ámbito económico y para la protección de la salud pública. (BOE 62, de 11 de marzo de 2020).
- Del Castillo Rodríguez, C y Enríquez Fernández, S. Nuevas condiciones de dispensación de medicamentos durante el estado de alarma declarado con motivo de la crisis sanitaria ocasionada por la enfermedad covid-19». Revista española de derecho administrativo. Nº 207, 2020, págs. 287-298.
- Del Castillo Rodríguez, C y Enríquez Fernández, S Medicamentos y productos sanitarios utilizados para combatir la enfermedad COVID-19, el principio de cautela y regulación del abastecimiento en España. Revista General de Derecho Administrativo, ISSN-e 1696-9650, Nº. 57, 2021.
- del Real Decreto-ley 7/2020, de 12 de marzo, por el que se adoptan medidas urgentes para responder al impacto económico del COVID-19. (Boletín Oficial del Estado 65, de 13 de marzo de 2020; rect. Boletín Oficial del Estado 82 de 25 de marzo de 2020).
- Resolución de 25 de marzo de 2020, del Congreso de los Diputados. (BOE 88, de 30 de marzo de 2020).
- Real Decreto-ley 21/2020, de 9 de junio, de medidas urgentes de prevención, contención y coordinación para hacer frente a la crisis sanitaria ocasionada por el COVID-19. (Boletín Oficial del Estado 163, de 10 de junio de 2020).
- Benítez-Llamazares, N. 2020. «La financiación de la sanidad pública española. Especial referencia a la crisis sanitaria generada por COVID-19». E-Revista Internacional de la protección Social. Vol V. nº 2, pp. 356-372.
- Comisión Europea. Medicamentos asequibles, accesibles y seguros para todos: la Comisión presenta una Estrategia Farmacéutica para Europa. https://ec.europa.eu/commission/presscorner/detail/es/ip_20_2173 Consultado el 8 de septiembre de 2021.
- Directiva 2001/83/CE del Parlamento Europeo y del Consejo, de 6 de noviembre de 2001, por la que se establece un código comunitario sobre medicamentos para uso humano. (DOCE L 311/93, 28 de noviembre de 2001).
- Directiva 89/105/CEE, del Consejo de 21 de diciembre de 1988 relativa a la transparencia de las medidas que regulan la fijación de precios de los medicamentos para uso humano y su inclusión en el ámbito de los sistemas nacionales del seguro por enfermedad. (DOCE L 40/8, de 11 de febrero de 1989).
- López-Casasnovas, G. and Pifarré i Arolas, H. (2021), «The Spanish Health-care System», Baltagi, B.H. and Moscone, F. (Ed.) The Sustainability of Health Care Systems in Europe (Contributions to Economic Analysis, Vol. 295), Emerald Publishing Limited, Bingley, pp. 189-207. https://doi.org/10.1108/S0573-855520210000295016
- OECD. Health at a glance 2019: OECD indicators. Paris: OECD Publishing. doi: 10.1787/4dd50c09-en. Consultado el 15 de septiembre de 2021
- Subdirección General de Información Sanitaria e Innovación del Ministerio de Sanidad, Consumo y Bienestar Social, sobre documentos de organismos internacionales: Organización Mundial de la Salud y Organización para la Cooperación y el Desarrollo Económicos. Disponible en: https://www.mscbs.gob.es/orgnizacion/orgInternacionales/relacionesUEyOOII/home.htm. Consultado el 30 de septiembre de 2021
- Espín Balbino, J. El sector farmacéutico y los medicamentos en la Unión Europea: una aproximación a los retos actuales, Escuela Andaluza de Salud Pública, Serie Monografías EASP nº 43, Granada, 2004, págs. 45-65.
- Sentencia del Tribunal Superior de Justicia de la Unión Europea de 19 de octubre de 2016, Asunto C-148/15, Deutsche Parkinson Vereinigung eV.
- Faus y Moliner, «La protección de la salud no justifica impedir descuentos en las ventas de medicamentos por internet». Disponible en: http://www.pmfarma.es/derecho/431-la- proteccion-de-la-salud-no-justifica-impedir-descuentos-en-las-ventas-de-medicamentos- por-internet.html. Consultado el 10 de septiembre de 2021.
- Comisión Europea. Communication from the Commission, Brussels, 30 December 2003, COM (2003) 839 final. Disponible en: https://ec.europa.eu/health/sites/default/files/files/eudralex/vol-1/com_2003_839/com_2003_839_en.pdf. Consultado el 20 de septiembre de 2021.
- Espín-Balbino, “La regulación económica de los medicamentos y el comercio paralelo en la Unión Europea”, en F. Balaguer Callejón; E. Arana García (Coords.) Libro homenaje al profesor Rafael Barranco Vela, vol. 2, Thomson Reuters-Civitas, Cizur Menor, 2014, p. 190
- Real Decreto 1785/2000 , de 27 de octubre, sobre la circulación intracomunitaria de medicamentos de uso humano. (Boletín Oficial del Estado núm. 259, de 28 de octubre de 2000).
- Agencia Española de Medicamentos y Productos Sanitarios. Circular nº 2/2012. Notificación previa de envíos de medicamentos a otros Estados miembros. Disponible en: https://www.aemps.gob.es/informa/notificacion-previa-de-envios-de-medicamentos-a- otros-estados-miembros/ Consultado el 6 de septiembre de 2021
- Herrera, M. ¿Cuál es el precio de los medicamentos en España y resto de países europeos? Disponible en: https://www.65ymas.com/consejos/cual/precio-medicamentos- espana-resto-paises-europeos_2574_102.html. Consultado el 1 de octubre de 2021.
- Farmainduustria. La marca como instrumento de creación de valor para la empresa. Las peculiaridades del medicamento. Farmaindustria: 2008. 184 p.
- EFE. La población rural cae un 10% desde el año 2000. Disponible en: https://www.efeagro.com/noticia/la-poblacion-rural-baja-10-desde-ano-2000/ Consultado el 16 de septiembre de 2021
- Ministerio de Sanidad Consumo y Bienestar Social. Prestación farmacéutica en el SNS. Informe monográfico. Disponible en: https://www.mscbs.gob.es/estadEstudios/estadisticas/sisInfSanSNS/tablasEstadisticas/Inf AnualSNS2019/Informe_PrestacionFarmaceutica_2019.pdf. Consultado el 15 de septiembre de 2021.
- FEFE. Observatorio del Medicamento de FEFE del año 2015. Disponible en: http://fefe.com/wp-content/uploads/2015/07/observatorio-medicamento-2015-mayo.pdf Consultado el 12 de septiembre de 2021.