RESUMEN:
El tratamiento adecuado de las enfermedades raras y el uso racional de los medicamentos huérfanos constituye actualmente uno de los retos más importantes para el Sistema Sanitario, y un continuo desafío para los Servicios de Farmacia Hospitalaria. El reducido número de medicamentos huérfanos comercializados, la escasa evidencia sobre su relación beneficio-riesgo y su elevado precio conllevan una elevada incertidumbre en la gestión de estos fármacos. Desde la Farmacia Hospitalaria se pretende trabajar para reducir el grado de incertidumbre asociado a la gestión farmacoterapeutica de las enfermedades raras. Para ello, es preciso trabajar en el conjunto de las etapas que constituyen el proceso farmacoterapéutico y que faciliten, entre otras, la disponibilidad de tratamientos, evitar inequidades, y conseguir los mejores resultados en salud, además de contribuir a la sostenibilidad del sistema. La aportación del farmacéutico de hospital ha sido clave en múltiples etapas del proceso como la evaluación, selección y planificación de medicamentos huérfanos, la adquisición y la gestión farmacoeconómica de medicamentos huérfanos, la elaboración de tratamientos, la dispensación de medicamentos, el seguimiento y optimación de los tratamientos con la aplicación de la farmacocinética clínica o más recientemente el abordaje de prácticas de humanización en la atención al paciente con enfermedades raras.
Palabras Clave: Medicamentos huérfanos, enfermedades raras, farmacia hospitalaria, gestión farmacoterapéutica
ABSTRACT:
Currently the adequate management of rare diseases and the rational use of orphan drugs constitute one of the most important challenges for the health system, furthermore these constitute a continuous challenge for Hospital Pharmacy Services. Rare diseases and orphan drugs management have high level of uncertainty due to small number of orphan drugs available, limited evidence on their benefit-risk ratio, and orphan drugs high price. The Hospital Pharmacy works to reduce the degree of uncertainty associated with the rare diseases pharmacotherapeutic management. To reach this goal is necessary to work on all the stages that constitute the pharmacotherapeutic process and that facilitate treatments availability, avoid inequalities, and achieve the best health results, and finally to contribute to health system sustainability . The work of the hospital pharmacist has been key in multiple stages of pharmacotherapeutic process such as evaluation, selection and planning of orphan drugs, acquisition and pharmacoeconomic management of orphan drugs, preparation of treatments, dispensing of medicines, monitoring and optimization of treatments by application of clinical pharmacokinetics or, more recently, approach humanization healthcare practices in patients with rare diseases.
Keywords: Orphan drugs, rare diseases, hospital pharmacy, pharmacotherapeutic management
1. INTRODUCCIÓN
Las Enfermedades raras (EERR) engloban un conjunto de trastornos graves, potencialmente mortales, debilitantes o que conllevan una incapacidad crónica y presentan una escasa prevalencia en la población. En la Unión Europea (UE) se definen como aquellas que tienen una prevalencia inferior a 5 casos por cada 10.000 habitantes. Se denomina enfermedad ultra-rara cuando afecta a menos de 1 persona por cada 50.000 habitantes. Aunque se denominan enfermedades minoritarias, la Organización mundial de la Salud (OMS) estima que existen actualmente entre 5.000 y 8.000 EERR, por lo tanto, a pesar de tratarse de enfermedades poco frecuentes de forma aislada, en su conjunto son importantes ya que afectan a alrededor de 25 millones de individuos en los Estados Unidos, unos 30 millones en la UE y a más de 300 millones de personas en todo el mundo. En España cerca de 3 millones de ciudadanos se ven afectados por alguna EERR (1).
En el ámbito asistencial y social los pacientes con EERR tienen que lidiar con numerosas dificultades: falta de información y conocimiento científico, falta de datos epidemiológicos y clínicos de la enfermedad, dispersión geográfica de los pacientes afectados por la misma patología, demora en el diagnóstico, falta de centros de referencia y tratamientos autorizados, en el caso de existir tratamientos autorizados existencia de desigualdades en el acceso a esos tratamientos, falta de atención integral y problemas de integración social escolar y laboral (1,2).
Para los sistemas de salud, clásicamente orientados al cuidado de las enfermedades de alta prevalencia, las EERR suponen un desafío debido a la complejidad de estas enfermedades, los nuevos hallazgos biotecnológicos y las demandas específicas que presenta este colectivo de pacientes.
2. MEDICAMENTOS HUÉRFANOS
Los medicamentos huérfanos (MMHH) son aquellos destinados a establecer un diagnóstico, prevenir o tratar una EERR o ultra-rara y cuya comercialización resulta poco probable sin incentivos adicionales (3).
El desarrollo de MMHH tiene dificultades particulares debidas al escaso conocimiento de la fisiopatología de la enfermedad, la falta de modelos preclínicos específicos, el infradiagnóstico, el reducido número de expertos clínicos y la dificultad en realizar ensayos clínicos por el reducido tamaño muestral o la falta de variables clínicas validadas, lo que aumenta la inversión necesaria para el desarrollo de un nuevo medicamento y la incertidumbre asociada a su efectividad. Además, la Industria debe generar suficientes beneficios para justificar la inversión realizada con ventas a un número muy reducido de pacientes antes de que expire la correspondiente patente.
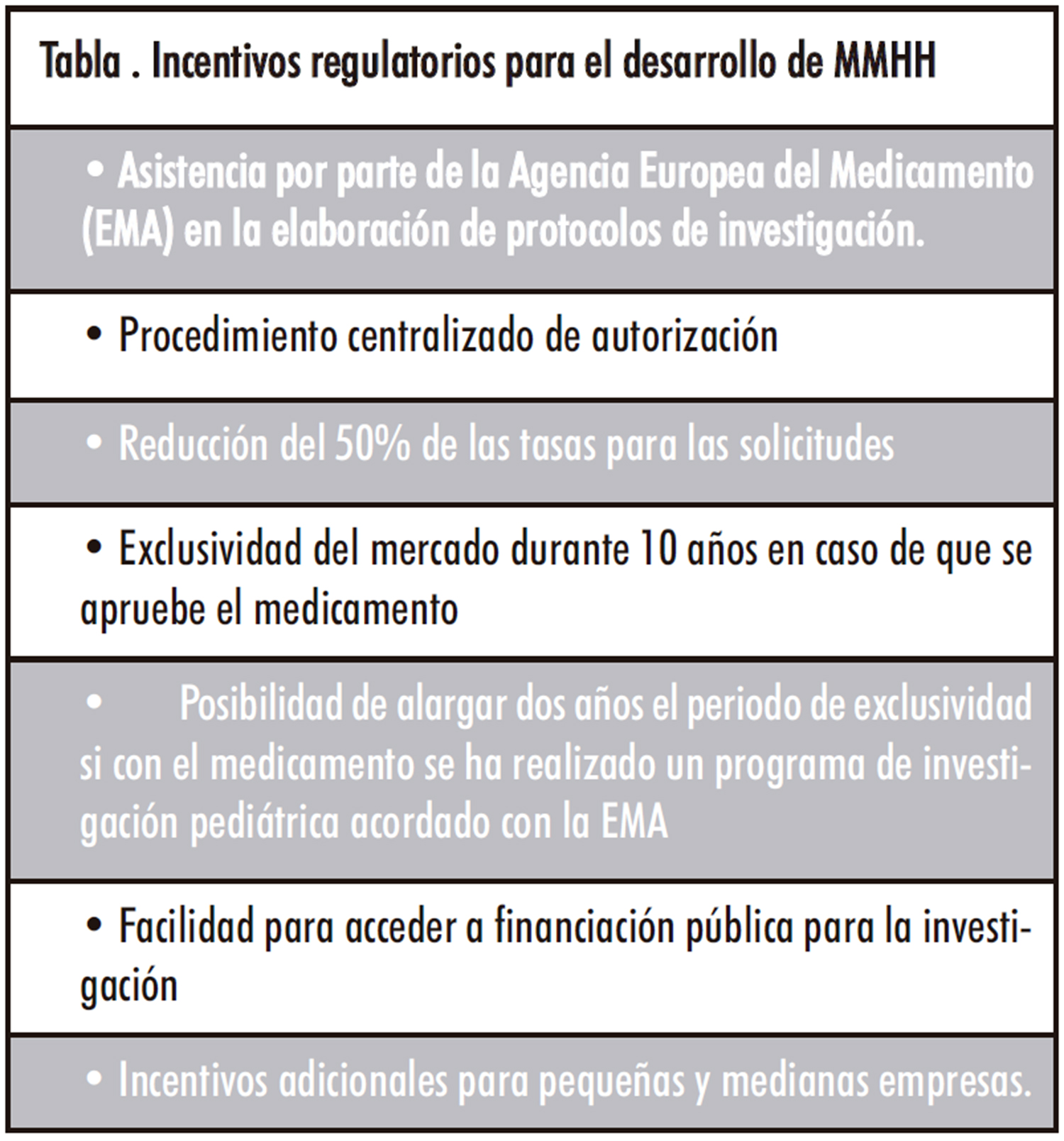
Tratar de salvar estas dificultades y apoyar el desarrollo de MMHH, ha llevado a los diferentes países a establecer estímulos y políticas que fomenten la investigación y el desarrollo de nuevos fármacos para EERR. Estados Unidos fue el primer país en desarrollar políticas al respecto. En 1983 promulgó la Ley de Medicamentos Huérfanos, que incluía exclusividad de mercado durante 7 años, ayudas para la realización de ensayos clínicos y exención de tasas para actividades reguladoras que se ofrecían a las compañías farmacéuticas para la puesta en marcha de programas de investigación y desarrollo de nuevos medicamentos para EERR. Además de incentivos económicos, también se les ofrecía protocolos de asistencia, acceso a subvenciones específicas y asesoramiento para el desarrollo (4). Posteriormente, en el año 2000, en Europa se aprobó el Reglamento nº 141/2000, del Parlamento Europeo y del Consejo, de 16 de diciembre de 1999, sobre medicamentos huérfanos, que además de fijar el procedimiento para declarar un fármaco como MMHH, estableció incentivos para fomentar la investigación, desarrollo y comercialización de dichos fármacos. La concesión de la designación huérfana permite inscribir el medicamento en el «Registro comunitario de medicamentos huérfanos» y conlleva importantes incentivos recogidos en la Tabla 1.
Los incentivos regulatorios han obtenido resultados positivos, observándose desde su incorporación un incremento en el número de peticiones y de designaciones de MMHH. En el último informe de la EMA, correspondiente al periodo 2000-2020, de las 3.678 solicitudes de designación de medicamentos huérfanos recibidas, el 64,8 % obtuvo una opinión favorable del Comité de Medicamentos Huérfanos de la Agencia Europea para la Evaluación de Medicamentos (COMP) (5). Sin embargo, la designación de un medicamento como huérfano es sólo un paso preliminar y no garantiza su uso en la condición designada ni implica necesariamente que el producto satisfaga los criterios de eficacia y seguridad. Para la concesión de la autorización de comercialización deben realizarse los ensayos clínicos pertinentes, como en cualquier otro medicamento. Por último, antes de que un MMHH esté disponible para los pacientes, el medicamento debe pasar por los organismos administrativos de cada país para gestionar su puesta en el mercado (condiciones de financiación y precio). Por tanto, un MMHH sólo es accesible cuando está comercializado y financiado.
De manera general se puede afirmar que características principales de los MMHH son su elevada incertidumbre sobre la relación beneficio-riesgo y su elevado coste. La incertidumbre en la relación beneficio-riesgo es consecuencia del diseño y las características de los ensayos clínicos. Alglucerasa, primer fármaco para terapia enzimática sustitutiva para la enfermedad de Gaucher, fue autorizado en 1998 por la Food and Drug Administration (FDA), en base a los resultados de un único ensayo clínico abierto sin grupo comparador, que incluyó únicamente 12 pacientes con un seguimiento de 9 meses (6). En el ámbito de la oncología, ya de por si con elevada incertidumbre, los ensayos clínicos de MMHH, en comparación con los medicamentos no designados como huérfanos, presentan menor reclutamiento, mayor utilización de diseños no aleatorizados ni enmascarados y menor utilización de variables finales de resultado (7). Respecto al elevado coste, en el entorno europeo, el gasto de MMHH se situaría, según las últimas publicaciones, en el 7,2% del coste farmacéutico total y los costes medios anuales por paciente de este tipo de tratamientos oscilan entre 27.811 y 1.647.627 euros (8,9).
Las características anteriormente descritas conllevan serias dificultades en la toma de decisiones a nivel de la autorización centralizada por la EMA, su posterior autorización de comercialización en España por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y la resolución de financiación por parte del Ministerio de Sanidad. De las designaciones de MMHH concedidas desde el año 2000 (aproximadamente 2.380) solo se han autorizado 224 medicamentos huérfanos (8,7%): 190 medicamento de nueva autorización y 34 medicamentos ya autorizados con nueva indicación huérfana. Según los últimos datos (31 de diciembre de 2020) en Europa se dispone de un total de 116 MMHH autorizados con designación huérfana vigente. De estos 116 MMHH, 99 (85%) han adquirido código nacional en España, 51 (44%) disponen de autorización de comercialización en nuestro país y sólo 46 (40%) están financiados por el Sistema Nacional de Salud. Concretamente en el año 2020, de los 18 MMHH autorizados por la EMA se financiaron 5 (10). A nivel autonómico existe la posibilidad de ampliar la Cartera Básica de Servicios del SNS y Farmacia para aquellos medicamentos no incluidos en la financiación del SNS, sin embargo, esta ampliación no es posible si existe, de manera expresa, una resolución de no financiación.
Los tiempos de espera para lograr la financiación pública son otro gran escollo en el acceso a los MMHH. En 2003 la media de tiempo desde la autorización de la EMA hasta la resolución de financiación era de 25 meses. En los últimos años, este tiempo se había reducido considerablemente hasta mantenerse alrededor de los 12-13 meses. Sin embargo, este pasado año 2020, el tiempo promedio aumentó 19 meses alcanzando los 33,1 meses de media. Y la tendencia es similar para algunos de los 53 medicamentos que están pendientes de financiación positiva a fecha 31 de diciembre de 2020; un 54% de los mismos lleva más de 3 años esperando decisión de financiación (10,11).
3. GESTIÓN FARMACOTERAPÉUTICA DE LOS MEDICAMENTOS HUÉRFANOS
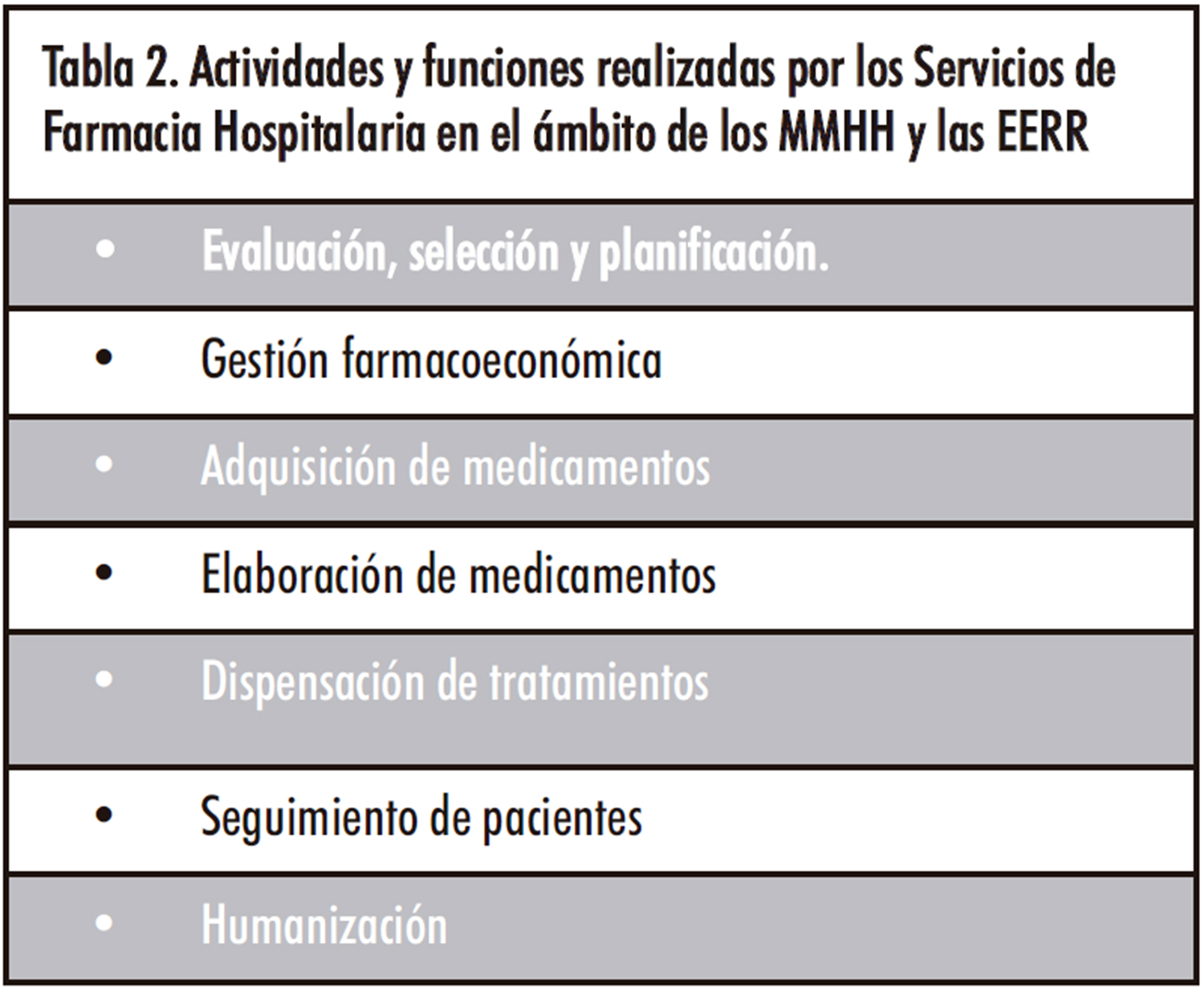
Las funciones y responsabilidades de los Servicios de Farmacia Hospitalaria están recogidas en el marco regulatorio nacional correspondiente y también en diferentes normas legislativas autonómicas (12,13). En el ejercicio de sus funciones de acuerdo a la legislación vigente, los Servicios de Farmacia tienen un largo recorrido en el manejo de las características principales de las MMHH señaladas anteriormente: la incertidumbre en la relación beneficio-riesgo y elevado impacto económico que conllevan. Las actividades y funciones realizadas en el ámbito de los MMHH y las EERR se recogen en la Tabla 2 y se desarrollan a continuación.
3.1. Evaluación, selección y planificación
El proceso de evaluación y selección de medicamentos en los hospitales es un proceso clave y estratégico y a la vez es una tarea multidisciplinar y participativa en la que intervienen distintos profesionales. Esta tarea se lleva a cabo en las Comisiones de Farmacia y Terapéutica (CFT). La CFT es una comisión clínica hospitalaria que actúa como órgano de asesoramiento, consulta, coordinación e información relacionada con los medicamentos en el hospital. Debe constituirse como una asesoría que, tanto de forma pasiva (respuesta a solicitudes de inclusión/exclusión de medicamentos de la guía farmacoterapeutica) como de forma activa (criterios explícitos de utilización de medicamentos, boletines de difusión periódica sobre información de medicamentos, etc.) incremente la calidad del uso de los medicamentos y el conocimiento de los mismos por parte de los profesionales sanitarios de un centro hospitalario. Se considera una comisión asesora de la Dirección del hospital y es una estructura bien asentada en la mayoría de países europeos, con una alta homogeneidad en cuanto a su composición, funcionamiento y herramientas de evaluación, donde destaca la participación universal de los farmacéuticos de hospital (14-16).
Las actividades del farmacéutico hospitalario en el seno de esta comisión se dirigen a la búsqueda de información, la evaluación crítica de la literatura, el análisis comparativo de las alternativas terapéuticas, la evaluación de la seguridad y la realización de estudios de farmacoeconomía. Afortunadamente en el ejercicio de esta actividad los farmacéuticos de hospital cuentan con diferentes herramientas de ayuda. Una de estas herramientas es el Informe de Posicionamiento Terapéutico (IPT). Para evitar una evaluación redundante con el consecuente consumo de recursos y la generación de inequidades en el sistema, el Ministerio de Sanidad instauró en 2013 los IPT que condensan en un único informe, reconocible por todo el SNS, la evidencia científica sobre un nuevo medicamento. En la elaboración de estos informes participan representantes de las 17 comunidades autónomas, de la AEMPS y del Ministerio de Sanidad. Desde 2013 se han publicado más de 300 informes, casi un tercio son de MMHH (17).
Otro elemento de apoyo importante en la evaluación y selección de medicamentos es el Grupo de Evaluación de Novedades, EStandarización e Investigación en Selección de Medicamentos (GENESIS) fundado en el seno de la Sociedad Española de Farmacia Hospitalaria (SEFH) en el año 2005. Este grupo surge como respuesta a la necesidad de una mayor coordinación y colaboración horizontal entre los hospitales, proporcionando una metodología común de evaluación de medicamentos, que garantice la toma de decisiones de calidad en el marco del sistema de salud. Los instrumentos metodológicos, los modelos de evaluación y el resultado de este grupo de trabajo se encuentran disponibles en la página web de la SEFH. Actualmente se dispone de 1.150 informes elaborados por distintos hospitales o mediante un sistema colaborativo siguiendo el modelo GENESIS. Igualmente se puede acceder y descargar el programa Método de Ayuda para la toma de Decisiones y la Realización de Evaluaciones de medicamentos (MADRE.4), que consiste en un conjunto de herramientas para facilitar la realización de informes de evaluación de forma ordenada y sistemática (18).
Sin embargo, a pesar de disponer de estas herramientas que ayudan a fijar el valor terapéutico de los medicamentos, la evaluación y selección de MMHH plantea numerosas dificultades. Ya en 2016, el Instituto Carlos III, en el documento Criterios de Financiación y Reembolso de los Medicamentos huérfanos señalaba que los criterios de coste-efectividad no deben ser los únicos utilizados para justificar la financiación de un MMHH y que la mayor parte de los países desarrollados basan la financiación de los medicamentos huérfanos en ciertos criterios adicionales, con el fin de acelerar el acceso a los mismos por parte de los pacientes (19). Además , a diferencia de otros países, en España no existe un umbral de eficiencia, es decir, no existe un umbral de coste por año de vida ajustado por calidad (AVAC) que refleje la disponibilidad a pagar por la sociedad por cada AVAC ganado con las diferentes terapias.
Según el Real Decreto Legislativo 1/2015, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, la inclusión de medicamentos en la financiación del SNS se realiza teniendo en cuenta distintos criterios generales, objetivos y publicados. Estos criterios son la gravedad, duración y secuelas de la enfermedad, las necesidades específicas de ciertos colectivos, el valor terapéutico y social del medicamento y su relación coste-efectividad, la racionalización del gasto público, la disponibilidad de alternativas y el grado de innovación (12). Por tanto, el propio marco legislativo invita a la utilización de un análisis multicriterio. Muchos de los criterios recogidos en la ley parecen perfectamente alineados hacia un impacto positivo en el acceso a MMHH, sin embargo, muchas veces el impacto de la relación coste-efectividad, la importancia de la racionalización del gasto público y el control publicitario pueden conllevar a resoluciones negativas.
En este sentido, el grupo de trabajo de Enfermedades Raras y Medicamentos Huérfanos de la SEFH (Orpha-SEFH) lleva tiempo trabajando en el desarrollo de herramientas que apoyen a los decisores tanto a nivel macro (MSSI), meso (CC.AA) y micro (hospitales), en la evaluación y determinación del valor terapéutico de los MMHH. En este contexto, el Análisis de Decisión Multicriterio (ADMC) se propone como una nueva herramienta que puede aportar congruencia y trasparencia a la hora de la evaluación para decidir la financiación y el acceso a fármacos nuevos. A nivel nacional, existen limitadas experiencias en las que el ADMC se utilice para determinar la contribución de valor de un medicamento desde una perspectiva holística (20,21). El ADMC desarrollado por el grupo de trabajo, incorpora a las evaluaciones tradicionales de eficacia, seguridad y coste, aspectos sobre las necesidades no cubiertas, criterios de calidad de vida y de gravedad de la enfermedad, valor de costes indirectos, criterios sobre la calidad de la evidencia científica y la asequibilidad (22). De forma muy resumida, el flujo de trabajo del grupo Orpha-SEFH para la realización del ADMC de MMHH se inicia cuando la EMA autoriza un medicamento. A partir de entonces empieza un trabajo colaborativo en el que se elabora una matriz de evidencia que es puntuada, analizada y debatida por todos los miembros del grupo, obteniéndose como resultado la emisión un informe de evaluación y posicionamiento del MMHH que se pone a disposición pública en la web del grupo y se difunde en medios científicos a través de la publicación en revistas científicas (23,24).
La segunda herramienta metodológica desarrollada por el grupo de trabajo Orpha-SEFH es el Horizon scaning de MMHH. Horizon Scanning se define como un examen sistemático de la información para identificar posibles amenazas, riesgos, problemas emergentes, tendencias potenciales, oportunidades o nuevas tecnologías que podrían afectar a un área de interés. La identificación de todas ellas ayuda a los equipos a planificar el futuro aprovechando tales desarrollos y estando mejor preparados para cuando ocurran (25). En el área de las innovaciones terapéuticas, se están desarrollando diferentes programas Horizon Scanning en Europa y tanto los sistemas de salud de Reino Unido como el italiano hace tiempo que vienen utilizando esta herramienta eficiente para el apoyo a la toma de decisiones y uso racional de los recursos disponibles (26,27). A nivel nacional, en 2018 el Ministerio de Sanidad propuso el Horizon Scanning, como una de las seis líneas estratégicas para favorecer el acceso a la innovación terapéutica. El grupo Orphar-SEFH publicó en febrero del 2020 el primer informe Horizon Scanning de MMHH con el objetivo de conocer la innovación que podría ser introducida en el SNS a corto y medio plazo y colaborar en la planificación de los recursos necesarios. Además, disponer de esta información en términos de valor es vital para una toma de decisiones que debe ser rápida tanto en la evaluación, como en la decisión de la financiación pública en el SNS. Debido a la generación constante de información sobre solicitudes de autorización de MMHH, estos informes se actualizan periódicamente. En el último informe publicado en diciembre de 2020, se identificaron un total de 82 nuevas moléculas (además de 3 MMHH que se encuentran en estudio de financiación con propuesta de resolución de precio negativo) y 4 nuevas indicaciones que están por llegar al mercado español (28).
3.2. Gestión farmacoeconómica
La farmacoeconomía afronta un reto de difícil manejo en el campo de los MMHH. La elevada incertidumbre debido a los resultados clínicos de los MMHH y al potencial impacto presupuestario final debe reconocerse en la asignación de precios y precisa nuevos modelos de financiación. Este nuevo modelo son los acuerdos de riesgo compartido (ARC). Este tipo de acuerdos son mecanismos de reembolso que facilitan el acceso a los fármacos sobre los que existe falta de evidencia sobre sus resultados clínicos y/o financiero, de manera que se vincula el precio de una innovación terapéutica con una serie de variables asociadas, objetivos y resultados. Los ARC se clasifican en acuerdos financieros y acuerdos basados en resultados. Entre los ARC financieros destacan los descuentos y los acuerdos precio/volumen, siendo los más utilizados por su sencillez. Los acuerdos que fijan límites de utilización (uso, tiempo o coste) como los techos de gasto o aquellos en los que la industria financia el inicio del tratamiento vinculándose su continuidad a determinadas condiciones, tienen por objetivo reducir la incertidumbre presupuestaria. Por su parte, los acuerdos basados en resultados pretenden acotar el riesgo derivado de financiar casos de pacientes que no responden al tratamiento y que no podrían haber sido identificados previamente. Bajo un esquema «no cure, no pay», si el medicamento no logra curar, aliviar o reducir los síntomas como estaba previsto, el fabricante debe devolver el pago recibido o parte del mismo. En este grupo también encontramos los acuerdos de cobertura condicional hasta la disposición mayor evidencia del fármaco en cuestión (29).
En Europa se están utilizando cada vez más los ARC para gestionar los aspectos de la incertidumbre asociados con la introducción de los MMHH en el sistema sanitario. Italia es el país con mayor número de esquemas y los antineoplásicos son los MMHH más prevalentes en los acuerdos, siendo la mitad acuerdos financieros, y el resto basados en resultados clínicos (30). La primera experiencia publicada de pago por resultados clínicos en MMHH en España fue la realizada en el Hospital Universitari i Politècnic La Fe, que inició un programa de riesgo compartido en 2012 para la adquisición del tratamiento de EERR de depósito lisosomal donde se incluyeron 8 pacientes (4 con enfermedad de Hurler, 2 con Pompe y 2 con Gaucher). Tras analizar las variables y criterios de respuesta definidos, todos los pacientes presentaron efectividad plena tras 2 o 3 años de seguimiento, por tanto dada la efectividad alcanzada, el hospital realizó el pago íntegro a los laboratorios farmacéuticos de todos los tratamientos administrados (31). Aunque el impacto económico fue limitado, el mayor logro fue reducir la brecha de conocimiento entre eficacia y efectividad constatando que las terapias administradas mostraron los beneficios óptimos por los que está dispuesto a pagar el financiador.
La principal dificultad para la aplicación generalizada de los ARC es la deficiencia de registros de resultados en salud. Para tratar de salvar esa dificultad el Ministerio de Sanidad lanzó en noviembre de 2019 el programa VALTERMED, acrónimo de VALor TERapéutico de los MEDicamentos. Este programa consiste en un sistema de información corporativo del SNS para determinar el valor terapéutico en la práctica clínica real de los medicamentos que se utilizan en España. El objetivo principal del programa es disponer de información óptima para la adecuada toma de decisiones en la gestión macro, meso y micro de la prestación farmacéutica, en las distintas etapas del ciclo del medicamento. El alcance prioritario de VALTERMED son los medicamentos de alto impacto sanitario y económico, por tanto es un nicho adecuado para los MMHH (32). El primer medicamento incluido en VALTERMED fue tisagenlecleucel (Kymriah®), una terapia Cart-T. El ARC publicado consistía en el reembolso en dos etapas: un primer pago de 52% del coste en el momento del tratamiento y un segundo pago del 48% restante, a los 18 meses, si el paciente ha logrado y mantenido una respuesta completa al tratamiento. Posteriormente se han incorporado otros MMHH en el programa. Pese a los logros y ventajas de estos acuerdos y programas, todavía existen numerosas barreras para su implantación como las reticencias o la dificultad de establecer contratos de confidencialidad con la industria farmacéutica, la complejidad para definir las variables clínicas de eficacia o los recursos necesarios para implantarlos, entre ellos estructuras y sistemas de información.
Sin duda uno de los elementos que más ha contribuido a la incorporación de innovaciones terapéuticas en la práctica clínica es la comercialización de medicamentos genéricos y medicamentos biosimilares. En el ámbito de las EERR y los MMHH no ha sido diferente. A fecha de diciembre de 2020, 47 medicamentos con designación huérfana habían vencido su periodo de exclusividad de 10 años. De estos 47, únicamente 13 tienen genérico comercializado en España (33). Miglustat, indicado para la enfermedad de Gaucher, fue el primer genérico de un MMHH. Este genérico se comercializó en 2014 un 38% más barato que su homólogo de referencia. Actualmente la competencia de mercado ha hecho que ambos medicamentos (genérico y de referencia) se comercialicen al mismo precio. Por lo tanto, la incorporación de genéricos y biosimilares es una opción muy interesante que contribuye a la sostenibilidad en este tipo de terapias de tan elevado coste.
3.3. Adquisición de MMHH
Los MMHH son, en su mayoría, medicamentos de uso hospitalario y por tanto la responsabilidad de su adquisición recae en los Servicio de Farmacia Hospitalaria. El cauce habitual de adquisición de MMHH autorizados, comercializados y financiados por el SNS es la compra a los laboratorios farmacéuticos. Sin embargo, es muy frecuente encontrarse con la necesidad de adquirir medicamentos para EERR que no pueden conseguirse mediante los cauces habituales. En esta situación es necesario recurrir a vías alternativas de adquisición que permitan garantizar el tratamiento de los pacientes: los ensayos clínicos y la gestión de medicamentos en situaciones especiales.
Cuando el paciente no tiene alternativas terapéuticas, la inclusión en un ensayo clínico es la opción más conveniente, siempre y cuando el paciente de su consentimiento. En abril de 2021 en Europa estaban registrados 19.831 ensayos clínicos, de ellos 1253 eran ensayos clínicos con medicamentos con designación huérfana. España, en la mismas fechas estaban registrados 6.257 ensayos clínicos de los cuales 635 eran con MMHH.
La legislación española considera a los Medicamentos en situaciones especiales cuando su uso se engloba en alguno de los siguientes supuestos (34):
a) Uso compasivo de medicamentos en investigación: utilización de un medicamento antes de su autorización en España en pacientes que padecen una enfermedad crónica o gravemente debilitante o que se considera que pone en peligro su vida y que no pueden ser tratados satisfactoriamente con un medicamento autorizado. Se trata de un uso de medicamentos en investigación al margen del ensayo clínico.
b) Medicamentos no autorizados en España (extranjeros): utilización de medicamentos autorizados en otros países, pero no autorizados en España, cuando no cumplan con la definición de uso compasivo de medicamentos en investigación. Muchos de los MMHH deben de ser tramitados como medicamentos extranjeros ya que, en España, una vez autorizados por la EMA, debe realizarse el proceso de fijación de precio y acuerdo de financiación por el SNS, lo que demora su disponibilidad en el mercado nacional.
c) Uso de medicamentos en condiciones diferentes a las autorizadas: utilización de medicamentos en condiciones distintas de las incluidas en la ficha técnica autorizada. También conocidos como medicamentos fuera de ficha técnica u “off label”.
Los Servicios de Farmacia Hospitalaria deben de tramitar el uso de los medicamentos en situaciones especiales a través de la AEMPS. Esta solicitud requiere adjuntar documentación clínica que justifique la necesidad de uso, la evidencia científica que apoye la solicitud y el consentimiento informado del paciente. En un hospital terciario y de referencia para numerosas patologías como el Hospital Universitari i Politècnic La Fe de Valencia en el año 2020 se tramitaron 2.087 solicitudes de medicamentos en situaciones especiales que permitieron el acceso al tratamiento a más de 1.100 pacientes.
3.4. Elaboración de medicamentos
Ante la falta de comercialización de medicamentos o la existencia de problemas de disponibilidad, bien por problemas puntuales de suministro, o bien porque deja de comercializarse por falta de rentabilidad, la formulación magistral, pretende cubrir las necesidades de los pacientes. Por otra parte, las presentaciones disponibles de los medicamentos comercializados no siempre se encuentran listas para administrar o en el modo requerido para cubrir las necesidades de todos los pacientes. En esas situaciones se debe recurrir a la preparación de medicamentos adaptados a la situación clínica, de tal forma que puedan ser administrados en las dosis precisas y durante un periodo de tiempo determinado según los requerimientos individuales. En España, en el marco del uso racional del medicamento, la responsabilidad técnica de la preparación de medicamentos en los hospitales recae sobre los Servicios de Farmacia, pudiéndose realizarse fuera del Servicio de Farmacia preparaciones extemporáneas de bajo riesgo (p.ej., reconstitución de medicamentos). Las actividades desarrolladas en los Servicios de Farmacia que permiten adaptar la presentación de los medicamentos a las necesidades individuales de los pacientes son la formulación magistral y el acondicionamiento (12,35).
En el ámbito de las EERR, debido a los problemas de acceso a nuevos tratamientos, especialmente por el limitado número de fármacos comercializados, las fórmulas magistrales son, en ocasiones, la única alternativa para tratar los síntomas de la enfermedad y mejorar la calidad de vida de estos pacientes. La necesidad de elaboración de medicamentos es aún más importante en la población pediátrica dado que una gran parte de las EERR (alrededor del 50%) afecta a la población pediátrica, por lo que una vez solucionada la adquisición del medicamento es muy probable que se necesiten dosificaciones o formas farmacéuticas distintas de la original, o bien que sea necesario acondicionar la materia prima para que se adapte mejor a las características del paciente (36). Los profesionales de la Farmacia Hospitalaria, conocedores de la dificultad de la elaboración y validación de una fórmula magistral, han trabajado de manera colaborativa a través de la SEFH en la creación de una base de datos on-line de fórmulas magistrales elaboradas para EERR. La base de datos compartida por los Servicios de Farmacia de todo el territorio español contiene actualmente 175 fórmulas magistrales para un total de 119 EERR.
Respecto al acondicionamiento, un gran número de MMHH se elabora de manera centralizada en el Servicio de Farmacia. Cabe destacar que muchos de los fármacos utilizados son extranjeros y no están etiquetados, ni contienen instrucciones en castellano, por lo que su preparación estandarizada y dispensación lista para administrar facilita la admiración y previene errores. En el año 2020 la elaboración centralizada de tratamientos en el Servicio de Farmacia Hospital Universitari i Politècnic La Fe de Valencia supuso la preparación de más de 70.000 tratamientos. Entre estas preparaciones se encuentran 47 MMHH.
Recientemente a las actividades de elaboración de medicamentos (formulación magistral y acondicionamiento) se ha incorporado la oportunidad de elaborar terapias avanzadas. Las terapias avanzadas son medicamentos altamente innovadores que se basan en el uso de genes (terapia génica), células (terapia celular) o tejidos (ingeniería tisular) para prevenir o tratar diversas enfermedades. Los medicamentos de terapia avanzada se rigen por un Reglamento Europeo que establece que su autorización debe seguir el procedimiento centralizado. Sin embargo, el propio reglamento establece una exención, la denominada exención hospitalaria. La traducción legal de esta exención hospitalaria en España se recoge en el Real Decreto 477/2014, de 13 de junio, por el que se regula la autorización de medicamentos de terapia avanzada de fabricación no industrial y que posibilita la fabricación hospitalaria de terapias avanzadas. Esta fabricación requiere la “autorización de uso” de la AEMPS, que garantiza que el medicamento autorizado satisface las garantías exigibles referentes a su calidad, seguridad, eficacia, identificación e información y se circunscribe la utilización del medicamento a la institución hospitalaria que haya obtenido la autorización de uso.
Por tanto, no se trata de una autorización de comercialización sino de una autorización de uso en un centro específico (37,38). La fabricación de terapias avanzadas, requiere además el cumplimiento de buenas prácticas de fabricación (GMP, de sus siglas en ingles) que deben ser certificadas por la AEMPS (39). Ya existen ejemplos de autorizaciones concedidas, uno de ellos es el Hospital Universitari i Politècnic La Fe, que dispone de autorización para fabricar linfocitos T INFgamma+ específicos para los virus de citomegalovirus, Epstein-Barr y adenovirus destinados a tratar a pacientes onco-hematológicos con reactivación vírica consecuencia de sus bajas defensas, por ejemplo, tras trasplante hematopoyético.
3.5. Dispensación de MMHH
La dispensación y distribución de los medicamentos es una de las responsabilidades legales de los Servicios de Farmacia Hospitalaria. Este proceso debe realizarse garantizando la calidad de los medicamentos y la cobertura de las necesidades (12).
En los pacientes hospitalizados la medicación se distribuye principalmente a través de un sistema de dispensación de medicamentos en dosis unitaria (SDMDU). El término “dosis unitarias” se refiere a la dosis concreta que un paciente determinado recibe en el momento de la administración. Por tanto, el SDMDU es un sistema para hacer llegar la medicación a pacientes hospitalizados en el que, previa validación de la prescripción médica por parte del farmacéutico, se dispensan las dosis de medicamento necesarias para cada paciente, acondicionadas de forma unitaria y debidamente identificadas (40). Para poner en contexto la actividad que supone un SDMDU, en un hospital terciario de 1000 camas de hospitalización como el Hospital Universitari i Politècnic La Fe, en el año 2020 se revisaron un total de 156.370 prescripciones médicas, correspondiente a 48.020 pacientes y un total de 4.228.
3.6. Seguimiento de pacientes
El seguimiento farmacoterapéutico, es la práctica profesional en la que el farmacéutico se responsabiliza de las necesidades del paciente relacionadas con los medicamentos mediante la detección, prevención y resolución de problemas relacionados con la medicación, de forma continuada, sistematizada y documentada, en colaboración con el propio paciente y con los demás profesionales del sistema de salud, con el fin de alcanzar resultados concretos que mejoren la calidad de vida del paciente (44).
Una de las actividades que engloba el seguimiento farmacoterapéutico es la monitorización farmacocinética que permite la individualización de los tratamientos. Algunos de los medicamentos que más habitualmente se monitorizan son antibióticos, antiepilépticos e inmunosupresores. En el ámbito de las EERR y los MMHH destaca la monitorización farmacocinética en la hemofilia A y B. La hemofilia A y la B se deben a la deficiencia cuantitativa del factor VIII y factor IX, respectivamente. En ambos casos, el déficit de estos factores, fundamentales para una correcta hemostasia, conlleva una mayor predisposición al sangrado. El tratamiento de estas patologías consiste en la suplementación con factores de origen plasmático o recombinante y tiene un elevado impacto económico para el sistema nacional de salud. Las utilidades de la monitorización farmacocinética en este grupo de pacientes se centran en conocer el perfil farmacocinético individual, personalizar los tratamientos en función del perfil farmacocinético, mejorar el control de sagrados y la adherencia y desarrollar modelos poblacionales.
En los últimos años se ha promovido el empleo de la profilaxis guiada por farmacocinética que consiste en la individualización de profilaxis basada en el perfil farmacocinético individual, con el objetivo de mantener los niveles plasmáticos adecuados que eviten la aparición de sangrados espontáneos y adaptar las infusiones a los momentos de mayor actividad física. Los principales parámetros farmacocinéticos que se deben identificar son (45):
a) Semivida plasmática (t1/2): Los pacientes con una semivida corta están expuestos a mayores periodos con niveles plasmáticos < 1 UI/dl, lo que aumenta el riesgo de sangrado.
b) Concentración máxima (Cmax) o nivel pico: Los pacientes con Cmax altas se previenen frente al desarrollo de sangrados traumáticos o relacionados con el ejercicio.
c) Concentración mínima (Cmin) o nivel valle: Tener niveles valle adecuados previene frente a la aparición de sangrados espontáneos.
d) Área bajo la curva (AUC): Tener un AUC elevado previene frente a la aparición de sangrados subclínicos y permite maximizar la ventana de protección.
Para el desarrollo de los modelos bayesianos poblacionales se han utilizado diferentes herramientas: NONMEM®, myPKFIT® y WAPPS Hemo®. NONMEN® se puede utilizar para todos los factores, pero tiene un manejo complejo y requiere un nivel elevado de conocimiento del programa. myPKFIT® es una herramienta ligada a un app que permite una estimación inmediata específica para dos factores de coagulación teniendo en cuenta covariables como la edad, el peso o el factor de Von Willebrand. WAPPS Hemo® ha sido desarrollada independiente de la industria farmacéutica y permite la estimación en 24h de todos los factores aplicando covariables como la edad, el peso, le altura, grupo sanguíneo o el factor de Von Willebrand. Además esta herramienta se puede ligar a diferentes apps (myWAPPS, florio, Haemoassist) (46,47).
La Unidad de Hemostasia y Trombosis del Hospital Universitario y Politécnico La Fe de Valencia en colaboración con el Servicio de Farmacia lleva 4 años empleando la profilaxis guiada por farmacocinética con 18 tipos de factores. En este periodo se han realizado más de 450 estudios farmacocinéticos de más de 250 pacientes, incluidos pacientes derivados de otros hospitales, además de prestar asesoramiento a otros hospitales tanto nacionales como internacionales. La experiencia en la práctica clínica de la profilaxis guiada por farmacocinética poblacional ha permitido facilitar el uso de forma práctica, al requerir menor número de muestras; mejorar el ajuste individual de dosis y frecuencia ante cambios en el tratamiento (swich), ya sea por otro factor de vida media estándar o por un factor de vida media extendida; detectar sangrados relacionados con la farmacocinética, por ejemplo baja t1/2; mejorar la educación a los pacientes, con impacto en la adherencia y potenciar la reducción de costes al administrar solo las dosis de medicamentos necesarias y prevenir costes derivados de estancias hospitalarias por episodios hemorrágicos. Pese a los beneficios de esta actividad su implantación genera algunas dificultades como la escasa disponibilidad de modelos poblacionales para todos los factores y subgrupos de pacientes, falta de conocimiento sobre covariables poco estudiadas que pueden influir y la necesidad de validar los tiempos de muestreo, los métodos de análisis y la población original (48,49).
Otra actividad incorporada al seguimiento de los pacientes es la salud digital. La Salud Digital es el concepto que incorpora las tecnologías de información y la comunicación (TIC) a productos, servicios y procesos de atención sanitaria, así como a las organizaciones o instituciones que pueden mejorar la salud y bienestar de los ciudadanos. La UFPE del Servicios de Farmacia del Hospital Universitario y Politécnico la Fe (Valencia) ha desarrollado una estrategia 2.0 plenamente centrada en los ciudadanos y pacientes y consta de un blog, una página de Facebook, una cuenta en Twitter, canal de YouTube, una cuenta de Pinterest, un semanario digital y un portal para empoderamiento y formación de ciudadanos y pacientes en farmacoterapia y uso de los medicamentos: eDruida. Todas estas herramientas 2.0 han contribuido a un mejor seguimiento de los pacientes, a un incremento de la relación profesional sanitario-paciente, a desarrollar programas educacionales para pacientes y a tener mayor un feed-back con los pacientes.
Entre las herramientas 2.0 (webs repositorios y apps), en el entorno de las EERR destaca el desarrollo de apps de utilidad para pacientes con Hemofilia. La adherencia al tratamiento y el correcto control de los episodios hemorrágicos son dos de los retos más destacados para las personas que conviven con la hemofilia. Para facilitar ambos desafíos, se han desarrollados diferentes apps como Haemoassist®, myPKFiT®, myWAPPS® o Florio®. El uso de estas TICs ha demostrado mejorar la adherencia al tratamiento profiláctico y tener un impacto positivo en la calidad de vida y percepción de enfermedad, así como en la estabilización de artropatías articulares (50). Además la comunicación y colaboración entre profesionales y pacientes a través de estas apps ha permitido el desarrollo de la profilaxis dirigida por farmacocinética, con resultados muy positivos en la calidad de vida de los pacientes y una reducción de los costes sanitarios.
3.7. Humanización de los servicios de farmacia
Como en el resto de profesiones sanitarias, el humanismo es un pilar fundamental de la profesión farmacéutica. Por tanto, Por este motivo la humanización de la asistencia debe ser una prioridad de los Servicios de Farmacia Hospitalaria. Las bases para la humanización de la asistencia sanitaria:
• Poner en valor la dignidad e individualidad de cada persona prestando una asistencia individualizada.
• Atender a las personas desde su concepción más holística, dando respuesta no solo a sus necesidades físicas, sino atendiendo también a su esfera emocional, social y espiritual.
• Hacer partícipes a los ciudadanos proporcionándoles la información y formación precisa para que puedan participar de forma proactiva en la toma de decisiones respecto a su salud.
• Considerar no solo a los pacientes, sino también a sus familiares y cuidadores.
• Poner en valor la profesionalización y vocación de los verdaderos agentes de humanización: los profesionales sanitarios.
Cada colectivo vulnerable tiene necesidades y realidades diferentes. Los pacientes con EERR son un colectivo vulnerable, entre otros motivos, debido a la falta de información sobre la patología, el retraso diagnóstico, la necesidad de desplazamientos largos para acudir a su hospital de referencia y la dificultad de acceso y complejidad de los tratamientos.
No cabe duda que las posibilidades para mejorar las condiciones de humanización de la asistencia sanitaria requieren de un fuerte compromiso y esfuerzo político y económico, sin embargo, también es posible realizar pequeñas acciones en la actividad profesional diaria que nos acerquen a una atención más humanizada. Con esta intención desde el Servicio de Farmacia del Hospital Universitari i Politécnic La Fe en colaboración con el grupo Orpha-SEFH, se ha desarrollado el “Manual de buenas prácticas de humanización de los servicios de farmacia hospitalaria en la atención a pacientes con enfermedades raras”. Este Manual pretende recoger todas aquellas acciones, actividades o prácticas que trataran de cubrir las necesidades no clínicas que los pacientes con EERR, así como las que sus familiares y/o cuidadores puedan tener a lo largo de su relación con los Servicios de Farmacia, Por otra parte, también busca recoger aquellas actividades dirigidas a impulsar la motivación e implicación de los profesionales sanitarios. Su objetivo es establecer estándares de humanización en los Servicios de Farmacia respecto a la atención a pacientes con EERR. Además, se pretende que el manual sea la base para la certificación de los Servicios de Farmacia, ya que la evaluación externa impulsa la implementación de estrategias de humanización. El Manual contiene 61 criterios agrupados en 5 líneas estratégicas: 1. Cultura de humanización, 2. Empoderamiento del paciente, 3.Cuidado del profesional, 4. Espacios físicos y confort y 5. Organización de la atención (51).
4. CONCLUSIONES
Los farmacéuticos de hospital, en su ejercicio práctico profesional, han demostrado su compromiso para mejorar los diferentes aspectos que engloban el complejo abordaje del proceso farmacoterapéutico del paciente con enfermedades raras.
Aún quedan importantes retos, en las demandas asistenciales y terapéuticas que precisa el paciente con enfermedades raras donde va ser estratégico la actuación y competencia del farmacéutico de hospital.
Agradecimientos
A todos los compañeros de la farmacia de hospital con los que he tenido la oportunidad de trabajar para mejorar la asistencia y la prestación farmacéutica a los pacientes con enfermedades raras, y de los que tanto he podido aprender.
5. REFERENCIAS
1. Nguengang Wakap S, Lambert DM, Olry A, et al. Rodwell C, et al. Estimating cumulative point prevalence of rare diseases: analysis of the Orphanet database. Eur J Hum Genet. 2020;28(2):165-73.
2. Federación Española de Enfermedades Raras (FEDER). Estudio sobre la situación de Necesidades Sociosanitarias de las Personas con Enfermedades Raras en España. Estudio ENSERio: Datos 2016-2017. DL: M-17132-2018. ISBN: 978-84-09-01971-7.
3. Reglamento (CE) nº 141/2000 del Parlamento Europeo y del Consejo, de 16 de diciembre de 1999, sobre medicamentos huérfanos.
4. Orphan Drug Act 1983. An Act to amend the Federal Food, Drug, and Cosmetic Act to facilitate the development of drugs for rare diseases and conditions, and for other purposes. January 4, 1983.
5. Conditional marketing authorisation Report on ten years of experience at the European Medicines Agency. European Medicines Agency. 2017. Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/Report/2017/01/WC500219991.pdf
6. Barton NW, Brady RO, Dambrosia JM, et al. Replacement therapy for inherited enzyme deficiency: macrophage-targeted glucocerebrosidase for Gaucher’s disease. N Engl J Med. 1991;324:1464–70.
7. Kesselheim AS, Myers JA, Avorn J. Characteristics of Clinical Trials to Support Approval of Orphan vs Nonorphan Drugs for Cancer. JAMA. 2011;305(22):2320–26. doi:10.1001/jama.2011.769
8. Mestre-Ferrandiz J, Palaska C, Kelly T, Hutchings A, Parnaby A. An analysis of orphan medicine expenditure in Europe: is it sustainable? Orphanet J Rare Dis. 2019;14(1):287.
9. Schlander M, Dintsios CM, Gandjour A. Budgetary Impact and Cost Drivers of Drugs for Rare and Ultrarare Diseases. Value Health. 2018;21(5):525-31.
10. Informe de acceso de los medicamentos huérfanos en España 2020. Aelmhu. 2020. Disponible en: https://aelmhu.es/index.php/faq/mmhh
11. Badia X, Vico T, Shepherd J, et al. Impact of the therapeutic positioning report in the P&R process in Spain: analysis of orphan drugs approved by the European Commission and reimbursed in Spain from 2003 to 2019. Orphanet J Rare Dis. 2020;15(1):224. doi: 10.1186/s13023-020-01507-4.
12. Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios. BOE. Disponible en: https://www.boe.es/eli/es/rdlg/2015/07/24/1/dof/spa/pdf
13. Ley 6/1998, de 22 de junio, de Ordenación Farmacéutica de la Comunidad Valenciana. BOE. Disponible en: https://www.boe.es/buscar/pdf/1998/BOE-A-1998-17351-consolidado.pdf
14. Orden del Ministerio de Trabajo de 7 Julio de 1972, B.O.E. del 19. Reglamento de Régimen, Gobierno y Servicios de las Instituciones Sanitarias de la Seguridad Social.
15. Real Decreto de 15 de Abril 1.987, B.O.E. del 16. Reglamento sobre Estructura, Organización y Funcionamiento de los Hospitales gestionados por el INSALUD.
16. Decreto 118/2010, de 27 de agosto, del Consell, por el que se ordenan y priorizan actividades de las estructuras de soporte para un uso racional de los productos farmacéuticos en la Agencia Valenciana de Salud. Disponible en: http://www.dogv.gva.es/auto/dogv/docvpub/rlgv/2010/D_2010_118_ca_DL_2013_2.pdf
17. Propuesta de colaboración para la elaboración de los informes de posicionamiento terapéutico de los medicamentos. Documento aprobado por la Comisión Permanente de Farmacia del SNS. AEMPS. 2013. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/propuesta-colaboracion-informes-posicionamiento-terapeutico.pdf
18. Web del Grupo de Evaluación de Novedades, EStandarización e Investigación en Selección de Medicamentos (GENESIS). Sociedad Española de Farmacia Hospitalaria. Disponible en: https://gruposdetrabajo.sefh.es/genesis/
19. Agencia de Evaluación de Tecnologías Sanitarias (AETS). Instituto de Salud Carlos III – Ministerio de Economía y Competitividad. Zozaya N, Villoro R, Hidalgo Á, Sarria A. Criterios de financiación y reembolso de los medicamentos huérfanos. Disponible en: http://gesdoc.isciii.es/gesdoccontroller?action=download&id=17/06/2016-16c31d38eb
20. Guarga L, Badia X, Fontanet M et al. Implementing reflective multicriteria decision analysis (MCDA) to assess orphan drugs value in the Catalan Health Service (CatSalut). Orphanet J Rare Dis. 2019; 14, 157 (2019).
21. Roldan UB, Badia X, Marcos-Rodriguez JAet al. Multi-criteria decision analysis as a decision-support tool for drug evaluation: a pilot study in a pharmacy and therapeutics committee setting. Int J Technol Assess Health Care 2018; 34: 519–26.
22. Badia X, Chugani D, Abad MR, et al. Development and validation of an MCDA framework for evaluation and decision-making of orphan drugs in Spain. Expert Opinion on Orphan Drugs. 2019;7(7-8):363-72.
23. Álvarez-Román MT, Cuervo-Arango I, Pérez-Santamarina R, et al. Determining the value contribution of emicizumab (Hemlibra ®) for the prophylaxis of haemophilia A with inhibitors in Spain by multi-criteria decision analysis. Glob Reg Heal Technol Assess. 2019;6(1):1–8.
24. Álvarez E, Álvarez-Roman MT, Cuervo-Arango I, et al. Determining the value contribution of emicizumab (Hemlibra® ) for the prophylaxis of haemophilia a patients without inhibitors in Spain by multi-criteria decision analysis (MCDA). Rev Esp Econ Salud. 2020;15(3):35-44.
25. Government horizon scanning. Ninth Report of Session 2013–14. Science and Technology Committee. House of Commons. 2014 [citado 03/06/2021]. Disponible en: https://publications.parliament.uk/pa/cm201314/cmselect/cmsctech/703/70302.htm
26. The NetherlandsMarangi M, Ivanovic J, Pistritto G. The Horizon Scanning System at The Italian Medicines Agency. Drug Discov Today. 2019;24(6):1268:80.
27. Segundo informe Horizon Scanning del Grupo de Enfermedades Raras y Medicamentos Huérfanos. SEFH. 2021 [citado 16/07/2021]. Disponible en: http://gruposdetrabajo.sefh.es/orpharsefh/images/stories/documentos/2_Informe_HorizonScanning_Orphar-SEFH.pdf
28. Espín J, Oliva J, Rodríguez-Barrios JM. Esquemas innovadores de mejora del acceso al mercado de nuevas tecnologías: los acuerdos de riesgo compartido. Gac Sanit. 2010;24:491-497.
29. Morel T, Arickx F, Befrits G, et al. Reconciling uncertainty of costs and outcomes with the need for access to orphan medicinal products: a comparative study of managed entry agreements across seven European countries. Orphanet J Rare Dis. 2013;8:198.
30. Edo-Solsona MD, Vitoria-Miñana I, Poveda-Andrés JL. Implementation and results of a risk-sharing scheme for enzyme replacement therapy in lysosomal storage diseases. Farm Hosp. 2020;44(1):10-15.
31. VALTERMED: Sistema de Información para determinar el Valor Terapéutico en la Práctica Clínica Real de los Medicamentos de Alto Impacto Sanitario y Económico en el SNS. Ministerio de Sanidad. 2019. Disponible en: https://www.mscbs.gob.es/profesionales/farmacia/valtermed/home.htm
32. Di Paolo A, Arrigoni E. Generic Substitution of Orphan Drugs for the Treatment of Rare Diseases: Exploring the Potential Challenges. Drugs. 2018;78(4):399-410.
33. Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales. BOE. Disponible en: https://www.boe.es/eli/es/rd/2009/06/19/1015/dof/spa/pdf
34. Ministerio De Sanidad, Servicios Sociales E Igualdad. Guía de buenas prácticas de preparación de medicamentos en servicios de farmacia hospitalaria. Disponible en: ttps://www.sefh.es/sefhpdfs/GuiaBPP_JUNIO_2014_VF.pdf
35. Nagore C, Lacalle E, Arteche L. El farmacéutico en el contexto de las enfermedades raras y los medicamentos huérfanos. Anales Sis San Navarra. 2008;31( Suppl 2 ):127-43.
36. Real Decreto 477/2014, de 13 de junio, por el que se regula la autorización de medicamentos de terapia avanzada de fabricación no industrial. BOE. Disponible en: https://www.boe.es/eli/es/rd/2014/06/13/477
37. Reglamento (CE) nº 1394/2007 del Parlamento Europeo y del Consejo, de 13 de noviembre de 2007, sobre medicamentos de terapia avanzada y por el que se modifican la Directiva 2001/83/CE y el Reglamento (CE) nº 726/2004. Disponible en: https://www.boe.es/doue/2007/324/L00121-00137.pdf
38. Directrices sobre normas de correcta fabricación específicas para Medicamentos de Terapia Avanzada. Ministerio de Sanidad, Consumo y Bienestar Social. Agencia española de medicamentos y productos sanitarios. Disponible en: https://www.aemps.gob.es/industria/inspeccionNCF/guiaNCF/docs/normas-correcta-fabricacion/nueva-guia-NCF-ATMPs.pdf.
39. Napal V, González M, Ferrándiz JR. Dispensación con intervención previa del Farmacéutico: dosis unitarias. En: Farmacia Hospitalaria, tomo I. Sociedad Española de Farmacia Hospitalaria, 2003.Disponible en: https://www.sefh.es/bibliotecavirtual/fhtomo1/cap2611.pdf?ts=20201123162418
40. Alfadhel M, Al-Thihli K, Moubayed H, Eyaid W, Al-Jeraisy M. Drug treatment of inborn errors of metabolism: a systematic review. Arch Dis Child. 2013;98(6):454-61.
41. Orden SND/293/2020, de 25 de marzo, por la que se establecen condiciones a la dispensación y administración de medicamentos en el ámbito del Sistema Nacional de Salud, ante la situación de crisis sanitaria ocasionada por el COVID-19. BOE núm. 85, de 27/03/2020.
42. Tortajada-Goitia B, Morillo-Verdugo R, Margusino-Framiñán L, et al. Survey on the situation of telepharmacy as applied to the outpatient care in hospital pharmacy departments in Spain during the COVID-19 pandemic. Farm Hosp. 2020;44(4):135-40.
43. Ministerio de Sanidad Y Consumo. Consenso sobre Atención Farmacéutica [Internet]. Madrid; 2002 [citado 16 julio de 2021]. Disponible en: http:// www.mscbs.gob.es/profesionales/farmacia/consenso/home.htm.
44. Collins PW, Fischer K, Morfini M, et al. Implications of coagulation factor VIII and IX pharmacokinetics in the prophylactic treatment of haemophilia. Haemophilia. The Official Journal of the World Federation of Hemophilia. 2011;17(1):2-10. DOI: 10.1111/j.1365-2516.2010.02370.x.
45. Chelle P, Yeung CHTT, Croteau SE et al. Development and Validation of a Population-Pharmacokinetic Model for Rurioctacog Alfa Pegol (Adynovate®): A Report on Behalf of the WAPPS-Hemo Investigators Ad Hoc Subgroup. Clin Pharmacokinet. 2020;59:245–56.
46. Chelle P, Yeung CHT, Bonanad S, et al. Routine clinical care data for population pharmacokinetic modeling: the case for Fanhdi/Alphanate in hemophilia A patients. J Pharmacokinet Pharmacodyn. 2019;46:427–38.
47. Megías-Vericat JE, Bonanad S, Haya S, et al. Cross-sectional comparative study of pharmacokinetics and efficacy between sucrose-formulated recombinant factor VIII (Kogenate®) and BAY 81-8973 (Kovaltry®) in patients with severe or moderate haemophilia A in prophylaxis. Haemophilia. 2019;25:215-18.
48. Megías-Vericat JE, Bonanad S, Haya S, et al. Bayesian pharmacokinetic-guided prophylaxis with recombinant factor VIII in severe or moderate haemophilia A. Thrombosis research. 2019;174:151-62
49. Cuesta-Barriuso R, López-Pina JA, Nieto-Munuera J, et al. Effectiveness of the Medtep Hemophilia online platform for adherence to prophylactic treatment in haemophilia patients: Results from a 1-year observational study. Haemophilia 2018 24(3):452-459
50. Poveda Andrés JL, Company Albir MJ, Edo Solsona MD, Arasa Gastaldo E. Manual de buenas prácticas de humanización de los servicios de farmacia hospitalaria en la atención a pacientes con enfermedades raras. newsRARE. 2020, 5 (sup1):13-30. ISBN: 978-84-949427-7-8.