1. INTRODUCCIÓN
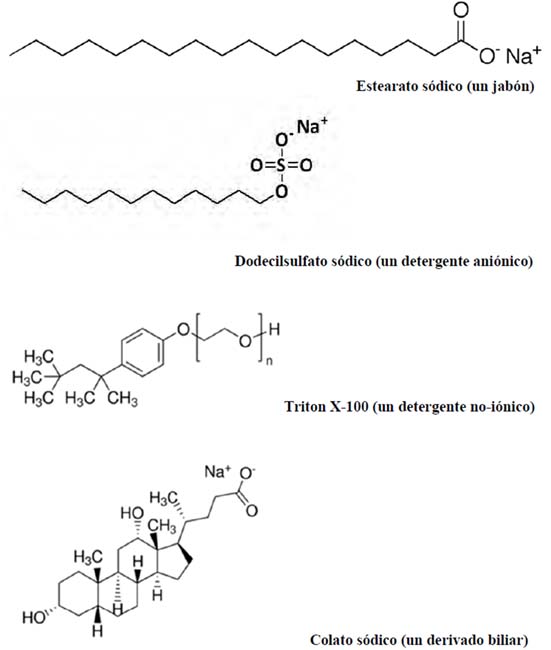
La pandemia de COVID-19 nos ha llevado, entre otros cambios de hábitos, a lavarnos con mucha frecuencia las manos con agua y jabón. El motivo es sencillo de enunciar, pero no tan fácil de comprender, al menos a nivel molecular. Se trata de que el virus (SARSCoV- 2) está rodeado por una membrana, muy parecida a las membranas celulares, de las que procede. Esta membrana es muy sensible a los detergentes. El jabón de tocador tiene como principio activo, e ingrediente mayoritario, los llamados en lenguaje químico “jabones”, sales sódicas o potásicas de ácidos grasos (ácidos monocarboxílicos, generalmente de 14-18 átomos de carbono) (Fig. 1). Los jabones son detergentes, y por ello destruyen en muy poco tiempo las membranas de los virus (en realidad, cualquier membrana biológica) y nos protegen de la enfermedad COVID-19.
Comencemos por precisar el sentido de algunos términos. Acabamos de decir que los jabones sódicos o potásicos son detergentes. Ésta es hoy una palabra de uso común, aunque hace un siglo se utilizara tan solo en el lenguaje técnico. El vocablo tiene prosapia clásica, el verbo latino detergo aparece utilizado por los escritores romanos clásicos, con el significado de borrar, ocultar o anular. En castellano, el diccionario de la RAE da la definición “Sustancia o producto que limpia químicamente”, expresión poco afortunada, como veremos enseguida. El Oxford English Dictionary da más en el clavo, cuando define “detergent. A water-soluble cleansing agent which combines with impurities and dirt to make them more soluble […]”. Larousse define: “détergent. Se dit d’un produit présentant les propriétés de détergence et utilisé pour cette raison dans les processus de lavage”, definición algo irritante, porque nos obliga a buscar “détergence”, definida como: “Phénomène permettant d’éliminer d’un milieu solide les salissures qui y adhèrent par leur mise en suspension ou en solution”, lo que no está tan mal.
Figura 1. Estructuras químicas de algunos detergentes representativos.
En un contexto más estrictamente científico, en su Gold Book, la IUPAC define “detergent” como: “A surfactant (or a mixture containing one or more surfactants) having cleaning properties in dilute solutions (soaps are surfactants and detergents)”. Esto nos lleva a la importante definición de surfactante, o tensioactivo, o tensoactivo. Un surfactante es una sustancia capaz de disminuir la tensión superficial en la superficie de contacto entre dos fases (aire y agua, en el contexto biológico). Por lo tanto, no todos los surfactantes son detergentes, porque no todos tienen las propiedades “limpiadoras”, pero todos los detergentes son surfactantes, pues todos ellos actúan disminuyendo la tensión superficial aire-agua. Y, volviendo a los jabones, los jabones de sodio y potasio son detergentes, pero la mayoría de los detergentes hoy en uso no son jabones.
Desde la perspectiva de su estructura, los detergentes son anfífilos solubles [1-3]. Los anfífilos son moléculas que contienen una parte hidrofílica, o polar, y otra hidrofóbica, o apolar. La biología nos muestra numerosos ejemplos de anfífilos, como los fosfolípidos de las membranas, y numerosas proteínas. Pero muy pocos anfífilos de origen natural son razonablemente hidrosolubles, y por tanto detergentes; por ejemplo, los fosfolípidos se agregan en medio acuoso formando micelas, o bicapas u otras formas de agregado, pero no son solubles en agua. Podemos resumir diciendo que la palabra “detergente” hace alusión a una función limpiadora, mientras que anfífilo o surfactante se refieren a propiedades físico-químicas de la molécula.
De entre los detergentes, el uso de los jabones se pierde, literalmente, en la noche de los tiempos. Sin embargo, solo en el siglo XX, en Alemania y durante la Gran Guerra, la falta de grasas biológicas obligó a la síntesis de productos químicos con propiedades detergentes, distintos de los jabones. Los primeros, hacia 1916, fueron alkil naftalenosulfonatos, y en la siguiente década se sintetizaron los alkil sulfonatos. Uno de estos es el muy conocido lauril sulfato sódico, o dodecil sulfato sódico (SDS), aún hoy muy empleado en numerosos ambientes, desde los laboratorios, en las técnicas de electroforesis, hasta los hogares, en los dentífricos. Durante la segunda guerra mundial aparecieron los alkil arilsulfonatos, que pronto dominaron el mercado. En la actualidad, son muchas decenas las familias de compuestos químicos sintéticos con propiedades detergentes que se encuentran en el mercado.
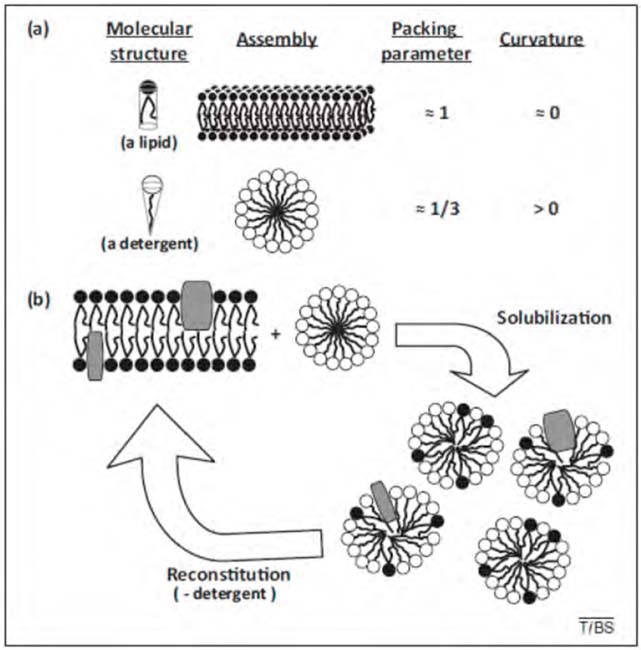
¿Cómo actúan los detergentes? En realidad, esta es la pregunta a la que intenta responder todo el presente trabajo. Sin embargo, podemos dar un primer esbozo de explicación, dentro de esta sección introductoria. Todo se basa en sus dos propiedades principales: son anfífilos y son hidrosolubles. Cuando se nos cae una mancha en la camisa, generalmente de naturaleza grasa, podemos eliminarla eficazmente tratándola con un detergente (p. ej. jabón de tocador, en una emergencia) y luego con agua abundante. Al secarse el agua, la mancha ha desaparecido. Lo que ocurre es que cada molécula de detergente tiene una parte hidrofóbica, que se une a la grasa, y una hidrofílica, que se une al agua. Se forman unas nanopartículas esféricas, las micelas, que contienen detergente y grasa. Las micelas se organizan de modo que los grupos polares (hidrofílicos) de los detergentes quedan orientados al exterior, o sea que, aunque la micela contiene grasas (hidrofóbicas) en su interior, el conjunto es hidrofílico y se dispersa fácilmente en el agua. Así la grasa queda solubilizada (Fig. 2).
Figura 2. Autoensamblajes en mezclas de lípidos y detergentes. (a) Geometrías moleculares y ensamblajes de lípidos puros o detergentes puros. La geometría molecular del lípido o del detergente determina el modo de ensamblaje: moléculas lipídicas aproximadamente cilíndricas dan origen en agua a bicapas planas, mientras que un detergente cónico origina micelas altamente curvadas. En ambos casos los contactos cadena hidrocarbonada-agua se minimizan. (b) Solubilización y reconstitución de membranas por adición y eliminación de detergentes. Cuando las bicapas planas (que pueden incluir proteínas) interaccionan con micelas de detergente curvas, se forman micelas mixtas lípido – proteína – detergente en el proceso llamado solubilización. El fenómeno puede revertirse eliminando el detergente (reconstitución) [26].
Volvamos a la COVID-19. ¿Por qué lavarse las manos evita la infección? Pues, sobre todo, porque el coronavirus SARS-CoV-2, como muchos otros, está rodeado por una membrana, y las membranas biológicas están formadas, básicamente, por un tipo de grasas, los llamados fosfolípidos. El detergente (jabón) solubiliza los fosfolípidos de la membrana, con lo que el genoma del virus queda desnudo, y pierde su estructura y su funcionalidad. Este es, básicamente, el mecanismo. Se dice fácil, pero comprender en detalle el mecanismo de la solubilización es otro cantar, y nos llevará unas cuantas páginas explicarlo bien, dentro de lo que hoy conocemos.
Nuestro trabajo comienza revisando brevemente la composición y arquitectura de las membranas celulares, sigue con una descripción sucinta de la estructura y propiedades de las membranas modelo utilizadas en las investigaciones biológicas, dedica luego su cuerpo principal a explicar la interacción de los detergentes con las bicapas fosfolipídicas que constituyen la matriz estructural de las biomembranas, y termina con algunas aplicaciones a la farmacia. Las fuentes primarias para el presente ensayo son los trabajos de investigación de los autores, desarrollados durante cuatro décadas largas, naturalmente complementadas y contrastadas con la de otros cultivadores de este importante campo de la biofísica. Quizá resulte procedente aquí un acto de justicia, al reconocer a los iniciadores e impulsores de este campo, el alemán Charles Tanford (nacido Tannenbaum) [2], y los finlandeses Ari Helenius y Kai Simons [3].
1.1. Las membranas celulares
Las biomembranas, o membranas celulares, constituyen los límites o fronteras celulares, y también los límites de los orgánulos dentro de la célula. Consisten en una matriz hidrófoba, formada por una doble capa orientada de fosfolípidos (glicolípidos en plantas) a la cual las proteínas se unen en diferentes formas. Las membranas existen en un estado condensado (sólido), y contradicen la creencia común de que las reacciones bioquímicas ocurren en solución acuosa. Una parte muy importante de los procesos bioquímicos que son esenciales para la célula ocurren dentro de las membranas celulares, es decir, en estado sólido. Esto se demuestra por la proporción de enzimas celulares que existen unidos a la membrana, que es más alta en los organismos más complejos, y que llega a un 25% del total en la especie humana.
Figura 3. El modelo de mosaico fluido de las membranas biológicas (Singer y Nicolson, 1972) [4].
Nuestra visión actual de la estructura y dinámica de las membranas biológicas se enmarca en el modelo del «mosaico fluido», propuesto en 1972 por Singer y Nicolson [4], influidos por el modelo anterior de Danielli y Davson (1935), que ya había propuesto la doble capa de fosfolípidos como el elemento estructural básico de las biomembranas (Fig. 3). El modelo de Singer y Nicolson, calificado por sus detractores como una “caricatura” de la membrana, fue un éxito instantáneo, ya que incorporó de forma sencilla y racional una gran cantidad de observaciones e ideas experimentales acumuladas en los años 50 y 60, muchas de las cuales parecían irreconciliables en ese momento. El éxito no solo fue muy rápido, sino que también fue duradero ya que, después de casi cinco décadas, la «caricatura» Singer-Nicolson aparece sin cambios en el capítulo dedicado a las membranas de cualquier libro de texto en Bioquímica o Biología Celular. De hecho, el modelo de mosaico fluido ha resistido notablemente bien el paso de los años, y esto en un campo en el que la investigación ha sido muy activa, con nuevas hipótesis importantes que han aparecido y desaparecido en ese período. Como consecuencia, nuestra visión de la estructura de la biomembrana no sigue siendo la misma que hace cincuenta años, y sin embargo, a los efectos de comprender el mecanismo de acción de los detergentes, el modelo del mosaico fluido en su forma clásica es perfectamente utilizable. El lector interesado en las modificaciones recientes del mismo puede consultar [5].
1.2.Membranas modelo
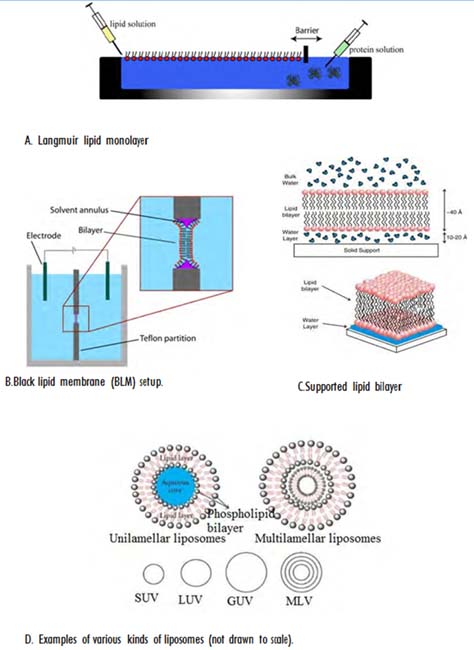
La complejidad estructural de las membranas celulares ha hecho necesaria la utilización de modelos simplificados de su estructura (“membranas modelo”) para el estudio experimental. Prácticamente toda la biofísica de membranas como hoy la conocemos ha sido estudiada en membranas modelo. Históricamente, el primer modelo experimental de membranas fue la monocapa de fosfolípidos extendida en una interfaz aire-agua en lo que luego se habría de llamar la “balanza de Langmuir” (Fig. 4a). Esta técnica permitió a Gorter y Grendel demostrar en 1925 que los lípidos en la membrana de los eritrocitos estaban organizados en una doble capa, o bicapa [6]. Desde entonces, las monocapas de Langmuir y sus modificaciones (Langmuir-Blodgett, etc.) han sido extremadamente útiles en los estudios biofísicos y tecnológicos de membranas y películas (films) en general. Es curioso que todos los estudios de monocapas se basan en los trabajos de Agnes Pokels, una ama de casa germana sin formación científica, que publicó sus resultados en 1891 en Nature, de la mano de Lord Rayleigh [7].
La misma revista publicó en 1962 los trabajos de Mueller y Rudin [8], que dieron lugar a las membranas lipídicas negras (black lipid membranes, BLM), otro modelo de membrana muy útil (Fig. 4b). Para establecer una BLM se utiliza una cámara de unos pocos mililitros de capacidad. Una hoja de plástico rígido con un pequeño agujero (inferior a 1 mm) en el centro separa los dos lados de la cámara. La bicapa se forma a través de este agujero, pintándolo con un pincel impregnado en una solución de fosfolípidos en disolvente orgánico. Las propiedades eléctricas de la bicapa se pueden medir colocando un electrodo a cada lado de la cámara. La composición iónica del medio acuoso se puede variar a voluntad a cada lado. Las BLM son el modelo de elección para estudiar las características de los canales iónicos, proteínas que pueden incorporarse a las BLM, y cuya conductancia y otros parámetros se miden directamente con este montaje experimental.
Figura 4. Representación esquemática de distintas membranas modelo
Unos veinte años más tarde Tamm y McConnell [9] describieron otro útil modelo de membrana, llamado bicapa lipídica apoyada, (supported lipid bilayer, SLB ) en el que, como su nombre indica, la bicapa lipídica, que flotaba libremente en el agua en los BLM, se encuentra apoyada en un soporte sólido inerte, p. ej. mica (Fig. 4c). Las SLB superan con mucho a los BLM en estabilidad y facilidad de manejo. Las SLB se preparan normalmente depositando sobre el soporte vesículas fosfolipídicas de la composición deseada. Las vesículas se fusionan espontáneamente y recubren el soporte. Entre éste y la SLB queda una capa de agua de 1-2 nm. Estas construcciones son la forma de membrana ideal para el uso de la microscopia de fuerza atómica [10].
Pero quizá el modelo de membrana más universalmente aceptado, y desde luego el más usado en estudios de detergentes, son las vesículas fosfolipídicas o liposomas (Fig. 4d). Inicialmente descritos como “mesofases esmécticas” por su descubridor/inventor el hematólogo británico Alec D. Bangham en 1964 [11] pronto adquirieron su nombre actual. Se distinguen cuatro tipos diferentes de liposomas, según su tamaño y método de preparación. Los originalmente descritos por Bangham corresponden a las hoy llamadas vesículas multilamelares (multilamellar vesicles, MLV ), consistentes en decenas de esferas concéntricas, cada una limitada por una bicapa fosfolipídica, y de un tamaño típico de 10 a 100 μm. Las MLV se forman espontáneamente dispersando fosfolípidos secos en un medio acuoso. Tratando las MLV con ultrasonidos se obtienen las vesículas pequeñas unilamelares (small unilamellar vesicles, SUV), de un tamaño entre 40 y 60 nm, y limitadas por una sola bicapa [12]. Su principal desventaja es que su pequeño tamaño conlleva una gran curvatura de la bicapa, que la hace poco estable. Las llamadas vesículas unilamelares grandes (large unilamellar vesicles LUV), de 80-200 nm, se obtienen también a partir de las MLV, extruyéndolas a través de filtros de policarbonato del tamaño de poro adecuado [13]. Las LUV reúnen las ventajas de MLV y SUV, al ser suficientemente grandes como para tener una curvatura que no las desestabilice, y al mismo tiempo ser unilamelares, lo que imita mejor el caso de las células. Por último, las vesículas unilamelares gigantes (giant unilamellar vesicles, GUV) se obtienen por procedimientos específicos, muy a menudo por aplicación de campos eléctricos [14, 15]. Las GUV tienen un tamaño (decenas de micras) comparable al de las células.
1.3. El papel de los detergentes en la investigación de membranas
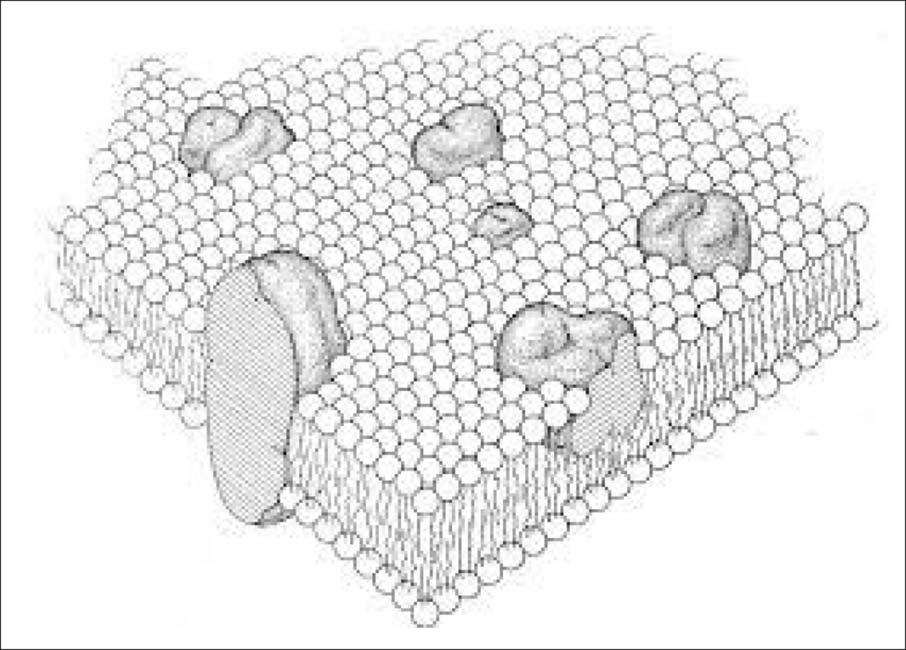
Como hemos dicho, la membrana biológica es una barrera hidrófoba entre dos compartimentos acuosos. Aunque la composición de la membrana varía considerablemente, hay varios atributos comunes a todas las biomembranas. Una característica común importante es que su matriz estructural está hecha de anfífilos insolubles en agua, particularmente fosfolípidos y proteínas anfifílicas, que son muy difíciles de disociar. Gran parte de los datos disponibles sobre la composición de las membranas celulares proviene de soluciones acuosas isotrópicas termodinámicamente estables, obtenidas al mezclar las membranas con anfífilos solubles en agua, los llamados detergentes (Fig. 1) [16-18]. Por encima de una concentración específica, llamada concentración micelar crítica (cmc), estos compuestos se autoensamblan en forma de micelas. Cuando las micelas de detergente se mezclan con estructuras laminares (membranas) hechas de anfífilos insolubles, se forman conjuntos mixtos cuya estructura depende de la relación molar de anfífilos solubles a insolubles: por debajo de un valor crítico de esta relación (Resat), los conjuntos mixtos son lamelares, mientras que por encima de otra relación crítica, Resol (ambos valores Re están definidos más abajo), las membranas se transforman en micelas mixtas detergente-lípido-proteína (Fig. 2) [19-22].
Este proceso, denominado solubilización, permite la identificación y caracterización de proteínas de membrana solubilizadas. Usando suficiente detergente y fosfolípido, se pueden hacer micelas mixtas para que contengan una sola molécula de proteína de membrana o ninguna. En estas condiciones, se pueden usar métodos estándar para purificar proteínas de membrana, cristalizarlas o reconstituirlas en proteoliposomas. A pesar de su importancia, la solubilización de las membranas celulares con detergentes no se ha estudiado sistemáticamente, en parte debido a la composición compleja de las biomembranas. En cambio, se ha dedicado mucho trabajo a la solubilización de las membranas modelo relativamente simples descritas en 1.2. Aunque estas bicapas lipídicas son ciertamente más sencillas que las biomembranas, su solubilización es compleja y muchas preguntas básicas aún no han sido respondidas. Una mejor comprensión de cómo funcionan los detergentes conduciría a métodos más eficientes de purificación y reconstitución de proteínas de membrana [16, 17, 23-25], y sobre todo a una elección racional del detergente más adecuado para cada caso, una decisión que actualmente se toma de manera puramente empírica.
2. EL MECANISMO DE ACCIÓN DE LOS DETERGENTES
Nos adentramos ya en la parte nuclear de nuestro trabajo, o sea, los mecanismos moleculares de la acción de los detergentes como solubilizantes de membranas. El detergente más utilizado en estos estudios ha sido el detergente no iónico Triton X-100, un detergente no homogéneo que contiene restos de polioxietileno de varias longitudes (Fig. 1). En esta sección sobre mecanismos de acción nos centramos en la solubilización de liposomas por Triton X-100. Los datos relativos a la solubilización por otros detergentes también se discuten cuando es relevante. En nuestra interpretación, los datos disponibles, y a menudo dispersos, obtenidos con una variedad de detergentes son consistentes con las conclusiones generales del trabajo. Esta sección está basada en nuestras revisiones en [26, 27].
2.1. Autoensamblaje en mezclas de anfífilos
El autoensamblaje de anfífilos se produce para evitar la exposición de sus restos hidrófobos al agua [2]. Intuitivamente, la naturaleza del autoensamblaje se rige por la estructura molecular del anfífilo: cuando la estructura molecular es cilíndrica (es decir, puede idealizarse como un cilindro), como es el caso de los fosfolípidos más estudiados, el volumen molecular (V) es aproximadamente igual al producto del área transversal de la superficie polar (S) y la longitud (l) de la cadena hidrofóbica [28]. Por lo tanto, el parámetro de empaquetamiento p [p = V / (S • l)] será 1,0 [28, 29]. Es probable que tales anfífilos formen autoensamblajes que son bicapas planas porque dicho ensamblaje produce una exposición mínima de las cadenas hidrófobas al agua (Fig. 2a).
La estructura molecular del Triton X-100, y de la mayoría de los otros detergentes, se puede idealizar como un cono, de modo que el volumen de la molécula sea menor que el producto del área de la superficie polar por la longitud de la cadena extendida. Por lo tanto, el parámetro de empaquetamiento para los anfífilos cónicos es inferior a 1,0 y la exposición de las cadenas hidrofóbicas al agua es mínima cuando se forman micelas curvas en lugar de bicapas (Fig. 2a) [28, 29].
La mezcla de fosfolípidos con un detergente producirá capas en las que no encajan idealmente ninguno de los dos anfífilos: los dos componentes son forzados por la entropía a residir en agregados mixtos. Antes de ser solubilizadas, las bicapas retienen su estructura lamelar, pero a medida que aumenta la relación detergente: lípido en las bicapas, se forman agujeros de diámetro creciente [30, 31]. El producto final de la micelización son casi siempre cilindros largos filiformes cuya superficie está curvada positivamente. La descripción alternativa (menos reciente) de las micelas mixtas en términos de un modelo de forma de disco también sería esperable, particularmente para las mezclas de sales biliares y fosfolípidos, porque los autoensamblajes discoidales pueden permitir la formación de una bicapa casi plana rica en fosfolípidos con los bordes curvos en el perímetro del disco cubiertos por detergente [32-34]. Al menos para el Triton X-100 y detergentes estructuralmente relacionados, favorecemos la descripción de la solubilización en términos de una serie hipotética de dos pasos (formación y sellado de micelas mixtas huecas) porque el producto de esta serie son micelas alargadas en lugarde discoidales. Además, las consideraciones teóricas demostraron que se puede esperar que los discos mixtos sean más estables que los cilindros solo en condiciones fisiológicamente no relevantes [35,36].
Figura 5. Curvatura espontánea y empaquetamiento molecular de lípidos. A, curvatura positiva; B, curvatura negativa; C, curvatura cero. Los lípidos pueden corresponder, por ejemplo, a dodecilsulfato sódico, fosfatidiletanolamina y fosfatidilcolina respectivamente [5]. Los detergentes tienen normalmente curvatura espontánea positiva
Otro enfoque más utilizado para el autoensamblaje de anfífilos se basa en la curvatura espontánea (Fig. 5), que se define como el recíproco del radio de la superficie sobre la cual se ensambla un anfífilo dado [37, 38]. El radio de curvatura espontánea se puede determinar experimentalmente [39]. Las moléculas cilíndricas son curvofóbicas, ya que tienden a agregarse a lo largo de superficies planas, cuyo radio de curvatura espontáneo es infinito (la curvatura espontánea es cero). Los anfífilos con una estructura molecular cónica son curvofílicos. Su parámetro de empaquetado puede ser menor o mayor que 1.0. Aquellos con p <1 (grupo de cabeza relativamente grande) tienden a agregarse en forma de micelas y su curvatura espontánea es positiva e igual al radio de sus micelas esféricas. Un tipo diferente de anfifilo con una geometría molecular cónica pero un grupo de cabeza relativamente pequeño (p> 1) tiende a formar estructuras hexagonales (tubulares) de curvatura espontánea negativa (no mostrada).
A partir de estas consideraciones, podemos ver el estado de agregación en las mezclas de lípidos y detergentes como un equilibrio entre las geometrías preferidas de los componentes. Cuando un anfífilo se ve obligado a residir en una superficie de curvatura diferente de su curvatura espontánea, se produce inestabilidad local. A veces el anfífilo se describe como “frustrado”. En estos términos, una mezcla de un fosfolípido curvofóbico y un detergente curvofílico forma agregados mixtos en los que se cancelan las inestabilidades causadas por ambos anfífilos, como se muestra esquemáticamente en la fig. 2. Se puede esperar que la curvatura promedio de un agregado mixto sea una media ponderada de la curvatura espontánea del detergente y los lípidos, como se discute en 2.9.
2.2. Parámetros en la caracterización de mezclas de lípidos y detergentes
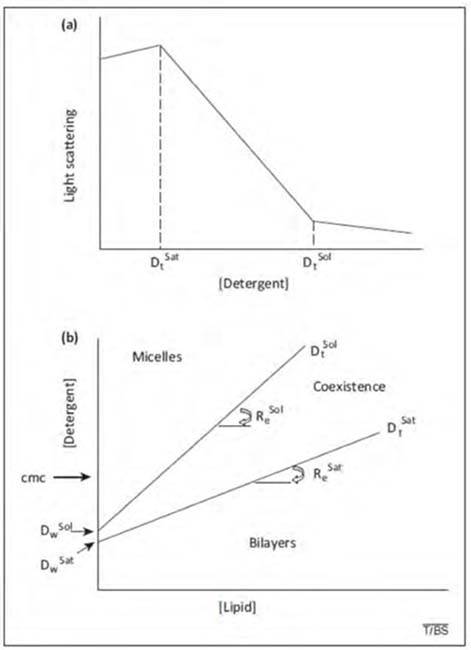
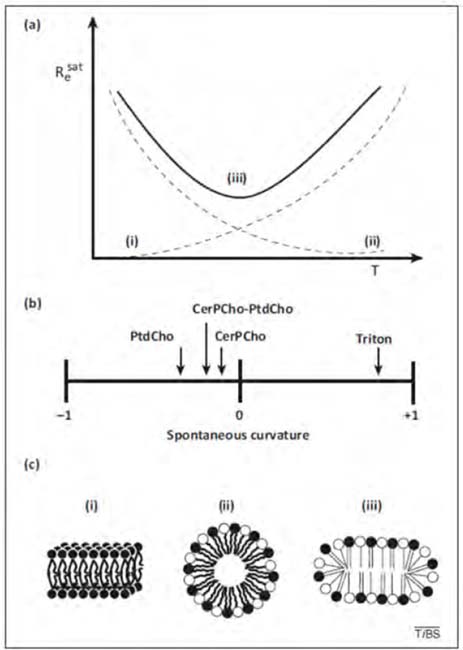
Los autoensamblajes formados en mezclas acuosas de detergentes y fosfolípidos se han estudiado exhaustivamente con diferentes detergentes y lípidos en función de sus concentraciones, en ausencia y presencia de diferentes lípidos y a diferentes temperaturas, utilizando diversos métodos [17, 19, 20]. Los resultados de estos estudios se han presentado en términos de diagramas de fase, en los que las concentraciones totales de detergente requeridas para el inicio y la finalización de la formación de micelas mixtas (Dtsat y Dtsol, respectivamente) se describen en función de la concentración de lípidos [L]. Nótese que los límites de fase, obtenidos a partir de la dependencia de Dt con respecto a [L], son aparentemente funciones lineales de la concentración de lípido (Fig. 6b). En consecuencia, la solubilización se caracteriza cuantitativamente por cuatro términos [20, 40], (a) la relación molar detergente/lípido efectiva (es decir, en la bicapa), requerida para el inicio de la solubilización Resat, (b) la proporción molar efectiva detergente/ lípido, Resol, un término similar correspondiente a la solubilización completa, (c) Dwsat y (d) Dwsol, que son las concentraciones de detergente obtenidas en extrapolaciones a [L] = 0 de las dependencias de Dtsat y Dtsol con [L].
Re se refiere a la relación molar efectiva (en oposición al total) [detergente] / [lípido], que es la fracción de la concentración total (o agregada) de detergente que reside en estructuras mixtas en condiciones de equilibrio. La distinción es necesaria porque en un sistema de membrana-detergente-agua el detergente se divide entre la membrana y el agua. En el rango entre Resat y Resol (Fig. 6b), las bicapas de fosfolípidos saturadas con detergente coexisten con micelas de detergente saturadas con lípidos, lo que implica que la energía de las bicapas de fosfolípidos saturadas con detergente (de una composición dada por Resat) es del mismo orden de magnitud que la energía de las micelas mixtas de una composición dada por Resol.
Figura 6. Caracterización de mezclas lípido-detergente. (a) Esquema descriptivo de la solubilización de membranas seguida a través de cambios en la dispersión luminosa de la suspensión de membranas. D sat y D sol corresponden a las concentraciones totales (no efectivas) de detergente que producen respectivamente el comienzo de la solubilización y la solubilización completa, para una determinada concentración de membrana. (b) Dependencia de D sat y D sol de la concentración de lípido. Las líneas rectas son los límites de la coexistencia de bicapas y micelas mixtas en mezclas acuosas lípido-detergente. Las pendientes de estas líneas son D sat y Resol, que corresponden respectivamente a las proporciones molares efectivas detergente/lípido que causan el comienzo y la finalización del proceso de solubilización. Dwsat y Dwsol son las concentraciones de detergente monomérico en agua al comienzo y al final de la solubilización, respectivamente. Ambos valores son más bajos que la concentración micelar crítica (cmc) del detergente puro en solución acuosa [26].
Dtsat y Dtsol tendrían que aproximarse a la concentración micelar crítica (cmc) del detergente, pero son con frecuencia más bajas que la cmc de los detergentes puros, probablemente debido al tamaño finito de las micelas, ya que a concentraciones muy bajas de lípido las concentraciones críticas de detergente pueden no ser función lineal de [L] [41]. Los diagramas de fases describen los estados de equilibrio. En sistemas mixtos de lípidos y detergentes en soluciones acuosas, los límites de fase describen el rango de solubilización parcial, a saber, el rango de concentraciones de fosfolípidos y detergentes donde la energía asociada a las micelas mixtas lípido-detergente es del mismo orden de magnitud que el de los liposomas saturados con detergente [20]. En varias publicaciones se observó que los límites de fase eran independientes del procedimiento utilizado para preparar el sistema mixto, asegurando que los diagramas de fase describían la situación de equilibrio, por ejemplo, en Schnitzer y cols. [41]. Desgraciadamente, en muchas publicaciones el procedimiento utilizado para estudiar los diagramas de fase es tal que no se puede garantizar que todos los experimentos se hayan realizado en condiciones de equilibrio (por ejemplo, Kragh-Hansen y cols. [42], y Stuart y Boekema [43]). A pesar de esta deficiencia, consideramos que cada mezcla de estado estacionario está en equilibrio, pero somos conscientes de la posibilidad de que, para ciertas composiciones, la estructura de los agregados lípido-detergente pueda ser simplemente un reflejo de trampas cinéticas, como se describe a continuación.
2.3. Métodos para caracterizar la solubilización de membranas por detergentes
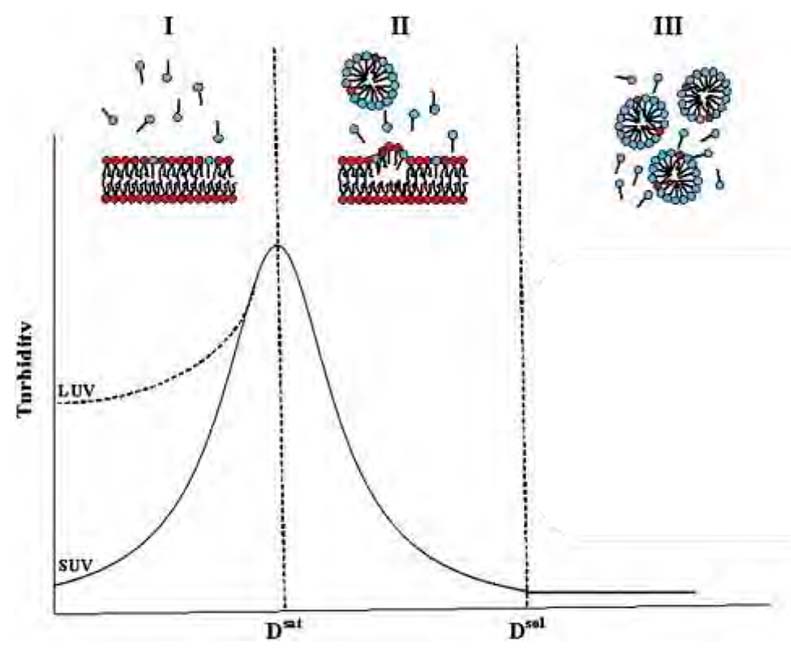
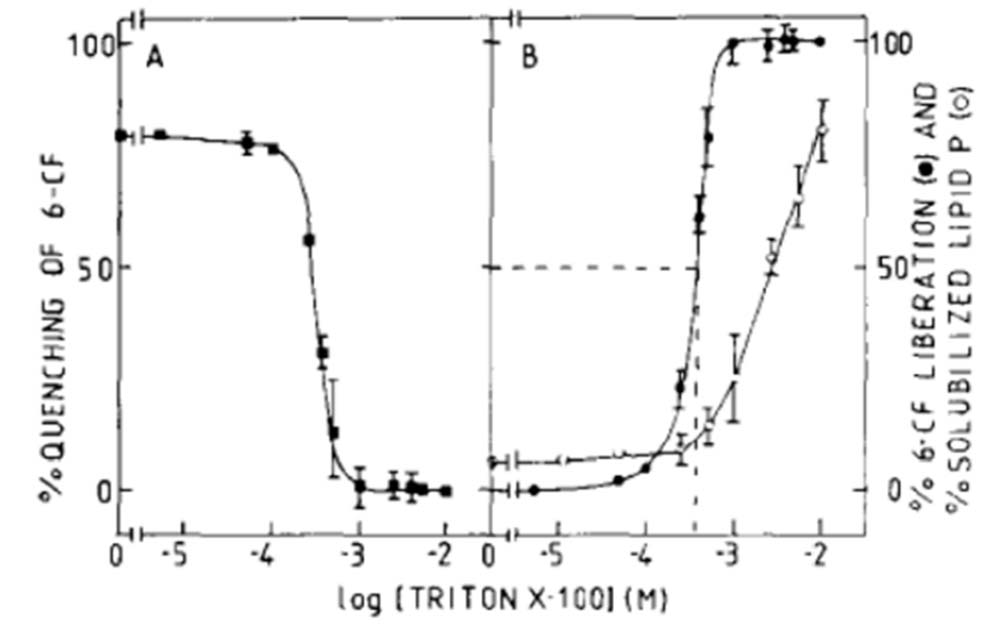
En la mayoría de los estudios, las suspensiones de liposomas se mezclan con disoluciones de detergentes y los sistemas resultantes se analizan por métodos espectrofotométricos, más comúnmente la dispersión luminosa. El efecto inicial de la adición de detergente sobre los liposomas depende del estado de agregación de los lípidos y del tamaño de las vesículas. En concreto, la adición de detergente a vesículas unilamelares pequeñas (SUV) da como resultado una mayor dispersión luminosa debido al crecimiento del tamaño de las vesículas inducido por el detergente.
Sin embargo, para vesículas unilamelares grandes (LUV), el tamaño de la vesícula puede permanecer inalterado o modificarse ligeramente antes del inicio de la solubilización debido a una solubilización de transición y la posterior reconstitución. En general, a medida que se agregan cantidades crecientes de detergente a una suspensión de membranas, la dispersión de la luz permanece constante o incluso aumenta hasta que, en un punto crítico, comienza a disminuir. Este es el inicio de la solubilización (Fig. 6a, Dtsat ). A medida que aumenta la conce tración de detergente, se alcanza otro punto crítico al finalizar la solubilización (Dtsol), más allá del cual la dispersión de la luz no sigue disminuyendo. La dependencia (aparentemente lineal) de los últimos dos puntos críticos con respecto a la concentración de fosfolípidos (Fig. 6b) da lugar a un diagrama de fases sencillo. La pendiente de cada una de estas líneas [detergente] / [lípido] es la relación entre la concentración de detergente en estructuras mixtas de lípido-detergente y la concentración de fosfolípido en los puntos de inicio y finalización de la solubilización. Estos dos parámetros son los Resat y Resol, antes descritos.
Además de la dispersión luminosa, existe toda una serie de técnicas destinadas a estudiar la dinámica de la solubilización de liposomas y la formación de los autoensamblajes formados por mezclas de detergente y lípido, incluyendo el tamaño, la forma y la composición de los liposomas y las micelas mixtas, preferiblemente sin separar las formas solubilizadas de las no solubilizadas, pues las técnicas de separación llevan con frecuencia a la aparición de artefactos. El método más directo para proporcionar información sobre la forma y el tamaño de los conjuntos detergente-lípido es la criomicroscopía electrónica de transmisión (crio-TEM) [44-46]. Sin embargo, la crio-TEM difícilmente puede arrojar resultados cuantitativos fiables sobre partículas pequeñas en presencia de partículas grandes. Esto último también es cierto para la dispersión de la luz, tanto estática como dinámica (correlación de fotones). En consecuencia, la espectroscopía de dispersión de la luz y otras técnicas de dispersión, aunque ampliamente utilizadas por razones de comodidad, producen resultados cuestionables en el inicio de la solubilización. También se debe tener en cuenta que los métodos de dispersión de la luz pueden verse perturbados por el aumento de la turbidez de algunos detergentes, por ejemplo el Triton X-100, que por encima de cierta temperatura («punto de nube») da lugar a formaciones altamente dispersantes [47].
Por el contrario, la espectroscopía de resonancia magnética nuclear de fósforo-31 (31P-RMN) es sensible a partículas pequeñas porque solo partículas pequeñas (por ejemplo, micelas mixtas) producen señales relativamente estrechas (observables) [48-50], mientras que el espectro de vesículas grandes se ensancha hasta hacerse casi indetectable. Dadas las diferentes sensibilidades de la dispersión de la luz y la RMN, estos métodos son complementarios. La RMN se puede usar para determinar cuantitativamente la etapa inicial de solubilización (por lo tanto, Resat), mientras que las técnicas de dispersión de la luz pueden ser útiles para proporcionar datos de Resol. También se puede obtener mucha información sobre los procesos estudiados utilizando la calorimetría de titulación isotérmica (ITC) [51-55]. Si se interpreta correctamente, este método puede proporcionar información tanto sobre la concentración de detergente a la cual ocurre una transformación como sobre el calor asociado a cada proceso. Las mediciones del ITC no proporcionan información estructural, pero la técnica es útil para obtener datos sobre procesos rápidos. Dados los problemas asociados a la sensibilidad de las técnicas de dispersión a partículas grandes, el ITC es beneficioso para estudiar procesos que probablemente se vean afectados por tales artefactos.
La espectroscopía de fluorescencia ofrece un conjunto completo de técnicas para ser utilizadas en relación con la solubilización de membranas por detergentes. La liberación al medio acuoso externo de compuestos fluorescentes hidrosolubles encapsulados en los liposomas se puede observar en tiempo real. El uso de compuestos fluorescentes de diferentes pesos moleculares [30, 56] indica el tamaño de las discontinuidades en la bicapa. Ciertas sondas fluorescentes bien conocidas, por ejemplo, el difenilhexatrieno, proporcionan información sobre el orden molecular de la bicapa y su perturbación por los tensioactivos [57]. Además, el movimiento transbicapa, o flip-flop, de moléculas anfifílicas, incluidos los tensioactivos, también se puede evaluar con técnicas de fluorescencia [56, 58].
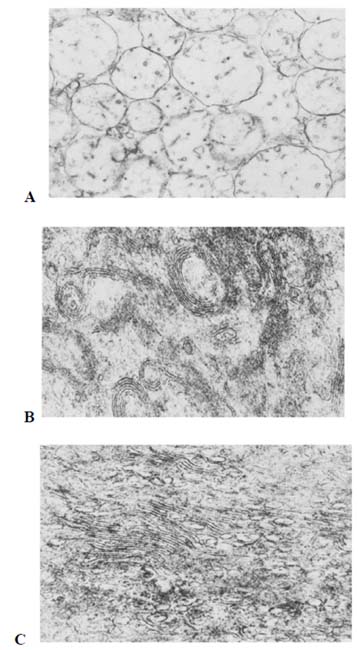
En general, se recomienda una combinación de técnicas. Por ejemplo, a pesar de sus deficiencias, la crio-TEM es una herramienta muy útil en la investigación del mecanismo de solubilización. La información cualitativa sobre los tipos de estructuras en las mezclas de lípidos y detergentes es esencial para la correcta interpretación de la dispersión de la luz y los datos de RMN. Esto es particularmente importante en los estudios mecanísticos, porque se puede esperar que las estructuras de transición contribuyan muy poco (si es que lo hacen) a las mediciones espectroscópicas. Sin embargo, la mera existencia de una estructura transitoria proporciona pistas sobre el mecanismo de solubilización, incluso cuando tales estructuras rara vez se observan. Como ejemplo, la crio-TEM de las estructuras presentes en dispersiones obtenidas por adición del detergente no iónico octilglucósido a las vesículas de fosfolípidos reveló, antes de la formación de micelas mixtas cilíndricas, liposomas con poros de tamaños cada vez mayores al agregar más octilglucósido [59]. La última observación concuerda con los datos de fluorescencia sobre la fuga de solutos encapsulados [56, 60, 61].
2.4. El modelo de tres etapas: definiciones y ambigüedades
Se han propuesto varios mecanismos para la solubilización de bicapas por detergentes. El consenso más general es que puede describirse según un modelo de tres etapas o pasos, como lo proponen Helenius y Simons [3]. El término «modelo de tres etapas» en sí es bastante ambiguo. A menudo se entiende en términos termodinámicos, lo que significa que, en el equilibrio, en el rango de valores debajo de Resat (Etapa 1), los conjuntos mixtos son bicapas; que por encima de Resol (Etapa 3), son micelas; y que dentro del rango de valores entre Resat y Resol (Etapa 2), coexisten bicapas y micelas. Sin embargo, el modelo también a menudo se entiende en términos cinéticos o mecanicistas, es decir, en términos de la secuencia de procesos que ocurren cuando se agrega una concentración solubilizante de detergente a las bicapas lipídicas. En estos términos, la Etapa 1 se relaciona con interacciones entre detergentes y lípidos que no producen estructuras micelares, la Etapa 2 es aquélla en la que las bicapas saturadas de detergente se convierten en micelas mixtas, y la Etapa 3 está reacionada con la reducción del tamaño de las micelas mixtas como resultado de su interacción con más d tergente. En términos de procesos, el modelo incluye una serie de etapas:
Etapa 1. Partición del detergente entre las bicapas lipídicas y el medio acuoso, descrita por un coeficiente de partición K, definido como
K = Dt/(L + Db)Dw
Donde Dt es la concentración total de detergente, L es la concentración de lípido y Db y Dw son las concentraciones de detergente unida a la membrana y en el agua, respectivamente. Por lo tanto,
1/K = (1/Re)/(1/Dw)
Etapa 2. Una desintegración inducida por el cambio en la composición de las bicapas, para formar micelas mixtas largas y filiformes.
Etapa 3. A concentraciones de detergente aún más altas, la solubilización es seguida por una serie relativamente rápida de procesos entrópicos, en los que se mezclan micelas grandes de detergente-fosfolípido con micelas de detergente puro, y se obtienen micelas mixtas más pequeñas con una mayor relación detergente / fosfolípido.
La primera y tercera etapas en este esquema son aparentemente triviales. Se cree comúnmente que, para el detergente, el reparto membrana/agua es rápido, pero la saturación de la bicapa se puede ralentizar por la necesidad de una difusión (nuevo reparto) del detergente entre las monocapas externa e interna de la bicapa (ver 2.7.a). El equilibrio de los sistemas mixtos de micelas (en la Etapa 3) es mucho más rápido que el equilibrio de los sistemas m celares y lamelares. La etapa 2 corresponde al proceso de disociación de micelas de una composición dada por Resol a partir de las bicapas saturadas en detergente, de una composición dada por Resat. El mecanismo detallado de esta transformación de bicapa en micelas (micelización) no se comprende completamente y es el tema de varias de nuestras investigaciones.
En la mayoría de los protocolos de solubilización comúnmente utilizados, la concentración de detergente es suficiente para la solubilización de la membrana (en equilibrio), y el comienzo de la micelización (Etapa 2) a menudo ocurre antes de que la Etapa 1 alcance el equilibrio. Esto, por supuesto, añade complejidad al proceso.
Figura 7. Las tres etapas de solubilización de la bicapa por los detergentes (11). (Arriba) Representación esquemática de las etapas I – III. (Rojo) Grupos polares de fosfolípidos. (Azul) Grupos polares de detergente. (Abajo) La solubilización de una preparación de vesículas (vesículas unilamelares pequeñas o grandes) se siguió a través de los cambios en la turbidez. [20].
2.5. Diagramas de fase y la necesidad de estudios cinéticos
Los límites de fase mostrados en la figura 6b son significativos solo para sistemas en equilibrio. Es importante tener en cuenta que una estructura en estado estacionario podría reflejar trampas cinéticas, es decir, estados de equilibrio aparentes, pero no reales si se considera un periodo de tiempo suficientemente largo. Por lo tanto, la afirmación de que en ocasiones la solubilización requiere más detergente debido a dificultades en la penetración no es estrictamente cierta porque, con el tiempo suficiente, ocurriría la solubilización. La forma tradicional de asegurar que un sistema dado esté en equilibrio es mostrar que las mezclas de igual composición preparadas de manera diferente son idénticas. Por ejemplo, las mezclas de una composición dada obtenida por co-dispersión de lípidos y detergente en soluciones acuosas deberían comportarse de la misma manera que las mezclas de la misma composición obtenida mezclando dispersiones de lípidos y detergentes que se han preparado individualmente. Las pocas investigaciones publicadas en las que se llevaron a cabo tales experimentos brindan un fuerte respaldo a la conclusión de que los sistemas estudiados estaban en equilibrio [41].
Lo menos que debemos hacer para descartar la posibilidad de que los límites de fase aparentes reflejen trampas cinéticas en lugar de estados de equilibrio es mostrar que las mezclas estudiadas se miden en condiciones de estado estacionario, tal como se detecta al controlar la dependencia del tiempo de una propiedad fisicoquímica. Pero alcanzar el equilibrio puede llevar de segundos a muchos días, dependiendo de la composición del sistema y la temperatura [41, 62-66]. Las cuestiones importantes del mecanismo y la cinética de la solubilización están más allá del alcance de la presente revisión, sin embargo, los estudios cinéticos son importantes para respaldar la validez de los aspectos termodinámicos discutidos aquí.
Los estudios cinéticos son particularmente importantes cuando el equilibrio es muy lento, como en los experimentos realizados a baja temperatura con lípidos en fase gel [67] o / y cuando el protocolo del experimento de solubilización implica la titulación de liposomas multilamelares (MLV) por una solución de detergente, por ejemplo desoxicolato [32] o Triton X-100 [52] Proponemos que las causas más importantes de resultados irreproducibles son protocolos experimentales inapropiados que usan condiciones de no equilibrio y / o métodos poco sensibles.
Las mezclas de detergente y fosfolípidos pueden ser estables durante largos períodos de tiempo sin estar en equilibrio [41, 68]. Como ejemplo, cuando se agrega una solución de detergente a vesículas unilamelares preformadas con el lípido en el estado gel o en los estados cristalinos (por ejemplo, DPPC por debajo de 40 ºC) [41,69], el equilibrio puede ser tan lento que la mezcla parece ser constante con respecto al estado de agregación de los conjuntos mixtos, a pesar de no estar en equilibrio. Agregados metastables atrapados cinéticamente pueden permanecer estables durante horas y, a veces, durante muchos días, como en el caso de las micelas metaestables ricas en colesterol formadas al mezclar vesículas de fosfolípidos ricas en colesterol con sales biliares [70, 71]. En el último caso, cuando se agrega una sal biliar a los liposomas de PC-colesterol, en ciertas condiciones la sal biliar agregada solubiliza los liposomas rápidamente pero posteriormente precipitan los liposomas ricos en colesterol formados inicialmente. Eventualmente, el colesterol cristaliza dentro de los agregados de vesículas, produciendo precipitados [71]. Procesos similares pueden ser responsables de la formación de cálculos biliares de colesterol [72].
La solubilización de vesículas multilamelares (MLV) es un proceso lento. Cuando los MLV se exponen a una solución de detergente [68], solo la bicapa más externa del MLV se expone al detergente agregado. En relación con la última bicapa, la concentración de detergente puede ser suficiente para solubilizar esta bicapa, dando como resultado la exposición de la siguiente bicapa al detergente. Las bicapas en las MLV pueden ir despegándose y solubilizándose una después de otra, pero incluso si la concentración total de detergente es suficiente para solubilizar todas las capas de lípidos, el proceso será mucho más lento que la solubilización de vesículas unilamelares de masa y composición idénticas [68]. Es probable que esto produzca errores graves si la solubilización es tan lenta que, en el momento de medir la turbidez de la dispersión, la solubilización aún no está completa. En otras palabras, se sobreestimará la concentración de detergente requerida para la solubilización completa.
Por el contrario, si la concentración de detergente es suficiente para solubilizar una o más bicapas lipídicas, pero no todas, la solubilización se hará visible a una concentración de detergente menor que la necesaria para el inicio de la solubilización de vesículas unilamelares de idéntica composición y concentración. En tales condiciones, las micelas mixtas formadas inicialmente se reconvertirán en bicapas cuando se solubilice más fosfolípido, debido a que disminuirá la relación efectiva detergente / lípido. En este caso, alcanzar un estado estable puede ser muy lento y si se mide antes del equilibrio completo, se subestimará el inicio de la solubilización.
2.6. Los factores que gobiernan la solubilización
Comprender el mecanismo de la micelización requiere información sobre al menos tres factores, a saber:
(a) los conjuntos detergente-lípido que existen en Resat,
(b) el producto de la transición de fase inducida por la composición, a saber, micelas de una composición dada por Resol, y
(c) el examen de tantas estructuras intermedias como sean necesarias para ayudar a determinar el mecanismo.
Una suposición subyacente esencial es que en cualquier punto dado la mezcla de detergente-lípido está en un estado estable. Éste puede ser el caso de un experimento de titulación lenta, como en el ITC, pero en términos generales, la Etapa 2 (es decir, la micelización) comienza antes del final de la Etapa 1, un hecho que a menudo complica la interpretación de los datos experimentales.
2.7. Vesículas saturadas de detergente (en Resat): composición química y propiedades estructurales y físicas
2.7.a. Partición del detergente de medios acuosos a bicapas, incluyendo la monocapa interna
El primer paso de la interacción bicapa / detergente es la introducción de moléculas de detergente en la monocapa externa de la bicapa de fosfolípidos. El coeficiente de partición K que describe el equilibrio del detergente entre las bicapas y la solución acuosa se rige por dos factores, a saber,
(a) la hidrofobicidad del detergente,
(b) su equilibrio hidrofílico / lipofílico y su curvatura espontánea [43, 73]. La curvatura espontánea refleja la tendencia de los anfífilos a empaquetarse en una superficie curva, como se ha comentado en 2.1 (Fig. 5) [26]. Los detergentes son curvofílicos, es decir, tienen una curvatura espontánea positiva, mientras que los fosfolípidos tienden a autoensamblarse formando una superficie plana, por lo tanto, su curvatura espontánea es aproximadamente cero, o incluso ligeramente negativa [36].
El coeficiente de partición K depende de estos factores, pero la velocidad a la que se equilibra la concentración de detergente en las dos monocapas puede variar considerablemente. En particular, la acumulación de detergente en la monocapa externa induce el paso de detergente a la monocapa interna, probablemente al perturbar la región interfacial de la bicapa mediante moléculas de detergente insertadas, lo que a su vez aumentará la probabilidad de formación de defectos estructurales transitorios en la membrana [59]. El movimiento transbicapa, o flip-flop, es a menudo el factor limitante de la solubilización. A su vez, este movimiento depende del tamaño y la polaridad del grupo polar del detergente [44]. No es probable que una molécula con un grupo polar muy grande se mueva a través de la bicapa [74, 75]. Por lo tanto, el sistema no puede alcanzar el equilibrio en un corto período de tiempo y la solubilización comúnmente comienza antes de que se pueda alcanzar el equilibrio. El consiguiente desequilibrio de masas puede desempeñar un papel en el mecanismo de solubilización por estos detergentes.
Tanto la penetración de un detergente en la monocapa externa como su movimiento transmembrana hacia la monocapa interna dependen de la composición de la bicapa. Como ejemplo, en su estudio de la solubilización de liposomas de varias composiciones diferentes por el detergente no iónico miristilsacarosa, Toro et al. [76] encontraron que la localización del detergente en la bicapa lipídica dependía de las características del grupo de cabeza polar lipídico, influyendo este último en el proceso de solubilización. También descubrieron que la inserción de moléculas de colesterol en la bicapa lipídica dificultaba la solubilización.
Se han llevado a cabo simulaciones de dinámica de partículas [77], destinadas a investigar el mecanismo de solubilización de vesículas por tensioactivos, centradas en el efecto de la hidrofobicidad del detergente. Según la interpretación de los autores, solo los tensioactivos con hidrofobicidad adecuada pueden solubilizar las vesículas. Los detergentes hidrofílicos permanecen sobre todo en la fase acuosa, mientras que los tensioactivos muy hidrofóbicos se incorporan casi totalmente a las bicapas, lo que induce el crecimiento del tamaño de las vesículas sin solubilizar la membrana. Solo los tensioactivos con hidrofobicidad moderada forman vesículas perforadas antes de la formación de micelas mixtas, por las razones que se describen a continuación. La extensión de la perforación crece con el aumento de la concentración de surfactante, hasta que finalmente se observa el colapso total de la vesícula. Se ha podido detectar la formación de poros en muchos sistemas detergente-lípido antes de la solubilización.
2.7.b. Aumento de tamaño de vesícula inducido por detergente
Se ha observado un aumento de tamaño inducido por detergente en pequeñas vesículas unilamelares, para muchos detergentes y varias composiciones diferentes de liposomas, a concentraciones sub-solubilizantes de detergente (Fig. 6a) [66, 78-81]. El crecimiento del tamaño de las vesículas desde un radio inicial ri a uno final rf aumenta por un factor de (rf / ri)2 el área de la superficie de las vesículas, lo que significa que se espera que disminuya el número de vesículas por un factor de (ri / rf)2.
Este proceso podría haberse producido a través de uno (o más) de estos tres mecanismos:
(a) fusión inducida por detergente, que implica la mezcla de los dos compartimentos acuosos y de las bicapas de las membranas que se fusionan;
(b) mecanismos de solubilización – reensamblaje inducidos por detergente, con lisis parcial seguida de la reconstitución de vesículas más grandes; y
(c) dismutación de los liposomas, caracterizada por la transferencia de lípidos de parte de las vesículas (probablemente las más pequeñas) a otros liposomas (presumiblemente más grandes).
Una diferencia importante entre los tres posibles mecanismos es la retención del soluto encapsulado. Por lo tanto, se puede esperar que los solutos de alto peso molecular permanezcan encapsulados en los liposomas si el crecimiento del tamaño se produce por fusión (como se cree que ocurre normalmente), mientras que se espera que la solubilización-reensamblaje esté acompañada por la pérdida de los solutos. Se espera que la tercera posibilidad esté acompañada de una retención parcial de solutos, es decir, solo los solutos de esas vesículas que se hicieron más grandes permanecerán atrapados, mientras que las moléculas de soluto que estaban atrapadas en las vesículas decrecientes se encontrarán en la solución externa [79].
Se ha demostrado el crecimiento de tamaño inducido por detergente mediante fusión de vesículas para liposomas cargados negativamente en presencia de Ca2+ [82]. La solubilización parcial de vesículas pequeñas producidas por sonicación, inducida por Triton X-100, es seguida por el reensamblaje en liposomas más grandes, según lo propuesto por Alonso et al. [80, 81], y por Edwards y Almgren [45]. El mecanismo de dismutación se propuso por primera vez para el aumento de tamaño inducido por sales biliares [83, 84]. Un estudio sobre el crecimiento del tamaño de liposomas inducido por concentraciones sub-solubilizantes del detergente no-iónico octilglucósido reveló una retención parcial de dextrano de alto peso molecular, marcado con fluorescencia [79]. La fracción de soluto retenido era proporcional al crecimiento del tamaño observado, apoyando así el mecanismo de dismutación [79]. La similitud del aumento de tamaño inducido por detergente en presencia de tensioactivos tan diferentes como las sales biliares y el octilglucósido [79-82] respalda la idea de que la dismutación puede ser un mecanismo frecuente para el crecimiento de tamaño inducido por detergentes.
2.7.c. Permeabilidad de las bicapas que contienen detergente
La liberación de solutos encapsulados de liposomas tratados con detergente se ha observado en varios estudios a concentraciones sub-solubilizantes de los anfífilos [30, 56, 80, 81]. Parte de esta liberación se puede atribuir al aumento de tamaño inducido por el detergente, pero se han observado agujeros en los LUV en ausencia de un crecimiento del tamaño.
Las simulaciones de dinámica de partículas muestran que durante el proceso de partición (Etapa 1), las moléculas tensioactivas individuales se incorporan a la bicapa lipídica de manera independiente [85]. La compatibilidad de las colas hidrofóbicas entre lípidos y tensioactivos permite que los tensioactivos penetren a través de la membrana con bastante facilidad y las moléculas de tensioactivo aparezcan en la región interna de la bicapa. Esta penetración del detergente puede deberse a la promoción del movimiento transbicapa del detergente, o a la penetración del detergente en el compartimento acuoso encapsulado y al posterior reparto entre este compartimento y la monocapa interna. En otras palabras [86], al aumentar la concentración de detergente en las monocapas externas, el área en exceso que resulta de la unión de los tensioactivos a la monocapa externa da como resultado la formación de poros trans-bicapa, la fluidificación de la bicapa y el aumento de las fluctuaciones de la bicapa, con mayor frecuencia y / o probabilidad cuando la concentración de surfactante se aproxima a Resat. Además, siempre que el detergente esté distribuido de manera no homogénea, las vesículas adoptan aspectos altamente deformados antes de que tenga lugar la perforación de la vesícula. La formación de poros se ha observado antes de la solubilización en muchas investigaciones. Con el desarrollo de más agujeros al incorporar más tensioactivo, la vesícula se rompe en unos pocos fragmentos de bicapas, que eventualmente, con nuevas adiciones de tensioactivo, se desintegran en pequeñas micelas mixtas [85]. Como ejemplo, estudios de la cinética de liberación del contenido liposomal tras la exposición de los liposomas a un exceso de surfactante [86] revelaron que, a bajas concentraciones de detergente, la liberación del contenido liposomal es consistente con la formación de canales en un número crítico de moléculas tensioactivas. Sin embargo, solo a concentraciones considerablemente más altas la cinética concuerda con la esperada para la ruptura de los liposomas inducida por detergente. Creemos que la estructura de tales canales (o poros) es la clave para comprender el mecanismo detallado de solubilización, como se discute más adelante.
2.8. La estructura y propiedades fisicoquímicas de las micelas mixtas de una Composición dada por Resol
La solubilización de lípidos por sales biliares se ha estudiado con gran detalle, utilizando muchos métodos. Estos estudios conducen a un consenso sobre una estructura discoidal de los agregados mixtos formados cuando se solubiliza todo el lípido. Según ese modelo, las micelas mixtas resultan ser bicapas discoidales pobres en detergente, cubiertas en su borde por una monocapa curva rica en detergente [87-90]. De manera similar, los datos sobre las micelas formadas tras la titulación de fosfolípidos por otros detergentes, particularmente los resultados de la dispersión dinámica de la luz y la dispersión de rayos X de ángulo pequeño, se interpretaron en el sentido de que estas micelas son elipsoides oblatos, con un gradiente creciente de tensioactivo desde el centro al perímetro siguiendo el eje mayor [47, 90].
Este enfoque produjo un mecanismo razonable y fácil de entender para la solubilización y la reconstitución de las bicapas lipídicas. Sin embargo, estudios posteriores con crio-TEM y detergentes distintos de las sales biliares mostraron objetos largos filiformes en lugar de las estructuras esperadas con forma de disco [44, 91]. Posteriormente, se demostró que los datos de dispersión concordaban con el modelo de barras flexibles y diversos estudios teóricos explicaron «por qué cilindros, y no discos» [36].
El paradigma actual es que, para la mayor parte de los detergentes, las micelas mixtas más grandes son estructuras muy largas y filiformes, y que al aumentar la concentración de detergente se reduce la longitud de estas micelas. En estas estructuras, casi todas las moléculas de lípidos son equivalentes, con la excepción de un pequeño número de moléculas en los dos bordes (extremos) de las micelas alargadas. Lo mismo es casi cierto para el detergente, excepto que la concentración de detergente en los extremos es algo
mayor.
2.8.a. Estructuras intermedias observadas en el rango de coexistencia
Como se describió anteriormente, las bicapas lipídicas pueden considerarse sobresaturadas incluso por debajo de Resat, porque contienen paredes ricas en detergente que cubren los bordes de los poros observados por crio-TEM. Cuando la bicapa contiene más detergente, el tamaño de los poros es mayor, lo que permite que las moléculas más grandes puedan salir de los liposomas [79]. La crio-TEM no proporciona datos cuantitativos, pero la existencia de estructuras distintas a las observadas en Resat o en Resol da una pista sobre el mecanismo de micelización de una bicapa sobresaturada. Tales estructuras intermedias han sido observadas por crio-TEM, que se sabe que preserva las microestructuras originales de los sistemas fluidos, en estudios de mezclas tanto de Triton X-100 [91] como de octilglucósido con PC de huevo [60] por debajo de Resat. A concentraciones de detergente algo más altas, además de los liposomas y las micelas largas filiformes, el sistema contenía algunos liposomas que parecían tener objetos largos (presumiblemente micelas mixtas) unidos a ellos [60].
En la mayoría de los casos de solubilización los detergentes se unen al exterior de las bicapas de fosfolípidos y voltean hacia la monocapa interna. En estos casos, la Etapa 2 de solubilización es una transición inducida por la composición de liposomas sobresaturados de detergente, grandes, perforados, de una composición dada por Resat, que se convierten en micelas largas, filiformes, de una composición dada por Resol. Las estructuras intermedias observadas ayudan a comprender el mecanismo detallado como se describe a continuación. Por el contrario, cuando una molécula de detergente no puede voltearse hacia la monocapa interna, la solubilización rápida por saturación de las bicapas está precedida por otros procesos que dan lugar a la exposición de ambas monocapas al detergente, como se describe en la siguiente sección.
2.9. El mecanismo de la transición de bicapa a micela inducida por detergentes
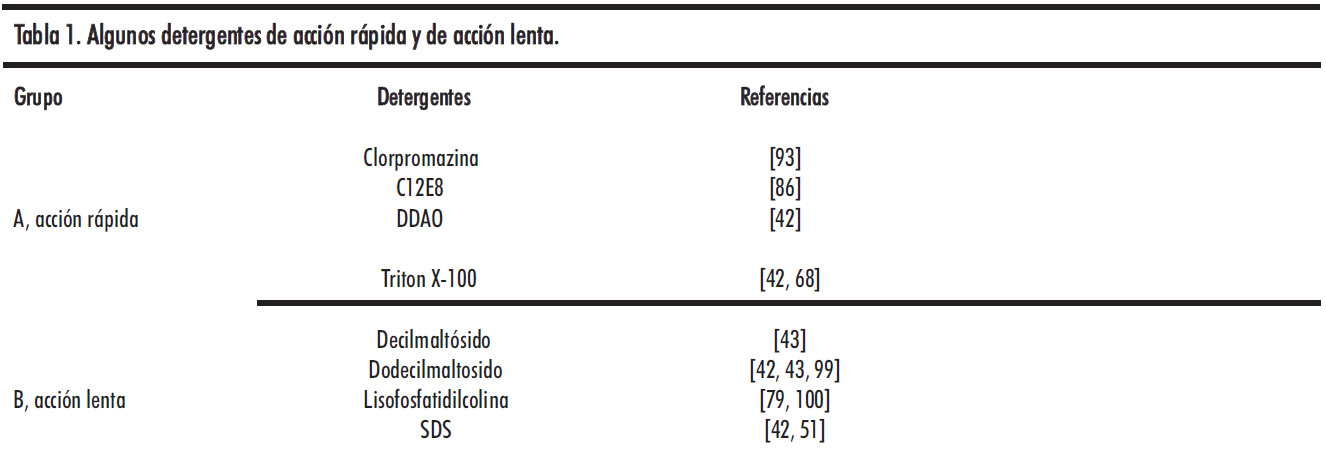
En relación con los mecanismos de solubilización, es importante tener en cuenta que la solubilización depende de manera crítica del movimiento transmembrana del detergente, a veces denominado flip-flop [42] Específicamente, se ha demostrado que cuando el volteado del detergente a la monocapa interna es rápido (por ejemplo, detergentes del Grupo A en la Tabla 1), la solubilización es rápida, mientras que cuando el volteado del detergente es lento (por ejemplo, el Grupo B), la solubilización es lenta.
La cinética de solubilización puede estar muy influenciada por factores como la temperatura, composición de vesículas y procedimiento de preparación de vesículas, entre otros. Los datos de esta tabla se han recopilado principalmente de publicaciones en las que se han comparado varios detergentes en las mismas condiciones. Se pueden ver más ejemplos en [150].
Dos investigaciones detalladas propusieron diferentes mecanismos específicos de solubilización rápida y lenta [42, 43]. Ambos estudios coincidieron en que la solubilización rápida se produce a través de la saturación de las bicapas de fosfolípidos. En uno de los estudios [42], el mecanismo de la solubilización rápida de las bicapas se denominó mecanismo transbicapa, y se describió como un proceso de todo o nada que da como resultado la solubilización completa (o la no-solubilización) de un liposoma. En el otro mecanismo publicado, el mismo proceso se describió como una rápida solubilización de fosfolípidos que ocurre a través de intermedios vesiculares abiertos [43]. Ambos mecanismos se proponen para sistemas en los que la velocidad de flip-flop es rápida, y ambos son experimentalmente muy similares, si no idénticos.
Por el contrario, los mecanismos propuestos para la solubilización lenta diferían considerablemente. Ambos estudios coincidían en que el proceso era lento porque el flip-flop era lento, y ambos acordaron que la solubilización lenta da como resultado la micelización de solo una parte de los fosfolípidos en un liposoma dado. No obstante, según uno de los mecanismos [42], la solubilización se produce mediante la unión de las micelas de detergente a las bicapas y la posterior «extracción de los componentes de la membrana directamente por las micelas de detergente» [43], mientras que según el otro mecanismo este proceso ocurre a través de las «micelas mixtas que se despegan de las vesículas cerradas» [85].
2.9.a. Evaluación de los mecanismos propuestos de solubilización lenta
En nuestra opinión, las pruebas experimentales de la unión de las micelas a una bicapa no son convincentes. Los hallazgos de agregados pre-micelares muy por debajo de la cmc (en un rango similar a Rwsat), que podrían estabilizarse reclutando lípidos de la membrana, no son consistentes con el mecanismo de extracción de micelas. No es muy probable que se formen pre-micelas de lípido-detergente mediante la extracción de fosfolípidos por detergente pre-micelar porque es probable que dichas pre-micelas no estén muy por debajo de Rwsatt antes de mezclar el detergente con liposomas estables. Por el contrario, la unión de los monómeros a la monocapa externa de la bicapa es probablemente lo suficientemente rápida como para alcanzar un reparto de detergente en cuasi-equilibrio entre la monocapa externa y la solución acuosa. La “monocapa externa con detergente” resultante puede que sea inestable debido a dos factores, a saber: (a) el desequilibrio de masa entre las monocapas externas e internas, y (b) la presencia de un anfífilo curvofílico (es decir, detergente) de una curvatura espontánea altamente positiva en una monocapa casi plana hecha de fosfolípidos, cuyo radio de curvatura espontáneo es cero o ligeramente negativo.
Por lo tanto, si una molécula de detergente no puede voltearse hacia la monocapa interna, es probable que se formen estructuras micelares en la monocapa externa y se desprendan de las vesículas cerradas como micelas mixtas [43]. En otras palabras, una concentración de detergente suficientemente alta promueve el desprendimiento (shedding) de tales micelas mixtas de la superficie de las bicapas en un amplio rango de concentraciones [85]. Un modelo similar, propuesto por Mrowczynska et al. [103], implica que cuando se insertan en las bicapas, las moléculas de detergente curvofílicas afectan a la curvatura o flexión (bending) de la bicapa, lo que da lugar a la perturbación de la membrana. Específicamente, cuando el detergente penetra en una bicapa, la membrana se invaginará o se evaginará, produciendo endo o exovesiculación, respectivamente. La forma alterada de la bicapa se acompaña de una segregación lateral dependiente de la curvatura de los componentes de la membrana. Basados en estos argumentos, los autores plantearon la hipótesis de que la solubilización se produce a través de la segregación, dependiente de la curvatura de la membrana, de los componentes de la misma [44]. Este mecanismo puede considerarse consistente con la formación de dominios de membrana que no pueden ser solubilizados por Triton X-100 (membranas resistentes a detergentes).
En relación con la solubilización lenta, esta hipótesis implica que la acumulación de detergente en la monocapa externa da como resultado el siguiente curso de eventos:
(a) el detergente monomérico se intercala en las áreas de membrana casi planas, lo que da como resultado la expansión de la monocapa externa; y
(b) cuando el detergente no voltea hacia la monocapa interna, se acumula en la monocapa externa, esforzándose por curvar la membrana hacia afuera, creando pequeñas invaginaciones de membrana (o micelas mixtas).
Nótese que, si el detergente puede voltearse a la monocapa interna y la monocapa interna resulta relativamente enriquecida en el mismo, también se crearán pequeñas invaginaciones de membrana o dominios cuasi-vesiculares o yemas (buds). Las micelas mixtas formadas a partir de partes ricas en detergente de la monocapa externa pueden existir por debajo de Rwsat y pueden extraer componentes de la membrana directamente al interior de las micelas mixtas [44]. Por lo tanto, mientras el equilibrio transmembrana sea muy lento y no ocurra la penetración de detergente a través de la bicapa, es probable que se formen dominios curvos laterales ricos en detergente en la monocapa externa y que experimenten desprendimiento o gemación de micelas, es decir, que ocurra micelización de solo una parte de la membrana. Suponiendo que tanto el desprendimiento como la solubilización micelar (mixta) contribuyen a la solubilización lenta observada cuando el equilibrio transmembrana es muy lento, la pregunta es cuál de las dos últimas posibilidades contribuye más a la solubilización. Desgraciadamente no sabemos, en este momento, cómo evaluar la contribución relativa de los dos mecanismos.
2.9.b. El mecanismo de saturación de la bicapa para una solubilización relativamente rápida
La rápida solubilización observada cuando el detergente puede voltearse desde las monocapas externas hacia las internas, con la solubilización de fosfolípidos que ocurre a través de intermediarios vesiculares abiertos [45], o bien por un ataque transbicapa, después del flip-flop de las moléculas de detergente a través de la bicapa lipídica [44], ha sido investigada con gran detalle. La solubilización a través de este mecanismo ocurre después de que toda la bicapa se satura (o sobresatura) y toda la membrana rica en detergente se solubiliza a través de un mecanismo de solubilización de todo o nada [44], como se discutió anteriormente. Este mecanismo puede seguir a la solubilización parcial por cualquiera de los mecanismos propuestos porque se puede esperar el equilibrio trans- bicapa si la bicapa se vuelve permeable al detergente, debido a la creciente incorporación de detergente a la monocapa externa. Así, ambos mecanismos de solubilización parcial allanan el camino para la exposición de la monocapa interna al detergente, y de ahí la rápida solubilización a través de un mecanismo de saturación rápida de bicapa. Esto es particularmente claro cuando la solubilización rápida aparece precedida por una fase de duración variable, el periodo de latencia, durante la cual la solubilización es mucho más lenta.
Durante el periodo de latencia, las moléculas de detergente saturan las dos monocapas ya sea volteándose hacia la monocapa interna o migrando a través de los orificios inducidos por el detergente. Finalmente se produce la desintegración (micelización) de toda la membrana [63, 92]. En el rango de coexistencia de bicapa / micela, la crio-TEM revela principalmente micelas laminares y filiformes, así como algunos intermediarios de tipo vesículas perforadas [44]. En muchos sistemas, las bicapas se desestabilizan a partir de un cierto contenido de tensioactivo en la membrana y luego se desintegran, formando micelas mixtas, o una fase hexagonal, u otras estructuras intermedias. En algunos casos las membranas perforadas pasan a micelas filiformes y a otros intermediarios, en forma de discos, micelas o fragmentos de bicapa, particularmente en sistemas que contienen una gran fracción de colesterol en la bicapa. Sin embargo, las micelas en forma de disco no son las estructuras principales, más bien existen como elementos transitorios en la transformación de micelas mixtas a vesículas [44].
La información disponible sobre el orden temporal de estas observaciones y sobre la dependencia de dicho orden temporal de las propiedades fisicoquímicas y de las concentraciones de lípidos y detergentes es bastante limitada. Sin embargo, se sabe que la solubilización está precedida por la liberación de solutos encapsulados, como lo indican las investigaciones de permeabilidad a concentraciones sub-solubilizantes de detergente [93, 94]. Cuando la solubilización es precedida por una fase de latencia, la fuga es lenta, lo que sugiere que el equilibrio del detergente entre las dos monocapas es un requisito previo para la formación de poros y la solubilización y, por lo tanto, parece que la solubilización ocurre solo después de que se perfora la bicapa [56]. No se sabe mucho sobre cómo depende del tiempo de solubilización de la velocidad de flip-flop del detergente, pero es probable que la diferencia de concentraciones del detergente entre las dos monocapas se desvanezca cuando la membrana se vuelva permeable al detergente. En condiciones Resat, las mezclas de detergente y lípidos generalmente contienen vesículas grandes, incluso si las vesículas originales eran pequeñas (debido al crecimiento del tamaño inducido por el detergente), y la membrana está perforada, con agujeros cubiertos por paredes curvas ricas en detergente como se describe en la figura 8.
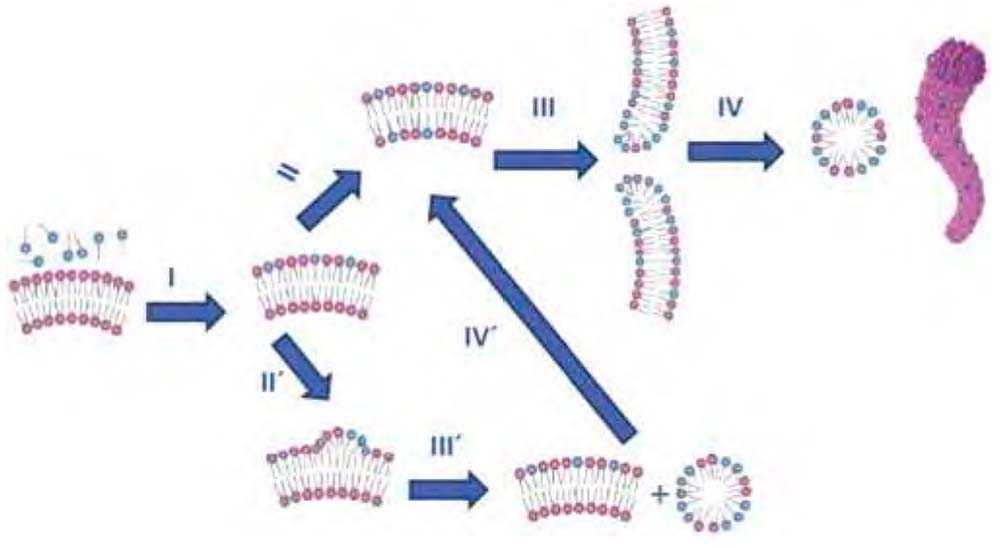
Figura 8. Mecanismos propuestos de micelización de la bicapa en una vesícula: (I) Los monómeros de detergente se insertan en la monocapa exterior de la vesícula. (II) El detergente se equilibra entre la monocapa interior y exterior mediante un rápido flip-flop. (III) Se forman poros en la bicapa. (IV) Se forman micelas mixtas lípido-detergente. Se muestran tanto una sección transversal como una vista general de una micela alargada. Cuando no es posible un flip-flop rápido, se produce una vía alternativa: (II ‘) La inserción de múltiples moléculas de detergente curvofílico provoca un gran aumento en la curvatura de la bicapa exterior. (III ‘) Las micelas mixtas lípido-detergente se desprenden de la bicapa, y este proceso conduce a movimientos trans– bicapa de detergente (IV’). El sistema puede entonces continuar siguiendo los procesos III y IV.
Las estructuras resultantes del proceso III en la Fig. 8 probablemente reflejan el equilibrio después de una inserción relativamente rápida, impulsada por la entropía, del detergente curvofílico en las bicapas, a través de un crecimiento de tamaño posterior (si las vesículas originales eran pequeñas), y de la formación de poros para acomodar las moléculas de detergente curvofílicas que residen a lo largo de las paredes curvas ricas en detergente de las perforaciones.
2.9.c. Micelización de liposomas sobresaturados
La transformación de liposomas saturados en detergente, con una composición dada por Resat, en micelas mixtas de composición Resol, requiere que, dentro del rango entre Resat y Resol, el detergente agregado se distribuya de manera desigual. Específicamente, si en Resat cada liposoma está formado por L moléculas de PC y L • Resat moléculas de detergente, la adición de detergente a concentración suficiente para la solubilización parcial produce una mezcla de liposomas cuya composición permanece inalterada. Sin embargo, otros liposomas absorben suficiente detergente para descomponerse en micelas mixtas, que contienen L • Resol moléculas de detergente, donde Resol es mucho mayor que Resat. Nuestra interpretación de esta distribución desigual es que la unión del detergente a las bicapas es cooperativa, tal vez porque inicialmente se acumula en defectos de la malla, y/o quizás las moléculas de detergente se mezclan mejor con los microdominios de lípido-detergente que con lípidos puros [48].
En algunos casos, las vesículas saturadas de detergente existentes en Resat surgen del movimiento rápido a través de la bicapa (flip-flop) de moléculas de detergente desde la monocapa lipídica externa a la interna. Este sería el caso en particular con detergentes (denotados como Grupo A en la Tabla 1), cuya cabeza polar es relativamente pequeña, de modo que el movimiento transbicapa es rápido. En este caso, la solubilización consistiría en la disociación de un liposoma sobresaturado completo en una o más micelas filiformes. En conclusión, las bicapas se someten a solubilización completa con detergente cuando toda la bicapa (incluida la monocapa interna) está saturada de detergente, y la bicapa está perforada con niveles sobresaturados de detergente. Consideramos que los datos disponibles son consistentes con este mecanismo. Esto incluye los experimentos que fueron considerados como pruebas para el mecanismo ‘basado en la formación directa de micelas mixtas’ [95] y el mecanismo ‘basado en la destrucción de vesículas a través de partículas pequeñas que contienen grandes cantidades de detergentes’ [96].
2.9.d. Dependencia de la velocidad de solubilización de las propiedades físico- químicas del detergente y la membrana
La incorporación de detergente a las membranas depende tanto de la naturaleza química del detergente como de la composición de la membrana. En ciertas condiciones puede estar prácticamente restringida a la monocapa externa, cuando el flip-flop de las moléculas de detergente hacia la monocapa interior es lento [51, 74]. Eventualmente, la perforación de la bicapa abolirá el gradiente de concentración de detergente entre las dos monocapas, pero esto ocurre simultáneamente con la Etapa 2.
Los datos en la Tabla 1 pueden interpretarse en términos de la hipótesis de que la solubilización, cuando va precedida por un periodo de latencia, ocurre solo después de que el gradiente de detergente es abolido. En particular, los detergentes que pertenecen a lo que hemos denominado Grupo B, probablemente penetran solo en la monocapa externa porque sus grupos hidrófilos son grandes, de modo que pueden acercarse a la monocapa interna solo después de que la membrana se perfore. Esto también es coherente con el hallazgo de que incluso los detergentes de este grupo pueden solubilizar fácilmente las bicapas, siempre y cuando estén empaquetadas con menor presión lateral (por ejemplo, a temperaturas más altas) [51, 97].
Por lo tanto, el mecanismo responsable del inicio lento de la solubilización por los detergentes del Grupo B se debe al gradiente de concentración de detergente entre las dos monocapas y al consiguiente desequilibrio de masa que provoca el desprendimiento (escape) de las micelas mixtas lípido-detergente a partir de las monocapas externas. La interacción entre las bicapas y las micelas de detergente puro es quizás menos probable que la penetración de monómeros de detergente en la monocapa exterior. Mientras el detergente no tenga acceso a la monocapa interna, se pueden formar algunas micelas mixtas individuales (presumiblemente esféricas); pero cuando la monocapa interna está accesible al detergente, debido al aumento de la permeabilidad de la membrana, el mecanismo se vuelve similar al seguido por detergentes del grupo A, y se produce una extensa solubilización.
Se ha propuesto [42, 43] que cada miembro de los dos grupos de detergentes, los solubilizadores rápidos y lentos (respectivamente, los Grupos A y B en la Tabla 1), seguirían un mecanismo de solubilización diferente. El Grupo A actuaría según un mecanismo transbicapa, como consecuencia de un flip-flop rápido, causando la desintegración de las vesículas, mientras que las micelas de detergentes del Grupo B extraerían gradualmente fosfolípidos de monocapa exterior de la membrana. Sin embargo, los datos disponibles [56, 86, 98-100] muestran, para diferentes detergentes del Grupo B, distintas composiciones de lípidos y concentraciones de vesículas, que esos detergentes (p. ej. colato, o dodecil sulfato de sodio) causan la completa o casi completa solubilización de la bicapa a concentraciones muy por debajo de su cmc, por lo que no es probable la extracción de fosfolípidos de las monocapas por micelas. La diferencia entre los dos grupos de detergentes es muy clara a partir de las observaciones de microscopía óptica de la solubilización de las bicapas lipídicas de vesículas unilamelares gigantes por dos detergentes representativos, Triton X-100 (Grupo A) y SDS (Grupo B) [101] . En presencia de Triton X-100, las GUV inicialmente mostraron un aumento en su área superficial, debido a la inserción de moléculas de detergente con un rápido equilibrio entre las dos monocapas. Luego, por encima de un determinado umbral de solubilidad, se abrieron agujeros, dando a la bicapa una apariencia de tela de encaje, y la bicapa desapareció gradualmente. Por otro lado, el SDS causó solo un aumento en la curvatura espontánea de la membrana, que se puede atribuir a la incorporación de SDS en la monocapa externa. El estrés resultante en la membrana podría causar la apertura de macroporos transitorios con una disminución sustancial del tamaño de la vesícula o el estallido completo de las vesículas. Para probar debidamente esta hipótesis se requeriría una investigación detallada del orden temporal de los eventos: cambio de las velocidades de flip-flop del detergente, fuga de solutos encapsulados a través de la bicapa, y solubilización. Hasta el momento, dicha información experimental no está disponible.
En conclusión, la Etapa 2 de la solubilización de las bicapas lipídicas por detergente, a saber, la transición de bicapas a micelas, puede entenderse en términos de un modelo basado en la estructura de las bicapas saturadas con detergente. La formación de tales bicapas está impulsada por la entropía, pero para compensar la introducción de una molécula de detergente curvofílica en una bicapa plana, la bicapa se convierte en una estructura perforada y eventualmente se miceliza. Esta secuencia de eventos solo puede ocurrir si la concentración de detergente en las dos monocapas es igual. Los detergentes con grandes grupos de cabeza hidrófilos no pueden voltearse a la monocapa interna. En cambio, forman micelas mixtas de lípido-detergente y, a través del escape de estos agregados, hacen que la bicapa sea permeable a las moléculas de detergente, lo que de hecho permite el equilibrio del detergente y, posteriormente, la solubilización de todo el liposoma.
2.9.e. Dependencia de la temperatura de la solubilización de las bicapas líquido- cristalinas
Tanto Resat como Resol dependen de la longitud y la insaturación de las cadenas hidrofóbicas, así como de la transición de fase y la temperatura [26]. Se dispone de abundantes datos sobre el efecto de la temperatura en la solubilización de bicapas gel y fluidas o líquido-cristalinas. Los resultados de estos estudios [41, 48, 102] son clave para comprender los efectos de otros factores. Por ejemplo, la concentración de detergente requerida para solubilizar las bicapas líquido-cristalinas aumenta al calentar el sistema. En comparación con las diferencias entre las bicapas de gel y las de cristal líquido, el cambio debido al calentamiento de los liposomas en fase cristal líquido es pequeño pero reproducible. Nuestra interpretación de estos resultados se basa en el supuesto de que la concentración de detergente requerida para la solubilización aumenta con la diferencia de curvatura entre los dos anfífilos. Por lo tanto, en la expansión inducida por calentamiento de las cadenas hidrocarbonadas del fosfolípido en relación con el grupo polar de cabeza, la curvatura espontánea del fosfolípido se vuelve más negativa, de modo que se necesita más detergente para solubilizar las bicapas a temperaturas más altas. Además, el área de la sección transversal del resto de detergente hidrófobo aumenta y, por lo tanto, el detergente se vuelve menos cónico, lo que significa que se necesita más cantidad para la solubilización [41, 69, 102]. Muchos experimentos confirman este enfoque, mostrando que la mayor contribución al cambio tanto en Resat como en Resol de las bicapas de cristal líquido es el cambio en la curvatura espontánea. En otras palabras, la flexión de una monocapa casi plana formada por fosfolípidos se vuelve más difícil (y por lo tanto requiere más energía) con el aumento de la temperatura. Otras fuerzas parecen jugar solo roles menores.
Figura. 9. Solubilización de membranas seguida por RMN. (a-c) Espectros de 31P-RMN de mezclas equimolares de fosfatidilcolina (PC)/esfingomielina (SM) en presencia de distintas concentraciones de Triton X-100. La relación molar efectiva detergente/lípido es de (a) 0, (b) 0,5 y (c) 1,3. La solubilización se detecta por la aparición de señales isotrópicas (desplazamiento químico 0 ppm) estrechas al añadir el detergente [31]. (d) Espectros de 31P-RMN de mezclas de PC/SM/colesterol en presencia de Triton X-100 a Re = 1,0. Obsérvese que la solubilización parcial en presencia de colesterol implica la solubilización preferente de PC sobre SM [26].
A partir de los datos disponibles, muchos de ellos resumidos en [26], podemos generalizar que la concentración de detergente requerida para la solubilización de las bicapas en fase líquido-cristalina es: (i) una función creciente del desorden molecular lipídico; (ii) una función creciente de la insaturación; (iii) una función ligeramente decreciente de la longitud de la cadena; y (iv) menor para la esfingomielina (SM) (0.5 Triton:SM) que para PC (2 Triton:PC) [63]. Además, a una concentración de detergente suficiente para la solubilización parcial de las bicapas mixtas PC-SM, las micelas mixtas ricas en SM aparecen antes de las micelas mixtas ricas en PC (Fig. 9a-c). Curiosamente, la concentración requerida para la solubilización de las bicapas que contienen colesterol es una función creciente de la concentración de colesterol [50] y se requieren concentraciones de detergente mucho más altas para SM que para PC en la solubilización de las bicapas SM – PC – colesterol [69, 102, 103] Esto significa que el colesterol estabiliza SM frente a la solubilización (Fig. 9d), probablemente debido a la formación de un complejo SM-colesterol de gran curvatura negativa. Esta podría ser la base del efecto DRM (ver sección 3).
2.9.f. Solubilización de bicapas en estado gel
Hay muchos menos datos disponibles sobre la solubilización de las bicapas en fase gel. Además, varias investigaciones publicadas contienen resultados cuestionables porque algunos experimentos utilizaron mezclas que no estaban en equilibrio. Por otra parte, los métodos utilizados a veces eran inapropiados para las preguntas formuladas. La razón principal de nuestras dudas es que la solubilización de las bicapas en fase gel es muy lenta (mucho más lenta que la solubilización de las bicapas líquido-cristalinas), lo que implica que las mezclas estudiadas podrían no estar en equilibrio y, por lo tanto, haber dado lugar a artefactos. A pesar de las limitaciones de los datos disponibles, se pueden hacer dos generalizaciones [41, 102-104]: (i) en comparación con las bicapas líquido-cristalinas, se requiere menos detergente para el inicio y la finalización de la solubilización de las bicapas en fase de gel; y (ii) dentro del rango de temperaturas de la fase de gel, la concentración de detergente requerida para la solubilización disminuye al aumentar la temperatura.
Figura. 10. Las dos fuerzas que compiten en la solubilización de bicapas por detergentes. (a) Dependencia de la temperatura (T) de las dos contribuciones a Resat: (i) contribución de la flexión, (ii) contribución intersticial, (iii) suma de ambas contribuciones. (b) Se muestran la fosfatidilcolina (PtdCho), esfingomielina (CerPCho) y Triton X-100 sobre un eje de curvatura espontánea. Cuanto más negativa es la curvatura espontánea del lípido, más detergente se requiere para su solubilización. (c) Deformaciones hipotéticas de la monocapa que acompañan la transición bicapa – micela: (i) estado inicial plano, (ii) estado intermedio resultante de la flexión de la monocapa y formación de un vacío, y (iii) estado final resultado del colapso del vacío y formación de un interior hidrofóbico [26].
Sugerimos que la concentración de detergente necesaria para solubilizar las bicapas en fase gel es menor que la necesaria para solubilizar las bicapas en fase cristal líquido porque la curvatura espontánea del fosfolípido es menos negativa en las bicapas en fase gel, más compacta. Además de la flexión de las monocapas de fosfolípidos, el otro contribuyente a la energía de solubilización es la energía asociada con el llenado del vacío en el centro de las micelas mixtas recién formadas (Fig. 10a) [41]. El proceso que conduce a las micelas sin vacío (Fig. 10c) se llama energía intersticial o void energy. Esta descripción no significa que alguna vez haya una micela con un vacío en el centro en equilibrio; más bien, hay energía asociada con el llenado necesario de una micela hueca (teórica y extremadamente inestable) que conduce a una estructura que no es hueca. Proponemos que (i) el efecto de la energía intersticial en la dependencia de la temperatura de la solubilización se opone al de la energía de flexión, (ii) los efectos de la temperatura en Resat y Resol reflejan un equilibrio entre la energía de flexión y la energía intersticial, y (iii) la contribución de la energía intersticial es más importante en el estado del gel que en las micelas mixtas más flexibles presentes por encima de la temperatura de transición térmica. El valor más bajo de Resat para la solubilización de las bicapas en fase gel significa que el coeficiente de partición del detergente entre las bicapas en fase gel y el medio acuoso es mayor que el observado para las bicapas de cristal líquido, o que las bicapas en fase de gel pueden acomodar menos detergente antes de que la energía asociada con las micelas mixtas que contienen lípidos sea igual a la de las bicapas que contienen detergente. La primera posibilidad puede descartarse sobre la base de que el coeficiente de reparto del Triton X-100 entre los lípidos en fase gel y el agua es igual al obtenido para las bicapas en fase cristal líquido [52]. Además, algunos datos brindan un fuerte respaldo a la posibilidad alternativa, mostrando que los lípidos en fase gel se saturan con detergente a concentraciones de detergente más bajas que las de la fase fluida [48]. La razón por la cual las fases gel y fluida acomodan diferentes cantidades máximas de detergente no está clara en la actualidad. Una posibilidad es que, en el estado fluido, el empaquetamiento de las moléculas de lípidos sea lo suficientemente flexible como para compensar la diferente curvatura espontánea del detergente; por lo tanto, la bicapa acomodaría más detergente antes de fragmentarse en micelas mixtas.
2.9.g. Solubilización diferencial
Poco se sabe sobre la solubilización de las bicapas formadas por más de un fosfolípido. De gran interés es la solubilización de fosfatidilcolina (PC) y esfingomielina (SM) en bicapas de PC-SM-colesterol, porque las bicapas en fase líquida-ordenada que contienen SM y colesterol son resistentes a los detergentes. Se cree que algunas membranas resistentes a los detergentes (DRMs) existen como rafts o balsas de membrana [23, 50, 105] (ver sección 3). El interés del colesterol en el contexto de esta discusión es que rigidifica el empaquetamiento de fosfolípidos en bicapas líquido-cristalinas pero fluidifica el empaquetamiento de las bicapas en fase gel. Cuando se añade a un lípido en fase gel, el colesterol transforma la fase gel de las bicapas en una nueva fase llamada “líquida (o fluida) ordenada”. El cambio en el empaquetamiento de lípidos cambia la curvatura espontánea del conjunto de lípidos a un valor menos negativo, reduciendo así la concentración de detergente necesario para la solubilización.
Una investigación con 31P-NMR reveló que, en ausencia de colesterol, cuando se añadió Triton X-100 a las bicapas de PC-SM a una concentración suficiente para que se pudiera realizar una solubilización parcial (pero no completa), la fracción solubilizada por el detergente estaba enriquecida en SM [50], como se esperaba de la menor curvatura negativa de la SM en relación con la PC (Fig. 9b y 10b). El colesterol invierte esta susceptibilidad relativa. Las bicapas que contienen colesterol están más ordenadas que las líquido-cristalinas, pero menos ordenadas que las de fase gel. En presencia de colesterol en bicapas PC-SM, la fracción solubilizada de las mezclas PC-SM-colesterol es pobre en SM (compárese el espectro de la figura 9b con el de la 9d). Estas observaciones sugieren que las mezclas de SM-colesterol tienen una curvatura espontánea negativa muy grande, que hace que sean resistentes a la solubilización por detergentes, como se muestra esquemáticamente en la figura 10b. También se ha propuesto que la razón por la que ciertas fracciones de membrana resisten a los detergentes es la mayor afinidad del colesterol por la SM, en comparación con la PC [106, 107].
2.9.h. ¿Cuánto detergente se necesita para solubilizar bicapas de fosfolípidos?
Suponiendo que la curvatura espontánea de las micelas mixtas (SM) es un promedio ponderado de las curvaturas espontáneas (Fig. 5) de los dos anfífilos (lípido y detergente), SM se puede calcular como:
Sm = Nl Sl = Nd Sd
donde Nl y Nd son las fracciones molares del lípido y detergente, respectivamente (Nl + Nd = 1,0), Sl es la curvatura espontánea del lípido, y Sd es la curvatura espontánea del detergente.
La curvatura espontánea de un anfífilo formador de micelas es positiva e igual al recíproco del tamaño de las micelas que se forman en soluciones acuosas [108, 109], mientras que la curvatura espontánea de la PC es ligeramente negativa [39]. Por lo tanto, el fosfolípido se autoensambla en bicapas y siempre que la fracción molar del detergente sea mucho menor que la del fosfolípido, la curvatura espontánea efectiva permanece cercana a la del lípido, y la mezcla lípido-detergente sigue siendo lamelar. La solubilización comienza a una fracción molar crítica en la que la bicapa no puede acomodar más detergente. En este punto, la bicapa acumula suficiente detergente para que la curvatura espontánea de los conjuntos mixtos alcance un valor suficientemente positivo como para adoptar una estructura micelar [35, 41].
Estudios anteriores han demostrado que la concentración saturante de detergente, expresada en términos de fracción molar de detergente necesario para superar la energía de flexión (Ndsat), es aproximadamente igual a la relación entre la curvatura espontánea del lípido y la del detergente. En términos de Re,
Resat /(1- Resat ) = Sl /Sd
y por lo tanto,
Resat = Sl /Sd + Sl
Si se conocen los radios de curvatura de un par detergente-lípido dado, esta última aproximación se puede utilizar para predecir cuánto detergente se necesita para solubilizar el lípido dado. En ausencia de estimaciones razonables de la curvatura curvatura, todavía podemos utilizar el razonamiento discutido anteriormente para explicar observaciones experimentales como la susceptibilidad de los liposomas de SM en comparación con los liposomas de PC. Específicamente, la solubilización de SM requiere una cuarta parte de la concentración de Triton X-100 porque su curvatura espontánea es menos negativa que la del PC.
3. MEMBRANAS RESISTENTES A DETERGENTES (DRM) Y RAFTS
La hipótesis de los rafts o balsas lipídicas fue propuesta por Simons y colaboradores en 1997 [110-112] para explicar ciertos aspectos del tráfico intracelular de esfingolípidos. Según esta hipótesis, las balsas serían regiones pequeñas y efímeras de la membrana plasmática celular, con una composición peculiar de lípidos (ricas en esfingolípidos, colesterol) y proteínas específicas. Los roles propuestos para los rafts crecieron a lo largo de los años hasta incluir muchos aspectos del tráfico de membranas intracelulares, la señalización celular, entrada de toxinas y virus, y apoptosis. Desgraciadamente, poco después de ser propuesta, la hipótesis, muy bien aceptada en su momento, se vio mezclada, en contra de toda lógica, con los componentes de membranas que resisten a la acción solubilizante de los detergentes, «membranas resistentes a los detergentes» (DRM) [113]. Esto ha dado origen a un sinnúmero de artefactos y datos experimentales erróneos. Esta sección está dedicada a aclarar esta confusión, y está basada en nuestra publicación de 2005 [23].
Fig. 11. Las membranas resistentes a los detergentes no se corresponden necesariamente con los rafts. (a) Esquema de la suspensión resultante de tratar una membrana celular con detergente. Las cabezas polares de las moléculas de detergente se representan como círculos vacíos. La suspensión contiene micelas mixtas lípido-proteína-detergente [las tres estructuras globulares en la zona media de la figura], y un residuo no solubilizado, DRM. (b) La membrana original. En este caso la DRM [la misma dibujada en (a)] correspondería a una estructura preexistente en la membrana nativa, pero éste no es, ni mucho menos, un caso general [23].
De manera en nada relacionada con los rafts, Ipsen y col. [114], con impecable razonamiento físico-químico, explicaron la existencia de dos tipos distintos de fases líquidas: una líquida ordenada (lo) y una líquida desordenada (ld). La fase líquido- ordenada estaría enriquecida en colesterol. Pero pronto los promotores de los rafts, atendiendo a su supuesta alta concentración de esteroles, decidieron que las balsas se considerían en la fase lo [115]. Sin embargo la evidencia experimental disponible habla en contra de la identificación de DRM con dominios de fase lo y con rafts. En particular, algunos protocolos experimentales podrían conducir a la formación de artefactos de estructuras DRM que no están presentes en las membranas nativas antes del tratamiento con detergente.
3.1.Resistencia a los detergentes y balsas de membrana
Una observación importante que atrajo poca atención en su momento es que, en ciertas condiciones, algunos componentes de membrana no se solubilizan incluso a altas concentraciones de determinados detergentes [116]. En particular, se sabe desde hace mucho tiempo que hay proteínas de membrana que están ancladas a la bicapa lipídica por glicosilfosfatidilinositol (GPI), y que son resistentes a la solubilización por detergentes como el Triton X-100 [117]. Brown y Rose [118] introdujeron la idea de microdominios de la bicapa lipídica que serían insolubles, y en los cuales se anclarían las moléculas de GPI insertado. Siguiendo una línea de pensamiento independiente, Simons y colaboradores [110-112] propusieron la existencia de las llamadas «balsas», microdominios enriquecidos en esfingolípidos y colesterol que están involucrados en numerosas funciones celulares, desde el tráfico de membranas y la morfogénesis celular hasta la señalización celular. Balsas y «membranas resistentes a los detergentes» (DRM) se propusieron en una etapa bastante temprana en estos estudios y se intentaron relacionar física y conceptualmente [113], lo que implicaría que proteínas de membrana resistentes a altas concentraciones de Triton X-100 estarían ubicadas en balsas. Los términos «balsas» y «DRM» se han utilizado a menudo como sinónimos, a pesar de sus diferentes orígenes y significados conceptuales. Por ejemplo, cuando se obtiene una fracción resistente al detergente a 4 ºC a partir de una membrana (que se solubiliza completamente con exceso de Triton X-100 a 37 ºC), esto se interpreta en términos de la hipótesis de que los DRM recuperados a 4 °C están a 37 ºC en forma de «balsas» que existirían en las membranas en ausencia de detergente (Fig. 11). Como se discutirá más adelante, esta hipótesis no es apoyada por la evidencia experimental.
Otro hallazgo fue que los DRM son ricos en esfingomielina (SM) y colesterol [119]. Esta observación fue importante porque se sabe que, en membranas modelo compuestas por SM, colesterol y fosfatidilcolina insaturada (PC), se produce una separación lateral de fase entre dominios de fase líquido-ordenada lo ricos en colesterol y SM, y dominios de fase ld ricos en PC [120]. Estos tres lípidos son abundantes en las membranas plasmáticas; por lo tanto, las fracciones resistentes a Triton X-100 (a 4 °C) ricas en colesterol y SM se identificaron con dominios de fase lo y balsas de membrana.
3.2. ¿Qué sistemas lipídicos son resistentes a los detergentes?
La resistencia al detergente implica que una fracción de la membrana permanece en fragmentos de bicapa muy grandes y no es transformada en pequeñas micelas incluso con altas concentraciones de detergente. Esto significa que la solubilización muchas veces se inicia, pero no se completa. Las razones de la solubilización incompleta pueden ser de naturaleza termodinámica o cinética.
Se ha propuesto que los DRM son dominios de baja fluidez porque contienen fosfolípidos que se encuentran en fase gel (baja fluidez) a la temperatura experimental y / o dominios ricos en colesterol (se sabe que el colesterol disminuye la fluidez de bicapas que de otro modo serían muy fluidas). Varias líneas de evidencia descartan tanto la posibilidad de que bicapas en fase gel o bicapas ricas en colesterol sean necesariamente resistentes a los detergentes [63, 102, 103]. Otra posibilidad que se ha sugerido como base para la resistencia a los detergentes pero se puede descartar es que las «bicapas resistentes» son aquellas formadas por esfingomielina u otros esfingolípidos. De hecho, la solubilización de bicapas de SM de huevo requieren menos Triton que la solubilización de bicapas de PC de huevo [47, 103, 121]. Además, otros esfingolípidos que se supone que existen en balsas, como los gangliósidos, en realidad facilitan la solubilización de bicapas por Triton X-100 [63].
También se ha sugerido que la resistencia a la solubilización se debe al hecho de que las balsas están en la fase lo. Se sabe que mezclas de esfingomielina y colesterol, dos lípidos presumiblemente comunes en balsas, dan lugar a fases lo [122]. La fase lo se caracteriza por permitir la difusión traslacional y al mismo tiempo mantener un alto grado de orden molecular en las cadenas de hidrocarburos. Se ha demostrado que al menos algunas fases lo son de hecho resistentes a los detergentes. Sin embargo, por razones de precisión conceptual, las fracciones de membrana deben denominarse micro- o nanodominios en la célula nativa y DRM sólo después de que el detergente se haya utilizado eficazmente (ver 3.6).
Una posibilidad que debe investigarse más a fondo es que la resistencia a los detergentes sea un resultado de interacciones SM-colesterol. Esta idea está respaldada por el hallazgo de DRM ricos en colesterol y SM en mezclas de Triton X-100 con vesículas de PC, SM y colesterol [63]. SM interactúa con el colesterol en las bicapas, quizás a través del puente de hidrógeno entre el 3β-OH del colesterol y el grupo carbonilo de SM [103, 122]. La condensación de las monocapas de SM en presencia de colesterol también se ha tomado como prueba que respalda una interacción específica entre estos dos lípidos, pero esta interpretación ha sido debatida. Cualquiera sea la razón, está claro que el SM y el colesterol podrían co-segregarse del fosfolípido en forma de bicapas fluidas-ordenadas, y que la presencia de ambos lípidos puede hacer las bicapas resistentes a la solubilización por Triton X-100 en una amplia gama de temperaturas.
En los experimentos de solubilización descritos en la literatura, no siempre está claro si los resultados representan estados de equilibrio de agregación. Dada la posibilidad de que la velocidad de solubilización sea lenta a bajas temperaturas y considerando que, en la mayoría de estudios previos, los estados de agregación han sido investigados sólo un corto tiempo después de mezclar la solución de detergente con las bicapas, es muy posible que sean los factores cinéticos en lugar de los termodinámicos los responsables de las observaciones. De hecho, muchos experimentos recientes [41, 63, 102, 103] indican que la resistencia de ciertas membranas a detergentes no se debe a su alta rigidez ni a la presencia de colesterol o esfingolípidos per se. Más específicamente, el efecto del colesterol y los esfingolípidos depende claramente (de manera compleja) tanto de la temperatura como de la composición de las bicapas.
3.3. Rafts y el efecto de la temperatura sobre la solubilización de la membrana
Los estudios que tratan las balsas y los DRM como sinónimos asumen, al menos implícitamente, (i) que existen los mismos dominios de fase lo en una membrana a 4 ºC y a 37 ºC, y (ii) que estos dominios lo son resistentes al detergente a 4 ºC pero pueden ser solubilizados a 37ºC. Ninguna de estas suposiciones está claramente apoyada por la evidencia experimental. De hecho, parece haber consenso entre los estudios sobre mezclas “raft-like” que imitan los lípidos de las balsas (sin detergente) [123, 124] en las que las mezclas muestran una transición gradual con el aumento de temperatura, de una fase líquida-ordenada a otra líquida-desordenada. Esto es inconsistente con la identificación de balsas con DRM y proporciona una explicación del hallazgo de que se pueden obtener DRM a 4 ºC pero no a 37 ºC.
La dependencia de la temperatura de la solubilización por detergente es compleja. En términos generales, la solubilización de bicapas en fase cristal-líquido requiere más detergente con mayor temperatura (es decir, Resol aumenta con la temperatura). Esta tendencia se ha observado para las vesículas de DPPC [41] y de 1-palmitoil-2- oleoilfosfatidilcolina (POPC) [125], y puede explicarse por el hecho de que aumentar la temperatura hace que la curvatura espontánea de la moléculas se haga más negativa (o menos positiva) al desordenar las colas hidrofóbicas y, posiblemente, también al deshidratar los grupos de cabeza. Esta curvatura espontánea más negativa contrarresta la transición a micelas mixtas curvadas positivamente.
El efecto de la temperatura sobre la solubilización de bicapas en la fase gel es resultado de una compensación de factores opuestos [41]: por un lado, se requiere más detergente para la solubilización a una temperatura más alta debido al efecto de la temperatura sobre la curvatura espontánea de los lípidos (y detergente); por otro lado, la solubilización requiere la “reabsorción” del vacío formado al curvar la monocapa lipídica [68], y este proceso (que consume energía) se promueve aumentando la temperatura.
Experimentalmente, la concentración de Triton X-100 requerida para solubilizar DPPC en fase gel es una función decreciente de la temperatura [41, 102]. La observación de que la cantidad de detergente necesaria para la solubilización de SM disminuye al aumentar la temperatura a bajas temperaturas, pero aumenta con el aumento de temperatura a altas temperaturas [70, 116] también puede ser interpretado en términos de la compensación descrita. En una mezcla de POPC-SM-colesterol, que se supone que forma fases coexistentes lo y ld, la solubilización de ld requiere, en términos generales, más detergente a alta temperatura [63].
Finalmente, cabe destacar que la concentración total de detergente que se requiere para la solubilización también depende de la CMC del detergente y su partición micela–agua. Ambos factores son comúnmente funciones de la temperatura en forma de campana, con la CMC en un mínimo y el coeficiente de partición membrana-agua a un máximo a unos 40 ºC, cuando el efecto hidrofóbico es más fuerte [125]. Con una concentración baja de lípidos y detergente, una cantidad sustancial de detergente (por debajo de la CMC) puede estar en agua e inactivo para la solubilización. Sin embargo, los monómeros no tienen ningún papel cuando se trata de completar la solubilización a concentraciones totales de detergente muy por encima de la CMC.
3.4. Cambios inducidos por el Triton X-100 en la estructura de los dominios
Algunos autores han propuesto que un detergente como el Triton X-100 dejaría intactos los dominios ricos en SM en la membrana porque no podría penetrar en ellos. Sin embargo, esta idea entra en conflicto con la suposición de que los dominios ordenados y desordenados en las membranas están en equilibrio; cambiar las propiedades de la fase rica en PC perturbará el equilibrio, y el reequilibrio necesariamente alterará también la fase rica en SM.
Los cambios inducidos por detergentes en los dominios ordenados comienzan a concentraciones de detergente por debajo de las requeridas para formación de micelas. Suponiendo una mezcla ideal dentro de o entre los dominios, la preferencia del detergente por la fase más fluida debería inducir una tendencia a convertir los dominios ordenados en dominios desordenados. Sin embargo, la mezcla de detergente con los componentes de la membrana no es ideal y provoca una aun mayor fluidización de los dominios fluidos ricos en detergente [126]. El efecto desfavorable del detergente sobre los lípidos, en particular sobre la SM, que prefiere las fases ordenadas, cambia la partición de los lípidos a favor de los dominios ordenados (de los cuales el Triton X-100 parece ser repelido). Por lo tanto, el número y / o el tamaño de los dominios ordenados se puede aumentar mediante la adición del (paradójicamente) fluidificante Triton X-100; de hecho, el Triton puede incluso estimular la aparición de dominios ordenados en una mezcla homogénea. Este efecto ha sido detectado por una variedad de métodos microcalorimétricos independientes [105] y se ha explicado cuantitativamente sobre la base de entalpías y entropías de interacciones Triton-SM no ideales [127]. La aplicación de Triton X-100 a membranas homogéneas de PC de huevo, SM y colesterol (proporción molar 7: 1: 1) produce DRM compuestas por PC: SM: colesterol 1: 1: 1 (mol:mol:mol), generalmente considerada una composición típica de rafts [63].
Además de afectar a los fenómenos termodinámicos, el Triton X-100 influye en los aspectos mecanicistas y / o cinéticos de los dominios de membrana. Podría, por ejemplo, conducir a la coalescencia de dominios ordenados. Giocondi y col. [128] han sugerido, a partir de la obtención de imágenes in situ de membranas celulares tratadas con Triton X-100 por microscopía de fuerza atómica, que los microdominios de membrana pueden organizarse en membranas resistentes a detergentes más grandes durante el tratamiento con Triton. Varias otras observaciones también indican que los detergentes provocan grandes cambios en la arquitectura de la bicapa (a saber, lisis de membrana y reensamblaje) a concentraciones sub-solubilizantes [45, 80]. En esta zona de «sub- solubilización», una fracción del lípido de la bicapa de hecho se solubiliza y los lípidos restantes forman grandes estructuras que pueden sedimentarse fácilmente [63].
Otro punto importante es que, mientras que la composición en lípidos difiere mucho entre una y otra monocapa de las membranas celulares, las peculiaridades de las composiciones lipídicas locales (que gobiernan la posible formación de los dominios) se pierden al solubilizar la célula. Este efecto podría agotar la disponibilidad de lípidos formadores de balsas (desintegrando así las balsas) o juntar lípidos que no interactúan in vivo (creando así dominios artificiales).
3.5. Utilizando diferentes detergentes se obtienen diferentes DRM
Las DRM más comúnmente estudiadas son las obtenidas de disoluciones de Triton X-100. Sin embargo, se pueden utilizar otros detergentes, que son menos fluidificantes. Tales detergentes tendrían un efecto más débil en la fase rica en PC y también serían capaces de insertarse, hasta cierto punto, en dominios ricos en SM. Como consecuencia, las diferencias estructurales entre dominios se reducirían (en lugar de aumentar, como con el Triton). El resultado sería la partición de más PC en los dominios ricos en SM y viceversa, y eventualmente la desaparición de dominios a favor de una membrana homogéneamente mezclada. Los posibles efectos de la promoción o reducción de balsas inducida por detergente han sido comentados por London y Brown [129], pero son ignorados por muchos investigadores. Estudios sistemáticos cuidadosos han revelado una gran variedad en la composición de lípidos y proteínas en las DRM obtenidas de una membrana dada utilizando diferentes detergentes [130]. Estos datos pueden considerarse pruebas de que los DRM difieren sustancialmente de los rafts. La interpretación alternativa – que las membranas nativas contienen diferentes tipos de balsas que son específicamente aisladas por detergentes específicos – no es consistente con la suposición básica de que las balsas se forman por una separación de dos fases líquidas en la bicapa lipídica. La idea de «balsas Lubrol» (es decir, balsas que estarían aisladas como “membranas resistentes al detergente Lubrol”) a diferencia de “balsas de Triton» y otros dominios in vivo en equilibrio supone implícitamente la coexistencia de membranas con más de dos fases líquidas, algo difícil de concebir y que carece de cualquier base experimental o teórica. Si hay, de hecho, diferentes tipos de balsas, éstas deben ser controladas por diferentes complejos de proteínas (que pueden adquirir ciertos lípidos en su entorno), pero no por la separación espontánea de fases de los lípidos. Incluso si éste fuera el caso, sería muy poco probable que diferentes complejos proteína-lípido pudieran aislarse selectivamente mediante diferentes detergentes. De hecho, existen pruebas sólidas de que no existen Balsas Lubrol y Balsas Triton, sino solo DRM Lubrol y DRM Triton. La identificación de estos DRM con dominios tipo raft preexistentes en la célula sería incorrecta.
3.6. Aplicaciones e interpretación de la extracción de DRM
Aunque muchas conclusiones de los estudios sobre DRM deben ser reconsideradas críticamente a la luz de nuestros actuales conocimientos, la aplicación de Triton X-100 y otros detergentes a 4 ºC a las células sigue siendo una herramienta interesante y útil en la investigación de membranas. La original y modesta intención de Yu y col. [116] para lograr una preselección de ciertas proteínas de membrana solubilizando las membranas con Triton X-100 frío claramente se ha cumplido. Además, ahora sabemos algo (ciertamente no todo) sobre los criterios de qué proteínas y lípidos se extraen preferentemente en las DRM. Al igual que muchas otras técnicas, desde los experimentos clásicos de reparto octanol-agua a las técnicas cromatográficas modernas, la extracción de DRM caracteriza las propiedades de una molécula en términos de su afinidad diferencial por varios ambientes (artificiales). Esto sin duda es interesante, pero el hallazgo de DRM no parece justificar la conclusión de que las balsas estén presentes en la membrana nativa, y encontrar una molécula en la fracción DRM no prueba su localización en balsas (ni viceversa) [131]. Las moléculas pueden tender a incluirse en DRM por una variedad de razones, por ejemplo: (i) es posible que prefieran un entorno de membrana más ordenado y compacto; (ii) podrían interactuar preferentemente con otros componentes de DRM como el colesterol o glicolípidos; o (iii) podrían favorecer una membrana de distinto espesor. Dar cuenta de los resultados obtenidos con diferentes detergentes podría ser mucho más complejo que simplemente recuperar un conjunto más o menos fijo de proteínas y lípidos [130]. Las proteínas de membrana que prefieren entornos ordenados, ricos en colesterol, podrían también inducir algún orden y enriquecimiento en colesterol dentro de su «vecindario». Estas proteínas vecinas pueden estabilizarse si las propiedades generales de la membrana se ajustan para hacerse más ordenadas y, por supuesto, es probable que muestren una mayor afinidad por dominios o entornos de membrana que sean más ordenados y ricos en colesterol. A su vez, la ubicación específica de una proteína en un entorno DRM podría conducir a una función proteica mejorada o modificada (ver [148] para el caso de los receptores de células inmunitarias).
En este sentido, la solubilización selectiva por detergentes, es decir, la técnica DRM, no se limita al problema de las balsas de lípidos, sino que tiene potencial para ser de valor general para la comprensión de las interacciones proteína-lípido. En contraste con nuestro conocimiento creciente de cada vez más proteínas de membrana, nuestro conocimiento de las funciones biológicas de los numerosos lípidos regulados de forma muy específica en las membranas celulares todavía es limitado. Después de muchos años en que esta falta de conocimiento fue malinterpretada como prueba de que la especificidad de los lípidos es irrelevante, la hipótesis de los rafts ha creado un enorme interés en los lípidos de membrana. Esto es una suerte, ya que se necesitarán muchos más modelos de complejos proteína-lípido para lograr una comprensión adecuada de las multiformes funciones de los lípidos de membrana. Las técnicas a base de detergentes pueden seguir teniendo un papel clave en tales estudios si los efectos de membrana de los detergentes se tienen en cuenta correctamente.
En resumen:
* Los DRM son solo el resultado de una solubilización incompleta de membranas por detergentes. Como tales, los DRM solo existen después del tratamiento con detergente. Los DRM no corresponden necesariamente a ninguna estructura de membrana que exista antes del tratamiento con detergentes. La resistencia a la solubilización por el detergente podría tener un origen termodinámico (por ejemplo, las geometrías relativas de ciertos componentes de la membrana y de ciertos detergentes no facilitan la formación de micelas mixtas) o cinético (por ejemplo, tratamientos con detergente demasiado cortos).
* Los dominios líquido-ordenados se forman en las membranas lipídicas como resultado de un enriquecimiento local en esteroles que dificulta la formación de confórmeros gauche (es decir, «acodamientos») en las cadenas acilo de los fosfolípidos, aumentando así el orden de la cadena sin alterar la traslación y difusión en el plano de los lípidos y proteínas asociadas. Se ha demostrado que los dominios líquido-ordenados son más resistentes a la solubilización por detergentes que los que se hallan en fase líquido- desordenada.
* Los rafts o balsas se definen como nanodominios transitorios de membrana in vivo, enriquecidos en esfingolípidos y colesterol. Los límites precisos de tiempo de vida y tamaño de lo que debe y no debe considerarse una balsa son actualmente un tema de debate. Dada su composición propuesta, es probable que las balsas constituyan dominios en fase lo, y que, frente a un detergente, su solubilización sea problemática. Sin embargo, la existencia de balsas es completamente independiente del uso de detergentes. Específicamente, no se ha demostrado que todas las balsas sean resistentes a los detergentes. Por el contrario, se ha mostrado que se pueden obtener muchas fracciones de DRM que no están relacionadas con los rafts.
4. ALGUNOS ESTUDIOS EXPERIMENTALES
En esta sección presentamos de forma resumida algunos resultados experimentales de nuestro laboratorio, obtenidos a lo largo de varias décadas, y que han contribuido a nuestra comprensión actual de los efectos biológicos de los detergentes.
4.1. Membranas mitocondriales
Algunos de nuestros primeros estudios sobre los fundamentos del uso de los detergentes se llevaron a cabo con membranas mitocondriales o sus proteínas integrales. Ya en 1980, Gurtubay y cols. [133] llevaron a cabo un análisis detallado de la solubilización de las membranas internas y externas mitocondriales, purificadas por centrifugación en gradiente. Entonces estaba reciente la publicación pionera de Helenius y Simons [3], basada en membranas de virus, en la que se proponían las tres etapas de la solubilización, mencionadas en la sección 2.4. El estudio de Gurtubay y cols. proporcionó un importante respaldo experimental a las ideas de Helenius y Simons. El detergente parecía actuar induciendo una transición de fase de membrana lamelar a micelas mixtas de proteína-lípido-detergente. Las membranas internas mostraban diferentes patrones de microscopía electrónica después del tratamiento con diferentes cantidades de tensioactivo (Fig. 12), mientras que las imágenes correspondientes de las membranas externas variaban solo ligeramente. Se observó una solubilización selectiva de varios componentes, especialmente en el caso de la membrana interna. Algunos lípidos de la membrana (p. ej., cardiolipina) se solubilizaban totalmente a concentraciones de detergente con las que otros, como la esfingomielina, permanecían en la membrana. Otros componentes de la membrana interna (flavinas, citocromos, coenzima Q) mostraron cada uno diferentes patrones de solubilización. Esto permitía la selección de condiciones para la solubilización óptima de un determinado componente de membrana con cierto grado de selectividad. También se estudió la influencia del Triton X-100 en diversas actividades enzimáticas de la membrana interna mitocondrial. El detergente parecía actuar especialmente mediante la alteración de la topología de los complejos funcionales, aunque al parecer se conservaba la actividad de las enzimas individuales. Las actividades enzimáticas relativamente simples, como la ATPasa, se solubilizaban más o menos según la concentración de detergente, mientras que la actividad succinato-citocromo c reductasa, estructuralmente más compleja, prácticamente desaparecía incluso a concentraciones bajas de Triton X-100.
Figura 12. Micrografías electrónicas de cortes finos de pellets obtenidos por centrifugación de membranas internas mitocondriales tratadas con Triton X-100. Concentraciones de detergente: (A) 0%, (B) 0,05%, (c) 0,10%. Las vesículas de membrana interna (A), sufren lisis y reensamblaje, dando lugar a vesículas multilamelares (B), y posteriormente, a bicapas planas apiladas (C). Aumentos: A, 20.000, B, 33.000; C, 42.000 [133].
Los efectos funcionales del Triton X-100 sobre la mitocondria, a concentraciones inferiores a las que producen solubilización, fueron objeto de trabajos ulteriores. Así Barbero y cols. [134] estudiaron con detalle la oxidación del succinato en las mitocondrias y su alteración por Triton X-100. Las actividades específicas de la succinato:coenzima Q reductasa, ubiquinona:citocromo c reductasa, citocromo oxidasa, succinato:citocromo c reductasa, succinato oxidasa y ubiquinol oxidasa se midieron en mitocondrias de hígado de rata en presencia de Triton X-100. Las últimas tres actividades resultaron ser mucho más sensibles a Triton X-100 que las primeras; los datos sugieren que los complejos lipoproteicos que conforman la cadena de transporte de electrones no pueden reaccionar entre sí en presencia del detergente. Al menos en el caso de la succinato:citocromo c reductasa, la reconstitución de las membranas tratadas con detergente con fosfolípidos añadidos externamente revierte la inhibición producida por Triton X-100. Estos resultados apoyan la idea de que los componentes de la cadena respiratoria difunden al azar en el plano de la membrana mitocondrial interna; el efecto principal del detergente sería perjudicar la difusión lateral al disminuir el área de la bicapa lipídica. Cuando se centrifugaron suspensiones mitocondriales tratadas con detergente para separar el material solubilizado del material particulado, sólo las tres primeras actividades enzimáticas mencionadas anteriormente se encontraban en los sobrenadantes. Después de la centrifugación, se manifiestó una actividad latente de ubiquinol: citocromo c oxidasa, mientras que el mismo proceso de centrifugación produjo la inhibición de la citocromo c oxidasa en presencia de ciertas concentraciones de Triton X-100. Estos efectos podrían deberse a una solubilización selectiva de las subunidades reguladoras o catalíticas, o a un cambio conformacional del complejo enzima-detergente. Más tarde, utilizando partículas submitocondriales de corazón de buey, Goñi y cols. [135] observaron que los efectos del Triton X-100 a concentraciones subsolubilizantes cambiaban según el estado fisiológico de las partículas: acopladas (funcionales), desacopladas (cadena transportadora de electrones y ATPasa activas, pero incapaces de producir ATP), e inhibidas con azida (cadena transportadora de electrones inactivada). Esto apoyaba la idea, entonces aún debatida, de que la síntesis de ATP en la fosforilación oxidativa pasaba por cambios conformacionales en la mitocondria.
4.2. Vesículas de retículo sarcoplásmico
Las células musculares tienen un retículo endoplásmico especializado en el almacenamiento/liberación de calcio en la contracción muscular, que se conoce como retículo sarcoplásmico (RS). El RS se aísla con facilidad a partir de músculo, y es muy rico en la llamada bomba de calcio, o ATPasa dependiente de Ca2+ (RS ATPasa, o Ca2+– ATPasa) que se purifica con detergentes con relativa facilidad [136]. Las vesículas de RS han sido muy utilizadas en estudios de solubilización de membranas por detergentes.
En nuestro laboratorio, Villalain y cols. [137] estudiaron comparativamente los efectos producidos por los detergentes Triton X-100, dodecilsulfato de sodio (SDS) y colato de sodio sobre las vesículas del RS. En todos los casos, los efectos máximos se encontraron ya 5 min después de la adición de detergente. Triton X-100 y SDS eran aproximadamente diez veces más eficaces que el colato en la solubilización de proteínas y fosfolípidos. Tanto el Triton X-100 como el SDS mantenían la acumulación de Ca2+ en vesículas de SR a concentraciones de detergente por debajo de 10-3 M; concentraciones más altas provocaban sin embargo una fuerte inhibición. Por otro lado, el colato producía una inhibición gradual de la acumulación de Ca2+ en el rango de concentración entre 10-4 M y 2.5 • 10-4 M. El Triton X-100 y el SDS causaban una solubilización gradual de la actividad específica de la CaCa2+-ATPasa hasta una concentración de detergente 10-3 M, por encima de la cual se producía una fuerte inactivación, mientras que la solubilización de la enzima aumentaba con la presencia de colato en todo el rango de concentración en estudio. El estudio sugería que el comportamiento diferente del colato de sodio, en comparación con SDS o Triton X-100, estaba relacionado con las estructuras moleculares de los tensioactivos, rígida plana en el caso del colato, y lineal flexible en los otros dos casos.
Estos estudios fueron continuados por Prado y cols. [138], que estudiaron el efecto de Triton X-100 sobre las vesículas del retículo sarcoplásmico mediante técnicas químicas, ultraestructurales y enzimáticas. En proporciones bajas de detergente / membrana (aproximadamente 1 Triton X-100 por 60 moléculas de fosfolípidos), el único efecto observado era un aumento en la permeabilidad de las vesículas. Concentraciones más altas de tensioactivo, hasta una proporción de detergente / fosfolípido de 1: 1, producían un gran aumento de la actividad ATPasa (Fig. 13). La solubilización de la membrana se producía como un fenómeno crítico cuando la relación molar tensioactivo / fosfolípido alcanzaba un valor de alrededor de 1,5: 1, correspondiente a 2 µmol de Triton X-100 / mg de proteína. En este punto, la turbidez de la suspensión caía, prácticamente toda la proteína y el fosfolípido se solubilizaba, y toda estructura organizada desaparecía. Simultáneamente, se observaba un aumento espectacular de la actividad específica de la ATPasa solubilizada. La repentina solubilización de casi todos los componentes de la bicapa a una determinada concentración de detergente se atribuyó a la relativa simplicidad de este sistema de membranas. La solubilización tenía lugar a la misma relación tensioactivo / membrana, al menos entre 0,5 y 4 mg de proteína de membrana / ml. El residuo no solubilizado parecía consistir principalmente en formas agregadas y deslipidizadas de ATPasa.
Figura 13. Efecto del Triton X-100 sobre la actividad específica de la Ca2+-ATPasa del retículo sarcoplásmico. En ausencia de detergente, la actividad era de 2,6 U/ mg proteína. Las actividades se midieron en (a) suspensión completa de retículo sarcoplásmico, (b) sobrenadantes de la centrifugación de la suspensión anterior a 150.000 xg, 60 min, 4 ºC, (c) sedimento post-centrifugación. Proteína: 8,7 x 10-6 M; lípido: 6,2 x 10-4 M. Valores medios ± S.E. (n = 4).
Los mismos autores se centraron a continuación en la solubilización del RS por dodecil sulfato sódico (SDS), seguida por espectroscopía IR [139]. Esta técnica espectroscópica permitía conectar los datos de solubilización de la bicapa con los cambios en la estructura de la proteína. El IR reveló que el SDS producía, de manera dependiente de la concentración, una disminución en la estructura de la hoja β, un cambio en los giros β y un aumento en la estructura desordenada de la Ca2+-ATPasa. El aumento de la actividad enzimática inducida por SDS a una proporción molar de proteína detergente de 80: 1 era concomitante con una reducción de la estructura en hoja β y una reordenación de los giros β, un efecto similar al observado con Triton X-100 [138]. La estructura de la RS Ca2+– ATPasa consiste en un dominio intramembranoso, principalmente helicoidal, y varios dominios citoplasmáticos compuestos por hélices α, hojas β, giros β y elementos desordenados [139]. El espectro infrarrojo sugería una influencia de las moléculas de tensioactivo en los dominios citoplasmáticos, en lugar de los intramembranosos, de la Ca2+-ATPasa a concentraciones de tensioactivo que potenciaban la actividad enzimática. Sin embargo, se había demostrado [137] que, en estas proporciones detergente / proteína, la capacidad de las vesículas de RS para acumular Ca2+ se ve afectada, probablemente debido a una mayor permeabilidad de la bicapa. Por tanto, el SDS podría actuar como un desacoplante para la Ca2+-ATPasa, y el aumento de la actividad enzimática podría deberse a uno o ambos efectos tensioactivos, sobre la proteína y / o sobre la bicapa. La acción detergente sobre la proteína podría consistir en un ‘aflojamiento’ de la puerta del canal, o de una barrera compuesta por una estructura de hoja β delante de la puerta del canal, facilitando así el cambio conformacional inducido por la unión de ATP [154] y estimulando la bomba de Ca2+. Con una alta concentración de SDS, la imagen era diferente: el aumento de la estructura desordenada se hacía obvio, incluso si todavía había alguna α-hélice presente. La pérdida de actividad enzimática podía deberse al menos a dos factores: uno, como se señaló anteriormente, a que la conformación general de la proteína en la micela se hallaba en gran medida modificada, y otro a que, incluso si la estructura del canal no se alterara, se mantendría en el interior de la micela, impidiendo así al sustrato alcanzar el sitio activo de la enzima.
La solubilización de RS por detergentes fue posteriormente estudiada con gran detalle por le Maire y cols. (ver una revisión en [140]). Según estos autores la solubilización implicaría una serie de estados intermedios que podrían estudiarse mediante diversos métodos fisicoquímicos y cinéticos; generalmente el proceso comenzaría por la desestabilización del componente lipídico de las membranas, lo cual se vería acompañado por una modificación de la unión del detergente a la membrana (por debajo de la concentración micelar crítica, CMC) pasando de una interacción no cooperativa a una cooperativa. Esto conduciría a la formación de fragmentos de proteínas y lípidos de membrana con bordes protegidos por detergente. En la etapa final de solubilización, las proteínas de membrana estarían presentes como protómeros, con los dominios originalmente insertados en la membrana recubiertos por detergente. Los autores llegaron a la conclusión de que, en general, el mecanismo más probable para la solubilización consistiría en la unión del detergente en forma de anillo, más que formando una micela. Este modo de interacción estaría respaldado por investigaciones de difracción de neutrones sobre la disposición del detergente en cristales tridimensionales de proteínas de membrana. Por otra parte, le Maire y cols. contribuyeron a la clasificación de los detergentes mostrada en la Tabla 1 (sección 2.9). Los detergentes más utilizados en la solubilización del RS son el colato y desoxicolato sódicos, y otros estructuralmente relacionados. Todos ellos pertenecen, según le Maire y cols. a los llamados en la Tabla 1 detergentes del grupo B, con una velocidad de volteo (flip) de la cara externa a la interna relativamente lenta, lo que sería el paso limitante y determinante para una solubilización lenta [27]. Más adelante (4.4.c) comentaremos nuevos datos sobre este aspecto cinético de la solubilización.
4.3. Membrana púrpura de Halobacterium
Las bacterias del género Halobacterium contienen en su membrana plasmática unos dominios (“membrana púrpura”, MP) que consisten en cristales bidimensionales de la proteína bacteriorrodopsina junto con lípidos característicos. El grupo prostético retinal que posee la bacteriorrodopsina imparte a los cristales su color púrpura característico, y puede existir en dos formas isoméricas, 13-cis y todo-trans. La MP ha sido muy utilizada para estudiar los efectos de los detergentes, pues el retinal sirve como sonda espectroscópica que informa de la situación de la proteína. A su vez, la bacteriorrodopsina ha servido con frecuencia como modelo de proteína intrínseca de membranas, por su relativamente fácil purificación en estado nativo.
En nuestro laboratorio, González-Mañas y cols. [141] observaron la interacción del Triton X-100 con las membranas púrpura de Halobacterium, a concentraciones de tensioactivo sublíticas y líticas. Estas membranas presentaban una serie de peculiaridades importantes en su comportamiento hacia el tensioactivo. Aunque la solubilización era un proceso muy lento, con un tiempo medio del orden de horas, la unión del detergente parecía ocurrir a la misma velocidad que la encontrada en otras membranas. Los lípidos se solubilizaban más fácilmente que las proteínas, de modo que casi nada de la proteína se solubilizaba a concentraciones de tensioactivo en las que aproximadamente el 75% del lípido estaba en forma de micelas mixtas con detergente. Sin embargo, una vez iniciada, la solubilización de proteínas tenía lugar dentro de un rango estrecho de concentraciones de tensioactivo. No se detectó variación en el espectro de absorción del retinal en la etapa prelítica, es decir, cuando el detergente se incorporaba a la membrana en forma monomérica. La rotura de la membrana se acompañaba de un cambio al azul en el máximo de absorción, isomerización del retinal (de todo-trans a 13-cis) y una disminución de la absorbancia específica (blanqueamiento) (Fig. 14). El aumento de las concentraciones de detergente
después de completada la solubilización no producía más cambios en el máximo espectral, pero la absorbancia específica disminuía progresivamente. Estos trabajos demostraron que Triton X-100 tiene un efecto complejo sobre el cromóforo retinal, modificando su configuración y microambiente (cambios en la longitud de onda máxima) y promoviendo la hidrólisis de la base de Schiff retinal-bacteriorropsina, lo cual se traduce en un blanqueamiento de la membrana.
Figura 14. Cambios inducidos por el Triton X-100 en el espectro visible de la membrana púrpura. (A) Espectros registrados en ausencia (1) y en presencia (2-5) de detergente a concentraciones 0,1, 0,5, 3 y 10 mM respectivamente. (B) Máximo de absorción luminosa por la membrana púrpura, en función de la concentración de detergente [141].
En la MP iluminada predomina el isómero todo-trans del retinal, pero en la oscuridad, el equilibrio entre las dos formas isoméricas del retinal en la bacteriorrodopsina cambia lentamente hasta alcanzar concentraciones iguales. Esto se acompaña de un desplazamiento del espectro de absorción de 568 a 558 nm. Estudios posteriores de los autores citados [142] profundizaron en la cinética de la adaptación a la oscuridad de la membrana púrpura a pH 5 y 7, en presencia y ausencia del detergente Triton X-100. Se consideró el efecto de las concentraciones de tensioactivo tanto sublíticas como líticas. Los resultados mostraron que: (a) la adaptación a la oscuridad era más rápida a pH 5 que a pH 7, (b) la adaptación a la oscuridad era más lenta y de menor amplitud en presencia que en ausencia de Triton X-100. Los datos pudieron interpretarse en términos de un modelo cinético sencillo de primer orden, según el cual la adaptación luz-oscuridad dependería básicamente del equilibrio entre los isómeros 13-cis y todo-trans. Los experimentos también sugerían que a pH 5, pero no a pH 7, las concentraciones solubilizantes de tensioactivo producían un aumento considerable en la velocidad de la reacción de adaptación a la oscuridad, quizás a través de cambios en el microambiente de un grupo protonable.
Otro trabajo de nuestro laboratorio, relacionado con la MP, es el de Del Río y cols. [143], a partir de la observación de que la bacteriorrodopsina se podía solubilizar fácilmente con Triton X-100 y otros detergentes, pero no con desoxicolato. Para comprender este comportamiento, se examinaron los efectos de una variedad de tensioactivos. Se pudo demostrar que los detergentes que contienen el anillo de colano (colato, taurocolato, ácido 3 [(3-colamidopropil) dietil-amonio] propanosulfónico …) son virtualmente incapaces de solubilizar la bacteriorrodopsina nativa. Sin embargo, cuando la proteína se reconstituye en dimiristil fosfatidilcolina y se analiza la solubilización a una temperatura tal que la bacteriorrodopsina esté en forma de monómeros, se produce la solubilización por los detergentes de colano. Los autores propusieron que los factores estéricos impedían el acceso de las moléculas tensioactivas planas rígidas a las regiones proteicas hidrófobas. Estas quizás se encontrarían en la interfaz monómero-monómero, cuya solvatación por los tensioactivos sería esencial para producir la solubilización. Observaron que la capacidad de algunos detergentes para solubilizar la bacteriorrodopsina siempre estaba asociada, dentro del mismo rango de concentraciones de tensioactivo, con el blanqueamiento (parcial o total) del cromóforo de la proteína. El blanqueamiento inducido por detergente era al menos parcialmente reversible, lo que sugería que el retinal libre (hidrolizado) permanecía asociado de manera no covalente a algunos componentes de la membrana. Mientras que algunas moléculas de tensioactivo permanecerían fuertemente unidas a la proteína de la membrana, los detergentes de colano se pueden eliminar por completo de la bacteriorrodopsina. Estos resultados indicaban que existía una relación estructura-función para los detergentes aplicados a la solubilización de bacteriorrodopsina, y son los precedentes de las clasificaciones funcionales de los detergentes como la que se muestra en la Tabla 1.
Otra contribución significativa al tema de la solubilización de la MP es la de Viguera y cols. [65], que exploraban las razones por las cuales la solubilización de estas membranas con detergentes necesita horas, o incluso días, para alcanzar el equilibrio, mientras que la mayoría de las biomembranas se solubilizan en cuestión de segundos o pocos minutos. Con ese objetivo, compararon los cambios en el espectro de absorción de la membrana púrpura producidos por el Triton X-100 hidrogenado en condiciones de equilibrio (24 h) con los provocados por el mismo tensioactivo en la escala de tiempo de minutos, segundos y fracciones de segundo. Hallaron que los diversos procesos que acompañan o conducen a la solubilización ya se detectaban, e incluso alcanzaban un equilibrio aparente, en los 10 s siguientes a la adición de detergente. No se detectaban nuevos fenómenos en los siguientes minutos u horas que fueran relevantes para el proceso en estudio. Esto llevó a la conclusión de que el largo proceso de solubilización consistía en la operación repetida de fenómenos simples que eran relativamente rápidos en sí mismos. Se propuso una hipótesis según la cual la rígida organización cristalina de la MP impidiría la inserción de monómeros de detergente en la bicapa lipídica; en cambio, el tensioactivo se uniría a la periferia de los parches, es decir, a la región de contacto hidrocarburo-agua, y la solubilización se llevaría a cabo gradualmente, desde la periferia hacia el núcleo de los parches de membrana, a una velocidad progresivamente menor según descienden las cantidades de detergente libre, y los sitios de unión al detergente se reducen mediante los pasos de solubilización anteriores.
4.4. Membranas modelo (liposomas)
4.4.a. Lisis y reensamblaje (fusión) de membranas inducida por detergentes
Algunos de nuestros primeros estudios con liposomas estudiaron el efecto de los detergentes sobre vesículas pequeñas unilamelares, obtenidas por ultrasonación [80, 81]. La predicción de Alonso y cols. era que, al añadir el detergente, la turbidez de la suspensión de liposomas descendería, como resultado de la solubilización de membranas. Pero lo que observaron fue que el Triton X-100, dodecilsulfato de sodio, colato de sodio o beta-octilglucósido aumentaban el tamaño de las vesículas de fosfolípidos cuando estaban por encima de la temperatura de transición de gel a líquido-cristalina. El fenómeno observado de crecimiento de vesículas prácticamente no se veía afectado por la composición de fosfolípidos, el potencial de superficie, los iones calcio, EDTA o la albúmina. La presencia de colesterol hacía que las vesículas fueran más susceptibles al crecimiento inducido por el detergente. Las concentraciones más altas de detergente causaban finalmente la solubilización de los liposomas. Estos estudios fueron continuados años más tarde por Urbaneja y cols. [94], que observaron cómo la solubilización de las vesículas pequeñas unilamelares comenzaba a bajas concentraciones de detergente, en comparación con el caso de vesículas grandes multilamelares, y se acompañaba de la rápida formación simultánea de grandes liposomas multilamelares. Las mediciones de la distribución de lípidos y detergente indicaban que, para una relación molar de lípido:detergente de 1:1, aproximadamente un tercio del lípido, con la mayor parte del detergente, se solubilizaba en forma de micelas mixtas. Los dos tercios restantes se encontraban en forma de liposomas multilamelares, prácticamente libres de detergente. Se consideró que estos resultados podían tener implicaciones con respecto a la fusión de membranas, así como a la reconstitución de proteínas de membrana en presencia de detergentes. Estas ideas encontraron más tarde su confirmación en los modelos de fusión de membranas propuestos en los años 90 y siguientes [144]. Se demostró además que los surfactantes potenciaban el papel del polietilenglicol utilizado experimentalmente para inducir fusión de células [145].
4.4.b. Permeabilización de membranas y liberación del contenido vesicular
La presencia de detergentes, incluso en concentraciones muy inferiores a las requeridas para observar cualquier aumento en el tamaño de las vesículas, favorece la liberación de su contenido [80, 81]. Esta observación, original en su día, ha recibido abundante confirmación experimental más tarde, en liposomas y en eritrocitos [30, 56]. Así, Ruiz y cols. [30] afrontaron un enfoque sistemático del fenómeno de la liberación de contenido liposómico dependiente de tensioactivos. Estudiaron separada y comparativamente una serie de métodos distintos, y variaron el tamaño de la molécula atrapada, la naturaleza del tensioactivo, la composición de las bicapas y la ultrasonación de los liposomas. Para comparar diferentes resultados, se definió un parámetro, R50, como la relación molar fosfolípido / tensioactivo que produce una liberación del 50 % del soluto atrapado (Fig. 15). Este parámetro parecía ser, en gran medida, independiente de la concentración de liposomas. La liberación del contenido de liposomas inducida por tensioactivos no ocurría como resultado de la destrucción/solubilización de las bicapas de fosfolípidos, sino que era un fenómeno diferente, que ocurría a concentraciones de detergente sustancialmente más bajas (2-5 veces) que la solubilización. La cantidad requerida de tensioactivo parecía aumentar con el tamaño del soluto atrapado. El R50 dependía claramente de la naturaleza del anfífilo soluble, pero no existía una relación obvia con su concentración micelar crítica. La liberación del contenido de vesículas también dependía de la composición de la bicapa: los fosfolípidos tenían diferentes efectos sobre la estabilidad de la membrana, según sus cabezas polares. El colesterol era interesante, ya que en proporciones equimolares con fosfatidilcolina, disminuía la estabilidad de la bicapa frente al Triton X-100, mientras que la aumentaba en presencia de colato. La ultrasonación también ejercía una influencia sobre la liberación del contenido de vesículas dependiente del tensioactivo; parecía disminuir la estabilidad de la bicapa, por lo que se requerían concentraciones más bajas de detergente para liberar los solutos atrapados.
Figura 15. Utilización de la 6-carboxifluoresceína para detectar la permeabilización de liposomas inducida por detergente. (A) Porcentaje de auto-atenuación de la fluorescencia de la 6- carboxifluoresceína, originalmente encapsulada en liposomas, en función de la concentración de Triton X-100. (B) Círculos negros, porcentaje de liberación de 6-carboxifluoresceína; círculos blancos, porcentaje de fosfolípido solubilizado. Las líneas de puntos indican el procedimiento para calcular el parámetro R50.
La liberación del contenido acuoso de las vesículas no es el único fenómeno producido por los detergentes a concentraciones sublíticas de la membrana. Ahyayauch y cols. [56] estudiaron por diversas técnicas los principales efectos de los detergentes a concentraciones subsolubilizantes sobre las membranas, a saber, el movimiento lipídico transmembrana (flip-flop), la ruptura de la barrera de permeabilidad de la membrana (liberación de contenidos) y la lisis / reensamblaje de vesículas. Para una comprensión adecuada de la solubilización de membranas mediante detergentes, es importante evaluar si los diversos efectos observados a concentraciones de surfactante subsolubilizantes ocurren de forma independiente entre sí o están interconectados por relaciones de causa- efecto para que puedan interpretarse como pasos necesarios en el proceso general. de solubilización. Para responder a esta pregunta, dichos autores exploraron los tres efectos mencionados anteriormente (flip-flop, fuga y lisis / reensamblaje), además de la solubilización o micelización, en membranas modelo (vesículas unilamelares grandes) y celulares (eritrocitos). Se utilizaron cinco tensioactivos estructuralmente diferentes, a saber, clorpromazina, imipramina, Triton X-100, dodecilsulfato de sodio y desoxicolato de sodio. Cada uno de ellos se comportó de forma diferente. Estos resultados revelaron que el flip-flop de lípidos, la fuga de vesículas y la lisis / reensamblaje de vesículas ocurrían de forma independiente entre ellos y con respecto a la solubilización de bicapas, por lo que no podrían considerarse partes necesarias y ordenadas de un proceso unificado de orden superior de solubilización de membranas por detergentes.
4.4.c. Solubilización de bicapas lipídicas por detergentes
Describimos en este apartado una serie de experimentos orientados a describir el fenómeno específico de la solubilización de membranas lipídicas, o sea su conversión en micelas mixtas lípido-detergente. Inicialmente se utilizaron bicapas formadas por fosfatidilcolina (lecitina) de huevo, con Triton X-100 como detergente. Más adelante se utilizaron otras composiciones lipídicas y otros surfactantes. En un artículo temprano [126] Goñi y cols. estudiaron el fenómeno de solubilización en condiciones de equilibrio. El equilibrio con vesículas grandes multilamelares se logró en menos de 24 h. Las estimaciones de la unión del detergente a las bicapas, utilizando [3H]Triton X-100, indicaron que el anfífilo se incorporaba incluso a concentraciones muy bajas (por debajo de su concentración micelar crítica); a concentraciones de detergente justo por debajo de las que producen la solubilización de la membrana se producía un aumento espectacular en la cantidad de Triton X-100 unido. La solubilización se producía a proporciones molares fosfolípido / detergente cercanas a 0,65, independientemente de la concentración de lípidos. La perturbación producida por el tensioactivo en la bicapa de fosfolípidos se estudió mediante calorimetría de barrido diferencial (DSC), RMN y espectroscopia de infrarrojos por transformada de Fourier. A baja concentración de detergente (relaciones molares lípido / detergente superiores a 3), se producía una reducción en la separación cuadrupolar de 2H-NMR, lo que sugería una disminución en el orden estático de las cadenas de acilo; el mismo efecto era detectado por espectroscopía infrarroja por transformada de Fourier en forma de cambios al azul de las bandas de vibración de estiramiento de los metilenos. Simultáneamente, la variación de entalpía de la transición de fase principal de los fosfolípidos se reducía en aproximadamente un tercio con respecto a su valor en el sistema lípido / agua puro. Para relaciones molares de fosfolípido / detergente entre 3 y 1, la disminución del orden estático de los lípidos no prosiguió; más bien se observaba un aumento en la fluidez, caracterizado por una marcada disminución en la temperatura de transición del punto medio de la transición de fosfolípido gel a fluido. Al mismo tiempo, un componente isotrópico aparecía en los espectros de 31P-NMR y 2H- NMR, y se detectaba una nueva endoterma de baja temperatura en las trazas calorimétricas. Cuando el fosfolípido y el Triton X-100 estaban presentes a proporciones equimolares, persistía alguna estructura en bicapa, a juzgar por las observaciones calorimétricas, pero la RMN revelaba sólo señales isotrópicas de un componente. En relaciones molares lípido / detergente por debajo de la unidad, las líneas de RMN se volvían más estrechas, la endoterma calorimétrica principal (lamelar) tendía a desaparecer y se producía la solubilización.
Los aspectos cinéticos de la solubilización fueron explorados por Alonso y cols. [68]. Se trataron suspensiones de liposomas unilamelares pequeñas (ultrasonadas) y multilamelares grandes con el detergente no iónico Triton X-100, y se estudiaron los cambios subsiguientes en la turbidez en función del tiempo, utilizando un sistema de cinética rápida por flujo detenido. Las suspensiones de liposomas ultrasonadas exhibieron un aumento de la turbidez que tenía lugar en dos etapas, una rápida de baja amplitud, que se completaba en menos de 100 ms, y una lenta de gran amplitud, que ocurría en 20-40 s. El primer aumento de turbidez estaba asociado a la incorporación de detergente a la bicapa y el segundo a la fusión de vesículas. La etapa rápida se puede detectar en todas las concentraciones de detergente, mientras que la lenta solo se ve por encima de la concentración micelar crítica de Triton X-100. Ambos procesos podían interpretarse en términos de cinéticas de primer orden. Los estudios de la variación de la constante de velocidad aparente kexp con la concentración de lípidos y detergente sugerían un mecanismo complejo de múltiples pasos. En el caso de los liposomas multilamelares, también se observó un rápido aumento de la turbidez después de la adición de detergente, seguido por una disminución lenta (20-60 s) de la turbidez y una disminución muy lenta (hasta 12 h) de la turbidez a gran escala. Estos procesos no se ajustaban a patrones exponenciales simples. También con estas vesículas grandes se concluyó que la etapa rápida reflejaba la incorporación de tensioactivo, mientras que la disminución de la turbidez se interpretó como la solubilización de la bicapa comenzando con la bicapa externa (etapa lenta) y avanzando a través de las restantes bicapas hacia el interior de la vesícula (etapa muy lenta).
Por su naturaleza hidrosoluble, los detergentes tienden a repartirse entre el medio acuoso y la membrana en los sistemas de tres componentes detergente – lípido – agua. La adecuada comprensión de los fenómenos de solubilización y relacionados requieren el estudio cuantitativo del reparto membrana – agua de los surfactantes, que se suele expresar normalmente como la relación efectiva detergente-lípido Re en la membrana (ver sección 2.2). Partearroyo y cols. hicieron estas medidas para el sistema fosfatidilcolina – Triton X-100 – agua [146], y obtuvieron relaciones molares efectivas tanto para el inicio (Resat ) como para la finalización (Resol) de la solubilización de las bicapas. Los valores de Resat fueron de 0.71-0.78 y los de Resol de 3.0 – 3.7 para las vesículas unilamelares. Las relaciones efectivas detergente: lípido resultaron ser independientes de la concentración de fosfolípidos.
Otra serie de estudios fueron dirigidos a observar la solubilización de bicapas en cuya composición entraban lípidos diferentes de la fosfatidilcolina de huevo. Así, Urbaneja y cols. [147] estudiaron la solubilización por Triton X-100 de liposomas multilamelares formados por mezclas de PC con colesterol, palmitato de colesterilo, betacaroteno, cardiolipina, fosfatidiletanolamina o gramicidina A (un péptido antibiótico de carácter hidrofóbico). La solubilización fue seguida a través de la disminución de la turbidez de la suspensión de liposomas, y también mediante la determinación de los componentes de la bicapa en la fracción solubilizada. El mismo patrón de solubilización se encontraba para PC insaturada (yema de huevo) o saturada (dimiristil PC). El colesterol se solubilizaba en paralelo con la PC; la gramicidina A se solubilizaba con preferencia a dicho fosfolípido, y los lípidos no-polares palmitato de colesterilo o betacaroteno permanecían insolubles a concentraciones de detergente que causaban la solubilización completa de la PC. La adición de cardiolipina o fosfatidiletanolamina no parecía alterar el patrón general de solubilización de la PC. La fosfatidiletanolamina era menos soluble que la PC, mientras que la cardiolipina se solubilizaba a a las mismas concentraciones de detergente que la PC. Estos resultados puedieron utilizarse para la interpretación de estudios previos con membranas naturales.
En un paso más hacia la complejidad, Ahyayauch y cols. [148] observaron la influencia de las cadenas acilo de la PC en la solubilización. Ensayaron diecisiete fosfatidilcolinas diferentes, químicamente definidas, dispersas en medio acuoso en forma de vesículas grandes unilamelares, con el detergente no iónico Triton X-100. Las temperaturas (20 ºC o 45 ºC) eran tales que las bicapas estaban siempre en estado líquido desordenado. Para cada caso, los parámetros de solubilización, Don (relación molar de detergente total: lípido que produce el inicio de la solubilización) y D50 (relación molar de detergente total: lípido que produce 50 % de solubilización), se determinaron en condiciones de equilibrio. Ambos parámetros variaron generalmente en paralelo. Cuando se introdujeron dobles enlaces en las cadenas acilo, permaneciendo constantes otros factores, la solubilización se hizo más difícil, es decir, se requirió más detergente. Los fosfolípidos cis-insaturados requerían más detergente que los correspondientes isómeros trans. El aumento de la longitud de la cadena en los fosfolípidos saturados entre C12 y C16 disminuyó moderadamente las relaciones de detergente / lípido necesarias para la solubilización. Los fosfolípidos con cadenas acilo y alquilo fueron igualmente susceptibles a la solubilización por Triton X-100. El orden de las cadenas de los ácidos grasos, medido por la polarización de fluorescencia de DPH, pareció facilitar la solubilización, quizás porque las bicapas más ordenadas tienen una menor capacidad para acomodar monómeros de detergente sin descomponerse en micelas mixtas de lípido-detergente.
El tema de la carga eléctrica de bicapas y detergentes fue estudiado por Urbaneja y cols. [149], que examinaron la interacción de nueve tensioactivos cargados eléctricamente con liposomas neutros o cargados eléctricamente. Los detergentes pertenecían a las familias de alquilpiridinio, alquiltrimetilamonio o alquilsulfato. Se utilizaron liposomas unilamelares grandes formados por fosfatidilcolina de huevo con o sin estearilamina (catiónica) o fosfato de dicetilo (aniónico). Los resultados sugirieron que las fuerzas electrostáticas no juegan un papel significativo en la formación de micelas mixtas y que las interacciones hidrofóbicas son, con mucho, las principales fuerzas involucradas en la solubilización. Además, a partir del estudio de treinta sistemas diferentes de liposoma- surfactante, se derivaron una serie de reglas empíricas que pueden ser útiles para predecir el comportamiento de surfactantes no probados: (i) la concentración de detergente que produce el inicio de la solubilización (Don) disminuye a medida que aumenta la longitud de la cadena de alquilo; la disminución sigue un patrón semilogarítmico en el caso de compuestos de alquilpiridinio; (ii) para tensioactivos con concentraciones micelares críticas (cmc) inferiores a 6 x 10-3 M, Don es independiente de la naturaleza del detergente y de la composición de la bicapa; para detergentes que tienen cmc superior a 6 x 10-3 M, Don aumenta linealmente con la cmc; y (iii) Don varía linealmente con la concentración de tensioactivo que produce la máxima solubilización.
Más recientemente, Lete y cols. [150] hicieron un gran esfuerzo para entender la distinción entre detergentes que actúan lenta o rápidamente según su cabeza polar, o su capacidad de volteo de una monocapa a la otra (flip-flop) (ver 2.9.d y 4.2). Evaluaron la solubilización de vesículas lipídicas de fosfatidilcolina de huevo por veintiún detergentes estructuralmente heterogéneos disponibles comercialmente, mediante la disminución de la turbidez de la suspensión de vesículas, ampliando así notablemente los resultados expuestos en la Tabla 1. Se realizaron mediciones tanto en equilibrio como con resolución temporal. Los resultados mostraron que los detergentes en estudio se clasificaban en una de dos categorías, a saber, detergentes de solubilización rápida y de solubilización lenta. Esta categorización era independiente de la concentración de detergente, es decir, un tensioactivo «lento» no se podía convertir en un tensioactivo «rápido» aumentando su concentración. Los espectros de 31P-NMR indicaron que los detergentes de acción lenta causaban una micelización gradual y monótona de las bicapas (dodecilsulfato de sodio) o la formación de intermediarios no micelares más complejos, quizás no lamelares (dodecilmaltósido). Por el contrario, los detergentes rápidos (por ejemplo, Triton X-100) provocaban la lisis y el reensamblaje de las vesículas antes de que tuviera lugar la solubilización en masa. Estos resultados apoyan la idea de que la solubilización de la membrana por los detergentes es rápida solo cuando el movimiento transbicapa (volteo) del surfactante es fácil.
4.4.d. Membranas resistentes a los detergentes
Desde los primeros estudios de solubilización de biomembranas por detergentes [116] quedó claro que, en casi todos los casos, había una fracción de componentes de membrana que no se lograba solubilizar por completo. Este residuo se llamó “membranas resistentes a los detergentes”, DRM por sus siglas en inglés. Ya hemos comentado (sección 3) la confusión que se creó en la década 1997-2006 cuando algunos autores asimilaron las DRM con las balsas lipídicas o rafts. En este apartado describiremos sucintamente nuestros esfuerzos por clarificar la situación, mediante el estudio de membranas modelo en equilibrio con detergente. Una vez más, el Triton X-100 fue el surfactante más utilizado en este contexto.
La hipótesis de los rafts [110] tuvo, entre otras virtudes, la de hacernos pensar en la posibilidad de dominios de membrana con propiedades distintas de las de la fase líquida- desordenada, por ejemplo microdominios en fase gel, o en fase líquido-ordenada. Por ese motivo comenzamos una larga serie de estudios examinando, en primer lugar, la solubilización de bicapas en fase gel, lo que hasta entonces apenas se había estudiado. Patra y cols. [102], midiendo la solubilización de las bicapas de fosfatidilcolinas saturadas por Triton X-100, pudieron observar que en el estado de gel, mucho más que en el estado fluido, la cantidad de detergente requerida para solubilizar el fosfolípido dependía en gran medida de la longitud de la cadena. Las PC con ácidos grasos saturados de 16 y 18 carbonos eran prácticamente insolubles a 4 ºC. Sin embargo, la adición de reactivos solubles en agua que perturban el enlace de hidrógeno, por ejemplo, urea, o de pequeñas proporciones de lípidos con escasa tendencia a formar fases lamelares, hacía que las bicapas fueran susceptibles de solubilización por detergente, incluso a bajas temperaturas.
Un descubrimiento importante en el terreno de las DRM fue la constatación de que las bicapas que contenían esfingomielina u otros esfingolípidos complejos eran más fácilmente solubilizables que las basadas en PC. Patra y cols [103] estudiaron experimentalmente la solubilización por Triton X-100 de vesículas unilamelares grandes formadas por esfingomielina de huevo pura o mezclas de esfingomielina:colesterol a diversas temperaturas. Para la esfingomielina pura, la solubilización ocurría más fácilmente a temperaturas justo por debajo de la temperatura de transición gel-fluido Tm. En general, la esfingomielina de huevo se solubilizaba con Triton X-100 más fácilmente que la fosfatidilcolina de huevo. Las mezclas de esfingomielina y colesterol eran insolubles en detergente en la mayoría de las condiciones. Se aplicó espectroscopia infrarroja para explorar las interacciones del colesterol y la esfingomielina a nivel de la interfaz lípido-agua. Además, se utilizaron varios análogos de colesterol (colestano, colestanona, androstenol) en experimentos de solubilización en paralelo con observaciones de IR. Los resultados mostraron que el colesterol modificaba la conformación (o las propiedades del enlace de H, o ambas cosas) del grupo de cabeza polar de la esfingomielina, tanto por encima como por debajo de Tm. Además, tanto el grupo hidroxilo en C3 como la cadena de hidrocarburos en C17 del núcleo esteroide parecen ser necesarios para que se detecte la insolubilidad. Estos resultados estarían relacionados con la insolubilidad observada de las ‘balsas’ de la membrana celular en detergente a 4 ºC, y en general con el origen de las DRM.
Otro dato importante resultó ser el de la insolubilidad de las bicapas formadas por esfingomielina y ceramida [151]. En este trabajo, Sot y cols., para responder a algunas de las preguntas relevantes, comenzaron por buscar una composición de bicapa sencilla que imitara a las membranas resistentes a los detergentes. El cribado de múltiples composiciones lipídicas demostró que la mezcla binaria de esfingomielina de huevo / ceramida de huevo (SM / Cer) presentaba la resistencia a los detergentes requerida. En membranas sin detergente compuestas por diferentes mezclas de SM y Cer (5-30 % en moles de Cer), la calorimetría de barrido diferencial, la espectroscopía de fluorescencia y los experimentos de microscopía de fluorescencia revelaron la presencia de dominios discretos de gel enriquecidos en Cer en un amplio rango de temperaturas. En particular, a temperaturas por debajo de la transición de fase de SM (aproximadamente 40 ºC), usando microscopía de fluorescencia, se observaban directamente dos fases gel (respectivamente enriquecidas en Cer y en SM). Aunque las membranas SM puras se solubilizaban completamente con Triton X-100 a temperatura ambiente, un 5% mol/mol de Cer era suficiente para inducir la resistencia al detergente, incluso con un gran exceso de detergente y tiempos de tratamiento prolongados. Las Cer de cadena corta no daban lugar a resistencia a los detergentes. Las mezclas de SM / Cer que contenían hasta 30 moles % de Cer se volvían completamente solubles a aproximadamente 50 º C, es decir, muy por encima de la temperatura de transición gel-fluido de la SM. Los resultados combinados de la solubilización dependiente de la temperatura y la calorimetría de barrido diferencial revelaron que los dominios ricos en SM se solubilizaban preferentemente sobre los ricos en Cer tan pronto como el primer lípido se fundía (es decir, a aproximadamente 40 ºC). Como consecuencia, a temperaturas que permiten sólo una solubilización parcial, el residuo no solubilizado se enriquece en Cer con respecto a la composición de la bicapa original. La microscopía de fluorescencia de vesículas unilamelares gigantes a temperatura ambiente muestra claramente que los dominios ricos en SM se solubilizan preferentemente sobre los ricos en Cer y que estos últimos se vuelven más rígidos y extensos como consecuencia de los efectos de los detergentes. Estas observaciones proporcionaron un fundamento físico-químico para los fenómenos de señalización dependiente de esfingomielinasa, generación de «plataformas de balsa» y membranas celulares resistentes a detergentes.
Figura 16. Microscopia confocal de fluorescencia. Estudio en función del tiempo (de 0 a 105 s) de la solubilización parcial de vesículas de esfingomielina y ceramida de huevo (relación molar 80:20) con doble tinción (DiI-C18, pseudocolor amarillo, tiñe preferentemente dominios fluidos y Laurdan, pseudocolor rojo, tiñe preferentemente dominos rígidos). Se muestran sólo los planos ecuatoriales. Cada grupo de tres figuras incluye imágenes teñidas por laurdan (L), por DiI-C18 (D) y una superposición de las dos anteriores (L + D). Las flechas indican la formación de un gran dominio enriquecido en ceramida [151].
Desde Patra y cols. [103] se sabe que las bicapas de SM se solubilizan más fácilmente que las de PC. Una posible explicación era que el Triton X-100 tuviera mayor afinidad por las bicapas de SM. Por otra parte, la hipótesis de los rafts, en uno de sus corolarios, sostenía que los lípidos a baja T se solubilizaban más difícilmente que a T alta, aunque esto ya se había mostrado contrario a la experiencia [63, 102]. Arnulphi y cols. [52] examinaron estas proposiciones midiendo el reparto lípido-agua del detergente no iónico Triton X-100 a concentraciones sub-solubilizantes, con bicapas de esfingomielina de huevo (SM), palmitil SM o dipalmitilfosfatidilcolina. Los tres lípidos exhiben una transición de fase gel-fluido en el rango de temperatura de 38-41 ºC. Solo se realizaron experimentos a concentraciones de Triton X-100 muy por debajo de la concentración micelar crítica, por lo que solo deben considerarse los monómeros de detergente. Las relaciones molares lípido / detergente nunca fueron <10:1, lo que garantiza que nunca se alcanzó la etapa de solubilización. Se aplicaron calorimetría de titulación isotérmica, DSC y espectroscopias de infrarrojos, fluorescencia y 31P-NMR en el rango de temperatura de 5-55 ºC. Los resultados mostraron que, independientemente de la naturaleza química del lípido, los valores de ΔG de reparto lípido/agua permanecieron en torno a -27 kJ / mol de lípido en la fase de gel y a -30 kJ / mol de lípido en la fase fluida. Esta pequeña diferencia no puede explicar las diferencias observadas dependientes de la fase en la solubilización. Estos valores prácticamente constantes de ΔG se produjeron como resultado de la compensación de los componentes entálpicos y entrópicos, que variaron tanto con la temperatura como con la composición de lípidos. En consecuencia, las diferentes susceptibilidades a la solubilización observadas no se pueden atribuir a diferencias en la unión detergente-bicapa sino a eventos adicionales en el proceso de solubilización, por ejemplo, diferente saturabilidad de bicapa por detergente o distinta propensión a formar micelas mixtas lípido-detergente. Los datos aquí resumidos arrojaron luz sobre las primeras etapas relativamente inexploradas de la solubilización de membranas y abrieron nuevas formas de comprender el fenómeno de la resistencia de las membranas a la solubilización por detergentes.
En relación con la observación [63, 102] de que las bicapas en fase gel requerían menos detergente para su solubilización que las que se hallan en fase fluida (al contrario de lo que muchos aseguraban), y para probar si esto se debía a una más fácil saturabilidad de la bicapa por el detergente, Ahyayauch y cols. [48] pudieron demostrar, a partir de datos de turbidez, calorimetría y 31P-NMR, que las bicapas en estado de gel (al menos hasta 13-20 °C por debajo de la temperatura de transición gel-fluido) se saturaban con detergente a concentraciones de detergente significativamente más bajas que las del estado fluido, independientemente de la temperatura. La diferente saturación podía explicar las diferencias observadas en la solubilización, y así estos datos proporcionaron una base física sólida a la observación de que para solubilizar bicapas en fase gel se necesitaba menos, y no más, detergente que cuando las membranas se hallaban en fase fluida.
En otra serie de experimentos, Ahyayauch y cols. [152] exploraron las primeras etapas de la solubilización de bicapas formadas por SM y ceramida (Cer), que son muy resistentes a la solubilización por Triton X-100 [151]. Para ello utilizaron una combinación de técnicas calorimétricas y espectroscópicas. Examinaron composiciones basadas en esfingomielina, con hasta un 30% molar de Cer, a 4, 20 y 50 °C. La presencia de Cer no modificaba la afinidad por el Triton X-100 (en términos de ΔG de unión por mol de lípido total) de las bicapas basadas en SM, aunque sí aumentaba la cantidad de detergente requerida para el inicio de la solubilización. A 50 °C se requirió más detergente para solubilizar las bicapas SM / Cer que a 20 °C. Es decir, tanto la presencia de Cer como la elevada T aumentaban la cantidad de detergente unido a bicapa necesario para iniciar su solubilización. Estos datos se pudieron racionalizar en términos de geometrías e interacciones de lípidos y detergentes [26].
Nuestro último, por el momento, esfuerzo por comprender el origen de la resistencia de ciertas fracciones de membrana a la solubilización por detergentes ha consistido en un estudio comparativo de la solubilización por Triton X-100 de mezclas binarias compuestas por esfingomielina de huevo (SM) y ceramida, o bien diacilglicerol, o colesterol [153]. La solubilización se ensayó en el rango de 4-50 °C, y los resultados se pudieron resumir en la que creemos ser una nueva forma de gráficos, que hemos llamado diagramas de temperatura-solubilización. A pesar de usar un gran exceso de detergente (relación lípido / detergente 1:20 en moles) y tiempos de solubilización prolongados (24-48 h), ciertas mezclas no podían ser solubilizadas por el Triton X-100 a una o más temperaturas. La DSC de todas las mezclas de lípidos y de todas las mezclas de lípido + detergente reveló que la resistencia al detergente estaba asociada con la presencia de dominios en fase gel a la temperatura del ensayo. Una vez que el sistema se “fundió” (pasó por encima de Tm), pudo producirse la solubilización. En general, la adición de lípidos de alto punto de fusión limitó la solubilización, mientras que la adición de lípidos de bajo punto de fusión la promovió. El análisis lipidómico de las membranas celulares de riñón canino Madin-Darby y de la correspondiente fracción DRM indicó un gran enriquecimiento en diacilglicerol saturado y ceramida en las fracciones no solubilizadas. Las mezclas de SM-colesterol eran especiales porque la solubilización del detergente iba acompañada, para ciertas temperaturas y composiciones, por un fenómeno independiente de reensamblaje de las bicapas lipídicas parcialmente solubilizadas. La temperatura a la que prevaleció la lisis y el reensamblaje fue de ~ 25° C, por lo que para algunas mezclas de SM-colesterol la solubilización se produjo tanto por encima como por debajo de 25 °C, pero no a esa temperatura. Estas observaciones pueden estar en el origen de los efectos de resistencia a los detergentes observados con las membranas celulares, y también significan que los restos de membranas resistentes a los detergentes que contienen colesterol pueden no corresponder a estructuras existentes en la membrana nativa antes de la adición del detergente.
Concluimos esta sección con una nota metodológica. Aunque muchos investigadores no sean conscientes de ello, los estudios cuantitativos de solubilización por detergentes se ven alterados con frecuencia por artefactos producidos durante la separación física de las fracciones solubilizada y resistente. Esto ocurre con prácticamente todos los métodos de separación, que son fundamentalmente centrifugación, filtración por membranas y filtración molecular por gel. El problema fue resuelto en nuestro laboratorio, al estudiar las mezclas lípido-detergente por 31P-NMR (Fig. 9). Esta técnica sólo detecta núcleos que giran con rapidez, como ocurre en el caso de las micelas, pero no con las bicapas. En consecuencia, la 31P-NMR permite medir la fracción micelizada (solubilizada) de una muestra sin separarla de la fracción no solubilizada. Ahyayauch y cols. [50] demostraron la aplicabilidad de la técnica al estudiar comparativamente la solubilización de las mezclas PC – colesterol y SM – colesterol, las últimas, como ya sabemos, mucho más difíciles de solubilizar.
Figura 17. Ejemplo de un diagrama temperatura-solubilización [153]. El diagrama representa la turbidez (%A500) de dispersiones lipídicas (MLV) 48 h después de la adición de Triton X-100, en este caso para bicapas de SM/Cer. Los distintos símbolos indican el descenso de turbidez alcanzado (ver la escala arriba). El 100% corresponde a la turbidez en ausencia de detergentes. Relación molar detergente:lípido 20:1.
5. APLICACIONES BIOFARMACÉUTICAS
Las aplicaciones de los detergentes a la farmacia son innumerables. Aquí nos limitaremos a exponer algunos ejemplos.
Fármacos detergentes. En primer lugar, se deben mencionar los fármacos con propiedades detergentes, es decir, moléculas de uso terapéutico que son anfífilos solubles, y por lo tanto es de suponer que su mecanismo de acción debe incluir, al menos parcialmente, las consecuencias de esta propiedad. Es el caso, por ejemplo, del antipsicótico clorpromazina y del antidepresivo imipramina, cuyas propiedades solubilizantes de membranas fueron demostradas entre otros por Ahyayauch y cols. [93]. Otro caso es el del dioctil sulfosuccinato de sodio (docusato sódico) detergente aniónico utilizado como laxante emoliente [154]. Debemos quizá también incluir en este apartado a la dipalmitil fosfatidilcolina, un surfactante, aunque no un detergente, utilizado como medicamento de sustitución en el síndrome de dificultad respiratoria neonatal.
Detergentes y estabilidad de los fármacos. Las micelas y otros agregados supramoleculares pueden afectar profundamente la estabilidad de los fármacos [155]. Los enlaces éster y amida son afectados particularmente, sobre todo por los detergentes con cargas eléctricas netas. Los efectos suelen estar relacionados con dos factores independientes, a saber, el coeficiente de partición del fármaco en la micela y el mecanismo de la reacción en el agregado. Los estudios publicados hacen referencia sobre todo a detergentes sintéticos, pero cabe esperar que los múltiples tensioactivos biológicos, p. ej. muchas proteínas, van a tener efectos similares. Por citar algunos casos característicos, los detergentes no-iónicos protegen de la hidrólisis al enlace éster del ácido acetilsalicílico, y lo mismo ocurre con el enlace éster de los anestésicos locales procaína, tetracaína y benzocaína. Entre las moléculas con enlaces amida, los detergentes eléctricamente neutros protegen al antiinflamatorio indometacina de la degradación hidrolítica, mientras que los catiónicos (ejemplo, hexadeciltrimetilamonio bromuro, HTAB) facilitan la reacción. En el caso de las benzodiazepinas, las micelas de detergentes neutros o catiónicos no afectan a la hidrólisis del enlace amida, que sin embargo es fuertemente inhibida por los detergentes aniónicos. Entre los antibióticos beta-lactámicos, la hidrólisis de su enlace característico se ve con frecuencia afectada por los surfactantes: la hidrólisis ácida de la propicilina y la cefazolina son estabilizadas por el HTAB e inhibidas por al aniónico SDS, probablemente por interacciones coulómbicas con el H+ [155].
Preparaciones farmacéuticas. El monumental Handbook of Detergents de Uri Zoller, en su parte E [154], y el menos voluminoso, pero muy informativo Liquid Detergents, de Kuo-Yann Lai [156], contienen información valiosísima sobre el papel de los detergentes en las preparaciones farmacéuticas y usos clínico-sanitarios. Según Zoller, la americana Food and Drug Administration (FDA) ha aprobado varias docenas de surfactantes para su uso en preparaciones farmacéuticas, entre ellos los polioxietilenglicol éteres de n-alcoholes, familia con la que está relacionado el Triton X-100, los poloxámeros y el dodecil sulfato sódico (SDS). Los detergentes son ampliamente utilizados en las formas para uso oral, incluídas nanopartículas y dispersiones sólidas, con el fin de proteger los fármacos y facilitar su absorción en el tracto gastrointestinal. En la administración parenteral se usan sistemas coloidales para direccionalizar los fármacos o para conseguir su liberación controlada. Con este fin se utilizan a menudo moléculas surfactantes, aunque no necesariamente detergentes, como la lecitina, una mezcla de lípidos de soja que emulsiona los triglicéridos y estabiliza así las formas parenterales tipo Intralipid, o verdaderos detergentes como los polioxil derivados del aceite de ricino que se dispersan en forma de micelas y se utilizan en la administración de fármacos muy hidrofóbicos, como el paclitaxel.
Para uso tópico, se aprueba la utilización de diversos detergentes en aplicaciones oftálmicas, vaginales, nasales y dérmicas. La administración de fármacos insolubles en agua en forma de colirios se consigue, por ejemplo, mediante el uso de poloxámeros, o de polisorbato 80. Para usos vaginales se ha utilizado el monoestearato de glicerilo, los poloxámeros y los polisorbatos. Los polisorbatos se usan también para aplicaciones locales nasales. Las cremas, pomadas y lociones de uso dérmico contienen a menudo liposomas, o las vesículas formadas por detergentes no-iónicos llamadas niosomas (Zoller, cap. 18).
Biosurfactantes. Parece adecuado incluir aquí una breve mención a los llamados biosurfactantes, que se suelen definir como surfactantes de origen microbiano. Entre ellos se encuentran los rhamnolípidos, producidos por algunas especies de Pseudomonas, los sophorolípidos, sintetizados por levaduras, o el emulsano, producido por Acinetobacter calcoaceticus. Sus aplicaciones surfactantes incluyen preparaciones herbicidas, pesticidas, detergentes domésticos, usos farmacéuticos y cosméticos. Los biosurfactantes presentan la ventaja de poder obtenerse en grandes cantidades a partir de cultivos microbianos a gran escala. Además, muchas de sus aplicaciones no requieren una purificación exhaustiva de los mismos. Su biodegradabilidad y baja toxicidad han hecho de los biosurfactantes una “estrella” de la “química verde” y de la “industria sostenible” [157, 158].
Detergentes e higiene personal. Por razones operativas, la industria distingue entre los detergentes líquidos y los sólidos. Los detergentes líquidos para la higiene personal (light- duty) se desarrollaron a partir de 1950 (Lai, cap. 7). Se trataba de surfactantes aniónicos, de tipo alquilbenceno sulfonato, a los que se añadían alcanolamidas para reforzar la espuma, un aspecto éste más bien psicológico, pero demandado por los consumidores. A partir de los años 60 se añadieron también agentes antimicrobianos. Desde los años 90 se han incorporado nuevos detergentes (p. ej. etoxisulfatos de cadena ramificada), nuevos antimicrobianos, polímeros que facilitan la retirada de la grasa, y diversos enzimas. A veces la base de estos “nuevos” detergentes líquidos es el oleato potásico. El siglo XXI ha visto el desarrollo de preparaciones con determinados colores y aromas supuestamente atractivos, dando lugar a productos con nombres comerciales tales como Spring Sensations (Colgate-Palmolive), Joy Invigorating Splash o Dawn Fresh Escapes (Procter & Gamble), este último con “brotes de manzana, explosión de cítricos y mezcla de flores salvajes”.
Los detergentes sólidos más utilizados para la higiene personal siguen siendo los jabones sódicos, es decir las sales sódicas de ácidos grasos (con frecuencia creciente, se usan los de origen vegetal con preferencia a las grasas animales). Son las pastillas de jabón que, con ciertos aditivos y perfumes, constituyen el llamado jabón de tocador, presente de manera casi universal en nuestros hogares.
Cerramos así el círculo de este trabajo, volviendo a los jabones utilizados en el lavado de manos para eliminar las partículas de SARS-CoV-2. Ahora comprendemos mejor el mecanismo por el cual esta operación tan sencilla destruye la membrana del virus, haciéndolo inviable. Sólo esperamos que llegue pronto el momento en que la ciencia (y solo la ciencia) alcanzará a controlar este agente patógeno.
Abreviaturas
BLM, black lipid membranes
Cer, ceramida
cmc, concentración micelar crítica
COVID-19, coronavirus disease 2019
crio-TEM, crio-microscopía electrónica de transmisión
DPPC, dipalmitil fosfatidilcolina
DRM, detergent-resistent membranes, membranas resistentes a los detergentes
Dtsat / Dtsol, concentración total de detergente requerida para el inicio / la finalización de la formación de micelas mixtas
GUV, giant unilamellar vesicles, vesículas gigantes unilamelares
ITC, isothermal calorimetry, calorimetría isotérmica lo / ld, fase lamelar fluida ordenada / desordenada
LUV, large unilamellar vesicles, vesículas unilamelares grandes
MLV, multilamellar vesicles, vesículas multilamelares
PC, fosfatidilcolina
Resat / Resol, relación molar efectiva [detergente] : [lípido] que produce el comienzo de la micelización / la micelización completa
RMN, resonancia magnética nuclear
SARS-CoV-2, Severe Acute Respiratory Syndrome – coronavirus – 2
SDS, sodio dodecil sulfato
SLM/SLB, supported lipid membranes/bilayers, membranas / bicapas lipídicas apoyadas
SM, esfingomielina
SUV, small (sonicated) unilamellar vesicles, vesículas unilamelares pequeñas (ultrasonadas).
Conflicto de intereses
Los autores no declaran conflicto de intereses de ningún tipo.
Agradecimientos
Los autores desean mostrar su gratitud a los colegas y estudiantes que durante tantos años les han prestado su colaboración fiel y entusiasta en sus investigaciones sobre detergentes. Deseamos destacar en particular a nuestro técnico de laboratorio, Dr. Jesús Sot, y a nuestra antigua colaboradora, ahora en Rabat, Dra. Hasna Ahyayauch. De los colegas internacionales que han compartido con nosotros horas de análisis y discusión deseamos mencionar especialmente a los profesores Kai Simons (Dresden), Dov Lichtenberg (Tel Aviv) y Heiko Heerklotz (Friburgo de Brisgovia).
Nuestras investigaciones han sido subvencionadas, a lo largo de los años, por la Unión Europea, el Gobierno de España, el Gobierno Vasco, la Diputación Foral de Bizkaia y la Universidad del País Vasco.
6. REFERENCIAS
- Surface and bulk interactions of lipids and water with a classification of biologically active lipids based on these interactions. Small DM. Fed Proc. 1970;29(4):1320-6.
- The hydrophobic effect and the organization of living matter. Tanford C. Science. 1978; 200(4345):1012-8.
- Solubilization of membranes by detergents. Helenius A, Simons K. Biochim Biophys Acta. 1975; 415(1):29-79.
- The fluid mosaic model of the structure of cell membranes. Singer SJ, Nicolson GL. Science. 1972; 175(4023):720-31.
- The basic structure and dynamics of cell membranes: an update of the Singer- Nicolson model. Goñi FM. Biochim Biophys Acta. 2014; 1838(6):1467-76.
- On bimolecular layers of lipoids on the chromocytes of the blood. Gorter E, Grendel F. J Exp Med. 1925; 41(4):439-43.
- Surface tension. Pokels A. Nature 1891; 46:437-39.
- Reconstitution of cell membrane structure in vitro and its transformation into an excitable system. Mueller P, Rudin DO, Tien HT, Wescott WC. Nature. 1962; 194:979-80.
- Supported phospholipid bilayers. Tamm LK, McConnell HM. Biophys J. 1985; 47(1):105-13.
- Atomic force microscopy of supported planar membrane bilayers. Singh S, Keller DJ. Biophys J. 1991; 60(6):1401-10.
- Diffusion of univalent ions across the lamellae of swollen phospholipids. Bangham AD, Standish MM, Watkins JC. J Mol Biol. 1965; 13(1):238-52.
- Studies on membrane fusion. I. Interactions of pure phospholipid membranes and the effect of myristic acid, lysolecithin, proteins and dimethylsulfoxide. Papahadjopoulos D, Hui S, Vail WJ, Poste G. Biochim Biophys Acta. 1976;448(2):254-64.
- Production of large unilamellar vesicles by a rapid extrusion procedure: characterization of size distribution, trapped volume and ability to maintain a membrane potential. Hope MJ, Bally MB, Webb G, Cullis PR. Biochim Biophys Acta. 1985;812(1):55-65.
- Electric-field-dependent thermal fluctuations of giant vesicles. Mitov MD, Méléard P, Winterhalter M, Angelova MI, Bothorel P. Phys Rev E Stat Phys Plasmas Fluids Relat Interdiscip Topics. 1993; 48(1):628-631.
- Giant unilamellar vesicles electroformed from native membranes and organic lipid mixtures under physiological conditions. Montes LR, Alonso A, Goñi FM, Bagatolli LA. Biophys J. 2007; 93(10):3548-54.
- Reconstitution of membrane processes. Racker E. Methods Enzymol. 1979; 55:699-711.
- Special Issue: Detergents in biomembrane studies. Goñi FM, Alonso A. (eds.). Biochim Biophys Acta. 2000; 1508:1-252.
- Liposomes as a model for solubilization and reconstitution of membranes. Lichtenberg D. In: Handbook of Nonmedical Applications of Liposomes (Barenholz, Y. and Lasic, D.D., eds.), pp. 199–218, 1996, CRC Press, Boca Raton, FL, USA.
- Interactions of surfactants with lipid membranes. Heerklotz H. Q Rev Biophys.2008; 41(3-4):205-64
- Characterization of the solubilization of lipid bilayers by surfactants. Lichtenberg D. Biochim Biophys Acta. 1985; 821(3):470-8.
- Detergents: an overview. Linke D. Methods Enzymol. 2009; 463, 603-617.
- Membrane proteins, lipids and detergents: not just a soap opera. Seddon AM, Curnow P, Booth P.J. Biochim. Biophys. Acta 2004; 1666:105-117.
- Detergent-resistant membranes should not be identified with membrane rafts. Lichtenberg D, Goñi FM, Heerklotz H. Trends Biochem Sci. 2005; 30(8):430-6.
- Membrane protein solubilization. Duquesne K, Sturgis JN. Methods Mol Biol. 2010;601:205-17.
- Strategies for the purification of membrane proteins. Smith SM. Methods Mol Biol. 2011; 681:485-96.
- Detergent solubilization of lipid bilayers: a balance of driving forces. Lichtenberg D, Ahyayauch H, Alonso A, Goñi FM. Trends Biochem Sci. 2013;38(2):85-93.
- The mechanism of detergent solubilization of lipid bilayers. Lichtenberg D, Ahyayauch H, Goñi FM. Biophys J. 2013; 105(2):289-99.
- Physical principles of membrane organization. Israelachvili JN, Marcelja S, Horn RG. Q Rev Biophys. 1980; 13(2):121-200.
- Theory of self-assembly of hydrocarbon amphiphiles into micelles and bilayers. Israelachvili, JN, Mitchell DJ, Ninham DW. J. Chem. Soc. Faraday Trans. II 1976; 72,1525–1568.
- Surfactant-induced release of liposomal contents. A survey of methods and results. Ruiz J, Goñi FM, Alonso A. Biochim Biophys Acta. 1988; 937(1):127-34.
- Intermediate structures in the cholate-phosphatidylcholine vesicle-micelle transition. Walter A, Vinson PK, Kaplun A, Talmon Y. Biophys J. 1991; 60(6):1315-25.
- Structural and kinetic studies on the solubilization of lecithin by sodium deoxycholate. Lichtenberg D, Zilberman Y, Greenzaid P, Zamir S. Biochemistry. 1979;18(16):3517-25.
- Detergent-phospholipid mixed micelles with a crystalline phospholipid core. Funari SS, Nuscher B, Rapp G, Beyer K. Proc Natl Acad Sci U S A. 2001;98(16):8938-43.
- Formation of Polymerlike Mixed Micelles and Vesicles in Lecithin-Bile Salt Solutions: A Small-Angle Neutron-Scattering Study. Pedersen JS, Egelhaf SU, Schurtenberger P. J. Phys. Chem. 1995; 99, 1299–1305.
- Phase behavior of dilute aqueous solutions of lipid–surfactant mixtures: effects of finite size of micelles.Roth Y, Opatowski E, Lichtenberg D, Kozlov MM. Langmuir 2000; 16:2052-2061.
- Shape of phospholipid/surfactant mixed micelles: cylinders or disks? Theoretical analysis. Kozlov MM, Lichtenberg D, Andelman D. J. Phys. Chem. B 1997; 101:6600–6606.
- Phase transitions between vesicles and micelles driven by competing curvature. Andelman D, Kozlov MM, Helfrich, W. Europhys. Lett. 1994; 25:231–236.
- Phase boundaries in mixtures of membrane-forming amphiphiles and micelle- forming amphiphiles. Lichtenberg D, Opatowski E, Kozlov MM. Biochim Biophys Acta. 2000; 1508(1-2):1-19.
- Intrinsic Curvature-Mediated Transbilayer Coupling in Asymmetric Lipid Vesicles. Eicher B, Marquardt D, Heberle FA, Letofsky-Papst I, Rechberger GN, Appavou MS, Katsaras J, Pabst G. Biophys J. 2018;114(1):146-157.
- Micelle to vesicle transition in aqueous solutions of bile salts and lecithin. Schurtenberger P, Mazer NA, Kanzig W. J. Phys. Chem. 1985; 89:1042–1059.
- Temperature-dependence of the solubilization of dipalmitoyl phosphatidylcholine (DPPC) by the non-ionic surfactant Triton X-100, kinetic and structural aspects. Schnitzer E, Lichtenberg D, Kozlov MM. Chem Phys Lipids. 2003; 126(1):55-76.
- The mechanism of detergent solubilization of liposomes and protein-containing membranes. Kragh-Hansen U, le Maire M, Møller JV. Biophys J. 1998; 75(6):2932-46.
- Two distinct mechanisms of vesicle-to-micelle and micelle-to-vesicle transition are mediated by the packing parameter of phospholipid-detergent systems. Stuart MC, Boekema EJ. Biochim Biophys Acta. 2007; 1768(11):2681-9.
- Mixed micelles and other structures in the solubilization of bilayer lipid membranes by surfactants. Almgren M. Biochim Biophys Acta. 2000; 1508(1-2):146-63.
- Solubilization of lecithin vesicles by C12E8-structural transitions and temperature effects. Edwards K, and Almgren M. J. Colloid Interface Sci. 1991; 147:1–21.
- Intermediate structures in the cholate-phosphatidylcholine vesicle-micelle transition. Walter A, Vinson PK, Kaplun A, Talmon Y. Biophys J. 1991; 60(6):1315-25.
- Studies on the molecular packing of mixed dispersions of Triton X-100 and sphingomyelin and its dependence on temperature and cloud point. Lichtenberg D, Yedgar S, Cooper G, Gatt S. Biochemistry. 1979; 18(12):2574-82.
- Lipid bilayers in the gel phase become saturated by Triton X-100 at lower surfactant concentrations than those in the fluid phase. Ahyayauch H, Collado MI, Alonso A, Goñi FM. Biophys J. 2012; 102(11):2510-6.
- Phosphorus NMR analysis of phospholipids in detergents. London E, Feigenson GW. J Lipid Res. 1979; 20(3):408-12.
- Cholesterol reverts Triton X-100 preferential solubilization of sphingomyelin over phosphatidylcholine: a 31P-NMR study. Ahyayauch H, Collado MI, Goñi FM, Lichtenberg D. FEBS Lett. 2009;583(17):2859-64.
- Thermodynamics of lipid membrane solubilization by sodium dodecyl sulfate. Keller S, Heerklotz H, Jahnke N, Blume A. Biophys J. 2006; 90(12):4509-21.
- Triton X-100 partitioning into sphingomyelin bilayers at subsolubilizing detergent concentrations: effect of lipid phase and a comparison with dipalmitoylphosphatidylcholine. Arnulphi C, Sot J, García-Pacios M, Arrondo JL, Alonso A, Goñi FM. Biophys J. 2007; 93(10):3504-14.
- The heat of transfer of lipid and surfactant from vesicles into micelles in mixtures of phospholipid and surfactant. Opatowski E, Lichtenberg D, Kozlov MM. Biophys J. 1997; 73(3):1458-67.
- Partitioning of octyl glucoside between octyl glucoside/phosphatidylcholine mixed aggregates and aqueous media as studied by isothermal titration calorimetry. Opatowski E, Kozlov MM, Lichtenberg D. Biophys J. 1997; 73(3):1448-57.
- Titration calorimetry of surfactant-membrane partitioning and membrane solubilization. Heerklotz H, Seelig J. Biochim Biophys Acta. 2000; 1508(1-2):69-85.
- Detergent effects on membranes at subsolubilizing concentrations: transmembrane lipid motion, bilayer permeabilization, and vesicle lysis/reassembly are independent phenomena. Ahyayauch H, Bennouna M, Alonso A, Goñi FM. Langmuir. 2010; 26(10):7307-13.
- Classifying surfactants with respect to their effect on lipid membrane order. Nazari M, Kurdi M, Heerklotz H. Biophys J. 2012; 102(3):498-506.
- Acceleration of phospholipid flip-flop in the erythrocyte membrane by detergents differing in polar head group and alkyl chain length. Pantaler E, Kamp D, Haest CW. Biochim Biophys Acta. 2000;1509(1-2):397-408.
- Vesicle-micelle transition of phosphatidylcholine and octyl glucoside elucidated by cryo-transmission electron microscopy. Vinson PK, Talmon Y, Walter A. Biophys J. 1989; 56(4):669-81.
- Structural phase transitions involved in the interaction of phospholipid bilayers with octyl glucoside. De la Maza A, Parra JL. Eur J Biochem. 1994; 226(3):1029-38.
- ‘Detergent-like’ permeabilization of anionic lipid vesicles by melittin. Ladokhin AS, White SH. Biochim Biophys Acta. 2001; 1514(2):253-60.
- Solubilization of phospholipid bilayers by surfactants belonging to the Triton X series: effect of polar group size. Partearroyo MA, Alonso A, Goñi FM , Tribout M, Paredes S. J. Colloid Interface Sci. 1996; 178:156–159.
- Triton X-100-resistant bilayers: effect of lipid composition and relevance to the raft phenomenon. Sot J, Collado MI, Arrondo JLR , Alonso A, and Goñi FM. Langmuir 2002; 18:2828–2835.
- Loading of preformed liposomes with high trapping efficiency by detergent- induced formation of transient membrane holes. Schubert R, Wolburg H, Schmidt KH, Roth HJ. Chem Phys Lipids. 1991; 58:121-129.
- Early and delayed stages in the solubilization of purple membrane by a polyoxyethylenic surfactant. Viguera AR, González-Mañas JM, Taneva S, Goñi FM. Biochim Biophys Acta. 1994; 1196(1):76-80.
- Interaction of detergents with lipid vesicles. Lasch J. Biochim Biophys Acta. 1995; 1241(2):269-92.
- Titration calorimetry of surfactant-membrane partitioning and membrane solubilization. Heerklotz H, Seelig J. Biochim Biophys Acta. 2000; 1508(1-2):69-85.
- Kinetic studies on the interaction of phosphatidylcholine liposomes with Triton X-100. Alonso A, Urbaneja MA, Goñi FM, Carmona FG, Cánovas FG, Gómez- Fernández JC. Biochim Biophys Acta. 1987; 902(2):237-46.
- The effect of cholesterol on the solubilization of phosphatidylcholine bilayers by the non-ionic surfactant Triton X-100. Schnitzer E, Kozlov MM, Lichtenberg D. Chem Phys Lipids. 2005; 135(1):69-82.
- Cholesterol precipitation from cholesterol-supersaturated bile models. Fudim- Levin A, Bor A, Kaplun A, Talmon Y, Lichtenberg D. Biochim Biophys Acta 1995; 1259(1):23-8.
- Stability of mixed micellar bile models supersaturated with cholesterol. Lichtenberg D, Ragimova S, Bor A, Almog S, Vinkler C, Kalina M, Peled Y, Halpern Z. Biophys J. 1988; 54(6):1013-25.
- Stability of mixed micellar systems made by solubilizing phosphatidylcholine- cholesterol vesicles by bile salts. Lichtenberg D, Ragimova S, Bor A, Almog S, Vinkler C, Peled Y, Halpern Z. Hepatology. 1990; 12(3 Pt 2):149S-153S; discussion 153S-154S.
- Binding of a nonionic detergent to membranes: flip-flop rate and location on the bilayer. Le Maire M, Møller JV, Champeil P. Biochemistry. 1987; 26(15):4803-10.
- Influence of the level of ceramides on the permeability of stratum corneum lipid liposomes caused by a C12-betaine/sodium dodecyl sulfate mixture. Cócera M, Lopez O, Coderch L, Parra JL, de la Maza A. Int J Pharm. 1999; 183(2):165-73.
- Membrane stress and permeabilization induced by asymmetric incorporation of compounds. Heerklotz H. Biophys J. 2001; 81(1):184-95.
- Solubilization of lipid bilayers by myristyl sucrose ester: effect of cholesterol and phospholipid headgroup size. Toro C, Sanchez SA, Zanocco A, Lemp E, Gratton E, Günther G. Chem Phys Lipids. 2009; 157(2):104-12.
- Solubilization mechanism of vesicles by surfactants: effect of hydrophobicity. Lin CM, Chang GP, Sheng YJ. J. Chem. Phys. 2011; 135:045102.
- Phase boundaries in mixtures of membrane-forming amphiphiles and micelle- forming amphiphiles. Lichtenberg D, Opatowski E, Kozlov MM. Biochim Biophys Acta. 2000; 1508(1-2):1-19.
- States of aggregation and phase transformations in mixtures of phosphatidylcholine and octyl glucoside. Almog S, Litman BJ, Wimley W, Cohen J, Wachtel EJ, Barenholz Y, Ben-Shaul A, Lichtenberg D. Biochemistry. 1990; 29(19):4582-92.
- Lysis and reassembly of sonicated lecithin vesicles in the presence of Triton X-100. Alonso A, Villena A, Goñi FM. FEBS Lett. 1981; 123(2):200-4.
- Increase in size of sonicated phospholipid vesicles in the presence of detergents. Alonso A, Sáez R, Villena A, Goñi FM. J Membr Biol. 1982; 67(1):55-62.
- Effect of calcium on kinetic and structural aspects of dilution-induced micellar to lamellar phase transformation in phosphatidylcholine-cholate mixtures. Almog S, Lichtenberg D. Biochemistry. 1988; 27(3):873-80.
- Structural characterization of the micelle-vesicle transition in lecithin-bile salt solutions. Long MA, Kaler EW, Lee SP. Biophys J. 1994; 67(4):1733-42.
- Size disproportionation in vesicular dispersions. Johnson NW, Kaler EW. J. Colloid Interface Sci. 1987; 116:444–457.
- The vesicle-to-micelle transformation of phospholipid-cholate mixed aggregates: a state of the art analysis including membrane curvature effects. Elsayed MM, Cevc G. Biochim Biophys Acta. 2011; 1808(1):140-53.
- Use of simple kinetic and reaction-order measurements for the evaluation of the mechanism of surfactant-liposome interactions. Velluto D, Gasbarri C, Fontana A. J. Phys. Chem. B. 2011; 115:8130–8137.
- From discoid micelles to spherical vesicles. The concept of edge activity. Fromherz P, Rocker C, Ruppel D. Faraday Discuss. Chem. Soc. 1986; 81:39–48.
- A molecular model for vesicle formation. Lasic DD. Biochim Biophys Acta. 1982; 692(3):501-2.
- The mechanism of vesicle formation. Lasic DD. Biochem. J. 1988; 256:1-11.
- Solubilization of phospholipids by detergents. Structural and kinetic aspects. Lichtenberg D, Robson RJ, Dennis EA. Biochim Biophys Acta. 1983; 737(2):285-304.
- Effects of Triton X-100 on sonicated lecithin vesicles. Edwards K, Almgren M, Brown W. Langmuir. 1989; 5:473–478.
- Curvature factor and membrane solubilization, with particular reference to membrane rafts. Mrówczyńska L, Salzer U, Iglič A, Hägerstrand H. Cell Biol Int. 2011 Oct;35(10):991-5.
- Surfactant effects of chlorpromazine and imipramine on lipid bilayers containing sphingomyelin and cholesterol. Ahyayauch H, Requero MA, Goni FM. J. Colloid Interface Sci. 2002; 256:284–289.
- Structural changes induced by Triton X-100 on sonicated phosphatidylcholine liposomes. Urbaneja MA, Goñi FM, Alonso A. Eur J Biochem. 1988; 173(3):585-8.
- Solubilization of liposomes by sodium dodecyl sulfate: new mechanism based on the direct formation of mixed micelles. López O, Keller M, Wehrli E, Parra JL, de la Maza A. Arch Biochem Biophys. 1999; 367(2):153-60.
- Process of destruction of large unilamellar vesicles by a zwitterionic detergent, CHAPS: partition behavior between membrane and water phases. Viriyaroj A, Kashiwagi H, Ueno M. Chem Pharm Bull (Tokyo). 2005; 53(9):1140-6.
- Thermodynamics of sodium dodecyl sulfate partitioning into lipid membranes. Tan A, Ziegler A, Steinbauer B, Seelig J. Biophys J. 2002; 83(3):1547-56.
- Reconstitution in liposome bilayers enhances nucleotide binding affinity and ATP-specificity of TrwB conjugative coupling protein. Vecino AJ, Segura RL, Ugarte- Uribe B, Aguila S, Hormaeche I, de la Cruz F, Goñi FM, Alkorta I. Biochim Biophys Acta. 2010; 1798(11):2160-9.
- Membrane solubilization by detergent: use of brominated phospholipids to evaluate the detergent-induced changes in Ca2+-ATPase/lipid interaction. De Foresta B, le Maire M, Orlowski S, Champeil P, Lund S, Møller JV, Michelangeli F, Lee AG. Biochemistry. 1989; 28(6):2558-67.
- Membrane-perturbing effect of fatty acids and lysolipids. Arouri A, Mouritsen OG. Prog Lipid Res. 2013; 52(1):130-40.
- Observing the solubilization of lipid bilayers by detergents with optical microscopy of GUVs. Sudbrack TP, Archilha NL, Itri R, Riske KA. J Phys Chem B. 2011; 115(2):269-77.
- Detergent solubilisation of phospholipid bilayers in the gel state: the role of polar and hydrophobic forces. Patra SK, Alonso A, Goñi FM. Biochim Biophys Acta. 1998; 1373(1):112-8.
- Liposomes containing sphingomyelin and cholesterol: detergent solubilisation and infrared spectroscopic studies. Patra SK, Arrondo JL, Alonso A, Goni FM. J. Liposome Res. 1999; 9, 247–260.
- Solubilization of supported lipid membranes by octyl glucoside observed by time-lapse atomic force microscopy. Morandat S, El Kirat K. Colloids Surf. B: Biointerfaces 2007; 55, 179–184.
- Triton promotes domain formation in lipid raft mixtures. Heerklotz H. Biophys J. 2002; 83(5):2693-701.
- Cholesterol homeostasis and the escape tendency (activity) of plasma membrane cholesterol. Lange Y, Steck TL. Prog Lipid Res. 2008; 47(5):319-32.
- Sphingomyelin and cholesterol: from membrane biophysics and rafts to potential medical applications. Barenholz Y. Subcell Biochem. 2004; 37:167-215.
- Temperature dependence of Triton X-100 micelle size and hydration. Streletzky K, Phillies GD. Langmuir 1995; 11, 42–47.
- Size and shape of detergent micelles determined by small-angle X-ray scattering. Lipfert J, Columbus L, Chu VB, Lesley SA, Doniach S. J Phys Chem B. 2007; 111(43):12427-38.
- Functional rafts in cell membranes. Simons K, Ikonen E. Nature. 1997; 387(6633):569-72.
- Model systems, lipid rafts, and cell membranes. Simons K, Vaz WL. Annu Rev. Biophys Biomol Struct. 2004;33:269-95.
- Lipid rafts and signal transduction. Simons K, Toomre D. Nat Rev Mol Cell Biol. 2000; 1(1):31-9.
- Association of GAP-43 with detergent-resistant membranes requires two palmitoylated cysteine residues. Arni S, Keilbaugh SA, Ostermeyer AG, Brown DA. J Biol Chem. 1998; 273(43):28478-85.
- Phase equilibria in the phosphatidylcholine-cholesterol system. Ipsen JH, Karlström G, Mouritsen OG, Wennerström H, Zuckermann MJ. Biochim Biophys Acta. 1987; 905(1):162-72.
- Interaction of influenza virus haemagglutinin with sphingolipid-cholesterol membrane domains via its transmembrane domain. Scheiffele P, Roth MG, Simons K. EMBO J. 1997;16(18):5501-8.
- Selective solubilization of proteins and phospholipids from red blood cell membranes by nonionic detergents. Yu J, Fischman DA, Steck TL. J Supramol Struct. 1973; 1(3):233-48.
- Ectoenzymes of the kidney microvillar membrane. Differential solubilization by detergents can predict a glycosyl-phosphatidylinositol membrane anchor. Hooper NM, Turner AJ. Biochem J. 1988; 250(3):865-9.
- Sorting of GPI-anchored proteins to glycolipid-enriched membrane subdomains during transport to the apical cell surface. Brown DA, Rose JK. Cell. 1992; 68(3):533-44.
- Both sphingolipids and cholesterol participate in the detergent insolubility of alkaline phosphatase, a glycosylphosphatidylinositol-anchored protein, in mammalian membranes. Hanada K, Nishijima M, Akamatsu Y, Pagano RE. J Biol Chem. 1995; 270(11):6254-60.
- The differential miscibility of lipids as the basis for the formation of functional membrane rafts. Rietveld A, Simons K. Biochim Biophys Acta. 1998; 1376(3):467-79.
- Permeability and integrity properties of lecithin-sphingomyelin liposomes. Hertz R, Barenholz Y. Chem Phys Lipids. 1975;15(2):138-56.
- Interaction of cholesterol with sphingomyelin in mixed membranes containing phosphatidylcholine, studied by spin-label ESR and IR spectroscopies. A possible stabilization of gel-phase sphingolipid domains by cholesterol. Veiga MP, Arrondo JL, Goñi FM, Alonso A, Marsh D. Biochemistry. 2001;40(8):2614-22.
- Effect of the structure of natural sterols and sphingolipids on the formation of ordered sphingolipid/sterol domains (rafts). Comparison of cholesterol to plant, fungal, and disease-associated sterols and comparison of sphingomyelin, cerebrosides, and ceramide. Xu X, Bittman R, Duportail G, Heissler D, Vilcheze C, London E. J Biol Chem. 2001; 276(36):33540-6.
- Cholesterol–phospholipid interactions, the liquid-ordered phase and lipid rafts in model and biological membranes. McMullen TP, Lewis RN, McElhaney RN. Curr. Opin. Colloid Interface Sci. 2004; 8: 459–468.
- Lipid/detergent interaction thermodynamics as a function of molecular shape. Heerklotz H, Binder H, Lantzsch G, Klose G, Blume A. J. Phys. Chem. B 1997; 101, 639–645.
- The interaction of phosphatidylcholine bilayers with Triton X-100. Goñi FM, Urbaneja MA, Arrondo JL, Alonso A, Durrani AA, Chapman D. Eur J Biochem. 1986; 160(3):659-65.
- The sensitivity of lipid domains to small perturbations demonstrated by the effect of Triton. Heerklotz H, Szadkowska H, Anderson T, Seelig J. J Mol Biol. 2003; 329(4):793-9.
- In situ imaging of detergent-resistant membranes by atomic force microscopy. Giocondi MC, Vié V, Lesniewska E, Goudonnet JP, Le Grimellec C. J Struct Biol. 2000; 131(1):38-43.
- Insolubility of lipids in triton X-100: physical origin and relationship to sphingolipid/cholesterol membrane domains (rafts). London E, Brown DA. Biochim Biophys Acta. 2000; 1508(1-2):182-95.
- Resistance of cell membranes to different detergents. Schuck S, Honsho M, Ekroos K, Shevchenko A, Simons K. Proc Natl Acad Sci U S A. 2003; 100(10):5795-800.
- Insights into the association of FcgammaRII and TCR with detergent-resistant membrane domains: isolation of the domains in detergent-free density gradients facilitates membrane fragment reconstitution. Korzeniowski M, Kwiatkowska K, Sobota A. Biochemistry. 2003; 42(18):5358-67.
- Location is everything: lipid rafts and immune cell signaling. Dykstra M, Cherukuri A, Sohn HW, Tzeng SJ, Pierce SK. Annu Rev Immunol. 2003; 21:457-81.
- Triton X-100 solubilization of mitochondrial inner and outer membranes. Gurtubay JI, Goñi FM, Gómez-Fernández JC, Otamendi JJ, Macarulla JM. J Bioenerg Biomembr. 1980; 12(1-2):47-70.
- Effect of the nonionic detergent Triton X-100 on mitochondrial succinate- oxidizing enzymes. Barbero MC, Valpuesta JM, Rial E, Gurtubay JI, Goñi FM, Macarulla JM. Arch Biochem Biophys. 1984; 228(2):560-8.
- Physiological state of submitochondrial particles and their susceptibility to Triton X-100. Goñi FM, Valpuesta JM, Barbero MC, Rial E, Gurtubay JI, Macarulla JM. Experientia. 1984; 40(2):193-5.
- Protein–lipid interactions. A study of (Ca2+-Mg2+)ATPase reconstituted with synthetic phospholipids. Gómez-Fernández JC, Goñi FM, Bach D, Restall C, Chapman D. FEBS Lett. 1979; 98(2):224-8.
- A comparative study of the effect of various detergents on the structure and function of sarcoplasmic reticulum vesicles. Villalaín J, Goñi FM, Macarulla JM. Mol Cell Biochem. 1982; 49(2):113-8.
- Membrane-surfactant interactions. The effect of Triton X-100 on sarcoplasmic reticulum vesicles. Prado A, Arrondo JL, Villena A, Goñi FM, Macarulla JM. Biochim Biophys Acta. 1983; 733(1):163-71.
- Solubilization of sarcoplasmic reticulum membranes by sodium dodecylsulphate. A Fourier-transform infrared spectroscopic study. Prado A, Muga A, Castresana J, Goñi FM, Arrondo JL. FEBS Lett. 1990; 269(2):324-7.
- Interaction of membrane proteins and lipids with solubilizing detergents. le Maire M, Champeil P, Moller JV. Biochim Biophys Acta. 2000; 1508(1-2):86-111.
- The interaction of Triton X-100 with purple membranes. Detergent binding, spectral changes and membrane solubilization. González-Mañas JM, Virto MD, Gurtubay JI, Goñi FM. Eur J Biochem. 1990; 188(3):673-8.
- Kinetics of purple membrane dark-adaptation in the presence of Triton X-100. González-Mañas JM, Goñi FM, Tribout M, Paredes S. Arch Biochem Biophys. 1990; 282(2):239-43.
- On the mechanism of bacteriorhodopsin solubilization by surfactants. Del Río E, González-Mañas JM, Gurtubay JI, Goñi FM. Arch Biochem Biophys. 1991; 291(2):300-6.
- The role of amphiphiles in model and cell membrane fusion. Prado A, Partearroyo MA, Nieva JL, Alonso A, Goñi FM. Prog Clin Biol Res. 1990; 343:103-16.
- Surfactant enhancement of polyethyleneglycol-induced cell fusion. Prado A, Partearroyo MA, Mencía M, Goñi FM, Barberá-Guillem E. FEBS Lett. 1989; 259(1):149-52.
- Effective detergent/lipid ratios in the solubilization of phosphatidylcholine vesicles by Triton X-100. Partearroyo MA, Urbaneja MA, Goñi FM. FEBS Lett. 1992; 302(2):138-40.
- The influence of membrane composition on the solubilizing effects of Triton X-100. Urbaneja MA, Nieva JL, Goñi FM, Alonso A. Biochim Biophys Acta. 1987; 904(2):337-45.
- Detergent solubilization of phosphatidylcholine bilayers in the fluid state: influence of the acyl chain structure. Ahyayauch H, Larijani B, Alonso A, Goñi FM. Biochim Biophys Acta. 2006; 1758(2):190-6.
- Detergent solubilization of phospholipid vesicle. Effect of electric charge. Urbaneja MA, Alonso A, Gonzalez-Mañas JM, Goñi FM, Partearroyo MA, Tribout M, Paredes S. Biochem J. 1990; 270(2):305-8.
- Fast and slow biomembrane solubilizing detergents: Insights into their mechanism of action. Lete MG, Monasterio BG, Collado MI, Medina M, Sot J, Alonso A, Goñi FM. Colloids Surf B Biointerfaces. 2019; 183:110430.
- Detergent-resistant, ceramide-enriched domains in sphingomyelin / ceramide bilayers. Sot J, Bagatolli LA, Goñi FM, Alonso A. Biophys J. 2006; 90(3):903-14.
- The onset of Triton X-100 solubilization of sphingomyelin/ceramide bilayers: effects of temperature and composition. Ahyayauch H, Arnulphi C, Sot J, Alonso A, Goñi FM. Chem Phys Lipids. 2013; 167-168:57-61.
- High-melting lipid mixtures and the origin of detergent-resistant membranes studied with temperature-solubilization diagrams. Sot J, Manni MM, Viguera AR, Castañeda V, Cano A, Alonso C, Gil D, Valle M, Alonso A, Goñi FM. Biophys J. 2014; 107(12):2828-2837.
- Handbook of detergents, part E: applications. U. Zoller. Surfactant Science Series, vol. 141 CRC Press, Boca Raton, FL, USA, 2009.
- Effect of detergents and other amphiphiles on the stability of pharmaceutical drugs. AG Oliveira, H Chaimovich. J Pharm Pharmacol 1993; 45:850-861.
- Liquid Detergents. Kuo-Yann Lai, Surfactant Science Series, vol. 129 CRC Press, Boca Raton, FL, USA, 2005.
- Biosurfactants: Multifunctional Biomolecules of the 21st Century. Khadydja D, Santos F, Rufino RD, Luna JM, Santos VA, Sarubbo LA. Int J Mol Sci. 2016; 17(3):401.
- Biosurfactants, natural alternatives to synthetic surfactants: Physicochemical properties and applications. Jahan R, Bodratti AM, Tsianou M, Alexandridis P. Advances in Colloid and Interface Science. 2020; 275:102061.