1. INTRODUCCIÓN
La Antártida es conocida como el continente más alto, más frío, más seco y más ventoso del mundo. Efectivamente, su altura media supera los 2000 m, debido a que el continente en sí está cubierto por un caparazón de hielo de unos dos kilómetros y medio de espesor. Además, en esta inmensa y elevada meseta helada se ha registrado el record de frío en la superficie de nuestro planeta; -93 ºC. La precipitación media, naturalmente en forma de nieve, es, en la mayor parte de la Antártida, similar a la del desierto del Sahara. Por último, desde el interior del continente, furiosos vientos catabáticos se desploman hacia la costa, superando con frecuencia los 300 km/h. Estas condiciones extremas, que sugieren ambientes marcianos, parecen incompatibles con la vida y en gran medida, lo son. Afortunadamente, hay épocas y lugares menos hostiles que ofrecen una oportunidad para la supervivencia. Durante el verano antártico la temperatura en las zonas costeras se aproxima o incluso llega a superar el punto de congelación y existen numerosos lugares en la vertiente occidental de la Península Antártica o en islas cercanas, expuestos a los relativamente templados y muy húmedos vientos procedentes del oeste, donde la precipitación llega a superar los 700 mm anuales, lo que supone un ambiente hiperhúmedo para estas latitudes (1).
Pero, independientemente del clima, la vida vegetal en la Antártida sólo es posible en el escaso 0,5% del continente descubierto de hielo. Para una extensión de 14 millones de kilómetros cuadrados, esto supone que la vida queda restringida a unos 70.000 km2, una extensión similar a Andalucía, aunque intensamente fragmentada en un rosario de minúsculas localidades costeras y nunataks que orla el continente. La zona más extensa libre de hielos, pero también la más inhóspita, son los Valles Secos de la región de McMurdo, que alcanzan los 14.000 km2 (2).
Así pues, la vida vegetal antártica está condicionada tanto por factores climáticos extremos, como por la acusada fragmentación de hábitat. Los avances recientes en biología molecular nos permiten explorar las relaciones filogeográficas entre poblaciones aisladas y determinar su origen y sus migraciones a través de los avatares climáticos y geológicos ocurridos desde tiempos remotos (3). Por otra parte, las técnicas de ecofisiología, perfeccionadas en las últimas décadas, ofrecen la oportunidad de conocer el funcionamiento vegetal de forma continua, automática y en su ambiente natural, incluso bajo las condiciones más extremas (4).
2. LA FLORA ANTÁRTICA; DIVERSIDAD Y PATRONES DE DISTRIBUCIÓN
A pesar de las restricciones geográficas y climáticas, la vida vegetal (líquenes y musgos) en la Antártida se encuentra hasta en los afloramientos rocosos más meridionales, a 87º S (5). Sin embargo, la mayoría de los vegetales antárticos se concentran en zonas mucho menos extremas y relativamente templadas, fundamentalmente en la región denominada Antártida marítima, que comprende la costa noroccidental de la Península Antártica y las islas cercanas (Fig. 1). Aquí la temperatura media durante el verano llega a superar en dos o tres grados el punto de congelación y llueve con relativa frecuencia. Los inviernos son fríos, naturalmente, pero no tanto como en regiones árticas de similar latitud. El paisaje es, sin embargo, típicamente antártico. La falta de calor en verano impide casi por completo el desarrollo de plantas vasculares y favorece la formación de enormes glaciares que se extienden hasta la costa. En los reducidos espacios que quedan libres de hielo se concentran grandes colonias de focas y pingüinos, las más diversas y abundantes comunidades vegetales de toda la Antártida y unas 20 bases científicas de 12 países, entre ellas las dos españolas situadas en Isla Livingston (Juan Carlos I) e Isla Decepción (Gabriel de Castilla).
A pesar de la relativa templanza de la Antártida marítima, sólo dos especies de plantas vasculares, Deschampsia antarctica (Poaceae) y Collobanthus quitensis (Caryophyllaceae) han logrado establecerse en este rincón antártico. Por el contrario, hasta 350 de las aproximadamente 400 especies de líquenes antárticos conocidos viven en esta zona, junto a la mayor parte del cerca del centenar de especies de musgos (6, 7) (Fig. 1). Suelo y roca aparecen con frecuencia completamente recubiertos por estos vegetales poiquilohídricos. El húmedo ambiente oceánico les permite mantenerse hidratados y activos durante muchos días al año, lo que explica sus tasas de crecimiento relativamente elevadas a pesar de las bajas temperaturas (8). Cuando penetramos hacia el continente dos factores confluyen para dificultar de forma drástica la capacidad de supervivencia de la vegetación: La sequedad y el frío extremo. Grupos enteros de líquenes, como todos aquellos que forman simbiosis con cianobacterias, están por completo ausentes en la Antártida continental. Aquí, las localidades más ricas no superan el centenar de especies entre líquenes y musgos, aunque lo normal es que no lleguen ni a 50 (9, 10). La biomasa de estas comunidades es hasta 100 veces inferior a la de la Antártida marítima y además están muy localizadas; la mayor parte de los afloramientos rocosos del continente antártico aparecen prácticamente desprovistos de cubierta vegetal.
Figura 1: Número de especies de líquenes (rojo) y musgos (negro) en diferentes regiones de la Antártida.
Durante un tiempo se pensó que la flora antártica, especialmente en lo que se refiere a los líquenes, estaba compuesta en su mayor parte (ca. 80%) por especies endémicas. Hoy sabemos que la situación es más equilibrada. Aproximadamente la mitad de las especies de musgos y líquenes antárticos pueden encontrarse también en el Hemisferio Norte, bien en zonas polares o alpinas (flora bipolar), bien en ambientes diversos no necesariamente ligados al frío (flora cosmopolita). La otra mitad se reparte entre especies de distribución austral (comunes a los extremos continentales e islas del Hemisferio Sur) y especies propiamente antárticas, que no suponen mucho más del 35% sobre el total. Estas proporciones se mantienen tanto en la Antártida marítima como en la Antártida continental (11).
3. LA VIDA EN EL LÍMITE
El continente antártico, ventoso, seco y muy frío, es sin duda una auténtica frontera para la vida, pero incluso en este ambiente en general inhóspito hay grados y matices. En el inmenso desierto helado se producen a veces sorprendentes concentraciones de especies de líquenes y musgos en ciertos roquedos, con una extensión de tan solo algunos cientos de metros cuadrados. Son los denominados microoasis antárticos (12), un nombre de lo más adecuado, ya que su presencia depende fundamentalmente de la disponibilidad de agua líquida. Pero, ¿cómo obtener agua líquida cuando la temperatura del aire se mantiene varios grados bajo cero, incluso en verano? La respuesta está en la intensa radiación solar, reforzada en ciertas orientaciones por la radiación reflejada desde el mar helado o la nieve. Las laderas y acantilados costeros con exposición norte son las zonas adecuadas para que se produzcan microoasis. Durante el verano la radiación solar incide directamente durante más de doce horas, lo que da lugar a la lenta fusión de los frentes de nieve y la formación de escorrentías y riachuelos que funcionan durante algunas horas, para congelarse de nuevo cuando quedan sombreados. En estas localidades, musgos y líquenes compiten intensamente por el espacio, imponiéndose los musgos en los lugares con mayor disponibilidad de agua y los líquenes en los más secos (13). Por supuesto, se encuentran todo tipo de situaciones intermedias.
Es interesante señalar que hemos encontrado evidencias de que el tiempo de reactivación metabólica después del largo invierno polar es proporcional a la disponibilidad de agua en cada localidad. De esta forma, los líquenes de los lugares más secos y expuestos alcanzan sus óptimos fotosintéticos solo dos horas después de la rehidratación, tras diez meses de inactividad. Sin embargo, los musgos, que viven en zonas largo tiempo inundadas, necesitan 24 horas de actividad para volver a alcanzar su óptimo fotosintético. Así, los líquenes muestran una buena adaptación a eventos esporádicos de hidratación, a los que responden con rapidez, mientras que los musgos necesitan vivir en condiciones más estables (14).
Sin embargo, el mantenimiento de actividad metabólica en los musgos durante días o semanas les expone a los dañinos efectos de la radiación ultravioleta, especialmente intensa en la Antártida continental, donde todas las primaveras se produce el conocido agujero de ozono. Como cabría esperar, los musgos más expuestos al sol muestran un alto porcentaje de absorción de luz UV, muy superior a los talos de sombra. Pero cuando individuos de zonas sombreadas se exponen al sol la eficiencia de su escudo UV aumenta hasta alcanzar valores máximos al cabo de una semana. Esta respuesta parece estar claramente inducida por la incidencia directa del sol, lo que supone una activa capacidad de aclimatación de estos organismos al ambiente lumínico (15).
Los microoasis forman un collar de joyas vivas que circunda todo el continente antártico y que penetran hasta latitudes muy altas a través de las Montañas Transantárticas. Hay una región, sin embargo, en la que incluso estas mínimas fuentes de hidratación están ausentes. Se trata de los Valles Secos, la zona más inhóspita de la Antártida, donde la vida retrocede hasta rincones insospechados. La precipitación es aquí inferior a 50 mm anuales, similar a la del centro del Sahara, la temperatura nunca supera el punto de congelación y a pesar de ello, la humedad relativa se sitúa alrededor del 25 %. La sequedad es tal, que el hielo de los glaciares que penetran en estos valles se sublima, creando frentes muy netos y estables, colgados a mitad de ladera. Nada parece ser capaz de sobrevivir en este desierto de polvo y rocas esculpidas por el viento. Algunos cadáveres de focas momificadas nos recuerdan que incluso los microorganismos descomponedores escasean (16). Pero la vida, lejos de estar ausente, aparece por doquier, sólo que no se ve a simple vista. Para encontrarla es preciso romper las rocas de granito o arenisca y entonces descubrimos una capa verde a algunos milímetros por debajo de la superficie. Son asociaciones simbióticas de algas, hongos y bacterias (líquenes s.l.) que forman una de las comunidades microbianas más extraordinarias de nuestro planeta (17, 18).
En el interior de las rocas las extremas condiciones ambientales se atemperan, al menos durante los meses de verano. En este microhábitat la temperatura puede superar los 15 ºC en un día soleado, ligeras nevadas estivales actúan como fuente de humedad, que en los intersticios rocosos se mantiene durante más tiempo y la estructura cristalina de estas rocas permite el paso de suficiente luz para la fotosíntesis hasta 1 cm por debajo de la superficie. Un pequeño invernadero natural en el que de vez en cuando se consigue un ambiente muy adecuado para la actividad biológica.
Los científicos empeñados en la búsqueda de vida en Marte se han inspirado en estos “líquenes” endolíticos para diseñar sus experimentos. Los astrobiólogos que intentan encontrar formas de vida terrestres capaces de resistir la exposición a las condiciones del espacio exterior, utilizan estos organismos extremófilos como objeto preferente para futuros vuelos espaciales. Los biólogos moleculares tratan de descubrir las secuencias genéticas relacionadas con su increíble resistencia a condiciones extremas (19).
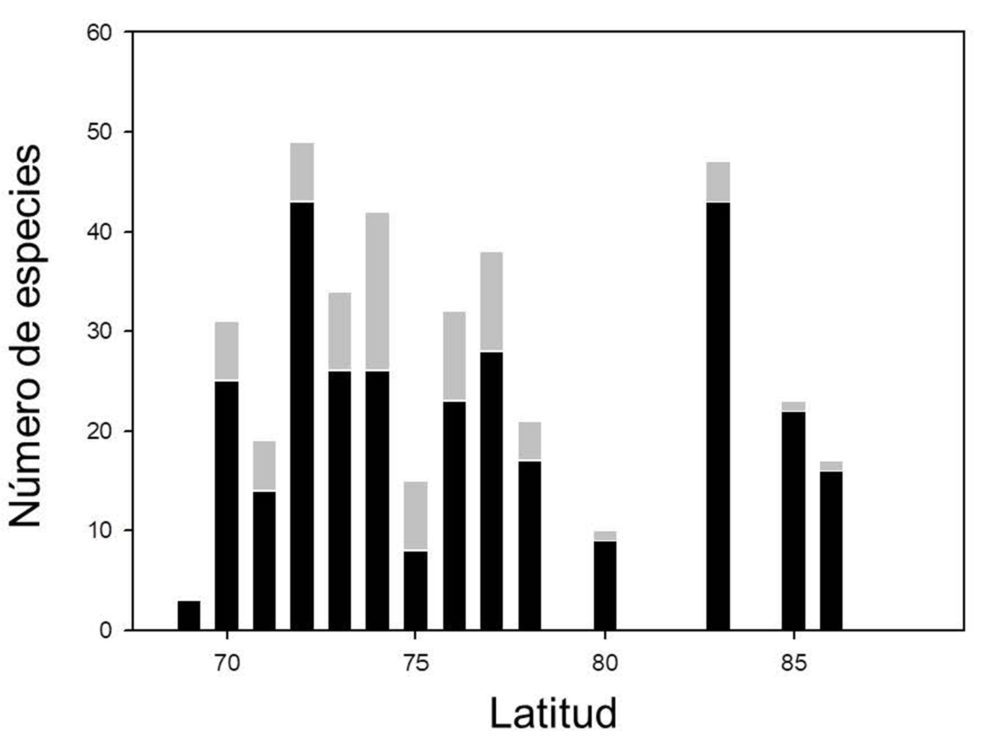
Figura 2: Número de especies encontradas a lo largo de las Montañas Transantárticas, en un gradiente latitudinal desde 69 a 86 ºS.
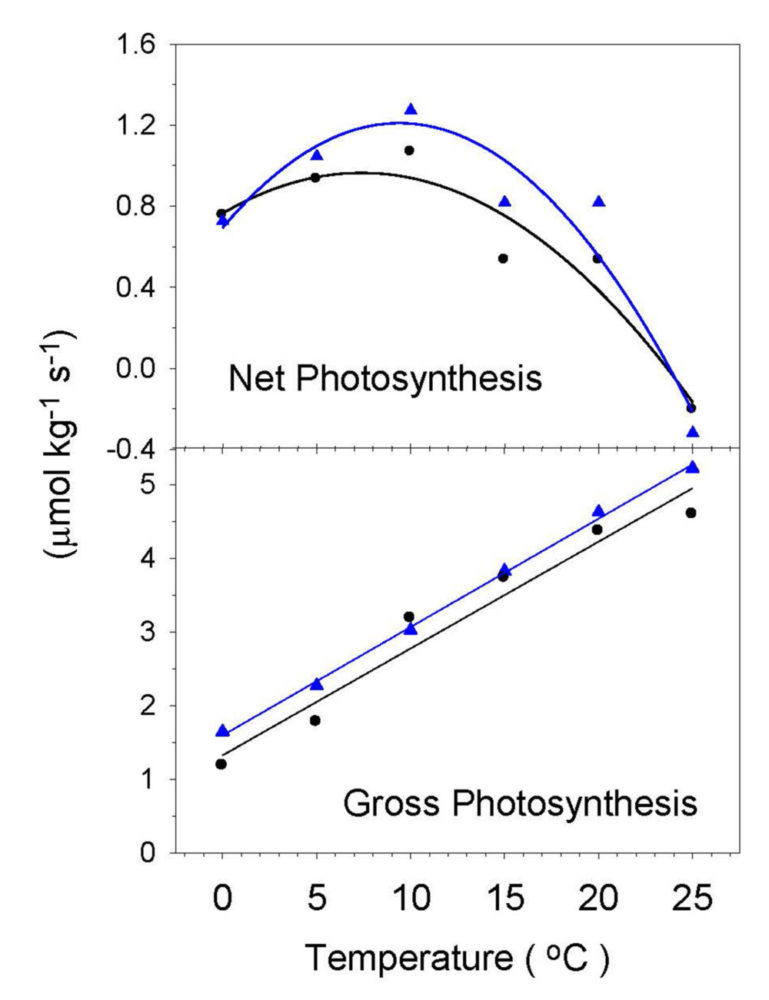
En lo más profundo de las Montañas Transantárticas, a sólo unos centenares de kilómetros del Polo Sur, se encuentran las localidades más meridionales con vida vegetal de nuestro planeta (Fig. 2). Aquí la nieve es abundante y las precipitaciones durante el verano ocurren con frecuencia. Los frentes de nieve en lenta fusión van hidratando brevemente las rocas, sobre las que se desarrollan unas 35 especies de líquenes y un musgo (Schistidium antarctici) (9). Muchas de ellas tienen una amplia distribución y es posible comparar el comportamiento fotosintético de poblaciones muy distantes. Así (Fig. 3) Umbilicaria decussata de Mount Kyffin (83º 45’S) muestra óptimos fotosintéticos a una temperatura similar (5-10 ºC) que la población de Isla Livingston (62º40’S), lo que descarta que exista adaptación de la simbiosis liquénica a las condiciones térmicas ambientales y más bien supone que las características microclimáticas de cada localidad atemperan los gradientes climáticos regionales.
Figura 3: Fotosíntesis neta y fotosíntesis bruta medida en el liquen Umbilicaria decusata a diferente temperatura en muestras procedentes de Isla Livingston (63 ºS), triángulos, y Mount Kyffin (84 ºS), círculos.
4. RELACIÓN ENTRE PRODUCTIVIDAD VEGETAL Y FACTORES CLIMÁTICOS
En la Antártida encontramos gradientes extremos de temperatura en función de la latitud. Hacia los 63 ºS, en la Península Antártica y archipiélago Shetland del Sur, la temperatura media anual es de alrededor de -2 ºC; en la misma Península Antártica, pero a 67 ºS, la temperatura media baja a -5,3 ºC; aún más al sur, en el borde continental, en la región de Cape Hallett, la media anual es de -14 ºC, mientras en los Valles Secos, a 77 ºS, se desploma hasta -20 ºC. En pleno casquete polar, en el Domo Concordia o en el Polo sur, a unos 3000m de altura, la temperatura media llega a los -50 ºC, pero aquí ya no hay afloramientos rocosos y por lo tanto, no existe la vida terrestre. Al mismo tiempo, también encontramos marcados contrastes en cuanto a la precipitación, desde los más de 700 mm al año en las Shetland del Sur, hasta los menos de 50 mm de los Valles Secos. Es de esperar que factores climáticos tan variables ejerzan una poderosa influencia en la vegetación y así sucede.
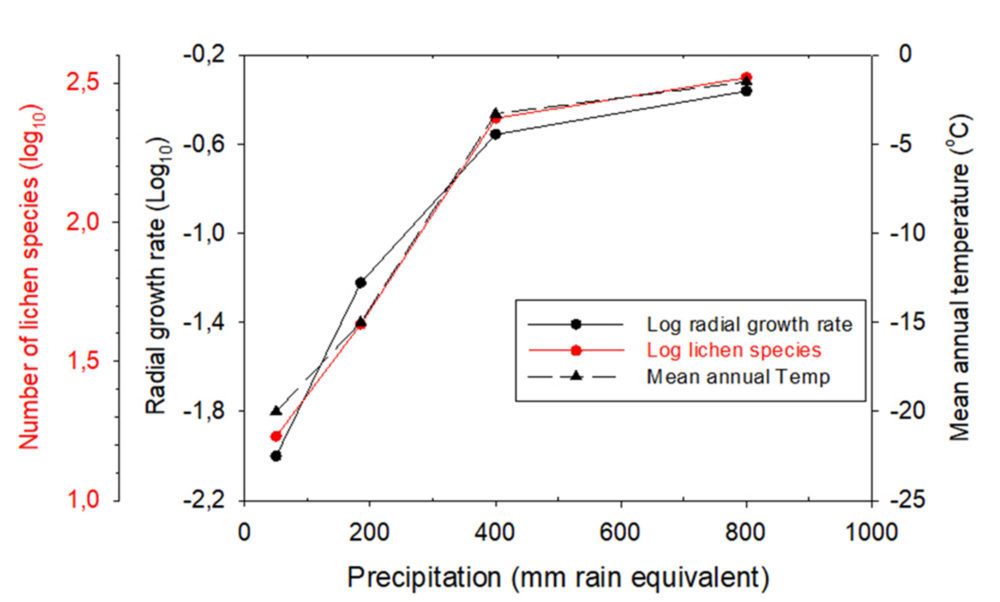
Los sencillos ecosistemas terrestres de la Antártida, en comparación con otros continentes, ofrecen una excelente oportunidad para mostrar la relación entre los parámetros ecológicos y ambientales, que opera a nivel global. En las regiones más húmedas y cálidas del extremo septentrional de la Península Antártica se reúnen la mayoría de las más de 500 especies de líquenes y musgos conocidas para toda la Antártida. Esta riqueza en especies va disminuyendo con la latitud, hasta alcanzar un mínimo en las Montañas Transantárticas, especialmente en la zona de los Valles Secos. Pero lo más interesante es que al mismo tiempo observamos una disminución en las tasas de crecimiento anual de los líquenes, que van desde los 0,8 mm anuales de aumento en diámetro, hasta los 0,02mm. La correlación entre crecimiento, temperatura y precipitación a lo largo del gradiente latitudinal es casi perfecta (Fig. 4); difícilmente podrá encontrarse otra mejor en alguna parte del mundo (20). Esta correlación nos muestra la extraordinaria sensibilidad de la biodiversidad y al mismo tiempo de la respuesta fisiológica individual ante la variación de los factores ambientales y por tanto, su capacidad de adaptación a los cambios que puedan producirse en el futuro. Para la Península Antártica, calculamos que una variación arriba o debajo de un solo grado centígrado, supone un incremento o disminución de hasta el 10% sobre la diversidad total. En cuanto a la productividad, hemos constatado que un grado centígrado de diferencia supone un aumento o disminución de hasta un 50% en las tasas de crecimiento anual. Naturalmente, esto depende de cada especie, pues las hay más o menos sensibles a los cambios de temperatura y todavía estamos muy lejos de comprender el comportamiento de la mayoría de ellas (21, 22).
Figura 4: Relación entre el número de especies de líquenes, el crecimiento radial en especies seleccionadas y la temperatura media anual, con respecto a la precipitación en cuatro localidades antárticas.
Aunque, a grandes rasgos, sea el macroclima y principalmente la temperatura, lo que regula la diversidad y el crecimiento de los líquenes y musgos, el microclima juega un papel fundamental en el desarrollo y la estructura de las comunidades. Como regla general puede decirse que cuanto más extremo es el clima, más decisivo es el microclima para la supervivencia de los vegetales. Mientras en la Antártida marítima, Península Antártica y archipiélagos, prácticamente cualquier lugar descubierto de hielo y nieve es adecuado para el establecimiento de la vegetación, en la Antártida continental, los líquenes y musgos están restringidos a los lugares en donde se produzca una confluencia favorable de factores que permita su hidratación, aunque sea de forma esporádica. Normalmente, se trata de sitios protegidos del viento, que pueden acumular radiación en verano y tienen cerca una fuente de agua a partir de la nieve o el hielo. Pero que haya nieve en las proximidades no es suficiente. En muchas ocasiones el agua helada se evapora, un proceso denominado “sublimación”, sin pasar por la fase líquida. En la Antártida, el delicado equilibrio entre sublimación y fusión resulta crucial para explicar la presencia de vida terrestre. Este balance está controlado por la radiación y la humedad relativa del aire. Por mucho sol que haga en verano, si el aire es demasiado seco no habrá agua líquida suficiente para el establecimiento de líquenes y musgos. El estudio de los factores determinantes de la sublimación o la fusión de la nieve es uno de los aspectos climáticos esenciales desde el punto de vista ecológico y sobre el que aún no existen suficientes datos. Curiosamente, las mayores tasas de sublimación parecen producirse en latitudes no extremadamente altas, entre 70 y 80º S. Más cerca del Polo, el sol está tan bajo en el horizonte que la radiación no alcanza para evaporar la nieve o el hielo, que así, lentamente, se funden sobre las rocas dando una oportunidad a la colonización vegetal (1, 23).
En otras ocasiones el origen de la hidratación resulta todavía menos evidente; no se ve agua por ninguna parte, a pesar de que, a nuestros pies, podamos admirar una abundante colonización brio-liquénica. En este caso, la fuente de hidratación suele encontrarse en el interior del suelo; se trata de la fusión de las capas más superficiales del permafrost, que da lugar a un flujo de agua de abajo a arriba, suficiente para crear pequeños jardines de líquenes y musgos sobre el suelo pedregoso.
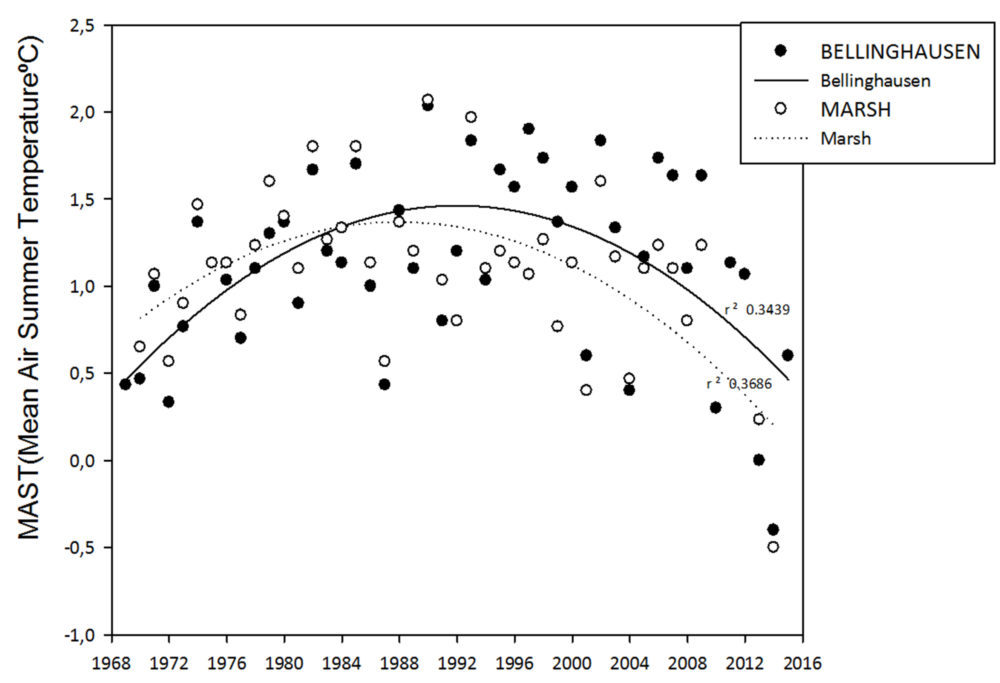
La mayor o menor duración de la cubierta nival es otro factor que durante largo tiempo no ha merecido la adecuada consideración. Aunque la nieve sea la principal fuente de agua para la vegetación, una duración excesiva puede limitar el crecimiento vegetal e incluso aniquilar a las especies más sensibles. La mayor o menor permanencia de la nieve depende tanto de la cantidad total de precipitación, como de la temperatura de verano. En los primeros quince años del presente siglo, en las Islas Shetland, se ha observado una ligera tendencia al aumento de la precipitación, al tiempo que se ha medido una significativa reducción de la temperatura durante los meses de verano (Fig. 5).
Figura 5: Evolución de la temperatura media del aire en verano (meses de diciembre a febrero) de dos estaciones científicas del área de la Península Antártica durante las últimas décadas.
La consecuencia ha sido el aumento de las áreas cubiertas de nieve y la mayor duración de estos neveros a lo largo de la estación favorable, lo que ha tenido efectos dramáticos para varias especies de líquenes (21) (Fig. 6).
Con comunidades tan dependientes de pequeños cambios en las condiciones climáticas, tiene mucho sentido establecer estaciones de monitorización a largo plazo que, como en Isla Livingston o en Victoria Land, nos permitan observar cómo responden los distintos componentes de la comunidad a la sutil variación de los factores ambientales y así poder establecer previsiones más ajustadas sobre lo que podemos esperar en el futuro (4).
Pero hay otros factores también relacionados con las condiciones ambientales y que tienen una gran influencia en la productividad anual de la vegetación: singularmente, la disponibilidad de nitrógeno, que como hemos visto, resulta estrechamente dependiente de la temperatura (24). Los alrededores de las colonias de aves son lugares de especial abundancia de nutrientes y aquí encontramos también las especies de líquenes con las mayores tasas de fotosíntesis de la Antártida, como Ramalina terebrata, con grandes individuos colgantes como guirnaldas en los roquedos costeros. No sabemos hasta qué punto un aumento de temperatura aceleraría las tasas de fijación de nitrógeno y su absorción por la comunidad vegetal, pero es seguro que la disponibilidad de nitrógeno y otros nutrientes aumentará con la temperatura y actuará como un estímulo adicional para el crecimiento y la productividad de los vegetales. Hay que tener en cuenta que en las regiones más templadas de la Antártida la temperatura media anual se encuentra sólo un par de grados por debajo del punto de congelación, por lo que un ligero calentamiento puede dar lugar a multitud de efectos concatenados de resultado final impredecible.
5. LA ANTÁRTIDA Y EL CALENTAMIENTO GLOBAL
Una de las grandes cuestiones de la investigación en biología antártica es hasta qué punto sus especies podrán adaptarse al proceso de calentamiento global. No es algo fácil de responder. Cada una de los centenares de especies vegetales y animales antárticas reaccionará de una forma diferenciada, lo que hace imposible las generalizaciones. Por otro lado, la Antártida está planteando un auténtico reto para los modelos climáticos que prevén diversos escenarios de calentamiento global para distintas latitudes. Normalmente se considera que el aumento de temperatura será mucho más débil en la zona ecuatorial y máximo en las regiones polares. Las tendencias detectadas hasta ahora en el Hemisferio Norte confirman este modelo, pero la Antártida parece haber quedado fuera de cualquier previsión. La Antártida continental muestra una significativa tendencia al calentamiento y a la pérdida de hielo en su región occidental, pero no así en la mucho mayor región oriental, donde, incluso, se ha detectado un aumento en el balance neto de hielo (Navarro et al). En la Antártida marítima, por otra parte, se han medido fuertes oscilaciones, con décadas de marcado calentamiento, seguidas por otras de enfriamiento (Fig. 5), que parecen responder a variaciones naturales en la circulación atmosférica (25).
El efecto más llamativo del calentamiento climático en la Antártida marítima es el acusado retroceso de los frentes glaciares. Pequeñas morrenas y considerables extensiones de suelo y roca han quedado al descubierto durante el pasado siglo, disponibles para la colonización vegetal (2, 26). En estos auténticos laboratorios naturales es posible seguir con precisión todo el proceso de colonización e incluso medir la velocidad de crecimiento de las especies pioneras. Dado que la mayoría de estas especies consisten en líquenes cosmopolitas o bipolares los datos sobre su tasa anual de crecimiento en la Antártida pueden compararse con los procedentes de otras localidades del mundo. Los resultados obtenidos han sido, hasta cierto punto, una sorpresa. En esta región de la Antártida los líquenes pioneros muestran una de las más altas tasas de crecimiento de todo el mundo, con valores que oscilan entre 0.5 y 1 mm de incremento anual en diámetro (Fig. 6). Este activo crecimiento incluso se ha acelerado en algunas especies durante los años de mayor calentamiento (21, 27).
Figura 6: Imágenes de la colonización liquénica sobre un bloque rocoso en una morrena reciente de Isla Livingston en 1991 (imagen superior) y 2015 (imagen inferior). Debido a la acumulación de años fríos y prolongada cubierta nival en verano, algunos talos han desaparecido (flecha superior, talo anaranjado de Caloplaca), mientras otros han continuado su crecimiento (flecha inferior, talo de Rhizocarpon).
Por el contrario, la especie endémica Himantormia lugubris, una de las más abundantes en la tundra de la Antártida marítima, muestra unos óptimos de temperatura para la fotosíntesis entre 0 y 5 ºC. Con los datos actuales podemos afirmar que si el incremento previsto de unos 3 ºC en la temperatura media anual para finales de siglo se hace realidad, supondrá una pérdida neta de carbono para esta especie, debido al aumento relativo de la respiración con respecto a la fotosíntesis. Esto significa que si Himantormia lugubris no fuera capaz de aclimatarse a las nuevas condiciones más cálidas, comenzaría a desaparecer en tan solo 40 o 50 años. La misma situación podría repetirse en otras especies endémicas tanto de líquenes como de musgos (22).
En cuanto a las dos únicas plantas vasculares que viven en esta zona (Deschampsia antarctica y Collobanthus quitensis), ya se ha detectado un importante incremento tanto en número de individuos, como en la extensión de sus poblaciones (28). Además, nuevas colonias están apareciendo en varias localidades de la Península Antártica y en las Islas Shetland del Sur. Esta situación claramente expansiva es hasta ahora la respuesta más evidente de los ecosistemas terrestres de la Antártida marítima al calentamiento global. Ahora la cuestión es cuándo comenzarán a instalarse otras especies, en su mayoría procedentes de Tierra de Fuego o la Patagonia, cuyas semillas son relativamente frecuentes en suelo y turberas antárticas, pero que hasta ahora han sido incapaces de germinar.
El panorama en la Antártida continental es completamente distinto. Aquí el breve periodo de actividad metabólica y la ausencia de la más leve tendencia al calentamiento parecen estar relacionados con las bajas tasas de crecimiento en todos los líquenes estudiados. En los Valles Secos, talos de Buellia frigida observados durante 23 años muestran un aumento anual de diámetro de tan solo 0.01 mm (29), es decir, dos órdenes de magnitud por debajo de lo observado en la Antártida marítima. Puesto que estos talos alcanzan con frecuencia un diámetro de 10 cm cabría deducir para ellos una edad de 10.000 años, si la tasa actual de crecimiento se hubiera mantenido durante toda su vida. Nos encontraríamos entonces ante uno de los organismos pluricelulares más longevos del mundo.
6. PASADO Y FUTURO DE LA ANTÁRTIDA
El calentamiento global no es el primer gran cambio al que se enfrenta la Antártida. En realidad, este continente ha experimentado ya uno de los acontecimientos climáticos más dramáticos en la historia de nuestro planeta, aunque de signo contrario. Hace 33 millones de años, cuando se formaban los primeros casquetes glaciares, la Antártida aún se encontraba en gran parte cubierta de bosques, parecidos a los que hoy existen en La Patagonia y Tierra del Fuego. El paulatino enfriamiento se mantuvo, los glaciares se fueron extendiendo y los bosques dejaron paso a una tundra de hierbas y arbustos cuyos últimos restos desaparecieron hace unos 5 millones de años (1). Finalmente, la enorme extensión de glaciares y mar helado de la Antártida empujó a todo el planeta hacia el periodo frío, con hielo también en el Hemisferio Norte, que denominamos Cuaternario. Un auténtico cataclismo para los ecosistemas terrestres antárticos, sin posibilidades de desplazamiento hacia latitudes más cálidas, atrapados entre el hielo y el mar.
Este proceso de extinción masiva y de extrema simplificación de los ecosistemas ha ido acompañado por no menos espectaculares respuestas adaptativas, que, como en el caso de los líquenes endolíticos, muestran hasta donde puede retroceder la vida, obligada por la persistencia de condiciones adversas.
La actividad humana podría invertir esta tendencia al enfriamiento en una escala aún por determinar, pero cuyas implicaciones alcanzarían a todo el planeta. Los modelos de previsión a largo plazo proponen escenarios muy distintos, pero hasta los más conservadores están de acuerdo en vaticinar un calentamiento de 3 ºC para el conjunto de la Antártida durante los próximos 100 años, lo que llevaría a una situación similar a la que sucedió hace 10 millones de años, cuando una tundra dominada por plantas leñosas y herbáceas cubría las regiones libres de hielo. Por supuesto, un cambio de esta magnitud supondría también una considerable disminución en la extensión y volumen de los grandes glaciares antárticos, con el consiguiente aumento de la extensión de tierra disponible para la colonización vegetal.
Pero la Antártida y el océano circundante no son entes pasivos en los procesos de cambio global. Muy al contrario, los 14 millones de kilómetros cuadrados de hielo antártico influyen de manera determinante en el balance radiactivo del planeta y la actividad biológica del Océano Antártico es clave para comprender el flujo de CO2 a escala mundial. Si el incremento previsto en la temperatura coincide con un aumento en la precipitación de nieve en el continente, la fusión de los frentes glaciares puede verse ampliamente compensada por la mayor formación de hielo en la zona de acumulación (30). La ausencia de un calentamiento acusado en el continente antártico, en oposición a lo que sucede en el Ártico, muestra la poderosa capacidad de regulación del clima antártico y puede suponer un factor de amortiguación en el clima global aún no suficientemente evaluado.
La lentitud en el crecimiento de los vegetales antárticos, su longevidad y la parsimonia de los cambios perceptibles en respuesta a la alteración de los factores ambientales, son una excelente base para monitorizar el efecto de las grandes tendencias climáticas en el continente helado.
7. FINANCIACIÓN
Trabajos financiados por los proyectos del Plan Nacional CGL 2006-12179-C02-01, POL2006-08405 CGL, CTM2009-12838-C04-01, CTM2012-38222-C02-0, CTM2015-64728-C2-1-R y PID2019-105469RB-C21 y de la Unión Europea ESA-AO-2000-EXO-BIOPAN-STONE-023 y PRI-PIMBDV-2011-0874. Deseo expresar también mi reconocimiento por el crucial apoyo financiero y logístico para las expediciones en la Antártida continental facilitado por Antarctica New Zealand (NZ), la National Science Foundation (USA) y el Korean Polar Reasearch Institute (South Korea).
8. REFERENCIAS
- Convey P. Antarctic ecosystems. In: Levin SA (ed) Encyclopedia of Biodiversity, 2nd edn. Waltham, MA: Academic Press, 2013, pp 179-188.
- Chown SL et al. The changing form of Antarctic biodiversity. Nature 2015; 522, 431-438.
- Gemma E Collins, Ian D Hogg, Peter Convey Leopoldo G Sancho, Don Cowan, W Berry Lyons, Byron J Adams, Diana H Wall, TG Allan Green. Genetic diversity of soil invertebrates corroborates timing estimates for past collapses of the West Antarctic Ice Sheet. PNAS 2020; 117: 22293–22302.
- Schroeter B, Green TGA, Pannewitz S et al. Fourteen degrees of latitude and a continent apart: comparison of lichen activity over two years at continental and maritime Antarctic sites. Antarctic Science 2010; 22: 681-690.
- Øvstedal, DO & Lewis Smith, RI. Lichens of Antarctica and South Georgia. A Guide to their identification and Ecology. (Cambridge University press, Cambridge, UK, 2001.
- Olech M. Lichens of King George Island, Antarctica. Institute of Botany of the Jagiellonian University, Cracow 2004, 391 pp.
- Peat HJ, Clarke A, Convey P. Diversity and biogeography of the Antarctic flora. Journal of Biogeography 2007; 34:132-146.
- Leo Sancho, Asunción de los Ríos, Ana Pintado, Claudia Colesie, José Raggio, Carmen Ascaso, Allan Green. Himantormia lugubris, an Antarctic endemic on the edge of the lichen simbiosis. Symbiosis 2020 (in press).
- Green TGA, Sancho LG, Türk R, Seppelt R, Hogg I. High diversity of lichens at 84º S, Queen Maud Mountains, suggests preglacial survival of species in the Ross Sea region, Antarctica. Polar Biology 2011: 34:1211–1220.
- Colesie C, Green TGA , Türk R, Hogg ID Sancho LG, Büdel B. Terrestrial biodiversity trends along the Ross Sea coastline, Antarctica: lack of a latitudinal gradient, controls and potential limits to bioclimatic modeling. Polar Biology 2014; 37: 1197–1208.
- Green TGA, Schroeter B, Sancho LG. Plant Life in Antarctica. In: Pugnaire FI, Valladares F (eds) Functional Plant Ecology, 2nd edn. CRC press, Boca Ratón, USA, 2007, pp 389-434.
- Kappen L. .Some aspects of the great success of lichens in Antarctica. Antarctic Science 2000; 12: 314-324.
- Seppelt RD, Tuerk R, Green TGA, Moser G, Pannewitz S, Sancho LG, Schroeter B. Lichen and moss communities of Botany Bay, Granite Harbour, Ross Sea, Antarctica. Antarctic Science 2010; 22: 691-702.
- Pannewitz S, Maysek K, Schlensog M, Seppelt R. Sancho, LG, Türk R, Schroeter B. The photosynthetic response of three common mosses from continental Antarctica. Antarctic Science 2005; 17: 341-352.
- Green TGA, Kulle D, Pannewitz S, Sancho LG & Schroeter B. UV protection in mosses growing in continental Antarctic. Polar Biology 2005; 28: 822-827.
- Cowan DA, Russell NJ, Mamais A, Sheppard DM. Antarctic Dry Valley mineral soils contain unexpectedly high levels of microbial biomass. Extremophiles 2002; 6: 431–36.
- De los Ríos A, Wierzchos J, Sancho LG, Green TGA, Ascaso C. Ecology of endolithic lichens colonizing granite in continental Antarctica. Lichenologist 2005; 37: 383-395.
- Pointing SB et al. Highly specialized microbial diversity in hyper-arid polar desert. PNAS 2009; 106: 19964-19969.
- De Vera et al. Limits of Life and the Habitability of Mars: The ESA Space Experiment BIOMEX on the ISS. Astrobiology 2019; 19: 145-157.
- Green TGA., Sancho LG, Pintado A, Schroeter B. Functional and spatial pressures on terrestrial vegetation in Antarctica forced by global warming. Polar Biology 2011; 34:1643–1656.
- Sancho LG, Pintado A, Navarro F et al. Recent warming and cooling in the Antarctic Peninsula Region has rapid and large effects on lichen vegetation. Sci Rep 2017; 7: 5689– 5697.673.
- Sancho LG, Pintado A, Green TGA Antarctic studies show lichens to be excellent biomonitors of climate change. Diversity 2019; 11,42.
- Bromwich DH; Guo Z; Bai L; Chen Q. Modeled Antarctic Precipitation. Part I: Spatial and Temporal Variability. J. Climate 2004; 17: 427–447.
- Benavent-González A, Delgado-Baquerizo M, Fernández-Brun L et al. Identity of plant, lichen and moss species connects with microbial abundance and soil functioning in maritime Antarctica. Plant Soil (2018) ; 429: 35-52.
- Turner J et al. Absence of 21st century warming on Antarctic Peninsula consistent with natural variability. Nature 2016; 535, 411-415.
- Cook A, Vaughan D, Luckman, A, Murray T. A new Antarctic Peninsula glacier basin inventory and observed area changes since the 1940s. Antarctic Science 2014; 26: 614-624.
- Sancho LG, Green TGA, Pintado A. Slowest to fastest: Extreme range in lichen growth rate supports their use as an indicator of global change in Antarctica 2007; Flora 202: 667- 673.
- Convey P, Smith RIL. Responses of terrestrial Antarctic ecosystems to climate change. Plant Ecology 2006; 18: 1-10.
- Green T.G.A., Brabyn, L., Beard, C. and Sancho, L.G. (2011) Extremely low lichen growth rates in Taylor Valley, Dry Valleys, continental Antarctica. Polar Biology 35: 535-541.
- Andrew Shepherd et al. (2019) Trends in Antarctic Ice Sheet Elevation and Mass. Geophysical Research Letters 46: 8174-8183.
AGRADECIMIENTOS
En primer lugar, deseo expresar mi agradecimiento a los miembros de esta Real Academia Nacional de Farmacia por el honor que me hacen con este nombramiento y por su calurosa acogida. Especialmente, quiero reconocer la iniciativa del insigne y admirado Prof. Bartolomé Ribas Ozonas, que desde hace tiempo llevaba animándome, con insistencia y cariño, a que presentara mi candidatura para ser miembro de esta honorable institución. Al mismo tiempo, quiero destacar y reconocer el brillante esfuerzo de la Prof. Mercedes Salaices Sánchez en su presentación de mi trayectoria científica en el acto de toma de posesión.
Me gustaría expresar mi agradecimiento a una serie de personas que han sido fundamentales en el desarrollo de mi vida profesional a lo largo de estos años. En primer lugar, al Prof. Salvador Rivas-Martínez, Académico de número de esta institución y Catedrático de Botánica de la Universidad Complutense de Madrid, recientemente fallecido, por haberme abierto en su día, hace ya muchos años, las puertas del Departamento de Botánica en la Facultad de Biología de la UCM, donde pude iniciarme y formarme en la investigación y docencia en Botánica. A la Prof. Ana María Crespo de las Casas, supervisora de mi Tesis Doctoral y desde entonces una colega y amiga muy cercana. Mi agradecimiento también a los profesores Joseph Poelt † (Graz, Austria), Ludger Kappen (Kiel, Alemania) y Otto Lange † (Würzburg, Alemania) por todas sus enseñanzas y extraordinario apoyo en mis estancias de investigación fuera de España. Deseo dedicar un reconocimiento especial al Prof. Allan Green (UK y Hamilton, New Zealand), extaordinario colega, compañero y maestro, que me condujo a las expediciones más ambiciosas en la Antártida continental y que ha compartido conmigo muchos años de trabajo en nuestro laboratorio de la Facultad de Farmacia de la UCM. También quiero expresar mi gratitud a todos los colegas del antiguo Departamento de Biología Vegetal II y ahora Departamento de Farmacología, Farmacognosia y Botánica, por su infinita comprensión y colaboración para facilitarme las largas ausencias obligadas por las expediciones a lugares tan remotos. Naturalmente, mi más sincero y cariñoso agradecimiento a todos los colegas y amigos que han participado o colaborado con nuestros proyectos de investigación (Fig. 7).
Dejo para el final lo que seguramente es más importante, mi agradecimiento, de corazón, a mi familia; a Teresa, Sofía y Laura y por supuesto, a mi madre, Rosa. Ellas han estado y siempre están ahí. Y también a los amigos y gente querida que me han apoyado en mi trayectoria personal y vital. Gracias.
Figura 7: Colegas que han colaborado en nuestros principales proyectos de investigación en la Antártida: 1. Allan Green (UK), 2. Roman Türk (Austria), 3. Thorsten Lumbsch (USA), 4. Jose Antonio Jiménez de las Heras (UCM), 5. José Raggio (UCM), 6. Felix Grewe (USA), 7. Ana Pintado (UCM), 8. Asunción de los Ríos (CSIC), 9. Roberto Lázaro (CSIC), 10. Isaac Garrido (CSIC), 11. Rolf Gademann (Alemania), 12. Javier Etayo (Aranzadi), 13. Nuria Beltrán (UCM), 14. Almudena Muñoz (UCM), 15. Claudia Colesie (UK), 16. Ulrike Ruprecht (Austria), 17. Ulrik Soechting (Dinamarca).