RESUMEN:
La industria farmacéutica está en continua búsqueda de nuevas tecnologías que permitan mejorar las formas de dosificación de las que se dispone, siendo uno de los objetivos el aumento de la adherencia a los tratamientos por parte de los pacientes. En este sentido, la impresión en 3 dimensiones (3DP) es una emergente técnica de fabricación aditiva que ha comenzado a abarcar muchos sectores industriales e influir directa e indirectamente en la calidad de vida de los individuos. Tanto es así, que la 3DP se postula como una de las técnicas que podría contribuir a que se produzca un gran cambio en el sector farmacéutico, permitiendo la personalización de los tratamientos de los pacientes, mejorando la biodisponibilidad de fármacos que presentan problemas de disolución o combinando toda la medicación de un paciente en una sola forma farmacéutica de toma diaria (polypill), entre otros. Esta nueva técnica de producción va a diferir enormemente de las clásicas formas de fabricación farmacéuticas y, en los próximos años puede suponer una transformación revolucionaria en la práctica farmacéutica.
Palabras Clave: industria farmacéutica, formas de administración, impresión 3D, adherencia, personalización de los tratamientos, biodisponibilidad, polypill
ABSTRACT:
The pharmaceutical industry is continually searching for new technologies to improve the characteristics of current medicines. One of the objectives is the increase of adherence to the treatments by patients. Simultaneously, 3-dimensional printing (3DP) is an emerging additive technique that is reaching many sectors of industry and influencing directly and indirectly the quality of life of patients. In this sense, 3DP postulates to be one of the technologies that contribute to the pharmaceutical development, allowing the personalized medicine in patients, improving the bioavailability of drugs with dissolution problems or combining all the medication of the patients in a single tablet (polypill), among others. This new technique will differ greatly from the traditional pharmaceutical manufacturing and in the coming years it may involve a revolutionary transformation in pharmaceutical practice.
Keywords: pharmaceutical industry, current medicines, 3D printing, adherence, personalized medicine, bioavailability, polypill
1. INTRODUCCIÓN
La revolución industrial del siglo XVIII hizo avanzar notablemente la medicina y supuso un enorme estímulo e impulso para la investigación en la industria farmacéutica. La comercialización de sueros, que facilitaron la aplicación de inyectables, o el uso de quimioterápicos, que ofrecieron nuevas dianas terapéuticas, fueron algunos de los adelantos de la época (1), impensables hasta el momento.
A principios del siglo XIX la historia de la tecnología farmacéutica comenzó a consolidarse y se produjeron los primeros adelantos farmacéuticos. Años después, con el desarrollo de la tecnología, surgió la fabricación de nuevos equipos de laboratorio (pipetas, centrifugadoras, molinos…) y esto facilitó la preparación de formas farmacéuticas tales como comprimidos, cápsulas, inyectables y supositorios.
Los farmacéuticos, a su vez, promovieron la producción de medicamentos, y las compañías farmacéuticas establecieron laboratorios de investigación. El “boom” farmacéutico llegó con el siglo XX, este fue testigo de uno de los mayores acontecimientos socio-sanitarios, el gran progreso farmacéutico. Los continuos avances en tecnología farmacéutica, junto con el descubrimiento de nuevos grupos farmacológicos (sulfamidas, hormonas, psicotrópicos o antihistamínicos), permitieron que la mortalidad materna producida por infecciones surgidas durante el parto disminuyera en más del 90%, o que la adherencia a los tratamientos por parte de los pacientes mejorara, por ejemplo (1).
La necesidad de disponer de medicamentos seguros, eficaces y de calidad se ha convertido en una verdadera preocupación en todos los países, y ello ha determinado que la industria farmacéutica vaya a la vanguardia de la tecnología y utilice todos los medios a su alcance; convirtiéndose, de esta forma, en una de las industrias más reguladas.
El principal objetivo del desarrollo de nuevas técnicas gira en torno a satisfacer exclusivamente las necesidades de cada individuo de forma personalizada (2). Para hacer frente a estos desafíos, es obvio que la investigación farmacéutica es imprescindible y trascendental. Su labor se centra mayormente en la evaluación, desarrollo y adaptación de la tecnología a los requisitos de alta calidad exigidos y regulados por la industria farmacéutica.
Al mismo tiempo, esa urgente necesidad de desarrollar medicamentos que encajen a la perfección con cada paciente hace que la demanda de innovadoras tecnologías crezca exponencialmente. Por ello, continuamente aparecen nuevas líneas de investigación e ideas tecnológicas que podrían llegar a ser la base para un cambio fundamental en el sector farmacéutico y sanitario.
En este sentido, la impresión 3D (3DP) podría ser una de las posibles propuestas para afrontar los ambiciosos y apasionantes retos actuales en el campo de la tecnología farmacéutica, con el fin de proponer alternativas eficaces, viables y adaptadas de forma única a cada paciente.
Dicha técnica de producción se fundamenta en construir objetos sólidos mediante la deposición sucesiva del producto en finas capas y, hasta el momento, ya ha sido ampliamente utilizada en la impresión de materiales funcionales como polímeros, metales o biomateriales. De hecho, su aceptación en áreas de investigación médica como la ingeniería de tejidos o la tecnología farmacéutica ha sido muy positiva.
Tanto es así, que esta tecnología podría competir con la producción industrial clásica, dónde la fabricación en continuo de comprimidos y cápsulas de dosis establecidas está implantada desde años atrás y, al menos a día de hoy, no hay lugar para fabricar formas de dosificación dosis-específicas o combinaciones de fármacos adaptados al tratamiento de cada individuo. El paso de la producción clásica a la implantación de una técnica tan novedosa y versátil como la 3DP puede suponer un impacto enorme, ya que, además de los factores mencionados hasta el momento, esta técnica se proyecta como una opción de cambio muy beneficiosa en lo que a producción, costes, comercialización y regulación industrial se refiere.
2. OBJETIVOS
El propósito de esta revisión bibliográfica se centra en el estudio de las técnicas de impresión en 3D y en cómo estas pueden ser aplicadas en el mundo sanitario; más concretamente en el ámbito de la tecnología farmacéutica. Con el fin de profundizar en el método tecnológico, es primordial la comprensión de los fundamentos teóricos básicos de la impresión en 3D. Para ello, se examinarán las distintas etapas en el proceso de fabricación y las formas de impresión más comúnmente utilizadas. Así, al adquirir una idea general de las técnicas aditivas, será posible el estudio de las aplicaciones de la 3DP en el mundo farmacéutico. Se tendrán en cuenta los beneficios, las limitaciones y los retos pendientes de la técnica, de forma que sea posible realizar una evaluación crítica de su futuro en el sector y estimar la forma en la que puede contribuir a mejorar la calidad de vida de los pacientes. Con todo ello, se busca hacer visible la 3DP en un área científica en la que, aun encontrándose en ciernes, promete registrar un gran rendimiento.
3. DESARROLLO
3.1. La 3DP
3.1.1 Origen y fundamentos de la 3DP
La 3DP se hizo visible a finales de la década de 1980, siendo destacable el descubrimiento de la impresora de inyección de tinta. Años después, en 1986, Charles Hull desarrolló una gama de tecnologías ahora conocidas como técnicas de 3DP; siendo la estereolitografía (SLA) (3) una de las primeras en destacar. El trabajo de C. Hull y su equipo se basó en inventar procesos aditivos para crear objetos capa por capa. De hecho, esa es la diferencia principal entre la 3DP y la fabricación clásica empleada hasta el momento: la forma en la que el objeto es elaborado.
Mientras la 3DP permite producir objetos capa por capa en una sola operación, los procesos tradicionales no lo hacen. Generalmente, incluyen etapas de doblado, moldeado, corte, soldadura y pegado, entre otros. A su vez, parte de la materia prima empleada es desperdiciada en el proceso de fabricación y son necesarias diversas máquinas especializadas en la materia, además de las grandes cantidades de energía requeridas. Todo ello, directa e indirectamente, contribuyó a que la 3DP se convirtiera rápidamente en una herramienta estándar en industrias como la automotriz o la aeroespacial (4). Estos acontecimientos fueron fundamentales para el avance que las técnicas de 3DP o prototipado rápido (RP) experimentarían en los próximos años.
En definitiva, la 3DP se define como una metodología relativamente nueva que utiliza conjuntos de datos de diseños asistidos por computadora (CAD) (5) tridimensionales para producir un modelo físico 3D. El principio de RP se basa en utilizar modelos de computadora 3D para la reconstrucción de un modelo físico tridimensional mediante la adición capa por capa de material, así se superpone el material sobre el sustrato y se obtiene el objeto diseñado (7). Por lo tanto, podría decirse que el propósito de una impresora 3D se centra en reproducir el diseño, previamente creado con un ordenador, en un objeto tridimensional físico semejante.
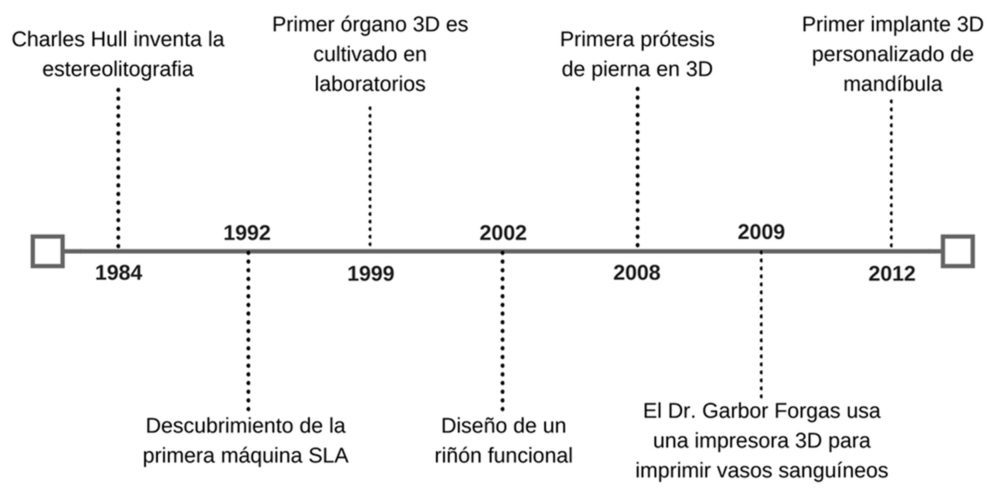
La disminución de costes de producción de las impresoras 3D está acelerando su propia expansión, y esto hace que el impacto de la 3DP en diversos campos de la ciencia aumente constantemente. Desde el punto de vista sanitario, la década del 1990 al 2000 marcó un antes y un después en la historia de la 3DP. En solo 10 años desde la aparición de la técnica de impresión, científicos de diferentes instituciones fabricaron un riñón funcional en miniatura (8), construyeron una prótesis e imprimieron los primeros vasos sanguíneos utilizando sólo células humanas (Figura 1) (9). De igual modo, actualmente, cada vez más investigadores trabajan con el propósito de afrontar los retos pendientes de la 3DP (Figura 2); y continúan apostando por emplear técnicas 2D y 3D para aplicaciones médicas como la liberación de fármacos, el tratamiento de enfermedades y la ingeniería de tejidos (3).
Figura 1. Acontecimientos históricos en el desarrollo de la 3DP y en el mundo sanitario
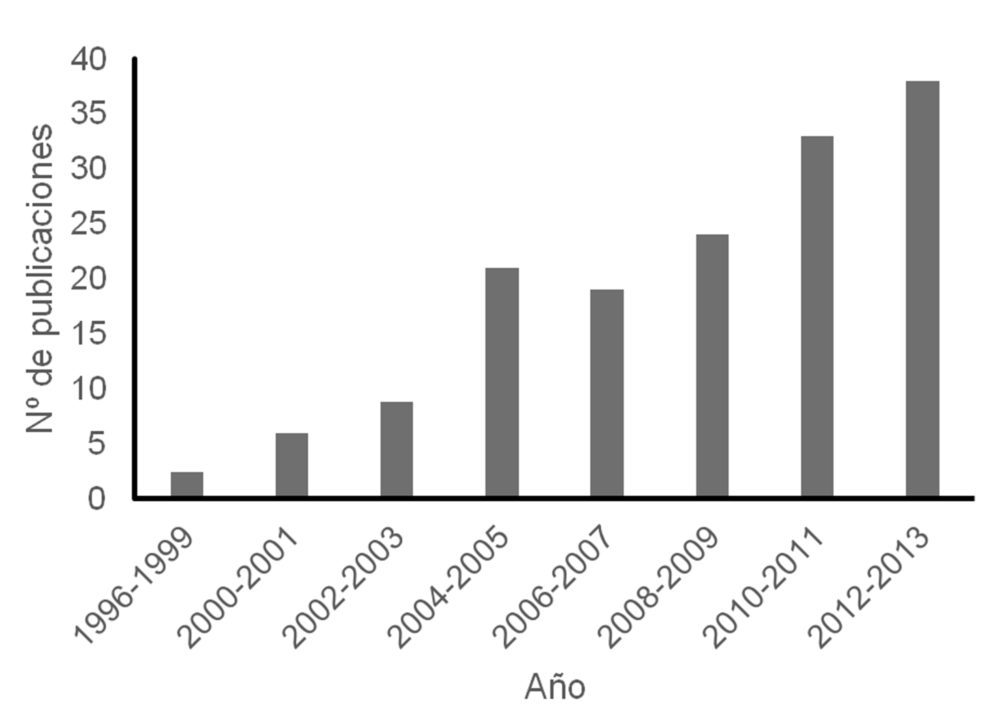 Figura 2. Aumento en el número de publicaciones registradas en Web of Science sobre impresión farmacéutica desde el año 1996
Figura 2. Aumento en el número de publicaciones registradas en Web of Science sobre impresión farmacéutica desde el año 1996
3.1.2 Proceso de fabricación de 3DP
El proceso de creación de un objeto en 3D es relativamente complejo, ya que muchos factores diferentes deben interactuar y trabajar conjuntamente de manera eficaz. Como muestra la Figura 3, la impresión inicia en la fase de diseño o preparado del modelo y finaliza con la de fabricación del prototipo ideado. Generalmente, la impresión incluye 3 pasos principales: la pre-impresión, la impresión y la post-impresión. A continuación, se detallan las características de cada fase (11).
Pre-impresión: en la primera fase del proceso se distinguen 3 importantes etapas: El diseño, la conversión del diseño a un formato legible por la impresora y la selección y procesamiento de la materia prima. Inicialmente se crea un diseño digital del producto previsto. Para ello, es posible la creación de un modelo CAD o la adquisición de una serie de imágenes en 2D correspondientes a las capas del producto a imprimir. La tomografía computarizada y la resonancia magnéticas son dos de las técnicas de imagen que permiten esta última opción (3).
Una vez elaborado el diseño es necesario transformar la representación 3D en un archivo, generalmente estereolitográfico (STL), que contenga toda la información geométrica para representar el modelo digital y que sea legible por la impresora en cuestión. Después, los programas de 3DP “rebanan” estas superficies en distintas capas imprimibles y transfieren las instrucciones de capa por capa digitalmente a la impresora. Es decir, convierten el modelo digital en una lista de comandos que la impresora pueda entender y ejecutar, generalmente llamados código g. Igualmente, la selección del material es otra parte vital en el proceso de impresión, y se rige principalmente por el tipo de impresora a usar y por los requisitos del producto final.
Impresión: esta etapa va a ser clave para obtener el resultado buscado. Comparte tres conceptos básicos con cualquier impresora de escritorio: la tinta, el hardware y el papel. No obstante, teniendo en cuenta el objeto a imprimir, los conceptos básicos de impresión presentarán especificaciones; en una bio-impresión por ejemplo, la tinta y los materiales serán biológicos, como su nombre indica.
La etapa comienza cuando las materias primas se agregan y se solidifican de manera automática, capa por capa para producir el producto deseado (12). Cada tipo de 3DP (láser, de extrusión…etc.) presenta variaciones específicas de la técnica. No obstante, el proceso general de impresión se resume de la siguiente manera. El cabezal de impresión comienza a desplazarse sobre los distintos ejes (x, y, z); así, mediante la deposición del sustrato sobre la base de la impresora se comienza a crear el objeto ideado capa a capa. Este proceso se repite siguiendo las instrucciones de dibujo asistido por ordenador (CAD) hasta que el objeto es finalmente fabricado. Llama la atención la adaptabilidad de la tecnología, ya que, con un simple cambio en CAD, el mismo equipo de impresión es capaz de imprimir una variedad ilimitada de productos.
A su vez, en el proceso de impresión se tiene muy en cuenta la geometría del producto a fabricar. En caso de querer crear un objeto con relieve característico, previamente se pueden generar estructuras de soporte o moldes, de forma que la materia prima se deposite sobre el molde y no sobre la base de la impresora. Este soporte, en muchas ocasiones, se imprime en un material diferente al del producto, que tras finalizar la impresión es retirado.
Post-impresión: después de la impresión, el objeto creado debe ser liberado de la plataforma de impresión, al igual que el sustrato no unido y las partes sobrantes o moldes, si están presentes, para favorecer la limpieza de la superficie. Adicionalmente, los productos pueden requerir secado, pulido u otros pasos de post-procesamiento.
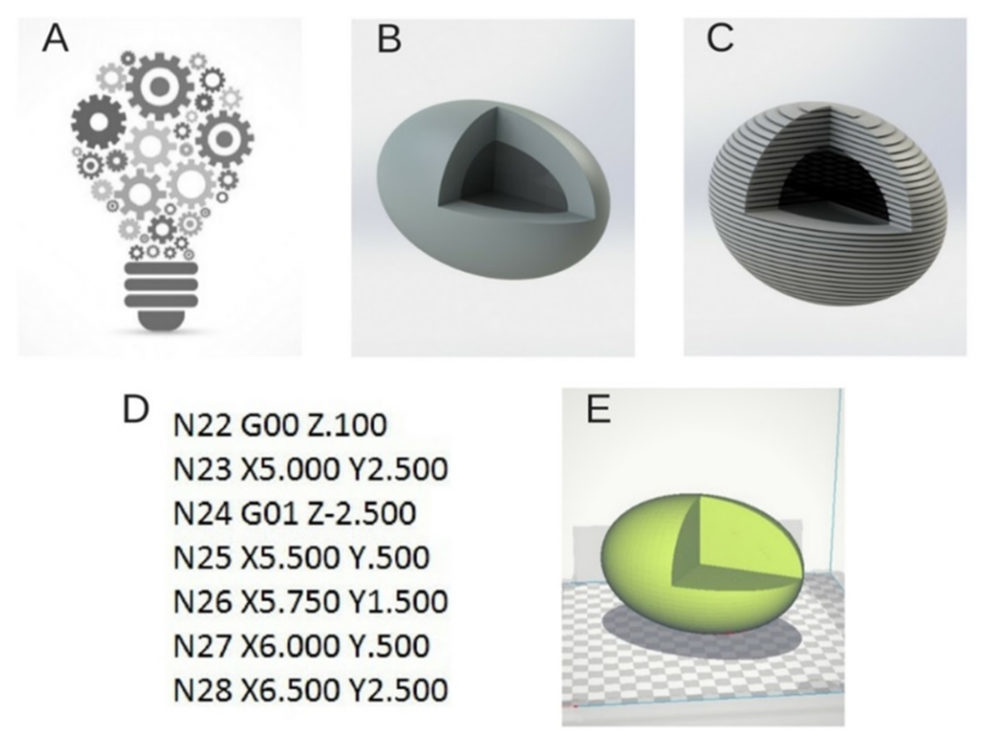 Figura 3. Esquema del proceso de 3DP: se visualiza que tras tener una idea del producto a fabricar (A) se puede diseñar el modelo digitalmente mediante un programa CAD, solidmaker, en este caso (B). Posteriormente, el diseño inicial se transforma en archivo STL y se lleva a cabo el rebanado (C). Así, se obtiene la información geométrica (código G) necesaria para enviar del ordenador a la impresora (D) y que ésta reproduzca el diseño ideado en un objeto físico tridimensional (E).
Figura 3. Esquema del proceso de 3DP: se visualiza que tras tener una idea del producto a fabricar (A) se puede diseñar el modelo digitalmente mediante un programa CAD, solidmaker, en este caso (B). Posteriormente, el diseño inicial se transforma en archivo STL y se lleva a cabo el rebanado (C). Así, se obtiene la información geométrica (código G) necesaria para enviar del ordenador a la impresora (D) y que ésta reproduzca el diseño ideado en un objeto físico tridimensional (E).
3.1.3 Tipos de impresión
La 3DP incluye una serie de técnicas de fabricación y una multitud de tecnologías experimentales (7). Muchas de ellas están siendo empleadas en industria o por grupos de investigación y otras están siendo desarrolladas actualmente. En los últimos 15 años, se han ido introduciendo constantemente una gran variedad de técnicas de 3DP; cada una con sus propias limitaciones y aplicaciones en la producción.
Antes de detallar las técnicas más importantes de impresión, cabe destacar que la tinta va a tener un papel determinante en todos los tipos de impresión, ya que variando su composición se obtendrán objetos de características muy dispares. En la fabricación de formas farmacéuticas, por ejemplo, además del principio activo (PA) las formulaciones de tinta presentan una amplia gama de compuestos; incluyendo ácido láctico o glicólico, etanol-dimetilsulfóxido, tensioactivos (por ejemplo, Tween 20), Kollidon SR*, glicerina, celulosa, propilenglicol, metanol o acetona (13). Dicho esto, a continuación, se analizan los tipos de impresión más relevantes.
* Kollidon SR: agente formador de la matriz basado en polivinilo / polivinilpirrolidona
* Estereolitografía (SLA)
La SLA consiste en la aplicación de un haz de luz ultravioleta sobre una resina líquida (contenida en un cubo) sensible a la luz (14). Así, la luz UV solidifica la resina capa por capa. La base que soporta la estructura se desplaza hacia abajo para que la luz vuelva a ejercer su acción sobre el baño de resina, esto ocurre constantemente hasta que el objeto alcanza la forma diseñada digitalmente. Una de las ventajas principales de esta técnica es que permite obtener piezas de altísima calidad; y, además, destaca la posibilidad de reutilizar el material.
* Inyección (Inkjet printing)
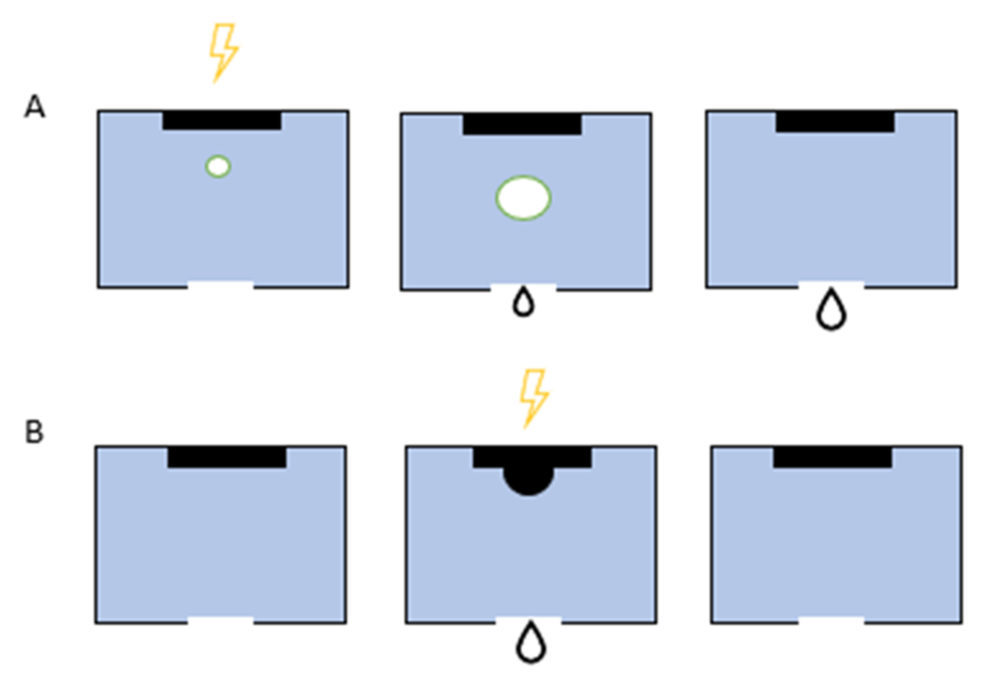
La impresión por inyección fue la primera tecnología de impresión ampliamente desarrollada, y es muy similar a la impresión convencional de inyección de tinta 2D. La impresión se ejecuta de la siguiente forma; una solución se almacena en el cartucho de tinta y este se conecta al cabezal de la impresora actuando como fuente de consumo durante el proceso de impresión, controlado electrónicamente. Durante el proceso, los cabezales de impresión generan gotas de un tamaño controlable que se depositan sobre la bandeja de construcción. Estos cabezales controlan tanto la velocidad de formación de gotas como la viscosidad del fluido, y pueden ser térmicos o piezoeléctricos (15). En el primer caso (Figura 4A) una fuente de calor favorece la formación de una burbuja, generando la caída de material en forma de gota. En el segundo caso (Figura 4B), en cambio, la deformación producida por voltaje en un disco piezoeléctrico es la causa de la caída (10).
Figura 4. Mecanismo de impresión por inyección térmica (A): el cabezal térmico que genera la gota muestra el aumento de la temperatura tras la recepción del pulso eléctrico, como consecuencia se forman burbujas de vapor. Una vez sobrecalentadas se da el crecimiento de las burbujas y ello provoca la deposición de una gotita. Finalmente se da el colapso de la burbuja. Mecanismo de impresión por inyección piezoeléctrica (B): la cámara generadora de gotas piezoeléctricas muestra el estado no activado. El movimiento del elemento piezoeléctrico tras la recepción de un impulso eléctrico da como resultado la formación de una gotita y posteriormente, se da el llenado de la cámara.
Hasta el momento, la 3DP por inyección ha sido la técnica más empleada para la fabricación de formas farmacéuticas. En la Tabla 1 se observan algunos de los ejemplos.
Tabla 1. Ejemplos de medicamentos impresos por inyección (13).
* Impresión SLS (Sinterizado Láser Selectivo)
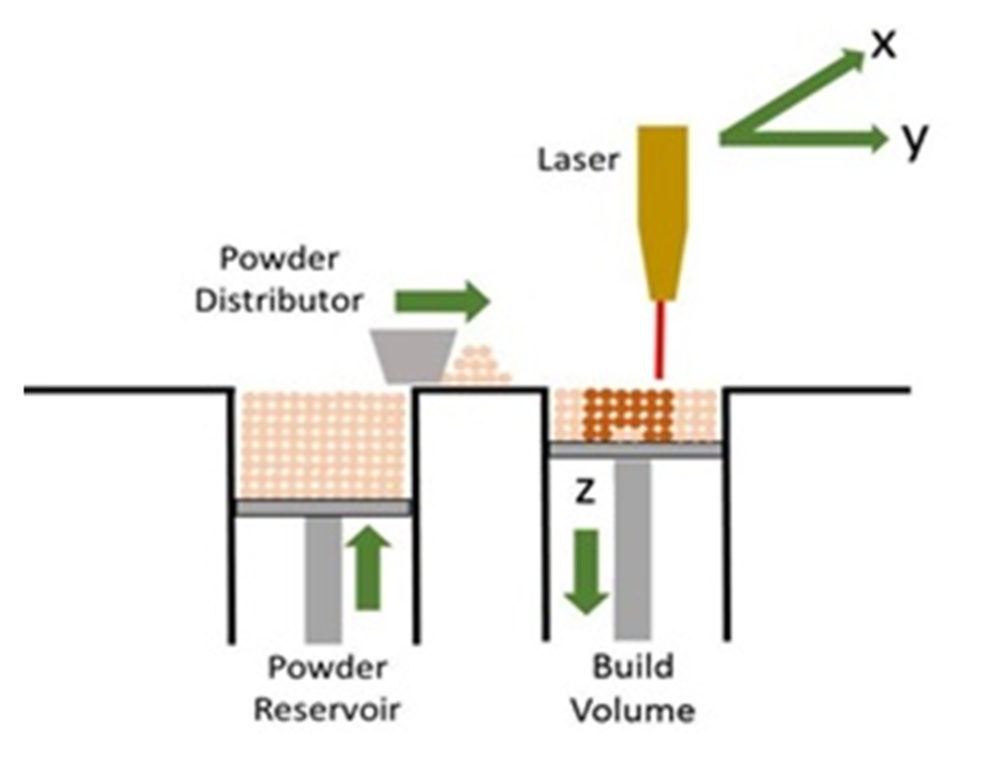
Esta técnica de impresión nació en los años 80, y pese a tener ciertas similitudes con la tecnología SLA, la impresión SLS permite imprimir un gran número de materiales en polvo. Durante la impresión, las partículas son calentadas por un láser (16) y éstas, por la alta temperatura, se funden y se unen a las partículas que las rodean (Figura 5). Es así como el producto 3D, una vez solidificado, queda enterrado dentro del sustrato para después ser retirado del mismo. Todo el material sobrante que no se utiliza en la fabricación del objeto es eliminado, por lo que se desperdicia gran cantidad de material, a diferencia de lo que ocurre en la técnica SLA.
Figura 5. Impresión SLS: se observa como una fuente de láser solidifica las partículas de polvo superficiales, posteriormente el eje z se desplaza hacia abajo y el distribuidor de polvo rellena la superficie con el material. Se trata de una forma de impresión similar a la SLA; con la diferencia de que en este caso el material a solidificar es polvo y en el caso de SLA es un líquido (resina). Reproducido con permiso de (17).
* Impresión por deposición de material fundido
También conocida por FFF (Fused Filament Fabrication), la técnica aditiva de modelado por deposición fundida es una tecnología que consiste en depositar el polímero fundido sobre una base plana, capa a capa (18). El material, que inicialmente se encuentra en estado sólido almacenado en rollos, se funde y es expulsado por la boquilla en finos hilos que se van solidificando mientras toman la forma del objeto final (19). Un motor se encarga de mover el filamento a través de un elemento de calentamiento; este lo funde a una temperatura de entre 170 y 240 grados. El filamento emerge fundido del extrusor y rápidamente se endurece a temperatura ambiente para fijarse con la capa inferior. El cabezal de impresión se mueve por el plano X-Y antes de moverse en el eje Z. Así, el objeto es impreso capa a capa desde la parte inferior a la superior.
Se trata de la técnica más común en cuanto a impresoras 3D de escritorio y usuarios domésticos se refiere. Es una técnica de impresión muy útil para el RP, y aunque los resultados pueden ser muy buenos, no suelen ser comparables con los que ofrecen las impresoras 3D de SLA o SLS, por ejemplo. La ventaja principal es que esta tecnología ha permitido poner la 3DP al alcance de cualquier individuo ̶ con impresoras como la Witbox ̶ y que permite imprimir una gran cantidad de materiales de impresión.
3.1.4 Adaptación de la 3DP a la producción farmacéutica
La 3DP de medicamentos es muy atractiva tanto para científicos como para investigadores del campo farmacéutico industrial que, acostumbrados a las formas de fabricación convencionales, ven esta técnica como una herramienta de infinitas posibilidades.
A pesar de esto, actualmente no se ha comercializado ningún modelo de impresora 3D especializada en procesos farmacéuticos. En cierta medida, esto podría deberse a las numerosas adaptaciones que son necesarias llevar a cabo en la impresora para cumplir con los requisitos de producción farmacéutica.
En las impresoras FFF por ejemplo (Figura 6), el filamento del carrete a imprimir no suele estar protegido del medio exterior (partículas, humedad, etc.) (a). Esta exposición podría favorecer la contaminación y por ello es muy recomendable instalar un compartimento aislante que asegure la estanqueidad 20.
Figura 6. Adaptaciones y requerimientos necesarios en una impresora de deposición fundida: a) carrete, b) carcasa de la impresora, c) cabezal del extrusor, d) boquilla, e) plataforma, f) motor, g) calentador y h) software. Reproducido con permiso de (20).
Algo similar ocurre con la carcasa de la impresora (b). Esta debe estar sellada para asegurar un correcto aislamiento del espacio donde se lleva a cabo la impresión del medicamento. De no ser así, y cumpliendo con las normas GMP, sería necesario instalar un equipo de flujo laminar o un contador de partículas para asegurar la calidad del producto farmacéutico.
A continuación, se citan otras adaptaciones necesarias, todas ellas indispensables para favorecer la especialización de las impresoras 3D de medicamentos:
• Facilidad de limpieza de los materiales que componen la impresora (c, d, e, g).
• Aislamiento del motor del medio de impresión, evitando así la cesión de aceites residuales al producto farmacéutico (f).
• Diseño de un software configurado y adaptado a los requisitos de las prescripciones farmacéuticas (h).
3.2 Sistemas de liberación farmacéutica
En los últimos años, los sistemas de administración de fármacos han avanzado rápidamente en su capacidad para transportar y liberar fármacos con precisión a las células y órganos diana. Esto es debido a que continuamente se utilizan nuevas ideas y tecnologías para hacer que estos sistemas sean aún más eficientes. En este sentido, las impresoras 3D prometen revolucionar también la fabricación de medicamentos (21), y quizás hacerlos más accesibles en todos los lugares del mundo.
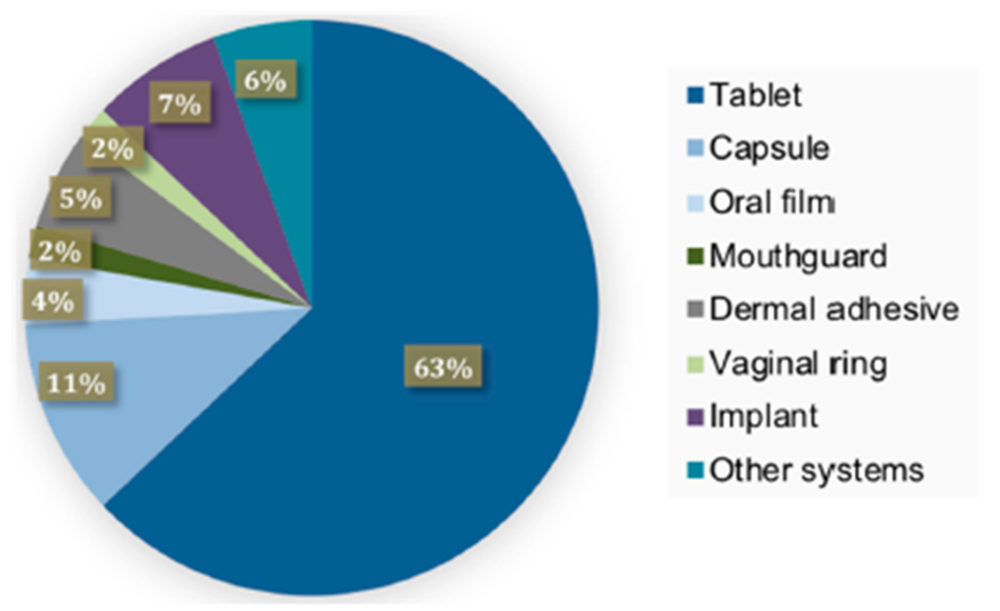
Las últimas publicaciones científicas avalan la gran variedad de formas farmacéuticas que las impresoras 3D son capaces de producir, lo cual evidencia la versatilidad y el potencial de la tecnología. Indudablemente, la mayoría de las investigaciones realizadas hasta el momento se centraron en las formas de dosificación oral, siendo los comprimidos (63%) las formas farmacéuticas más estudiadas (20).
Figura 7. Representación gráfica de las formas farmacéuticas más investigadas en 3D. Reproducido con permiso de (20).
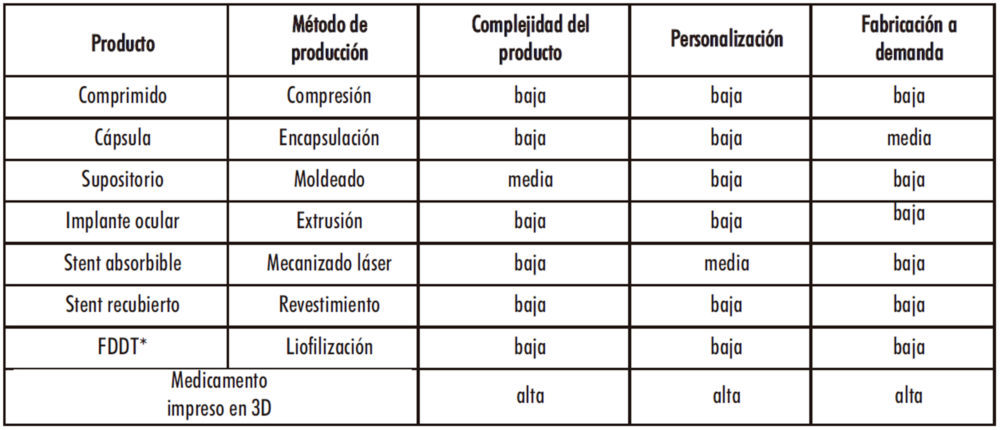
Hay muchos factores que diferencian los procesos de fabricación farmacéuticos tradicionales de hoy y la 3DP. No obstante, los 3 parámetros principales a destacar de la impresión de medicamentos son: la complejidad, la personalización y la fabricación bajo demanda del producto (Tabla 2). Justamente, estas van a ser las ventajas más destacadas de la técnica y las razones de motivación principales para el desarrollo de medicamentos en 3D.
Tabla 2. Comparación de los procesos farmacéuticos clásicos con la 3DP (11).
*Fast Dissolving Disintegrating Tablets (comprimidos bucodispersables)
3.2.1 Complejidad del producto
Las formas de dosificación farmacéuticas han evolucionado en complejidad durante los años, desde ungüentos, polvos y lociones preparadas por los griegos y romanos, a comprimidos, preparados por primera vez en 1878 por el Dr. Robert Fuller (22). Las formas farmacéuticas evolucionaron en el siglo XX, creando comprimidos de liberación prolongada y modificada, así como sistemas transdérmicos, entre otros. Por lo tanto, la introducción de la 3DP de productos farmacéuticos, que se dio a conocer por primera vez en 1996, introduce un nuevo elemento en la evolución de la forma de dosificación: la digitalización farmacéutica.
Debido a que la estructura de un medicamento puede afectar la liberación del fármaco, las complejas estructuras 3D crean nuevas oportunidades para su administración. Por ejemplo, el producto farmacéutico impreso en 3D recientemente aprobado por la FDA (23), SPRITAM®, tiene una estructura porosa (Figura 8) producida por tecnología Zipdose. Esta no deja de ser una técnica de impresión por inyección, con la variante de que dispone de una cama de polvo como superficie de impresión. Esta técnica une el polvo sin compresión, y la estructura formada permite que los comprimidos, de hasta 1000 mg de levetiracetam, se disgreguen en segundos cuando se administran (24).
Figura 8. Comprimidos Spritam: 750mg de levetiracetam (primer plano) y 1000mg de levetiracetam (segundo plano). Se puede observar el aspecto poroso que tiene el comprimido impreso por la tecnología Zipdose (24). Images used with permission. © 2020 Aprecia Pharmaceuticals, LLC.
El proceso de fabricación es el siguiente (Figura 9): una vez establecida una fina capa de polvo del PA, la impresora deposita pequeñas gotas de líquido para unir las partículas del polvo a nivel microscópico. Estos pasos se repiten hasta que el comprimido alcanza su altura apropiada. El producto final es similar a cualquier otro comprimido, sólo que un poco más alto y con un exterior más áspero.
Figura 9. Esquema de la tecnología Zipdose: se observa como el polvo del principio activo es depositado sobre la base (A). A continuación, se administra una gota del líquido sobre la fina capa de polvo (B) y esta une las partículas sólidas entre sí (C). El proceso se repite continuamente hasta obtener el comprimido del tamaño deseado (D) (24). Images used with permission. © 2020 Aprecia Pharmaceuticals, LLC.
Las formas complejas impresas en 3D pueden tener una disolución más rápida que los productos tradicionales de liberación inmediata, lo cual resulta sumamente útil a la hora de tratar brotes epilépticos donde la rapidez del efecto farmacológico es trascendental.
Por otra parte, estudios realizados por Aprecia afirman que en torno al 40-50% de los ciudadanos estadounidenses tienen problemas a la hora de tragar comprimidos, y que de esos individuos que muestran dificultades un 8% opta por omitir la dosis. Por ello, la capacidad de disgregación que presentan comprimidos 3D como SPRITAM® pueden ayudar a solventar dicho problema y así mejorar la adherencia al tratamiento. Lo mismo sucede con pacientes epilépticos, donde un 45% de pacientes informaron haber experimentado ataques epilépticos después de no tomar una dosis de su medicación a causa de dificultades en la ingesta de comprimidos (24). Entre las estrategias ideadas para aumentar las velocidades de disolución, se incluyen la impresión de formas farmacéuticas de gran superficie y de dispersiones amorfas por extrusión en caliente. La 3DP, por tanto, puede proporcionar estrategias alternativas que aborden la velocidad de disgregación de compuestos poco solubles y mejorar así su absorción.
A su vez, la 3DP ha permitido el desarrollo de procesos de encapsulación de PA en múltiples capas de excipientes, o impresiones de dosis muy bajas (Figura 10). El fármaco se incorpora a la forma de dosificación a través de 3DP, como solución o suspensión de partículas sólidas en líquido, en lugar de por el convencional manejo y compresión de polvos secos.
Figura 10. Algunas de las propuestas que ofrece la 3DP en la mejora de la fabricación de formas farmacéuticas
Por otra parte, el reciente crecimiento de la biotecnología ha provocado el aumento de fármacos proteínicos y polipéptidos. La administración oral de proteínas es un desafío importante, ya que existen barreras que dificultan el proceso de absorción (barreras físicas relacionadas con las uniones estrechas epiteliales) y también pueden surgir problemas de estabilidad durante el proceso de fabricación de la formulación. El uso de 3DP ayudaría a la investigación de nuevas formas farmacéuticas de liberación de péptidos y proteínas (Figura 10 y 11), teniendo como objetivo el máximo aumento de la biodisponibilidad oral de las proteínas (Figura 11).
Figura 11. Esquema del dispositivo desarrollado para la administración oral de proteínas: revestimiento entérico, región contenida de inhibidores de proteasa y región interna que contiene partículas de proteína-polímero y potenciador de la penetración.
Otra de las opciones que permite la 3DP es la precisa distribución espacial de los componentes dentro de una forma farmacéutica. Así mismo, se abre una ventana a un gran número de diseños y complejas geometrías. Ejemplo de ello son los comprimidos huecos o parcialmente llenos que se pueden fabricar fácilmente mediante 3DP. Cabe destacar que todo ello no sería posible con los métodos de fabricación farmacéuticos tradicionales, como podría ser la técnica de compresión directa, por poner un ejemplo (25).
En cuanto a los comprimidos se refiere, muchas investigaciones muestran que la 3DP podría replicar las formas sólidas de dosificación oral existentes, tales como comprimidos convencionales, comprimidos con revestimientos insolubles o entéricos, comprimidos bicapa, films orales y sistemas osmóticos (27). En definitiva, este apartado demuestra que la 3DP puede contribuir a desarrollar nuevas formas de administración farmacéutica además de colaborar en la mejora de la tecnología existente.
La 3DP de cápsulas, aunque no sea tan común, también presenta un gran rendimiento. Recientes estudios confirman que una cápsula bicompartimental de polímeros diferentes es capaz de presentar una cinética de liberación de dos pulsos. Además, modificando el grosor de la cubierta de la cápsula y el volumen del núcleo se ha demostrado que es posible modificar la cinética de liberación de la forma farmacéutica (20). La tecnología de impresión en 3D ha demostrado ser capaz de producir formas anatómicas muy complejas tanto en comprimidos como en cápsulas, con principios activos de distintas características y con cinéticas de liberación acorde al efecto farmacológico buscado.
Por todo ello, se espera que en el futuro se produzcan nuevos dispositivos farmacéuticos para administrar medicamentos adaptados a las características anatómicas del cuerpo como: lentes de contacto cargadas con principios activos o uñas poliméricas farmacéuticas para tratar las infecciones por hongos, entre otros.
3.2.2 Personalización
La creciente conciencia en la industria de la salud de que las soluciones terapéuticas individuales y adaptadas son las características clave para el éxito del tratamiento de los pacientes ha dado lugar a nuevas tecnologías de procesamiento, entre las cuales destaca la 3DP. Esta técnica, a priori, puede que no se presente como la mejor opción de fabricación a gran escala. Esto se debe a que la velocidad de trabajo de una comprimidora convencional puede ser 100 veces superior a la de una impresora 3D, por ejemplo.
Sin embargo, a pesar de no poder igualar la velocidad de producción, es una técnica ciertamente útil para abordar una brecha terapéutica existente como la necesidad de individualización de las terapias farmacológicas, actuando de manera complementaria o alternativa a la producción convencional de medicamentos (20). Cabe destacar que, para la progresión de las terapias individualizadas, la producción de pequeños lotes de producto farmacéutico desempeña un papel fundamental. De no fabricarse a pequeña escala, estas novedosas terapias no avanzarían, ya que deben fabricarse a demanda y en momentos específicos (26). Así, la 3DP se podría definir como la técnica idónea para impulsar la fabricación a demanda de medicamentos personalizados.
Un elemento clave en el bienestar es la salud individual de una persona y, por ello, los medicamentos y el éxito de cualquier tratamiento farmacológico tienen un papel integral (2). Hipócrates ya aconsejaba tratar a la persona y no a la enfermedad (10), basándose en que el tratamiento de los aspectos individuales del paciente reemplaza al de la fisiopatología subyacente y es por ello que todo individuo requiere de un sistema de administración efectivo y personalizado, además de fármacos eficaces.
La personalización de los tratamientos es muy demandada en la población pediátrica y geriátrica, sobre todo. Los requerimientos de dosificación varían constantemente debido a los rápidos cambios en las funciones fisiológicas y metabólicas, la grasa corporal y las modificaciones en el aclaramiento renal (10). En el caso de los ancianos, la personalización se complica aún más con la polimedicación, ya que los pacientes de 65 años o más, toman entre 13-28 medicamentos diarios (10). Este dato es un ejemplo de la necesidad existente de un estricto control de la dosis, para reducir el potencial de interacciones y asegurar un tratamiento efectivo.
La precisión en la dosificación de los principios activos es uno de los principales beneficios de la 3DP, destacando particularmente la impresión por FFF por sus favorables resultados (20).
Está demostrado que las diferentes poblaciones de pacientes (recién nacidos, niños, adolescentes, adultos y personas mayores) requieren distintos regímenes de dosis de medicación; y las terapias con fármacos individualizados pueden aumentar la adherencia al tratamiento por parte de los pacientes, resolviendo así algunos de los desafíos relacionados con la eficacia de ciertas terapias.
La investigación en este campo puede permitir el diseño y fabricación de productos farmacéuticos de manera personalizada para satisfacer las necesidades futuras de los individuos y de los diferentes grupos de pacientes. Por lo tanto, el término medicina personalizada no debería ser usado exclusivamente para referirse a enfermedades metabólicas, sino que también debe extenderse para cubrir grupos de pacientes especiales, para quienes también es necesario un tratamiento adecuado a la edad (28).
La 3DP al ser tan flexible permite cambiar la forma y el tamaño de la forma de dosificación en respuesta a las necesidades del paciente, a diferencia de las técnicas de fabricación tradicionales (25). Las dosis de las formas farmacéuticas sólidas orales se eligen durante los ensayos clínicos iniciales, con la finalidad de ejercer un efecto terapéutico en la mayor parte de la población (10). Ejemplo de ello es la producción de fluoxetina (Prozac). El fabricante eligió una dosis de 20 mg para la producción en masa, ejerciendo un efecto en el 64% de la población. Sin embargo, con una dosis inferior (5 mg) el 54% de la población también mostró un efecto beneficioso, además de presentar menores efectos adversos y disminuir las tasas de abandono durante los ensayos respecto a la dosis más alta (10).
Los medicamentos personalizados se deberían describir como “una forma de suministrar fármacos a los individuos de manera segura y efectiva, a diferencia de los sistemas de suministro orientados a las masas”, según Jonathan y Karim (29). Por lo tanto, la dosificación personalizada debe permitir adaptar la cantidad de fármaco administrada en base al peso, altura y metabolismo del paciente.
Las formas de dosificación impresas en 3D podrían asegurar una dosificación precisa en lactantes o permitir la dosificación personalizada de fármacos altamente potentes, como la teofilina o la prednisolona. Se ha estimado que la prevalencia de efectos adversos debidos a un tratamiento no adaptado al paciente es del 75 al 85%, por lo que podría decirse que el rango de mejora farmacéutica es muy amplio (10).
Otro aspecto a tener en cuenta es la impresión multi-fármaco o polypill para combinar todos los PA de un paciente en una sola forma farmacéutica y toma diaria. Este tipo de 3DP supondría una mejora significativa en la adherencia al tratamiento de pacientes poli-medicados, como los ancianos. Muchas de las interacciones y efectos adversos presentes en esta población se deben a incumplimientos terapéuticos. Por tanto, el hecho de reducir el tratamiento de un individuo polimedicado a un comprimido de única toma diaria supondría una mejora en el cumplimiento terapéutico, y por consiguiente una reducción de las interacciones y los efectos adversos.
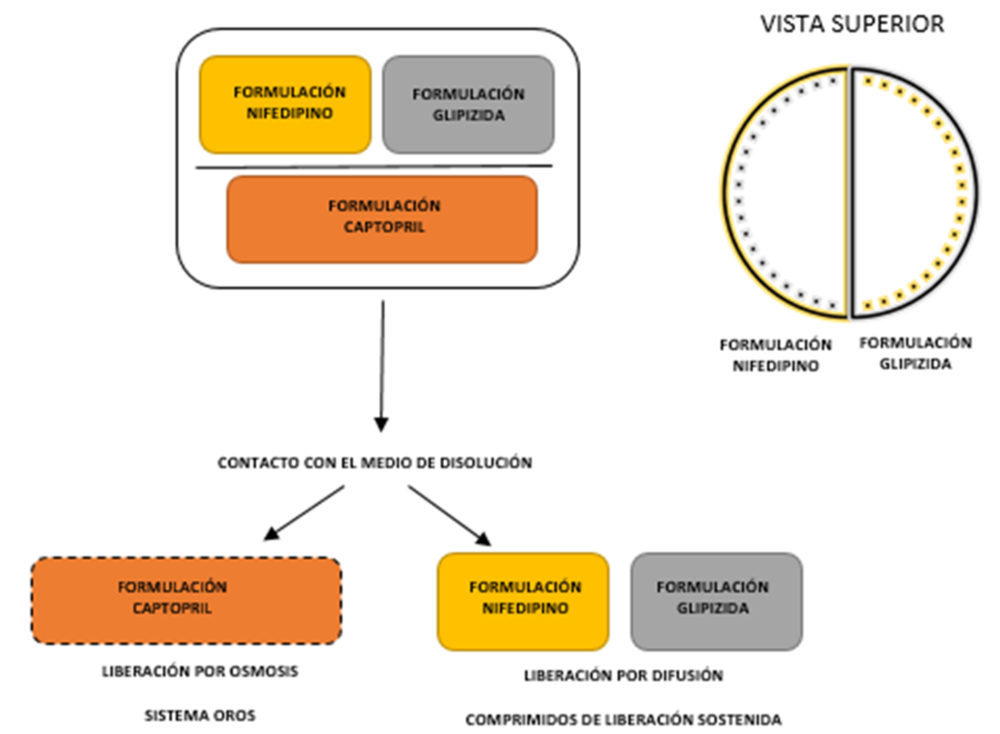
Ejemplo de ello es el comprimido multi-fármaco de glipizida, nifedipino y captopril ideado por Khaled et al (29). Además de la administración múltiple de PA, se busca obtener una liberación sostenida de nifedipino y glipizida, y una liberación controlada de captopril. Se demostró que una bomba osmótica permitía administrar el captopril (Figura 12) de una manera controlada durante un período largo de tiempo, independiente de la concentración de fármaco. Para ello, se empleó una matriz de hidroxipropilmetilcelulosa (HPMC) y una superficie formada por una membrana semipermeable de acetato de celulosa y PEG 6000. Esta, en contacto con fluidos acuosos, se disuelve creando poros superficiales y permitiendo la correcta liberación del PA.
De esta forma, se evidencia el potencial de las tecnologías de 3DP en la individualización del concepto polypill (Figura 12). No obstante, uno de los retos pendientes es la disminución del tamaño del comprimido, ya que podrían darse problemas de deglución de comprimidos de gran tamaño por su elevado contenido de excipientes (29).
En lo que a la personalización de implantes se refiere, la 3DP también permite la adaptación perfecta del dispositivo a las características anatómicas de los pacientes. Además, destaca la información reciente del Instituto Tecnológico de Massachusetts (MIT) respecto a la fabricación de implantes multi-fármacos para medir la eficacia quimioterapéutica de distintos fármacos en los tumores de pacientes. En resumen, la personalización puede mejorar significativamente la adherencia al tratamiento de los pacientes.
Figura 12. Esquema de un polypill compuesto por captopril, nifedipino y glipizida: se observa la distribución espacial de los distintos PA y los mecanismos de liberación de osmosis (captopril) y de difusión (nifedipino y glipizida).
Para demostrar esta idea, investigadores de la Universidad de Londres han impreso medicamentos en forma de animales para niños, ya que plantearon la hipótesis de que las figuras impresas “podrían aumentar potencialmente el cumplimiento de los pacientes pediátricos” (30). El escenario ideal sería que el médico podría preguntar a los propios niños, en este caso, acerca de los colores o formas preferidas de ellos para tenerlo en cuenta en la fabricación del medicamento; ya que el hecho de que los niños puedan tener su propio producto personalizado podría ser especialmente beneficioso para el éxito de la terapia, el resultado está aún por determinar.
3.2.3 Fabricación a demanda
Una impresora 3D puede fabricar una variedad muy amplia de productos de calidad, al igual que lo hace una impresora de inyección de tinta doméstica. La capacidad de impresión “a la carta” promete ser muy beneficiosa para la salud y, además de los beneficios expuestos en los puntos anteriores, destaca por ser útil en 3 situaciones: impresión directa sobre pacientes, impresión con recursos limitados e impresión de fármacos de baja estabilidad.
Actualmente, ya se han aplicado técnicas 3D para crear soportes en ingeniería de tejidos o geles de cicatrización de heridas, todo ello producido a demanda (31). Esta forma de impresión podría llegar a salvar vidas en situaciones con limitaciones de tiempo o recursos, tales como áreas de desastre, salas de emergencia, quirófanos, ambulancias o unidades de cuidados intensivos.
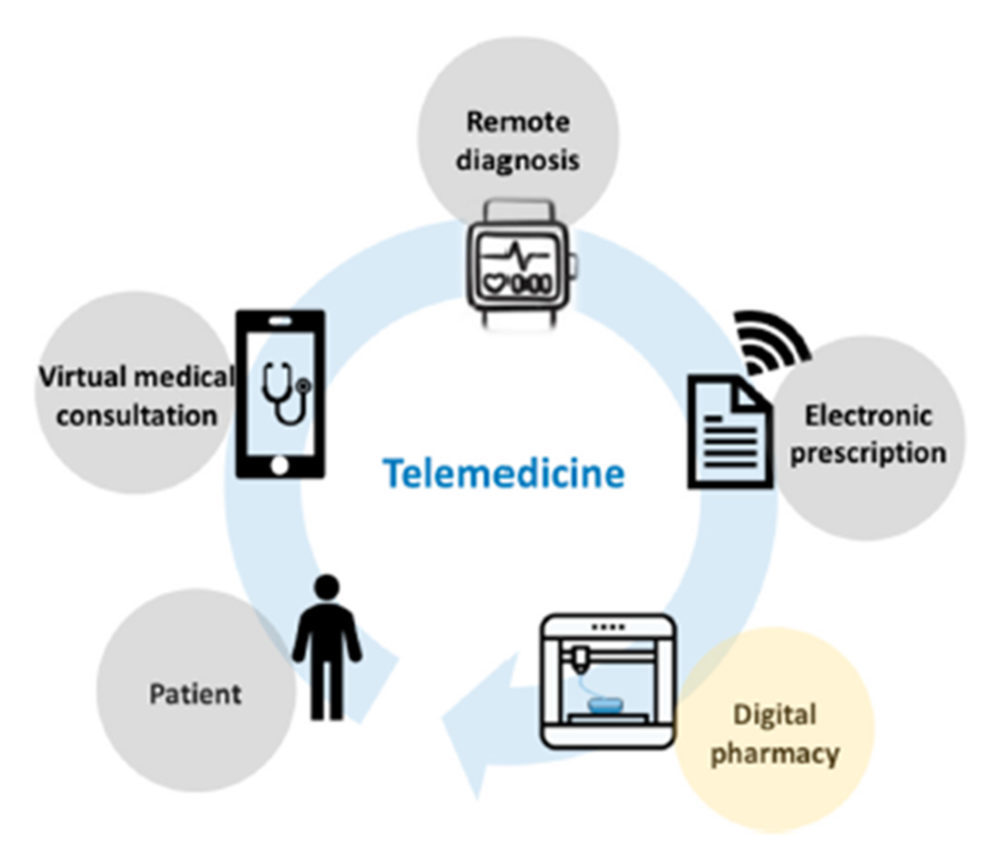
Los medicamentos impresos en 3D personalizados parecen ser la pieza que faltaba para completar la atención farmacéutica actual. La telemedicina (Figura 13) tiene la capacidad de ampliar el acceso a la salud, lo que permite contactar a pacientes de regiones necesitadas con médicos y farmacéuticos cualificados que emplean los recursos tecnológicos más novedosos del momento. Este tipo de medicamentos podrían presentarse como tratamientos farmacoterapéuticos en respuesta a una receta virtual, lo cual allana el camino hacia la farmacia virtual (20).
Figura 13. Esquema de la digitalización farmacéutica. Reproducido con permiso de (20).
En cuanto a la impresión de fármacos de baja estabilidad se refiere, en 2014, un equipo de la Universidad de Nottingham propuso utilizar el método para la impresión de nitroglicerina; fármaco utilizado para tratar la angina de pecho y caracterizado por su tendencia a degradarse en su almacenamiento (11). Este problema se evita en caso de ser fabricado al momento mediante 3DP; lo cual indica que diversos PA, actualmente en desuso por su baja estabilidad, podrían ser introducidos nuevamente en el mercado para ser utilizados eficazmente gracias a las técnicas aditivas.
Además, el uso de la 3DP también ofrece la posibilidad de eliminar parcialmente los equipos de fabricación tan costosos y específicos empleados hasta hoy. Esta idea es muy importante, ya que, en un futuro, la 3DP podría abaratar los costes de producción farmacéutica, y por consiguiente el precio final de los tratamientos.
3.3 Otras aplicaciones en el mundo sanitario
La 3DP ha sido introducida recientemente en los servicios de salud, y su uso resulta realmente inspirador por la capacidad y potencial de la 3DP de salvar vidas o mejorarlas dramáticamente (32). En las últimas décadas, además de en la fabricación de formas farmacéuticas, también se ha utilizado en investigación, educación o ingeniería de tejidos.
3.3.1 Investigación
La 3DP abre nuevas oportunidades para las actividades de investigación científica. Puede ayudar a aclarar los procesos fisiológicos que aún no se entienden completamente y, a su vez, a mejorar la comprensión de diversas complejas patologías (muchas de ellas de difícil diagnóstico o de áreas corporales de compleja morfología). Para ello se fabricarían modelos 3D sólidos, pudiéndose emplear materiales como el silicio o el poliuretano e imitar las propiedades elásticas de los vasos (6), por ejemplo.
En cuanto a los estudios farmacéuticos, se sabe que las líneas celulares se han utilizado tradicionalmente para la detección de drogas y la toxicología. Una vez que los agentes diana se identifican in vitro, se realizan estudios en animales. No obstante, los estudios en animales no necesariamente se traducen en resultados humanos.
Así, se evidencia la limitada capacidad de generalizar datos de modelos animales en seres humanos. Por ello, puede ser muy atractiva la creación de chips de tejido humano 3D que contengan estructuras de micro-tejido con múltiples tipos de células (3), donde los sistemas impresos reproduzcan interacciones célula-célula comparables a los tejidos u órganos reales. Debido al papel crucial del hígado en el metabolismo y la toxicidad de los fármacos, este va ser uno de los tejidos a prueba más importantes (8).
3.3.2 Educación y formación
Los procedimientos quirúrgicos requieren un conocimiento profundo de la anatomía humana y las relaciones topográficas de las diferentes estructuras anatómicas. Este conocimiento ha sido tradicionalmente desempeñado con la ayuda y preparación de cadáveres humanos. Siempre es favorable adquirir una mayor experiencia en el área de interés antes de operar al paciente, y la fabricación de modelos 3D son una herramienta útil para ello. Por eso, lo realmente interesante es que la 3DP permite estudiar y practicar la intervención quirúrgica de forma individualiza para cada intervención en particular. Además, los modelos 3D también permiten la práctica quirúrgica de cirujanos jóvenes sin tener que arriesgar la salud de ningún paciente para ello.
3.3.3 Ingeniería de tejidos
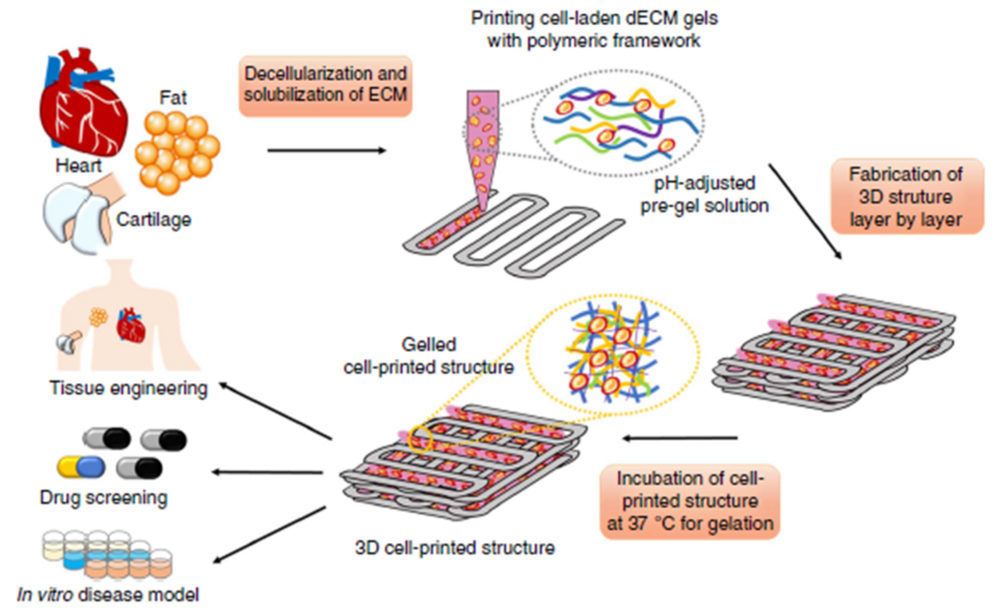
En EEUU cada 15 minutos se suma una persona a la lista de espera de trasplantes (33). Este dato es un ejemplo indicativo de la demanda existente en el mundo sanitario por la ingeniería de tejidos, y convierte a la 3DP de órganos y tejidos en una tecnología muy prometedora dentro de la industria de la salud. A pesar de necesitar tiempo para su establecimiento, los avances actuales para crear tejidos (vasos, tejido neuronal), órganos, huesos, cartílagos y dispositivos protésicos (36) proporcionan una visión de cómo nuestras vidas pueden ser mejoradas en los próximos años (14). Por ejemplo, utilizando las propias células de cultivo o células madre de un paciente, el Instituto Wake Forest de Medicina Regenerativa ha desarrollado una técnica de 3DP para la ingeniería de tejidos y órganos (Figura 14), donde el objetivo final es ayudar a resolver la escasez de órganos disponibles para trasplantes34.
Los científicos están trabajando en una variedad de proyectos incluyendo estudios sobre tejidos como el oído o músculo. La impresora empleada está diseñada para imprimir estructuras de órganos y tejidos utilizando datos de exploraciones médicas, tales como pruebas de imágenes de resonancia magnética (MRI). La idea básica es imprimir las células vivas, y los biomateriales que unen a las células, en una forma 3D. Esta estructura de órganos o tejidos se implanta en el cuerpo, donde continuaría desarrollándose.
Figura 14. Esquema del proceso de impresión de tejido utilizando tinta dECM*: los tejidos se solubilizan en condiciones ácidas y a pH fisiológico, todo ello tras pasar por una combinación de procesos físicos, químicos y enzimáticos. La impresión de tejidos se realizó capa por capa con la encapsulación de células madre vivas, seguido de la gelificación a 37ºC. Finalmente se observan algunas de las aplicaciones del tejido impreso. Reproducido con permiso de (35).
*Decellularized extracellular matrix (matrices extracelulares naturales)
4. Futuro de la técnica y conclusión
La industria farmacéutica dentro de 15 años será muy diferente a la que vivimos hoy, desde los medicamentos que serán comercializados hasta los asuntos económicos y la oficina de farmacia. De todas formas, lo más importante es que los elementos citados tengan un cambio positivo en todos los aspectos de la industria, contribuyendo a mejorar el objetivo principal, que es incrementar la calidad y esperanza de vida del ser humano.
No obstante, también se deben afrontar con valentía los retos pendientes de la técnica; ya que al igual que cualquier otra tecnología revolucionaria aún en desarrollo, necesita ajustes para su apropiada aclimatación al mundo sanitario. Por ejemplo, la viscosidad del material a imprimir debe tener un flujo adecuado para la correcta impresión, cosa que no siempre ocurre. A su vez, las propiedades mecánicas de las formulaciones deben ajustarse adecuadamente, de no ser así podrían surgir problemas. Algunos productos farmacéuticos impresos en 3D no presentan la estructura ideal; esto sucede cuando los componentes de la formulación se unen a otros elementos de la impresora y, por consiguiente, no se da la correcta unión partícula-partícula. Este problema interfiere en la liberación del fármaco, lo cual se traduce en un tratamiento ineficaz. En resumidas cuentas, es necesario el estudio de las limitaciones para saber en qué aspectos incidir con el propósito de corregir los errores actuales y pulir la 3DP de medicamentos al máximo.
A pesar de ello, la rápida evolución de las tecnologías de 3DP y el descubrimiento de las “tintas farmacéuticas” no hacen más que aumentar la confianza por la fabricación de formas farmacéuticas personalizadas. Esto, revolucionará el ámbito sanitario y acercará la fabricación de la forma de dosificación a los usuarios, proporcionando una dosis más eficaz y segura. Desde los años 90, el número de técnicas capaces de crear objetos sólidos capa por capa ha aumentado ampliamente, y parece que el interés por el desarrollo de métodos de fabricación aditiva de fármacos ha crecido en poco tiempo. En un futuro muy próximo, las compañías farmacéuticas podrían prestar una creciente atención a estas técnicas para desarrollar medicamentos personalizados, evitar incompatibilidades entre fármacos, diseñar formas de dosificación de liberación múltiple, aumentar la solubilidad de fármacos poco solubles (producción de formas amorfas), fabricar medicamentos con materiales porosos con un inicio rápido de acción o limitar la degradación de moléculas biológicas.
En unos años, estas tecnologías pueden transformar la práctica de la farmacia permitiendo que los tratamientos sean verdaderamente individualizados y adaptados específicamente a cada paciente. Los farmacéuticos podrían usar las características de cada individuo (edad, raza, metabolismo (28)) y el perfil farmacogenético para predecir una dosis de medicación específica. La medicación podría ser dispensada por un sistema automatizado incorporado a la tecnología 3DP y las dosis podrían ajustarse cambiando los parámetros de la impresora basándose en la respuesta clínica del paciente.
La tecnología 3DP, incluso, podría llegar hasta centros ambulatorios si la mayoría de los fármacos estuvieran disponibles en forma de tinta imprimible o la tinta se pudiera combinar en la farmacia. Entonces, los pacientes podrán reducir su carga de medicamentos considerablemente a un polypill por día, lo que mejoraría sustancialmente la adherencia del paciente. Esto supondría un paso de gigante para la tecnología farmacéutica y el campo sanitario, en general. Además, las tecnologías 3DP podrían reemplazar las actuales tecnologías aditivas y disminuir el costo total de fabricación, reduciendo el uso de tecnologías innecesarias.
Como en otros campos, grandes avances suponen grandes sacrificios y tiempo de espera. Las regulaciones y los requisitos de la 3DP podrían llegar a ser un obstáculo en lo que a la adopción rápida de la impresión de fármacos se refiere. Se deben llevar a cabo rigurosos ensayos, los cuales requieren gran financiación además de tiempo. Esto podría suponer una barrera para la aplicación inmediata de las formas de dosificación impresas en 3D.
Sin embargo, no debe olvidarse que el desarrollo de los procesos de impresión tridimensional en el campo farmacéutico está en sus inicios. A pesar de hacer incursiones masivas en otras industrias manufactureras como la industria aeroespacial y automotriz, la 3DP aún está en su infancia. Muchos desafíos técnicos y regulatorios deben ser superados antes de la adopción generalizada en la industria farmacéutica. Sin embargo, con el ritmo al que se está desarrollando la 3DP y las ventajas que aporta a la forma de dosificación personalizada, su importancia no puede ser ignorada, y la inversión de tiempo y fondos valen la pena.
El potencial de la 3DP en el desarrollo de productos farmacéuticos personalizados es innegable; sin embargo, es fundamental que los equipos de impresión se adapten a la tecnología y características farmacéuticas. Además, un proceso de producción viable como el presente necesita de la coparticipación de la industria farmacéutica y de las farmacias digitales; sin olvidar lo necesario que es trabajar conjuntamente con las agencias regulatorias para establecer este tipo de producto en el mercado y en el mundo sanitario.
La factibilidad comercial de esta tecnología se ha demostrado a través de la aprobación de la FDA de un producto farmacéutico impreso en 3D en agosto de 2015; y generalmente, la FDA fomenta el desarrollo de formas de dosificación complejas y procesos de fabricación, como la impresión de comprimidos 3D. Si bien la experiencia de fármacos impresos en 3D es limitada y las técnicas de impresión en 3D son variadas, las estrategias de impresión actuales son factibles.
En los próximos años las tecnologías de 3DP podrían ser una alternativa, a veces total y otras complementaria, de los procesos de fabricación actuales. ¿Se aproxima otra revolución industrial? Independientemente de la respuesta, será una verdadera revolución la forma en la que los productos son fabricados.
5. Referencias
1. Boussel P, Bonnemain H, Bové F. Histoire de la pharmacie et de l’industrie pharmaceutique. Paris: Editions Pro – Officina; 1990.
2. Sandler N, Preis M. Printed Drug-Delivery Systems for Improved Patient Treatment. Trends in Pharmacological Sciences. 2017;38(3):317
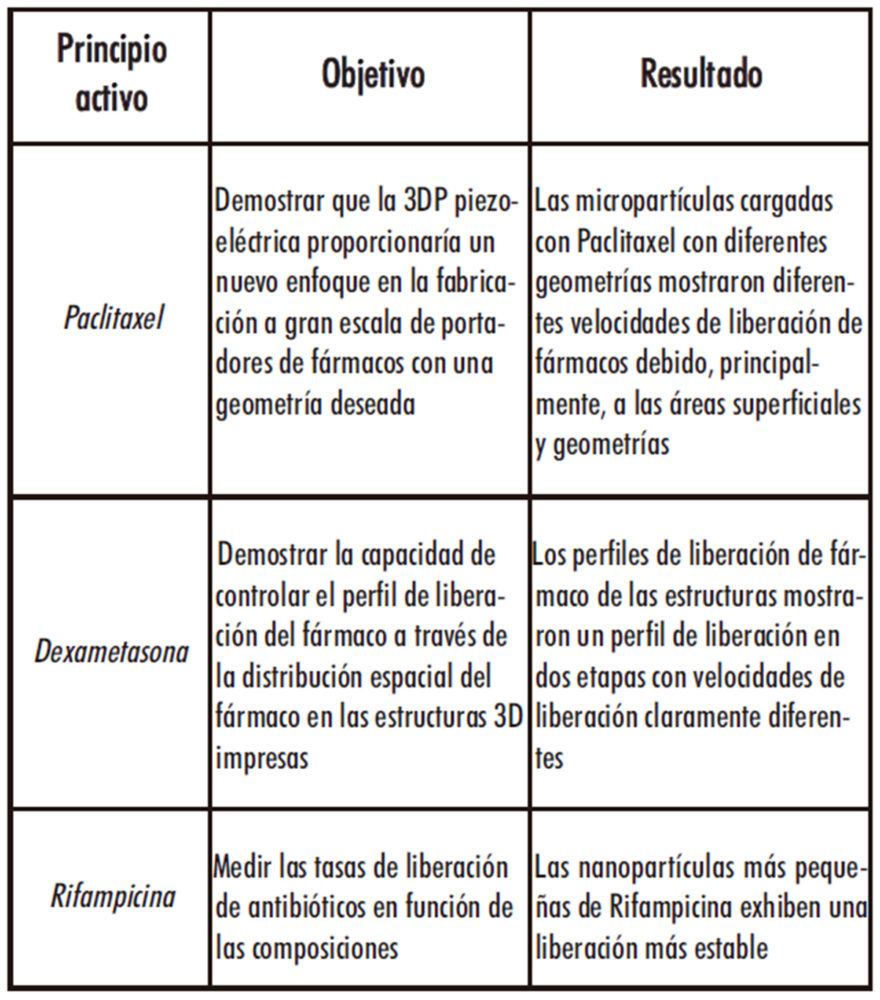
3. Khaled SA, Burley JC, Alexander MR, Yang J, Roberts CJ. 3D printing of five-in-one dose combination polypill with defined immediate and sustained release profiles. J Control Release. 2015;217:308–14.
4. Goyanes A, Wang J, Buanz A, Martínez-Pacheco R, Telford R, Gaisford S et al. 3D Printing of Medicines: Engineering Novel Oral Devices with Unique Design and Drug Release Characteristics. Molecular Pharmaceutics. 2015;12(11):4077-4084.
5. Yu D, Zhu L, Branford-White C, Yang X. Three-Dimensional Printing in Pharmaceutics: Promises and Problems. Journal of Pharmaceutical Sciences. 2008;97(9):3666-3690.
6. Rengier F, Mehndiratta A, von Tengg-Kobligk H, Zechmann C, Unterhinninghofen R, Kauczor H et al. 3D printing based on imaging data: review of medical applications. International Journal of Computer Assisted Radiology and Surgery. 2010;5(4):335-341.
7. Sanchez Jimenez F, Fernandez de la Puente A, Llorente Geniz J. TECNICAS DE PROTOTIPADO RAPIDO. Universidad de Sevilla, España
8. Shafiee A, Atala A. Printing Technologies for Medical Applications. Trends in Pharmacological Sciences. 2017.
9. T. Rowe Price. A brief history of 3D printing. 2011
10. Alomari M, Mohamed F, Basit A, Gaisford S. Personalised dosing: Printing a dose of one’s own medicine. International Journal of Pharmaceutics. 2015;494(2):568-577.
11. Norman J, Madurawe R, Moore C, Khan M, Khairuzzaman A. A new chapter in pharmaceutical manufacturing: 3D-printed drug products. Advanced Drug Delivery Reviews. 2017;108:39-50.
12. Preis M, Breitkreutz J, Sandler N. Perspective: Concepts of printing technologies for oral film formulations. International Journal of Pharmaceutics. 2015;494(2):578-584.
13. Ursan I, Chiu L, Pierce A. Three-dimensional drug printing: A structured review. Journal of the American Pharmacists Association. 2013;53(2):136-144.
14. Chia H, Wu B. Recent advances in 3D printing of biomaterials. Journal of Biological Engineering. 2015;9(1).
15. Kolakovic R, Viitala T, Ihalainen P, Genina N, Peltonen J, Sandler N. Printing technologies in fabrication of drug delivery systems. Expert Opinion on Drug Delivery. 2013;10(12):1711-1723.
16. Axpe E, Oyen M. Applications of Alginate-Based Bioinks in 3D Bioprinting. International Journal of Molecular Sciences. 2016;17(12):1976.
17. Kinstlinger I, Bastian A, Paulsen S, Hwang D, Ta A, Yalacki D et al. Open-Source Selective Laser Sintering (OpenSLS) of Nylon and Biocompatible Polycaprolactone. PLOS ONE. 2016;11(2):e0147399.
18. Goyanes A, Buanz A, Basit A, Gaisford S. Fused-filament 3D printing (3DP) for fabrication of tablets. International Journal of Pharmaceutics. 2014;476(1-2):88-92.
19. Do A, Khorsand B, Geary S, Salem A. 3D Printing of Scaffolds for Tissue Regeneration Applications. Advanced Healthcare Materials. 2015;4(12):1742-1762.
20. Araújo M, Sa-Barreto L, Gratieri T, Gelfuso G, Cunha-Filho M. The Digital Pharmacies Era: How 3D Printing Technology Using Fused Deposition Modeling Can Become a Reality. Pharmaceutics. 2019;11(3):128.
21. Khaled S, Burley J, Alexander M, Roberts C. Desktop 3D printing of controlled release pharmaceutical bilayer tablets. International Journal of Pharmaceutics. 2014;461(1-2):105-111.
22. Esteva de Sagrera J. Historia de la farmacia. Barcelona: Masson; 2005.
23. Boetker J, Water J, Aho J, Arnfast L, Bohr A, Rantanen J. Modifying release characteristics from 3D printed drug-eluting products. European Journal of Pharmaceutical Sciences. 2016;90:47-52.
24. FDA approves the first 3D printed drug product, Aprecia Introduces its First Product Using the ZipDose® Formulation Platform for the Treatment of Epilepsy. Aprecia Pharmaceuticals. 2015.
25. Alhnan M, Okwuosa T, Sadia M, Wan K, Ahmed W, Arafat B. Emergence of 3D Printed Dosage Forms: Opportunities and Challenges. Pharmaceutical Research. 2016;33(8):1817-1832.
26. Öblom H, Zhang J, Pimparade M, Speer I, Preis M, Repka M et al. 3D-Printed Isoniazid Tablets for the Treatment and Prevention of Tuberculosis—Personalized Dosing and Drug Release. AAPS PharmSciTech. 2019;20(2).
27. Goole J, Amighi K. 3D printing in pharmaceutics: A new tool for designing customized drug delivery systems. International Journal of Pharmaceutics. 2016;499(1-2):376-394.
28. Raijada D, Genina N, Fors D, Wisaeus E, Peltonen J, Rantanen J et al. A Step Toward Development of Printable Dosage Forms for Poorly Soluble Drugs. Journal of Pharmaceutical Sciences. 2013;102(10):3694-3704.
29. Goole J, Amighi K. 3D printing in pharmaceutics: A new tool for designing customized drug delivery systems. International Journal of Pharmaceutics. 2016;499(1-2):376-394.
30. M. P. Chhaya, P. S. Poh, and E. R. Balmayor, et al. Additive manufacturing in biomedical sciences and the need for definitions and norms. Expert Rev. Med. Devices 12 (2015) 537-543.
31. A. Skardal, et al., Bioprinted amniotic fluid-derived stem cells accelerate healing of large skin wounds. Stem. Cells. Transl. Med. 1 (2012) 792-802.
32. Sun Y, Ruan X, Li H, Kathuria H, Du G, Kang L. Fabrication of non-dissolving analgesic suppositories using 3D printed moulds. International Journal of Pharmaceutics. 2016;513(1-2):717-724.
33. Mandrycky C, Wang Z, Kim K, Kim D. 3D bioprinting for engineering complex tissues. Biotechnology Advances. 2016;34(4):422-434.
34. 3D Printing and the Future of Manufacturing. Computer Sciences Corporation. USA; 2012.
35. Pati F, Jang J, Ha D, Won Kim S, Rhie J, Shim J et al. Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink. Nature Communications. 2014;5.
36. Salvador Verges À, Otero Viñas M, Fernández Luque L, García Cuyàs F. Medical Applications of 3D Printing. Universidad de Vic; 2016.