El incremento de animales de compañía y animales productores de alimentos, junto con el importante gasto sanitario que estos suponen, hacen que el sector del medicamento veterinario esté adquiriendo cada vez más peso en España. Ante esta situación, se nos plantea la duda de si los propietarios, veterinarios y especialmente farmacéuticos, estamos correctamente preparados e informados. Tal como se observa en la recopilación de leyes sobre venta y distribución de medicamentos de uso veterinario realizada en este trabajo, actualmente no existe una legislación que se adecúe a las necesidades sanitarias de estos animales pudiendo observar en su aplicación intrusiones por parte del veterinario en las funciones legalmente establecidas y propias del farmacéutico o la venta ilegal de medicamentos veterinarios por parte de establecimientos sin la debida autorización. Por lo que al farmacéutico respecta, la falta de información y formación en este campo se manifiesta en varios aspectos como la falta de atención farmacéutica o la aceptación de recetas indebidamente cumplimentadas por el veterinario. Todo ello incrementa el riesgo de realizar un mal uso de los medicamentos por parte del propietario suponiendo así un peligro no solo para el propio animal, sino también para las personas como ocurre en el caso concreto de los antibióticos. Por tanto, nos encontramos frente a un importante problema de regulación y falta de información entre propietarios y profesionales sanitarios, que hace necesaria la realización de campañas informativas y la formación de farmacéuticos y veterinarios desde los Colegios Oficiales y Universidades.
The veterinary medicinal sector is gaining more and more importance in Spain because of the increasing of livestock population and pets, and the significant healthcare costs that they involve. Given this situation, are the owners, veterinarians and especially pharmacists, properly prepared and informed? As it can be seen in the compilation of laws about sale and distribution of veterinary medicaments presented in this work, nowadays there is not a legislation adapted to the health requirements of these animals. Indeed, there are some problems in the application of the law such the intrusion of veterinarians in the own and legally established pharmacist’s functions and the ilegal sale of veterinary drugs by non properly authorized establishments. Concerning the pharmacist’s role, the lack of information and training in this area, is manifested in several aspects such a limited ability of pharmaceutical advice and the admission of prescriptions improperly filled by the veterinarian. Taken together, it increases the risk of abuse or wrong use of drugs by the owner, assuming a real danger not only for the animal itself, but also for the people, as in the case of antibiotics consumption. In conclusion, we are facing a critical problem of law regulation and lack of knowledge between owners and healthcare professionals. Therefore, it would be necessary that Universities and Official Colleges carry out information campaigns and organize specific training to pharmacists and veterinarians.
Keywords: Veterinary drugs; Pharmacy; Legislation; Prescription; Pets; Antibiotics.
1.INTRODUCCIÓN
El mundo veterinario está adquiriendo cada vez más peso en España. Por un lado, con los animales productores de alimentos, de los cuales hay registrados alrededor de 767 millones de cabezas ganaderas, incluyendo aves de corral (1). Y, por otro lado, el creciente número de animales de compañía, unos 13 millones, aunque si tenemos en cuenta todos aquellos que no están registrados, se estima que nos movemos en torno a los 20 millones de mascotas (2). Esto quiere decir que, en al menos el 40% de hogares en España, hay un animal doméstico que convive estrechamente con el ser humano.
Además del creciente número de animales, nos encontramos frente a un aumento en los cuidados que el propietario proporciona y en el gasto por animal, entre los que se encuentran los cuidados sanitarios. En total, en España se invierten más de 590 millones de euros en medicamentos veterinarios.
Ante esta situación, es evidente que es necesario un control. Por ello nos disponemos a analizar si el marco legal actual es suficiente para realizarlo y si los profesionales implicados (farmacéuticos y veterinarios) estamos suficientemente informados y preparados. También estudiaremos los problemas que aparecen en la aplicación de la normativa existente.
2. MARCO LEGAL
El papel del farmacéutico en la venta y distribución de medicamentos destinados a la salud humana está perfectamente regulado y establecido. Las distintas materias que se cursan a lo largo del plan de estudios del Grado en Farmacia, se encuentran mayoritariamente centradas en salud humana y solo muy colateralmente se hace relación a la venta y distribución de medicamentos destinados a animales.
Sin embargo, el papel del Farmacéutico en la venta y distribución de medicamentos veterinarios (MV) no siempre es claro. Las competencias comunes con otros profesionales sanitarios (especialmente veterinarios), el hecho de que algunos de los animales receptores de medicación vayan a ser fuente de alimentos humanos, el que no existan (o sean muy minoritarias) oficinas de farmacia (OF) específicas para medicamentos veterinarios y que la venta y distribución se puedan realizar por diferentes vías, suponen entre otros, los motivos por los que resulta necesario situarnos en contexto y profundizar en el lugar que ocupa el farmacéutico en el sector del medicamento de uso veterinario.
Por otra parte, no resulta fácil encontrar la legislación que regula la posesión, venta y distribución de los MV: la normativa europea se ha adaptado a las regulaciones de cada estado miembro de la UE y, en España, la transferencia de competencias en materia de sanidad ha supuesto marcos reguladores diferentes para cada Comunidad Autónoma (C.A.).
Además, el sector del MV se caracteriza por determinadas particularidades. Así, los medicamentos destinados a los animales productores de alimentos de consumo humano sólo podrán autorizarse en condiciones que garanticen la inocuidad de estos alimentos para el consumidor en lo que respecta a la posible existencia de residuos de tales medicamentos.
Finalmente, a esta situación hay que añadir las continuas actualizaciones que implican modificaciones en legislaciones vigentes. Este panorama ha supuesto que el trabajo que presento haya tenido que comenzar con una intensiva búsqueda de legislación a diferentes niveles: Unión Europea (3,4), España (5-7) y Comunidades Autónomas (8-12), actualizando las escasas publicaciones existentes sobre el tema (13).
En el capítulo 3, se expone la legislación europea, su adaptación en el Estado Español y las diferencias entre dos Comunidades Autónomas (CC.AA.) limítrofes que se han tomado como ejemplo: La Rioja y el País Vasco. En el capítulo 4 se comenta la situación concreta que se encuentra a la hora de aplicar la normativa legal en la C.A. de La Rioja.
De la normativa vigente se extrae la definición de conceptos y terminología aplicable que resulta necesaria establecer antes de abordar con rigor este tema.
2.1. Definiciones
2.1.a Medicamento veterinario
Se define como MV toda sustancia o combinación de sustancias que se presente como poseedora de propiedades curativas o preventivas con respecto a las enfermedades animales, o que pueda administrarse al animal con el fin de restablecer, corregir o modificar sus funciones fisiológicas ejerciendo una acción farmacológica, inmunológica o metabólica, o de establecer un diagnóstico clínico veterinario (3-7).
Los MV legalmente reconocidos en España son los siguientes:
a) Las especialidades farmacéuticas de uso veterinario.
b) Los medicamentos prefabricados de uso veterinario.
c) Las premezclas medicamentosas y los productos intermedios elaborados con las mismas con destino a piensos.
d) Las fórmulas magistrales destinadas a los animales.
e) Los preparados o fórmulas oficinales.
f) Las autovacunas de uso veterinario.
2.1.b. Receta veterinaria
Se entiende por receta veterinaria el documento normalizado por el cual los facultativos legalmente capacitados prescriben la medicación para su dispensación por los centros autorizados (5-7). Estas recetas deberán cumplir con los requisitos que se establecen de acuerdo con el apartado 4 del artículo 85 de la Ley 25/1990, expuesto en el punto 3.5 de este trabajo (Figura 1).

2.1.c. Tiempo de espera
Periodo de tiempo necesario entre la última administración del medicamento veterinario a un animal y la obtención de productos alimenticios de dicho animal, a fin de proteger la salud pública, garantizando que dichos productos alimenticios no contengan residuos en cantidades que superen los límites máximos de residuos de sustancias activas fijados de conformidad con el Reglamento (CEE) número 2377/1990 del Consejo, de 26 de junio de 1990, por el que se establece un procedimiento comunitario de fijación de los límites máximos de residuos de los medicamentos veterinarios en alimentos de origen animal (3,4).
2.1.d. Pienso medicamentoso
Todo pienso que lleva incorporado una premezcla medicamentosa (5-7).
3. LEGISLACIÓN ACTUAL
Como se ha explicado anteriormente, mediante la recopilación de la normativa vigente a diferentes niveles (europea, nacional y autonómica), nos disponemos a dar respuesta a algunas de las preguntas que surgen asiduamente a la hora de afrontar el tema de los MV. Entre estas preguntas se encuentra el tema central de este trabajo: establecer el papel del farmacéutico en la venta y distribución de estos medicamentos.
3.1. Sobre prescripción: ¿qué medicamentos necesitan prescripción?
La legislación europea (3,4) se completa con la española (5-7) al establecer los MV que deben prescribirse para su dispensación:
a) Medicamentos de administración directa por el veterinario. En los que se incluyen gases medicinales y medicamentos inmunológicos.
b) Medicamentos cuyo suministro o utilización están sujetos a restricciones oficiales como las de los convenios de las Naciones Unidas contra el tráfico ilícito de sustancias estupefacientes y psicótropas.
c) Los destinados a tratamientos o procesos patológicos que requieran un diagnóstico preciso previo o que interfieran en acciones diagnósticas posteriores.
d) Medicamentos destinados a animales productores de alimentos exceptuando aquellas sustancias que no entrañan ningún riesgo directo o indirecto, incluso si se administra incorrectamente, para los animales tratados, las personas que lo administran, las personas que consumen sus productos o el medio ambiente.
e) Prescripción excepcional por vacío terapéutico, incluidos preparados oficiales, fórmulas magistrales y autovacunas.
f) Medicamentos de uso humano para uso animal.
Se establece que sea el veterinario quien deba llevar un registro que contenga la fecha de examen de los animales, la identificación del propietario, el número de animales tratados, el diagnóstico, los medicamentos prescritos, las dosis administradas, la duración del tratamiento y los tiempos de espera recomendados. Toda esta información deberá guardarla durante al menos cinco años (7).
3.2. Sobre dispensación: ¿quién puede dispensar los MV y dónde?
La legislación española (5-7) nombra como únicos centros dispensadores de MV a las OF. Aun así, las entidades o agrupaciones ganaderas y los establecimientos comerciales detallistas también podrán dispensar MV siempre que tengan la debida autorización y que estén bajo el control de sus respectivos servicios farmacéuticos.
Al igual que en medicamentos de uso humano, el papel de los almacenes distribuidores será únicamente el abastecer de estos medicamentos a los centros dispensadores.
3.2.a. Oficinas de farmacia
Las OF, además de poder dispensar los MV, serán los únicos centros autorizados en la elaboración y dispensación de formulaciones magistrales y preparados oficinales.
En caso de desabastecimiento de un MV y siempre que se obtenga la conformidad del interesado, sólo el farmacéutico/a podrá realizar una sustitución por otro con la misma composición, forma farmacéutica, vía de administración y dosificación. De esta posibilidad quedan excluidos los medicamentos inmunológicos y aquellos que determine el Ministerio de Agricultura, Pesca y Alimentación de acuerdo con el de
Sanidad y Consumo por su biodisponibilidad y estrecho margen terapéutico.
En caso de urgencia o lejanía de una OF, también podrán ponerse a disposición botiquines de urgencia para la dispensación de MV, pero deberá estar vinculado con un establecimiento autorizado dispensador de estos medicamentos (5-12).
3.2.b. Entidades o agrupaciones ganaderas
Según el artículo 85 del Real Decreto de 1995 (5), las entidades o agrupaciones ganaderas interesadas en la dispensación de MV deberán disponer de locales acondicionados para su almacenamiento, deberán llevar a cabo un programa zoosanitario aprobado por la Comunidad Autónoma correspondiente y deberán estar bajo la supervisión de un servicio farmacéutico y un servicio veterinario.
Otro de los requisitos que deben cumplir este tipo de entidades es la dispensación exclusiva a los miembros que formen dicha agrupación. Por tanto, el ámbito de actuación podrá ser tan amplio como el que abarquen las explotaciones ganaderas, pero se requerirán tantos servicios farmacéuticos como centros de dispensación y tantos servicios veterinarios como sean necesarios para la realización de visitas periódicas a las explotaciones.
3.2.c. Establecimientos comerciales detallistas
Los establecimientos comerciales detallistas también podrán dispensar MV (incluidos los piensos medicamentosos) a clínicas veterinarias, entidades ganaderas y propietarios de animales domésticos. Esta dispensación deberá realizarla el farmacéutico o bajo su supervisión (5-7).
En la legislación del País Vasco se especifica que, durante las franjas horarias en las que el farmacéutico no estuviera presente, se actuará según el plan de trabajo establecido por el farmacéutico responsable a quien el Colegio Oficial de Farmacéuticos denomina “Farmacéutico Garante”, cuyo papel se desarrolla más adelante (9,10). Esta figura también está presente en La Rioja, aunque no se especifique en la legislación.
Por otro lado, los MV destinados a peces de acuario, pájaros de casas particulares, palomas mensajeras, animales de terrario, pequeños roedores, hurones y conejos utilizados únicamente como animales de compañía, que no contengan sustancias que exijan un control veterinario y que no requieran prescripción veterinaria, también podrán comercializarse en establecimientos minoristas autorizados (comúnmente llamados “tiendas de animales” o “pajarerías”). Esto supone que los establecimientos tienen que ser aptos para el almacenamiento de este tipo de medicamentos y llevar un control documental de las dispensaciones (5).
3.3. Sobre documentación y requisitos necesarios para posesión y transferencia de medicamentos veterinarios
3.3.a. Autorización y registro
Para tener y comercializar MV con propiedades anabolizantes, antiinfecciosas, antiparasitarias, antiinflamatorias, hormonales o psicótropas se necesita autorización. En La Rioja (11,12), aquellos centros que dispongan esa autorización, deben estar presentes en el Registro Oficial de
Centros Relacionados con los Medicamentos Veterinarios. Una vez que tengan la autorización, deberá guardarse un registro de los movimientos de estos medicamentos durante cinco años (7).
Los propietarios o responsables de animales productores de alimentos también deben justificar la adquisición, posesión y administración de MV a dichos animales. Para ello deberán guardar la copia de la receta durante los cinco años siguientes a su administración, incluso cuando el animal sea sacrificado durante ese periodo (5-8).
3.3.b. Requisitos de los almacenes de distribución
Los almacenes mayoristas de distribución deben reunir ciertos requisitos, entre los que se encuentran (5-8):
a) Condiciones de locales e instalaciones que permitan asegurar el mantenimiento de la calidad de los MV.
b) Instalaciones diferenciadas para estupefacientes y psicótropos y para medicamentos de uso humano.
c) Presencia de personal técnico cualificado (Director Técnico Farmacéutico)
3.3.c. Requisitos de agrupaciones ganaderas y establecimientos detallistas
La legislación del País Vasco (9,10) y de La Rioja (11,12) coinciden en que las entidades o agrupaciones ganaderas y los establecimientos comerciales detallistas deben reunir, para su autorización, los siguientes requisitos:
a) Condiciones de locales e instalaciones que permitan asegurar el mantenimiento de la calidad de los MV.
b) Posesión de un servicio veterinario y un servicio farmacéutico.
c) Diferenciación de la zona de atención al usuario y el almacén.
d) Almacenamiento de estupefacientes, psicótropos y otras sustancias sometidas a control especial, bajo la responsabilidad y custodia del técnico farmacéutico.
e) Posesión de un archivo en el que consten los documentos y registros obligatorios (recetas, transacciones realizadas, etc.)
El farmacéutico responsable o farmacéutico garante podrá hacerse cargo también de otros servicios farmacéuticos (hasta un máximo de cuatro como se especifica en la legislación del País Vasco (9)) siempre que demuestre el cumplimiento de sus funciones y obligaciones, valorándose su disponibilidad, residencia y volúmenes de dispensaciones del Centro.
3.4. Sobre entidades oficiales de control y autorización: ¿quién controla y autoriza?
Una vez que el centro demuestre tener personal técnicamente capacitado y el local y equipos adecuados para la conservación y manipulación de MV, podrán acceder a solicitar una autorización de dispensación.
Generalmente, esta autorización la otorgará de manera expresa y justificada, la Dirección General de Sanidad de la Producción Agraria del Ministerio de Agricultura, Pesca y Alimentación (en La Rioja, la Consejería de Agricultura, Ganadería y Desarrollo Rural (12) y en el País Vasco, el Departamento de Agricultura, Pesca y Política Alimentaria (10)), de acuerdo con la Dirección General de Farmacia y Productos Sanitarios del Ministerio de Sanidad y Consumo (5).
3.4.a. Autorización de los laboratorios preparadores de MV
Para que un laboratorio pueda fabricar MV o cualquiera de los procesos que ello implica como el envasado, el acondicionamiento y la presentación de venta, debe solicitar una autorización que le será dada por la Dirección General de Sanidad de la Producción Agraria del Ministerio de Agricultura, Pesca y Alimentación, de acuerdo con la Dirección General de Farmacia y Productos Sanitarios del Ministerio de Sanidad y Consumo. Una vez autorizado, el Ministerio de Agricultura, Pesca y Alimentación, lo hará público en el Boletín Oficial del Estado (BOE).
Para su autorización, el laboratorio deberá disponer de un director técnico, un responsable de fabricación y un responsable de control de calidad. Estos últimos, bajo la autoridad del director técnico.
En la solicitud, además de lo mencionado anteriormente, se deberá detallar los MV y las formas farmacéuticas que pretenda fabricar.
3.4.b. Oficinas de farmacia y almacenes de distribución
Tanto en La Rioja como en el País Vasco, las OF y almacenes de distribución farmacéutica de uso humano que ya estén autorizados por sus respectivas Consejerías de Salud, quedan exceptuados de solicitar su inclusión en el Registro Oficial de Centros relacionados con los MV (9-12).
Sin embargo, deberán comunicar a las respectivas Consejerías de Salud su intención de dispensar o distribuir este tipo de medicamentos. Ésta será la encargada de remitir la información, de manera anual, a la Consejería de Agricultura, Ganadería y Desarrollo Rural que corresponda, quien otorgará dicha autorización tras verificar que los datos expuestos en la solicitud y las condiciones del establecimiento sean correctos.
3.4.c. Entidades o agrupaciones ganaderas
Una vez que la agrupación ganadera demuestre cumplir con los requisitos mencionados anteriormente y que dispongan de la presencia de al menos un veterinario, por un lado, y por el otro, un farmacéutico al frente del servicio farmacéutico, podrá pedir la autorización de dispensación de MV a las Consejerías de Agricultura, Ganadería y Pesca.
Una vez autorizado, sólo podrán distribuir MV a los miembros que compongan dicha agrupación.
Actualmente, La Rioja no dispone de ninguna agrupación ganadera mientras que en el País Vasco se encuentra la entidad ABERE, situada en Vitoria (14).
3.4.d. Establecimientos comerciales detallistas
Lo mismo ocurre en el caso de los establecimientos detallistas. Una vez que entreguen la documentación pertinente en la que demuestren tener espacios que cumplan con las condiciones para el almacenamiento y dispensación de MV y la contratación de un servicio farmacéutico que asegure esas condiciones y el correcto cumplimiento del servicio de dispensación, podrán solicitar la autorización a las Consejerías de Agricultura, Ganadería y Pesca.
En este momento, La Rioja cuenta con seis establecimientos comerciales detallistas autorizados (cuatro de ellos en Logroño) mientras que el País Vasco cuenta con 21 (sólo uno situado en Vitoria) (14).
3.5. Sobre recetas
Las recetas de MV estarán formadas por una parte original destinada al centro dispensador y dos copias: una para el propietario o responsable de los animales y otra para el veterinario que efectúa la prescripción. No podrán superar el tratamiento en más de un mes.
En este documento debe aparecer (5-8) (Figura 1):
a) Datos del prescriptor: Nombre y dos apellidos, dirección completa, provincia del Colegio al que pertenece, número de colegiado y NIF.
b) Datos del propietario o responsable de los animales: nombre y apellidos, dirección y, si es el caso, el Código de Registro de la explotación ganadera.
c) Medicamento: denominación legible, forma farmacéutica, presentación y número de ejemplares a dispensar en el caso de que existan varias.
d) Tiempo de espera en los animales productores de alimento con destino al consumo humano, aunque sea nulo.
e) Animal: especie y número.
f) Frases: “Válido sólo para un medicamento” y “Caduca a los diez días”. Se pueden encontrar al reverso de la receta.
g) Firma y rúbrica del prescriptor y fecha de prescripción.
Las instrucciones sobre el uso o la administración del medicamento podrán figurar en la receta o en la copia destinada al propietario o responsable.
Sin embargo, guías publicadas por el Consejo General de Colegios Oficiales de Farmacéuticos especifican que todos estos apartados deberán estar en las recetas destinadas a animales productores de alimentos de consumo humano mientras que en el caso de animales domésticos, para que la receta sea válida y pueda ser dispensado el medicamento, deben tener como mínimo los datos relativos al prescriptor (nombre y dos apellidos, firma, dirección completa, número de colegiado y provincia de colegiación), datos relativos a la prescripción (denominación del medicamento, forma farmacéutica y número de envases) y la fecha de prescripción (15).
El centro dispensador y el veterinario que prescribe deberán conservar las recetas durante al menos cinco años mientras que la copia destinada al propietario será retenida también por éste hasta pasados los seis meses después de realizar el tratamiento y el tiempo de espera que figura en ella (5-8).
3.6. Sobre fórmulas magistrales y preparados oficinales
La formulación magistral, tanto en humanos como en animales, está experimentando una mayor demanda en los últimos años. En el caso de la veterinaria, algunas de las causas son:
a) La presencia de lagunas terapéuticas (“medicamentos huérfanos”, uso de dosis diferentes a las disponibles, elaboración de medicamentos con principios activos que no se comercializan combinados, etc.).
b) La adaptación del medicamento a las necesidades del animal.
c) La preparación de medicamentos de escasa estabilidad como es el caso del permanganato potásico (uso en descontaminación de peceras), con una caducidad de siete días.
Este recurso forma parte de lo que la normativa veterinaria define como “prescripción excepcional por vacío terapéutico” o “prescripción en cascada”. Por lo tanto, para que el veterinario pueda prescribir una fórmula, el medicamento que se quiere preparar no debe estar disponible en el mercado ya que la normativa legal establece que la formulación magistral debe ser el último recurso terapéutico en el caso de los animales.
La orden veterinaria para la elaboración de una fórmula magistral o de un preparado o fórmula oficinal se extenderá en el modelo de receta normalizado, pero en ella el veterinario tendrá que incluir la composición tanto cuantitativa y como cualitativa, el proceso morboso que se pretende tratar y especie animal a la que se destina y la cantidad que debe elaborarse (16).
Como se ha indicado, la fórmula magistral sólo puede ser preparada por un farmacéutico o bajo su supervisión y dispensada en las OF.
3.7. Sobre envases
La legislación (3-8) indica la conveniencia, tanto para aumentar la información del usuario como para mejorar la protección de los consumidores en el caso de los animales productores de alimentos, reforzar las disposiciones relativas al etiquetado y a los prospectos de los medicamentos veterinarios.
Para ello deberán llevar un mínimo de caracteres legibles (Figura 2):
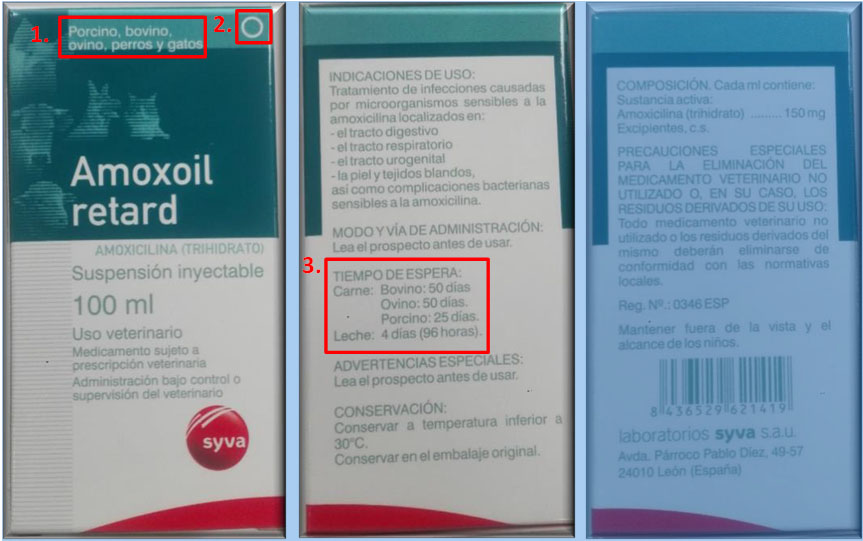
a) Denominación del medicamento.
b) Composición cualitativa y cuantitativa en principios activos por dosis.
c) Número de lote.
d) Número de la autorización de comercialización.
e) Nombre o la razón social y el domicilio o la sede social del titular de la autorización de comercialización y, en su caso, del fabricante.
f) Especies animales a las que esté destinado, modo y vía de administración.
g) Tiempo de espera, aunque sea nulo en caso de animales productores.
h) Fecha de caducidad.
i) Precauciones de conservación, si las hay.
j) Precauciones especiales que hayan de tomarse al eliminar los medicamentos sin usar y los productos de desecho derivados de los medicamentos, si los hay.
k) Frase “para uso veterinario”
l) Símbolos en el ángulo superior derecho:
– Dispensación con receta veterinaria
– Dispensación con receta de estupefacientes
– Dispensación de psicótropos anexo II del RD 2829/1977
– Dispensación de psicótropos anexo I del RD 2829/1977
– Conservación en el frigorífico
– Conservación en congelación
m) Igualmente deberán figurar las siguientes siglas según caso:
– AV junto con “Administración exclusiva por el veterinario”, cuando el medicamento tenga que ser administrado exclusivamente por el veterinario.
– En todos los casos, deberá figurar la leyenda: “Uso veterinario”.
– En el caso particular de las premezclas medicamentosas deberá figurar la leyenda: “Premezclas medicamentosas para piensos”.
3.8. Sobre el papel del veterinario
Las funciones de Técnicos Veterinarios son (5-8):
a) Garantizar el cumplimiento de los programas zoosanitarios.
b) Prescripción de los medicamentos.
c) Supervisión de los tratamientos y del cumplimiento de los tiempos de espera.
d) Supervisión del servicio veterinario de establecimientos comerciales detallistas y agrupaciones ganaderas.
e) Custodiar las recetas veterinarias dispensadas, debiendo conservarlas a disposición de las autoridades durante al menos cinco años.
Además, el clínico veterinario está autorizado para adquirir y administrar MV a animales bajo su directa dirección y control, en casos de urgencia o lejanía de otros centros dispensadores, o en el caso que así lo requiera el medicamento administrado (botiquín de urgencia), siempre que nada de ello implique actividad comercial.
Al hacer uso de su botiquín, el veterinario deberá:
a) Suministrar al propietario sólo la cantidad mínima necesaria para realizar el tratamiento de urgencia.
b) Extender la receta con destino al propietario tal y como se ha explicado anteriormente.
c) Justificar ante el centro dispensador dicha dispensación en el plazo de dos meses.
En el caso de animales productores de alimentos de consumo humano, el veterinario será el responsable de las posibles reacciones
adversas y de los efectos residuales no previstos.
3.9. Sobre el papel del farmacéutico
La legislación fija las funciones de los Técnicos Farmacéuticos como (5-8):
a) Garantizar el cumplimiento la legislación sobre dispensación de MV.
b) Asegurar el correcto almacenamiento de los medicamentos y garantizar su legitimidad de origen.
c) Verificar las condiciones sanitarias de transporte, de entrada y salida de medicamentos.
d) Vigilar, controlar y custodiar las recetas veterinarias dispensadas, debiendo conservarlas a disposición de las autoridades durante al menos cinco años.
e) Supervisar el cumplimento de la legislación especial sobre estupefacientes y psicótropos y exigir la adopción de las medidas adecuadas.
f) Colaborar en los programas zoosanitarios que requieran de sus servicios profesionales.
g) Elaboración o supervisión de la elaboración de fórmulas magistrales o preparados oficinales.
Tampoco debemos olvidar la importancia de la atención farmacéutica incluso en el ámbito veterinario.
Para ser responsable del servicio farmacéutico de un establecimiento comercial detallista o de una agrupación ganadera, el farmacéutico deberá estar colegiado y no ser titular de OF. Una vez que cumpla con estos requisitos, su presencia y actuación profesional deberá garantizar el correcto cumplimiento de las funciones que tiene legalmente encomendadas.
En el País Vasco, la presencia física del farmacéutico garante estará fijada por el Director de Ordenación Sanitaria con la conformidad del Consejero de Sanidad, teniendo en cuenta el volumen de actividad y los medicamento dispensados (9-10). En La Rioja no existe normativa específica.
El responsable del servicio farmacéutico realizará un plan de trabajo en el que especifique:
a) Calendario y horario previsible de presencia semanal.
b) Número de establecimientos de los que sea responsable y su ubicación física.*
c) Procedimientos de trabajo.
*El farmacéutico no podrá ser responsable de más de cuatro establecimientos en el País Vasco mientras que en La Rioja, no se especifica.
4. APLICACIÓN DE LA LEGISLACIÓN VIGENTE EN LAS COMUNIDADES AUTÓNOMAS: SITUACIÓN EN LA C.A. DE LA RIOJA
Con el fin de contrastar y completar la información obtenida de la legislación europea, española y las autonómicas y conocer su aplicación real, se realizaron visitas a varias de las diferentes entidades implicadas en la venta y distribución de MV en la C.A de La Rioja.
4.1. Almacenes de distribución mayoristas
COFARES es una de las cooperativas de distribución farmacéutica más importante de España.
El almacén, situado en Logroño, al que se realizó la visita solicitó la autorización conjunta de almacenamiento y distribución de medicamentos de uso humano y veterinario a la Consejería de Sanidad de La Rioja y, una vez concedido, ha estado distribuyendo estos medicamentos exclusivamente a las OF de esta comunidad.
Dispone de una zona específica, separada de los medicamentos de uso humano, para el almacenamiento de los medicamentos de uso veterinario. También señalan que, actualmente, están desarrollando una División específica de MV de la cual ya comienza a llegar información a las farmacias (Figura 3).

Debido a la implantación en Europa del código BIDI o datamatrix en los envases de los medicamentos con el fin de evitar falsificaciones (Figura 4), ha sido inevitable hablar sobre el uso de este código en los MV. Señalan que los medicamentos de uso veterinario no están obligados a llevar el BIDI, por eso, los pocos que lo llevan no están cargados en el repertorio y cuando se leen, dan error. Actualmente, en COFARES tienen alrededor de 250 referencias de MV.
4.2. Oficina de Farmacia
Basándome en las prácticas tuteladas realizadas durante seis meses en una farmacia tipo de Logroño, se han podido observar ciertos detalles sobre la dispensación de MV.
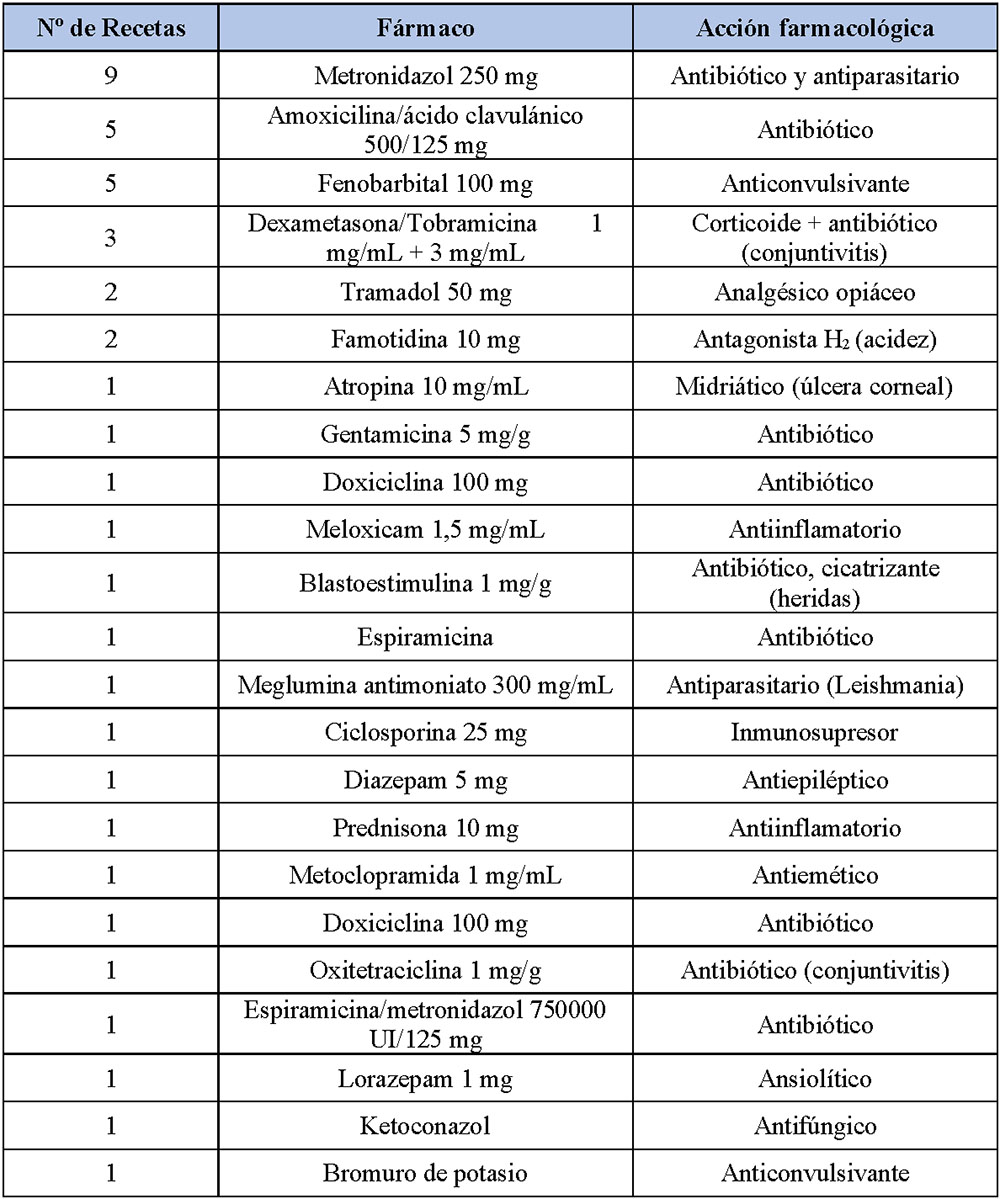
Durante el año 2018/19, han llegado a la farmacia al menos 41 recetas veterinarias, representadas en la siguiente tabla (Tabla 1).
A pesar de que el número de recetas veterinarias que llegan a las farmacias dependen mucho de su ubicación y de la cercanía que haya con clínicas veterinarias, el número de recetas veterinarias que reciben los farmacéuticos es muy reducido en comparación con el número total de recetas de medicamentos de uso humano.
En este caso, cabe destacar que 21 de las 41 recetas veterinarias recibidas son o contienen antibióticos.
También, llama la atención la variedad de estructura e información que contienen dichas recetas (Anexo). Algunas de ellas, con muy escasa información; sólo el nombre del medicamento, sello y firma del veterinario prescriptor cuando debería incluir además la dosis, forma farmacéutica, fecha de prescripción, dirección del veterinario y, en la mayoría de los casos, la frase “prescripción excepcional” al tratarse de la dispensación de un medicamento de uso humano con el fin de tratar a un animal por vacío terapéutico.
Tabla 1. Prescripciones recibidas desde el 3 de Enero de 2018 hasta el 10 de Enero del 2019 en la Farmacia Tipo de Logroño
Por otra parte, comparando una de las farmacias de Vitoria con ésta situada en Logroño, durante el mismo periodo de tiempo han recibido aproximadamente 48 recetas veterinarias (12 de ellas, fórmulas magistrales destinadas a animales domésticos), es decir, han llegado 1,5 veces más recetas veterinarias. Así pues, la frecuencia con la que llegan recetas veterinarias a la farmacia de Logroño es menor. Uno de los motivos a los que se puede deber es al mayor número de mascotas que hay en el País Vasco. Sólo en perros, se registraron 320.000 en el año 2016 (17) mientras que, en ese mismo año, en La Rioja se registraron 55.917 (18). Hay que mencionar que, de las recetas veterinarias recibidas en la farmacia de Vitoria, el 20 % eran fórmulas magistrales destinadas a animales domésticos.Además de medicamentos con receta, en la OF se dispensan otros medicamentos cuya prescripción no es obligatoria por lo que es difícil realizar una estimación total de la dispensación de medicamentos que irán destinados a animales. Además, los dueños de mascotas también consiguen la mayoría de los medicamentos a través del veterinario a pesar de que la venta con fines comerciales por parte de éste está prohibida por ley. Sin embargo, estas personas se encontrarán con la aplicación de un 21 % de IVA en las clínicas veterinarias mientras que en los establecimientos comerciales detallistas y OF se aplica el 10 % a los MV, considerados productos sanitarios (19).Esta aplicación de IVA la desconocen muchos usuarios ya que los propietarios de mascotas están totalmente acostumbrados a obtener los MV en las clínicas veterinarias. Tampoco ayuda la escasez de farmacias que ofrecen productos dirigidos a mascotas por lo que, son pocos los usuarios que cuentan con este canal para obtener los MV.
Sin embargo, el aumento de animales de compañía plantea a las farmacias la opción de crear una sección específica de veterinaria que atraería a ellas un nuevo sector de la población (20).El tema no supone nada nuevo ya que en el año 2014 se abrió en Madrid la primera farmacia especializada en veterinaria, pero su titular, la farmacéutica Esther Guerrero Martín, confiesa en varias entrevistas (21) que su apertura no fue nada fácil ya que hay un gran desconocimiento sobre esta especialidad farmacéutica, incluso dentro de los propios ministerios.
4.3.Clínica veterinaria
También se pudo sacar conclusiones muy interesantes tras preguntar acerca de la prescripción y dispensación de MV a un veterinario.
En general, los veterinarios son reticentes a hacer recetas porque prefieren ser ellos los que dispensen los medicamentos. Sin embargo, no debemos olvidar que la legislación deja claro que los veterinarios no pueden dispensar MV con fines comerciales y que esta práctica supone a los propietarios de animales pagar más debido a la aplicación de un 21 % de IVA (19).
Aún así, es tan frecuente esta práctica, que a los dueños de animales domésticos les parece normal adquirir los medicamentos por esta vía y desconocen la opción de comprarlos a través de las OF o los establecimientos comerciales detallistas.
Por otra parte, una vez que el veterinario se decide a completar una receta, no es raro que desconozca o que, aun conociéndolos, no escriba todos los datos obligatorios que deben figurar en ella. Pero, a pesar de ello, estas recetas se siguen aceptando en las OF y en los establecimientos comerciales detallistas.
Esto se debe al gran desconocimiento de la legislación que hay por parte de veterinarios y farmacéuticos y que, al tratarse de recetas privadas, la revisión de datos de estos documentos en las farmacias no es tan exhaustiva y es poco habitual su reclamación.
La conclusión de esta visita fue la necesidad de realizar campañas informativas por parte de los Colegios Oficiales destinadas a los profesionales implicados y a los propietarios de animales.
4.4.Establecimiento comercial detallista
Otra de las visitas que se realizó fue a un establecimiento comercial detallista, con el fin de ver cuál es la función de un farmacéutico garante.
Para ser farmacéutico garante es necesario estar colegiado y no ser titular de OF. Una vez que cumples esos requisitos, el siguiente paso es firmar un plan de trabajo con el propietario del establecimiento en el que figuren aspectos como: calendario y horario previsible de presencia semanal, número de establecimientos de los que sea responsable el farmacéutico y su ubicación física, y procedimientos de trabajo.
En este caso concreto, la farmacéutica iba una vez al mes para comprobar el registro de temperaturas tanto del establecimiento como del frigorífico, realizar un control de entrada y salida de MV que incluye contrastar el número de medicamentos que se han dispensado en ese mes con el número de recetas recibidas, comprobar las caducidades, asegurar un plan de actuación en el uso racional de medicamentos y, aunque con menos frecuencia, confirmar la retirada o inmovilización de lotes que comunique la Agencia Española de Medicamentos y
Productos Sanitarios o AEMPS (última retirada: 13 de mayo de 2019 (22), o la incorporación de otros nuevos (23).
Aquí también se habló del desconocimiento que hay tanto de los propietarios de animales como entre los profesionales y se manifestó una preocupación por la falta de regulación ya que se comercializan muchos MV sin la debida autorización: veterinarios que usan los medicamentos de su “botiquín de urgencia” con fines comerciales, establecimientos comerciales que venden piensos medicamentosos sin autorización, tiendas de animales que dispensan medicamentos que necesitan prescripción, etc.
Generalmente, la frecuencia con la que llegan recetas veterinarias a este tipo de establecimientos es considerablemente mayor que en las OF.
Debido a las continuas actualizaciones en estos últimos años sobre la regulación del uso de medicamentos en ganadería, tanto veterinarios prescriptores como los centros dispensadores tienen especial cuidado en que las recetas destinadas a estos animales estén debidamente cumplimentadas, sin embargo, no es así con las prescripciones para animales domésticos. En estos casos, las recetas que llegan al establecimiento pocas veces tienen los datos mínimos necesarios. Otras veces, hacen un uso erróneo de la frase “prescripción excepcional” destinada a los casos en los que hay un vacío terapéutico y hay que recurrir a medicamentos de uso humano o a formulación magistral y cuando hay que ponerla (en la mayoría de las recetas que llegan a las OF), no lo hacen (Figura 1).
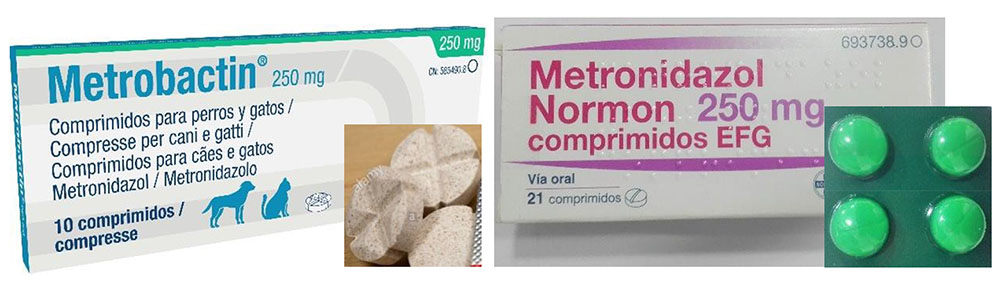
Otro de los temas que se abordaron en la visita fue el uso indebido de la medicación de uso humano para el tratamiento de animales. A pesar de ser el mismo principio activo, la forma farmacéutica y la información que viene en el prospecto no es la misma. Por ejemplo, entre las numerosas recetas de antibióticos que llegaron a la farmacia en la que hice las prácticas tuteladas, muchas de ellas eran de metronidazol. En este caso, el veterinario debería haber recetado el medicamento veterinario existente con ese principio activo (Metrobactín®) ya que el comprimido está preparado para partirlo en función de la dosis que haya que dar, ya sea según el peso o la especie de la mascota, y en el prospecto, viene la información relevante al uso de este medicamento en animales (Figura 5).
5. OTRAS CONSIDERACIONES
5.1. Venta online
La posibilidad de vender medicamentos de uso veterinario por internet en España es relativamente reciente. De hecho, la ley que lo regula entró en vigor en el año 2016 (24).
En ella se considera centros dispensadores de este tipo de medicamentos tanto a OF legalmente autorizadas para la venta a distancia de medicamentos de uso humano sin receta, como a establecimientos detallistas. Un ejemplo de estos establecimientos autorizados de venta a distancia de medicamentos veterinarios no sujetos a prescripción es el situado en Logroño, “Unomás, Nutrición y salud animal” (www.unomasweb.com) (14).
Sólo se podrán dispensar por este medio aquellos MV que no necesiten prescripción. Por lo tanto, queda prohibida la venta online de fórmulas magistrales, preparados oficinales, MV no autorizados por la AEMPS, autovacunas de uso veterinario y los medicamentos sujetos a prescripción veterinaria.
Si un centro está interesado en la venta de MV por internet deberá notificarlo directamente a la Consejería de Sanidad correspondiente de cada Comunidad Autónoma, que se encargará de inspeccionar y revisar las ventas por este medio.
Una vez autorizado, la OF o el establecimiento detallista elaborará un sitio web que deberá contener como mínimo: datos de contacto y un enlace al sitio web de la autoridad competente, el nombre del titular y el número de colegiado del farmacéutico, dirección física del centro dispensador, horarios y precios y tiempo estimado para la entrega de los medicamentos. También deberán añadir a la página web el enlace y el logo del Ministerio de Agricultura ya que es la autoridad competente que va a coordinarse con la AEMPS y la Consejería de Sanidad en este asunto.
Al igual que en los sitios web de venta de medicamentos de uso humano, es necesario la existencia de un logo de identificación que asegure la venta legal de los MV (similar al logo Distalfarma, Figura 6) sin embargo a día de hoy, éste todavía no está disponible.
A pesar de que la venta sea a distancia, la actuación profesional del farmacéutico es requisito inexcusable para la dispensación al público de medicamentos a través de sitios web. Ya sea en OF o en establecimientos detallistas. Y será deber del farmacéutico valorar la pertinencia o no de la dispensación y proporcionar asistencia, a través de servicios de farmacovigilancia y seguimiento terapéutico (15).
5.2. Caso particular de los antibióticos
En veterinaria, los antibióticos se emplean para el tratamiento de animales infectados y como profilaxis para prevenir infecciones (especialmente en el manejo de un alto número de animales en espacios reducidos), pero también se han usado con la finalidad de promover el crecimiento y engorde de los animales. Desde el año 2006, esta práctica está prohibida en la Unión Europea (UE), sin embargo, sigue siendo legal en Asia, África, Oceanía y en todo el continente americano.
Este uso indebido de los antibióticos contribuye de manera importante a la aparición de bacterias multirresistentes con las que podemos entrar en contacto fácilmente a través de alimentos y agua contaminadas o mediante contacto directo con heces de animales (animales de compañía, abono, etc.).
Como respuesta al abuso de antibióticos tanto en humanos como en animales productores de alimentos, en 2014 la AEMPS creó en España un Plan estratégico para reducir el riesgo de selección y diseminación de la resistencia a los antibióticos (PRAN) (Figura 7), en concreto, el Programa Reduce, enfocado al uso de antibióticos en avicultura, cunicultura y ganado bovino (Figura 8).


Hay que tener en cuenta que además de los ganaderos, los dueños de mascotas también son grupos de riesgo por la adquisición o relación con las infecciones bacterianas ya que el uso de antibióticos en animales de compañía no se encuentra tan controlado.
Por tanto, es fundamental el trabajo conjunto de veterinarios y farmacéuticos para mejorar las herramientas disponibles para obtener datos de consumo de antibióticos por especies animales y conseguir reducir al máximo el uso indebido de estos medicamentos y su diseminación en el medio ambiente, con el fin de ralentizar lo más posible el avance de la resistencia a antibióticos en el mundo (25-27).
5.3. Consideraciones adicionales
La necesidad de controlar el uso de MV por su influencia en la sanidad humana es una realidad. Así, muchos antimicrobianos utilizados en animales destinados a la producción de alimentos son idénticos o están estrechamente relacionados con los utilizados en el ser humano. El uso de estos antimicrobianos en animales destinados a la producción de alimentos puede llevar a la sección y propagación entre ellos de bacterias resistentes a los antibióticos, que después pueden transmitirse al ser humano a través de los alimentos y de otras vías.
Por ello, para mitigar las consecuencias que para la salud humana tiene el uso de antimicrobianos de importancia médica en animales destinados a la producción de alimentos, la Organización Mundial de la Salud (OMS) (28) realiza cada cinco años una serie de directrices en las que se hacen recomendaciones y declaraciones sobre prácticas óptimas basadas en evidencias.
– Recomendación I: reducción general del uso de todas las clases de antimicrobianos de importancia médica en los animales destinados a la producción de alimentos. Categoría de recomendación: Firme.
– Recomendación II: restricción completa del uso de todas las clases de antimicrobianos de importancia médica para estimular el crecimiento de los animales destinados a la producción de alimentos ya que, como se ha dicho anteriormente, esta práctica todavía se sigue haciendo en Asia, África, Oceanía y América. Categoría de recomendación: Firme.
– Recomendación III: restricción completa del uso de todas las clases de antimicrobianos de importancia médica con el fin de prevenir enfermedades infecciosas que todavía no han sido diagnosticadas clínicamente en los animales destinados a la producción de alimentos. Categoría de recomendación: Firme.
– Recomendación IV: restricción del uso de antimicrobianos de importancia crítica y de máxima prioridad para la medicina humana para profilaxis y tratamiento de animales destinados a la producción de alimentos. Categoría de recomendación: Condicional.
A pesar de que estas recomendaciones propuestas por la OMS se refieren a animales productores de alimentos, también se debería plantear la regulación del uso de antibióticos en el resto de animales.
Estudios recientes en Reino Unido hablan sobre el elevado porcentaje de consultas de perros y gatos en las que se prescribieron y/o administraron antibióticos. Y en EE.UU., revelaron que tan solo un 17 % de los casos en los que se prescribió antibióticos eran infecciones confirmadas (26)
Por tanto, estos datos junto con el importante aumento de animales domésticos, hace necesaria también la elaboración de guías para el correcto uso de antibióticos en este tipo de animales.
6. CONCLUSIONES
Como se ha podido observar, la legislación que regula hoy en día el proceso de venta y distribución de medicamentos de uso veterinario no está lo suficientemente clara ni a nivel europeo, ni al estatal ni al autonómico. El hecho de que, en España, este tema lo dirijan de manera conjunta dos ministerios diferentes (Ministerio de Agricultura, Pesca y Alimentación y Ministerio de Sanidad y Consumo), no siempre bien coordinados, también dificulta la resolución de problemas y toma de decisiones en determinadas ocasiones.
Hemos visto que tampoco se respetan las funciones propias y legalmente establecidas de los profesionales implicados en este proceso. Tanto es así, que es frecuente encontrar cierto intrusismo por parte de los veterinarios en aspectos que la legislación atribuye a los farmacéuticos como puede ser la venta de medicamentos con fines comerciales.
Por otra parte, la falta de información desde los Ministerios hacia los propietarios de animales y de formación desde Colegios y
Universidades hacia farmacéuticos y veterinarios acerca de este tema, complica la situación de manera importante ya que, el riesgo de usar de manera incorrecta los MV es muy alto.
Para solucionar este problema en continuo crecimiento, se hace inevitable la necesidad de una revisión de la legislación y de la realización de campañas formativas e informativas sobre la venta y distribución de medicamentos de uso veterinario.
Por tanto, este trabajo supone una llamada de atención a los estamentos legislativos para que coordinen y clarifiquen sus normativas, a las respectivas Facultades para que incluyan este tema en la formación de sus futuros egresados, y a los Colegios Oficiales de Veterinarios y Farmacéuticos sobre la necesidad de realizar campañas formativas e informativas. También resulta necesario realizar inspecciones más frecuentes y exhaustivas para garantizar el cumplimiento de la legislación.
De esta manera podremos contribuir de manera muy positiva en uno de los objetivos de la Agenda para el Desarrollo Sostenible del 2030, la salud y bienestar no sólo de los animales, sino también en el de las personas. Porque, como bien dice el lema de los veterinarios: la salud de los animales es la salud del pueblo (Higia pecoris, salus populi). Y en esto, los farmacéuticos tenemos un papel muy importante.
7. REFERENCIAS
01. Informe Anual de Indicadores: Agricultura, Pesca, Alimentación y Medio Ambiente. Gobierno de España. Ministerio de Agricultura, Pesca y Alimentación 2017. p. 95
02. Las mascotas también van a la farmacia. Levante: el mercantil valenciano. 2019 [Consultado: 28 Jul 2019]. Disponible en: https://www.levante-emv.com/vida-y-estilo/salud/2019/07/26/mascotas-farmacia/1905193.html
03. DIRECTIVA 2001/82/CE DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 6 de noviembre de 2001 por la que se establece un código comunitario sobre medicamentos veterinarios. Diario Oficial de la Unión Europea (L0082/1- L0082/123)
04. DIRECTIVA 2004/28/CE DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 31 de marzo de 2004 que modifica la Directiva 2001/82/CE por la que se establece un código comunitario sobre medicamentos veterinarios. Diario Oficial de la Unión Europea (L136/58-L136/84)
05. REAL DECRETO 109/1995, de 27 de enero, sobre medicamentos veterinarios. BOE nº 53 (pág. 7353-7409)
06. REAL DECRETO 1246/2008, de 18 de julio, por el que se regula el procedimiento de autorización, registro y farmacovigilancia de los medicamentos veterinarios fabricados industrialmente. BOE nº 193 (pág. 34044-34084)
07. REAL DECRETO 1132/2010, de 10 de septiembre, por el que se modifica el Real Decreto 109/1995, de 27 de enero, sobre medicamentos veterinarios. BOE nº 233 (pág. 81447-81463).
08. LEY 13/2007, de 22 de noviembre, de medicamentos veterinarios. BOE nº 2 (pág. 91-100)
09. DECRETO 1/1997, de 7 de enero, sobre autorización y control de establecimientos y servicios de atención farmacéutica dedicados a la distribución y dispensación de medicamentos veterinarios y de las unidades de fabricación de piensos medicamentosos en la Comunidad Autónoma del País Vasco. BOPV nº 509 (pág. 1606-1619)
10. DECRETO 156/2001, de 30 de julio, sobre autorización y control de los establecimientos relacionados con la distribución y dispensación de medicamentos veterinarios, la fabricación y distribución de piensos medicamentosos y la elaboración de autovacunas de uso veterinario en la Comunidad Autónoma del País Vasco. BOPV nº 4771 (pág. 15947-15960)
11. DECRETO 24/2000, de 19 de mayo, por el que se establecen normas sobre regulación de medicamentos veterinarios y piensos medicamentosos en la Comunidad Autónoma de La Rioja. BOR nº 65 (pág. 2076).
12. LEY 8/1998, de 16 de junio, de Ordenación Farmacéutica de la Comunidad Autónoma de La Rioja. BOR nº 74 (pág. 2379). BOE nº 156 (pág. 21800).
13. González Bueno A, Puerto Sarmiento FJ. Medicamentos veterinarios y piensos medicamentosos. En: Compendio de Historia de la Farmacia y Legislación Farmacéutica. Madrid: Editorial Síntesis S.A.; 2011. p. 365-377.
14. Catálogo de establecimientos, distribuidores o dispensadores autorizados de medicamentos veterinarios y venta a distancia de medicamentos veterinarios. Ministerio de Agricultura, Pesca y Alimentación [Consultado: 4 May 2019]. Disponible en: https://www.mapa.gob.es/es/ganaderia/temas/sanidad-animal-higiene-ganadera/Higiene-de-la-produccion-primaria-ganadera/medicamentos-veterinarios/buscador-med.aspx
15. Guía práctica, 28 de septiembre de 2016. Asunto: Dispensación y suministro de medicamentos de uso animal. Consejo General de Colegios Oficiales de Farmacéuticos (www.portalfarma.com)
16. Del Arco Ortiz de Zárate J, Hidalgo Pérez ME. Formulación magistral en veterinaria (I). Panorama Actual del Medicamento 2018; 48 (418): 1107-1112.
17. Campuzano B. Un perro por cada siete guipuzcoanos. El Diario Vasco. 2018 [Consultado: 2 May 2019]. Disponible en: https://www.diariovasco.com/gipuzkoa/gipuzkoa-tierra-perros-20180306141130-nt.html
18. Fernández A. El ejército canino se multiplica por cuatro en 15 años en La Rioja. La Rioja. 2017 [Consultado: 2 May 2019]. Disponible en: https://www.larioja.com/la-rioja/ejercito-canino-multiplica-20170730235113-ntvo.html
19. REAL DECRETO-LEY 20/2012, de 13 de julio, de medidas para garantizar la estabilidad presupuestaria y de fomento de la competitividad. BOE nº 168 (pág. 50428-50518).
20. Sección veterinaria en OF – Cornejo A. El medicamento veterinario pide paso en la botica urbana. El Global. 2012 [Consultado: 17 feb 2019]. Disponible en: www.elglobal.net/hemeroteca/el-medicamento-veterinario-pide-paso-en-la-botica-urbana-AWEG_687373
21.Núñez Benítez F. Primera farmacia veterinaria en España. Así nació la primera farmacia veterinaria autorizada en España. Animal’s Health. 2018 [Consultado: 25 Sep 2018]. Disponible en: https://www.animalshealth.es/profesionales/en-espana- solo-existe-una-farmacia-veterinaria-autorizada
22. Circular nº 128/19 (Farmacias), 13 de mayo de 2019. Asunto: Retirada de medicamentos veterinarios. Colegio Oficial de Farmacéuticos de La Rioja.
23. Circular nº 38/18 (Farmacias), 1 de enero de 2018. Asunto: Notificación anual de movimientos de medicamentos de uso veterinario con principios activos antimicrobianos. Colegio Oficial de Farmacéuticos de La Rioja.
24. REAL DECRETO 544/2016, de 25 de noviembre, por el que se regula la venta a distancia al público de medicamentos veterinarios no sujetos a prescripción veterinaria. BOE nº 300 (pág 86657-86664)
25. García Fernández s, Ruiz Garbajosa P, Morosini Reilly MI. Relevancia, prevalencia y mecanismos de resistencia microbiana. En: Uso racional de antibióticos y gestión de residuos. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2018. p. 29-49.
26. Navarro San Francisco C, Ruiz Garbajosa P, Cantón Moreno R. Estrategias frente a la resistencia, En: Uso racional de antibióticos y gestión de residuos. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2018. p. 51-72.
27. Cantón Moreno R, Martínez García L, Varas Doval R, González Zorn B. En: Uso racional de antibióticos y gestión de residuos. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2018. p. 73-127.
28. WHO guidelines on use of medically important antimicrobials in food-producing animals. Geneva: World Health Organization; 2017. Licence: CC BY-NC-SA 3.0 IGO.
