RESUMEN:
Este trabajo constituye una anotación sobre el método de Kjeldahl destacando su importancia, las etapas de que consta, incluyendo en la de valoración la determinación iodométrica del punto final, haciendo mención asimismo de un nuevo método de linearización. El nombre de Kjeldahl ha sido verbalizado, un honor raramente asociado con un químico.
ABSTRACT:
This paper constitutes an annotation on the Kjeldahl method emphasizing its importance, the steps of which it consists, including in the titration step the iodomometric determination of the end point, pointing out a new method of linearization. The name of Kjeldahl has been verbalized, an honour rarely associated with a chemist.
Palabras clave:
método de Kjeldahl; valoración; método de linearización
1. INTRODUCCIÓN
Hace unos 130 años, el químico danés Johan Gustav Christoffer Thorsager Kjeldahl (1849-1900), Figuras 1 a 3, Jefe del Departamento de Química del Laboratorio de la Fundación Carsberg de la Compañía de Cerveza Carlsberg, introdujo un método conocido más tarde bajo el epónimo de método de Kjeldahl, que básicamente se encuentra todavía en uso. Fue en la reunión de la Sociedad Química Danesa (Kemisk Forening) celebrada el 7 de Marzo de 1883. Ese mismo año, el método fue publicado en alemán en la revista “Zeitschrift für Analytische Chemie” (1), y en lengua francesa y danesa en comunicaciones del Laboratorio Carlsberg (1). Debido al respeto que el fundador del Laboratorio, el industrial danés Mr. J.C. Jacobsen sentía por Pasteur y por su trabajo en la industria francesa del vino (2), fueron también publicados extensos resúmenes en francés de los trabajos llevados a cabo en la Fundación Carsberg.
También aparece un extenso resumen del trabajo en Chemical News en Agosto (3), por lo que el método es rápidamente adoptado. The Analyst dio primeramente detalles del método en 1885 (4), aunque el método había sido previamente mencionado por Blyth en 1884, dando el nombre de Kjeldahl incorrectamente como Vijeldahl. Un periodo de tiempo sorprendentemente corto transcurre entre la aparición del método de Kjeldahl y la publicación de mejoras adicionales efectivas, tanto en Europa como en América, debido al tremendo impacto que el trabajo de Kjeldahl tuvo en otros investigadores, especialmente en Alemania. La mayor parte de las primeras contribuciones fueron discutidas por Fresenius en el “Zeitschrift”, a menudo con una extensión de varias páginas. En toda la historia de la química analítica, ningún método ha sido adoptado en tan corto tiempo como el método de Kjeldahl para la estimación de nitrógeno, como ha sido indicado por Kebler en 1891 (5) al comienzo de una anotación en la que compila las referencias sobre la estimación de nitrógeno por Kjeldah (unas sesenta) y por otros métodos (unas doscientas).


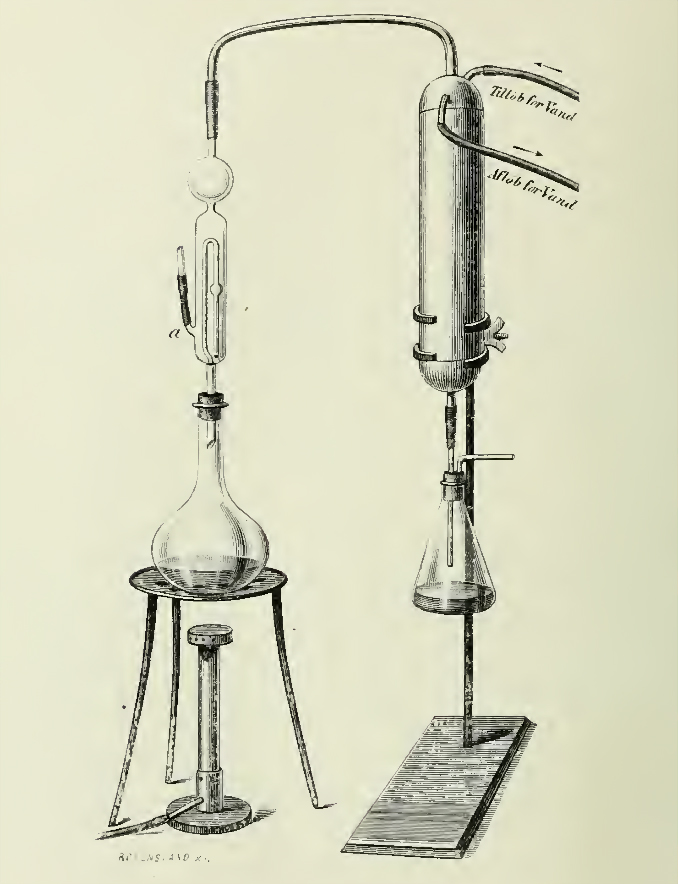
2. EL METODO DE KJELDAHL Y LA INDUSTRIA CERVECERA
El método de Kjeldahl fue originalmente destinado a la industria cervecera como ayuda para el seguimiento de los cambios en proteínas durante la germinación del grano y la fermentación (1); cuanto más baja la cantidad de proteína en la “mush”, mayor era el volumen de cerveza producido. Fue Berzelius quien sugirió en 1883 el uso de la palabra “proteína” en una carta (6) a Mulder porque se derivaba de la palabra griega que significa “to be in the first place”. El contenido de proteína depende estrictamente del contenido de nitrógeno orgánico total; i.e., la estructura de la proteína no interfiere en su determinación exacta, pero carece de selectividad analítica debido a que no distingue entre nitrógeno basado en proteína y nitrógeno no proteico. Casos de adulteración (i.e. adulteración de alimentos basados en proteína con melanina y compuestos no proteicos relacionados) que explotan esta vulnerabilidad analítica han sido recientemente detectados (7) y constituyen nuevos ejemplos de problemas que datan incluso de antes (8) de que fuera introducido el método de Kjeldahl.
El contenido de proteína en un alimento se estima multiplicando el contenido de nitrógeno por un factor de conversión (9) de nitrógeno a proteína, generalmente establecido en 6,25, que supone que el contenido de nitrógeno de las proteínas es del 16 %. No está claro quien fue el primero que preconizó su uso. Este factor de conversión general es usado para la mayor parte de los alimentos porque sus contenidos no proteicos son despreciables. Sin embargo, las proteínas puras difieren en términos de sus contenidos de nitrógeno debido a diferencias en la composición de sus aminoácidos, oscilando entre el 13,4 % y el 19,3 %; diferentes factores multiplicativos son apropiados para muestras de diferente naturaleza. El factor 5,7 se aplica para el trigo y el de 6,38 para los productos lácteos. El sistema aproximado en el que la proteína se mide como el nitrógeno total multiplicado por un factor específico domina claramente los estudios (10) de composición de los alimentos. De hecho, la mayor parte de los valores citados para proteína en bases de datos de composición de alimentos se deriva de los valores de nitrógeno total o nitrógeno orgánico total.
3. LAS TRES ETAPAS DEL METODO DE KJELDAHL
El método de Kjeldahl consiste en tres etapas (1, 3, 11-13):
1) Digestión ácida (H2SO4 conc.), digestión (mineralización) de la muestra conteniendo nitrógeno, en un frasco de digestión con cuello largo, causando su conversión a iones NH4+. El matraz de Kjeldahl, que construyó en 1888 para simplificar el método, se encuentra todavía hoy en uso (14, 15).
Kjeldahl (1) comentaba:
“Le principe de la nouvelle méthode consiste donc à chauffer pendant quelque temps la matière à analyser avec une forte proportion d’acide sulfurique concentré jusqu’à une température voisine du point d’ébullition de l’acide, et à oxyder la dissolution ainsi obtenue avec un excès d’hypermanganate de potasse sec en poudre.”
(The principle of the new method, therefore, is to heat the substance in question for some time with a sufficient quantity of concentrated sulfuric acid, and then to oxidize the solution thus obtained with an excess of dry, powdered permanganate).
2) La transformación de los iones NH4+ en NH3 (neutralización con álcali) y destilación (Fig. 3) del NH3, que se recoge de forma apropiada (16) en una vasija de valoración.
3) Valoración de la disolución; el amonio procedente de la destilación se recoge frecuentemente en un exceso de ácido estándar y se determina por una valoración por retroceso con disolución de álcali estándar. Una práctica más común es el uso de ácido bórico para atrapar el amoniaco.
La historia subyacente y el trabajo que condujo a la evolución del método de Kjeldahl hasta el presente estado son interesantes (11). La técnica más antigua de determinación del nitrógeno (proteína) fue desarrollada por Dumas, quien introdujo en 1831 (17) el método de combustión para el análisis de nitrógeno. El método de Will y Varrentrapp, para estimar el nitrógeno orgánico como amoniaco (18), que data de 1841, aunque menos generalmente aplicable, es más fácil, y fue frecuentemente aplicado hasta la publicación del método de Kjeldahl. Wanklyn, en 1868 (19), mejora el método Will-Varrentrapp añadiendo permanganato potásico en medio alcalino para incrementar el efecto oxidativo de la cal sodada (soda lime).
4. EL MÉTODO DE KJELDAHL FUENTE DE INNOVACIÓN
Kjeldahl ideó en 1883 un método para la determinación de nitrógeno en sus estudios sobre los cambios de proteínas en granos (grain) usado en la industria cervecera (20), llevados a cabo en el laboratorio de la Fundación Carlsberg. Desde entonces, el análisis de nitrógeno por Kjeldahl es una medida clásica en química analítica y ha sido extensamente usada durante los pasados 130 años. La continua aparición de nuevas evidencias y novedades justifica su valoración. El método de Kjeldahl implica una digestión ácida y destilación. En el método original, se usa ácido sulfúrico solo como medio de digestión. El método de Kjeldahl se ha aplicado a casi todas las formas de nitrógeno orgánico a través de varios pretratamientos y procedimientos modificados.
Diferentes reactivos o combinaciones de reactivos han sido usados para conseguir la descomposición de la material por el ácido sulfúrico (11), que transforma cuantitativamente la materia orgánica a iones amonio. Una digestión eficiente se asocia (21) con una serie de factores tales como digestor, temperatura de digestión, relación de ácido a sulfato potásico, catalizador, tiempo de digestión o uso de peróxido de hidrógeno. Las condiciones de la digestión se ajustan conforme a la concentración de la muestra y al tipo de material a ser analizado. El uso de un catalizador en la digestión de Kjeldahl acelera la oxidación y completa la digestión permitiendo la determinación de nitrogeno consecuente. El mercurio (su uso está declinando debido a consideraciones ambientales), selenio y cobre son los catalizadores elegidos, aunque para algunas aplicaciones el titanio ha encontrado algún uso.
El procedimiento puede definirse en términos de alícuota de muestra (macro, semimicro o micro) y por el método de ensayo del amonio generado, i.e. valoración ácido-base o acabado instrumental. Los métodos semimicro y micro han reducido considerablemente el tiempo requerido para la determinación. Tiempos de digestión cortos asociados con la máxima recuperación de nitrógeno pueden lograrse usando una metodología basada en el diseño experimental y en las superficies de respuesta, con procesos de digestión con microondas, y con la ayuda combinada del ácido sulfúrico-peróxido de hidrógeno sin catalizador (11).
La cuantificación del amonio destilado se logra generalmente por valoración; el amoniaco es absorbido en un exceso de ácido bórico (22), seguido por valoración con un ácido estándar en presencia de un indicador apropiado (e.g. indicador de Tashiro: rojo de metilo al 0,1 % y azul de metileno al 0,1 %). El advenimiento de analizadores automáticos de nitrógeno por combustión en los últimos 20 años ha comenzado a reemplazar al método de digestión de Kjeldahl porque son menos laboriosos. Sin embargo, el método de Kjeldahl puede llevarse a cabo con recursos limitados; la determinación de nitrógeno por el método de Kjeldahl no requiere dispositivos costosos o técnicas especializadas, y es preciso y exacto (11). El método de Kjeldahl se utiliza para la calibración de otros ensayos de proteínas; es todavía el método de referencia primario para el análisis de proteínas.
El método original tal como lo presentó Kjeldahl ha sido objeto de continuas mejoras. Hoy día, los sistemas de digestión ofrecen seguridad tanto desde una perspectiva personal como desde un punto de vista medioambiental. La velocidad y versatilidad del método se ha incrementado así como simplificado el procedimiento analítico entero. Un amplio rango de bloques (blocs) de digestión, unidades de destilación y autoanalizadores están disponibles hoy día (23-25). Los laboratorios cuya frecuencia de uso del análisis de nitrógeno por Kjeldahl no justifican la compra y mantenimiento de un equipo automatizado pueden beneficiarse de la aplicación de los métodos manuales. La determinación del contenido de nitrógeno es un análisis frecuentemente llevado a cabo en la industria y en el comercio, y numerosas organizaciones poseen métodos oficiales.
5. EL ACABADO ANALITICO
El amoniaco puede determinarse mediante valoración directa del exceso de ácido, o, como el mismo Kjeldahl prefería (Fig. 2), por un método iodométrico (1, 26), conforme a las reacciones consecutivas
IO3– + 5 I– + 6 H+ = 3 I2 + 3 H2O
I2 + 2 S2O32- = 2 I– + S4O62-
La elevada precisión de la valoración con almidón como indicador permitía a Kjeldahl trabajar con pequeñas
muestras de material, o con una alícuota del destilado. No obstante, como el dióxido de carbono se encuentra generalmente presente en el destilado, es aconsejable hervir la disolución antes de la adición de la disolución estándar de iodato-ioduro. Por esta razón, este método se usa raramente hoy día. Sin embargo, se ha comprobado que el método iodométrico es preferible al ácido-base en la microdeterminación de nitrógeno porque el riesgo de desplazamiento del punto final por la absorción del dióxido de carbono es mucho menor.
La valoración del amonio absorbido en disolución de H3BO3 fue propuesta por primera vez por Winkler (27) que comenta
“Boric acid is indeed such a week acid, that its solution does not cause a noticeable colour change of certain indicators. Ammonia is, however, completely fixed by it, provided that a suitable excess of acid is present.”
Una de las ventajas de esta elección es que solo se requiere una disolución estándar como valorante, bien HCl o H2SO4, obteniéndose los resultados de la valoración directamente. Cuando se recoge el amoniaco en un exceso de ácido fuerte, HCl o H2SO4, se requieren dos disoluciones estándar, la de NaOH y la del ácido, obteniéndose los resultados de manera indirecta.
Cuando se usa ácido bórico en lugar de un disolución estándar de ácido para recoger el destilado (11, 28), se evita el uso de una disolución estándar alcalina. Esta disolución es vulnerable a la absorción del dióxido de carbono atmosférico y subsecuentemente cambia su molaridad. Ni la cantidad ni la concentración (sobre el 4 %) del ácido bórico ha de ser precisa. En la modificación de Winkler por tanto, el NH3 se recoge en un exceso de ácido bórico
NH3 + H3BO3 = NH4+ + H2BO3– (1)
El borato formado se determina por valoración con HCl estándar, requiriendo un mol de HCl cada mol de NH3
H2BO2– + H+ = H3BO3 (2)
La disolución en el punto de equivalencia contiene una mezcla de dos ácidos H3BO3 y NH4Cl, por lo que un indicador que vire en la región de transición ácida (pH 5-6) es satisfactorio.
La constante de equilibrio de la reacción (1) viene dada por
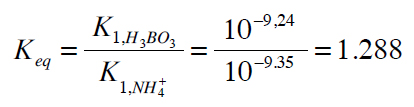
Aunque esta constante de equilibrio es baja, la fracción de amoniaco convertida en ión amonio se incrementa con la diferencia de concentraciones entre el ácido bórico y el amoniaco. Sin embargo, el ácido clorhídrico valora tanto el ión borato correspondiente a la reacción (2), como el amoniaco que no es convertido en ión amonio en la reacción (1).
H2BO2– + H+ = H3BO3
NH3 + H+ = NH4+
siendo la suma de los dos equivalente al amoniaco destilado.
Se han deducido las ecuaciones rigurosas correspondientes a las curvas de valoración de las valoraciones directas y por retroceso del amoniaco (29), junto con sus curvas derivadas. El pHeq se incrementa en la valoración por retroceso del amoniaco (cuando se recoge el destilado en exceso ya sea de ácido clorhídrico o de ácido sulfúrico) con hidróxido de sodio, conforme la concentración de amoniaco disminuye, alcanzando el valor de 7 correspondiente a la valoración de un ácido fuerte con una base fuerte cuando la concentración de amoniaco es cero. El pHeq en la valoración con ácido clorhídrico del amoniaco recogido en exceso de ácido bórico permanece prácticamente igual y próximo a 5,2.
Las dos opciones, valoración directa y por retroceso, consideradas desde un punto de vista teórico, suministran buenos resultados analíticos (29) si el valor de pH en el punto final es próximo a 5,2. Cuando se utiliza un ácido fuerte para recoger el amoniaco es necesario conocer de antemano la cantidad aproximada de amoniaco a destilar, para que el ácido se encuentre en suficiente exceso. Cuando se utiliza ácido bórico en gran exceso para recoger el amoniaco destilado, no debe excederse la temperatura ambiente de cara a evitar la inestabilidad de las disoluciones de borato amónico.
Algunos problemas pueden experimentarse en la práctica como consecuencia de que el sistema experimental se aparte del modelo teórico seguido más arriba, dado el comportamiento del ácido bórico en disoluciones concentradas, al originar especies polinucleares (28, 30). Recientemente se ha propuesto un método potenciométrico, basado en el método de Schwartz (31) que conlleva la linearización de la curva de valoración y la determinación consiguiente del punto final.
6. WILHELM JOHANNSEN Y ASPECTOS BIOGRAFICOS DE KJELDAHL
Wilhelm Johannsen (1857-1927), farmacéutico, redactó el obituari de Kjeldahl, publicado primero en alemán (32) y trasladado luego al francés (33) e inglés (34). Johannsen, uno de los fundadores de la ciencia de la genética, fue en sus inicios ayudante en el departamento de química del Laboratorio Carsberg bajo la dirección del químico Johan Kjeldahl, y es muy conocido ya que acuñó (35, 36) el término de gen en 1909. Oesper (37), Veibel (38), Szabadvary (14), Ottesen (39), Burns (2), Rancke-Madesn y Chalmers (40), Szabadvary (41), Pérez-Bustamante (42) y Sella (43) han dado detalles de la vida de Kjeldahl. Kjeldahl fue elegido miembro de las academias científicas de Dinamarca y Christiania (Norwegian Academy of Sciences and Letters), y recibió un doctorado honorario de la Universidad de Copenhagen (2, 37).
7. COMENTARIOS FINALES
A pesar de su antiguiedad el método de Kjeldahl conserva su importancia. Conviene resaltar que Kjeldahl llevaba a cabo el acabado analítico mediante una reacción iodométrica. Kjeldahl (como Nessler) ha sido verbalizado, un honor raramente asociado a un químico (38). Todos los químicos comprenden lo que significa cuando se dice que una sustancia ha sido kjeldalizada (2, 38), o que uno kjeldaliza una muestra (44). Kjeldahl fue antecesor de S.P.L. Sörensen como Jefe del Laboratorio Carlsberg de Copenhague, que introdujo la notación de pH (44, 45).
8. REFERENCIAS
- Kjeldahl J. Neue Methode zur Bestimmung des Stickstoffs in organischen Körpern. Z Anal Chem 1883; 22: 366-82; En ny Methode til Kvaelstofbestemmelsei organiske Stoeffer. Medd Carlsb Lab 1883; 2(1): 1-27; Sur une Nouvelle Méthode de Dosage de l’Azote dans les Substances Organiques (French summary: Résumé du CR Trav Lab Carlsb; separately paged section) 1883; 2: 1-12.
- Burns DT. Kjeldahl, the Man, the Method and the Carlsberg Laboratory. Anal Proceed 1984; 21(6): 210-4.
- Kjeldahl J. New Method for the Determination of Nitrogen. Chem News 1883; 48(1240): 101-2.
- Analyst Ed. On Kjeldahl method for determination of nitrogen. Analyst 1885; 10(6); 127-8.
- Kebler JF. Notes on the Estimation of Nitrogen in Nitrates by Kjeldahl’s Method, and an Index to the Literature on the Estimation of Nitrogen. J Anal Appl Chem 1891; 5: 257–78.
- Zelitch I. Hubert Bradford Vickery 1893–1978, Biographical Memoir. Washington, DC: National Academy of Sciences 1985.
- Moore JC, DeVries W, Lipp M, Griffiths JC, Abernethy DR. Total Protein Methods and Their Potential Utility to Reduce the Risk of Food Protein Adulteration. Compr Rev Food Sci Food Saf 2010; 9(4): 330–57.
- Möller J. Protein Analysis Revisited. Focus 2010; 34(2): 22– 3.
- Mariotti F, Tome D, Mirand PP. Converting Nitrogen into Protein—Beyond 6.25 and Jones’ Factor. Crit Rev Food Sci Nutr 2008; 48(2): 177–84.
- Greenfield H, Southgate DAT. Review of Methods of Analysis. In Food Composition Data. 2nd ed. Roma: Production, Management and Use, FAO 2003: Ch. 7, pp. 97–148.
- Sáez-Plaza P, Michalowski T, Navas MJ, Asuero AG, Wybraniec S. An overview of the Kjeldahl method of nitrogen determination. Part I. Early history, chemistry of the procedure, and titrimetric finish. Crit Rev Anal Chem 2013; 43(4): 178-223.
- McKenzie HA. The Kjeldahl Determination of Nitrogen: Retrospect and Prospect. Trends Anal Chem 1994; 13(4): 138–44.
- Ashraf M, Shah RA. Developments in the Kjeldahl Method for Determination of Nitrogen. Pakistan J Sci Res 1963; 15, 45–57.
- Szabadváry F. Kjeldahl, Johann Gustav Christoffer. In Dictionary of Scientific Biography. Gillispie CC Ed. Vol 7. New York: American Council of Learned Societies, Charles Scribner’s Sons 1973: pp. 393-4.
- Kjeldahl J. Et Destillationsapparat til Brug ved Kvaelstofbestemmelse. Medd Carlsb Lab 1888; 2(5): 197-8; Un Appareil Distillatoire a l’Usage de la Determination de l’Azote (French summary: Résumé du CR Trav Lab Carlsb; separately paged section).
- Thiex NJ, Manson H, Anderson S, Persson JA. Determination of Crude Protein in Animal Feed, Forage, Grain, and Oilseeds by Using Block Digestion with a Copper Catalyst and Steam Distillation into Boric Acid: Collaborative Study. J AOAC Int 2002; 85(2): 309–17.
- Dumas JB. Lettre de M. Dumas a M. Gay-Lussac, Sur les Proce ́de ́s de l’Analyse Organique. Ann Chim Phys 1831; 2(47): 198–215.
- Varrentrapp F, Will H. Neue Methode zur Bestimmung des Stickstoffs in organischen Verbindungen. Ann Chem Pharm 1841; 39(3): 257–96; Nouvelle Me ́ thode pour la Determination de l’ A zote dans les Combinaisons Organiques. J Pharm Chim 1842; 1: 14–25; Am J Pharm 1843; 8: 141–51.
- Wanklyn A, Gamgee A. On the Action of Permanganate of Potash on Urea, Ammonia, and Acetamide in Strongly Alkaline Solutions. J Chem Soc 1868; 21: 25–31.
- Bradstreet RB. A Review of the Kjeldahl Determination of Organic Nitrogen. Chem Rev 1940; 27(2): 331–50.
- Lynch JM, Barbano DM. Kjeldahl Nitrogen Analysis as a Refer- ence Method for Protein Determination in Dairy Products. J AOAC Int 1999; 82(6): 1389–98.
- ISO. ISO 5983–1:2005. Animal Feeding Stuffs – Determination of Nitrogen Content and Calculation of Crude Protein Content – Part 1: Kjeldahl Method. Geneve: International Organization for Standardization 2009.
- Persson JA, Wennerholm M, O’Halloran S. Handbook for Kjeldahl digestión. Hilleroed, Denmark: FOSS 2008.
- FOSS. Keltec 8400 Auto Sampler System. 2010. http://www.youtube.com/watch?v=V6h6JzNh1rE (video)
- FOSS. Kjeldahl Analysis Goes Online: New KjeltecTM System En- hances Traceability and Efficiency in the Laboratory. Focus 2009; 33(1): 4.
- Kjeldahl J. Nogle Bemaerkninger om den jodometriske Syretitrering. Medd Lab Carlsb 1888; 2(5): 323-9; Quelques Remarques sur le Dosage Iodometrique des Acides (French summary: Résumé du CR Trav Lab Carlsb; separately paged section) 2(5): 193-6.
- Winkler JW. Beitrag zur titrimetrischen Bestimmung des ammoniaks. Zeitschrift für Angewandte Chemie 1913; 26(31): 231-2.
- Martín J, Fernández Sarria L, Asuero AG. The Kjeldahl titrimetric finish: on the ammonia titration trapping in boric acid. In Advances in Titration Techniques. Vu Dang Hoang Ed. Croacia: Science, Technology and Medicine open access publisher 2017: pp. 22-58.
- Michalowski T, Asuero AG, Wybraniec S. The titration in the Kjeldahl method of nitrógen determination: base or acid as titrant? J Chem Educ 2013; 90(2): 191-7.
- Cruz G. Boric acid in Kjeldahl analysis. J Chem Educ 2013; 90: 1645-8.
- Schwartz L. Advances in acid-base Gran methodology. J Chem Educ 1987; 64(11): 947-50.
- Johannsen W. Johan Kjeldahl 1849-1900. Obituary. Berichte der Deutschen Chemischen Gesellschaft 1900; 33(3): 3881-8.
- Johannsen W. Johan Kjeldahl 1849-1900. CR Trav Lab Carlsb 1903; 5: I-VIII.
- Holter H, Møller KM. The Carlsberg Laboratory 1876/1976. Rhodos, Denmark: The Carlsberg Foundation 1976.
- Dunn LC. “Johannsen, Wilhelm Ludwig”. In Dictionary of Scientific Biography. Vol 7. Gillispie CC Ed. New York: American Council of Learned Societies, Charles Scribner’s Sons 1971: pp. 113-5.
- Wikipedia. Wilhelm Ludvig Johannsen; http://en.wikipedia.org/wiki/Wilhelm_Johannsen
- Oesper RE. Kjeldahl and the Determination of Nitrogen. J Chem Educ 1934; 11(8): 457-62.
- Veibel S. John Kjeldahl (1849-1900). J Chem Educ 1949; 26(9): 459-61
- Ottesen M. A Short Biography of Johan Kjeldahl. Chem Britain 1983; 50: 52-4.
- Rancke-Madsen E, Chalmers RA. Scandinavian contribution to analytical chemistry. Talanta 1975; 22(12): 939-43.
- Szabadváry F. History of Analytical Chemistry. Yverdon, Switzerland: Gordon and Breach 1992.
- Pérez-Bustamante JA. Johann Gustav Kristoffer Kjeldahl (1849-1900). Quim Anal (Madrid) 2000; 19(4): 247-8.
- Sella A. Clasic kit: Kjeldahl flask. Chemistry World, May. www.rsc.org/chemistryworld/Issues/2008/May/KjeldahlFlask.asp
- Hansen EH. The Current Status of Analytical Chemistry in Denmark. A Personnel View. Anal Proceed 1993; 30(1): 3-9.
- Rideal EK. Soren Peter Lauritz Sörensen. J Chem Soc 1940; 554-61.
