Page 49 - 88_01
P. 49
ANALES
RANF
www.analesranf.com
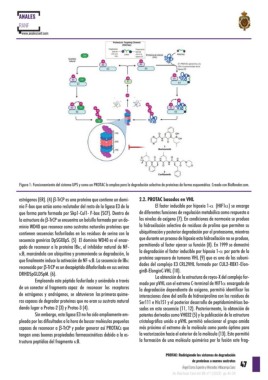
Figura 1: Funcionamiento del sistema UPS y como un PROTAC lo emplea para la degradación selectiva de proteínas de forma esquemática. Creado con BioRender.com.
estrógenos (ER). (4) ß-TrCP es una proteína que contiene un domi- 2.2. PROTAC basados en VHL
nio F-box que actúa como reclutador del resto de la ligasa E3 de la El factor inducible por hipoxia 1-a (HIF1a) se encarga
que forma parte formada por Skp1-Cul1- F-box (SCF). Dentro de
la estructura de ß-TrCP se encuentra un bolsillo formado por un do- de diferentes funciones de regulación metabólica como respuesta a
minio WD40 que reconoce como sustratos naturales proteínas que los niveles de oxígeno (7). En condiciones de normoxia se produce
contienen secuencias fosforiladas en los residuos de serina con la la hidroxilación selectiva de residuos de prolina que permiten su
secuencia genérica DpSGXXpS. (5) El dominio WD40 es el encar- ubiquitinación y posterior degradación por el proteasoma, mientras
gado de reconocer a la proteína IBk, el inhibidor natural de NF- que durante un proceso de hipoxia esta hidroxilación no se produce,
kB, marcándola con ubiquitina y promoviendo su degradación, lo permitiendo al factor ejercer su función (8). En 1999 se demostró
que finalmente induce la activación de NF-kB. La secuencia de IBk la degradación el factor inducible por hipoxia 1-a por parte de la
reconocida por ß-TrCP es un decapéptido difosforilado en sus serinas proteína supresora de tumores VHL (9) que es una de las subuni-
DRHDSpGLDSpM. (6). dades del complejo E3 CRL2VHL formado por CUL2-RBX1-Elon-
ginB-ElonginC-VHL (10).
Empleando este péptido fosforilado y uniéndolo a través
de un conector al fragmento capaz de reconocer los receptores La obtención de la estructura de rayos-X del complejo for-
de estrógenos y andrógenos, se obtuvieron las primeras quime- mado por pVHL con el extremo C-terminal de HIF1a encargado de
ras capaces de degradar proteínas que no eran su sustrato natural la degradación dependiente de oxígeno, permitió identificar las
dando lugar a Protac-2 (3) y Protac-3 (4). interacciones clave del anillo de hidroxiprolina con los residuos de
Ser111 e His151 y el posterior desarrollo de peptidomiméticos ba-
Sin embargo, esta ligasa E3 no ha sido ampliamente em- sados en esta secuencia (11, 12). Posteriormente, la obtención de
pleada por las dificultades a la hora de buscar moléculas pequeñas potentes derivados como VH032 (5) y la publicación de la estructura
capaces de reconocer a ß-TrCP y poder generar así PROTACs que cristalográfica unido a pVHL permitió seleccionar el grupo amida
tengan unas buenas propiedades farmacocinéticas debido a la es- más próximo al extremo de la molécula como punto óptimo para
tructura peptídica del fragmento kB. la vectorización hacia el exterior de la molécula (13). Esto permitió
la formación de una molécula quimérica por la fusión este frag-
PROTAC: Redirigiendo los sistemas de degradación 47
de proteínas a nuevos sustratos
Ángel Cores Esperón y Mercedes Villacampa Sanz
An. Real Acad. Farm.Vol. 88. nº 1 (2022) · pp. 45-59