Page 36 - 79_03
P. 36
J.
C.
Rodríguez
Rey
sustrato
de
la
proteína
quinasa
dependiente
de
AMP
(AMPK)
lo
que
podría
explicar
la
mayor
entrada
de
glucosa
en
el
músculo
que
se
produce
durante
el
ejercicio.
AKT
Y
EL
METABOLISMO
HEPÁTICO
El
hígado,
cuyo
principal
transportador,
Glut2,
es
independiente
de
insulina,
modifica
los
niveles
de
glucosa
mediante
su
conversión
en
glucógeno
o
en
ácidos
grasos.
Se
sabe
desde
hace
tiempo
que
la
insulina
regula
la
actividad
de
los
principales
enzimas
reguladores
de
estos
dos
procesos,
así
como
los
de
la
gluconeogénesis
mediante
modificación
covalente.
Sin
embargo,
la
principal
regulación
de
los
procesos
que
se
desarrollan
en
un
período
de
tiempo
largo,
como
es
el
caso
de
la
diabetes
tipo
2,
se
lleva
a
cabo
alterando
la
síntesis
de
los
propios
enzimas.
En
el
metabolismo
hepático
la
insulina
participa
en
esta
regulación
a
través
de
dos
factores
de
transcripción:
FoxO1
y
SREBP--1c
(Figura
4a).
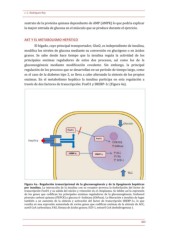
Figura
4a.--
Regulación
transcripcional
de
la
gluconeogénesis
y
de
la
lipogénesis
hepáticas
por
insulina.
La
interacción
de
la
insulina
con
su
receptor
provoca
la
fosforilación
del
factor
de
transcripción
FoxO1
y
su
salida
del
núcleo
y
retención
en
el
citoplasma.
Se
inhibe
así
la
expresión
de
los
genes
que
codifican
los
principales
enzimas
reguladores
de
la
gluconeogénesis,
fosfoenol
piruvato
carboxi
quinasa
(PEPCK)
y
glucosa
6--
fosfatasa
(G6Pasa).
La
liberación
e
insulina
da
lugar
también
a
un
aumento
de
la
síntesis
y
activación
del
factor
de
transcripción
SREBP--1c,
lo
que
resulta
en
una
expresión
aumentada
de
varios
genes
que
codifican
enzimas
de
la
síntesis
de
ACC,
acetil
CoA
carboxilasa;
FAS,
Sintasa
de
ácidos
grasos;
SCD--1,
estearil
CoA
deshidrogenasa
1.
421