Page 78 - 8_04
P. 78
Tuberin protein: therapeutic target to activate autophagy and mitophagy avoiding the progression to type 2 diabetes
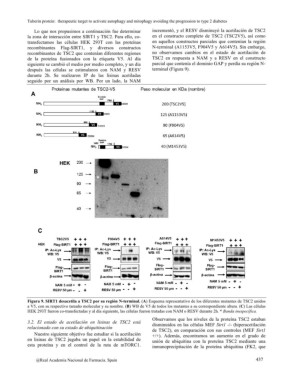
Lo que nos propusimos a continuación fue determinar incrementó, y el RESV disminuyó la acetilación de TSC2
la zona de interacción entre SIRT1 y TSC2. Para ello, co- en el constructo completo de TSC2 (TSC2V5), así como
transfectamos las células HEK 293T con las proteínas en aquellos constructos parciales que contenían la región
recombinantes Flag-SIRT1, y diversos constructos N-terminal (A1153V5, F904V5 y A614V5). Sin embargo,
recombinantes de TSC2 que contenían diferentes regiones no observamos cambios en el estado de acetilación de
de la proteína fusionados con la etiqueta V5. Al día TSC2 en respuesta a NAM y a RESV en el constructo
siguiente se cambió el medio por medio completo, y un día parcial que contenía el dominio GAP y perdía su región N-
después las células se estimularon con NAM y RESV terminal (Figura 9).
durante 2h. Se realizaron IP de las lisinas acetiladas
seguido por un análisis por WB. Por un lado, la NAM
A
B
Figura 9.?SIRT1 desacetila a TSC2 por su región N-terminal. (A) Esquema representativo de los diferentes mutantes de TSC2 unidos
a V5, con su respectivo tamaño molecular y su nombre. (B) WB de V5 de todos los mutantes a su correspondiente altura. (C) Las células
HEK 293T fueron co-transfectadas y al día siguiente, las células fueron tratadas con NAM o RESV durante 2h. * Banda inespecífica.
3.2. El estado de acetilación en lisinas de TSC2 está Observamos que los niveles de la proteína TSC2 estaban
relacionado con su estado de ubiquitinación disminuidos en las células MEF Sirt1 -/- (hiperacetilación
de TSC2), en comparación con sus controles (MEF Sirt1
Nuestro siguiente objetivo fue estudiar si la acetilación +/+). Además, encontramos un aumento en el grado de
en lisinas de TSC2 jugaba un papel en la estabilidad de unión de ubiquitina con la proteína TSC2 mediante una
esta proteína y en el control de la ruta de mTORC1. inmunoprecipitación de la proteína ubiquitina (FK2, que
@Real Academia Nacional de Farmacia. Spain 437