Page 114 - Demo
P. 114
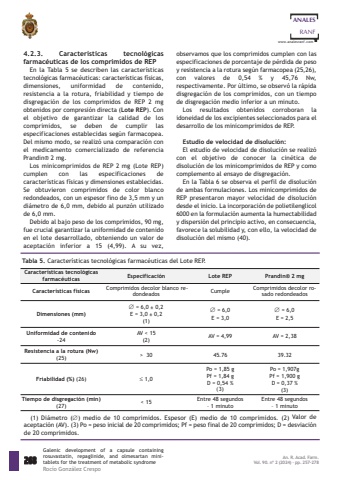
observamos que los comprimidos cumplen con lasespecificaciones de porcentaje de p%u00e9rdida de pesoy resistencia a la rotura seg%u00fan farmacopea (25,26),con valores de 0,54 % y 45,76 Nw,respectivamente. Por %u00faltimo, se observ%u00f3 la r%u00e1pidadisgregaci%u00f3n de los comprimidos, con un tiempode disgregaci%u00f3n medio inferior a un minuto.Los resultados obtenidos corroboran laidoneidad de los excipientes seleccionados para eldesarrollo de los minicomprimidos de REP.Estudio de velocidad de disoluci%u00f3n:El estudio de velocidad de disoluci%u00f3n se realiz%u00f3con el objetivo de conocer la cin%u00e9tica dedisoluci%u00f3n de los minicomprimidos de REP y comocomplemento al ensayo de disgregaci%u00f3n.En la Tabla 6 se observa el perfil de disoluci%u00f3nde ambas formulaciones. Los minicomprimidos deREP presentaron mayor velocidad de disoluci%u00f3ndesde el inicio. La incorporaci%u00f3n de polietilenglicol6000 en la formulaci%u00f3n aumenta la humectabilidady dispersi%u00f3n del principio activo, en consecuencia,favorece la solubilidad y, con ello, la velocidad dedisoluci%u00f3n del mismo (40).4.2.3. Caracter%u00edsticas tecnol%u00f3gicasfarmac%u00e9uticas de los comprimidos de REPEn la Tabla 5 se describen las caracter%u00edsticastecnol%u00f3gicas farmac%u00e9uticas: caracter%u00edsticas f%u00edsicas,dimensiones, uniformidad de contenido,resistencia a la rotura, friabilidad y tiempo dedisgregaci%u00f3n de los comprimidos de REP 2 mgobtenidos por compresi%u00f3n directa (Lote REP). Conel objetivo de garantizar la calidad de loscomprimidos, se deben de cumplir lasespecificaciones establecidas seg%u00fan farmacopea.Del mismo modo, se realiz%u00f3 una comparaci%u00f3n conel medicamento comercializado de referenciaPrandin%u00ae 2 mg.Los minicomprimidos de REP 2 mg (Lote REP)cumplen con las especificaciones decaracter%u00edsticas f%u00edsicas y dimensiones establecidas.Se obtuvieron comprimidos de color blancoredondeados, con un espesor fino de 3,5 mm y undi%u00e1metro de 6,0 mm, debido al punz%u00f3n utilizadode 6,0 mm.Debido al bajo peso de los comprimidos, 90 mg,fue crucial garantizar la uniformidad de contenidoen el lote desarrollado, obteniendo un valor deaceptaci%u00f3n inferior a 15 (4,99). A su vez,268ANALESRANFwww.analesranf.comGalenic development of a capsule containingrosuvastatin, repaglinide, and olmesartan minitablets for the treatment of metabolic syndromeRoc%u00edo Gonz%u00e1lez CrespoAn. R. Acad. Farm.Vol. 90. n%u00ba 2 (2024) %u00b7 pp. 257-278 Tabla 5. Caracter%u00edsticas tecnol%u00f3gicas farmac%u00e9uticas del Lote REP.Caracter%u00edsticas tecnol%u00f3gicasfarmac%u00e9uticas Especificaci%u00f3n Lote REP Prandin%u00ae 2 mgCaracter%u00edsticas f%u00edsicas Comprimidos decolor blanco re,dondeados Cumple Comprimidos decolor rosado redondeadosDimensiones (mm)%uf0c6 = 6,0 %u00b1 0,2E = 3,0 %u00b1 0,2 (1)%uf0c6 = 6,0E = 3,0%uf0c6 = 6,0E = 2,5Uniformidad de contenido-24AV < 15(2) AV = 4,99 AV = 2,38Resistencia a la rotura (Nw)(25) >%u00a0 30 45.76 39.32Friabilidad (%) (26) %uf0a3 1,0Po = 1,85 g Pf = 1,84 g D = 0,54 %(3)Po = 1,907g Pf = 1,900 g D = 0,37 %(3)Tiempo de disgregaci%u00f3n (min)(27) < 15 Entre 48 segundos %u2013 1 minutoEntre 48 segundos %u2013 1 minuto(1) Di%u00e1metro (%uf0c6) medio de 10 comprimidos. Espesor (E) medio de 10 comprimidos. (2) Valor deaceptaci%u00f3n (AV). (3) Po = peso inicial de 20 comprimidos; Pf = peso final de 20 comprimidos; D = desviaci%u00f3nde 20 comprimidos.