Page 152 - 79_01
P. 152
J.
R.
Lacadena
y
F.
Mayor
Menéndez
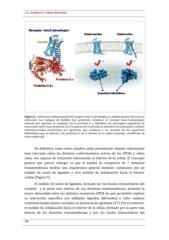
Figura
6.--
Estructura
tridimensional
del
receptor
beta--2
adrenérgico
y
cambios
promovidos
tras
su
activación.
Los
trabajos
de
Kobilka
han
permitido
cristalizar
el
receptor
beta--2--adrenérgico
activado
por
agonista
en
complejo
con
la
proteína
G
e
identificar
las
principales
superficies
de
interacción
entre
estas
proteínas.
En
el
esquema
de
la
derecha
se
muestran
los
principales
cambios
conformacionales
promovidos
por
agonistas,
que
conducen
a
un
aumento
de
las
superficies
hidrofóbicas
que
se
ofrecen
a
las
proteínas
G
en
el
interior
de
la
célula
(esquema
modificado
de
www.nobel.org).
En
definitiva,
todos
estos
estudios
están
permitiendo
obtener
información
muy
relevante
sobre
las
distintas
conformaciones
activas
de
los
GPCRs
y
sobre
cómo
son
capaces
de
transmitir
información
al
interior
de
la
célula.
El
concepto
general
que
parece
emerger
es
que
la
familia
de
receptores
de
7
dominios
transmembrana
tendría
una
arquitectura
general
modular,
compuesta
por
un
módulo
de
unión
de
ligandos
y
otro
módulo
de
señalización
hacia
el
interior
celular
(Figura
7).
El
módulo
de
unión
de
ligandos,
formado
por
las
bucles
extracelulares
del
receptor
y
la
parte
más
externa
de
sus
dominios
transmembrana,
presenta
la
mayor
diversidad
entre
los
distintos
receptores
GPCR
(lo
que
permitiría
explicar
su
interacción
específica
con
múltiples
ligandos
diferentes)
y
sufre
cambios
conformacionales
menos
acusados
en
presencia
de
agonistas
(37).
Por
el
contrario,
el
modulo
de
señalización
hacía
el
interior
de
la
célula,
formado
por
la
parte
más
interna
de
los
dominios
transmembrana
y
por
los
bucles
intracelulares
del
146