Page 55 - 81_01
P. 55
Paloma Santos-Moriano et al
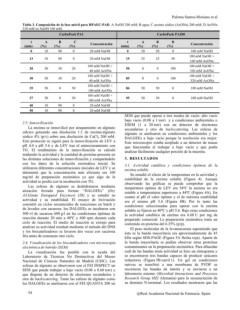
Tabla 3. Composición de la fase móvil para HPAEC-PAD. A NaOH 200 mM; B agua; C acetato sódico (AcONa) 200 mM; D AcONa
320 mM en NaOH 100 mM.
CarboPack PA1 CarboPack PA200
t A B C Concentración t A B D Concentración
(min) (%) (%) (%) (min) (%) (%) (%)
20 mM NaOH 100 mM NaOH
0 10 90 0 0 50 50 0 100 mM NaOH +
20 mM NaOH 160 mM AcONa
13 10 90 0 15 25 25 50 100 mM NaOH +
100 mM NaOH + 320 mM AcONa
20 50 30 20 40 mM AcONa 50 0 0 100 100 mM NaOH +
320 mM AcONa
30 50 30 20 100 mM NaOH + 85 0 0 100
40 mM AcONa 100 mM NaOH
35 50 0 50 100 mM NaOH + 86 50 50 0
100 mM AcONa 100 mM NaOH
37 50 0 50 100 mM NaOH + 95 50 50 0
100 mM AcONa
40 10 90 0 20 mM NaOH
50 10 90 0 20 mM NaOH
2.5. Inmovilización SEM que puede operar a tres modos de vacío: alto vacío
bajo vacío (0.08 a 1 torr) y a condiciones ambientales o
La enzima se inmovilizó por atrapamiento en alginato ESEM (1 a 20 torr) con un detector de electrones
cálcico goteando una disolución 1:1 de enzima:alginato secundarios y otro de backscattering. Las esferas de
sódico 4% (p/v) sobre una disolución de CaCl2 200 mM. alginato se analizaron en condiciones ambientales y los
Este protocolo se siguió para la inmovilización de LEV a DALGEEs a bajo vacío porque la resolución era mejor.
pH 4.0 a pH 5.6 y de LEV tras el entrecruzamiento con Este microscopio estaba acoplado a un detector de masas
TG. El rendimiento de la inmovilización se calculó que funcionaba al trabajar a bajo vacío y que podía
midiendo la actividad y la cantidad de proteína presente en analizar fácilmente cualquier porción de la muestra.
las distintas soluciones de inmovilización y comparándolo
con los datos de la solución enzimática inicial. Se 3. RESULTADOS
utilizaron diferentes concentraciones iniciales de LEV y se
determinó que la concentración más eficiente era 100 3.1. A ctividad catalítica y condiciones óptimas de la
mg/ml de preparación enzimática ya que algo de la enzima soluble
actividad se perdía con la incubación con TG.
Se estudió el efecto de la temperatura en la actividad y
Las esferas de alginato se deshidrataron mediante estabilidad de la enzima soluble (Figura 4). Aunque
aireación forzada para formar “DALGEEs” (Dry observando las gráficas se puede comprobar que la
A LGinate Entrapped Enzymes) (28) y se estudió su temperatura óptima de LEV era 54ºC la enzima no era
actividad y su estabilidad. El ensayo de lixiviación estable a temperaturas superiores a 44ºC (Figura 4A). En
consistió en ciclos secuenciales de reacciones en batch y cuanto al pH el valor óptimo y el de máxima estabilidad
de lavados con sacarosa: los DALGEEs se incubaron con era el mismo pH 5.6 (Figura 4B). Por lo tanto las
500 µl de sacarosa 600 g/l en las condiciones óptimas de condiciones seleccionadas para operar con la enzima
reacción durante 20 min a 40ºC y 600 rpm durante cada soluble se fijaron en 40ºC y pH 5.6. Bajo estas condiciones
ciclo de reacción. El medio de reacción se extrajo para la actividad catalítica de enzima era 6.68 U por mg de
analizar su actividad residual mediante el método del DNS preparado comercial. La preparación enzimática tenía un
y los biocatalizadores se lavaron dos veces con sacarosa contenido en proteína del 6.25% (p/p).
fría antes de comenzar otro ciclo.
El peso molecular de la levansacarasa suponiendo que
2.6. V isualización de los biocatalizadores con microscopía ésta es la banda mayoritaria era aproximadamente de 45
electrónica de barrido (SEM) kDa según SDS-PAGE (Figura 5A flecha roja). Aparte de
la banda mayoritaria se podían observar otras proteínas
La visualización fue posible con la ayuda del contaminantes en la preparación enzimática. Para dilucidar
Laboratorio de Técnicas No Destructivas del Museo cuál de las bandas tenía actividad se hizo un zimograma y
Nacional de Ciencias Naturales de Madrid (CSIC). Las se encontraron tres bandas capaces de producir azúcares
esferas de alginato se observaron con el FEI INSPECT un reductores (Figura 5B carril 1). Un gel en condiciones
SEM que puede trabajar a bajo vacío (0.08 a 0.60 torr) y nativas se transfirió a una membrana de PVDF se
que dispone de un detector de electrones secundarios y recortaron las bandas de interés y se enviaron a un
otro de backscaterring. Tanto las esferas de alginato como laboratorio externo (Microbial Interactions and Processes
los DALGEEs se analizaron con el FEI QUANTA 200 un Research Group HZI Alemania) para la secuenciación de
su dominio N-terminal. Los resultados mostraron que las
54 @Real Academia Nacional de Farmacia. Spain