Page 26 - 81_01
P. 26
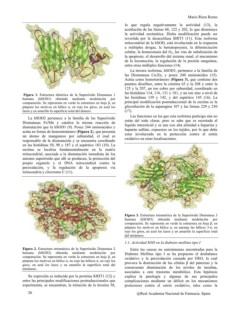
Figura 1. Estructura dímérica de la Superóxido Dismutasa 1 Mario Riera Romo
humana (hSOD1) obtenida mediante modelación por
comparación. Se representa en verde la estructura en hoja ß, en lo que regula negativamente la actividad (13), la
púrpura los motivos en hélice a, en rojo los giros, en azul los acetilación de las lisinas 68, 122 y 202, lo que disminuye
lazos y en amarillo la superficie total del dímero. la actividad enzimática. Dicha modificación puede ser
revertida por la desacetilasa SIRT3 (11). Esta isoforma
La hSOD2 pertenece a la familia de las Superóxido mitocondrial de la hSOD, está involucrada en la respuesta
Dismutasas Fe/Mn y cataliza la misma reacción de a múltiples drogas, la hematopoyesis, la diferenciación
dismutación que la hSOD1 (9). Posee 244 aminoácidos y celular, la homeostasia del O2, las vías de señalización de
actúa en forma de homotetrámero (Figura 2), que presenta la apoptosis, el desarrollo del sistema renal, el mecanismo
un átomo de manganeso por subunidad, el cual es de la locomoción, la regulación de la presión sanguínea,
responsable de la dismutación y se encuentra coordinado entre otras múltiples funciones (14).
en las histidinas 50, 98 y 187 y el aspártico 183 (10). La
enzima se localiza fundamentalmente en la matriz La tercera isoforma, hSOD3, pertenece a la familia de
mitocondrial, asociada a la dismutación inmediata de los las Dismutasas Cu/Zn, y posee 240 aminoácidos (15).
aniones superóxido que allí se producen, la protección del Actúa como homotetrámero (Figura 3), que contiene dos
propio organelo y el DNA mitocondrial contra la puentes disulfuro, entre la cisteína 63 y la 208 y entre la
peroxidación, y la regulación de la apoptosis vía 125 y la 207, un ion cobre por subunidad, coordinado en
mitocondria y citocromo C (11). las histidinas 114, 116, 131 y 181, y un ion zinc a nivel de
las histidinas 139 y 142, y del aspártico 145 (16). La
principal modificación postraduccional de la enzima es la
glicosilación de la asparagina 107 y las lisinas 229 y 230
(17).
Las funciones en las que esta isoforma participa aún no
están del todo claras, pero se sabe que es secretada al
líquido intersticial y se une con alta afinidad a heparina y
heparán sulfato, expuestos en los tejidos, por lo que debe
estar involucrada en la protección contra el estrés
oxidativo en estas localizaciones.
Figura 2. Estructura tetramérica de la Superóxido Dismutasa 2 Figura 3. Estructura tetramérica de la Superóxido Dismutasa 3
humana (hSOD2) obtenida mediante modelación por humana (hSOD3) obtenida mediante modelación por
comparación. Se representa en verde la estructura en hoja ß, en comparación. Se representa en verde la estructura en hoja ß, en
púrpura los motivos en hélice a, en cian las hélices p, en rojo los púrpura los motivos en hélice a, en naranja las hélices 3-p, en
giros, en azul los lazos y en amarillo la superficie total del rojo los giros, en azul los lazos y en amarillo la superficie total
tetrámero. del tetrámero.
Su expresión es inducida por la proteína KRIT1 (12) y 1.1. Actividad SOD en la diabetes mellitus tipo I
entre las principales modificaciones postraduccionales que
experimenta, se encuentran, la nitración de la tirosina 58, Entre las causas no autoinmunes encontradas para la
Diabetes Mellitus tipo I se ha propuesto el desbalance
26 oxidativo y la peroxidación causada por ERO, la cual
provoca la destrucción de las células ß del páncreas y la
consecuente disminución de los niveles de insulina,
asociados a este trastorno metabólico. Esta hipótesis
explica la patología y algunas de sus principales
complicaciones mediante un déficit en los mecanismos
protectores contra el estrés oxidativo, tales como la
@Real Academia Nacional de Farmacia. Spain