Page 97 - 82_01
P. 97
Microcalorimetry contributions to early diagnosis of bacterial infections
2.3. Montaje experimental y recogida de datos Voltajeperfiles de estas bacterias es el tiempo que separa los dos
(µV)picos de flujo, ya que se observa que este periodo es mayor
En el recinto externo del calorímetro se ha mantenido en las muestras de E.coli. En el caso de P. mirabilis, tras el
una temperatura constante de 309,65 K. En la célula primer pico característico de todos los termogramas, y
testigo se incorporan 7 ml de medio de cultivo más 1ml de antes del primer pico de máximo voltaje, se describe una
suero fisiológico, y en la experimental 7ml de medio de zona en la que no llega a manifestarse un vértice, pero que
cultivo. Ambas células se introducen a través de dos se ha ajustado a una ecuación de tipo polinómico y de la
orificios cilíndricos, paralelos entre sí, que van desde la que hemos podido extraer un punto de inflexión.
parte superior del microcalorímetro hasta el recinto interno
de las termopilas. La gran distancia que separa las células 100
de la entrada, permite minimizar los efectos de conducción E. coli 10 UFC/ml
calorífica hacia el exterior. El sistema se deja estabilizar
durante aproximadamente dos horas, momento en el que se 80
introduce en la célula experimental 1ml de la
concentración establecida. 60
La experiencia también se ha realizado con una 40
muestra sin bacterias (control).
20
Los datos son recogidos por el sistema de adquisición y
tratamiento de datos, a intervalos de 15 segundos durante 0
el tiempo que dure la experiencia. La precisión en la señal 100
calorimétrica es de un 1 µV.
E. coli 103 UFC/ml
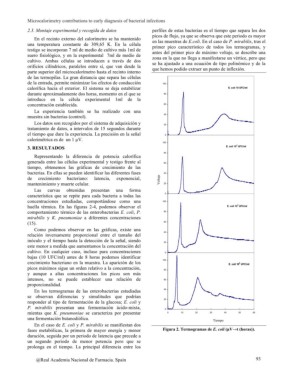
3. RESULTADOS 80
Representando la diferencia de potencia calorífica 60
generada entre las células experimental y testigo frente al
tiempo, obtenemos las gráficas de crecimiento de las 40
bacterias. En ellas se pueden identificar las diferentes fases
de crecimiento bacteriano: latencia, exponencial, 20
mantenimiento y muerte celular.
0
Las curvas obtenidas presentan una forma 100
característica que se repite para cada bacteria a todas las
concentraciones estudiadas, comportándose como una E. coli 105 UFC/ml
huella térmica. En las figuras 2-4, podemos observar el 80
comportamiento térmico de las enterobacterias E. coli, P.
mirabilis y K. pneumoniae a diferentes concentraciones 60
(15).
40
Como podemos observar en las gráficas, existe una
relación inversamente proporcional entre el tamaño del 20
inóculo y el tiempo hasta la detección de la señal, siendo
este menor a medida que aumentamos la concentración del 0
cultivo. En cualquier caso, incluso para concentraciones 100
bajas (10 UFC/ml) antes de 8 horas podemos identificar
crecimiento bacteriano en la muestra. La aparición de los E. coli 106 UFC/ml
picos máximos sigue un orden relativo a la concentración,
y aunque a altas concentraciones los picos son más 80
intensos, no se puede establecer una relación de
proporcionalidad. 60
En los termogramas de las enterobacterias estudiadas 40
se observan diferencias y simulitudes que podrían
responder al tipo de fermentación de la glucosa; E. coli y 20
P. mirabilis presentan una fermentación ácido-mixta,
mientas que K. pneumoniae se caracteriza por presentar 0
una fermentación butanodiólica. 0 10 20 30 40 50 60
En el caso de E. coli y P. mirabilis se manifiestan dos Tiempo
fases metabólicas, la primera de mayor energía y menor (h)
duración, seguida por un periodo de latencia que precede a
un segundo periodo de menor potencia pero que se Figura 2. Termogramas de E. coli (µV?t (horas)).
prolonga en el tiempo. La principal diferencia entre los
@Real Academia Nacional de Farmacia. Spain 93